-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPřínos biopsie sentinelových uzlin pro léčbu lokálně pokročilých stadií karcinomu děložního hrdla
Contribution of sentinel lymph-node biopsy to treatment of locally advanced stages of cervical cancers
Objective:
Usage of sentinel lymph-node (SLN) concept in locally advanced cervical cancers might help to individualise management. According to SLN status could be patients refered to neoadjuvant chemotherapy (NAC) with subsequent surgery or to primary chemoradiation. The aim of our study was to evaluate sensitivity of SLN detection in locally advanced cervical cancers and to assess the impact of NAC on frequency of their metastatic involvement.Design:
Retrospective clinical study.Setting:
Department of Obstetrics and Gynecology, General Faculty Hospital and 1st Medical Faculty, Charles University, Prague.Materials and methods:
Included were patients with cervical cancer stages FIGO IB1 (> 3 cm), IB2, IIA2 and selected cases of stages IIB with incipient parametrial involvement. Patients were distributed into two different protocols – patients in group NAC-SLN were refered to radical hysterectomy with SLN biopsy after 3 cycles of NAC, other patients (group SLN) underwent SLN biopsy and NAC was administered only in SLN-negative cases.Results:
Altogether 101 patients were included (group SLN = 62, group NAC-SLN = 39). Detection of SLN in whole cohort reached 90.1% per patient and 68.3% bilaterally. No differences were found between SLN group and NAC-SLN group in frequency of per patient SLN detection (90.3% vs 89.7%) and bilateral detection (69.4% vs 66.7%). Prevalence of macrometastases, micrometastases and ITC in the SLN group was 37.1% (23/62), 11.3% (7/62) and 8.1% (5/62), respectively. In the NAC-SLN group macrometastases in SLN were detected in 17.9% (7/39) patients, in 1 patient was detected micrometastis in SLN and no patient had ITC. Difference in frequency of metastases in SLN was significant (p = 0,013). No patient had progressed during NAC, complete response was seen in 15.1% (11/73) patients and reduction of tumour volume > 30% in 84.9% (62/73) patients.Conclusions:
Detection of SLN in locally advanced cervical cancers reached comparable results to early stages. NAC did not influence frequency of SLN detection, but it significantly decreased prevalence of metastatic SLN involvement.Keywords:
cervical cancer, neoadjuvant chemotherapy, sentinel lymph-node
Autoři: J. Sláma; Michal Zikán
; D. Fischerová; R. Kocián; A. Germanová; F. Frühauf; D. Cibula
Působiště autorů: Gynekologicko-porodniká klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Vyšlo v časopise: Ceska Gynekol 2016; 81(3): 165-170
Souhrn
Cíl studie:
Koncept sentinelové uzliny (SLN) u lokálně pokročilých nádorů děložního hrdla by mohl umožnit individualizovat léčebný postup a podle stavu SLN referovat pacientky buď k neoadjuvantní chemoterapii (NAC) s následnou chirurgickou léčbou, nebo naopak k primární chemoradioterapii. Předmětem výzkumu bylo zhodnocení citlivosti detekce SLN u lokálně pokročilých karcinomů a zhodnocení vlivu NAC na frekvenci jejich metastatického postižení.Typ studie:
Retrospektivní klinická studie.Pracoviště:
Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha.Materiál a metodika:
Zařazeny byly pacientky s karcinomem děložního hrdla FIGO IB1 (> 3 cm), IB2, IIA2 a vybraná stadia IIB s incipientním postižením parametrií. Pacientky byly distribuovány do dvou odlišných protokolů – skupina NAC-SLN byla referována k radikální hysterektomii s biopsií SLN po třech cyklech NAC, další pacientky (skupina SLN) byly referovány nejprve k biopsii SLN a teprve při jejich negativitě byla podána NAC.Výsledky:
Celkem bylo zařazeno 101 pacientek (skupina SLN = 62, skupina NAC-SLN = 39). Detekce SLN v celém souboru dosahovala 90,1 % na pacientku a 68,3 % bilaterálně. Mezi skupinou SLN a skupinou NAC-SLN nebyly zjištěny rozdíly ve frekvenci detekce na pacientku (90,3 % vs 89,7 %) ani bilaterální detekce (69,4 % vs 66,7 %). Prevalence makrometastáz, mikrometastáz a izolovaných nádorových buněk ve skupině SLN byla 37,1 % (23/62), 11,3 % (7/62) a 8,1 % (5/62). Ve skupině NAC-SLN byla makrometastáza v SLN zjištěna u 17,9 % (7/39) pacientek, u jedné pacientky byla v SLN mikrometastáza a u žádné nebyly detekovány ITC. Rozdíl ve frekvenci jednotlivých typů metastáz v SLN byl signifikantníl (p = 0,013). U žádné pacientky nebyla zaznamenána progrese onemocnění během NAC, kompletní patologická odpověď byla prokázána u 15,1 % (11/73) pacientek a redukce objemu nádoru o více než 30 % u 84,9 % (62/73) pacientek.Závěry:
Detekce SLN u lokálně pokročilých karcinomů děložního hrdla dosahovala srovnatelných výsledků jako u časných stadií. NAC neovlivnila frekvenci detekce SLN, ale vedla k signifikantnímu snížení prevalence metastatického postižení SLN.Klíčová slova:
karcinom děložního hrdla, neoadjuvantní chemoterapie, sentinelová uzlinaÚVOD
Při léčbě lokálně pokročilých nádorů děložního hrdla je za „zlatý standard“ považována konkomitantní chemoradioterapie. Zejména v Evropě je ale často využíván alternativní postup kombinující neoadjuvantní chemoterapii (NAC) následovanou radikálním chirurgickým výkonem. Největší přínos má ale NAC s radikálním operačním výkonem u pacientek s negativními spádovými lymfatickými uzlinami, které nemusí být dále léčeny adjuvantní radioterapií. U pacientek s karcinomem děložního hrdla ve stadiu IB2–IIB se pohybuje pětileté přežití mezi 55–80 % [3, 12]. Při volbě vhodného léčebného postupu by proto měla být také zohledněna morbidita spojená s léčbou a kvalita dalšího života.
Pro selekci pacientek k primární chemoradioterapii nebo k NAC následované radikálním chirurgickým zákrokem je zásadní znalost stavu spádových lymfatických uzlin. Jejich metastatické postižení je zjištěno u 12–27 % pacientek s lokálně pokročilým karcinomem děložního hrdla [14]. V případě pozitivity lymfatických uzlin je i u pacientek léčených NAC s následným radikálním chirurgickým zákrokem nutná ještě adjuvantní radioterapie. Pacientky tak podstoupí všechny tři modality onkologické léčby. Z tohoto důvodu se však signifikantně zvyšuje poléčebná morbidita a zhoršuje kvalita jejich života [4, 16]. Perzistující pozitivita lymfatických uzlin je navíc nepříznivým prognostickým parametrem snižujícím přežití o více než polovinu, zvláště pak u pacientek po NAC. Zaneta ve své práci prezentoval kompletní léčebnou odpověď na NAC u 35 % pacientek s metastatickým postižením lymfatických uzlin podle předléčebného CT. Celkové pětileté přežití v této kohortě dosáhlo 66 %, zatímco pouze 27 % při perzistenci metastatického postižení uzlin po NAC [18].
K přesnější predikci stavu regionálních lymfatických uzlin je možno využít biopsii a ultrastagingové vyšetření sentinelových uzlin (SLN) [2, 5]. Využití konceptu SLN by mohlo umožnit individualizovat léčebný management a podle stavu SLN referovat pacientky buď k NAC s následnou radikální chirurgickou léčbou, nebo naopak k primární konkomitantní chemoradioterapii. V naší práci jsme se věnovali konceptu SLN a jeho významu pro management lokálně pokročilých karcinomů děložního hrdla. Předmětem výzkumu bylo především zhodnocení citlivosti detekce SLN a zhodnocení vlivu NAC na frekvenci jejich metastatického postižení.
CHARAKTERISTIKA SOUBORU
Do studie byly zařazeny pacientky referované do Onkogynekologického centra Gynekologicko-porodnické kliniky Všeobecné fakultní nemocnice a 1. LF UK v Praze s lokálně pokročilým karcinomem děložního hrdla ve stadiu FIGO IB1 s nádorem větším než tři cm („pseudobulky“), ve stadiiích IB2, IIA2 a ve vybraných případech stadia IIB s incipientním šířením do parametrií (disrupcí pericervikální fascie nebo invazí menší než tři mm).
METODIKA
Všechny pacientky byly seznámeny se studijním protokolem a podepsaly informovaný souhlas. Pacientky byly distribuovány do dvou odlišných protokolů; historicky starší skupina pacientek (skupina NAC-SLN) byla referována k radikální hysterektomii včetně biopsie SLN po třech cyklech intenzifikované (10–12 dní) NAC ifosfamid (1,75 g/m2)/cisplatina (75 mg/m2) u dlaždicobuněčných karcinomů a doxorubicin (35 mg/m2)/cisplatina (75 mg/m2) u adenokarcinomů). Díky změně vnitřních doporučených postupů pro léčbu lokálně pokročilých karcinomů děložního hrdla byly další pacientky (skupina SLN) referovány nejprve k laparoskopické biopsii SLN a teprve podle výsledku histopatologického vyšetření bylo rozhodnuto o případném podání NAC.
V obou kohortách byla identifikována SLN, která byla exstirpována z laparotomie nebo laparoskopicky a odeslána k peroperačnímu vyšetření. Stranově specifická systematická pánevní lymfadenektomie byla provedena v případě, že na příslušné straně nebyla detekována SLN. Další postup závisel na výsledku peroperačního vyšetření – při pozitivitě SLN byla děloha ponechána in situ, provedena stagingová systematická paraaortální lymfadenektomie a pacientka byla referována k primární radikální chemoradioterapii, naopak při negativitě SLN byla u dosud neléčených žen podána NAC v intenzifikovaném režimu a následně provedena radikální operace. V obou skupinách (SLN i NAC-SLN) byla sledována a porovnána frekvence detekce a stranově specifická detekce SLN a prevalance makrometastáz, mikrometastáz a izolovaných nádorových buněk (ITC) v SLN.
Odpověď na podání NAC byla hodnocena podle RECIST kritérií modifikovaných jako změna objemu primárního tumoru: kompletní klinická odpověď byla definována jako nepřítomnost reziduálního nádoru při kontrolním transrektálním ultrazvukovém vyšetření nebo magnetické rezonanci; kompletní patologická odpověď byla definována jako žádný reziduální nádor nebo nádorové reziduum se stromální invazí menší než tři mm při finálním histopatologickém vyšetření; parciální odpověď byla definována jako redukce objemu nádoru alespoň o 30 %; stabilní onemocnění bylo definováno jako změna objemu nádoru, která nesplňuje kritéria hodnocení pro parciální odpověď nebo progresi onemocnění a progrese onemocnění byla definována jako zvětšení objemu nádoru o více než 20 %.
Detekce a vyšetření sentinelové uzliny
K detekci SLN byla použita samostatně patentová modř (Patent blau V, Byk Gueden, Germany or Bleu patenté V 2,5 %, Guerbet, France) nebo kombinovaná technika s radiokoloidem (20 MBq 99mTc). U žádné pacientky nebyla provedena předoperační lymfoscintigrafie. Aplikace byla provedena 88mm (20G) spinální jehlou (Guebert, France). Standardní postup lymfatického mapování popsaný řadou autorů byl modifikován pro lokálně pokročilé tumory. Na základě detailního předoperačního posouzení topografie tumoru pomocí transrektálního ultrazvukového vyšetření byla aplikace směrována přísně do reziduálního stromatu. Pečlivě byl sledován únik aplikované látky přes cervikální kanál signalizující aplikaci do nekrotické části tumoru a ve stejnou dobu byla pod laparoskopickou kontrolou kontrolována i přímá aplikace do parametrií. Za SLN byla považována každá uzlina vykazující signál při snímání gama sondou a/nebo zbarvená lymfatická uzlina.
Histopatologické a imunohistochemické vyšetření
Získaná tkáň označená jako SLN byla odeslána bez fixace k peroperačnímu vyšetření. Vzorky byly makroskopicky posouzeny k určení počtu a velikosti jednotlivých uzlin. Zjevně metastaticky infiltrované uzliny byly prokrájeny. SLN, které nevykazovaly známky metastatického postižení, byly rozpůleny kolmo na svou dlouhou osu a polovina každé uzliny byla peroperačně vyšetřena metodou zmrazeného řezu. Následně byla každá polovina SLN prokrájena v intervalu dvou mm a dále rutinním způsobem zpracována a barvena hematoxylinem a eozinem (H&E). Negativní SLN při rutinním vyšetření byla dále vyšetřena v ultrastagingovém protokolu, který zahrnoval vždy čtyři konsekutivní řezy z každého parafínového bloku v intervalu 150 µm. První řez z každé úrovně byl barven H&E. Jestliže byly následující čtyři plátky barvené H&E negativní, potom byl první plátek z každé úrovně vyšetřen imunohistochemicky s protilátkami proti cytokeratinům AE1/AE3 (1 : 50 dilution, Dako, Glostrup, Denmark). Imunohistochemické vyšetření bylo provedeno metodou avidin-biotinového komplexu (Ventana ES autostainer, Ventana, Medical Systems, Tucson, AZ).
Makrometastázy byly definovány jako nádorová depozita > 2,0 mm; mikrometastázy byly definovány jako nádorová depozita velikosti 0,2 až 2,0 mm a ITC byly definovány jako depozita menší než 0,2 mm, včetně přítomnosti jednotlivých, nekohezivních cytokeratin-pozitivních nádorových buněk. Nízkoobjemové metastatické postižení uzlin (low volume disease – LVD) zahrnovalo současně mikrometastázy a ITC.
Statistická analýza
Standardní robustní souhrnná statistika byla použita k popisu primárních dat, medián nahrazený 5. až 95. percentilem byl použit pro plynulé proměnné, absolutní a relativní četnost pro kategorické proměnné. Statistická významnost rozdílů mezi skupinami pacientek byla posuzována pomocí Mannova-Whitneyho U testu pro dva nezávislé vzorky (plynulé proměnné) a ML χ2 testu (kategorické proměnné). Párové rozdíly v objemu tumoru před NAC a po NAC byly statisticky testovány proti nulové hodnotě za pomoci t-testu pro párové porovnání. Výsledky byly ve všech analýzách považovány za statisticky významné na hladině alfa < 0,05. K analýzám byl použit program IBM SPSS 19.0.1 (IBM Corporation, 2010).
VÝSLEDKY
Charakteristika souboru je uvedena v tabulce 1. Do studie bylo zařazeno celkem 101 pacientek, z toho 62 pacientek bylo referovaných nejprve k biopsii SLN (skupina SLN) a 39 pacientek bylo operovaných po předchozím podání NAC (skupina NAC-SLN). V obou skupinách převažovaly pacientky ve FIGO stadiích IB2 a IIB s incipientním postižením parametrií (39,6 % a 37,6 %) bez rozdílu v zastoupení histotypů. Celkem bylo vyšetřeno 217 SLN. Průměrně byly detekovány 2,2 (0–4) SLN na pacientku. Frekvence detekce v celé kohortě dosahovala 90,1 % na pacientku a 68,3 % bilaterálně. Mezi skupinou SLN a skupinou NAC-SLN nebyly zjištěny signifikantní rozdíly ve frekvenci detekce na pacientku (90,3 % vs 89,7 %) ani bilaterální detekce (69,4 % vs 66,7 %) a nebyl zaznamenán žádný rozdíl ve frekvenci detekce podle použité metody. Frekvence detekce nevykazovala závislost na stadiu onemocnění, histotypu nádoru, přítomnosti LVSI, body mass indexu pacientky nebo gradingu nádoru.
Tab. 1. Charakteristika studovaného souboru 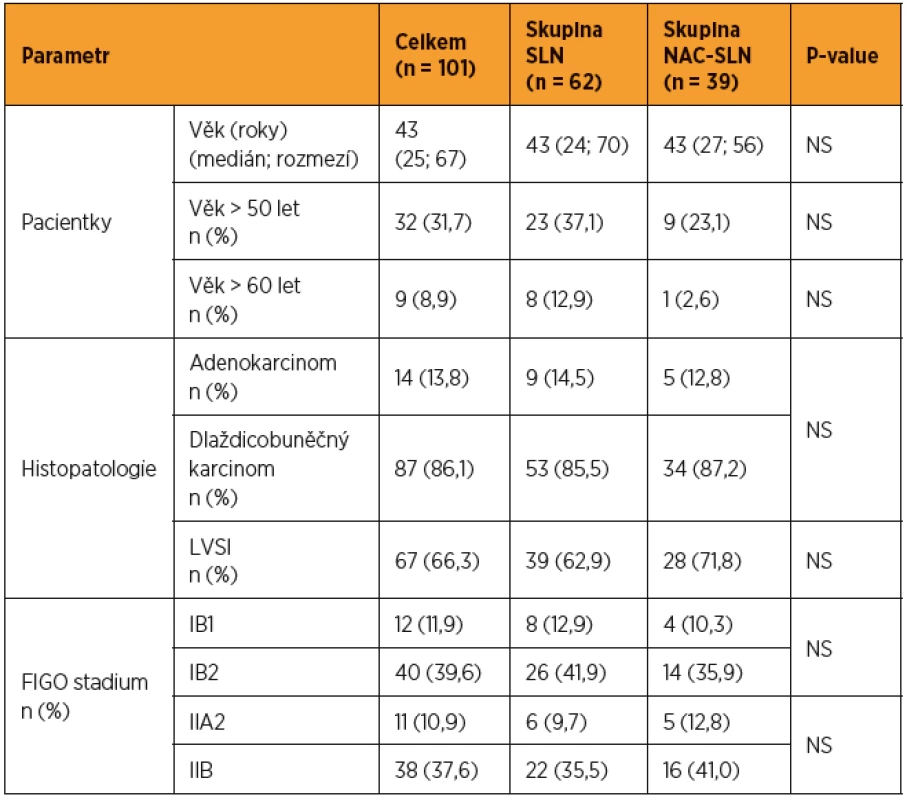
NS = statisticky nesignifikantní U více než poloviny pacientek (56,5 %) ve skupině SLN bylo zjištěno metastatické postižení SLN, zatímco u pacientek ve skupině NAC-SLN byla metastáza v SLN prokázána jen u 20,5 % (8/39). Prevalence makrometastáz, mikrometastáz a ITC ve skupině SLN byla 37,1 % (23/62), 11,3 % (7/62) a 8,1 % (5/62). Ve skupině NAC-SLN bylo makrometastatické postižení SLN zjištěno u 17,9 % (7/39) pacientek, pouze u jediné pacientky byla zjištěna v SLN mikrometastáza a u žádné nebyly v SLN detekovány ITC. Mezi oběma kohortami byl zjištěn při hodnocení frekvence všech typů metastáz v SLN signifikantní rozdíl (p = 0,013) (tab. 2). Statisticky významné bylo také izolované porovnání obou kohort založené pouze na prevalenci makrometastáz (p = 0,033) nebo pouze nízkoobjemového metastatického postižení SLN (p = 0,049) (tab. 3).
Tab. 2. Výsledky histopatologického ultrastagingového vyšetrení SLN 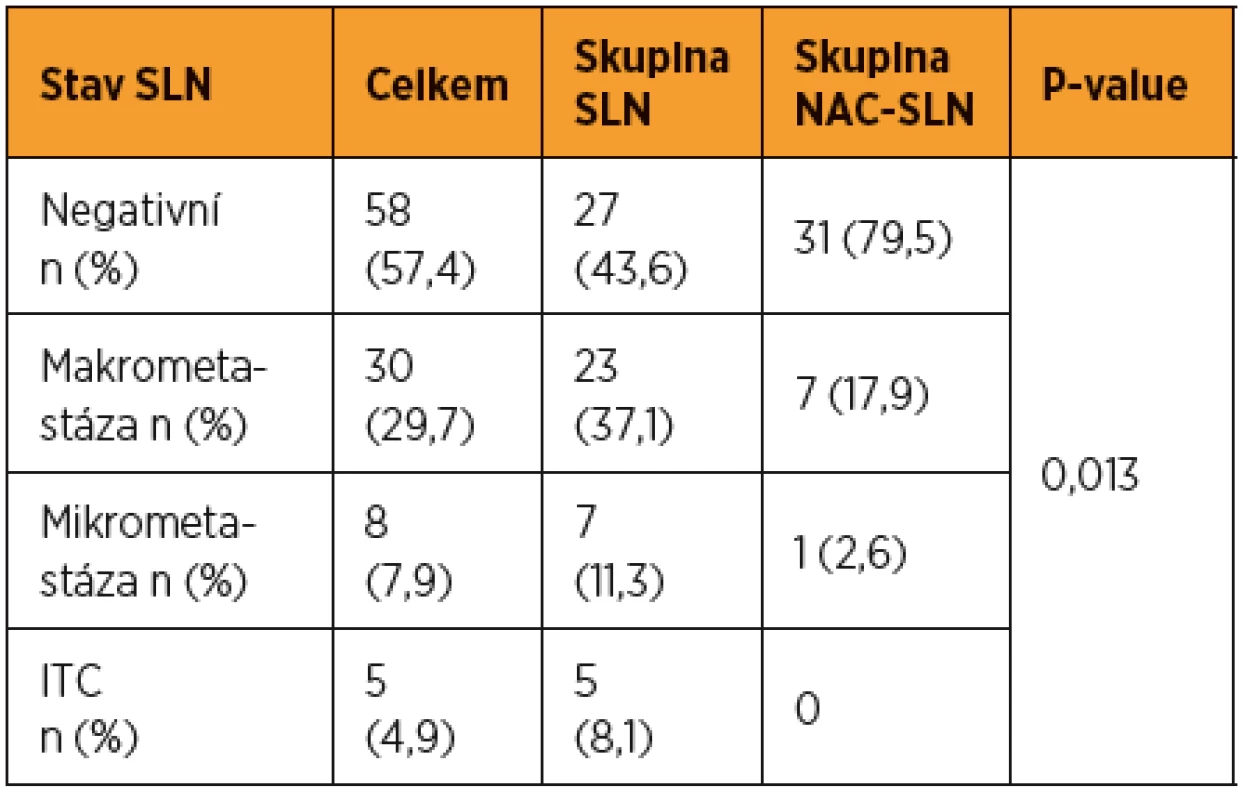
ITC = izolované nádorové Tab. 3. Samostatné srovnání podle prevalence makrometastáz a LVD 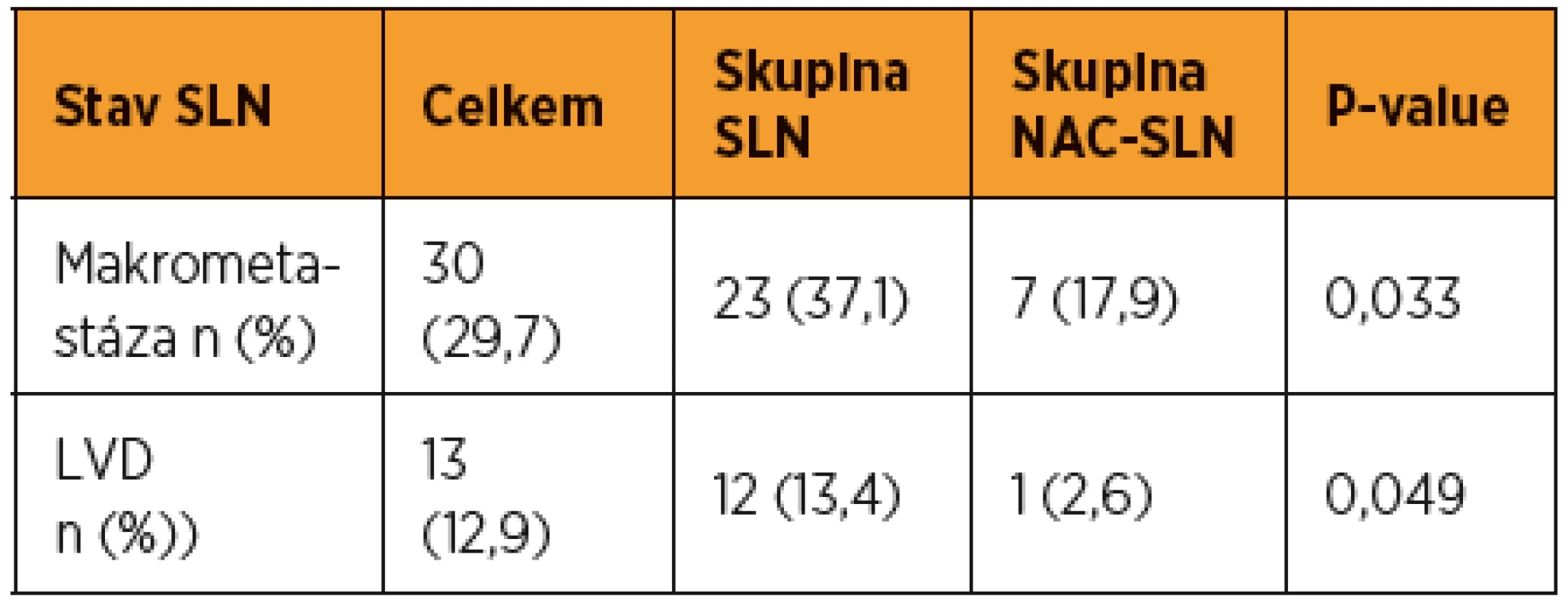
Prevalence byla pocítána ve skupine s pozitivními SLN (n = 43): makrometastázy – 69,8 %; mikrometastázy – 18,6 %; ITC – 11,6 %; LVD – 30,2 % LVD = low volume disease (mikrometastázy a ITC) U žádné pacientky v celé sledované kohortě nebyla zaznamenána progrese onemocnění během NAC. Celkem 39 pacientek ze skupiny NAC-SLN a 34 pacientek (54,8 %) ze skupiny SLN (všechny pacientky s negativními SLN, všech pět pacientek s ITC v SLN a dvě ze čtyř pacientek s mikrometastázou v SLN) bylo nakonec léčeno NAC následovanou radikálním chirurgickým výkonem. Medián objemu nádorů před léčbou dosahoval 20,1 cm3 a po léčbě 2,3 cm3. Kompletní patologická odpověď byla prokázána u 15,1 % (11/73) pacientek a redukce objemu nádoru o více než 30 % u 84,9 % (62/73) pacientek. Žádný rozdíl v odpovědi na NAC nebyl zaznamenán mezi skupinami pacientek s pozitivní a s negativní SLN.
DISKUSE
Vliv NAC na detekci SLN u pacientek s lokálně pokročilým karcinomem děložního hrdla nebyl dosud dostatečně hodnocen. V našem souboru jsme zjistili stejnou frekvenci detekce SLN bez ohledu na předchozí podání NAC (89,7 % ve skupině po aplikaci NAC a 90,3 % bez NAC). Srovnatelná byla i bilaterální detekce SLN (66,7 % vs 69,4 %). Stejně tak byla srovnatelná frekvence detekce při samostatném použití patentové modři a při použití kombinované metody. Díky využití principu stranově specifické detekce SLN nebyl v souboru zjištěn žádný falešně negativní případ. Barranger et al. v malém souboru 11 pacientek stadia IB2–IIB po neoadjuvantní chemoradioterapii uvádějí při použití kombinované techniky 100% frekvenci detekce. Bilaterálně SLN sice identifikovali pouze u čtyř pacientek (36,4 %), ale také nezjistili v celém souboru žádný falešně negativní případ [1]. Ani v jiném souboru 51 pacientek stadia IB2 po NAC nebyl prokázán žádný falešně negativní případ SLN [11]. Frekvence detekce SLN se v naší práci ani v žádném dosud publikovaném souboru nelišil mezi kohortami s laparoskopickým a laparotomickým přístupem [1, 8, 11].
Řada prací již prokázala vysokou citlivost a nízkou falešnou negativitu detekce SLN u malých nádorů (< 2 cm) v časných stadiích karcinomu děložního hrdla [7, 8]. Opakovaně uváděnou limitací konceptu SLN u lokálně pokročilých karcinomů děložního hrdla je nízká detekční schopnost. Nejčastěji zmiňovaným důvodem je blokáda lymfatických cév nádorovými buňkami [17]. Naše výsledky ale tento předpoklad nepotvrzují. Frekvence detekce SLN dosahovala v naší práci u všech hodnocených lokálně pokročilých nádorů 90,1 % na pacientku a 68,3 % bilaterálně, bez signifikantního rozdílu ve vztahu k použité metodě detekce. V menším souboru 26 pacientek s nádory stadia IB2 po NAC byla při kombinované metodě frekvence detekce na pacientku 92,3 % (24/26) a 91,7 % (23/26) bilaterálně [11]. Stejní autoři ale v jiném souboru pacientek po NAC (n =25) uvádějí při izolovaném použití patentové modři pouze 60,0% (15/25) detekci na pacientku a 40,0% (10/25) detekci bilaterálně. Důvodem takové diskrepance může být použití standardní techniky peritumorózní aplikace látky bez modifikace pro lokálně pokročilé nádory. Podstatou modifikované techniky je pečlivá předoperační identifikace reziduálního stromatu a kontrola úniku aplikované látky přes nekrotickou část tumoru nebo přímého podání látky do parametrií.
Dosažení odpovědi na NAC je zaznamenáno v širokém rozmezí u 62–90 % pacientek a u 5–48 % je zaznamenána kompletní patologická odpověď [4, 9, 10, 15, 16]. Důvodem širokého rozmezí je především nejednotnost v použitém režimu léčby. V našem souboru nebyla zaznamenána u žádné pacientky progrese onemocnění, u 84,9 % (62/73) byla redukce objemu nádoru více než 30 % a u 15,1 % (11/73) byla zjištěna kompletní odpověď. Při použití stejného režimu NAC jako v naší práci uvádí Robová et al. kompletní odpověď u 12,6 % pacientek a redukci objemu o více než 50 % u 78,8 % pacientek s onemocněním stadia „pseudobulky“ IB1 a stadia IB2 [13]. Hodnocení efektu NAC je ale omezeno prakticky jen na posouzení změny objemu tumoru děložního hrdla pomocí magnetické rezonance nebo transrektálního ultrazvukového vyšetření [6]. Posouzení efektu NAC na stav lymfatických uzlin pomocí zobrazovacích metod je nepřesné, navíc i prediktivní význam nálezu zvětšených uzlin je nízký. Při podrobné analýze části našeho souboru bylo metastatické postižení prokázáno jen u čtyř z devíti pacientek se zvětšenými pánevními uzlinami [3].
Porovnání obou skupin sledovaných pacientek ukázalo signifikantní rozdíl ve frekvenci přítomnosti metastatického postižení SLN – zatímco v souboru žen referovaných nejprve k biopsii SLN bylo zjištěno u 56,4 % (35/62) případů jejich metastatické postižení (37,1 % makrometastáz, 11,3 % mikrometastáz a 8,1 % ITC), v souboru pacientek po předchozí NAC bylo nalezeno jen u 17,9 % (8/39), z toho pouze u jediné pacientky byla v SLN prokázána mikrometastáza a u žádné pacientky nebyly nalezeny ITC. V souboru 142 pacientek, které podstoupily NAC, zjistila Robová et al. metastatické postižení u 18,3 % případů. Nespecifikuje však, v jakém poměru byly zjištěny mikrometastázy a makrometastázy [13]. V jiné práci byly po neoadjuvantní chemoradioterapii zjištěny metastázy v SLN u dvou pacientek z 11 (18,2 %), ale jen v jednom případě byla prokázána makrometastáza. V kontrolní skupině bez chemoradioterapie bylo prokázáno metastatické postižení u tří pacientek z 15 (20 %), u jedné byla makrometastáza, zatímco u ostatních byly prokázány mikrometastázy nebo přítomnost ITC [1]. Ve velkém souboru 645 žen, které podstoupily radikální operaci včetně biopsie SLN, byly u 10,1 % případů nalezeny v SLN mikrometastázy a u 14,7 % makrometastázy. Přítomnost mikrometastáz byla spojena se signifikantní redukcí celkového přežití, které se nelišilo od pacientek s makrometastázami (p = 0,886) [2]. Dosud lze však pouze spekulovat, zda by významná redukce makrometastáz a téměř úplná eliminace mikrometastáz mohla vést ke zlepšení prognózy pacientek po NAC.
ZÁVĚR
Naše práce vyvrátila starší předpoklady, že koncept SLN u lokálně pokročilých karcinomů děložního hrdla ve vysokém počtu případů selhává. Díky využití modifikované techniky aplikace detekční látky bylo dosaženo srovnatelné frekvence detekce SLN jako u časných stadií onemocnění. Podstatou modifikace metodiky je pečlivá předoperační identifikace reziduálního stromatu, do kterého je následně aplikována detekční látka za pečlivé kontroly úniku přes nekrotickou část tumoru nebo přímé aplikace do parametrií. Frekvence nálezu SLN v naší práci dosahovala 90,1 % na pacientku a 68,3 % bilaterálně, bez signifikantního rozdílu při samostatném použití patentní modři nebo při použití kombinované techniky detekce.
U všech pacientek, kde se nepodařilo SLN identifikovat bilaterálně, byla provedena stranově specifická systematická pánevní lymfadenektomie. Díky takovému postupu bylo zjištěno u dalších dvou žen metastatické postižení pánevních lymfatických uzlin. V celém souboru navíc nebyl díky podmínce dosažení bilaterální detekce SLN a využití stranově specifické pánevní lymfadenektomie zaznamenán žádný falešně negativní případ SLN.
Neoadjuvantní chemoterapie neovlivnila frekvenci detekce SLN, ale vedla k signifikantnímu snížení prevalence metastatického postižení SLN. Redukce přítomnosti uzlinových metastáz by mohla představovat jeden z důvodů pro zlepšení prognózy pacientek po NAC. Tento předpoklad však může být studován pouze v randomizované prospektivní studii.
Doc. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: Jiri.Slama@vfn.cz
Zdroje
1. Barranger, E., Cortez, A., Grahek, D., et al. Laparoscopic sentinel node procedure for cervical cancer: Impact of neodjuvant chemoradiotherapy. Ann Surg Oncol, 2004, 11, p. 445–452.
2. Cibula, D., Abu-Rustum, NR., Dušek, L., et al. Prognostic signifikance of low volume sentinel lymph node disease in early – stage cervical cancer. Gynecol Oncol, 2012, 124, p. 496–501.
3. Cibula, D., Kužel, D., Sláma, J., et al. Sentinel node (SLN) biopsy in the management of locally advanced cervical cancer. Gynecol Oncol, 2009, 115, p. 46–50.
4. Colombo, N., Peiretti, M. Critical review of neoadjuvant chemotherapy followed by surgery for locally advanced cervical cancer. Int J Gynecol Cancer, 2010, 20, p. S47–S48.
5. Euscher, ED., Malpica, A., Atkinson, EN., et al. Ultrastaging improves detection of metastases in sentinel lymph nodes of uterine cervix squamous cell carcinoma. Am J Surg Pathol, 2008, 32, p. 1336–1343.
6. Fischerova, D., Cibula, D., Stenhova, H., et al. Transrectal ultrasound and magnetic resonance imaging in staging of early cervical cancer. Int J Gynecol Cancer, 2007, 18, p. 766–772.
7. Gortzak-Uzan, L., Jimenez, W., Nofech-Mozes, S., et al. Sentinel node biopsy vs. pelvic lymphadenectomy in early stage cervical cancer: Is it time to change the gold standard? Gynecol Oncol, 2010, 116, p. 28–32.
8. Levenback, CF., van der Zee, AGJ., Rob, L., et al. Sentinel lymph node biopsy in patients with gynecologic cancers. Expert panel statement from the International Sentinel Node Meeting, February 21, 2008. Gynecol Oncol, 2009, 114, p. 151–156.
9. Lopez-Graniel, C., Reyes, M., Chanona, G., et al. Type III radical hysterectomy after induction chemotherapy for patients with locally advanced cervical carcinoma. Int J Gynecol Cancer, 2001, 11, p. 210–217.
10. Modarress, M., Maghami, FQ., Golnavaz, M., et al. Comparative study of chemoradiation and neoadjuvant chemotherapy effects before radical hysterectomy in stage IB–IIB bulky cervical cancer and with tumor diameter greater than 4 cm. Int J Gynecol Cancer, 2005, 15, p. 483–488.
11. Rob, L., Strnad, P., Robova, H., et al. Study of lymphatic mapping and sentinel node identification in early stage cervical cancer. Gynecol Oncol, 2005, 98, p. 281–288.
12. Robova, H., Halaska, M., Pluta, M., et al. The role of neoadjuvant chemotherapy and surgery in cervical cancer. Int J Gynecol Cancer, 2010, 20, p. S42–S46.
13. Robova, H., Rob, L., Halaska, M. J., et al. High-dose neoadjuvant chemotherapy in bulky IB cervical cancer. Gynecol Oncol, 2013, 128, p. 49–53.
14. Sakuragi, N., Satoh, C., Takeda, N., et al. Incidence and distribution pattern of pelvic and paraaortic lymph node metastasis in patiens with stages IB, IIA, and IIB cervical carcinoma treated with radical hysterectomy. Cancer, 1999, 85, p. 1547–1554.
15. Serur, E., Mathews, RP., Gates, J., et al. Neoadjuvant chemotherapy in stage IB2 squamous cell carcinoma of the cervix. Gynecol Oncol, 1997, 65, p. 348–356.
16. Sláma, J., Dundr, P., Dušek, L., et al. Sentinel lymph node status in patients with locally advanced cervical cancers and impact of neoadjuvant chemotherapy. Gynecol Oncol, 2012, 125, p. 303–306.
17. Wydra, D., Sawicki, S., Wojtylak, S., et al. Sentinel node identification in cervical cancer patients undergoing transperitoneal radical hysterectomy: a study of 100 cases. Int J Gynecol Cancer, 2006, 16, p. 649–654.
18. Zanetta, G., Colombo, A., Milani, R., et al. Long-term result of sequential postoperative treatment with vincristine, bleomycin, mitomycin-c, cisplatin and radiotherapy after surgery for high-risk patients with cervical carcinoma stage Ib–IIa. Int J Gynecol Cancer, 1995, 5, p. 40–44.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2016 Číslo 3- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Přínos biopsie sentinelových uzlin pro léčbu lokálně pokročilých stadií karcinomu děložního hrdla
-
Dlaždicobuněčné prekancerózy vulvy
Historie a současný stav problematiky - Management péče o HIV pozitivní těhotné v období let 1996–2014
- Operace endometriomů ovaria a ovariální rezerva
- Paraneoplastické neurologické syndromy u gynekologických malignit
- Antepartální možnosti prevence epiziotomie a ruptury hráze při porodu
- Vplyv systémovej enzýmovej terapie na hojenie jazvy po cisárskom reze
- Akutní pankreatitida v graviditě komplikovaná rupturou aneuryzmatu arteria lienalis
- Spontánní porod po dvou císařských řezech a jeho možné komplikace – kazuistika
- Rupture of focal nodular hyperplasia in the 37th week of pregnanacy – case report
- Traumatická ruptura spony při vaginálním porodu – kazuistika
- Adrenokortikální onkocytom jako raritní příčina Cushingova syndromu v graviditě a následná děložní ruptura po porodu
- Současná témata reprodukční medicíny v České republice
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Traumatická ruptura spony při vaginálním porodu – kazuistika
- Antepartální možnosti prevence epiziotomie a ruptury hráze při porodu
- Spontánní porod po dvou císařských řezech a jeho možné komplikace – kazuistika
- Operace endometriomů ovaria a ovariální rezerva
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



