-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPacient s ložiskovou psoriázou úspěšně léčenou bimekizumabem – kazuistika
18. 11. 2025
Následující kazuistika popisuje úspěšnou terapii závažné ložiskové psoriázy u 36letého pacienta s anamnézou jaterních změn v minulosti. Odhojení klinických projevů lupénky se projevilo velmi rychle po nasazení bimekizumabu a terapie probíhá dosud, zcela bez jakýchkoliv komplikací.
Popis případu
Onemocnění u nemocného s diagnózou závažné ložiskové psoriázy trvá již řadu let, jeho rodinná anamnéza je přitom bez výskytu kožních onemocnění. Pacient neudává kloubní obtíže. V osobní anamnéze vyšetření v hepatální poradně v roce 2017. Doporučen byl k vyloučení hereditární hemochromatózy (HH) pro poněkud vyšší, ale ještě normální hladinu Fe v sušině při jaterní biopsii a hladinu ferritinu 556.
Provedena biopsie jater s následujícím závěrem: Proužek z jehlové biopsie jater délky 32 mm, kde je 15 portálních polí, není zde téměř žádný zánětlivý infiltrát, drobné žlučovody bez pozoruhodností. Jen výjimečně vybíhají z portálních polí krátké, delikátní vazivové pruhy. Dominuje obraz převážně velkokapénkové steatózy, která postihuje asi 90 % hepatocytů. Nenacházíme známky cholestázy ani Malloryho hyalin, obraz vyvinuté steatohepatitidy zřetelně vyjádřen není. Oblast centrálních žil bez pozoruhodností. V barvení na železo nacházíme lehkou depozici železa v hepatocytech periportálně v zóně 1. Fibrózu ani cirhotickou přestavbu nezjišťujeme. Balonová degenerace hepatocytů není patrná. Skóre podle Kleinera: steatóza stupně 3, lobulární zánět 0, balonová degenerace hepatocytů 0 = 3 (skóre aktivity NAFLD /NAS/ 3). Fibróza podle Kleinera 0–1C (velmi diskrétní fokální portální fibróza). Závěr: Obraz převážně velkokapénkové steatózy, kde etiologie není zcela jasná, diagnóza NASH (nealkoholová steatohepatitida – závažná forma nealkoholového ztukovatění jater /NAFLD/) nejistá. Vzhledem k akumulaci malého množství železa v zóně 1 hepatocytů a vysoké hladině ferritinu doporučujeme vyloučit klinicky možnost zcela iniciálního stadia HH.
InzerceUZ vyšetření břicha ukázalo mírnou hepatomegalii s obrazem steatózy s nesteatotickým okrskem u žlučníku, lipomatózní špatně přehledný pankreas a hraniční velikost sleziny.
Genetické vyšetření se závěrem: Heterozygot pro mutaci H63D v genu HFE (spojováno s HH, autosomálně recesivní onemocnění s nekompletní penetrancí), obě další mutace nenalezeny.
Elastografické vyšetření s vyšetřením elasticity jater (SWE – shear waves elastography jakožto neinvazivní diagnostická UZ zobrazovací metoda) prokazuje nález odpovídající ještě spíše normálním hodnotám F0.
Pacient byl dlouhodobě léčen kortikoidními externy a fototerapií UVB. Při kontrolním vyšetření v červenci 2024 indikováno nasazení methotrexátu (MTX) v dávce 15 mg/týden. Tato terapie byla provázena nauzeou a zvracením již po první dávce MTX, a byla proto ukončena. Nedošlo však k laboratornímu zvýšení jaterních enzymů. Hodnota indexu skóre závažnosti psoriázy (PASI) dosahovala v září 2024 18,0.
Od 21. října 2024 byl v terapii nasazen dimethyl-fumarát, titrován až do dávky 2-2-2 tbl. à 120 mg (úvodní dávka 30 mg 1× denně 1. týden; 2× denně 2. druhý týden a 3× denně 3. týden; po 3 týdnech navýšena na 120 mg 1× denně po dobu 4. týdne léčby, 2× 120 mg po dobu 5. týdne atd.). Tuto terapii pacient toleroval, nicméně došlo pouze k mírnému zlepšení kožního nálezu lupénky. Z těchto důvodů bylo rozhodnuto o switchi pacienta na cílenou biologickou léčbu duálním inhibitorem interleukinů IL-17A/F bimekizumabem inj. s.c.
Biologická terapie byla zahájena v dubnu 2025, pacient byl edukován stran aplikace i možnosti výskytu nežádoucích příhod ve smyslu kandidové infekce.
Obr. 1 a 2 Před nasazením léčby bimekizumabem
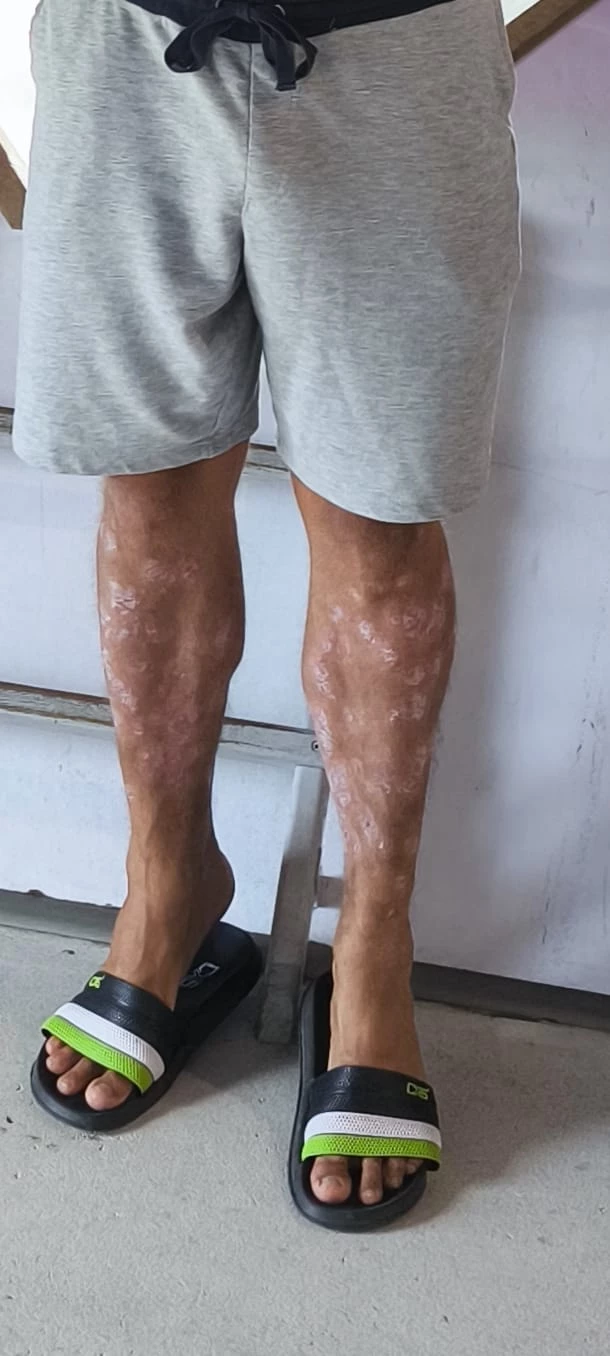
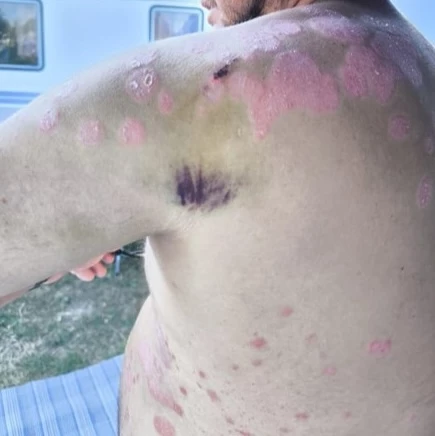
Rentgenové vyšetření srdce a plic ukázalo následující: V přehledném plicním parenchymu bez ložiskových změn či známek zánětlivé konsolidace. Cévní hily, stín horního mediastina a srdeční stín nerozšířeny. Bez známek fluidothoraxu.
Panel vyšetření hepatitid s negativním nálezem. Test Quantiferon Plus – infekce M. tuberculosis nepravděpodobná (normální hodnoty). Z ostatních laboratorních hodnot – C-reaktivní protein (CRP) v normě, krevní obraz a diferenciál v normě. Jaterní enzymy se zvýšením alaninaminotransferázy (ALT) od 1,35 do 2,30, aspartátaminotransferázy (AST) od normálních hodnot do 1,12 a gamma-glutamyltransferázy (GGT) od 1,40 do 2,11; alkalická fosfatáza (ALP) v normě.
Bimekizumab je podáván ve formě 2 subkutánních injekcí po 160 mg v týdnech 0, 4, 8, 12, 16 a poté každých 8 týdnů. Vstupní hodnota skóre PASI při zahájení této léčby činila 13,9.
Aplikace nebyla provázena komplikacemi, poslední v dávce 2× 160 mg proběhla v týdnu 16 počátkem července 2025. V této době byla závažnost klinického obrazu hodnocena následujícími hodnotami skórovacích systémů: PASI 0,3, Dermatologický index kvality života (DLQI) 0. Výrazné zlepšení a ústup kožních projevů však pacient pozoroval již během prvních 14 dnů po zahájení této léčby.
Obr. 3–7 Po 2 týdnech léčby bimekizumabem
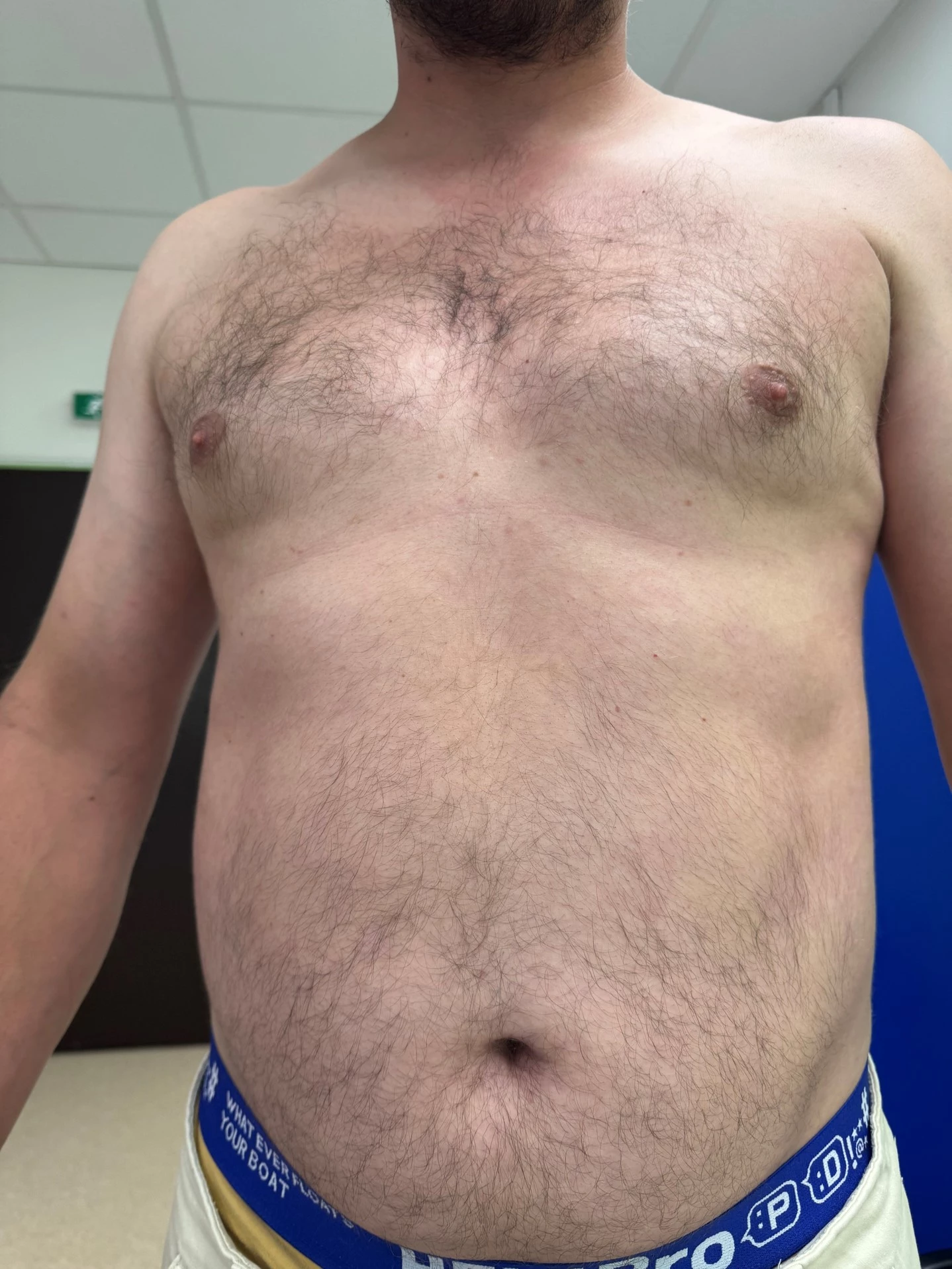
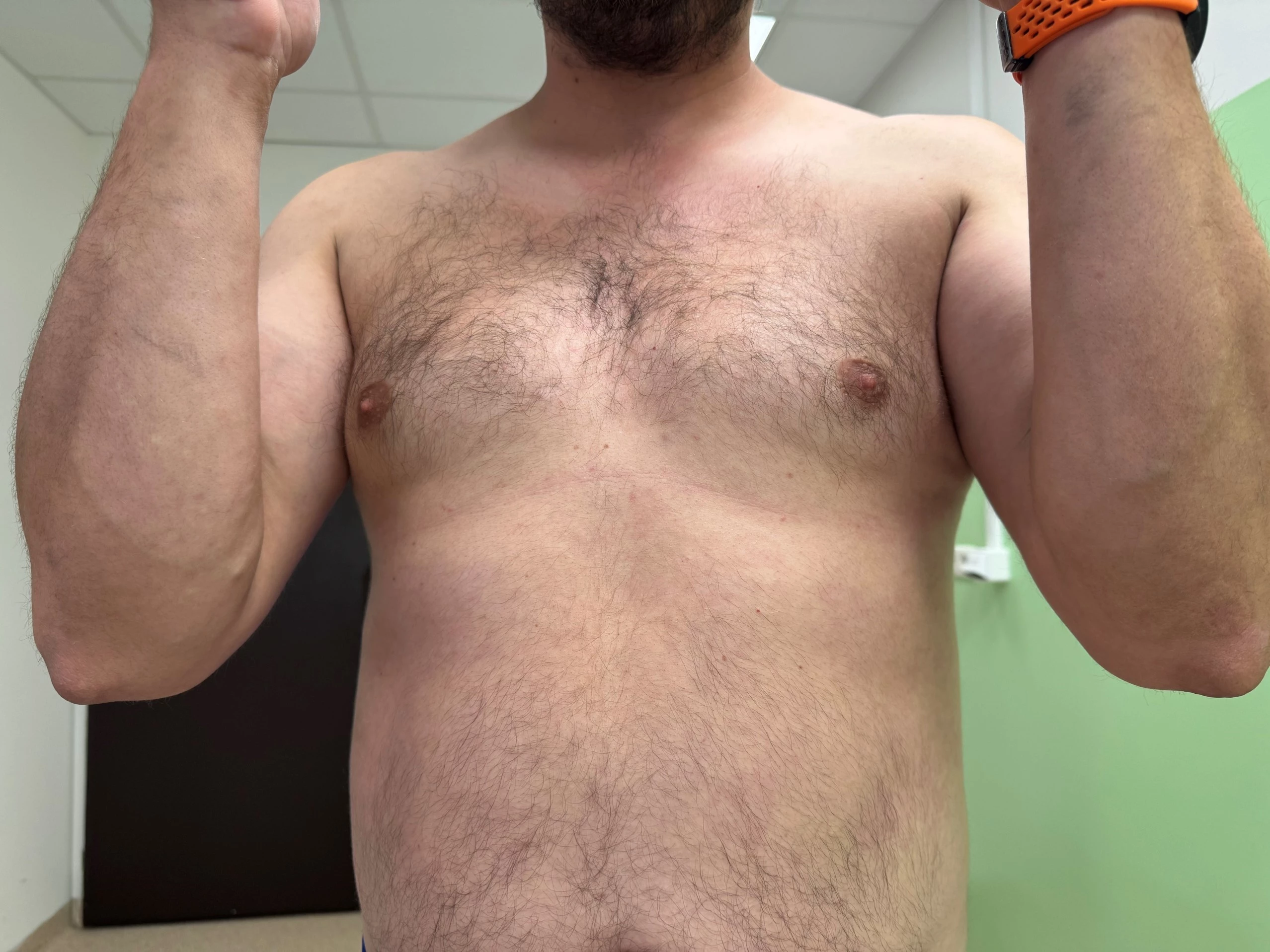
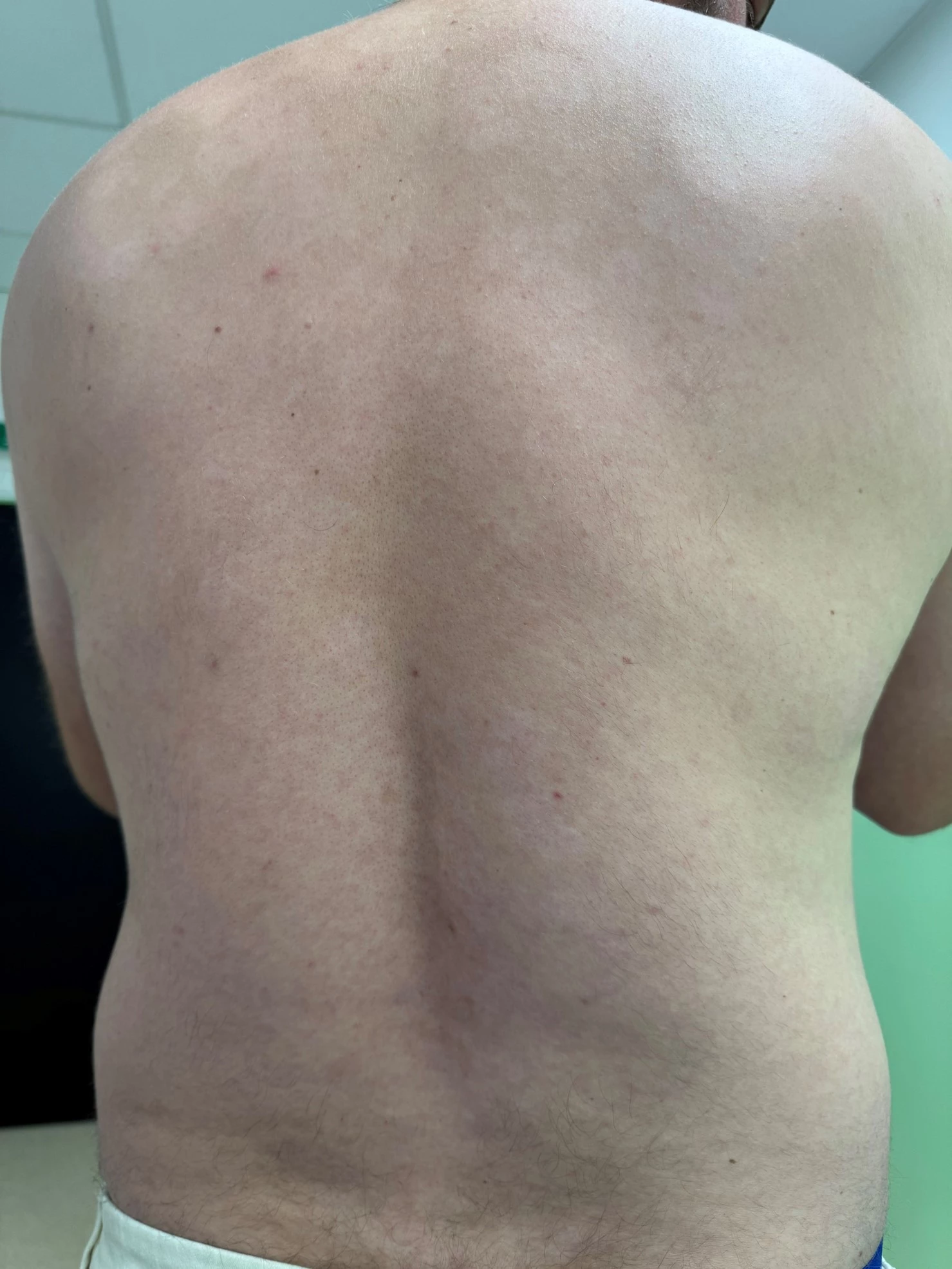
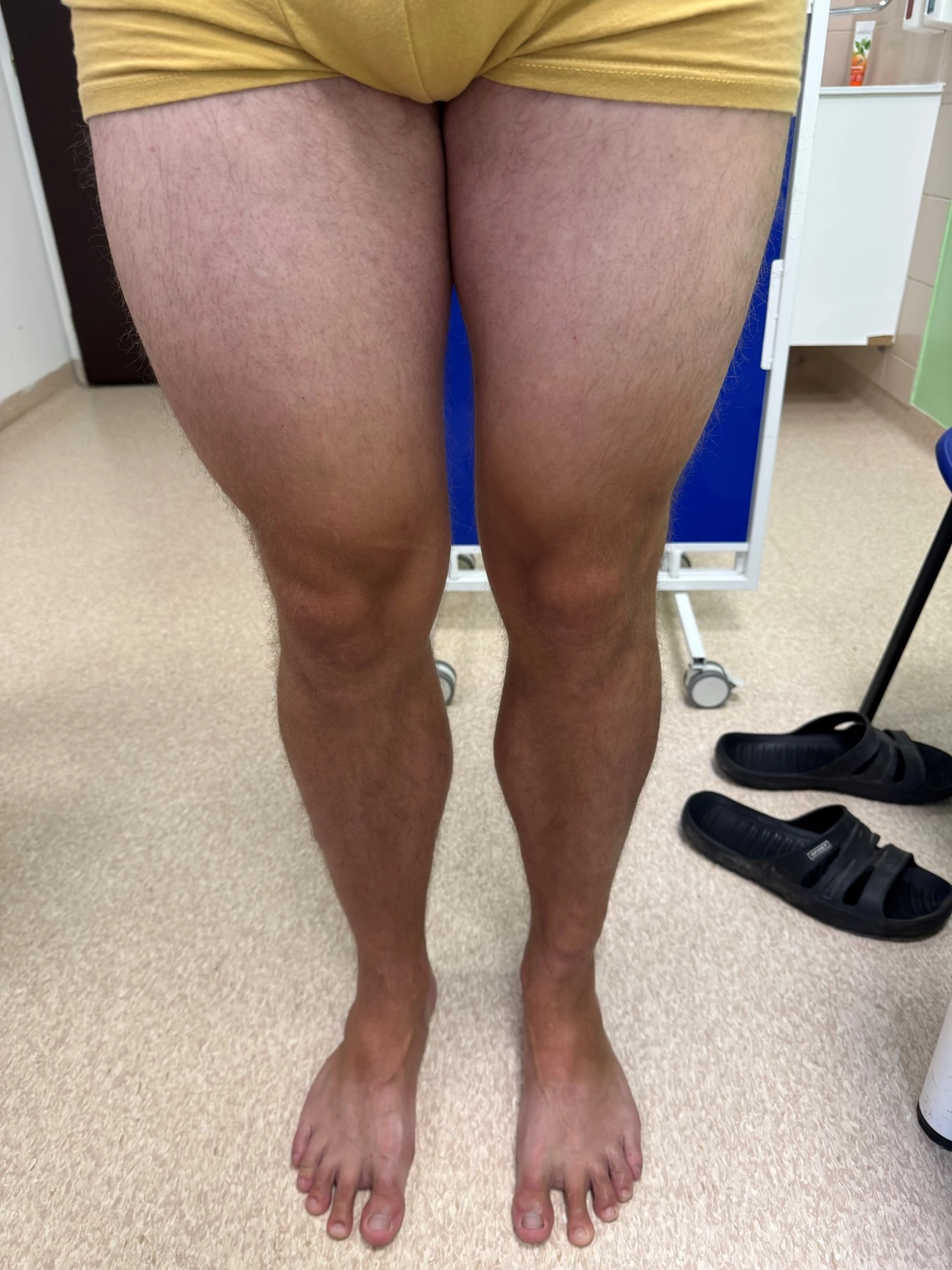
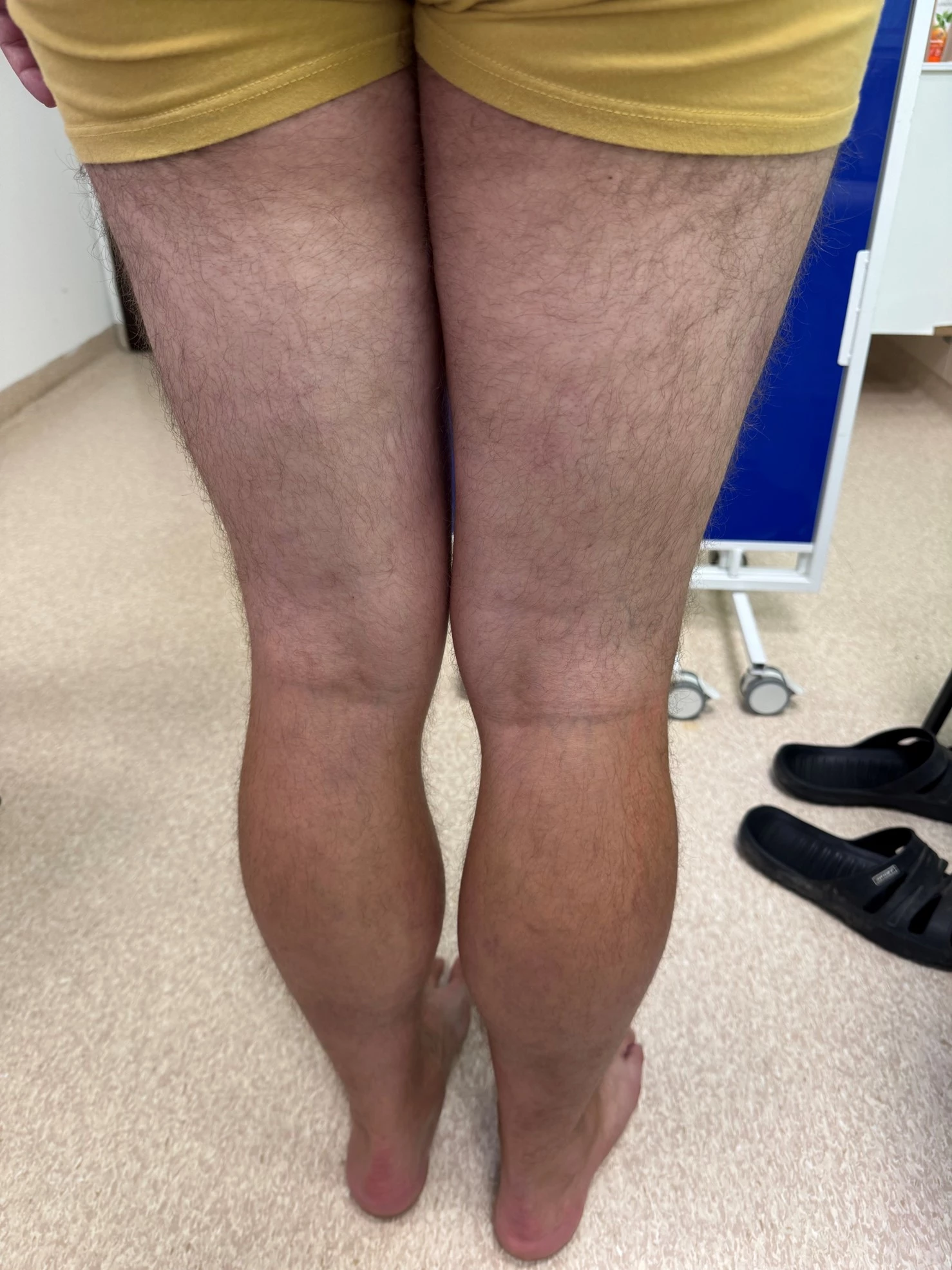
Při posledním vyšetření koncem června 2025 v objektivním kožním nálezu minimální reziduální erytémy na končetinách, není deskvamace, bez infiltrace. Kůže téměř čistá včetně projevů ve kštici. Lehký erytém v axilách.
Diskuse
Bimekizumab je humanizovaná monoklonální IgG protilátka, která selektivně inhibuje IL-17A a IL-17F. Je indikovaný u dospělých nemocných se středně těžkou až těžkou formou ložiskové psoriázy vyžadující systémovou léčbu.
U našeho pacienta byl pozorován extrémně rychlý efekt v dosažení ústupu klinických projevů psoriázy a i během dosavadního relativně krátkého období terapie vynikající bezpečnostní profil přípravku.
V randomizované studii BE READY a jejím otevřeném prodloužení BE BRIGHT bylo hodnoceno přetrvávání klinické odpovědi po vysazení bimekizumabu během 1 roku u pacientů se středně těžkou až těžkou ložiskovou psoriázou. Autoři se snažili zjistit, zda lze odpovědi na tuto léčbu znovu dosáhnout a udržet ji následně po dobu 2 let. Zařazeni byli pacienti randomizovaní k bimekizumabu, kteří po 16 týdnech dosáhli PASI 90 a byli rerandomizováni k následnému užívání placeba po dobu 40 týdnů. Pokud si udrželi PASI 75 až do 56. týdne, byli převedeni zpět na bimekizumab, který užívali v následném otevřeném hodnocení. Jestliže mezi 16. a 56. týdnem došlo k relapsu (< PASI 75), dostali na 12 týdnů bimekizumab. Účastníci s > PASI 50 po této 12týdenní léčbě vstoupili do otevřeného hodnocení bimekizumabu.
K užívání placeba po dosažení PASI 90 s bimekizumabem bylo po 16 týdnech rerandomizováno 105 pacientů. Z nich 31,4 % užívalo celých 40 týdnů placebo, což znamená, že si udrželo ≥ PASI 75, přičemž 51,5 % si udrželo PASI 90 a 33,3 % dosáhlo v 56. týdnu PASI 100. Po obnovení léčby bimekizumabem se odpověď na léčbu výrazně zlepšila a přetrvávala až do 96. týdne. K relapsu (< PASI 75) došlo během podávání placeba u 62,9 % pacientů. V průběhu 12týdenní znovu nasazené léčby bimekizumabem dosáhlo 90,8 % z nich PASI 90 a 63,1 % PASI 100. V 96. týdnu podíl pacientů s PASI 90 přetrvával a podíl s PASI 100 se zvýšil.
Tyto výsledky dokládají přetrvávající odpověď na bimekizumab během 40 týdnů po vysazení u třetiny nemocných, možnost dosažení opakované odpovědi na léčbu při opětovném nasazení bimekizumabu a jeho následnou účinnost přetrvávající po dobu 2 let (1).
Duální inhibice IL-17A/F prostřednictvím bimekizumabu má předpoklady pro vysokou úspěšnost nejen v případě intra class převodů ve skupině inhibitorů IL-17, ale může být řešením i pro pacienty s primární či sekundární rezistencí vůči léčivům ze skupiny inhibitorů IL-23 (3).
Bimekizumab je schopen ovlivnit i kardiovaskulární (KV) komorbidity. Výsledky hodnocení jeho vlivu na biomarkery KV zánětu (CRP, poměr neutrofily : leukocyty /NLR/, index triglyceridy/glykémie /TyG/) u pacientů se středně těžkou až těžkou ložiskovou psoriázou ze studií BE VIVID a BE RADIANT v porovnání se secukinumabem, ustekinumabem a placebem byly prezentovány na kongresu Evropské akademie dermatovenerologie (EADV) v roce 2023. Při léčbě bimekizumabem došlo po 16 týdnech k významně většímu poklesu NLR v porovnání s placebem a k významnému poklesu CRP v porovnání se vstupem do studie, a to zejména u účastníků s vyšším CRP (≥ 5 mg/dl) při zahájení léčby. Pokles obou těchto biomarkerů přetrvával po celý rok léčby bimekizumabem. Index TyG zůstal od vstupu do studie po celou dobu léčby stabilní. Porovnání s aktivní terapií, které bylo k dispozici, ukázalo podobné trendy u secukinumabu a ustekinumabu (4).
Pacienti léčení bimekizumabem vykazují zlepšení klinických projevů i v parametrech kvality života již od 4. týdne. Vysoká úroveň odpovědi byla dále pozorována ve 48. týdnu a přetrvávala až do 144. týdne.
Efekt terapie se týká i takzvaných obtížně léčitelných oblastí psoriázy. Nemocní s výchozí hodnotou skóre postižení kštice (sIGA) ≥ 3 na začátku léčby dosáhli vysoké míry zhojení po 16 týdnech a ta přetrvávala po dobu 3 let. Stejně tak u pacientů s výchozí hodnotou skóre palmoplantárního postižení (ppIGA) ≥ 3 na začátku léčby dosáhli vysoké míry zhojení po 16 týdnech, s přetrváváním po dobu 3 let. A konečně i nemocní s výchozí hodnotou skóre postižení nehtových plotének psoriatickým onemocněním (mNAPSI) > 10 na začátku léčby vykázali míru zhojení nehtů zvyšující se do 1. roku a s udržením do 3. roku; míra zhojení odrážela delší dobu potřebnou pro růst a regeneraci nehtů (data ze 4 klinických studií: BE READY, BE SURE, BE VIVID, BE BRIGHT/BE RADIANT OLEs) (2).
doc. MUDr. Miloslav Salavec, CSc.
Klinika nemocí kožních a pohlavních LF UK a FN Hradec KrálovéReference:
1. Costanzo A., Papp K., Griffiths C. E. M. et al. P2511 Bimekizumab response through 3 years in patients with plaque psoriasis who stopped and re-started treatment. EADV Congress, Berlin, 2023 Oct 11−14.
2. Salavec M. Efekt terapie bimekizumabem u středně závažné až závažné psoriázy během 144 týdnů: výsledky dokumentované pacienty ze studie BE RADIANT. Dermatologie pro praxi 2024; 18 (3): 135–139.
3. Tichý M. Bimekizumab ve 3. linii biologické léčby po selhání risankizumabu – kazuistika. Dostupné na: www.prolekare.cz/tema/psoriaza/detail/bimekizumab-ve-3-linii-biologicke-lecby-po-selhani-risankizumabu-kazuistika-136898
4. Warren R. B., Langley R. G., Kokolakis G. et al. P2549 Bimekizumab impact on cardiovascular inflammation markers in moderate to severe plaque psoriasis: results from phase 3 trials. EADV Congress, Berlin, 2023 Oct 11–14.
5. SmPC Bimzelx. Dostupné na: https://ec.europa.eu/health/documents/community-register/2021/20210820152533/anx_152533_cs.pdfFotodokumentace: archiv Kliniky nemocí kožních a pohlavních LF UK a FN Hradec Králové
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Dermatologie Dětská dermatologie Dětská revmatologie
Nejnovější kurzy
Autoři: doc. MUDr. Přemysl Falt, Ph.D.
Autoři: Prim. MUDr. Spyridon Gkalpakiotis, MBA. Ph.D.
Autoři: Prim. MUDr. Spyridon Gkalpakiotis, MBA. Ph.D.
Přejít do kurzů
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




