-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNarušení a deficity kognitivních funkcí u schizofrenie
Datum publikace: 1. 11. 2017
Úvod
Výskyt schizofrenie je u evropské populace udáván v 1,2 %, DSM-V uvádí celoživotní prevalenci 0,3–0,7 % (DSM-V, 2013). Chronicitou průběhu pak představuje onemocnění způsobující trvalou invaliditu.
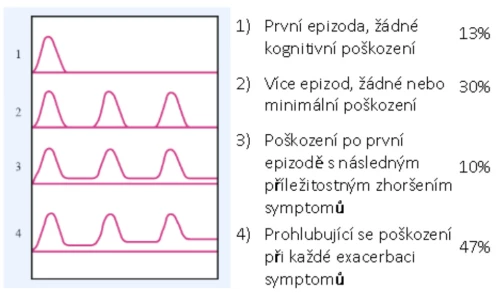
Role kognitivních deficitů u schizofrenie je zkoumána řadou autorů (Nuechterlein, et al. 2010, Crow, et al., 2010, Keefe, et al., 2006, Fuller, et al., 2002, Saykin, et al., 1994). Zaměření studií zahrnuje celé spektrum kognitivních poruch. Kognitivní postižení se u schizofrenních pacientů liší formou, závažností a průběhem onemocnění. Prokazatelné kognitivní deficity se objevují až u poloviny pacientů (Heinrichs a Zaksanis, 1998; Kelly, et al., 2000; Keefe, et al., 2005. Svou roli sehrávají také adaptační schopnosti pacienta v průběhu celého života. Nejvýraznější deficity nacházíme u pacientů s dlouhodobě nepříznivou odpovědí na léčbu a při chronickém průběhu onemocnění. Neexistuje specifický profil kognitivních funkcí, šíře deficitů je variabilní od izolovaných až po globální poškození, která naplňují kritéria pro demenci (Graf 1). Průběžné sledování kognitivního výkonu pacientů se schizofrenií poskytuje nenahraditelné informace o průběhu léčby a odpovědi na ni a poskytuje prostor pro tvorbu individuálního rehabilitačního plánu.
Graf 1 – Deficity spojené se schizofrenií (Frith, 1992)

Charakteristika a průběh kognitivních deficitů
Hodnocení kognitivních deficitů se opírá o výkon pacientů v příslušných neuropsychologických testech. Z definice kognitivních deficitů jsou vyjmuta taková narušení, která jsou v přímé souvislosti s psychotickými symptomy (porucha asociací, bludy, halucinace) nebo psychofarmakologickou medikací (útlum, zpomalení psychomotorického tempa) či jsou jimi zapříčiněna. Změny v oblasti kognitivních funkcí se u pacientů se schizofrenií formují již v rámci premorbidního vývoje. Pozorované premorbidní změny jsou zpočátku popisovány častěji jako osobnostní nápadnosti či premorbidní dispozice než deficity samotné. Prokázáno bylo například částečné poškození verbální paměti a čichu u pacientů, u kterých se později manifestovalo psychotické onemocnění (Brewer, et al., 2003).
Na vývoj deficitů lze pohlížet jako na jev související s premorbidním poklesem, který při vyjádření onemocnění pokračuje v prohlubující se deterioraci. Vývojovou deteriorací se zabývala Andreasenová (2010) a z důvodu neurovývojových změn mozku ji označuje jako neuroprogresi. Blízkou předchozímu pojetí je také teorie neurovývojového deficitu, kdy se stabilní kognitivní poškození projeví na začátku onemocnění a přetrvává v remisích. Premorbidní známky poškození kognice jsou však velmi subtilní a skokové poškození se objevuje před obdobím první epizody schizofrenie a v jeho průběhu. Následující dynamika je variabilní, deficit může přetrvávat nezávisle na dalších symptomech onemocnění (Bratti a Bilder, 2006, Andreasen, 2010).
Ke kognitivnímu narušení dochází přinejmenším u některých pacientů už před rozvinutím se psychózy samotné a je dříve měřitelné než kterýkoliv jiný aspekt nemoci. Proto se narušení kognitivních funkcí stává stále významnějším primárním cílem pro léčbu (Hyman a Fenton, 2003, Gold, 2004, Davidson a Keefe, 1995, Buchanan, et al., 2005). I když pokles kognitivních funkcí před propuknutím schizofrenie není dostatečný na to, abychom mohli jistě predikovat budoucí rozvoj onemocnění, je kognitivní fungování u budoucích pacientů v průměru nižší než u zdravých kontrol už před objevením se poruchy. Přítomnost poznávacích deficitů nebo pokles kognitivních funkcí během dospívání předpovídá schizofrenní rozvoj v různých vzorcích populace (Fuller, et al., 2002, Reichenberg, et al., 2005, Davidson, et al., 1999, Brewer, et al., 2003, Keefe, et al., 2004, Keefe, et al., 2006, Keefe, et al., 2007, Brewer, et al., 2005). Kognitivní narušení se však významněji neliší od narušení u dětí, které později rozvinou afektivní poruchu, a podobný kognitivní deficit se může objevit i u řady dětí, u kterých se v budoucnosti žádná z poruch neobjeví (Cannon, et al., 2002, Fuller, et al., 2002). Jedinci, kteří později rozvinou schizofrenii, také vykazují horší školní hodnocení od časného dětství až do pozdního dospívání (Fuller, et al., 2002). Patrně pacienti se schizofrenií začínají život s kognitivním výkonem, který je mírně horší než u jejich vrstevníků. Narušení však není dost specifické, aby šlo schizofrenní vývoj včas předpovědět. Jak dětství postupuje, kognitivní výkon se u těchto dětí postupně zhoršuje. Před tím, než se psychóza v pozdní adolescenci či ranné dospělosti rozvine, je výkon budoucích pacientů se schizofrenií významně horší než u zdravých vrstevníků. I když pacienti s afektivními poruchami také v dospělosti vykazují kognitivní deficity, jejich postižení je před objevením se poruchy v dospělosti významně menší (Cannon, et al., 2002).
O deficitech mluvíme až na základě systematického pozorování, objektivních anamnestických údajích a především na základě výsledků testových diagnostických metod. V průběhu prodromální fáze onemocnění dochází k prohlubování dříve pozorovaných nápadností, ke změnám v oblasti emotivity (kolísavé úzkostně-depresivní ladění, emoční oploštělost), myšlení (nadměrná hloubavost, tendence k pseudofilozofování), sociálních schopností (stažení se, vztahovačnost) a chování (ztráta spontaneity, nemluvnost). Deficity samotné jsou zjevné a obvykle poměrně snadno zjistitelné při manifestaci onemocnění první psychotickou epizodou (Bilder, et al., 2000). V průběhu první epizody často dochází k jejich dramatickému prohloubení. Deficity kognitivních funkcí jsou stejné co do závažnosti i profilu jako u pacientů s chronickým průběhem onemocnění, tj. obraz kognitivních deficitů bude totožný u pacienta s akutním začátkem onemocnění a jeho průběhem v atakách jako u pacienta s chronickým začátkem a kontinuálním průběhem. Stran výsledného stavu rozsahu a hloubky kognitivních deficitů jsou nejrizikovější skupinou pacienti s chronickým začátkem onemocnění a kontinuálním průběhem (24 %). Naopak příznivá prognóza je u 25 % pacientů spojena s akutním začátkem onemocnění, průběhem v krátkých atakách (nejlépe pokud anamnesticky známe možné spouštěcí faktory, jako jsou emoční krize, ztráta blízké osoby, izolace, nemoc, trauma, užívání drog) a vyšším věkem (Ciompi, 1980). Průběhy onemocnění uvádíme v grafu (Graf 2).
Graf 2 – Typické příklady vývoje schizofrenie (Shepherd, 1989)
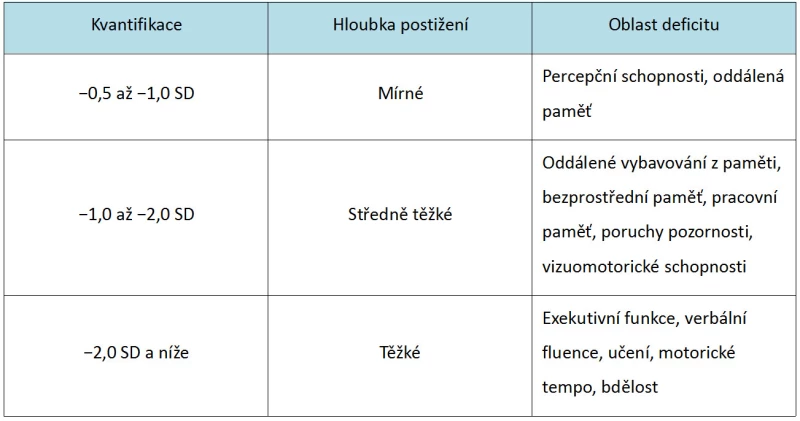
Kognitivní deficit můžeme vyjádřit kvalitativně (dle specifických fenoménů vyskytujících se v rámci použitého testu, např. formální a obsahová chudost kresby) i kvantitativně, kde jsou výsledky srovnávány se statistickou normou. Mírnému poškození odpovídají výkony do −0,5 směrodatné odchylky (SD) včetně, středně těžkému poškození odpovídá rozmezí menší než −0,5 až −1,5 SD a těžkému poškození více než −1,5 SD (Harvey a Keefe, 2009). Individuální hodnoty variují dle specifických testů. Pacienti se schizofrenií vykazují ve vybraných neurokognitivních testech pokles o 1,5 až 2 standardní odchylky proti zdravým kontrolám (Keefe, 2008). Využít lze taktéž Harveyho (1997) kvantifikaci deficitů, která využívá odlišných hranic pro dělení závažnosti deficitů (Tab. 1).
Tab. 1 – Přehled kvantifikace, hloubky postižení a oblastí deficitů u pacientů se schizofrenií (Harvey, 1997, upraveno)
Závažnost tohoto narušení je vyšší v doménách paměti, pozornosti, pracovní paměti, řešení problémů, rychlosti zpracování a sociální kognice (Nuechterlein, et al., 2004). Bohužel, i když v diagnostických manuálech DSM-V a MKN-10 jsou uvedeny odkazy na kognitivní narušení, žádné z diagnostických kritérií ani subtypů schizofrenie nezahrnuje požadavek zjištění kognitivní dysfunkce. Tyto kognitivní deficity jsou u pacientů se schizofrenií přítomny už před zahájením antipsychotické léčby (Saykin, 1994) a u pacientů, kteří jsou schopni kognitivní testy dokončit, nejsou zkresleny psychotickými příznaky (Keefe, et al., 2006). Závažnost kognitivních deficitů se dále projevuje v oblastech a aktivitách běžného denního života pacientů, ve schopnostech dostát svým sociálním rolím a schopnostech žít plnohodnotný osobní, pracovní a sociální život. V případě, že je u pacienta přítomen globální kognitivní deficit (či kombinace mnestických poruch a jiné poruchy symbolických funkcí) přetrvávající či progredující po dobu šesti měsíců a zároveň jsou přítomny změny v oblasti behaviorální a funkční, pak bývají naplněna také kritéria typická pro kortikální demenci. Na rozdíl od pacientů s Alzheimerovou nemocí podávají pacienti se schizofrenií výrazně lepší výkon v oddáleném vybavování informací (Davidson, et al., 1996).
Klinický význam rozpoznání kognitivního narušení
I když zjištění „kognitivního narušení“ není dost specifické kritérium pro diagnózu schizofrenie oproti jiným psychotickým poruchám, může poskytnout užitečnou informaci, která pak umožňuje kvalitnější léčbu pacienta (Kendell a Jablensky, 2003), například při využití integrovaného psychoterapeutického programu (IPT, Roder, et al., 2006). V posledních letech lze sledovat vyšší příklon ke sledování úrovně kognitivních a exekutivních funkcí v rámci základního managementu péče o pacienty se schizofrenií. Někteří autoři stále navrhují, aby se narušení kognitivních funkcí objevilo přímo v diagnostických kritériích pro schizofrenii, protože to by náležitě zvýšilo pozornost kliniků vůči kritériu, které pomáhá lépe zvážit dlouhodobou prognózu (Hyman a Fenton, 2003, Keefe, 2008). Zařazení kognitivního narušení mezi diagnostická kritéria by také mohlo dále zvýšit zájem výzkumu o léčebné postupy, které zlepšují kognitivní fungování (Buchanan, et al., 2005).
Schizofrenie a deficit kognitivních funkcí
Koncepce schizofrenie s kognitivními deficity se opírají o teoretické koncepce jak Andreasenové (1979) a Crowa (2000), tak Strausse a Carpentera (1972) a zahrnuje přítomnost výhradně primárních negativních příznaků, které se vyskytují po dostatečně dlouhou dobu (Höschl, et al., 2002). K negativním symptomům patří nemluvnost (omezené množství spontánní řeči a informací v řeči obsažených, alogická řeč), zúžená afektivita (omezené prožívání a exprese emocí), anhedonie–asocialita (schází prožitek příjemných pocitů, redukován je sociální kontakt a dochází k sociálnímu vyčlenění), apatie (redukce zájmu a energie, zaměření aktivity určitým směrem) a nesoustředěnost (narušující všechny cílené činnosti pacienta, patrná v rozhovoru). Pro zjišťování deficitního syndromu je dlouhodobě používán index PDS (proxy for deficit syndrome), který je součástí krátké psychiatrické hodnoticí škály BPRS (Brief Psychiatric Rating Scale; Overall a Gorham, 1962).
Pozornost
Funkce pozornosti jsou u pacientů se schizofrenií komplexně narušeny po stránce tenacity (vytrvalosti po delší dobu), koncentrace (koncentrace na jeden objekt nebo činnost s potlačením okolních rušivých jevů), rozsahu (kapacity zahrnout více jevů), distribuce (sledování dvou a více jevů současně) i přepojování (přemísťování různými směry). U paranoidních stavů můžou být některé z pozornostních funkcí alterovány, například intenzita pozornosti vztahující se k určitému ději spojenému s paranoidním procesem myšlení, zvýšená ostražitost, detekce určitých konkrétních znaků v okolí (vysoká vnímavost k elektronickým zařízením, neznámým osobám, které jsou nablízku aj.). Při orientačním vyšetření často neshledáme poruchu v rozsahu prosté pozornosti, pacient se schizofrenií detekuje řadu podnětů na způsob kamery (potíže má až při filtraci podnětů, viz exekutivní funkce) a základní rozsah pozornosti nebývá narušen. Potíže nastávají v okamžiku, kdy má s informacemi dále pracovat.
Paměť
V oblasti paměti nacházíme deficity především v oblasti paměti deklarativní (sémantická a epizodická1), zatímco paměť procedurální2 je intaktní. Vzhledem k fungujícímu efektu nápovědy, tj. při poskytnutí vodítek či klíčů, předpokládáme, že paměťový proces je postižen spíše ve fázi vybavování naučeného materiálu než při samotném procesu vštípivosti (Kučerová a Říhová, 2006). Naproti tomu Přikryl (Přikryl, 2010) uvádí, že pokud pacientům poskytneme nápovědu či návod, jak správně využít sémantické strategie při vštěpování informací, zlepší se výkon v příslušném kognitivním úkolu a současně dochází k úpravě deficitu ventrolaterálního prefrontálního kortexu. Mnestické deficity patří k nejnápadnějším v klinickém neuropsychologickém nálezu a přetrvávají i v období remise onemocnění. Častý je deficit verbální pracovní paměti, v menší míře je poškozena vizuálně-prostorová pracovní paměť (Tůma, 2008).
Poruchy sémantické paměti se projevují nejvíce při volném vybavení, lepší je schopnost znovupoznání a při poskytnutí nápovědy. Pacienti mají potíže především s kódováním informací a konsolidací paměťových stop. Poruchy verbální deklarativní paměti souvisí s abnormalitami v oblasti mediálních temporálních laloků. Mírnější forma poškození se projevuje zvýšenou zapomnětlivostí verbálního paměťového materiálu. Závažnější deficity se projevují u jedinců s vysokým rizikem schizofrenního onemocnění i u jejich příbuzných (Cirilo a Seidman, 2003).
V oblasti vizuální paměti se setkáváme s větším rozptylem výkonu. V případě použití neuropsychologických testů vizuální paměti (Reyova–Osterriethova komplexní figura, RCFT, Bentonův vizuálně-retenční test, BVRT) nejsou ojedinělé tzv. autistické reprodukce, což jsou kresby, které se odchylují od zadání testu a nemají vztah k podnětovému obrazci, nesouvisejí spolu, obsahem mohou být i jiné symboly. Celkový výkon se od normy nemusí odchylovat a takový výkon naznačuje neporušenost percepčního a retenčního procesu v dané paměťové modalitě (Obereignerů, 2015).
1Deklarativní paměť neboli paměť explicitní pomáhá uchovávat informace o okolním světě, předmětech a událostech. Je přístupná vědomému vybavení a k vytvoření paměťového záznamu stačí i jednorázová zkušenost. Přístup k deklarativní paměti má více mozkových systémů a je závislá na hipokampu. Informace může nabývat i abstraktní či pojmové podoby. Z ontogenetického hlediska se objevuje až ve druhém roce života. S tím souvisí i možnost výbavnosti nejranější vzpomínky právě mezi 2. a 3. rokem života. Sémantická paměť zachycuje faktické informace a znalosti, slouží jako encyklopedický slovník s výklady. Epizodická paměť, též autobiografická, uchovává příhody, události a děje.
2Procedurální paměť neboli paměť implicitní či motorická uchovává informace o tom, jak provádět činnosti. Uchovává motorické dovednosti, percepční schémata, podmíněné reflexy a zahrnuje také paměť emoční. Není přístupná vědomému vybavení a paměťová stopa se lépe vytváří opakovaným učením. Podrobnější informace o mnestických poruchách z hlediska klinického a neurovědního viz lit. (Hort a Rusina, 2007).
Řeč
Poruchy řeči jsou projevem poruchy myšlení a mohou také souviset s narušením exekutivních procesů a paměti. Přítomny jsou formální poruchy řeči – neologismy, paralogie, poruchy asociací nebo syntaktické poruchy. Narušení fonemické verbální fluence je projevem poruchy exekutivních procesů. Spontánní verbální fluence u řady pacientů narušena není. Řeč hodnotíme jako fluentní tehdy, pokud pacient produkuje 90 a více slov za minutu a zároveň používá více než 5 slov ve větě (Ambler, et al., 2004). U 16 % pacientů je řeč hodnocena jako inkoherentní, resp. alogická (Andreasen, 1979). Další nápadnosti řečového projevu uvádíme v přehledu (Tab. 2). Nemluvnost a bezobsažná řeč jsou řazeny mezi negativní příznaky schizofrenie spolu se zúžením afektu, abulií a anhedonií. Naopak inkoherentní řečový projev doprovázený gramatickou dezorganizací, náhlými změnami tématu a nedostatkem logické návaznosti mezi větami (rozvolnění asociačního procesu) řadíme k příznakům pozitivním (Wing, et al., 1974).
Tab. 2 – Typy řečových nápadností sledovaných u pacientů se schizofrenií (Andreasen, 1979, upraveno)

Exekutivní funkce
Bleulerem pozorované deficity v oblasti pozornosti a zpracování informací byly připisovány snížené schopnosti filtrace irelevantních stimulů. Původní teorie byla později rozšířena a doplněna tak, že pacienti se schizofrenií nejsou schopni vyloučit irelevantní stimuly ze smyslových orgánů, což způsobuje jejich utrpení (McGhie, et al., 1961). Přesycení informacemi ze smyslových orgánů vede k celkové fragmentaci kognitivních procesů a následně pak k poruchám myšlení. Základem pro deficity pozornosti a zpracování informací je porušení funkce okruhů frontálních laloků skládajících se z kortiko-striato-palido-talamických struktur (dorzolaterální prefrontální okruh, laterální orbitofrontální, mediofrontální; Miller a Cummings, 2007). Nezáleží však na tom, ve kterém místě k narušení okruhu dochází. U pacientů pozorujeme stejné deficity (Cummings a Benson, 1992).
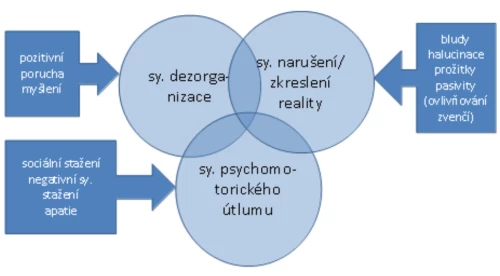
Mahurin a kol. (1998) studovali vztah exekutivních schopností a typů schizofrenie. Vycházeli z Liddlova faktorově analytického zpracování BPRS, rozdělujícího pacienty se schizofrenií na tři skupiny podle převahy symptomů (s převahou psychomotorického útlumu, tj. pacienti stažení – zpomalení, syndrom dezorganizace, tj. s konceptuální dezorganizací, a syndrom zkreslení skutečnosti, tj. pacienti s výrazným narušením reality, Graf 3). Pacienti s převahou psychomotorického útlumu podávali nejslabší výsledky napříč všemi použitými testy exekutivních funkcí. K dalším exekutivním deficitům patří narušení abstrakce a schopnosti řešit problémy (Palmer a Heaton, 2009).
Graf 3 – Psychopatologické syndromy schizofrenie (Liddle, 1987)
Inteligence
Rozsáhlá britská studie (Jones, et al., 1994), provedená na vzorku 5362 dětí narozených v průběhu jediného týdne roku 1946 a mapující jejich další vývoj z hlediska sociodemografických proměnných, vývojových, kognitivních a behaviorálních faktorů, uvádí 30 případů schizofrenie v dospělosti. V anamnéze pacientů jsou uvedeny zpomalení motorického vývoje, řečové vady a sklon k samotářství od nejútlejšího věku až do mladšího školního věku. Ve starším školním věku je již patrný pokles v oblasti výkonu kognitivních funkcí, zjištěna je mírně nižší hodnota celkového IQ v porovnání s vrstevníky a ve škole jsou dosahovány jen průměrné a podprůměrné výkony. V adolescenci jsou již přítomny nápadnosti v sociálním kontaktu, často je přítomna sociální úzkost. Matky uvedených pacientů popisují další nápadnosti v kontaktu se svými dětmi ve smyslu emočního odcizení, rezervovanosti, vyhýbání se hře jak s matkou, tak později vyhýbání se interakcím s druhými dětmi až po výlučné samotářství. Premorbidní intelektový výkon, při sledování komplexními inteligenčními testy, je zachován u čtvrtiny pacientů. V rámci nejčastěji užívaných, Wechslerových komplexních inteligenčních testů (WAIS-III, v zahraničí WAIS-IV, od roku 2018 připravované vydání WAIS-V) s dobově podmíněným výběrem subtestů zaměřeným na schopnosti člověka účelně jednat, racionálně myslet a efektivně zacházet se svým prostředím se setkáváme s následujícími znaky typickými pro onemocnění schizofrenního okruhu:
- velká intersubtestová variabilita,
- chabý úsudek a poruchy porozumění sociální realitě, snížení smyslu pro realitu,
- chabá koncentrace, ale dobrá pasivní receptivní pozornost, malá výběrovost vnímání,
- u floridních procesů se objevují rozmanité deviantní a bizarní verbalizace,
- náhlé změny v úrovni kvality odpovědí.
Nevýhodou komplexních inteligenčních testů je relativně malá diskriminace specifických funkčních deficitů, přičemž jejich nedostatečné odhalení snižuje celkový intelektový výkon.
Intaktní funkce
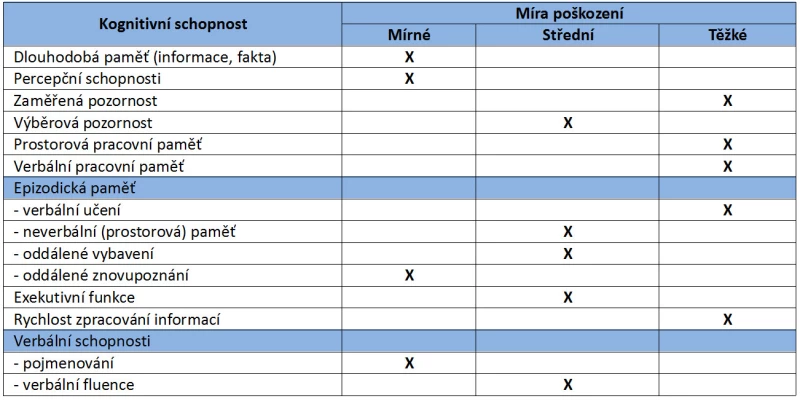
Z kvantitativního hlediska jsou nejčastějšími zachovalými funkcemi všeobecná informovanost a procedurální paměť. Zavádějící může být porucha řeči, kdy se ve skutečnosti jedná primárně o poruchu v oblasti exekutivních funkcí. Vzhledem ke značnému rozsahu kognitivních deficitů uvádíme přehled úrovní poškození jednotlivých schopností (Tab. 3).
Tab. 3 – Úroveň poškození kognitivních schopností u schizofrenie (Grant a Adams, 2009, upraveno)
Diagnostika kognitivních deficitů
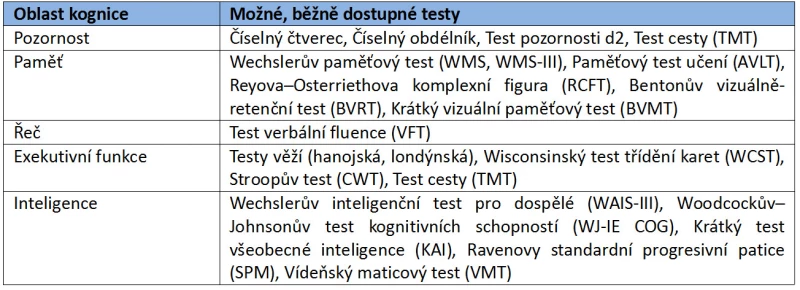
Jak jsme již uvedli, kognitivní deficity jsou spojeny především s přítomností negativních symptomů schizofrenie. Andreasenová a Olsen (1982) předpokládali, že negativní a pozitivní symptomatika představují spektrum s odlišným zastoupením u jednotlivých pacientů, přičemž třetina z nich má symptomy z obou částí spektra. Pro diagnostiku negativních příznaků Andreasenová (1981) publikovala škálu pro hodnocení negativních symptomů (SANS) a krátce nato škálu pro hodnocení pozitivních symptomů (SAPS, 1981). Škála rozšiřovala možnosti již dlouho používané škály BPRS (Overall a Gorham, 1962). Obdobně zaměřená je škála pozitivních a negativních příznaků (PANSS, Kay, et al., 1988). Hodnocení kognitivních deficitů z hlediska neuropsychologického probíhá obvykle u nás běžně dostupnými, standardizovanými, nebo alespoň provizorně normovanými metodami, a to dle příslušných kognitivních oblastí (Tab. 4).
Tab. 4 – Testy kognitivních funkcí
K relativně novějším posuzovacím nástrojům řadíme například Beckovu posuzovací škálu kognitivního náhledu (BCIS; Beck, et al., 2004) Současným trendem je používání specializovaných baterií (diagnostických i terapeutických), doporučovaných na základě konsenzu MATRICS (Measurement and Treatment Research to Improve Cognition in Schizophrenia, Green, et al., 2004), které obsahují 7 kognitivních oblastí (pozornost/vigilance, pracovní paměť, rychlost zpracování informací, verbální učení a paměť, zrakové učení a paměť, logické myšlení a řešení problémů, sociální kognice) specifických pro schizofrenní onemocnění (Nuechterlein, et al., 2010, Green, et al., 2004). Uvedená skupina expertů MATRICS vypracovala diagnostické doporučení týkající se testové baterie MCCB (MATRICS Consensus Cognitive Battery; Neuchterlein, et al., 2008, Kern, et al., 2008; Tab. 5).
Tab. 5 – Přehled metod testové baterie MCCB (Neuchterlein, et al., 2008, Kern, et al., 2008)

Existují i počítačové testové baterie, např. CogState Schizophreina Battery (Pietrzak, et al., 2009), případně specifické testy, např. sociální kognice (Mayer-Salovey-Caruso Emotional Intelligence Test – Managing Emotions, MSCEIT), rychlosti zpracování informací (Brief Assessment of Cognition in Schizophrenia (BACS) aj. S rozšířením Exnerova hodnoticího přístupu v Rorschachově metodě (ROR) se zlepšilo hodnocení a kvantifikace kognitivních poruch u schizofrenie, které jsou zde zachyceny v indexech kognitivní triády (zpracovávání [processing] – zprostředkování [mediation] – představivost, vytváření idejí [ideation]).
Metakognitivní trénink jako možnost kognitivní remediace u pacientů trpících schizofrenií
Kognitivní remediace neboli kognitivní trénink slouží u pacientů se schizofrenií k pozitivnímu ovlivnění činnosti kognitivních funkcí. Není pochopitelně jedinou možností terapie, nicméně některé studie ukazují na jeho dobrou účinnost (Moritz, et al., 2010). V terapii schizofrenie se využívají psychofarmakologické intervence, z psychoterapeutických přístupů pak kognitivně-behaviorální terapie a trénink sociálních dovedností.
Kognitivní dysfunkce u pacientů trpících schizofrenií můžou narušit interpersonální interagování ve smyslu snížené schopnosti empatie a vyjadřování emocí, správného vyhodnocení sociální situace nebo připisování správného významu sociálního kontextu. Pacienti inklinují k unáhleným závěrům a jsou tzv. sociálně neobratní, což snižuje jejich společenskou hodnotu.
Jednou z možností, jak pracovat v terapii na možné kognitivní rehabilitaci, je metakognitivní trénink (Moritz, et al., 2007). Pacient se v rámci tréninku učí přemýšlet o svých myšlenkových procesech, o tom, jak myslí a uvažuje v běžném životě. Trénink sestává z osmi modulů, které se fokusují na specifické kognitivní procesy, negativně ovlivněné psychopatologií schizofrenie. Po každém probraném modulu dostanou pacienti domácí úkol, ve kterém si můžou ověřit, případně dál trénovat naučené dovednosti (Moritz, et al., 2007).
Metakognitivní trénink pochopitelně nenahradí farmakoterapii, výhledově však může přispět ke zlepšení schopnosti nahlížet na vlastní kognitivní procesy a lépe fungovat v rámci sociálních interakcí.
Závěr
Trvalé kognitivní postižení a s ním spojená případná invalidita plynou častěji z přítomnosti negativní symptomatiky a kognitivních deficitů, které mají závažnější a dlouhodobější dopad než zdánlivě dramatický průběh nemoci s bohatou bludnou a halucinatorní produkcí. Jádrovými kognitivními deficity u schizofrenie jsou poruchy pozornosti, pracovní paměti a exekutivních funkcí.
- Ambler Z., Bednařík J., Růžička E. Klinická neurologie. Praha, Triton, 2004; 450.
- American Psychiatric Association (2013). Diagnostic and statistical manual of mental disorders (5th ed.). Arlington: American Psychiatric Publishing.
- Andreasen N. C., Olsen S. A. Negative vs. positive schizophrenia: Definition and validation. Arch Gen Psychiatr, 1982; 39 : 789–794.
- Andreasen N. C. Scale for the Assessment of Negative Symptoms (SANS). University of Iowa, Iowa City, IA, 1981.
- Andreasen N. C. Thought, language and communication disorders: 2 Diagnostic significanace. Archives of General Psychiatry, 1979; 36 : 1325–1330.
- Andreasen N. (2010). The lifetime trajectory of schizophrenia and the concept of neurodevelopment. Dialogues Clinical Neuroscience, 12 (3): 409–15.
- Beck A. T., Baruch E., Balter J. M., et al. A new instrument for measuring insight: the Beck Cognitive Insight Scale, Schizophr Res, 2004; 68 : 319–329.
- Bilder R. M., Goldman R. S., Robinson D., et al. Neuropsychology of first-episode schizophrenia: Initial characterization and clinical correlates. American Journal of Psychiatry, 2000; 157 : 549–559.
- Bratti I., Bilder M. (2006). Neurocognitive deficits and first-episode schizophrenia: Characterization and course. In Sharmac T., Harvey P. (Eds), The early course of schizophrenia (88–110). New York: Oxford University Press.
- Brewer W. J., Francey S. M., Wood S. J., et al. Memory impairments identified in people at ultra-high risk for psychosis who later develop first-episode psychosis. Am J Psychiatry 2005; 162 : 71–78.
- Brewer W. J., Wood S. J., McGorry P. D., et al. Impairment of olfactory identification ability in individuals at ultra-high risk for psychosis who later develop schizophrenia. American Journal of Psychiatry, 2003; 160 : 1790–1794.
- Buchanan R. W., Davis M., Goff D., et al. A Summary of the FDA-NIMH-MATRICS workshop on clinical trial designs for neurocognitive drugs for schizophrenia. Schizophr Bull 2005; 31 : 5–21.
- Cannon T. D., van Erp T. G., Rosso I. M., et al. Fetal hypoxia and structural brain abnormalities in schizophrenic patients, their siblings, and controls. Arch Gen Psychiatry 2002; 59 : 35–41.
- Ciompi L. Catamnestic long-term study on the course of life and aging of schizophrenics. Schizophr Bull, 1980; 6 : 606–618. In Höschl C., Libiger J., Švestka J. Psychiatrie. Praha: Tigis, 2002; 354.
- Cirillo M. A., Seidman L. J. Verbal Declarative Memory Dysfunction in Schizophrenia: From Clinical Assessment to Genetics and Brain Mechanisms.: Neuropsychology Review. 2003; 13 (2): 43–77.
- Crow T. J. The nuclear symptoms of schizophrenia reveal the four quadrant structure of language and its deictic frame. Journal of Neurolinguistics. 2010; 23 : 1–9.
- Crow, T. J. (2000). Schizophrenia as the price that homo sapiens pays for language: a resolution of the central paradox in the origin of the species. Brain Res Rev., 31, 2–3 : 118–29.
- Cummings J. L., Benson F. D. Dementia. A clinical approach (2nd ed.). Boston: Butterworth-Heinemann, 1992.
- Davidson M., Harvey P. D., Welsh K., et al. Cognitive impairment in old-age schizophrenia: A comparative study of schizophrenia and Alzheimer’s disease. American Journal of Psychiatry, 1996; 153 : 1274–1279.
- Davidson M., Keefe R. S. E. Cognitive impairment as a target for pharmacological treatment in schizophrenia. Schizophr Res 1995; 17 : 123–129.
- Davidson M., Reichenberg A., Rabinowitz J., et al. Behavioral and intellectual markers for schizophrenia in apparently healthy male adolescents. Am J Psychiatry 1999; 156 : 1328–1335.
- Frith C. D. Cognitive neuropsychology of schizophrenia. Hove, Lawrence Erlbaum Associates, 1992.
- Fuller R., Nopoulos P., Arndt S., et al. Longitudinal assessment of premorbid cognitive functioning in patients with schizophrenia through examination of standardized scholastic test performance. Am J Psychiatry 2002; 159 : 1183–1189.
- Gold J. M. Cognitive deficits as treatment targets in schizophrenia. Schizophr Res 2004; 72 : 21–28.
- Green M. F., Nuechterlein K. H., Gold J. M., et al. Approaching a consensus cognitive battery for clinical trials in schizophrenia: the NIMH-MATRICS conference to select cognitive domains and test criteria. Biol. Psychiatry, 2004; 56 : 301–307.
- Harvey P. D., Keefe R. S. E. Clinical neuropsychology of schizophrenia. In Grant I, Adams KM. Neuropsychological assessment of neuropsychiatric and neuromedical disorders. Oxford, Oxford university press. 2009; 507–522.
- Harvey P. (1997). Cognitive function in patients with schizophrenia: Report from a roundtable meeting of experts in cognitive dysfunction in schizophrenia. Budapest: Hungary.
- Heinrichs R., Zaksanis K. (1998). Neurocognitive deficit in schizophrenia: A quantitative review of the evidence. Neuropsychology, 12, 426–445.
- Hort J., Rusina R., et al. Paměť a její poruchy. Praha: Maxdorf, 2007.
- Höschl C., Libiger J., Švestka J. Psychiatrie. Praha: Tigis, 2002 : 160.
- Hyman S. E., Fenton W. S. Medicine. What are the right targets for psychopharmacology? Science 2003; 299 : 350–351.
- Jones P., Rodgers B., Murray R., et al. Child development risk factors for adult schizophrenia in the British 1946 birth cohort. Lancet 1994; 344 : 1398–1402.
- Kay S. R., Opler L. A., Lindemayer J. P. Reliability and validity of the positive and negative syndrome scale for schizophrenics. Psychiatr Res, 1988; 23, 99–110.
- Keefe R. S. E., Bilder R. M., Harvey P. D., et al. Baseline neurocognitive deficits in the CATIE schizophrenia trial. Neuropsychopharmacology 2006; 31 : 2033–2046.
- Keefe R. S. E., Perkins D. O., Gu H., et al. A longitudinal study of neurocognitive function in individuals at-risk for psychosis. Schizophr Res 2006; 88 : 26–35.
- Keefe R. S. E., Sweeney J. A., Gu H., et al. Effects of olanzapine, quetiapine, and risperidone on neurocognitive function in early psychosis: a randomized, double-blind 52 week comparison. Am J Psychiatry 2007; 164 : 1061–1071.
- Keefe R. S. E. Should cognitive impairment be included in the diagnostic criteria for schizophrenia? World Psychiatry 2008; 7 : 22–28.
- Keefe R. S. E., Goldberg T. E., Harvey P. D., et al. The brief assessment of cognition in schizophrenia: reliability, sensitivity, and comparison with a standard neurocognitive battery. Schizophr Res 2004; 68 : 283–297.
- Keefe R. S., Eesley Ch., Poe M. (2005). Defining a cognitive function decrement in schizophrenia. Biological Psychiatry, 57 : 688–691.
- Kendell R., Jablensky A. Distinguishing between the validity and utility of psychiatric diagnoses. Am J Psychiatry 2003; 160 : 4–12.
- Kern R., Nuechterlein K., Green M. (2008). The MATRICS Consensus Cognitive Battery, part 2: Co-norming and standardization. American Journal of Psychiatry, 165: 214–220.
- Kučerová H., Říhová Z. Kognitivní deficit u schizofrenie. In Preiss M, et al. Neuropsychologie v psychiatrii. Praha: Grada, 2006; 189–233.
- Liddle P. F. The symptoms of chronic schizophrenia: A re-examination of the positive-negative dichotomy. British Journal of Psychiatry 1987; 151 : 145–151.
- Mahurin R. K., Velligan D. I., Miller A. L. Executive-frontal lobe cognitive dysfunction in schizophrenia: A symptom subtype analysis. Psychiatry Research, 1998; 79 : 139–149.
- McGhie A., Chapman J. Disorders of attention and perception in early schizophrenia. British Journal of Medical Psychology, 1961; 34, 103–116.
- Miller B. L., Cummings J. L. The human frontal lobes. 2ed. New York, Guilford Press, 2007.
- Moritz S., Vitzthum F., Randjbar S., et al. Detecting and defusing cognitive traps: metacognitive intervention in schizophrenia. Curr Opin Psychiatry. 2010 Nov; 23 (6): 561–9.
- Moritz S., Woodward T. S. Metacognitive training in schizophrenia: from basic research to knowledge translation and intervention. Curr Opin Psychiatry. 2007; 20 (6): 619–25.
- Nuechterlein K. H., Barch D. M., Gold J. M., et al. Identification of separable cognitive factors in schizophrenia. Schizophr Res 2004; 72 : 29–39.
- Nuechterlein K. H., Green M. F., Kern R. S. Schizophrenia as a cognitive disorder: Recent approaches to identifying its core cognitive components to aid treatment development. In: Advances in schizophrenia research 2009. Gattaz W. F. (Ed.); Busatto G. (Ed.); New York, NY, US: Springer Science and Business Media, 2010 : 267–282.
- Nuechterlein K., Green M., Kern R. (2008). The MATRICS consensus cognitive battery, part 1: Test selection, reliability, and validity. American Journal of Psychiatry, 165: 203–213.
- Obereignerů, R. Bentonův vizuální retenční test (2. vyd.). Praha: Testcentrum, 2015.
- Overall J. E., Gorham D. R. The brief psychiatric rating scale. Psychological Reports, 1962; 10, 799-812.
- Palmer B. W., Heaton R. K. Execituve dysfunction in schizophrenia. In: Grant I., Adams K. M. (2009) Neuropsychological Assessment of Neuropsychiatric and Neuromedical Disorders. Oxford University Press, New York. 2009 : 511.
- Pietrzak R. H., Olver J., Norman T., et al. A comparison of the CogState Schizophrenia Battery and the Measurement and Treatment Research to Improve Cognition in Schizophrenia (MATRICS) Battery in assessing cognitive impairment in chronic schizophrenia. Journal of Clinical and Experimental Neuropsychology, 2009; 31 (7): 848–859.
- Přikryl R. Narušená epizodická paměť u schizofrenie z pohledu funkčních zobrazovacích metod mozku. Čes a slov Psychiat, 2010; 106 (5): 296–299.
- Reichenberg A., Weiser M., Rapp M. A., et al. Elaboration on premorbid intellectual performance in schizophrenia: premorbid intellectual decline and risk for schizophrenia. Arch Gen Psychiatry 2005; 62 : 1297–304.
- Roder V., Muelle D. R., Mueser K. T., Brenner H. D. Integrated Psychological Therapy (IPT) for Schizophrenia: Is It Effective? Schizophrenia bulletin. 2006; 32 (S1): 81–93.
- Saykin A. J., Shtasel D. L., Gur R. E., et al. Neuropsychological deficits in neuroleptic naive patients with first-episode schizophrenia. Arch Gen Psychiatry 1994; 51 : 124–31.
- Shepherd M., Watt D., Falloon I., et al. The natural history of schizophrenia: a five-year follow-up study of outcome prediction in a representative sample of schizophrenics. Psychol Med Monogr, 1989; 15 (Suppl.): 1–46.
- Smolík P. Duševní a behaviorální poruchy. Praha: Maxdorf, 1996; 152.
- Strauss J. S., Carpenter W. T. (1972). The Prediction of Outcome in Schizophrenia, I. Characteristics of Outcome. Arch Gen Psychiatry. 27, 6 : 739–746.
- Tůma I. Kognitivní deficit a psychopatologie schizofrenie. Psychiatrie, 2008; 12 (2): 101–106.
- Wing J. K., Cooper J. E., Sartorius N. Description and classification of psychiatric symptoms. London, Cambridge University Press, 1974.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



