-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výběr a sekvence terapie u relabující CLL
Následující příspěvek se zabývá sekvencí léčby u relabující/refrakterní CLL (R/R CLL), a to při intoleranci podávané léčby nebo rezistenci na ni. Z dlouhodobých výsledků studie MURANO vyplývá, že u pacientů předléčených imunochemoterapií vedla kombinace venetoklax + rituximab k mediánu PFS 53,6 měsíce a 5letému OS 82,1 %. Intolerance vůči inhibitoru Brutonových kináz (BTKi) nevylučuje použití jiné látky z této skupiny, naopak rezistence vůči BTKi vyžaduje změnu léčby, nejlépe na venetoklax. Venetoklax je účinnější u pacientů, kteří dosud neužívali BTKi, a také u těch, u nichž byla léčba BTKi ukončena pro intoleranci, nikoliv pro rezistenci. Po selhání léčby CLL venetoklaxem dosahují BTKi lepší účinnosti, pokud pacient dříve BTKi neužíval. Riziko vzniku mutací, které mají na svědomí rezistenci na léčbu, je potom výrazně nižší při časově omezené léčbě.
Před výběrem terapie relabující/refrakterní chronické lymfocytární leukémie (R/R CLL) je třeba zohlednit přítomnost genetických mutací, podávanou terapii 1. linie a odpověď na ni, výkonnostní stav pacienta, jeho přidružená onemocnění a průvodní medikaci. Česká doporučení z roku 2021 uvádějí jako hlavní léčebné možnosti (dle abecedy) akalabrutinib, ibrutinib, idelalisib + rituximab, venetoklax + rituximab, samotný venetoklax a u pacientů bez závažných komorbidit je možné zvážit také alogenní transplantaci.
Pacienti předléčení imunochemoterapií
U pacientů po předchozí imunoterapii bylo doloženo prodloužení doby přežití bez progrese (PFS) při léčbě ibrutinibem v porovnání s ofatumumabem ve studii RESONATE,1 při léčbě akalabrutinibem v porovnání s idelalisibem + rituximabem ve studii ASCEND2 a při léčbě venetoklaxem + rituximabem v porovnání s bendamustinem + rituximabem ve studii MURANO.3
Studie MURANO přinesla již dlouhodobá data z 5letého sledování, tj. po dobu 3 let po ukončení terapie. Kombinace venetoklax + rituximab vedla k mediánu PFS 53,6 měsíce v porovnání se 17,0 měsíci v rameni s bendamustinem + rituximabem. 5leté celkové přežití (OS) dosáhlo 82,1 % v rameni s venetoklaxem v porovnání s 62,2 % v rameni s bendamustinem. Tento přínos byl patrný i u rizikových genetických podskupin (obr. 1).3
Obr. 1 Dlouhodobé přežití pacientů s R/R CLL předléčených imunochemoterapií při léčbě venetoklax + rituximab nebo bendamustin + rituximab (dlouhodobé výsledky studie MURANO)3
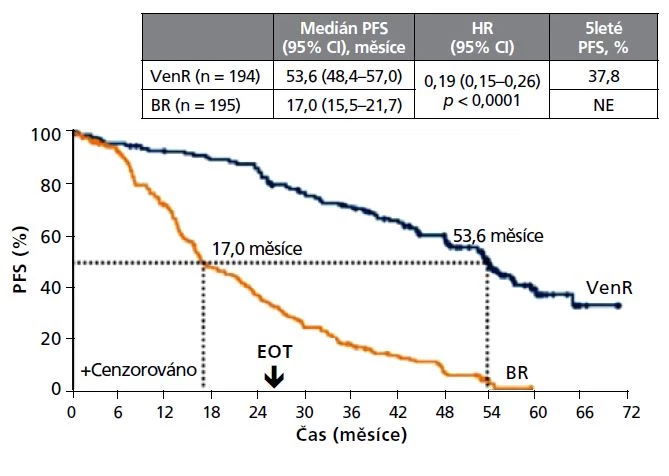
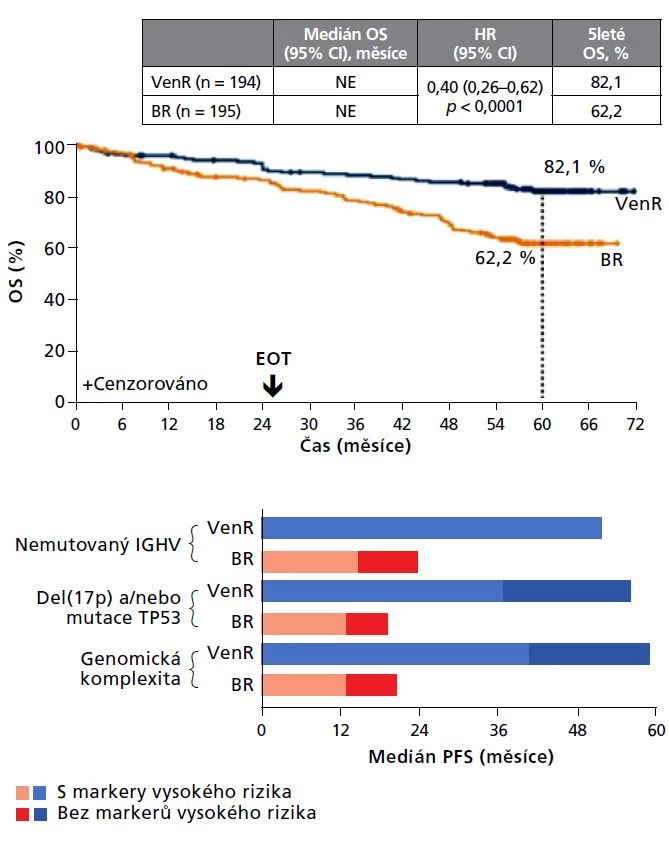
Pozn.: BR – bendamustin + rituximab; EOT – konec terapie; HR – poměr rizik; NE – nedosaženo; OS – celkové přežití; PFS – přežití bez progrese; VenR – venetoklax + rituximab.
Pacienti po předchozí léčbě inhibitory BTK
Účinnost inhibitorů Brutonových kináz (BTKi) omezuje intolerance a rezistence. Pravděpodobnost přerušení léčby ibrutinibem ve 4 prospektivních studiích činila během 5 let 41 % u nepředléčených pacientů a 54 % u nemocných s R/R CLL. Získaná rezistence na ibrutinib bývá důvodem progrese CLL. Nejčastějším důvodem progresivní CLL při terapii kovalentními BTKi, respektive po ní je mutace BTK C481, která byla zjištěna v 56 % případů.4–7
U pacientů s R/R CLL po vysazení BTKi (91 % ibrutinib, 9 % idelalisib) ukazují retrospektivní data z reálné praxe významně delší PFS při následném podávání venetoklaxu nebo jiného BTKi než při podávání chemoimunoterapie (obr. 2), přičemž s venetoklaxem bylo dosaženo nejvyššího podílu kompletních remisí (32 %).8
Obr. 2 Přežití bez progrese pacientů s R/R CLL po vysazení BTKi při léčbě venetoklaxem, jiným BTKi nebo chemoimunoterapií18

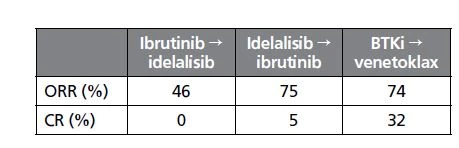
Pozn.: BTKi – inhibitor Brutonových kináz; CR – kompletní remise; mPFS – medián přežití bez progrese; NR – nedosaženo; ORR – míra odpovědi na léčbu; PFS – přežití bez progrese.
Retrospektivní observační studie hodnotila vliv předléčení BTKi na terapii venetoklaxem. Výsledky ukázaly, že předchozí expozice BTKi nemá zásadní dopad na míru odpovědi na léčbu (ORR) venetoklaxem. ORR a podíl kompletních remisí (CR) byly srovnatelné u nepředléčených, předléčených, a dokonce i předléčených ≥ 2 liniemi, nicméně u pacientů nepředléčených ibrutinibem bylo dosaženo delšího PFS než u těch, kteří dříve ibrutinib užívali (poměr rizik [HR] 3,7; p < 0,001).9, 10 Post hoc analýza studie M14-032 zahrnující pacienty předléčené BTKi ukázala vyšší ORR (75 vs. 43 %) a delší PFS (medián nedosažen vs. 16,4 měsíce) u pacientů, kteří měli pouze 1 předchozí linii BTKi oproti pacientům s > 1 linií BTKi.11
Venetoklax má ovšem přínos i u pacientů refrakterních na ibrutinib. Ve studii s nemocnými s R/R CLL po mediánu předchozích linií 4 dosáhl při léčbě venetoklaxem medián PFS 24,7 měsíce, ORR 70 % a podíl pacientů s uMRN 42 %. PFS bylo delší u nemocných s uMRN.12, 13
Za rezistenci CLL na BTKi jsou zodpovědné mutace BTK. Nejznámější je mutace C481S, která snižuje vazebnou afinitu BTKi. V takových případech je možné použít BTKi s nekovalentní vazbou, jako jsou pirtobrutinib, nemtabrutinib, vekabrutinib či fenebrutinib.14 Dokonce byl vytvořen prediktivní model vzniku rezistence na ibrutinib. Zahrnuje 4 rizikové faktory: mutaci TP53, R/R onemocnění, zvýšení hladiny β2-mikroglobulinu a zvýšení hladiny laktátdehydrogenázy (LDH). Pokud je přítomen ≤ 1 z těchto rizikových faktorů, mají pacienti delší OS a menší pravděpodobnost vzniku rezistentní mutace.15
Pacienti po předchozí léčbě venetoklaxem
U pacientů s CLL po selhání léčby venetoklaxem vykazují účinnost BTKi. V retrospektivní multicentrické analýze s pacienty po léčbě venetoklaxem bylo s BTKi dosaženo ORR 84 %, pokud nebyli dříve léčeni BTKi, a ORR 54 %, pokud již BTKi předtím dostávali. Vliv předléčenosti BTKi se při nasazení BTKi po venetoklaxu projevil i z hlediska PFS, které činilo 32 měsíců u pacientů bez předchozí léčby BTKi, zatímco u těch, kteří již BTKi dříve užívali, bylo PFS ovlivněno důvodem vysazení předchozího BTKi. Delší PFS bylo pozorováno u pacientů s intolerancí předchozího BTKi oproti jedincům s rezistencí na tuto léčbu.16
Také studie MURANO prokázala účinnost BTKi po selhání venetoklaxu. V rameni s VenR dostávalo následnou léčbu BTKi 26,9 % pacientů s progresí onemocnění a v rameni s bendamustinem + rituximabem 58,5 % s progresí. Při této následné terapii BTKi bylo v rameni původně randomizované k venetoklaxu dosaženo 100% ORR. V rameni s původní randomizací k bendamustinu + rituximabu činila ORR 83,9 %.17
Tato práce také ukázala, že opakovaná léčba CLL venetoklaxem je možná. Z pacientů s progresí onemocnění dostávalo následnou léčbu s venetoklaxem 47,8 % v rameni s VenR a 12,2 % v rameni s bendamustinem + rituximabem. ORR činila při následné léčbě venetoklaxem 72,2 % v rameni s předchozí léčbou venetoklaxem a 80 % v rameni s předchozí léčbou bendamustinem.13
Pacienti po selhání inhibitorů BTK i BCL2
Problematickou skupinu tvoří nemocní s CLL po selhání inhibitorů BTK i BCL2. Jakákoliv další léčba u nich byla spojená s PFS 9,2 měsíce, OS 25,5 měsíce a ORR 34 %. Delší OS bylo pozorováno u pacientů, kteří dostávali BTKi a BCL2i v časnějších liniích, tj. neužívali dříve více než 1 linii chemoimunoterapie.18
Vznik rezistentních mutací při kontinuální léčbě
Kontinuální podávaní BTKi je spojené s rizikem vzniku mutací BTK a PLCG2, které mohou být zdrojem rezistence. Mutace se zpravidla vyskytují mezi 2. a 3. rokem léčby (medián 30 měsíců). Podobné je to u venetoklaxu, na nějž může vzniknout rezistence v důsledku mutací BCL2 (G101V, D103Y aj.). Objevuje se při kontinuální monoterapii (medián 33 měsíců), ovšem časově omezená léčba je spojená s nízkým rizikem vzniku rezistence.19–22
Vznik rizikových mutací při terapii venetoklaxem byl hodnocen ve studii CLL14, ve které pacienti dostávali VenG nebo G-CLB. Více mutací bylo zjištěno ve větvi s chemoimunoterapií. U žádného pacienta s VenG přitom nedošlo ke vzniku mutace BCL2.23 Studie CLL13 ukázala menší genomickou komplexitu po terapii venetoklaxem než po chemoimunoterapii.24 Časově omezená terapie venetoklaxem tedy znamená menší selektivní tlak a možnost indukce rezistence.
Závěr
U pacientů s R/R CLL intolerance BTKi nevylučuje použití jiného léku z téže skupiny (jiný cBTKi), naopak resistence na BTKi vyžaduje změnu léčby, nejlépe za venetoklax. Venetoklax je účinnější u pacientů, kteří dosud neužívali BTKi, v porovnání s předléčenými BTKi a také u pacientů, u nichž byla léčba BTKi ukončena pro intoleranci spíše než pro rezistenci. Po selhání léčby CLL venetoklaxem dosahují BTKi lepší účinnosti, pokud pacient dříve BTKi neužíval.
Časnější použití BTKi/BCL2i v rámci linií léčby je spojeno s lepší terapeutickou odpovědí a delším PFS. Pacienti s rezistencí na BTKi vyžadují dlouhodobější strategii se zvážením použití nových léků (nekovalentní BTKi, buněčná terapie aj.). Důvodem rezistence mohou být získané mutace, které se objevují měsíce před klinickou progresí. Proto je výhodou časově omezená léčba, která riziko vzniku těchto mutací snižuje.
doc. MUDr. Daniel Lysák, Ph.D.
Hematologicko-onkologické oddělení FN PlzeňLiteratura:
1. Munir T, Brown JR, O'Brien S et al. Final analysis from RESONATE: Up to six years of follow-up on ibrutinib in patients with previously treated chronic lymphocytic leukemia or small lymphocytic lymphoma. Am J Hematol 2019; 94 (12): 1353–1363.
2. Jurczak W, Pluta A. Wach M et al. Acalabrutinib versus rituximab plus idelalisib or bendamustine in relapsed/refractory chronic lymphocytic leukemia: ASCEND results at 4 years of follow-up. J Clin Oncol 2022 Jun 1; 40 (16_suppl.): 7538.
3. Seymour JF, Kipps TJ, Eichhorst BF et al. Enduring undetectable MRD and updated outcomes in relapsed/refractory CLL after fixed-duration venetoclax-rituximab. Blood 2022 Aug 25; 140 (8): 839–850.
4. Woyach JA, Ruppert AS, Guinn D et al. BTKC481S-mediated resistance to ibrutinib in chronic lymphocytic leukemia. J Clin Oncol 2017; 35 (13): 1437–1443.
5. Lampson BL, Brown JR. Are BTK and PLCG2 mutations necessary and sufficient for ibrutinib resistance in chronic lymphocytic leukemia? Expert Rev Hematol 2018; 11 (3): 185–194.
6. Mato AR, Flinn IW, Pagel JM et al. Results from a first-in-human, proof-of-concept phase 1 trial in pretreated B-cell malignancies for Loxo-305, a next-generation, highly selective, non-covalent BTK inhibitor. Blood 2019; 134 (Suppl_1): 501.
7. Burger JA, Barr PM, Robak T et al. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia 2020; 34 (3): 787–798.
8. Mato AR, Hill BT, Lamanna N et al. Optimal sequencing of ibrutinib, idelalisib, and venetoclax in chronic lymphocytic leukemia: results from a multicenter study of 683 patients. Ann Oncol 2017; 28 (5): 1050–1056.
9. Nabhan C,Klink A, Samp J et al. Management and outcomes of 222 CLL patients (pts) treated with venetoclax (VEN) in the real world. J Clin Oncol 2018; 36 (15_suppl.): 7529.
10. Mato AR, Tam CS, Alan JN et al. Disease and patient characteristics, patterns of care, toxicities, and outcomes of chronic lymphocytic leukemia (CLL) Patients treated with venetoclax: a multicenter study of 204 patients. ASH 2017, abstract 4315.
11. Wierda WG, Byrd JC, Davids MS et al. Venetoclax for chronic lymphocytic leukaemia patients who progress after more than one B-cell receptor pathway inhibitor. Br J Haematol 2019; 185 (5): 961–966.
12. Jones JA, Mato AR, Wierda WG et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial. Lancet Oncol 2018; 19 (1): 65–75.
13. Kater AP et al. Five-year analysis of MURANO study demonstrates enduring undetectable minimal residual disease (uMRD) in a subset of relapsed/refractory chronic lymphocytic leukemia (R/R CLL) patients (pts) following fixed-duration venetoclax-rituximab (VenR) therapy (Tx). ASH 2020, abstract 125, session 642.
14. Wang E, Mi X, Thompson MC et al. Mechanisms of resistance to noncovalent Bruton’s tyrosine kinase inhibitors. N Engl J Med 2022 Feb 24; 386 (8): 735–743.
15. Ahn IE, Tian X, Ipe D et al. Prediction of outcome in patients with chronic lymphocytic leukemia treated with ibrutinib: development and validation of a four-factor prognostic model. J Clin Oncol 2021; 39 (6): 576–585.
16. Mato AR, Roeker LE, Jacobs R et al. Assessment of the efficacy of therapies following venetoclax discontinuation in CLL reveals BTK inhibition as an effective strategy. Clin Cancer Res 2020; 26 (14): 3589–3596.
17. Harrup RA, Owen C, D'Rozario J et al. Efficacy of subsequent novel targeted therapies, including repeated venetoclax-rituximab (VenR), in patients (pts) with relapsed/refractory chronic lymphocytic leukemia (R/R CLL) previously treated with fixed-duration VenR in the MURANO study. ASH 2020, abstract 3139, session 642.
18. Eyre TA, Hess LM, Sugihara T et al. Clinical outcomes among patients with chronic lymphocytic leukemia (CLL)/small lymphocytic lymphoma (SLL) who received treatment with a covalent BTK and BCL2 inhibitor in the United States: a real-world database study. Leuk Lymphoma 2023 May; 64 (5): 1005–1016.
19. Ahn IE, Underbayev C, Albitar A et al. Clonal evolution leading to ibrutinib resistance in chronic lymphocytic leukemia. Blood 2017; 129 (11): 1469–1479.
20. Woyach JA. Treatment-naive CLL: lessons from phase 2 and phase 3 clinical trials. Blood 2019; 134 (21): 1796–1801.
21. Blombery P, Anderson MA, Gong JN et al. Acquisition of the recurrent Gly101Val mutation in BCL2 confers resistance to venetoclax in patients with progressive chronic lymphocytic leukemia. Cancer Discov 2019; 9 (3): 342–353.
22. Tausch E, Close W, Dolnik A et al. Venetoclax resistance and acquired BCL2 mutations in chronic lymphocytic leukemia. Haematologica 2019; 104 (9): e434–e437.
23. Tausch E, Schneider C,Yosifov D et al. Genetic markers and outcome in front line obinutuzumab plus chlorambucil or venetoclax – updated analysis of the CLL14 trial. EHA 2021, abstract S144.
24. Fürstenau M, Thus YJ, Robrecht S et al. High karyotypic complexity is an independent prognostic factor in patients with CLL treated with venetoclax combinations. Blood 2023 May 12; blood.2023019634.Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




