-
Medical journals
- Career
Markery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
Authors: J. Procházková 1; R. Pilka 2; A. Měchurová 3; O. Šimetka 4; P. Brychtová 5; M. Procházka 2
Authors‘ workplace: Hemato-onkologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. K. Indrák, DrSc. 1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D. 2; Ústav pro péči o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 3; Porodnicko-gynekologická klinika FN, Ostrava, přednosta MUDr. O. Šimetka 4; Baťova nemocnice, Zlín, primář MUDr. Z. Adamík, Ph. D. 5
Published in: Ceska Gynekol 2009; 74(4): 279-281
Category: Original Article
Overview
Cíl práce:
Shrnutí současných znalostí o vybraných markerech aktivace endotelu v patogenezi některých chorob včetně patologických stavů v graviditě.Typ studie:
Přehledový článek.Metodika:
Zpracování literárních údajů.Závěr:
Endotel je extrémně metabolicky aktivní orgán tvořící bariéru mezi krví a tkáněmi. Při jeho aktivaci se uvolňuje řada produktů, kterými endotelové buňky řídí vazomotoriku, koagulaci, reologické vlastnosti krve a zánětlivou reakci. Při preeklampsii dochází k insuficientní trofoblastické invazi mateřských spirálních arterií, což může vést k sekreci faktorů do mateřské cirkulace, které způsobují alteraci endotelu. Uvádíme přehled vyšetřovaných markerů aktivace endotelu, jejich klinický význam a možnosti laboratorního stanovení.Klíčová slova:
endotel, těhotenství, preeklampsie.ÚVOD
Endotelové buňky tvoří spolu s buňkami hladkého svalstva a fibroblasty cévní stěnu. Jsou umístěny v jedné vrstvě na luminálním povrchu cév. Netvoří jen pasivní výstelku cévního lumen, ale naopak jsou extrémně metabolicky aktivním orgánem tvořícím bariéru mezi krví a tkáněmi. Lze je považovat jak za senzorické struktury přijímající hemodynamické a humorální signály, tak za efektorové buňky, produkující celou řadu působků s vlivem jak na sousední vrstvu svalových buněk, tak cestou cirkulace na celý organismus. V organismu dospělého člověka se nachází 6 trilionů endotelových buněk, tyto tvoří orgán vážící 1 kg a zaujímající plochu 5000 m2 [2].
Jako první objevil díky užití primitivního mikroskopu existenci bariéry mezi krví a tkáněmi Malpighi, který rovněž popsal kapilární spojení mezi drobnými arteriemi a žílami [2].
Endotelové buňky nejsou uniformní hmotou, ale vykazují výraznou orgánovou specifitu. Fenotyp endotelií se liší v závislosti na umístění v jednotlivých orgánech, a dokonce i v různých segmentech cév jednoho orgánu [3]. Regulace fenotypu dokonce umožňuje odlišné složení endoteliálních struktur v jednom místě v různých časových úsecích [3].
Intaktní endotel má za fyziologických podmínek silný inhibiční vliv na koagulaci prostřednictvím faktorů, které syntetizuje a uvolňuje či exprimuje na svém povrchu. Dva z těchto faktorů – prostaglandin I2 (PGI2 či prostacyklin) a oxid dusnatý (NO či endothelium derived relaxing factor – EDRF) – mají silnou vazodilatační aktivitu [5]. Působí na buňky hladké svaloviny v cévní stěně a ovlivňují tak krevní průtok. Obě substance též inhibují agregaci destiček a adhezi leukocytů.
Endotelové buňky obsahují na svém povrchu celou řadu receptorů, kterými přijímají jak hemodynamické signály (intenzitu pulsace, proudění a roztažení cévní stěny), tak humorální působky (receptory cytokinů, růstových faktorů, bakteriálních substancí, angiotenzinu II, koagulačních faktorů II, V, IX, X apod.) [3]. Na základě těchto podnětů dojde k aktivaci endotelu, což vede k uvolňování celé řady produktů, kterými endotelové buňky řídí vazomotoriku (cévní tonus, krevní tlak, perfuzi orgánů), koagulaci (adhezi a agregaci trombocytů, aktivaci koagulační kaskády a fibrinolýzy), udržování reologických vlastností krve a v neposlední řadě zánětlivou reakci (migraci a chemotaxi leukocytů, monocytů a makrofágů, fagocytózu, cévní permeabilitu) [1, 3]. Všechny tyto děje potom hrají klíčovou roli v regulaci buněčného metabolismu. Produkty endotelových buněk ukazuje tabulka 1.
Table 1. Produkty endotelových buněk 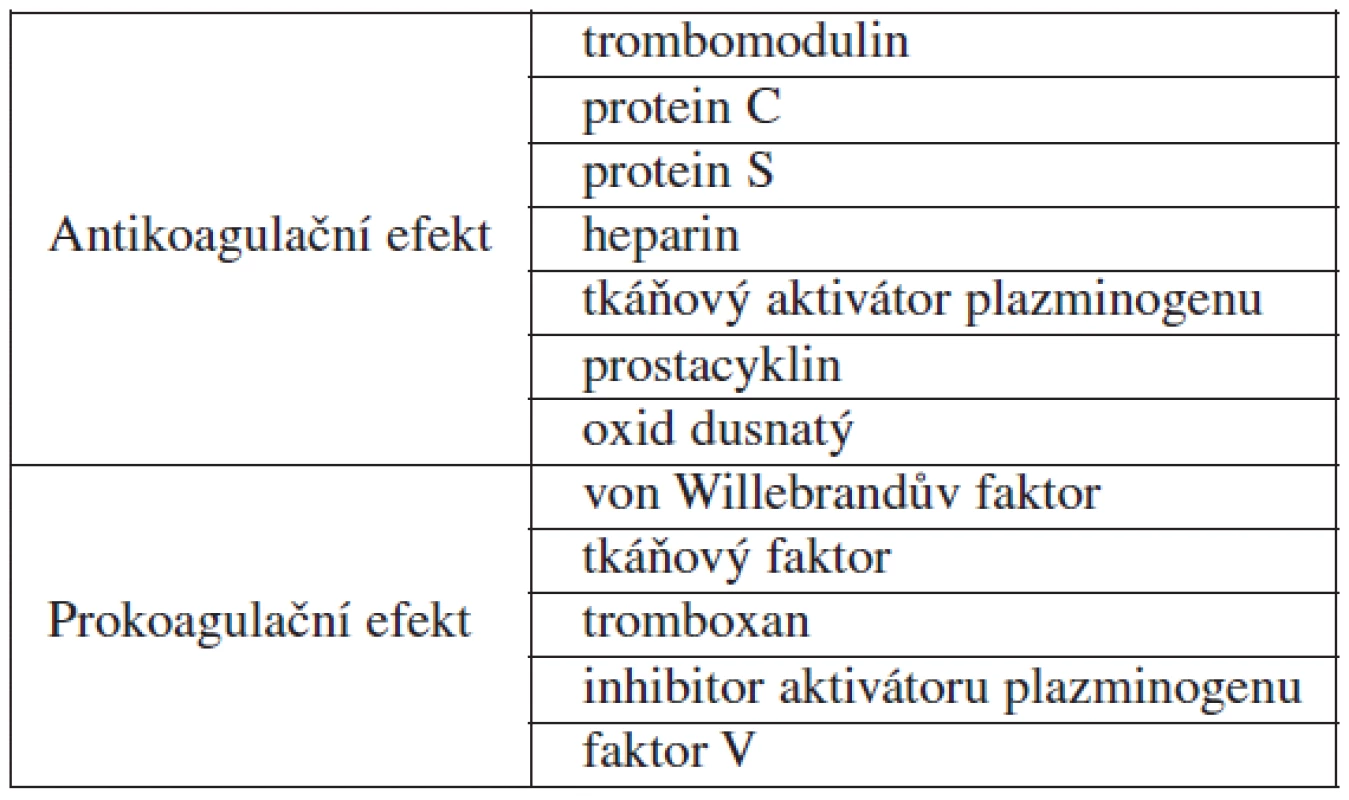
V poslední době dochází k prudkému rozvoji poznatků o funkci produktů aktivace endotelových buněk a snaze vyvinout laboratorní metody k jejich detekci. V minulosti již byl prokázán význam markerů aktivace endotelu při jeho poškození následkem aterosklerózy (především v akutní fázi ischémie myokardu, dolních končetin a ischemických cévních mozkových příhod umožňuje vyšetření jejich hladiny předpovědět tíží příhody), prediktivní potenciál markerů aktivace endoteliálních buněk ke stanovení rizika vývoje aterosklerózy v budoucnosti je teprve zkoumán. Stejně tak je zájem vědců zaměřen na význam stanovení těchto markerů u dalších patologických stavů spojených s poškozením endotelu, jako je např. vznik maligních nádorů a jejich metastázování a patologické stavy v těhotenství (preeklampsie a diabetes mellitus). Hypertenzní onemocnění v těhotenství a preeklampsie jsou multisystémová onemocnění charakterizovaná hypertenzí, někdy s proteinurií a generalizovanou systémovou vazokonstrikcí. Při preeklampsii dochází k insuficientní trofoblastické invazi mateřských spirálních arterií, což vede k poruchám prokrvení fetoplacentární jednotky. To může vést k sekreci faktorů do mateřské cirkulace, které způsobují aktivaci endotelu a alteraci vaskulární reaktivity. Tyto cirkulující faktory však dosud nebyly identifikovány.
Bylo již potvrzeno, že v klinické fázi onemocnění dochází k signifikantnímu zvýšení některých látek, které signalizují poškození endotelu – endotelin, vitronektin a endoteliální adhezivní molekuly VCAM – 1 (vascular cell adhesive molecules), ICAM – 1 (intercellular adhesive molecules) [7]. V posledních letech se prudce rozvíjejí laboratorní metody stanovující další markery aktivace endotelu, např. t-PA, PAI-1, vWF, EPCR, trombomodulin a endotelové mikropartikule s prokoagulační aktivitou, jejichž význam již byl prokázán např. při alteraci endotelu následkem aterosklerózy, zatím ovšem nebyly podrobně zkoumány ve vztahu k preeklampsii. V následující části je uveden přehled dosud nejznámějších vyšetřovaných markerů aktivace endotelu, jejich klinický význam a možnosti laboratorního stanovení.
MARKERY AKTIVACE ENDOTELU
Tkáňový aktivátor plazminogenu
Tkáňový aktivátor plazminogenu (t-PA) je serinová proteáza s fibrinolytickou aktivitou. Je detekovatelná v celé řadě tělních tekutin (sliny, mléko, žluč, cerebrospinální mok, moč), nejvyšší koncentrace je v orgánech s bohatým cévním zásobením (děloha, ledviny, plíce) [5]. Sekrece t-PA v klidovém stavu je velmi nízká, stejně tak jako jeho hladina v cirkulaci, odkud je rychle degradován, ale syntéza stimulovaná různými podněty je velmi rychlá. Endotelové buňky jsou hlavním místem jeho produkce v organismu, dalším zdrojem jsou aktivované monocyty a megakaryocyty [5]. t-PA je hlavním aktivátorem fibrinolýzy a jediným specifickým aktivátorem plazminogenu. Aktivace plazminogenu prostřednictvím t-PA je potencována fibrinem – pouze v jeho přítomnosti může t‑PA aktivovat plazminogen štěpením na aktivní molekuly plazminu [5]. Plazmin potom odbourává fibrin obsažený v trombech. V plazmě se t-PA nachází v koncentraci 2–8 ng/ml, nicméně 95 % tohoto množství je vázáno v komplexech s PAI-1 a pouze 5 % tvoří volná forma. Zvýšené hodnoty t-PA nacházíme po chirurgických zákrocích, traumatech, při zánětech, postižení cév aterosklerózou, léčbě heparinem, ale i po větší fyzické zátěži, a stresu, takže odběr krve je nutno provádět za klidových podmínek k vyloučení falešně pozitivních výsledků. Další příčinou zvýšené hladiny t-PA je těžší jaterní onemocnění, protože játra jsou hlavním místem odbourávání [4]. Hladina t-PA bývá nejčastěji vyšetřována metodou ELISA.
Inhibitor aktivátoru plazminogenu 1
Inhibitor aktivátoru plazminogenu (PAI-1) je přirozený inhibitor t-PA a urokinázy a je produkován aktivovanými endotelovými buňkami, hepatocyty a megakaryocyty [5]. V plazmě se vyskytuje ve dvou formách – ve funkčně aktivní volné formě, která je stabilizována vazbou na vitronektin a ve funkčně inaktivní formě v komplexu s t-PA či urokinázou – 80 % celkového množství.
PAI-1 je rovněž skladován v alfa-granulích trombocytů [5]. Bazální hladina v plazmě je nízká, vykazuje diurnální cyklus s ranním peakem. PAI-1 je „proteinem akutní fáze“, jeho hladina se tedy zvyšuje při infekcích, malignitách a v pooperačních stavech [4]. Zvýšená hladina PAI-1 je nalézána u pacientů s projevy aterosklerózy, při léčbě heparinem, při zánětech a v těhotenství. Fyziologická koncentrace PAI-1 je za bazálních podmínek 7–23 ng/ml, je stanovována metodou ELISA.
Von Willebrandův faktor
Von Willebrandův faktor (vWf) je produktem převážně endotelových buněk – 85 % celkového množství – a je pak skladován ve Weibelových-Paladeho tělíscích, zbývajících 15 % je tvořeno v megakaryocytech a a skladováno v alfa-granulích trombocytů. Von Willebrandův faktor hraje klíčovou roli v tvorbě primární hemostatické zátky – umožňuje adhezi trombocytů k místu poškození cévní stěny a dále stabilizuje koagulační faktor VIII, který chrání před degradací. Fyziologická hladina antigenu vWf je 61–158 % a zvyšuje se u celé řady stavů spojených s aktivací endotelu – trauma, operace, infekce, malignity. Stanovení antigenu vWf je možné imunoturbidimetricky.
Trombomodulin
Trombomodulin je transmembránový glykoprotein s významným inhibičním účinkem na proces koagulace. Je vázán na cévním endotelu. Jeho funkcí je inhibice trombinu, se kterým vytváří po vazbě inaktivní komplex [4]. Další klíčovou roli v inhibici koagulace hraje aktivací proteinu C, a to prostřednictvím komplexu s aktivovaným koagulačním faktorem II [4]. Aktivace proteinu C komplexem trombomodulin/trombin probíhá 1500–2000krát rychleji než samotným trombinem [5]. Z povrchu endotelových buněk je trombomodulin uvolňován proteolytickým štěpením elastázou neutrofilů při jejich poškození [5]. Laboratorně lze hladinu trombomodulinu stanovit metodou ELISA, fyziologická koncentrace je u mužů 10–52 ng/ml, u žen 10–42 ng/ml.
Endoteliální receptor proteinu C
Endoteliální receptor proteinu C (EPCR) je transmembránový glykoprotein primárně lokalizovaný na endotelu velkých cév. Jeho funkce spočívá v umožnění vazby proteinu C (PC) na endotel a zde jeho interakci s komplexem trombin – trombomodulin, což výrazně urychluje aktivaci PC (až pětinásobně) a současně propůjčuje PC jeho protizánětlivou aktivitu [4]. Antikoagulační působení aktivovaného PC je zprostředkováno inhibicí aktivovaného koagulačního faktoru V a VIII. Laboratorní stanovení solubilní formy EPCR je možné metodou ELISA, fyziologické rozmezí je 65–230 ng/ml.
Endoteliální mikropartikule
Neporušený povrch endotelu hraje klíčovou roli v udržování integrity cévní stěny a hemostázy. Při alteraci endotelu a obnažení subendoteliálních struktur dochází k adhezi leukocytů a trombocytů na postižené místo, k aktivaci koagulačních faktorů a dalšímu poškozování endoteliálních buněk, což má za následek uvolňování jejich fragmentů (mikropartikulí) do cirkulace. Endoteliální mikropartikule (EMP) jsou drobné (≤ 1 μm) vezikuly, jejichž množství a struktura nám umožňuje posoudit míru a povahu endoteliálního poškození. Pro vyšetření EMP je nejvýhodnější průtoková cytometrie s použitím celé řady monoklonálních protilátek, za fyziologických poměrů nalézáme 1177–1765 částic/μl.
Metaloproteinázy a inhibitory metaloproteináz
Metaloproteinazy (MMP) a jejich inhibitory (TIMP) představují skupinu proteolytických enzymů, které štěpí složky extracelulární matrix [6].
Při aktivaci MMP a TIMP jako následku aktivace endoteliálních buněk v důsledku jak fyziologických pochodů (růst a diferenciace tkání a orgánů), tak patologických procesů (zánět, ischémie, nádorová transformace apod.) dochází k modifikaci extracelulární subendoteliální matrix těmito enzymatickými systémy, poté k migraci endoteliálních buněk s následnou neovaskularizací či zánikem cév v dané oblasti.
MMP a TIMP tedy hrají důležitou roli v procesu remodelace cévní stěny, při tvorbě kolaterál v ischemizované tkáni, při procesu metastázování a neovaskularizace nádorů a v neposlední řadě v rámci implantace embrya do děložní sliznice a vývoji utero-placentární jednotky.
Práce je podpořena Grantem Ministerstva zdravotnictví ČR IGA NR 9282-3/2007.
MUDr. Jana Procházková
Hemato-onkologická klinika
FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: prochazkovajana@hotmail.com
Sources
1. Blann, AD. Assessment of endothelial dysfunction: focus on atherothrombotic disease. Pathophysiol Haemostasis Thrombosis, 2005, p. 34.
2. De Caterina, R., Libby P. Endothelial Dysfunctions and Vascular Disease. Blackwell Publishing, 2007, p. 3-25.
3. Hoffbrand, AV., Catovsky, D., Tuddenham, EGD. Postgraduate Hematology. Blackwell Publishing, 2005, p. 787-792.
4. Kvasnička, J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada Publishing, 2003, s. 40-65.
5. Pecka, M. Laboratorní hematologie v přehledu - Fyziologie a patofyziologie hemostázy. 2004, s. 22-24, 87-97, 113-118.
6. Pilka, R., Hrachovec, P. Matrix metaloproteinázy a menstruace. Čes Gynek, 2003, 68, s. 36-40.
7. Šimetka, O., Brychtová, P., Procházková, J., Procházka, M. Laboratorní změny aktivace endotelu u syndromu HELLP. Gynekolog, 2008, 2, s. 48-53.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 4-
All articles in this issue
- Mediolaterální epiziotomie a poranění análního sfinkteru
- Chemoterapie během těhotenství
- Preeklampsie – některé možnosti predikce
- Ischemizující metody léčby děložních myomů
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
- Proteomika a biomarkery karcinomu endometria
- Markery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Prognostické faktory u mezenchymálních a smíšených nádorů děložního těla
-
Operování přirozenými tělními otvory
Hybridní transvaginální cholecystektomie - Placenta adherens partim accreta – ojedinělé možnosti terapie
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Placenta adherens partim accreta – ojedinělé možnosti terapie
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

