-
Medical journals
- Career
Súčasné trendy v diagnostike a liečbe kongenitálneho hyperinzulinizmu
Authors: Juraj Staník 1,2; Martina Škopková 1; Monika Rosoľanková 3; Iwar Klimeš 1; Daniela Gašperíková 1
Authors‘ workplace: DIABGENE & Laboratórium diabetu a porúch metabolizmu, Ústav experimentálnej endokrinológie, Biomedicínske centrum SAV, Bratislava, Slovenská republika 1; I. detská klinika LF UK a DFNsP, Bratislava, Slovenská republika 2; Neonatologická klinika intenzívnej medicíny LF UK a DFNsP Bratislava, Slovenská republika 3
Published in: Vnitř Lék 2016; 62(Suppl 4): 103-112
Category: Reviews
Overview
Kongenitálny hyperinzulinizmus (congenital hyperinsulinism – CHI) je najčastejšou príčinou závažných perzistujúcich hypoglykémií u novorodencov a dojčiat. Z hľadiska prognózy je kľúčová včasná diagnostika, ktorá určí príčinu ochorenia a účinná liečba volená podľa princípov farmakogenetiky. Pri diagnostike typu CHI má dominantné postavenie DNA analýza 11 génov zasahujúcich do sekrécie inzulínu, ktoré spôsobujú izolované formy CHI. Genotyp zároveň určí aj optimálny liečebný postup, ktorý pozostáva z medikamentóznej liečby a diétnych opatrení, menej často z chirurgickej intervencie. Najmä medikamentózna liečba najťažších (na diazoxid rezistentných) foriem CHI zaznamenala v posledných rokoch výrazný posun vpred.
Kľúčové slová:
analógy somatostatínu – diazoxid – DNA analýza – hypoglykémie – kongenitálny hyperinzulinizmusÚvod
V posledných desaťročiach sa čoraz viac klinický výskum v oblasti diabetológie a endokrinológie orientuje na presné určenie typu ochorenia (napr. metódami DNA analýzy) a voľby optimálnej liečby šitej na mieru pacienta (ideálne podľa princípov farmakogenetiky). Kým pri najčastejších ochorenia ako sú napr. diabetes 1. a diabetes 2. typu (DM1T, DM2T) je tento smer len v plienkach, pri monogénových poruchách sekrécie a účinku inzulínu je realitou už niekoľko rokov. Známejšie je uplatnenie DNA analýzy a farmakogenetiky pri monogénovom diabete, ako je MODY alebo neonatálny diabetes [1], ale rovnakú úlohu hrá aj pri monogénovej nadprodukcii inzulínu (kongenitálnom hyperinzulinizme), s ktorou ju spája podobná genetická príčina (viaceré rovnaké gény, avšak odlišné mutácie).
Kongenitálny hyperinzulinizmus (congenital hyperinsulinism – CHI) je označenie pre hypoglykémie s nadprodukciou inzulínu na podklade genetického defektu, ktorý zasahuje do sekrécie inzulínu v B-bunkách pankreasu. Genetický defekt vedie k hyperplázii (a pri niektorých formách aj hypertrofii) B-buniek, ktorá zvyčajne vzniká už prenatálne. Klinicky sa prejavuje závažnými hypoglykémiami (glykémia býva často aj pod 1 mmol/l), ktoré môžu mať trvalé následky v dôsledku poškodenia mozgu [2].
Epidemiológia
Výskyt CHI vzhľadom na veľkú etiologickú a príznakovú šírku nie je presne známy. Výskyt CHI je vo väčšine Európskych krajín približne 1 : 30 000–1 : 50 000 živo narodených detí [3]. V niektorých uzavretých komunitách s vysokou konsangvinitou (určité oblasti v Izraeli a Saudskej Arábii) je jeho výskyt niekoľkonásobne vyšší (až 1 : 2 500) [4,5].
Etiológia
Vo viac ako 50 % prípadov je etiológia kongenitálneho hyperinzulinizmu známa, pričom najčastejšie ide o mutácie v génoch zodpovedných za sekréciu inzulínu (schéma 1) [6]. Jednotlivým typom CHI sa podrobnejšie venujeme v samostatnej časti nižšie.
Schéma 1. Schematické znázornenie miesta účinku produktov poškodených génov v B-bunke. Upravené podľa Senniappan 2012 [7] ![Schéma 1. Schematické znázornenie miesta účinku produktov poškodených génov v B-bunke. Upravené podľa Senniappan 2012 [7]](https://pl-master.mdcdn.cz/media/image/5ed24df5ac41766ed40cdb0e637be93a.jpg?version=1537794215)
Patogenéza
Patogenéza vzniku hypoglykémií je u všetkých foriem kongenitálneho hyperinzulinizmu rovnaká a súvisí s nadprodukciou inzulínu [7]. Pri CHI nefunguje riadenie vylučovania inzulínu, ktoré je nezávislé od hladín glykémie. Napriek hypoglykémii pokračuje nadprodukcia inzulínu. Tento fakt je kľúčovým pri diagnostike CHI. Počas hypoglykémie je najviac ohrozeným orgánom mozog, nakoľko glukóza je jeho primárnym zdrojom energie. Sekundárnym zdrojom sú ketolátky [8], ktoré sa ale pri CHI v dôsledku hyperinzulinémie netvoria vôbec. Mozog tak prichádza o primárny aj sekundárny zdroj energie [9].
Klinický obraz
Hoci väčšina prípadov CHI sa manifestuje hypoglykémiami už v neonatálnom období, niektoré sa môžu manifestovať kedykoľvek v priebehu detstva. Závažnosť hypoglykémií ale spravidla so stúpajúcim vekom manifestácie klesá. Ak je nadprodukcia inzulínu už počas intrauterinného vývoja, býva prítomná makrozómia novorodenca (zvyčajne stupeň makrozómie koreluje so stupňom hyperinzulinizmu). Po narodení v dôsledku liečby glukózou dochádza k ďalšiemu veľmi rýchlemu nárastu hmotnosti. Príznaky pri manifestácii CHI v neonatálnom období sú nešpecifické (slabé satie, letargia alebo iritabilita), dokonca niekedy úplne chýbajú, pri závažnejšej hypoglykémii to môže byť apnoe, kŕče a kóma v dôsledku neuroglykopénie [10]. U niektorých pacientov sa môže objaviť kardiomyopatia a hepatomegália (v dôsledku ukladania glukózy vo forme glykogénu) [11,12]. Pri manifestácii CHI od neonatálneho obdobia do jedného roka sú príznakmi hypoglykémie kŕče a epizódy ospalosti alebo iritability [10]. Po prvom roku života sú to typické príznaky hypoglykémie, spôsobené adrenalínom a aktiváciou sympatika, ako je bledosť, slabosť, tachykardia a potenie [9]. Stupeň poškodenia mozgu závisí od závažnosti a dĺžky trvania hypoglykémie ako aj od vnímavosti mozgového tkaniva (závisí aj od zrelosti plodu), preto je vo všeobecnosti ťažko odhadnuteľný [7].
Diagnostika
Včasná diagnóza je nesmierne dôležitá najmä vzhľadom na riziko poškodenia mozgu hypoglykémiou. Diagnostické a pomocné kritériá, platné pre všetky formy hyperinzulinemických hypoglykémií, vrátane CHI, sú uvedené v tab. 1 [7,13].
Table 1. Diagnostické a podporné kritériá hyperinzulinemických hypoglykémií. Upravené podľa [7] ![Diagnostické a podporné kritériá hyperinzulinemických hypoglykémií. Upravené podľa [7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b52e5d3dd710dea34052024eee1db840.jpg)
Ďalším krokom diagnostického procesu je rýchla identifikácia pacientov, ktorí nereagujú adekvátne na štandardnú liečbu a vyžadujú agresívnejší terapeutický prístup. Na ich identifikáciu sa využíva najmä citlivosť na diazoxid, PET-CT a DNA analýza. Rezistencia na diazoxid (liek voľby v chronickej liečbe CHI) je prvým znakom závažnej formy ochorenia. V publikovaných súboroch 55–60 % z diazoxid rezistentných pacientov má fokálnu formu CHI na podklade ABCC8 alebo KCNJ11 mutácií, zvyšok tvoria pacienti s difúznymi formami. Odlíšenie prináša DNA analýza – akýkoľvek iný nález ako paternálna ABCC8 alebo KCNJ11 mutácia prakticky vylučuje fokálnu formu. V prípade paternálnych mutácií je ale potrebné fokálnu formu verifikovať pomocou PET-CT za použitia 18F-L-DOPA, nakoľko druhá mutácia spôsobujúca vznik difúznej formy môže raritne vzniknúť v germinálnych bunkách [14]. PET-CT je nevyhnutnosťou pred chirurgickým zákrokom, nakoľko určí polohu fokusu [15]. Keďže DNA analýza má vyššiu senzitivitu (100 %) ale nižšiu špecificitu ako PET-CT, stále častejšie sa volí ako prvá metóda [16].
Diferenciálna diagnostika
Nakoľko je diferenciálna diagnostika hypoglykémií v detskom veku veľmi široká, je v prvom rade potrebné potvrdiť, že hypoglykémia vznikla na podklade hyperinzulinizmu (hyperinzulinemická hypoglykémia – HH). Avšak ani pri potvrdení hyperinzulinemickej hypoglykémie nie je kongenitálny hyperinzulinizmus jedinou príčinou. Nadprodukciu inzulínu môžu spôsobovať aj iné príčiny, ktoré primárne nezasahujú do metabolizmu B-buniek pankreasu.
Syndrómové formy hyperinzulinemickej hypoglykémie
Medzi syndrómové formy CHI patria poruchy glykozylácie a niektoré iné syndrómy [17]. Pri syndrómových formách je hypoglykémia len jedným z príznakov (na rozdiel od CHI, u ktorého je zvyčajne jediným príznakom). Medzi dedičné metabolické poruchy asociované s hyperinzulinemickými hypoglykémiami patria kongenitálne poruchy glykozylácie (congenital disorder glycosylation – CDG) a tyrozinémia. CDG sú multisystémové ochorenia, vznikajúce na podklade poruchy syntézy glykánov alebo ich väzby na iné makromolekuly (glykoproteíny, glykolipidy). V súčasnosti poznáme viacero typov porúch glykozylácie, pričom najčastejšou formou je CDG la [18]. CDG Ia má veľmi široké spektrum klinických prejavov, pričom medzi menej časté patrí aj hyperinzulinemická hypoglykémia [18] s miernym klinickým priebehom. Hyperinzulinemické hypoglykémie sú hlavným príznakom pri CDG Ib, spolu s enteropatiou, kongenitálnou fibrózou pečene a koagulopatiou [19]. Včasná diagnostika CDG Ib je veľmi dôležitá, nakoľko existuje účinná liečba manózou. V prípade pretrvávania hypoglykémií je úspešná liečba diazoxidom. Hyperinzulinemické hypoglykémie boli opísané aj pri CDG 1d [20]. Tyrozinémia I. typu sa okrem závažného poškodenia pečene a obličiek u niektorých pacientov spája aj s CHI [21]. Diétne opatrenia nebývajú úspešné, využíva sa preto citlivosť na diazoxid. V opísaných prípadoch sa hyperinzulinémia upravila do 3 rokov života. Pri ďalších syndrómových formách HH sa hypoglykémia spája s nadmerným rastom (celého tela alebo len niektorých častí), ide o tzv. makrozomické syndrómy. Najznámejším a aj najčastejšie sa vyskytujúcim je Beckwithov-Wiedemannov syndróm [22], ktorý sa vyskytuje v incidencii približne 1 :13 700 živonarodených detí [23]. Charakterizuje ho zvýšený pre - aj postnatálny rast, makroglosia, defekty brušnej steny, organomegália, hemihypertrofia, ryhy na ušniciach, zvýšené riziko neoplaziem a abnormality obličiek [24]. HH sa vyskytuje približne u 50 % pacientov s týmto syndrómom, pričom u väčšiny sú hypoglykémie len tranzitórne a ustúpia spontánne do niekoľkých dní [25]. Zriedkavo sa vyskytujú perzistujúce hypoglykémie vyžadujúce liečbu diazoxidom alebo raritne aj subtotálnu pankreatektómiu. Sotov syndróm, Perlmanov syndróm a Simpsonov-Golabiho-Behmelov syndróm majú podobný klinický obraz ako Beckwithov-Wiedemannov syndróm, sú však omnoho zriedkavejšie [25]. Medzi syndrómy bez zjavnej makrozómie spôsobujúce HH patria Usherov syndróm, Kabuki syndróm, Costellov syndróm a Ondinov syndróm [25,26]. Prehľad syndrómových foriem spájaných s hyperinzulinemickými hypoglykémiami je uvedený v tab. 2.
Table 2. Prehľad syndrómových foriem spájaných s hyperinzulinemickými hypoglykémiami a ich základné klinické charakteristiky. Modifikované podľa [9] ![Prehľad syndrómových foriem spájaných s hyperinzulinemickými hypoglykémiami a ich základné klinické charakteristiky. Modifikované podľa [9]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/564ab07414abf7e79dece876f150a49f.jpg)
AD – autozómovo dominantná dedičnosť AR – autozómovo recesívna dedičnosť PMR – psychomotorická retardácia Liečba
Cieľom liečby CHI je dosiahnutie normoglykémie (3,5–5,6 mmol/l), pričom voľba terapeutického postupu závisí od závažnosti hypoglykémií.
V akútnych prípadoch sa podávajú roztoky glukózy. Pri ohrození života alebo riziku poškodenia mozgu sa môže pri závažných hypoglykémiách podávať bolus glukózy do periférnej žily. Z definície CHI (potreba glukózy minimálne 10 mg/kg/min) vyplýva, že efektívna býva liečba 10% glukózou pri rýchlosti viac ako 6 ml/kg/hod. V prípadoch, v ktorých nie je možné zabezpečiť intravenózny prístup, alebo bolus glukózy a následná infúzia do periférnej žily je nedostatočná, sa môže podať intramuskulárne glukagón (0,5–1 mg) [7]. Hlavným efektom glukagónu je mobilizácia glukózy z glykogénu v pečeni. Glukagón je preto účinný najmä pri náhle vzniknutých hypoglykémiách; pri postupne sa rozvíjajúcich alebo prolongovaných je jeho účinok viditeľne menší, nakoľko sa pečeňový glykogén spotreboval už v priebehu rozvoja hypoglykémie. Výnimku tvorí práve CHI (a iné príčiny hyperinzulinemickej hypoglykémie), kedy vysoké hladiny inzulínu bránia glykogenolýze. Vysoké bolusy glukagónu ale spôsobujú paradoxnú reakciu – glukagón je totiž stimulátor vylučovania inzulínu. Preto po boluse glukagónu, keď odznie jeho maximálny účinok, dochádza k rebound-hypoglykémii. Vzhľadom na tento fenomén je potrebné po podaní glukagónu zabezpečiť i.v. prístup a podať roztok glukózy. Ďalším nežiaducim efektom glukagónu je vracanie, ktoré môže znemožniť podanie stravy (glukózy) per os. Inou možnosťou použitia glukagónu pri akútnych hypoglykémiách je vo forme intravenóznej alebo subkutánnej infúzie.
V chronickej liečbe perzistujúcich hypoglykémií je liekom prvej voľby diazoxid. Diazoxid sa pôvodne používal ako antihypertenzívum. Viaže sa na draslíkový kanál (hladkého svalu, ale aj B-buniek), ktorý otvára. V B-bunkách bráni tak depolarizácii bunkovej membrány a splynutiu sekrekčných granúl s inzulínom s bunkovou membránou a uvoľneniu inzulínu do cirkulácie. Pacienti s mutáciou ABCC8 a KCNJ11 sú rezistentní na diazoxid v 82 % prípadov [27]. Nakoľko práve mutácie ABCC8 a KCNJ11 tvoria väčšinu prípadov CHI s manifestáciou po narodení, väčšina závažných neonatálnych prípadov je rezistentná na diazoxid. Nakoľko drvivá väčšina pacientov s inými formami CHI dobre reaguje na podávanie diazoxidu, citlivosť na tento liek sa veľmi často využíva v diferenciálnej diagnostike jednotlivých foriem CHI (pozri nižšie). Za rezistenciu sa pokladá stav, pri ktorom sa nepodarí udržať u pacienta glykémiu nad 3 mmol/l pri normálnej strave a aj pri 8–12-hodinovom lačnení. Iniciálna dávka je zvyčajne 5 mg/kg/deň (pri ťažkých formách až do 20 mg/kg/deň). Najčastejším nežiadúcim účinkom diazoxidu je hypertrichóza. Je prítomná takmer vždy na celom tele s maximom na čele. Druhým častým nežiadúcim účinkom je retencia tekutín. Vyskytuje sa najmä u novorodencov a môže spôsobiť srdcové zlyhanie (spomedzi slovenských pacientov liečených diazoxidom sa nevyskytlo ani u jedného, na rozdiel od hypertrichózy, ktorú mali všetci – nepublikované dáta). Odporúča sa preto najmä v neonatálnom období kombinácia diazoxidu a tiazidového diuretika. Počas liečby diazoxidom je potrebné aj monitorovanie tlaku, pretože spôsobuje hypotenziu u normotenzných pacientov (diazoxid je pôvodne antihypertenzívum). Ďalším nežiadúcim efektom liečby môže byť pokles koncentrácie IgG.
Oktreotid je analóg somatostatínu a používa sa najmä v dlhodobej liečbe CHI. Má širokospektrálne účinky na endokrinný systém, pričom v liečbe CHI sa využíva najmä supresia vylučovania inzulínu. Oktreotid býva účinný aj pri formách CHI rezistentných na diazoxid [28], pri ktorých býva liekom voľby [28]. Úvodná dávka je 5–10 μg/kg/deň, pričom sa môže zvýšiť až na 15–50 μg/kg/deň [9]. Nevýhodou oktreotidu je vytvorenie si tolerancie a potreba stále vyšších dávok u niektorých pacientov. Nežiadúcim účinkom je potlačenie vylučovania aj rastového hormónu a spomalenie lineárneho rastu. Časté bývajú gastrointestinálne ťažkosti – žlčníkové kamene, hnačka a nafukovanie a vzostup pečeňových aminotransferáz [29,30]. V roku 2010 bola publikovaná práca, v ktorej spomedzi 192 dojčiat liečených oktreotidom mali 4 nekrotizujúcu enterokolitídu [31]. Aj keď sa jej výsledky citujú v takmer každej zahraničnej práci o CHI, jej výstupy pre prax sú veľmi diskutabilné (vzhľadom na nízky počet prípadov s NEC ako aj rizikovosť CHI pacientov per se).
Ďalším liekom, ktorý sa používa v liečbe CHI, je kalciový blokátor nifedipín. Nifedipín redukuje vtok kalciových iónov do B-buniek, čím znižuje sekréciu inzulínu. Tento efekt sa prejavuje v oveľa nižších dávkach ako v iných indikáciách (kardiologických v dospelosti), preto je riziko vedľajších účinkov minimálne. Problémom tohto lieku je, že je účinný len u malého počtu pacientov a jeho použitie v indikácii CHI je len sporadické a neoverené na väčšom počte pacientov [7].
Použitie glukokortikoidov nie je odporúčané v žiadnom z publikovaných liečebných postupov.
Nové medikamenty v liečbe CHI
Trend hľadania nových liekov pre CHI sa zameriava najmä na závažné prípady rezistentné na diazoxid ako alternatívu oktreotidu ako aj invazívnemu chirurgickému zákroku. Prvou skupinou týchto liečiv sú analógy somatostatínu s predĺženým účinkom, nakoľko oktreotid je potrebné podávať subkutánne 4krát denne, alebo kontinuálne inzulínovou pumpou. Patrí medzi ne oktreotid LAR (long-acting release) a lanreotid, ktoré sa podávajú 1krát mesačne [32,33] a zabezpečujú porovnateľnú (alebo dokonca lepšiu) stabilitu glykémií ako oktreotid. Riziko nežiaducich účinkov je taktiež podobné ako pri oktreotide (podľa našich klinických skúseností je vplyv lanreotidu na rast nižší ako pri oktreotide). Na Slovensku boli doposiaľ 2 detskí pacienti liečení oktreotidom nastavení na lanreotid. Okrem vyššej kvality života sa zmena prejavila aj zvýšenou chuťou do jedla, čo je pri tejto diagnóze veľmi kľúčové. Ďalším perspektívnym liekom je sirolimus (pôvodne rapamycin), ktorý inhibuje jednu z dráh vylučovania inzulínu (mTOR). V roku 2013 bola uverejnená štúdia v prestížnom New England Journal of Medicine, ktorá prezentovala 4 deti s CHI rezistentné na oktreotid, ktoré dobre zareagovali na liečbu sirolimom [34–36]. Vzhľadom na závažnosť ich hypoglykémií bolo inou možnosťou len chirurgické odstránenie väčšej časti pankreasu.
Systém kŕmenia je veľmi dôležitou súčasťou zachovania normoglykémie. Efektívne je podávanie sacharidovej stravy v kratších intervaloch. U niektorých detí býva v domácom prostredí nevyhnutné kontinuálne kŕmenie cez nazogastrickú sondu alebo cez gastrostómiu [37]. Kontinuálne kŕmenie býva vhodné najmä v priebehu nočných hodín. S cieľom protekcie mozgových funkcií sa pri medikamentózne nezvládnuteľných formách CHI ojedinele skúšala aj ketogénna diéta (spolu s oktreotidom) s dobrým efektom [38].
Počas liečby CHI je nevyhnutný monitoring glykémií aj v domácom prostredí glukomerom. Frekventnejšie merania glykémií by mali byť najmä počas infekcií, keď je limitovaný perorálny príjem.
Chirurgická liečba CHI
Jej indikácie závisia od typu CHI. Pri fokálnych formách s presným určením lokalizácie fokusu sú dobré výsledky pri parciálnej pankreatektómii (v súčasnosti už laparoskopicky) [39–41]. Ak sa odstráni fokus, je riziko pretrvávania hypoglykémií minimálne a nízke je aj riziko vzniku diabetu po operácii. Pri difúznych formách so závažným priebehom je situácia odlišná. Operácia býva úspešná v liečbe hypoglykémií len pri odstránení viac ako 95 % pankreasu (takmer totálna pankreatektómia) [42]. Riziká operácie, ktorá sa robí laparotomickým prístupom, sú vysoké [43]. V 50–60 % prípadov pretrvávajú hypoglykémie aj po odstránení takmer celého pankreasu [9,44]. Riziko vzniku diabetu a exokrinnej pankreatickej insuficiencie po operácii je rovnako veľmi vysoké (20–50 % bezprostredne po operácii a viac ako 90 % do 14 rokov od operácie) [9,44]. Preto sa zvyčajne operácia indikuje len pri konzervatívne nezvládnuteľných hypoglykémiách (rezistentných na oktreotid a inú liečbu a kontinuálne kŕmenie cez gastrostómiu) [45]. V ostatných prípadoch sa volí radšej vyčkávacia taktika, ktorá sa v najväčších centrách uprednostňuje v poslednej dobe aj pri fokálnych formách, nakoľko u väčšiny detí s CHI sa hypoglykémie vekom zmierňujú [7].
Prognóza
Z hľadiska prežívania a kvality života pacientov s CHI sú rozhodujúce 2 orgány – mozog a pankreas. Poškodenie mozgu nastáva v dôsledku prolongovaných hypoglykémií, ktoré sa u novorodencov zvyčajne prejavia ako kóma alebo status epilepticus; u starších detí sú takéto závažné prejavy hypoglykémií veľmi zriedkavé [9,44]. Zaostávanie v psychomotorickom vývoji alebo neurologický deficit sú následkom takýchto stavov u približne 25 % pacientov s CHI, pričom tretina z nich má závažný neurologický deficit. Závažné poškodenie intelektu je u 11 % pacientov s neonatálnou manifestáciou CHI, kým u detí s neskorším objavením sa CHI je to len 3 %. U pacientov po operácii je to asi 10 % (bez ohľadu na to, či mal pacient fokálnu alebo difúznu formu), kým u detí, ktoré nevyžadovali operáciu, len 4 % [9,44].
Formy izolovaného kongenitálneho hyperinzulinizmu
Spôsobujú ho mutácie génov zasahujúcich do sekrécie inzulínu v B-bunkách pankreasu. V súčasnosti poznáme už 11 génov, ktorých mutácie spôsobujú izolovaný CHI (schéma 1) [46]. Na základe funkcie proteínového produktu sa dajú rozdeliť na mutácie transmembránových prenášačov (poškodené gény ABCC8 a KCNJ11 pre podjednotky draslíkového kanála a MCT1), enzymopatie (GLUD1, GCK, HK1, PGM1, HADH, UPC2), mutácie génov pre transkripčný faktor (HNF4A, HNF1A).
Mutácie génov KCNJ11 a ABCC8 pre podjednotky draslíkového kanála
Mutácie génov KCNJ11 a ABCC8 sú najčastejšou príčinou kongenitálneho hyperinzulinizmu a sú zodpovedné za 40–45 % prípadov izolovaného CHI [6,27,47]. Ich klinický obraz ale môže byť veľmi rôznorodý v závislosti od typu mutácie. Pacienti vo väčšine prípadov neodpovedajú na liečbu diazoxidom.
Genetika
Gény KCNJ11 (kóduje Kir6.2) a ABCC8 (kóduje SUR1) sa nachádzajú na chromozóme 11 [48]. Kým KCNJ11 má len 1 exón, ABCC8 ich má 39. Inaktivačné mutácie týchto génov sú zodpovedné za kongenitálny hyperinzulinizmus, aktivačné mutácie spôsobujú naopak diabetes. Doposiaľ sa opísalo 150 inaktivačných mutácií génu ABCC8 a 24 génu KCNJ11 [7]. Najnovšie sa zistilo, že okrem mutácií môžu vyvolávať CHI aj parciálne delécie ABCC8 génu [49]. Oba gény sú ale veľmi polymorfné, čo značne komplikuje DNA diagnostiku a najmä interpretáciu výsledku [50]. Väčšina prípadov CHI na podklade ABCC8 a KCNJ11 mutácií je sporadických, rodinný výskyt je omnoho zriedkavejší. Dedičnosť závisí od typu mutácie; autozómovo dominantná alebo recesívna [51]. Dominantné mutácie sú menej časté, ale spôsobujú takmer všetky familiárne formy [52]. Na klinické prejavenie sa stačí poškodenie jednej z alel génu. Recesívne mutácie sú oveľa častejšie, ale na klinickú manifestáciu sú potrebné mutácie oboch alel génu [53]. Pri zdedení mutovanej alely od matky aj od otca sú poškodené obe alely génu vo všetkých B-bunkách pankreasu a vzniká difúzna hyperplázia B-buniek s najzávažnejším klinickým priebehom. Recesívne mutácie sa môžu klinicky prejaviť, aj keď dieťa zdedí len jednu mutovanú alelu – a druhá sa poškodí počas intrauterinného vývoja – vznikajú tak fokálne formy (obr. a schéma 2) [54]. Mutácie ABCC8 a KCNJ11 sú jedinou známou príčinou fokálnych foriem CHI [6,55,56].
Image 1. PET-CT u pacientky s fokálnou formou CHI 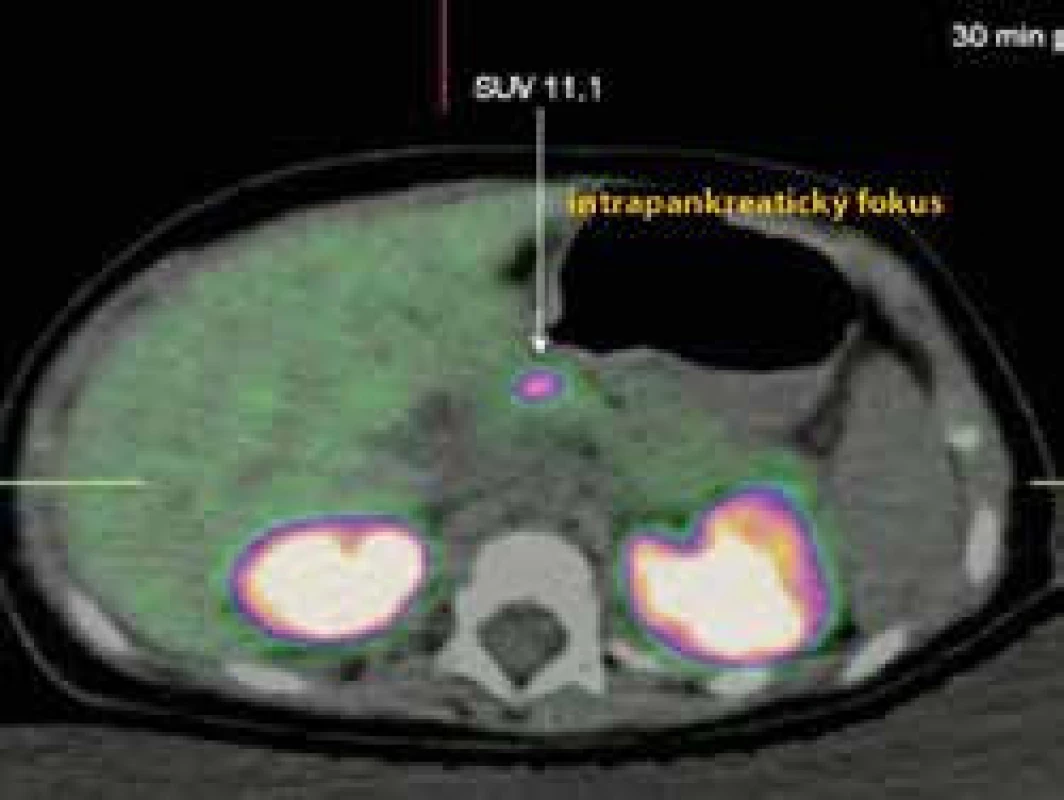
Schéma 2. Schéma jednej z možností vzniku fokálnych foriem CHI 
Ľavá časť obrázku zachytáva situáciu, kedy má pacient mutáciu na otcovskom chromozóme 11, ale materinský chromozóm 11 je intaktný. Táto situácia sa vyskytuje u 98–99 % prípadov a nosič je klinicky zdravý. Na schéme vpravo je situácia u 1–2 % detí, kedy počas ontogenézy pankreasu dochádza k delécii časti materinského chromozómu 11 s génmi KCNJ11, ABCC8, ale aj génmi, ktoré podliehajú imprintingu. Na otcovskom chromozóme 11 sa naopak celá oblasť zduplikuje. Výsledkom je, že dieťa má 2 mutácie na otcovskom chromozóme a poruchu imprintovaných génov. Na chromozóme od otca je totiž aktívny aktivátor rastu (IGF2) a inaktívne sú rastové inhibítory (gény H19 a CDKNIC). Výsledkom je nekontrolovaný rast buniek s mutovanými génmi ABCC8 alebo KCNJ11, čo spôsobuje v hyperplastickej oblasti nadprodukciu inzulínu. Upravené podľa [81] Syndróm hyperinzulinizmu a hyperamonémie (HI/HA syndróm)
HI/HA syndróm je spôsobený mutáciami génu pre mitochondriálny enzým – glutamátdehydrogenázu [57]. Po mutáciách ABCC8 a KCNJ11 je to druhá najčastejšia príčina CHI.
Genetika
Ochorenie vzniká na podklade mutácií génu GLUD1, ktorý kóduje glutamátdehydrogenázu [58]. Doteraz sa opísalo viac ako 20 aktivačných mutácií GLUD1. Ochorenie má autozómovo dominantný typ dedičnosti. Aj keď väčšina prípadov je sporadická, bol opísaný aj rodinný výskyt GLUD1 mutácií [9]. Klinický obraz je charakterizovaný opakujúcimi sa postprandiálnymi hypoglykémiami po jedlách bohatých na bielkoviny [59,60] ako aj hypoglykémiami nalačno [61]. Hypoglykémie sú sprevádzané asymptomatickým 2 - až 5-násobným zvýšením amoniaku v plazme [59]. Pri HI/HA syndróme sú časté neurologické komplikácie, ako je epilepsia a poruchy učenia [61,62]. Pre diagnostiku tohto ochorenia je dôležitý rutinný skríning hladiny amoniaku v plazme u všetkých pacientov s CHI.
Mutácie HADH
Ďalšou formou CHI sú mutácie génu pre mitochondriálny enzým L-3-hydroxyacyl-koenzým A dehydrogenázu (HADH), ktorý zasahuje do β-oxidácie mastných kyselín [63].
Genetika
Gén pre HADH sa nachádza na chromozóme 4 a exprimuje sa v rôznych tkanivách, pričom jeho vysoká expresia je práve v pankrease [63]. Ochorenie má autozómovo recesívny charakter a pacienti sú často z konsangvinných rodín [64]. Klinický obraz môže byť veľmi rôznorodý – od závažných neonatálnych foriem CHI až po mierne CHI so vznikom v priebehu detstva. Všetky formy dobre reagujú na podávanie diazoxidu [64].
Glukokinázový hyperinzulinizmus
Spôsobujú ho mutácie génu pre glukokinázu, ktorá slúži ako glykemický senzor B-buniek.
Genetika
Inaktivačné mutácie glukokinázy spôsobujú diabetes (heterozygotné MODY-2, homozygotné neonatálny diabetes), kým aktivačné heterozygotné mutácie vedú k zvýšenej sekrécii inzulínu [65]. Klinický obraz: Glukokináza má dominantnú úlohu v regulácii sekrécie inzulínu nalačno, preto aj hypoglykémia sa prejavuje najmä nalačno. Ich závažnosť veľmi kolíše a závisí aj od typu mutácie [66]. Začiatok hypoglykémií môže byť od neonatálneho obdobia až do dospelosti [67].
Hexokinázový a fosfoglukomutázový hyperinzulinizmus
Ide o raritné formy CHI [46]. Hexokináza (HK1) podobne ako glukokináza fosforyluje glukózu, ale za normálnych podmienok sa v B-bunkách neexprimuje. Mutácie v nekódujúcej oblasti HK1 génu u jednej rodiny ale mohli spôsobiť abnormálny prepis hexokinázy aj v pankrease [68].
Mutácie fosfoglukomutázy boli nedávno opísané u pacientov s hypoglykémiami, rázštepom podnebia, slabosťou a abnormálnou glykozyláciou. Aj keď fenotyp podobný glykogenózam (hyperketotické hypoglykémie) bol častejší, u časti pacientov bol obraz typický pre CHI [69].
Cvičením indukovaný hyperinzulinizmus
Toto ochorenie charakterizuje vznik hypoglykémií 30–45 minút po intenzívnom aeróbnom cvičení [70]. Príčinou je porucha monokarboxylového transportéra MCT1, ktorý prenáša laktát a pyruvát do buniek [71].
Genetika
MCT1 transportér je kódovaný génom SLC16A1 [71]. Za normálnych okolností sa tento gén neexprimuje v B-bunkách pankreasu, ale v mnohých iných tkanivách. Autozómovo dominantné mutácie jeho promótora ale spôsobujú, že sa prepisuje aj v B-bunkách. Doposiaľ boli opísané mutácie u troch fínskych rodín. Liečbu táto forma CHI zvyčajne nevyžaduje, stačí sa vyhýbať intenzívnemu aeróbnemu cvičeniu.
Mutácie génu UCP2
Mitochondriány proteín UCP2 je negatívny regulátor sekrécie inzulínu, pretože znižuje pomer ATP/ADP [72]. Doteraz sa opísalo niekoľko pacientov s miernou formou CHI pri heterozygotných inaktivačných mutáciách UCP2 [73].
Mutácie HNF4A a HNF1A
HNF4A je gen kódujúci transkripčný faktor HNF4α (hepatálny nukleárny faktor 4 α), ktorý riadi expresiu génov zasahujúcich do vylučovania inzulínu [74]. Mutácie HNF4A spôsobujú postupné zlyhanie sekrécie inzulínu a prejavujú sa ako cukrovka typu HNF4A-MODY so vznikom v adolescencii a včasnej dospelosti. V rokoch 2007 a 2008 sa zistilo, že rovnaké mutácie ako u dospelých spôsobujú cukrovku HNF4A-MODY, u detí spôsobujú makrozómiu a tranzientný alebo perzistentný hyperinzulinizmus s hypoglykémiami [75–77].
Genetika
Ide o heterozygotné mutácie s autozómovo dominantným typom dedičnosti. Aj keď jedna mutácia sa môže prejaviť ako CHI vo včasnom detstve a neskôr v dospelosti ako HNF4A-MODY [78], väčšina rodičov detí s CHI, ktorí sú nosičmi mutácie, diabetes nemá [79]. Rovnaké prejavy ako pri mutáciách HNF4A sa opísali nedávno aj pri mutáciách HNF1A, ktoré spôsobujú aj cukrovku typu HNF1A-MODY a sú veľmi časté u detských pacientov v ČR [47]. Klinický obraz: Závažnosť hypoglykémií je veľmi rôznorodá od miernych foriem reagujúcich na diétne opatrenia, po formy vyžadujúce liečbu diazoxidom. Boli opísané aj prípady, kedy CHI pretrvával od narodenia až do 8. roku života [80].
Diagnostika CHI na Slovensku
Zavedením DNA analýzy génov ABCC8, KCNJ11, GCK a HNF4A v laboratóriu DIABGENE (pôvodne z dôvodu DNA analýzy monogénovej cukrovky) sa na Slovensku výrazne posunula aj diagnostika kongenitálneho hyperinzulinizmu [82,83]. V súčasnosti naše pracovisko disponuje rutinnou analýzou väčšiny génov spôsobujúcich CHI ako aj panelom 40 génov vyšetrovaných metódou sekvenovania novej generácie. Za obdobie rokov 2004–2016 bolo vyšetrených 16 pacientov s CHI, pričom genetická príčina sa potvrdila u 5 z nich, čo sa využilo aj pri farmakogenetickej úprave liečby.
Záver
Kongenitálny hyperinzulinizmus patrí medzi zriedkavé ochorenia so závažnými, život ohrozujúcimi komplikáciami a možnými trvalými následkami. Včasná DNA analýza umožňuje výrazné skrátenie času diagnostiky a voľbu účinnej liečby na báze princípov farmakogenetiky.
Podporené „Transendogen“ (ITMS kód projektu 26240220051), APVV 0107–12 a DIASAN.
RNDr. Daniela Gašperíková, DrSc.
daniela.gasperikova@savba.sk
DIABGENE & Laboratórium diabetu a porúch metabolizmu, Bratislava, Slovenská republika
Ústav experimentálnej endokrinológie BMC SAV, Bratislava, Slovenská republika
www.sav.sk
Doručeno do redakce 3. 9. 2016
Přijato po recenzi 4. 11. 2016
Sources
1. Stanik J, Huckova M, Stanikova D et al. Genetics of monogenic forms of diabetes. Vnitř Lék 2011; 57(11): 937–945.
2. Lang TF, Hussain K. Pediatric hypoglycemia. Adv Clin Chem 2014; 63 : 211–245.
3. Palladino AA, Bennett MJ, Stanley CA. Hyperinsulinism in infancy and childhood: when an insulin level is not always enough. Clin Chem 2008; 54(2): 256–263.
4. Mathew PM, Young JM, Abu-Osba YK et al. Persistent neonatal hyperinsulinism. Clin Pediatr (Phila) 1988; 27(3): 148–151.
5. Glaser B, Blech I, Krakinovsky Y et al. ABCC8 mutation allele frequency in the Ashkenazi Jewish population and risk of focal hyperinsulinemic hypoglycemia. Genet Med 2011; 13(10): 891–894. Dostupné z DOI: <http://dx.doi.org/10.1097/GIM.0b013e31821fea33>.
6. Flanagan SE, Kapoor RR, Hussain K. Genetics of congenital hyperinsulinemic hypoglycemia. Semin Pediatr Surg 2011; 20(1): 13–17. Dostupné z DOI: <http://dx.doi.org/10.1053/j.sempedsurg.2010.10.004> -
7. Senniappan S, Shanti B, James C et al. Hyperinsulinaemic hypoglycaemia: genetic mechanisms, diagnosis and management. J Inherit Metab Dis 2012; 35 : 589–601.
8. Dunne MJ, Cosgrove KE, Shepherd RM et al. Hyperinsulinism in infancy: from basic science to clinical disease. Physiol Rev 2004; 84(1): 239–275.
9. Arnoux JB, Verkarre V, Saint-Martin C et al. Congenital hyperinsulinism: current trends in diagnosis and therapy. Orphanet J Rare Dis 2011; 6 : 63. Dostupné z DOI: <http://dx.doi.org/10.1186/1750–1172–6-63>
10. Arnoux JB, de Lonlay P, Ribeiro MJ et al. Congenital hyperinsulinism. Early Hum Dev 2010; 86(5): 287–294. Dostupné z DOI: <http://dx.doi.org/10.1016/j.earlhumdev.2010.05.003>.
11. Akcay T, Taskin N, Ulucan K et al. Congenital hyperinsulinism and cardiomyopathy. Fetal Pediatr Pathol 2012; 31(3): 190. Dostupné z DOI: <http://dx.doi.org/10.3109/15513815.2012.656831>.
12. Bulbul A, Bolat F, Comert S et al. Persistent hyperinsulinemic hypoglycemia with left ventricular hypertrophy and dysrhythmia: a case report. Fetal Pediatr Pathol 2010; 29(3): 165–171. Dostupné z DOI: <http://dx.doi.org/10.3109/15513811003777334>.
13. Aynsley-Green A, Hussain K, Hall J et al. Practical management of hyperinsulinism in infancy. Arch Dis Child Fetal Neonatal Ed 2000; 82(2): F98-F107.
14. Barthlen W, Blankenstein O, Mau H et al. Evaluation of [18F]fluoro-L-DOPA positron emission tomography-computed tomography for surgery in focal congenital hyperinsulinism. J Clin Endocrinol Metab 2008; 93(3): 869–875.
15. Barthlen W. Surgery in congenital hyperinsulinism-tips and tricks not only for surgeons. A practical guide. Semin Pediatr Surg 2011; 20(1): 56–59. Dostupné z DOI: <http://dx.doi.org/10.1053/j.sempedsurg.2010.10.002>.
16. Banerjee I, Skae M, Flanagan SE et al. The contribution of rapid KATP channel gene mutation analysis to the clinical management of children with congenital hyperinsulinism. Eur J Endocrinol 2011; 164(5): 733–740. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-10–1136>.
17. Sperling MA. New insights and new conundrums in neonatal hypoglycemia: enigmas wrapped in mystery. Diabetes 2013; 62(5): 1373–1375. Dostupné z DOI: <http://dx.doi.org/10.2337/db12–1839>.
18. Shanti B, Silink M, Bhattacharya K et al. Congenital disorder of glycosylation type Ia: Heterogeneity in the clinical presentation from multivisceral failure to hyperinsulinaemic hypoglycaemia as leading symptoms in three infants with phosphomannomutase deficiency. J Inherit Metab Dis 2009; 32(Suppl 1): S241-S251. Dostupné z DOI: <http://dx.doi.org/10.1007/s10545–009–1180–2>.
19. Bohles H, Sewell AA, Gebhardt B et al. Hyperinsulinaemic hypoglycaemia – leading symptom in a patient with congenital disorder of glycosylation Ia (phosphomannomutase deficiency). J Inherit Metab Dis 2001; 24(8): 858–862.
20. Sun L, Eklund EA, Chung WK et al. Congenital disorder of glycosylation id presenting with hyperinsulinemic hypoglycemia and islet cell hyperplasia. J Clin Endocrinol Metab 2005; 90(7): 4371–4375.
21. Baumann U, Preece MA, Green A et al. Hyperinsulinism in tyrosinaemia type I. J Inherit Metab Dis 2005; 28(2): 131–135.
22. Munns CF, Batch JA. Hyperinsulinism and Beckwith-Wiedemann syndrome. Arch Dis Child Fetal Neonatal Ed 2001; 84(1): F67-F69.
23. Wangler MF, An P, Feinberg AP et al. Inheritance pattern of Beckwith-Wiedemann syndrome is heterogeneous in 291 families with an affected proband. Am J Med Genet A 2005; 137(1): 16–21.
24. Fukuzawa R, Umezawa A, Morikawa Y et al. Nesidioblastosis and mixed hamartoma of the liver in Beckwith-Wiedemann syndrome: case study including analysis of H19 methylation and insulin-like growth factor 2 genotyping and imprinting. Pediatr Dev Pathol 2001; 4(4): 381–390.
25. Kapoor RR, James C, Hussain K. Hyperinsulinism in developmental syndromes. Endocr Dev 2009; 14 : 95–113. Dostupné z DOI: <http://dx.doi.org/10.1159/000207480>.
26. Alexander S, Ramadan D, Alkhayyat H et al. Costello syndrome and hyperinsulinemic hypoglycemia. Am J Med Genet A 2005; 139(3): 227–230.
27. Bellanne-Chantelot C, Saint-Martin C, Ribeiro MJ et al. ABCC8 and KCNJ11 molecular spectrum of 109 patients with diazoxide-unresponsive congenital hyperinsulinism. J Med Genet 2010; 47(11): 752–759. Dostupné z DOI: <http://dx.doi.org/10.1136/jmg.2009.075416>.
28. Bas VN, Ozkan M, Zenciroglu A et al. Seizure due to somatostatin analog discontinuation in a case diagnosed as congenital hyperinsulinism novel mutation. J Pediatr Endocrinol Metab 2012; 25(5–6): 553–555.
29. Abdel Khalek M, Kandil E. Is octreotide safe for the management of persistent hyperinsulinemic hypoglycemia of infancy? Eur J Pediatr Surg 2011; 21(3): 188–189.
30. Demirbilek H, Shah P, Arya VB et al. Long-term follow-up of children with congenital hyperinsulinism on octreotide therapy. J Clin Endocrinol Metab 2014; 99(10): 3660–3667. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–1866>.
31. Laje P, Halaby L, Adzick NS et al. Necrotizing enterocolitis in neonates receiving octreotide for the management of congenital hyperinsulinism. Pediatr Diabetes 2010; 11(2): 142–147. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–5448.2009.00547.x>.
32. Le Quan Sang KH, Arnoux JB, Mamoune A et al. Successful treatment of congenital hyperinsulinism with long-acting release octreotide. Eur J Endocrinol 2012; 166(2): 333–339. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-11–0874>.
33. Kuhnen P, Marquard J, Ernert A et al. Long-term lanreotide treatment in six patients with congenital hyperinsulinism. Horm Res Paediatr 2012; 78(2): 106–112.
34. Unal S, Gonulal D, Ucakturk A et al. A novel homozygous mutation in the KCNJ11 hgene p. F315I of a neonate with congenital hyperinsulinism and succesful management by sirolimus. J Clin Res Pediatr Endocrinol 2016. Dostupné z DOI: <http://dx.doi.org/10.4274/jcrpe.2773>.
35. Senniappan S, Alexandrescu S, Tatevian N et al. Sirolimus therapy in infants with severe hyperinsulinemic hypoglycemia. N Engl J Med 2014; 370(12): 1131–1137. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1310967>.
36. Shah P, Arya VB, Flanagan SE et al. Sirolimus therapy in a patient with severe hyperinsulinaemic hypoglycaemia due to a compound heterozygous ABCC8 gene mutation. J Pediatr Endocrinol Metab 2015; 28(5–6): 695–699. Dostupné z DOI: <http://dx.doi.org/10.1515/jpem-2014–0371>.
37. Al-Shanafey S, Alkhudhur H. Food aversion among patients with persistent hyperinsulinemic hypoglycemia of infancy. J Pediatr Surg 2012; 47(5): 895–897. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jpedsurg.2012.03.002>.
38. Maiorana A, Manganozzi L, Barbetti F et al. Ketogenic diet in a patient with congenital hyperinsulinism: a novel approach to prevent brain damage. Orphanet J Rare Dis 2015; 10 : 120. Dostupné z DOI: <http://dx.doi.org/10.1186/s13023–015–0342–6>.
39. Adzick NS, Thornton PS, Stanley CA et al. A multidisciplinary approach to the focal form of congenital hyperinsulinism leads to successful treatment by partial pancreatectomy. J Pediatr Surg 2004; 39(3): 270–275.
40. Al-Shanafey S. Laparoscopic vs open pancreatectomy for persistent hyperinsulinemic hypoglycemia of infancy. J Pediatr Surg 2009; 44(5): 957–961. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jpedsurg.2009.01.042>.
41. Bax KN, van der Zee DC. The laparoscopic approach toward hyperinsulinism in children. Semin Pediatr Surg 2007; 16(4): 245–251.
42. Barthlen W, Mohnike W, Mohnike K. Techniques in pediatric surgery: congenital hyperinsulinism. Horm Res Paediatr 2010; 74(6): 438–443. Dostupné z DOI: <http://dx.doi.org/10.1159/000321902>.
43. Al-Nassar S, Sakati N, Al-Ashwal A et al. Persistent hyperinsulinaemic hypoglycaemia of infancy in 43 children: long-term clinical and surgical follow-up. Asian J Surg 2006; 29(3): 207–211.
44. Beltrand J, Caquard M, Arnoux JB et al. Glucose metabolism in 105 children and adolescents after pancreatectomy for congenital hyperinsulinism. Diabetes Care 2012; 35(2): 198–203. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–1296>.
45. Barthlen W, Mohnike W, Mohnike K. Techniques in pediatric surgery: congenital hyperinsulinism. Horm Res Paediatr 2011; 75(4): 304–310. <http://dx.doi.org/10.1159/000323532>.
46. Stanley CA. Perspective on the Genetics and Diagnosis of Congenital Hyperinsulinism Disorders. J Clin Endocrinol Metab 2016; 101(3): 815–826. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2015–3651>.
47. Rozenkova K, Malikova J, Nessa A et al. High Incidence of Heterozygous ABCC8 and HNF1A Mutations in Czech Patients With Congenital Hyperinsulinism. J Clin Endocrinol Metab 2015; 100(12): E1540-E1549. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2015–2763>.
48. Bryan J, Munoz A, Zhang X et al. ABCC8 and ABCC9: ABC transporters that regulate K+ channels. Pflugers Arch 2007; 453(5): 703–718.
49. Flanagan S, Damhuis A, Banerjee I et al. Partial ABCC8 gene deletion mutations causing diazoxide-unresponsive hyperinsulinaemic hypoglycaemia. Pediatr Diabetes 2012; 13 : 285–289.
50. Stanik J, Lethby M, Flanagan SE et al. Coincidence of a novel KCNJ11 missense variant R365H with a paternally inherited 6q24 duplication in a patient with transient neonatal diabetes. Diabetes Care 2008; 31(9): 1736–1737. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08–0549>.
51. Fernandez-Marmiesse A, Salas A, Vega A et al. Mutation spectra of ABCC8 gene in Spanish patients with Hyperinsulinism of Infancy (HI). Hum Mutat 2006; 27(2): 214.
52. Ocal G, Flanagan SE, Hacihamdioglu B et al. Clinical characteristics of recessive and dominant congenital hyperinsulinism due to mutation(s) in the ABCC8/KCNJ11 genes encoding the ATP-sensitive potasium channel in the pancreatic beta cell. J Pediatr Endocrinol Metab 2011; 24(11–12): 1019–1023.
53. Darendeliler F, Bas F. Hyperinsulinism in infancy – genetic aspects. Pediatr Endocrinol Rev 2006; 3(Suppl 3): S521-S526.
54. de Lonlay P, Touati G, Robert JJ et al. Persistent hyperinsulinaemic hypoglycaemia. Semin Neonatol 2002; 7(1): 95–100.
55. Delonlay P, Simon A, Galmiche-Rolland L et al. Neonatal hyperinsulinism: clinicopathologic correlation. Hum Pathol 2007; 38(3): 387–399.
56. Ismail D, Smith VV, de Lonlay P et al. Familial focal congenital hyperinsulinism. J Clin Endocrinol Metab 2011; 96(1): 24–28. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2010–1524>.
57. Palladino AA, Stanley CA. The hyperinsulinism/hyperammonemia syndrome. Rev Endocr Metab Disord 2010; 11(3): 171–178. Dostupné z DOI: <http://dx.doi.org/10.1007/s11154–010–9146–0>.
58. Kibbey RG, Choi CS, Lee HY et al. Mitochondrial GTP insensitivity contributes to hypoglycemia in hyperinsulinemia hyperammonemia by inhibiting glucagon release. Diabetes 2014; 63(12): 4218–4229. Dostupné z DOI: <http://dx.doi.org/10.2337/db14–0783>.
59. Hsu BY, Kelly A, Thornton PS et al. Protein-sensitive and fasting hypoglycemia in children with the hyperinsulinism/hyperammonemia syndrome. J Pediatr 2001; 138(3): 383–389.
60. Balasubramaniam S, Kapoor R, Yeow JH et al. Biochemical evaluation of an infant with hypoglycemia resulting from a novel de novo mutation of the GLUD1 gene and hyperinsulinism-hyperammonemia syndrome. J Pediatr Endocrinol Metab 2011; 24(7-): 573–577.
61. Aso K, Okano Y, Takeda T et al. Spectrum of glutamate dehydrogenase mutations in Japanese patients with congenital hyperinsulinism and hyperammonemia syndrome. Osaka City Med J 2011; 57(1): 1–9.
62. de las Heras J, Garin I, de Nanclares GP et al. Familial hyperinsulinism-hyperammonemia syndrome in a family with seizures: case report. J Pediatr Endocrinol Metab 2010; 23(8): 827–830.
63. Flanagan SE, Patch AM, Locke JM et al. Genome-wide homozygosity analysis reveals HADH mutations as a common cause of diazoxide-responsive hyperinsulinemic-hypoglycemia in consanguineous pedigrees. J Clin Endocrinol Metab 2011; 96(3): E498-E502. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2010–1906>.
64. Di Candia S, Gessi A, Pepe G et al. Identification of a diffuse form of hyperinsulinemic hypoglycemia by 18-fluoro-L-3,4 dihydroxyphenylalanine positron emission tomography/CT in a patient carrying a novel mutation of the HADH gene. Eur J Endocrinol 2009; 160(6): 1019–1023. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0945>.
65. Christesen HB, Tribble ND, Molven A et al. Activating glucokinase (GCK) mutations as a cause of medically responsive congenital hyperinsulinism: prevalence in children and characterisation of a novel GCK mutation. Eur J Endocrinol 2008; 159(1): 27–34. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0203>.
66. Cuesta-Munoz AL, Huopio H, Otonkoski T et al. Severe persistent hyperinsulinemic hypoglycemia due to a de novo glucokinase mutation. Diabetes 2004; 53(8): 2164–2168.
67. Sayed S, Langdon DR, Odili S et al. Extremes of clinical and enzymatic phenotypes in children with hyperinsulinism caused by glucokinase activating mutations. Diabetes 2009; 58(6): 1419–1427. Dostupné z DOI: <http://dx.doi.org/10.2337/db08–1792>.
68. Pinney SE, Ganapathy K, Bradfield J et al. Dominant form of congenital hyperinsulinism maps to HK1 region on 10q. Horm Res Paediatr 2013; 80(1): 18–27. Dostupné z DOI: <http://dx.doi.org/10.1159/000351943>.
69. Tegtmeyer LC, Rust S, van Scherpenzeel M et al. Multiple phenotypes in phosphoglucomutase 1 deficiency. N Engl J Med 2014; 370(6): 533–542. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1206605>.
70. Meissner T, Friedmann B, Okun JG et al. Massive insulin secretion in response to anaerobic exercise in exercise-induced hyperinsulinism. Horm Metab Res 2005; 37(11): 690–694.
71. Otonkoski T, Jiao H, Kaminen-Ahola N et al. Physical exercise-induced hypoglycemia caused by failed silencing of monocarboxylate transporter 1 in pancreatic beta cells. Am J Hum Genet 2007; 81(3): 467–474.
72. Zhang CY, Baffy G, Perret P et al. Uncoupling protein-2 negatively regulates insulin secretion and is a major link between obesity, beta cell dysfunction, and type 2 diabetes. Cell 2001; 105(6): 745–755.
73. Gonzalez-Barroso MM, Giurgea I, Bouillaud Fet al. Mutations in UCP2 in congenital hyperinsulinism reveal a role for regulation of insulin secretion. PLoS One 2008; 3(12): e3850. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0003850>.
74. Gupta RK, Vatamaniuk MZ, Lee CS et al. The MODY1 gene HNF-4alpha regulates selected genes involved in insulin secretion. J Clin Invest 2005; 115(4): 1006–1015.
75. Pearson ER, Boj SF, Steele AM et al. Macrosomia and hyperinsulinaemic hypoglycaemia in patients with heterozygous mutations in the HNF4A gene. PLoS Med 2007; 4(4): e118. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pmed.0040118>.
76. Kapoor RR, Heslegrave A, Hussain K. Congenital hyperinsulinism due to mutations in HNF4A and HADH. Rev Endocr Metab Disord 2010; 11(3): 185–191. Dostupné z DOI: <http://dx.doi.org/10.1007/s11154–010–9148-y>.
77. Kapoor RR, Locke J, Colclough K et al. Persistent hyperinsulinemic hypoglycemia and maturity-onset diabetes of the young due to heterozygous HNF4A mutations. Diabetes 2008; 57(6): 1659–1663. Dostupné z DOI: <http://dx.doi.org/10.2337/db07–1657>.
78. Conn JJ, Simm PJ, Oats JJ et al. Neonatal hyperinsulinaemic hypoglycaemia and monogenic diabetes due to a heterozygous mutation of the HNF4A gene. Aust N Z J Obstet Gynaecol 2009; 49(3): 328–330. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1479–828X.2009.01009.x>.
79. Stanescu DE, Hughes N, Kaplan B et al. Novel Presentations of Congenital Hyperinsulinism due to Mutations in the MODY genes: HNF1A and HNF4A. J Clin Endocrinol Metab 2012; 97(10): E2026-E2030. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–1356>.
80. Flanagan SE, Kapoor RR, Mali G et al. Diazoxide-responsive hyperinsulinemic hypoglycemia caused by HNF4A gene mutations. Eur J Endocrinol 2010; 162(5): 987–992. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-09–0861>.
81. James C, Kapoor RR, Ismail D et al. The genetic basis of congenital hyperinsulinism. J Med Genet 2009; 46(5): 289–299. Dostupné z DOI: <http://dx.doi.org/10.1136/jmg.2008.064337>.
82. Staník J, Gašperíková D, Klimeš I. Monogénové poruchy sekrécie a účinku inzulínu. Bratislava. Univerzita Komenského, 2015. ISBN 978–80–223–3803–5.
83. Staník J, Rosoľanková M, Hučková M et al. Klinický manažment a DNA diagnostika detí s kongenitálnym hyperinzulinizmom. Diabetes a obezita 2012; 12(24): 42–60.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl 4-
All articles in this issue
- Adaptace tukové tkáně na redukční nízkoenergetickou dietu u obézních jedinců
- Heterogenita dětského diabetu a její terapeutické implikace
- Historie diagnostiky a léčby diabetické retinopatie
- Metabolický syndrom u nemocných s diabetes mellitus 1. typu, prevalence, vliv na morbiditu a mortalitu, komplexní přístup k nemocnému
- Frekvence a načasování jídel a změny v body mass indexu: analýza dat z Adventist Health Study-2
- Edukace pacienta s diabetem – součást komplexní terapie
- Pregestační diabetes mellitus a gravidita
- Bariatrické operace u nemocných s diabetem
- Duše jako imunomodulátor
- Syndrom diabetické nohy z pohledu internisty podiatra
- Komplex oxLDL/β2-glykoprotein I jako proaterogenní autoantigen. Je ateroskleróza autoimunitní onemocnění?
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Perspektivní molekuly pro léčbu hyperglykemie u pacientů s diabetem 2. typu
- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Obstrukční spánková apnoe a diabetes mellitus 2. typu
- Krátkodobá a dlouhodobá glykemická variabilita a její vztah k mikrovaskulárním komplikacím diabetu
- Složení makronutrientů v diabetické dietě
- Je glukóza pouze základní energetický substrát?
- Súčasné trendy v diagnostike a liečbe kongenitálneho hyperinzulinizmu
- Máme uvažovat o nové klasifikaci diabetu ovlivněné terapeutickým rozhodováním?
- Diabetes mellitus ve starším věku z pohledu klinického diabetologa
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Edukace pacienta s diabetem – součást komplexní terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

