-
Medical journals
- Career
Dětské nádory metastazující do kostní dřeně a jejich hematologický obraz
Authors: S. Valníček 1; J. Zapletal 1; J. Blatný 1; B. Jordanová 1; M. Kokeszová 1; D. Kodýtková 2
Authors‘ workplace: Oddělení klinické hematologi e FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Miroslav Penka, CSc., pracoviště Dětská nemocnice, vedo ucí lékař MU Dr. Jan Blatný, Ph. D. 1; Klinika dětské onkologi e Lékařské fakulty MU a FN Brno, pracoviště Dětská nemocnice, přednosta prof. MU Dr. Jaroslav Štěrba, Ph. D. 2
Published in: Vnitř Lék 2009; 55(Suppl 1)(Supplementum 1): 52-58
Overview
Práce uvádí přehled dětských nádorů, nejčastěji metastazujících do kostní dřeně, ve stručnosti také možné klinické a laboratorní projevy metastáz, vypočítává a hodnotí morfologické způsoby jejich průkazu, zejména při hematologickém vyšetřování aspirací kostní dřeně. Stručně si všímá morfologi e hlavních z těchto nádorů a v přílohách představuje jejich mikrofotografi e s popisem. Zmiňuje se i o možných nesnázích, k nimž může při hodnocení docházet. Cituje literární údaje a uvádí zkušenosti z vlastního pracoviště.
Klíčová slova:
dětské nádory – metastázy do kostní dřeně – morfologi e – aspirace kostní dřeněÚvod
Nádory dětského věku se odlišují od nádorů dospělých na prvém místě histogenetickým původem. Zatímco v dospělosti se vyskytují zejména malignity epiteliální, setkáváme se u dětí hlavně s nádory krvetvorného systému a se solidními tumory mezodermu a ne uroektodermu. Dětské nádory často rychle rosto u a časně metastazují. Kromě klinických a laboratorních známek, které vedo u k indikaci vyšetření kostní dřeně (KD) u nemocných dětskými nádory, je v dnešní době provedení této di agnostické metody také so učástí stagingu maligních tumorů a požadují je pa ušálně i příslušné léčebné protokoly. Druhy nádorů, které metastazují do KD, jso u rozdílné u dětí a dospělých. Zatímco u dospělých metastazují do KD kromě jiných maligních nádorů zejména karcinom plic, karcinom prostaty u mužů a karcinom prsní žlázy u žen, u dětí jso u to zejména ne uroblastom, alve olární rhabdomyosarkom (aRMS), Ewingův sarkom (ES), PNET (primitivní ne uroektodermální tumory) a retinoblastom [1,3,4].
Ačkoliv nitrolební nádory metastazují zřídka mimo klenbu lební, můžeme se dosti vzácně setkat s ložisky metastáz embryonálních CNS tumorů, zejména medulloblastomu [1,5,10].
Klinické a laboratorní projevy, které mohou vést u nádorů k podezření na metastázy do kostní dřeně
- bolesti v kostech (nejsou specifické, nelze je hodnotit u kojenců a malých dětí, moho u se objevit jako první subjektivní potíže např. i u le ukemi í)
- změny na skeletu při zobrazovacích vyšetřeních
- zvýšení kalci a a/ nebo alkalické fosfatázy v séru; v některých případech
- výskyt jaderných červených krvinek (erytroblastů) v nátěrech z periferní krve, popřípadě so učasně nález určitého počtu mladých forem granulocytů. Je‑li tento obraz provázen anémi í, mluvíme o le uko - erytroblastové anémii [1]. Tyto změny se však vyskytují hlavně u dospělých, u dětí je vidíme vzácně.
- nemusí se projevit žádná z uvedených známek
Techniky používané k průkazu metastáz do KD a jejich citlivost
Jso u to aspirace KD a trepanobiopsie KD.
Postup je následující: trepanobi opsi e i aspirace se provádí obvykle z obo u lopat kostí kyčelních, spina ilica ventralis, popřípadě z tibi e. Z aspirace se zhotovuje co největší počet nátěrů, z trepanobi optického válečku se provádí otisk nebo roztěr, pak se trepanobi optický vzorek předává patologům ke zhotovení a vyhodnocení co největšího počtu řezů. Barbara Bainová et al [1] citují několik prací, které srovnávají a hodnotí záchytnost metastáz a citlivost uvedených metodik: při přítomnosti kostních metastáz byl ve 28 % pozitivní nález infiltrace KD v nátěrech ze vzorků získaných aspirací. V preparátech z jedné trepanobi opsi e byla pozitivita u 35 – 45 % [1,6]. Jestliže jso u metastázy prokázány v trepanobi optických preparátech, jso u pak také nalezeny ve 3/ 4 i v nátěrech z aspirace. Trepanobi opsi e je tedy citlivější metodo u a její senzitivita se ještě zvětší, odebíráme‑li vzorky z obo u stran. Citlivost aspirace KD je tím vyšší, čím větší je počet vyšetřených nátěrů KD. Zvyšuje se i vyšetřením řezů ze sraženiny, získané z aspiračního vzorku [1].
V naší laboratoři speci ální morfologi e Oddělení klinické hematologi e ve Fakultní dětské nemocnici Brno hodnotíme vždy 4 nátěry z aspirace KD z levé kosti kyčelní a 4 z pravé strany. So učasně prohlížíme otisk nebo stěr z trepanobi optických vzorků, a to rovněž z obo u kostí kyčelních. Preparáty hodnotí nezávisle vždy minimálně 2 hematologové speci alisté. V některých případech se prohlíží i aspirační punktát jiných míst. Může být položena otázka, proč se vyšetřují i nátěry z aspirace, jestliže je známo, že bi optická vyšetření KD prokazují metastázy častěji a že v některých případech se najdo u metastázy jen v bi optických preparátech a v aspirátech nikoliv. Aspiráty se vyšetřují proto, že někdy je tomu opačně a pozitivní nález metastáz zjistíme jen v nátěrech z aspirací [7,8]. Za důležitý považujeme i fakt, že výsledek vyšetření aspirátu je dostupný během několika hodin, zatímco výsledek vyšetření trepanobi opsi e v řádu dnů až týdnů. Vzhledem k významnosti pozitivity či negativity průkazu metastáz je tedy nutné provádět obě metody so učasně. Je tomu tak zejména u stagingu v době stanovení di agnózy u solidních tumorů, u dětí např. u ne uroblastomu (u dospělých u karcinomu prsu a plic). Obě vyšetření paralelně jso u indikována také tehdy, je‑li velmi pravděpodobné, že jso u metastázy přítomny, a jestliže jejich průkaz ovlivní výběr bezprostřední léčby [1].
Hodnocení aspirátů KD při pátrání po metastázách
Nejprve hodnotíme nátěr jako obvykle, přehledným zvětšením, prohlížíme jeho okraje, poněvadž na nich bývají přítomny větší buňky, což moho u být některé buňky nádorové, nebo shluky tumorózních buněk, např. rozety. Ty nacházíme nejčastěji u ne uroblastomu, méně často u Ewingova sarkomu a ostatních PNET. Pozorné prohlížení je nutné, zejména není‑li na první pohled, tj. např. již v přehledném zvětšení, patrná masivní infiltrace nádorem [9]. Nasajeme‑li při aspiraci velké množství KD, moho u být jednotlivé nádorové buňky rozptýleny mezi buňkami krvetvorné dřeně. Samozřejmě záchytnost hematologické di agnostiky dřeňových metastáz se zvyšuje s počtem prohlédnutých nátěrů KD. Na našem pracovišti toto hodnocení provádí, jak shora řečeno, minimálně 2 lékaři hematologové, kteří mají zkušenosti ve speci ální morfologii. U metastáz některých dětských nádorů může být v určení druhu nádoru důležité cytochemické vyšetření. Je‑li k dispozici otisk z primárního nádorového ložiska, může být srovnání jeho morfologi e cenno u pomocí v di agnostice metastáz, i když morfologi e metastatických buněk se může v praxi od morfologi e základního tumoru lišit. Je to způsobeno mezi jiným i techniko u otisku a rozprostřením buněk v nátěru z aspirace.
Jednotlivé shora jmenované dětské nádory metastazující do KD a morfologie jejich metastáz
Neuroblastom
Postihuje nejčastěji děti do 1 roku věku. Patří společně s rhabdomyosarkomem a Ewingovým sarkomem (ES) k maligním tumorům, nejčastěji infiltrujícím kostní dřen. Je vůbec nejčastější nehematologicko u malignito u, která u dětí infiltruje KD [10]. V systematice nádorů je uváděn spolu s gangli one uromem a gangli one uroblastomem ve skupině ne uroblastomových nádorů. Jeho histologické typy jso u: nediferencovaný, málo diferencovaný a diferencovaný. Buňky ne uroblastomu (obr. 1 a 2) jso u malé, s kulatým nebo oválným jádrem a malým množstvím cytoplazmy. Někdy k jejich poznání pomůže i excentrické uložení jádra, ale jednotlivé buňky tohoto nádoru jso u v KD téměř neidentifikovatelné. Mají obvykle vysoký N/ C poměr a často se podobají malým blastům ALL (L 1, resp. L 2), což může činit potíže, zejména jestliže infiltrace KD ne uroblastomem je masivní. Tehdy se zmíněná di agnóza může vnucovat, obzvláště pokud byla punkce KD prováděna jako jedno z prvních vyšetření, např. pro periferní anémii a trombocytopenii, a neznáme‑li ještě výsledky ostatních vyšetření. Pro odlišení však obvykle pomůže radi ologický obraz a průkaz katecholaminů v moči, většino u i klinický nález. Ne uroblasty tvoří často rozety, které nacházíme nejčastěji na okrajích preparátu, kde po nich pátráme nejprve přehledným zvětšením, stejně jako to děláme při hledání megakaryocytů. Tvorba rozet není u jiných malobuněčných nádorů dětského věku obvyklá (ojediněle u ES). Buňky ne uroblastomu mají, stejně jako buňky medulloblastomu, pozitivní re akci na a - naftylacetátesterázu (ANAE), ale mají odlišno u morfologii od buněk monocytární lini e a pro monocytární linii specifická butyrátesterása (BE) je u nich negativní [10,14]. Di agnosticky významný je nález ne urofibril, obvykle u shuku ne uroblastů nebo v rozetách, občas i samostatně. Při panoptickém barvení se ne urofibrily jeví jako světle růžová až růžově fi alová vláknitá hmota.
Image 1. Neuroblastom: velký svazek růžovofialových neurofibril, obklopujících metastázu neuroblastomových buněk v KD. U některých není patrná cytoplazma. V okolí několik malých lymfocytů, u levého okraje myelocyt, nad ním metamyelocyt (na obrázku četné erytrocyty v rouleaux). 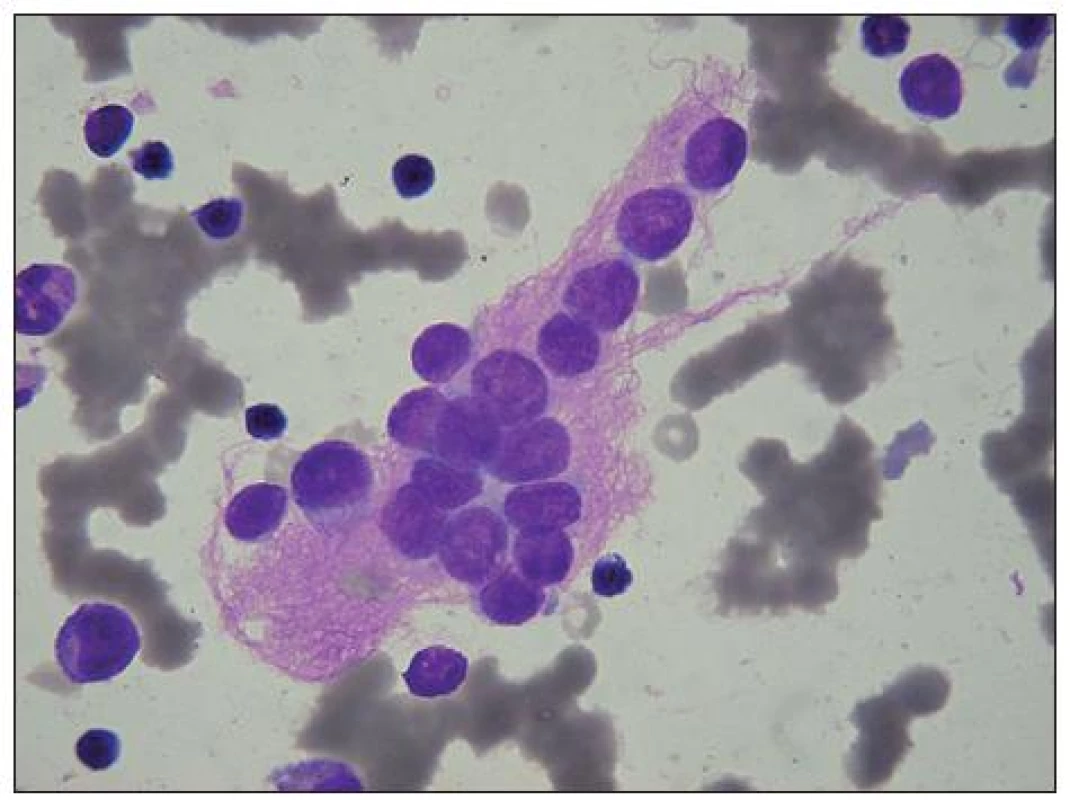
Image 2. Neuroblastom – pro srovnání otisk primárního tumoru. Rozetovitý útvar neuroblastomových buněk s ganglioidní diferenciací. Velká světlá, částečně excentricky uložená jádra, s velkými jadérky. Místy vakuoly v cytoplazmě. V pravé horní části rozetky ojedinělé fagocytované erytrocyty. 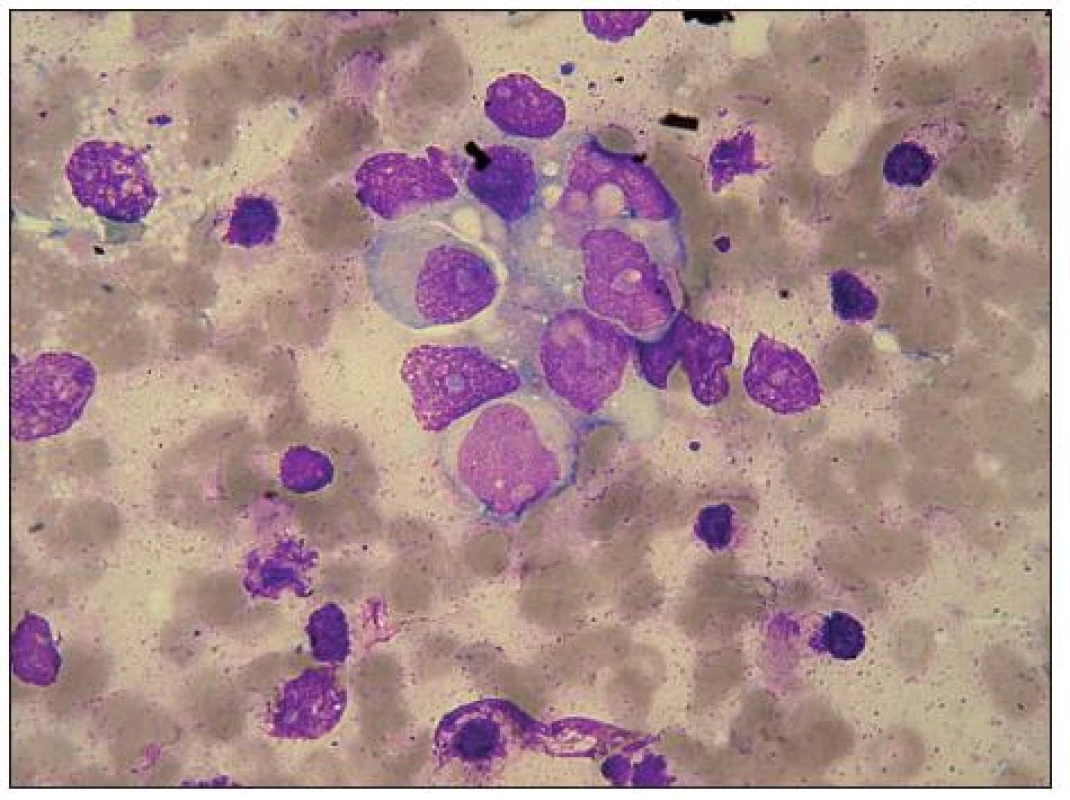
Sarkomy měkkých tkání (STS) a nejčastější z nich – rhabdomyosarkom (RMS) – alveolární typ
Tvoří 5 – 8 % pedi atrických malignit. Vyskytuje se nejčastěji u dětí do 5 let [20]. U RMS, di agnostikovaných ve IV. stadi u, má dřeňové metastázy již 30 % postižených dětí [10]. V nátěrech z aspirátů KD jeho metastázy pozůstávají z buněk značně vari abilního tvaru (obr. 5). Jádra bývají kulatá, oválná až mírně laločnatá, jaderný chromatin v malých buňkách hutnější, ve větších řidší, ale hrubě zrnitý až hrubě trámčitý. Cytoplazma středně bazofilní, s acidofilním perinukle árním projasněním. Nacházíme i buňky dvo ujaderné a vícejaderné buňky s „nafo uklo u“ cytoplazmo u nebo rhabdomyoblasty vřetenovitého tvaru. Periferní cytoplazma je obvykle vyplněna vakuolovitými, při panoptickém barvení prázdnými prostůrky [14,16,20], které moho u splývat a vytvářet tzv. „jezírka“ („lakes“) (obr. 6, 7 a 8). Cytochemicky PAS re akcí je ve vakuolách a „lakes“ prokazován glykogen (obr. 9). To může být di agnosticko u pomůcko u. V některých případech buňky RMS fagocytují, zejména erytrocyty, ale i např. buněčná jádra. Tvorba rozet v nátěrech se u RMS ne uvádí. Mezi našimi nemocnými jsme občas našli malé buněčné skupiny, které rozety připomínaly (obr. 5). Alve olární RMS bývá spojen s translokacemi t(2;13)(q37;q14) nebo t(1;13)(p13;q14) [10].
Image 3. Malý rozetoidní trs rhabdomyoblastů v KD. Buňky s velkým jádrem, cytoplazma je vakuolisovaná a stejně jako na předchozím obrázku je na periferii bazofilní, perinukleárně acidofilní. Buňky v horní části splývají, snad jde o jednu vícejadernou buňku. V levé dolní části shluku je dvoujaderná buňka, v levém dolním rohu holé jádro, plazmocyt a bazofilní normoblast. 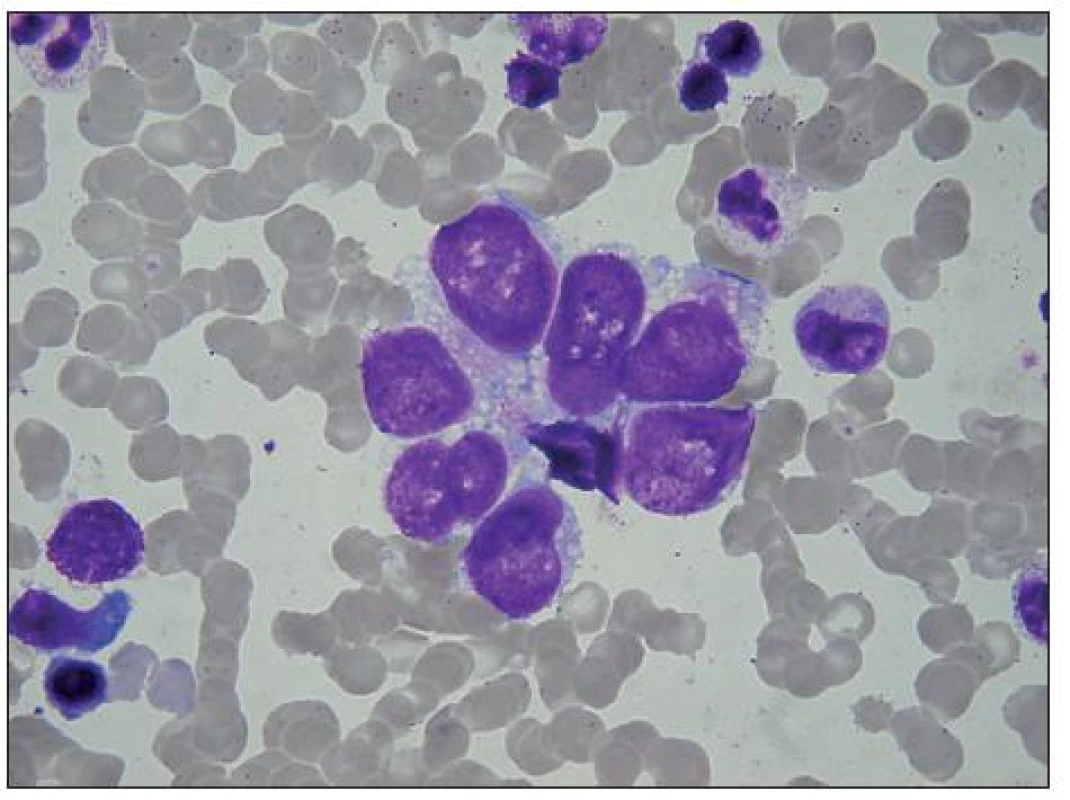
Image 4. Velké ložisko RMS buněk v KD, prostoupené četnými vakuolami, které místy splývají a vytvářejí tak tzv. „jezírka“ (lakes). Místy je naznačena fagocytóza erytrocytů. 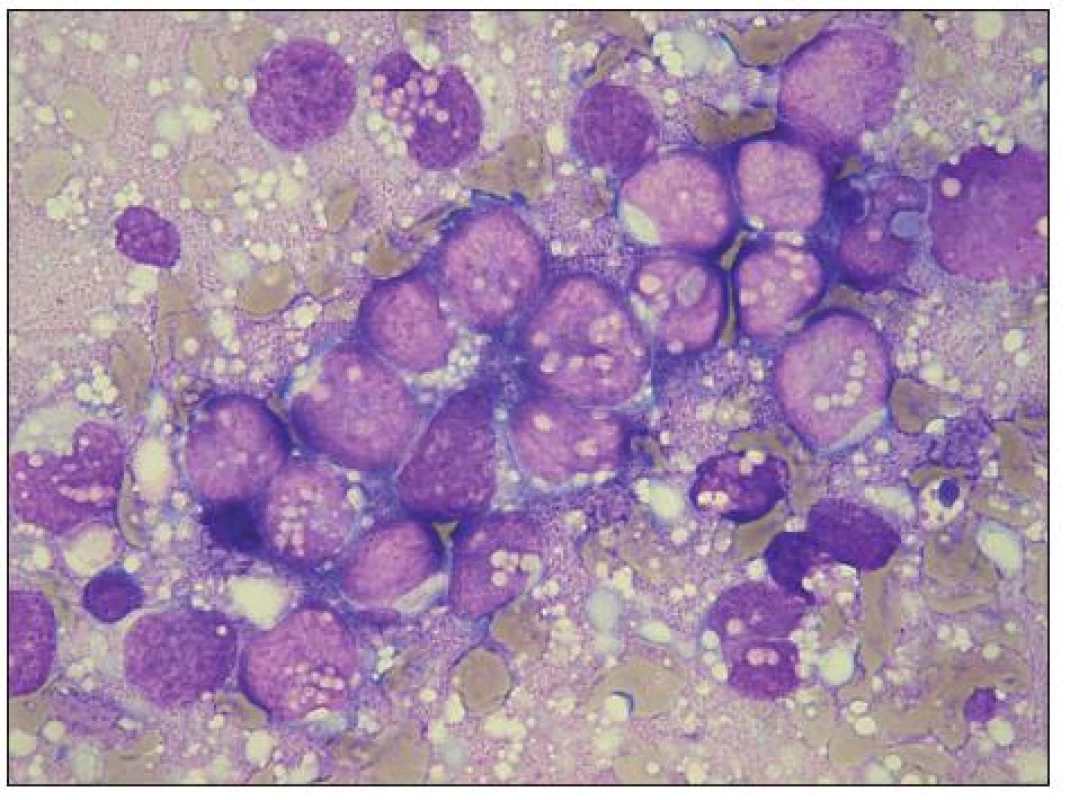
Image 5. Centrálně velká vícejaderná rhabdomyosarkomová buňka s nepravidelnou jadernou membránou a řidším, hrubším chromatinem. Obsahuje vakuoly, „jezírka“, fagocytuje erytrocyty. Vlevo tři RMS buňky s vakuolami a malými „jezírky“, vpravo malá buňka s hutným chromatinem, ale velkými vakuolami (netypická). Nad ní malý nahojaderný lymfocyt, dole uprostřed svraštělý eosinofil. 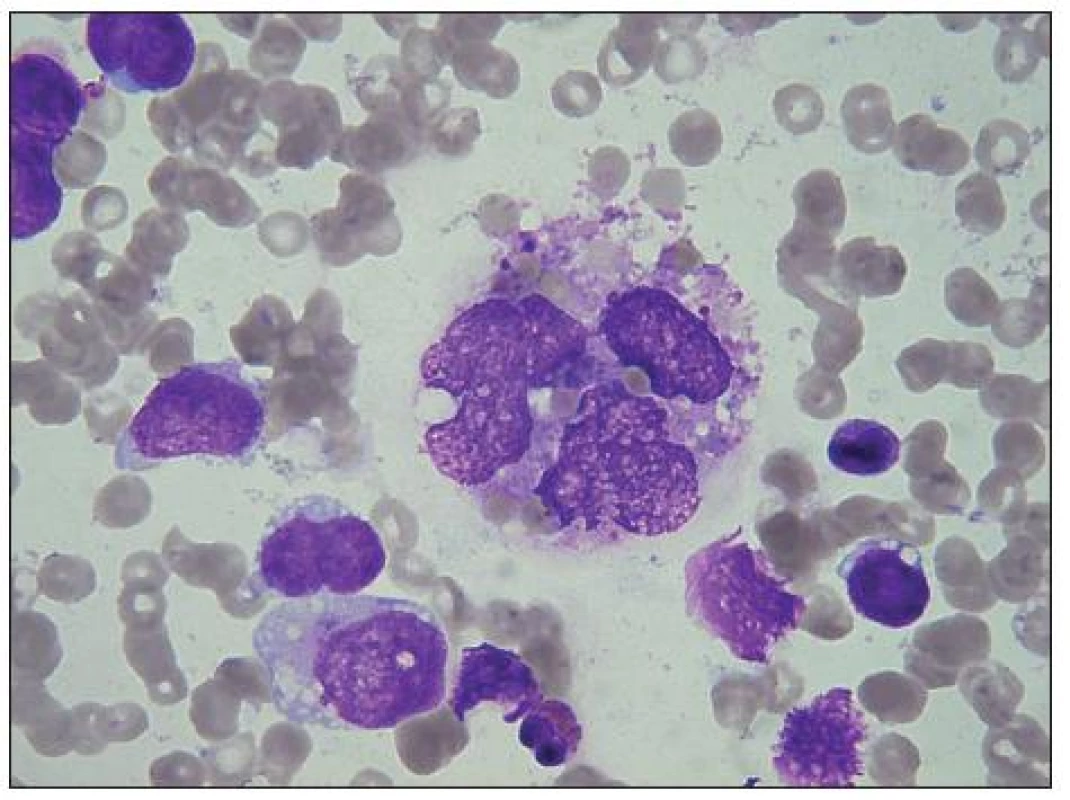
Image 6. Centrálně a uprostřed dole dvě buňky RMS, fagocytující zbytky buněk, buněčných jader a fragmenty erytrocytů. Nejde o fagocytující histiocyty. Dále v těchto buňkách vidíme, velké vakuoly, nápadná jsou zde hlavně „jezírka“, „lakes“ (viz šipky), vzniklá splynutím vakuol, velmi častá u buněk RMS, takže jsou diagnostickou pomůckou. Na snímku jsou ještě další buňky RMS a jejich holá jádra, vlevo segmentovaný neutrofil a na dolním okraji je viditelná ½ neutrofilního segmentu. 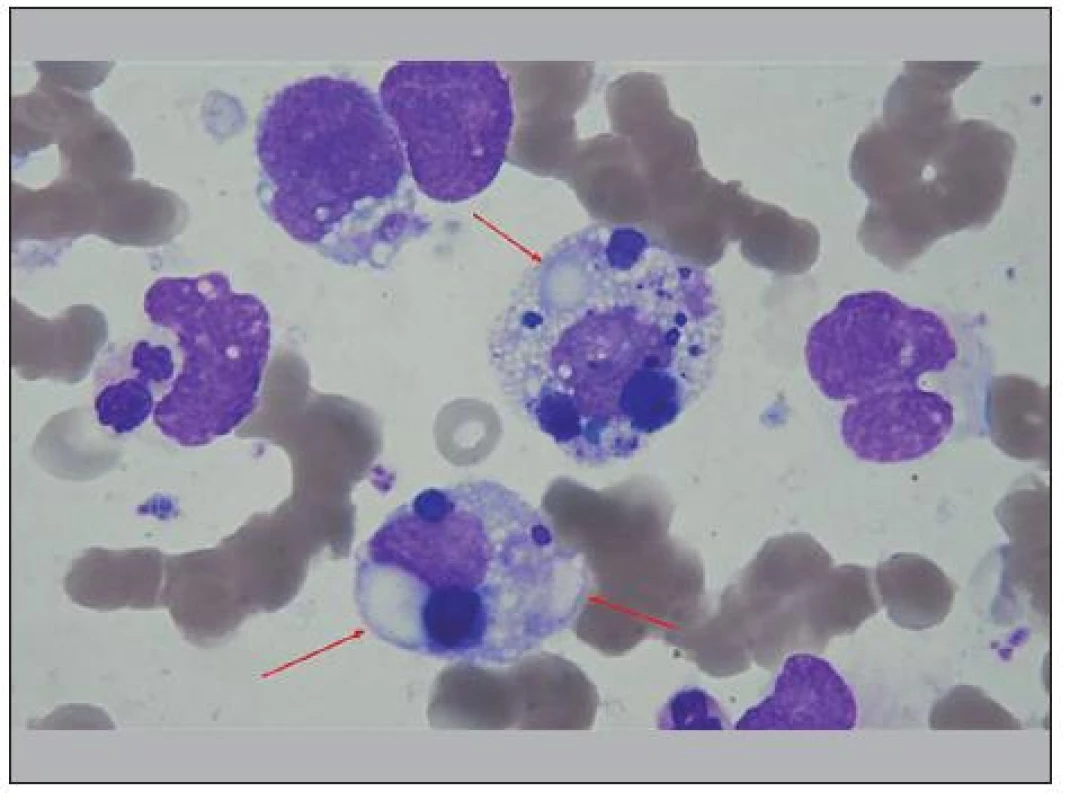
Image 7. Vakuoly a „jezírka“ v buňkách RMS nejsou ve skutečnosti prázdné prostory, jsou vyplněny glykogenem, což potvrzuje silně positivní PAS reakce. 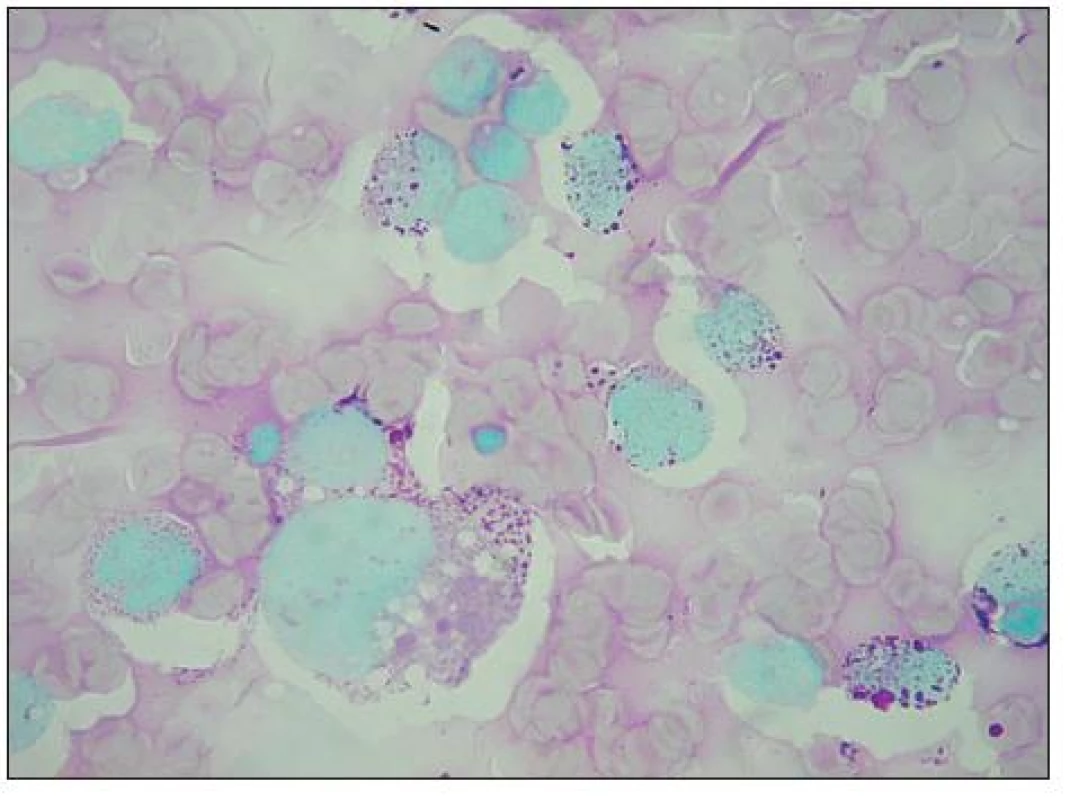
Ewingův sarkom (ES) a primitivní neuroektodermální tumory (PNET)
ES je primitivním, vysoce maligním nádorem měkkých tkání a kostí, obyčejně metastazujícím do KD, kostí a plic. Vyskytuje se převážně u dětí a mladistvých. Skupina nádorů ES je histologicky tvořena malými uniformními buňkami s minimální morfologickou diferenci ací, nebo většími, méně uniformními s různým stupněm ne uroektodermální diferenci ace, přitom ES bývá méně diferencován. ES a PNET se překrývají do značné míry po stránce histologické, sdílejí tutéž translokaci t(11;22)(q24;q12) a téměř všechny buňky exprimují membránový antigen CD 99 [1,10,11]. Zatímco ES bývá v kostech, PNET nacházíme v měkkých tkáních. Nyní jso u většino u považovány za odlišno u expresi téhož nádorového typu. Z hlediska morfohematologického (obr. 10) vidíme u ES v hematologických nátěrech KD při nálezu metastáz někdy buněčno u anizocytózu, jadérka bývají patrná ve velkých buňkách, v malých obvykle zřetelná nejso u, nepravidelně vybarvená cytoplazma je šedomodrá, resp. světle bazofilní, v některých buňkách bývají drobné vakuoly. U ES a PNET můžeme buněčné rozety najít zřídka (udává se 10% výskyt), zatímco u ne uroblastomu tvoří nádorové buňky rozety často. U ostatních jmenovaných metastazujících dětských nádorů se rozety údajně nenacházejí.
Image 8. Ložisko buněk Ewingova sarkomu v KD s výraznou anisocytózou. Větší buňky s řidším trámčitým chromatinem mají patrná modravá jadérka, která nevidíme v menších jádrech s chromatinem tmavěji se barvícím. Světlá, modrošedá cytoplazma, nepravidelně vybarvená, hranice mezi buňkami splývají. Ve dvoubuňkách s bazofilnější cytoplazmou a ohraničenou buněčnou membránou jsou patrné vakuoly. V několika buňkách bazofilní inkluze. Vlevo nahoře malý lymfocyt, ve střední části pole vlevo dva neutrofilní segmenty a polychromní normoblast, v dolní části od leva lymfocyt, polychromní normoblast a metamyelocyt. 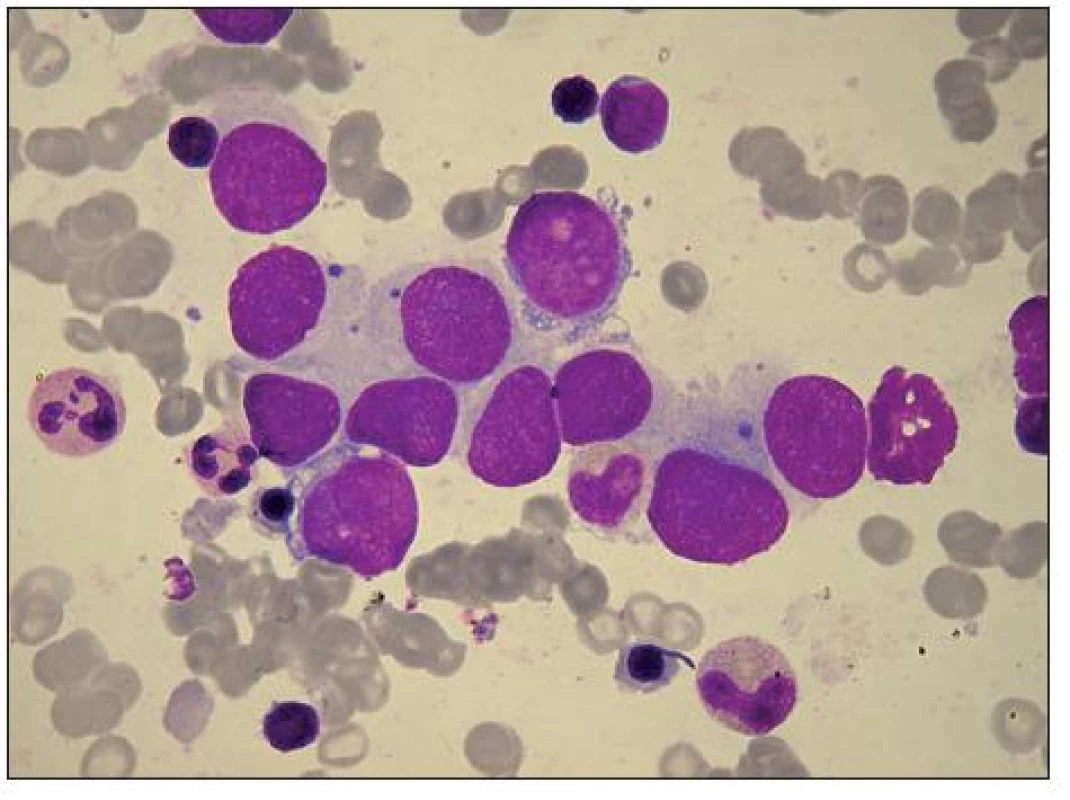
Medulloblastom
Tento maligní, invazivní embryonální tumor je tumorem intrakrani álním (vermis, čtvrtá komora, mozeček) [15]. Ty tak často do kostní dřeně nemetastazují [1,10]. Bývá lokalizován v zadní jámě lební, po stránce patologické je považován za nádor ne urogenní, stejně jako ne uroblastom, s nímž má podobno u mikroskopicko u skladbu. Některými patology je také považován za formu ne uroblastomu. Tvořívá někdy buněčné rozety. Má s ním také stejné cytochemické vlastnosti, které pomáhají určit jeho metastázy v KD, tj. pozitivitu ANAE (obr. 4) a negativitu BE. Má však pestřejší morfologii v hematologických preparátech, jak vidíme na fotografi ích (obr. 3), tj. jádra nejen kulatá, ale i laločnatá, nepravidelná, o něco menší N/ C poměr, u některých buněk i poměrně dosti široko u cytoplazmu, mívá vakuoly jádra i cytoplazmy. Tato větší morfologická pestrost činí nepravděpodobno u záměnu infiltrace KD jeho buňkami za ALL (snad jen s výjimko u L 3), což činí ještě nepravděpodobnějším nitrolební lokalizace jeho primárního ložiska.
Image 9. Medulloblastom, velký shluk maligních buněk, metastáza v kostní dřeni. Zejména ve srovnání s neuroblastomem je zřetelná polymorfie tvaru i velikosti buněk i jader, ta jsou spíše excentricky uložená, nepravidelná, až laločnatá, ojediněle s velkými jadérky. Výrazná vakuolizace bazofilní cytoplazmy, zčásti i jádra. Vlevo nahoře segmentovaný neutrofil a hypogranulární myelocyt. 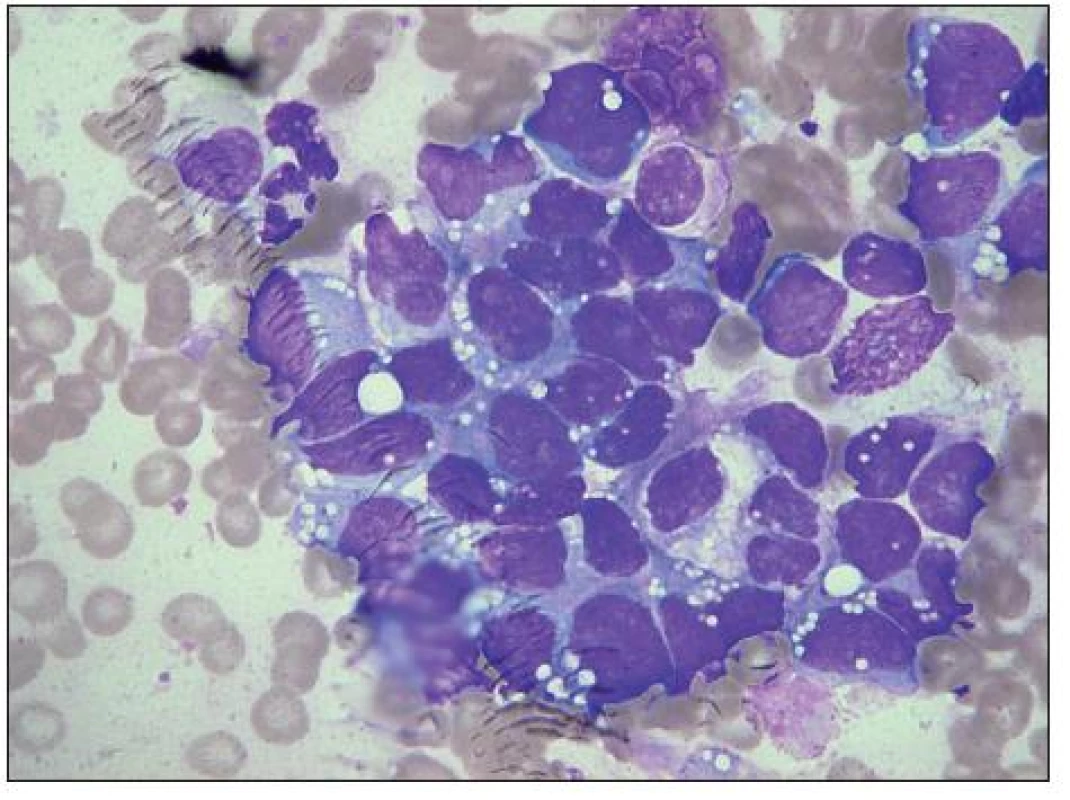
Image 10. Reakce na nespecifickou alfa-naftylacetát-esterázu (ANAE) je u buněk medulloblastomu stejně jako u neuroblastomu pozitivní. 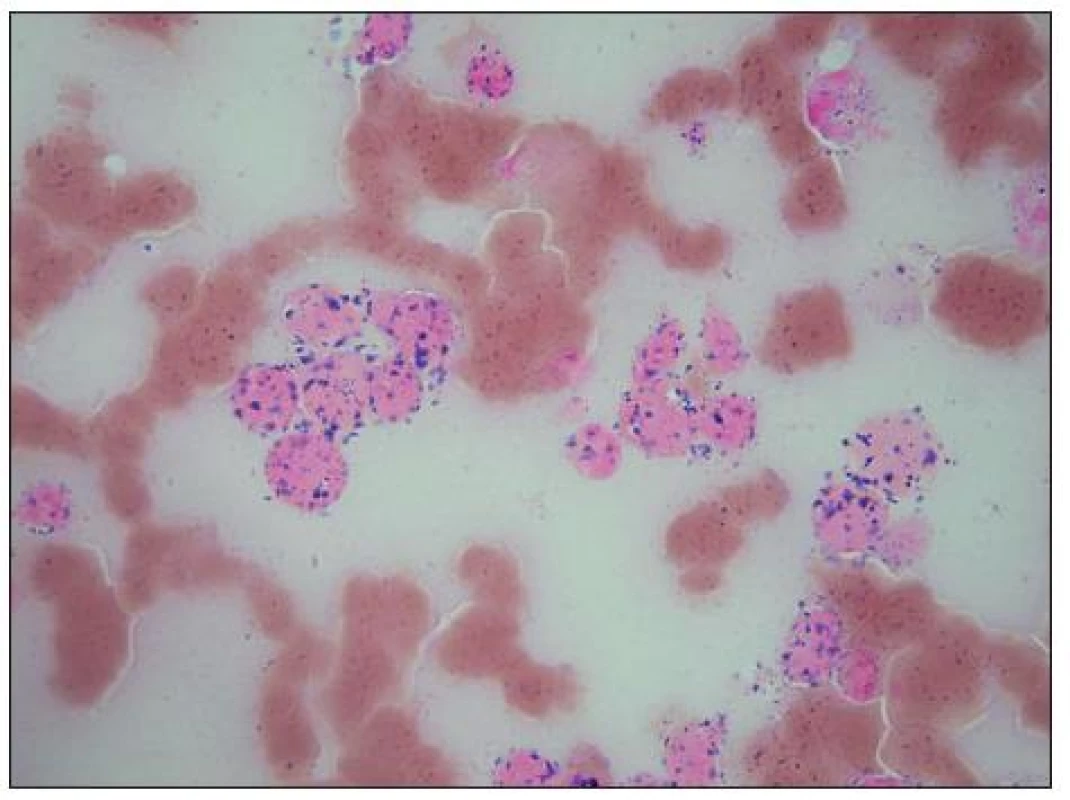
Retinoblastom
Je to další z dětských malobuněčných nádorů, s relativně malým kulatým jádrem. O tomto tumoru je nutno se zde zmínit, poněvadž se uvádí mezi tumory metastazujícími u dětí do KD, metastazuje ale velmi vzácně [20]. I když se vyskytoval mezi našimi nemocnými, nenašli jsme žádný případ dřeňových metastáz. Retinoblastom bývá spojen s chromozomální abnormalito u 13q– [10].
Význam vyšetřování KDve stagingu solidních tumorů
Vyšetření a hodnocení aspirace a trepanobi opsi e KD u dětí je na onkologických pracovištích samozřejmo u so učástí komplexního vstupního vyšetření, např. u ne uroblastomu [1]. Uvádí se [12], že v čase stanovení vstupní di agnózy je infiltrace ne uroblastomem v KD pozitivní asi u 1/ 2 těch dětí, které mají metastatická ložiska v jiných lokalizacích. Při tom je častá neshoda mezi nálezem v nátěrech z aspirace KD a trepanobi opsi emi. Byla např. nalezena pozitivita jen v trepanobi opsii ve 20 %, zatímco v aspirátu byly nalezeny metastázy u 7 % dětí, u nichž byla trepanobi opsi e negativní. Pokud se vyšetřovaly aspirační i trepanobi optické vzorky z levé i z pravé kosti kyčelní, sto upla při stagingu pozitivita asi o 10 %, což není zdaleka zanedbatelné. I tak musí být prohlížení velmi pozorné, protože nádorové buňky můžeme najít často jen v ojedinělých ložiscích [9,13]. Z toho vyplývá, že nelze zanedbat ani jeden z těchto dvo u způsobů. V so učasnosti by byl jiný postup již di agnostickým opomenutím. Vždy musí být vyšetřena jak trepanobi opsi e, tak aspirace. Pracoviště bi optická mají ještě možnost, aby v případech, kdy nálezy nelze považovat za přímo di agnostické, ale jen podezřelé, po užila vyšetření imunohistochemická, např. u ne uroblastomu průkaz NB - 84, chromograninu - A, jehož negativita však výskyt ne uroblastomu údajně nevylučuje [15], nebo rozporně hodnocené ne uron - specifické enolázy [15,16]. U alve olárního RMS je doporučováno vyšetření na desmin, myogenin, myo D1 [15], u ES vyšetření membránového CD 99 [15]. Širší pojednávání bi optických metod je však mimo rámec tohoto referátu. Jak zde bylo již na jiných místech zmíněno, hematolog má jako pomůcku při vyšetření na metastázy v nátěrech po užití různých vyšetření cytochemických, což ovšem nepomůže např. u nálezu jednotlivé podezřelé buňky v nátěru KD. Zatímco cytochemické metody jso u na hematologických pracovištích běžné, po užívání imunocytochemických vyšetření nátěrů z aspirace KD u nás zatím zavedeno není. Ale některé zahraniční práce je doporučují. Je to např. po užití protilátek proti ne uro‑ektodermálním antigenům UJ13A a UJ127.11 u ne uroblastomu [17,18].
Úskalí a možné nesrovnalosti
Při hodnocení hematologických vzorků by u zkušeného pracovníka nemělo dojít k záměně např. komponent normální kostní dřeně za metastatické nádorové buňky. Literatura však upozorňuje na nesnáze se záměno u megakaryocytů, rozmačkaných erytrocytů, oste oblastů, oste oklastů, makrofágů, endoteli í a fibroblastů [1]. Nicméně, a utorům tohoto článku se zdá nepravděpodobné, že by erudovaný hematolog mohl většinu uvedených elementů zaměnit s maligními buňkami, které zde byly uvedeny. Připo uštíme možnost pochyb snad u některých nezralých, malých dysplastických megakaryocytů, nebo megakyryoblastů a některých atypických histi ocytů, např. při srovnání se solitární buňko u rhabdomyocytu, Ewingova sarkomu, nebo u ne uroblastomu při srovnání s lymfocyty, s blasty akutní le ukemi e, případně možnost pochyb při srovnání vakuolizované buňky medulloblastomu s buňko u Burkitttova lymfomu, nebo blastem L3, samozřejmě u všech také vice versa. Maligní buňka by mohla být takto zaměněna za buňku, která se může vyskytno ut v normální KD, nebo za buňku některé hematologické malignity. Za metastázu maligních elementů může být považován např. přebarvený trs slepených oste oblastů [1]. Pochyby a záměny moho u nastat zejména u buněk poškozených, částečně rozdrcených při natírání preparátu, nebo při posuzování nátěru KD v tlusté, nerozetřené a přebarvené počáteční části, což by se proto nemělo dít. V knize [1] Barbary J. Bainové et al (str. 456) se např. upozorňuje, že v případě, je‑li před vpichem bi optické jehly protínána kůže malým řezem a po užije se jednorázová jehla, může se dostat do získaného materi álu částečka kůže, potní žlázy,vlasového váčku nebo kosterního svalu. Zde je připomínáno, že při podezření na nepatřično u příměs, zalito u do parafinového bloku při histologickém vyšetření, je možno po užít k rozlišení molekulární analýzu (PCR) nebo vyšetření histokompatibilitních antigenů (HLA typizace) [19], resp. povrchových CD markerů. To ovšem není možné při hodnocení hematologického preparátu nátěru KD. Stalo se naším zvykem, že ke každému preparátu pořizujeme paralelně s hodnocením mikroskopicko u fotodokumentaci, ktero u archivujeme, a takto dokumentujeme i každo u významno u solitární buňku nejasného původu, aby ji mohlo poso udit více pracovníků, popřípadě aby mohla taková fotografi e být odeslána e‑mailem na jiné pracoviště ke konzultaci. Pokud je to možné, barvíme a srovnáváme při hodnocení metastáz v KD otisk primárního tumoru, jak to doporučují i jiná pracoviště [20].
Table 1. Počty pacientů s jednotlivými diagnózami, kteří byli léčeni na Klinice dětské onkologie FN Brno v letech 1998–2007, a uvádí frekvenci infiltací KD nádorovými buňkami. 
Závěr
Víceleté zkušenosti v pátrání po metastázách solidních dětských nádorů, často metastazujících do kostní dřeně, je platno u metodo u jak pro staging na počátku di agnózy, tak pro sledování výskytu metastáz průběhu léčby, popřípadě po ní. Toto vyšetření musí být u dětí prováděno minimálně z obo ustranných aspirací KD z hřebenů kostí kyčelních. Hodnocení by měli provádět minimálně 2 erudovaní lékaři hematologové s dostatečně dlo uho u morfologicko u erudicí v hodnocení patologických kostních dření, popřípadě ještě jeden supervisor. Je‑li k dispozici nátěr nebo otisk z povrchu trepanobi optického válečku, je jeho poso uzení vhodným způsobem ke zvýšení citlivosti vyšetření. Bezpodmínečné je so učasné hodnocení histologické z trepanobi opsi í, které provádí zkušený histopatolog.
MUDr. Svatopluk Valníček
www.fnbrno.cz
e-mail: valnicek.s@seznam.czDoručeno do redakce: 10. 4. 2009
Sources
1. Bain BJ, Clark DM, Lampert IA et al. Bone Marrow Pathology. Oxford: Blackwell Sci ence 2001; 430 – 447, 456 – 457.
2. Finkelstein JZ, Ekert H, Isaacs H et al. Bone marrow metastases in children with solid tumo urs. Am J Dis Child 1970; 119 : 49 – 52.
3. Delta BG, Pinkel D. Bone marrow aspirati on in children with malignant tumo urs. J Paedi atr 1964; 64 : 542 – 546.
4. Kleinschmid - Demasters BK. Bone marrow metastases from gli oblastoma multiforme. Cum Pathol 1997; 27 : 197 – 202.
5. Hoffmann M, Heinrich D, Dingeldein Det al. Medulloblastoma with oste oblastic metastasis and bone marrow fibrosis. Bone Marrow Transplant 1999; 23 : 631.
6. Suprun H, Ryvlin AM. Metastatic carcinoma in histologic secti ons of aspirated bone marrow: a comparative a utopsy study. So uth Med J 1976; 69 : 438 – 439.
7. Savage RA, Hoffman GC, Shaker K. Di agnostic problems involved in detecti on of metastatic ne oplasms by bone marrow aspirate compared with needel bi opsy. Am J Clin Pathol 1978; 70 : 623 – 627.
8. Singh G, Kra use JR, Breitfeld V. Bone marrow examinati on for metasatatic tumo ur. Cancer 1977; 40 : 2317 – 2321.
9. Che ung NKV, Heller G, Kushner BH et al. Detecti on of metastatic ne uroblastoma in bone marrow: when is ro utine marrow histology insensitive? J Clin Oncol 1997; 15 : 2807 – 217.
10. Mufti GJ, Flandrin G, Schaefer HE et al. Atlas of malignant haematology London: Martin Dunitz Ltd. Reprint 1997; 356, 366 – 368.
11. Toretzky JA, Kalebic T, Blahasley V et al. The insulin like growth factor - 1 receptor is required for EWS/ FLI - 1 transformati on o fibroblasts. J Bi ol Chem 1997; 272 : 30822 – 30827.
12. Franklin IM, Pritchard J. Detecti on of bone marrow invasi on by ne uroblastoma is improved by sampling at two sites with aspirates and bi opsi es. J Clin Pathol 1983; 36 : 1215 – 1218.
13. Reid MM. Detecti on of bone marrow infiltrati on by ne uroblastoma in clinical practice: how far have we come? Eur J Cancer A Gen Top 1994; 30 : 134 – 135.
14. Kačírková P, Campr V. Hematologický atlas krve a kostní dřeně. Praha: Grada 2007; 251 – 252.
15. Gi angaspero F, Bigner SH, Kleihues P et al. Medulloblastoma. In: Kleihues P, Cavenee WK World He alth Organisati on Classificati on of Tumo urs. Pathology & Genetics Tumo urs of the Nervo us System. Oxord University Press, IARC Press, Lyon 2000; 6 – 7, 129, 141, 153.
16. Reid MM, Sa unders PWG, Bown N et al. Alve olar rhabdomyosarcoma infiltrating bone marrow at presentati on: the value to di agnosis of bone marrow trephine bi opsy specimens. J Clin Pathol 1992; 45 : 759 – 762.
17. Rogers DW, Trele avan JG, Kemshe ad JT et al. Monoclonal antibodi es for detecting bone marrow invasi on by ne uroblastoma. J Clin Pathol 1989; 42 : 422 – 426.
18. Carey PJ, Thomas I, Buckle G et al. Immunocytochemical examinati on of bone marrow in disseminated ne uroblastoma. J Clin Pathol 1999; 43 : 9 – 12.
19. Salisbury J, Byers P. The staging of ne oplasi a. In: Salisbury J, Wo ods C, Byers P(eds). Dise ases of Bones and Jo ints: Cell Bi ology, Mechanisms, Pathology. London: Chapmann and Hall 1994.
20. Collins RD, Swerdlow SH. Pedi atric Hematopathology. New York, Edinburgh, London, Philadelphi a: Churchill Livingstone 2001; 18, 162.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue Supplementum 1-
All articles in this issue
- Léčba chronického srdečního selhání v interní ambulanci
- Léčba hypertenze u obezity
- Rozdíly mezi muži a ženami u akutního srdečního selhání
- Nová klasifikace Ph negativních chronických myeloproliferativních nemocí v přehledu
- Akutní krvácení z horní části gastro intestinálního traktu
- Přetížení železem – novinky v patogenezi a léčbě
- Léčba chronické myeloidní leukemie (CML) v éře imatinibu
- Maligní lymfomy trávicího traktu
- Současné možnosti diagnostiky a léčby systémové AL-amyloidózy
- Problematika porúch hemostázy pri metabolickom syndróme
- Protrombotický stav pri NAFLD a jeho dôsledky
- Liečba diabetika s ischemickou chorobou srdca
- Zmeny vo funkčnom renálnom náleze po maratónskom behu, po 100-kilometrovom behu a po 24-hodinovom dlhotrvajúcom behu
- Histiocytární choroby
- Diferenciální diagnostika eozinofilie
- Zahraniční styky Československé hematologické společnosti v letech 1951– 1989
- Di abetik, paci ent internisty
- Indikace k vyšetření rizikových faktorů žilní trombózy
- Hemofili e z pohledu vývoje zajištění péče o nemocné
- Dětské nádory metastazující do kostní dřeně a jejich hematologický obraz
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika eozinofilie
- Přetížení železem – novinky v patogenezi a léčbě
- Histiocytární choroby
- Akutní krvácení z horní části gastro intestinálního traktu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

