-
Medical journals
- Career
Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
Authors: A. Šuláková 1; O. Pozler 2; Nováčková L.† 3; D. Šalounová 4
Authors‘ workplace: Klinika dětského lékařství, FN Ostrava, přednosta doc. MUDr. M. Hladík, Ph. D., Dětská klinika, FN Hradec Králové , přednosta prof. MUDr. M. Bayer, CSc., Ústav klinické biochemie, FN Ostrava , přednosta RNDr. Z. Švagera, Ph. D., Ekonomická f 1
Published in: Čes-slov Pediat 2012; 67 (1): 3-10.
Category: Original Papers
Overview
Pozadí:
Prevalence anémie u nespecifických střevních zánětů (NSZ) je vysoká a významně ovlivňuje kvalitu života, morbiditu i mortalitu těchto nemocných. Deficit železa (ID = iron deficiency, IDA = iron deficiency anemia), chronický zánět (ACD = anemia of chronic disease) a nebo kombinace obou těchto stavů (ACD/ID) jsou její nejčastější příčinou. Diagnostika ID při současně probíhajícím zánětu může být obtížná. Tradiční parametry indikující deficit železa (sérové železo, saturace transferinu, feritin) jsou ovlivněny zánětem a jejich interpretace může být komplikovaná. Normální koncentrace feritinu při probíhajícím zánětu ID nevylučuje. Omezenou výpovědní hodnotu feritinu při koexistenci zánětu zlepší solubilní transferinový receptor (sTfR) a kalkulace sTfR/F indexu (sTfR/log feritin).Cílem studie bylo u dětí s NSZ při stanovení diagnózy:
1. zjistit celkovou prevalenci anémie, 2. zjistit prevalenci jednotlivých typů (ACD, IDA a ACD/ID), 3. porovnat v diagnostice anémie a deficitu železa tradičně užívané laboratorní testy s vyšetřením sTfR a sTfR/F indexem.Metody:
Do souboru bylo zařazeno 56 pacientů s nově diagnostikovaným NSZ v období mezi lednem 2005 a prosincem 2009. Kritéria pro zařazení do souboru byla: nově stanovená diagnóza NSZ splněním diagnostických kritérií a horní věková hranice 19 let. U všech nemocných byl vyšetřen kompletní krevní obraz, sérové železo, vazebné kapacity, feritin, sTfR a kalkulován sTfR/F index. Jako indikátor zánětu byl zvolen C-reaktivní protein >5 mg/l. Anémie byla definována hodnotou hemoglobinu -2 SD vzhledem k věku a pohlaví. Anemičtí pacienti byli rozděleni do 3 skupin (IDA, ACD/ID, ACD) podle výsledků tradičně užívaných parametrů a podle hodnot sTfR a sTfR/F indexu. Následně bylo provedeno porovnání obou metod.Výsledky:
Anémie byla zjištěna u 66,1 % pacientů, statisticky významně častěji u nemocných s Crohnovou nemocí (CN). U nemocných s ulcerózní kolitidou (UC) byla zjištěna pouze IDA (37,5 %), zatímco u CN byla zjištěna anémie u 77,5 % a převažovala ACD a ACD/ID. Rozdíl v prevalenci jednotlivých typů anémie byl mezi CN a UC statisticky významný.
Shoda v diagnóze mezi tradičními testy a testy s využitím sTfR/F indexu byla u IDA statisticky významná (p <0,0001), u ACD/ID shoda nastala při zvýšení cutoff feritinu na <20 µg/l. Zjistili jsme přesah hodnot sTfR mezi neanemickou a anemickou populací a jeho omezenou schopnost samostatně diagnostikovat ID ve srovnání s feritinem. Tento nedostatek byl odstraněn kalkulací sTfR/F indexu. ROC analýza prokázala výbornou diskriminaci pomocí sTfR/F indexu (1,00) a sTfR (0,95) pro ACD/ID a ACD. Cutoff sTfR/F byl 1,12.Závěr:
Studie potvrdila vysokou prevalenci anémie již v době manifestace nespecifického střevního zánětu a význam sTfR a sTfR/F indexu jako nezbytných doplňujících testů v diferenciální diagnostice deficitu železa v přítomnosti zánětu. Výtěžnost vyšetření podporuje širší využití této metody v gastroenterologických ambulancích.Klíčová slova:
anémie chronických nemocí, anémie z deficitu železa, deficit železa, solubilní transferinový receptor, feritin, děti, nespecifický střevní zánětÚvod
Anémie je častým příznakem závažného postižení gastrointestinálního traktu. U nespecifických střevních zánětů (NSZ) bývá přítomná již v době stanovení diagnózy, nebo vedoucím příznakem před abdominálními symptomy. Lze ji považovat více za součást klinického obrazu NSZ než za komplikaci [1]. Protože často probíhá „asymptomaticky“, nevěnuje jí adekvátní pozornost ani pacient, ani jeho ošetřující lékař. Termín asymptomatická však pouze odráží adaptaci nemocného na sníženou výkonnost a kvalitu života.
Prevalence anémie se udává mezi 6,2 % až 75 % u CN, v případě UC mezi 8,8 % až 66,6 % (81 % u dětí v době diagnózy UC) [2, 3, 9, 25, 26]. Rozdíly v prevalenci ovlivňuje studovaná populace (dospělí nebo děti, ambulantní nebo hospitalizovaní pacienti) a použitá kritéria [3]. Vyšší prevalence se uvádí ve starších studiích a u hospitalizovaných pacientů [3]. Závažná anémie (hemoglobin <100 g/l) se vyskytuje až u 1/3 pacientů a 30 % nemocných s NSZ má anémii trvale [1].
V etiopatogenezi dominují dvě příčiny: deficit železa (ID = iron deficiency) a chronický zánět. Anémie chronických nemocí (ACD, anemia of chronic disease) je důsledkem neefektivní erytropoézy a zkráceného přežívání erytrocytů. Aktivace prozánětlivých cytokinů (tumor necrosis factor-α, interferon-γ, interleukin (IL)-1 a IL-6) inhibuje erytropoézu a vede k dysfunkci distribuce a transportu železa do kostní dřeně (tzv. funkční deficit železa) [1, 3]. ACD provází chronické i akutní zánětlivé stavy, infekční a nádorová onemocnění. ID je nejčastěji důsledkem slizničního krvácení a malabsorpce, prevalence se udává 36–90 %, častější je u UC a u CN s postižením tlustého střeva [1, 2, 21]. U CN je častější koexistence obou stavů [1]. Diagnostika ID je esenciální, suplementace železa u IDA (iron deficiency anemia) může zlepšit kvalitu života nemocného s NSZ [8], ale u ACD, kde je nízké sérové železo projevem funkčního deficitu, může suplementace železa zhoršit průběh NSZ [5]. Diagnostika IDA je poměrně jednoduchá, obtíže nastávají při současně probíhajícím jiném onemocnění. Indexy červených krvinek (MCV – mean corpuscular volume, MCHC – mean corpuscular haemoglobin content), saturace transferinu a feritin jsou v přítomnosti zánětu málo spolehlivé parametry [19, 29]. Feritin je reaktant akutní fáze a při současném deficitu železa může být jeho koncentrace normální nebo zvýšená [18, 19]. Koncentrace feritinu <12 μg/l je vysoce specifická pro ID (98 %), ale má velmi nízkou senzitivitu (25 %), kterou lze zvýšit při cutoff <30 μg/l (92 %) [19, 29]. Vyšetření kostní dřeně, event. terapeutický test železem, je vyšetření senzitivní, ale invazivní, drahé a u dětských pacientů málo indikované. Udává se až 30% nepřesnost v hodnocení přítomnosti barvitelného železa v kostní dřeni [29]. Solubilní transferinový receptor (sTfR) je neinvazivní test, má vysokou senzitivitu pro ID a není ovlivněný zánětem [7, 9, 10, 19]. sTfR je ovlivněn stavem zásob železa, signalizuje přechod od vyčerpání zásob železa k depleci ve funkčním kompartmentu a odráží erytropoetickou aktivitu v kostní dřeni [4, 7, 9, 15, 30]. Nedostatek železa a zvýšená erytropoéza zvyšují sTfR i v přítomnosti chronického či akutního zánětu [6, 13], což umožňuje jeho využití v diagnostice ID u chronických nemocí [11]. Inverzní vztah mezi sTfR a feritinem a kalkulace jejich poměru (sTfR/log feritin = sTfR/F index) [4, 13, 22] zvyšuje senzitivitu i specificitu vyšetření ID [6, 7, 9, 17]. Pro ID je charakteristická vysoká hodnota sTfR a sTfR/F indexu ve srovnání s ACD [9]. Feritin <100 μg/l, saturace transferinu <16 % a sTfR/F index >2 jsou v přítomnosti zánětu velmi suspektní z deficitu železa [2, 7].
Cíl studie
Cílem studie bylo u dětí s NSZ při stanovení diagnózy zjistit:
- prevalenci anémie,
- prevalenci ID, IDA, ACD, ACD/ID,
- porovnat v diagnostice deficitu železa a anémie tradičně užívané laboratorní testy s vyšetřením sTfR a sTfR/F indexem.
Pacienti a metody
Charakteristika souboru
Do souboru bylo zařazeno 56 pacientů s nově diagnostikovaným NSZ v období mezi lednem 2005 a prosincem 2009, kteří splňovali diagnostická kritéria ČKSGE pro NSZ [20] (tab. 1) a byli mladší 19 let. Pacientům nebyla podána krevní transfuze ani léčba železem 4 měsíce před zařazením do studie. V souboru 56 nemocných byla častěji diagnostikována CN než UC. Průměrný věk v době stanovení diagnózy NSZ a zastoupení pohlaví jsou uvedeny v tabulce 2.
Table 1. Kritéria ČKSGE pro nespecifické střevní záněty. 
Table 2. Charakteristika souboru, prevalence a typ anémie u CN a UC. 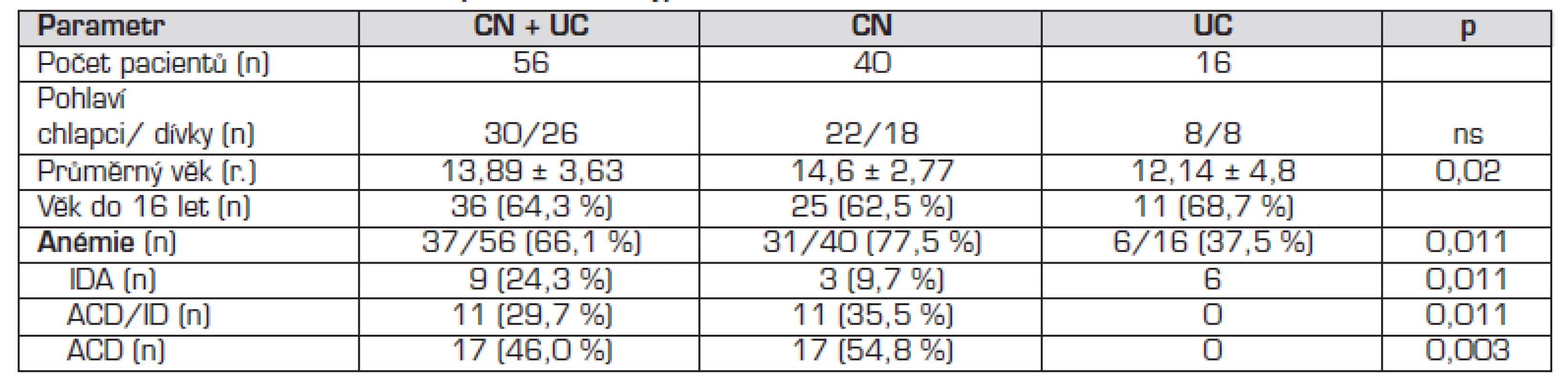
Metody
Laboratorní vyšetření proběhla v době stanovení diagnózy NSZ, kdy pacienti nevykazovali známky jiného akutního zánětlivého onemocnění. Od pacienta na lačno byl mezi 8.–10. hodinou získán vzorek venózní krve. V krevním vzorku byl vyšetřen krevní obraz a diferenciální rozpočet, CRP (mg/l) turbidimetrickou metodou DAKO Citomation (AuOlympus), železo (μmol/l) fotometrickým testem IRON, TPTZ metoda (2,4,6-tri(2-pyridyl)-5-triazin) typu „end point“ (Olympus Diagnostica/Beckman Coulter), vazebná kapacita železa (μmol/l) fotometrickou metodou (AuOlympus), feritin (μg/l) metodou chemiluminiscenční imunoanalýzy (LIA, luminiscenční imunoanalýza, Siemens), sTfR (mg/l) nefelometrickou metodou DADEBehring (Nefelometr BN 100). Matematický výpočet sTfR/F indexu byl proveden podle Punnonnena jako poměr sTfR k log feritinu [7].
Jako referenční hodnoty byly použity hodnoty hemoglobinu, sérového železa a feritinu uvedené v Nathan and Oski’s Hematology of Infancy and Childhood, 1998 (tab. 3A, 3B). Pro sTfR byla stanovena horní mez normálních hodnot 1,8 mg/l a pro CRP 5 mg/l podle referenčních hodnot laboratoře, pro feritin <20 μg/l signalizující ID u pacientů s NSZ [2, 11] a hodnoty sTfR/F indexu >2 pro IDA a <1 pro ACD.
Tab. 3A. Průměrné hodnoty a dolní limity normálních hodnot hemoglobinu, hematokritu a MCV v závislosti na věku. 
Tab. 3B. Hodnoty normálních hodnot feritinu, železa a saturace transferinu v závislosti na věku. 
Definice pojmů
- Anémie byla definována jako průměrná koncentrace hemoglobinu <-2 SD vzhledem k věku a pohlaví.
- Deficit železa (ID, iron deficiency) je definován podle Nutrition Examination Study III (NHANES III) [13, 18] jako přítomnost dvou ze tří následujících parametrů: feritin <10 μg/l, saturace transferinu <10 % a erytrocytární protoporfyrin >1,42 μmol/l. Erytrocytární protoporfyrin jsme nestanovovali, ID v naší studii je definován přítomností feritinu <10 μg/l a saturace transferinu <10 %.
- Anémie z deficitu železa (IDA)
- s využitím obvykle užívaných testů: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, feritin <10 μg/l, saturace transferinu <10 %.
- s využitím sTfR: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, hodnoty sTfR/F >2 a CRP <5 mg/l.
- Anémie chronických chorob (ACD)
- s využitím obvykle užívaných testů: Hemoglobin <-2 SD vzhledem k věku a pohlaví, feritin >20 μg/l, CRP >5 mg/l.
- s využitím sTfR: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, hodnoty sTfR/F <1 a CRP >5 mg/l.
- Anémie chronických chorob kombinovaná s deficitem železa (ACD + ID)
- s využitím obvykle užívaných testů: Hemoglobin průměr <-2 SD vzhledem k věku a pohlaví, feritin <30 μg/l, CRP >5 mg/l.
- s využitím sTfR: Hemoglobin <-2 SD vzhledem k věku a pohlaví, sTfR/F >1, CRP >5 mg/l.
V tabulkách 3A a 3B jsou uvedeny průměrné hodnoty a dolní limity normálních hodnot hemoglobinu, hematokritu a MCV v závislosti na věku a hodnoty normálních hodnot feritinu, železa a saturace transferinu v závislosti na věku.
Statistické metody
Normální rozložení dat bylo testováno D’Agostino Pearsonovým omnibus testem. V případě normálního rozložení jsou výsledky vyjádřeny jako průměr ± standardní odchylka (SD), v opačném případě jako medián + IQR (interquartil range, tj. 25. percentil a 75. percentil). Srovnání mezi dvěma skupinami bylo provedeno Studentovým t-testem, srovnání více než dvou skupin bylo analyzováno metodou rozptylu ANOVA s Bonferroniho korekcí pro mnohočetná porovnávání nebo Kruskalovým-Wallisovým testem s korekcí podle Dunneho pro mnohočetná porovnávání. Hladina shody v počtu pacientů s diagnózou IDA při použití klasických laboratorních ukazovatelů a sTfR/F indexu byla testována pomocí McNammarova testu. Statistická významnost byla stanovena na hladině p = 0,05. Shoda diagnózy byla hodnocena Fisherovým testem.
Všechny statistické analýzy byly provedeny programem GrapPad5 Prism (GraphPad Software Inc., USA). Studie byla schválena etickou komisí FN v Ostravě. Informovaný souhlas s vyšetřením a studií byl získán buď od zákonných zástupců pacientů, nebo samotných pacientů.
Výsledky
Anémie
Anémie byla zjištěna u 37/56 (66,1 %) nemocných, statisticky významně častěji u CN. Výskyt jednotlivých typů anémie je uveden v tabulace 2. Deficit železa (IDA + ACD/ID) byl zjištěn u 20/56 (36 %) nemocných s NSZ, u CN 14/40 (35 %), 6/16 (37,5 %) u UC.
IDA
IDA byla detekována pomocí tradičních testů u 9/37 (24,3 %) anemických nemocných, 6/16 (37,5 %) u UC, 3/31 (9,7 %) u CN. S využitím sTfR/F indexu byla IDA stanovena u 7/37 (18,9 %). Shoda obou metod byla statisticky významná (p <0,0001).
ACD a ACD/ID
ACD byla diagnostikována tradičními testy při cutoff feritinu >20 μg/l u 21/37 (56,8 %), s využitím sTfR/F u 17/37 (46 %) anemických pacientů, zbylí čtyři nemocní byli tímto testem zařazeni jako ACD/ID. Shoda tradičních testů při cutoff feritinu >20 μg/l se sTfR/F byla statisticky významná (p <0,0001).
ACD/ID byla diagnostikována tradičními testy při cutoff feritinu <10 μg/l jen u 2/37 (5,4 %), s využitím sTfR/F indexu u 11/37 (29,7 %) anemických pacientů. Shoda metod nebyla statisticky významná (p = 0,12). Statisticky významná shoda nastala při zvýšení cutoff feritinu na <30 μg/l (u 12/37) (p <0,0001).
Feritin
U 11/37 (29,7 %) anemických pacientů byla koncentrace feritinu <10 μg/l (u všech s IDA a u dvou s ACD/ID). U 5/11 ACD/ID byl feritin >10 μg/l a u 4/11 20–30 μg/l. Cutoff pro odlišení ACD a IDA i pro odlišení ACD a ACD/ID byl 33 μg/l (senzitivita 100 %, specificita 94 %). Cutoff pro odlišení IDA a ACD/ID byl 8,7 μg/l (senzitivita 89 %, specificita 91 %).
sTfR
Koncentrace sTfR byly >1,8 mg/l u většiny nemocných s IDA a ACD/ID, u 3 nemocných s IDA byly v referenčním rozmezí. U ACD byly koncentrace sTfR u 11/17 v referenčním rozmezí a u 6/17 zvýšené. Koncentrace sTfR nebyly statisticky významně rozdílné mezi IDA a kombinovanou anémií ACD/ID, ale byly statisticky významně nižší u ACD proti ACD/ID a IDA (tab. 4).
Table 3. Metabolismus železa a CRP v jednotlivých skupinách. 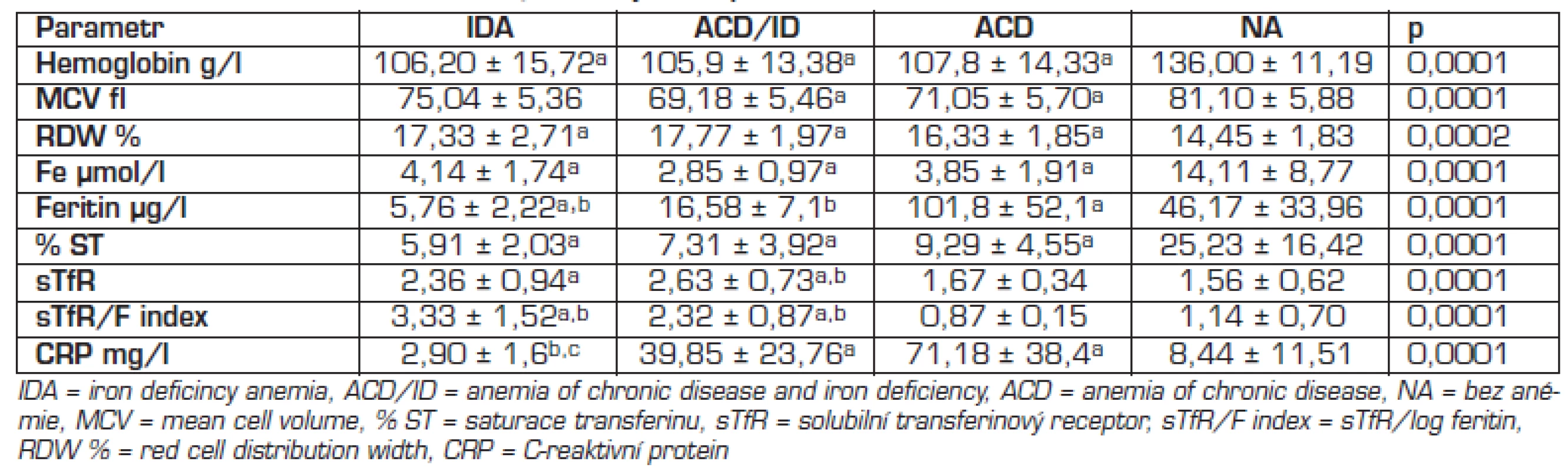
avýznamně odlišné od NA bvýznamně odlišné od ACD cvýznamně odlišné ACD/ID ROC analýza (tab. 5): cutoff 2,2 mg/l pro diskriminaci IDA a ACD měl 55,6% senzitivitu a 94% specificitu, koncentrace 1,8 mg/l měla 67% senzitivitu a 70% specificitu. Pro diskriminaci ACD a ACD/ID měl cutoff 2,2 mg/l 73% senzitivitu a 94% specificitu, cutoff 1,8 mg/l měl 100% senzitivitu a 70% specificitu.
Table 4. AUC<sup>ROC</sup> hodnoty (SE) parametrů metabolismu železa v diagnostice typu anémie. 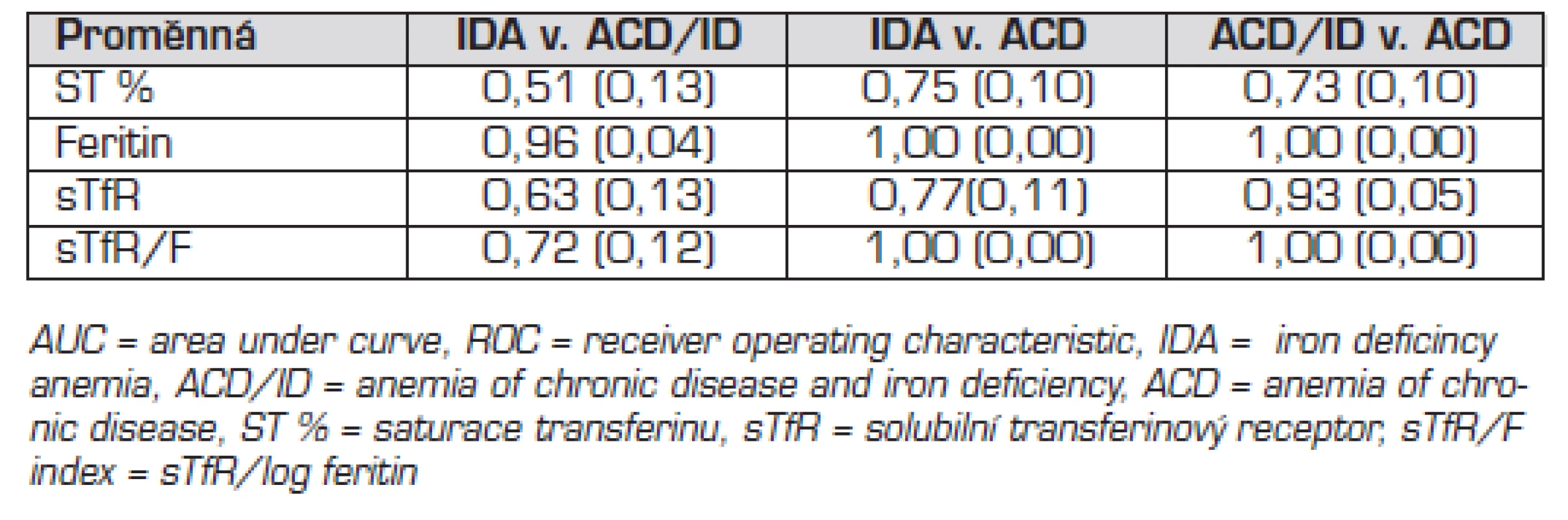
sTfR/F index
Hodnoty sTfR/F indexu byly statisticky významně vyšší u IDA a ACD/ID než u ACD a neanemických pacientů (tab. 4). Kalkulace sTfR/F zlepšila senzitivitu i specificitu diagnostiky ID v přítomnosti zánětu ve srovnání s izolovaným vyšetřením feritinu a sTfR (tab. 5). Rozdíl hodnot sTfR/F indexu mezi skupinami byl statisticky významný. Cutoff 2 pro diskriminaci IDA a ACD měl 77% senzitivitu a 100% specificitu. Cutoff 3 pro diskriminaci IDA a ACD/ID měl 56% senzitivitu a 91% specificitu. Cutoff 1,1 pro diskriminaci ACD/ID a ACD měl senzitivitu 100 % a specificitu 94 %. Porovnání ROC křivek pro sTfR, sTfR/F a feritin nezjistilo statisticky významný rozdíl (p = 0,12 až 1,00) s výjimkou porovnání křivek pro sTfR a feritin v případě diskriminace IDA a ACD/ID (p = 0,02).
Diskuse
Prevalence anémie u dětí s NSZ podle několika dostupných literárních údajů kolísá v rozmezí 41,3–78 % [9, 25, 26]. Anémie je v těchto publikacích různě definovaná: hematokrit <0,30 až <0,36, Hb <110 g/l nebo pro dívky <120 g/l a pro chlapce <125 g/l a v poslední uvedené publikaci Hb <-2 SD k průměrné hodnotě zdravé populace v USA, která se také jako jediná zabývá prevalencí anémie v době stanovení diagnózy NSZ u dětí [26]. Ostatní studie uvádějí prevalenci anémie u různě dlouho léčených pacientů (tab. 6). A tak skutečná hodnota prevalence není zcela jasná, protože tato jednotlivá data se liší jak definicí anémie, tak stadiem onemocnění, ve kterém byla prevalence anémie stanovena.
Table 5. Prevalence anémie u dětí s IBD – přehled studií. 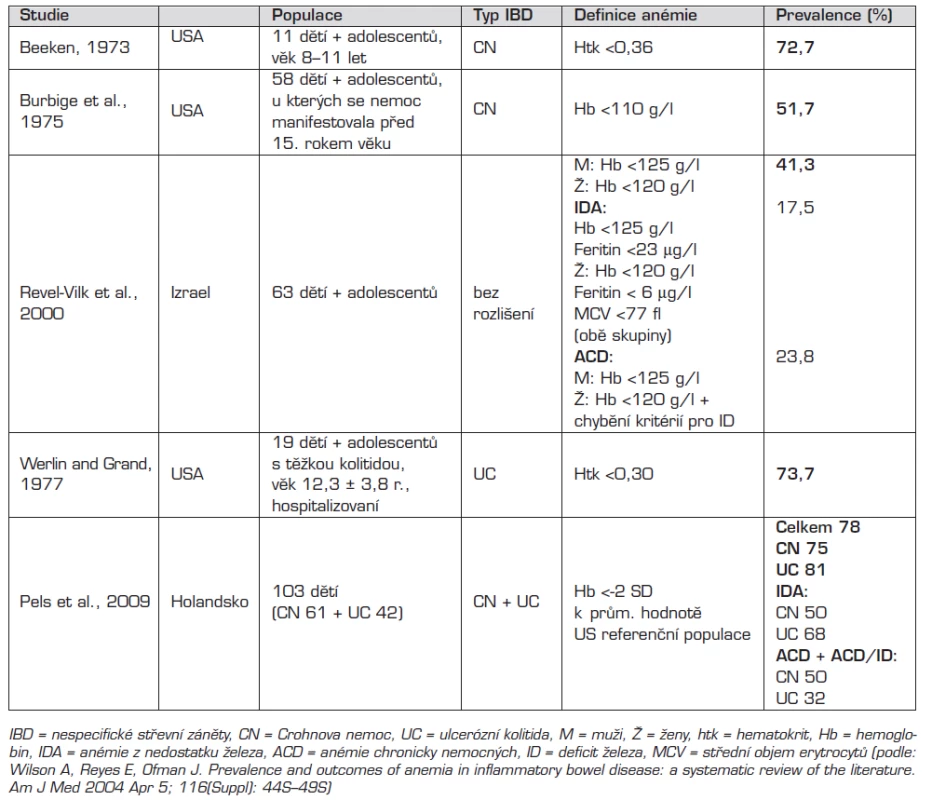
Námi zjištěná prevalence anémie 66,1 % v celém souboru a 77,5 % ve skupině s CN odpovídá literárním údajům o prevalenci anémie u dětí s NSZ, u nemocných s UC pak byla prevalence nižší (37,5 %) [2, 3, 25, 26]. Prevalence IDA, ACD/ID a ACD činila 24 %, 30 % a 46 % v tomto pořadí.
Pels et al. uvádějí prevalenci IDA u dětí v době manifestace NSZ 50 % u CN a v případě UC 68 % [26]. Autoři také prokázali, že s délkou onemocnění NSZ stoupá výskyt IDA a klesá ACD (s/bez ID). V našem souboru pacientů s NSZ jsme prokázali výrazně nižší prevalenci IDA (9 z 37 (24 %) anemických pacientů, u CN 10 % a v případě UC 37,5 %) v době manifestace onemocnění ve srovnání s touto prací (p = 0,0013). Na druhou stranu jsme v naší studii zachytili procentuálně vyšší zastoupení pacientů s ACD (s/bez ID) u nemocných s CN (90 %). Nižší prevalence IDA a vyšší prevalence ACD v souboru našich pacientů by mohla ukazovat na diagnostiku v časnějším stadiu onemocnění u našich pacientů s nižším zastoupením nemocných s UC, u kterých je uváděna vyšší prevalence IDA [1, 21]. Prevalenci IDA v době stanovení diagnózy NSZ mohou ovlivňovat i další faktory, jako je množství železa ve stravě a aktuální potřeba železa (zvýšená v období intenzivního vývoje a růstu).
Rozdíly v prevalenci anémie mezi studiemi mohou vysvětlit použitá kritéria, velikost a charakter souboru a doba trvání NSZ v době hodnocení anémie [3, 7, 9, 24, 28]. Intenzivnější a agresivnější terapie NSZ může vysvětlit snížení výskytu anémie, zejména ACD.
Diagnostika IDA není obtížná, problémy nastávají při současně probíhajícím zánětu (ACD/ID), kdy feritin jako reaktant akutní fáze může být normální nebo zvýšený [16, 19]. Zvýšením cutoff feritinu na <30 μg/l v naší studii stoupla jeho senzitivita na 100 %, specificita byla 94 %. Cutoff feritinu pro ACD/ID se ve studiích udává mezi 20–50 μg/l [9, 11, 12, 19, 27]. V naší studii byl ve skupině s ACD/ID feritin <20 μg/l u 5/11 a <30 μg/l u 4/11 nemocných. Interval 20–100 μg/l je tzv. šedá zóna, feritin >100 μg/l současný ID vylučuje [1, 4, 5, 6, 9, 23, 27]. V naší studii byly hodnoty feritinu v šedé zóně u 13/17 ACD a u 4/17 ACD byly >100 μg/l. Při probíhajícím zánětu je feritin málo spolehlivý parametr pro diagnostiku ID a je vhodné použít další biochemický parametr, sTfR.
Koncentrace sTfR v naší studii byly u nemocných s ACD a u nemocných bez anémie v referenčním intervalu laboratoře, u obou skupin s ID byly hodnoty zvýšené. Průměrné koncentrace sTfR u ACD/ID i IDA přesahovaly zjištěné cutoff 2,2 mg/l. Pozorovali jsme přesah hodnot sTfR: u 3/11 ACD/ID byly koncentrace <2,2 mg/l a u 3/9 s IDA byly dokonce v referenčním intervalu. Naopak u 2 nemocných bez anémie a známek ID a u 4/17 ACD byly koncentrace sTfR zvýšené. Přesah hodnot sTfR mezi zdravou a anemickou populací se v literatuře popisuje [19]. ROC analýza prokázala dobrou schopnost sTfR diskriminovat ID při zánětu, ale byla nižší ve srovnání s cutoff feritinu <20 μg/l. Hodnoty AUCROC pro sTfR byly s výjimkou diskriminace ACD/ID a ACD nižší než v relevantní studii [7]. Příčinou může být odlišná metodika stanovení sTfR (metodika vyšetření sTfR dosud není standardizována), závažnost ID v době diagnostiky NSZ, přesah hodnot sTfR mezi zdravou a ID populací. Lze spekulovat o negativním vlivu cytokinů na erytropoézu a následně na koncentraci sTfR i při ID [13] a vlivu věku [13–16, 22]. Vyšší koncentrace sTfR jsou u malých dětí (u novorozenců pro vysokou erytropoetickou aktivitu, u kojenců a malých dětí v souvislosti s častým deficitem železa). Hodnot dospělých dosahují děti od 16 let. Referenční intervaly pro věkové kategorie však dosud nebyly standardizovány. Dále některé studie uvádějí horší asociaci sTfR s ID i u jinak zdravé populace [13, 14]. Závislost na pohlaví byla popsána u dětí do 6 měsíců věku [16]. Kalkulací sTfR/F indexu jsme dosáhli výborné diskriminace mezi jednotlivými typy anémie (AUCROC = 1,00). Tyto výsledky odpovídají některým literárním údajům [7, 9, 11], jiné prameny takovéto výsledky nepotvrzují [12]. Diagnostika IDA tradičně užívanými testy byla ve shodě s diagnostikou pomocí sTfR/F, v případě ACD/ID nastala shoda při zvýšení cutoff feritinu na <30 μg/l, využití sTfR/F v diagnostice v tomto případě bylo nezbytné.
Závěr
Studie zjistila vysokou prevalenci anémie v době stanovení diagnózy, ale současně nižší prevalenci IDA ve srovnání s relevantní studií [26].
Pro diagnostiku ID u NSZ je nutné zvolit vyšší cutoff feritinu <30 μg/l. sTfR/F index <1 svědčí pro ACD, >2 pro IDA, cutoff >1,1 pro odlišení ACD/ID a ACD. sTfR v diagnostice ID nenahrazuje feritin, ale jako další biochemický parametr, který není ovlivněn zánětem, upřesňuje diagnostiku ID, eliminuje vliv zánětu a kalkulací sTfR/F indexu také eliminuje překrývání hodnot sTfR. sTfR/F index v kombinaci s CRP jako parametrem zánětu zvyšuje senzitivitu i specificitu diagnostiky ID u nemocných s NSZ. sTfR/F index považujeme za nezbytný parametr v diagnostice ID u chronických nemocí. Eliminuje chybnou interpretaci laboratorních hodnot a umožní správně vytypovat nemocné s rizikem přetrvávajícího ID a stanovit vhodnou dobu pro suplementační léčbu. Dostupnost metody umožňuje její širší využití i v gastroenterologické ambulantní praxi.
Došlo: 2. 5. 2011
Přijato: 31. 8. 2011
MUDr. Astrid Šuláková
KDL FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: astrida.sulakova@fnspo.cz
Sources
1. Gasche C, Lomer MC, Cavill I, Weiss G. Iron, anaemia, and inflammatory bowel disease. Gut 2004; 53(8): 1190–1197.
2. Kulnigg S, Gasche C. Systemic review: managing in Crohn disease. Aliment Pharmacol Ther 2006; 24 : 1507–1523.
3. Wilson A, Reyes E, Ofman J. Prevalence and outcomes of anemia in inflammatory bowel disease: a systematic review of the literature. Am J Med 2004 Apr5;116(Suppl): 44S–49S.
4. Suominen P, Punnonen K, Rajamäki A, et al. Serum transferin receptor and transferin receptor-ferritin index identify healthy subject with subclinical iron deficits. Blood 1998; 92(8): 2934–2939.
5. Oldenburg B, et al. Review article: Iron and inflammatory bowel disease. Aliment Pharmacol Ther 2001; 15(4): 429–438.
6. Malope BI, et al. The ratio of serum transferin receptor and serum ferritin in the diagnosis of iron status. Br J Hematol 2001; 115 : 84–89.
7. Punnonen K, et al. Serum transferin receptor and its ratio to serum ferritin in the diagnosis of iron deficiency. Blood 1997; 89(3): 1052–1057.
8. Wells ChW, Lewis S, Barton, JR, et al. Effects of changes in haemoglobin level on quality of life and cognitive function in inflammatory bowel disease patients. Inflamm Bowel Dis 2006; 12(2): 123–130.
9. Revel-Vilk, S et al. Serum transferin receptor in children and adolescent with inflammatory bowel disease. Eur J Pediatr 2000; 159 : 585–589.
10. Punnonen K, Irjala K, Rajamäki A. Iron-deficiency anemia is associated with high concentrations of transferrin receptor in serum. Clin Chem 1994; 40(5): 774–776.
11. Wians FH, et al. Discriminating between iron deficiency anemia and anemia of chronic disease using traditional indices of iron status vs transferin receptor concentration. Am J Clin Pathol 2001; 115 : 112–118.
12. Markovič M, et al. Usefulness of soluble transferrin receptor and ferritin in iron deficiency and chronic disease. Scand J Clin Lab Invest 2005; 65 : 571–576.
13. Ooi Cara L, et al. Pediatric reference intervals for soluble transferrin receptor and transferrin receptore-ferritin index. World J Pediatr 2009; 5(2): 122–126.
14. Chouliarasa GL, et al. Serum transferrin receptors: distribution and diagnostic perforance in pre-school children. Blood Cells, Molecules, and Diseases 2009; 43(2): 163–168.
15. Virtanen MA, et al. Higher concentrations of serum transferrin receptor in children than in adults. Am J Clin Nutr 1999; 69 : 256–260.
16. Choi JW, et al. Change in transferin receptor concentrations with age. Clin Chem 1999; 45(9): 1562–1563.
17. Margetic S, et al. Soluble treansferin receptor and transferrin receptor-ferritin index in iron deficiency anemia and anemia in rheumatoid arthritis. Clin Chem Lab Med 2005; 43(3): 326–331.
18. Looker AC, Dallman PR, Carroll MD, et al. Prevalence of iron deficiency in the United States. JAMA 1997; 26(12): 973–976.
19. Mast AE, et al. Clinical utility of the soluble transferin receptor and comparison with the serum ferritin in several populations. Clin Chemist 1998; 44 : 45–51.
20. Malý J. Diagnostika a následná péče o děti s nespecifickými střevními záněty. Pediatrie pro Praxi 2004; 1 : 7–9.
21. Mamula P, et al. Total dose intravenous infusion of iron dextran for iron-deficiency anemia in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2002; 34(3): 286–290.
22. Dimitriou H, Stiakaki E, Markak EA, et al. Soluble transferrin receptor levels and soluble transferin/log ferritin index in the evaluation of erythropoietic status in childhood infections and malignancy. Acta Paediat 2000; 89 : 1169–1173.
23. Zhu A, Kaneshiro M, Kaunitz JD. Evaluation and treatment of iron deficiency anemia: a gastroenterological perspective. Dig Dis Sci 2010; 55 : 548–559.
24. Vijverman A, Piront P, Brlaiche J, Louis E. Evolution of the prevalence and characteristics of anemia in inflammatory bowel diseases between 1993 and 2003. Acta Gastroenterol Belg 2006; 69(1): 1–4.
25. Pels LPM, van de Vijver E, Waalkens HJ, et al. Slow hematological recovery in children with IBD-associated anemia in cases of „Expectant Management“. JPGN 2010; 51(6): 708–713.
26. Pels LPM, van de Vijver E, Waalkens H, et al. IBD-associates anemia in children: controlling intestinal inflammation is not enough to normalize hemoglobin. Abstract P083 in the congress book reports interim results. Paris: PIBD 2009.
27. Schilling RF. Anemia of chronic disease: A misnomer (editorials). Ann Inter Med 1991;115(7): 572–573.
28. Schreiber S, Howaldt S, Schnoor M, et al. Recombinant erythropoietin for the treatment of anemia in inflammatory bowel disease. N Engl J Med 1996; 334(7): 619–623.
29. Koulaouzidis A, Said E, Cottier R, Saeed AA. Soluble transferin receptors and iron deficiency, a step beyond ferritin. A systemic review. J Gastrointestin Liver Dis 2009; 18(3): 345–352.
30. Suominen P, Virtanen A, Lehtonen-Veromaa M, et al. Regression-based reference limits for serum transferin receptor in children 6 months to 16 years of age (technical briefs). Clin Chem 2001; 47(5): 935–937.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 1-
All articles in this issue
- Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
- Vliv matrixových metaloproteináz na hojení ran po operaci vrozeného rozštěpu rtu
- Koncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
- Nárast polinózy u školskej mládeže v meste a na vidieku za posledných 20 rokov (1988–2009)
- Mikrodeleční syndrom Xp21: Závažná příčina selhání nadledvin, svalové dystrofie, poruchy hladin krevních lipidů a vývojové retardace u dvouměsíčního neprospívajícího kojence
- Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Perspektiva dětské lůžkové péče v České republice v roce 2011
- Zkušenosti s dlouhodobou neakutní péčí o dítě s postižením ve Strančicích
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

