-
Medical journals
- Career
Použití rivaroxabanu v prevenci cévní mozkové příhody u pacienta s chronickým srdečním selháním a nevalvulární fibrilací síní – kazuistika
Authors: F. Málek; D. Vondráková; J. Škoda; P. Neužil
Authors‘ workplace: Ambulance srdečního selhání a hypertenze, Kardiocentrum, Nemocnice Na Homolce, Praha
Published in: Kardiol Rev Int Med 2016, 18(2): 130-132
Overview
Rivaroxaban je přímý orální inhibitor faktoru Xa, který je indikován k prevenci tromboembolických příhod u pacientů s nevalvulární fibrilací síní. Kazuistika z reálné praxe ukazuje možnost použití rivaroxabanu v primární prevenci cévní mozkové příhody u pacienta s chronickým srdečním selháním a vysokým rizikem tromboembolické příhody a se středně vysokým rizikem krvácení. Toto sdělení zdůrazňuje nutnost opakovaných laboratorních kontrol u těchto vulnerabilních pacientů se sledováním především renálních parametrů během epizod kardiální dekompenzace.
Klíčová slova:
nevalvulární fibrilace síní – srdeční selhání – renální funkce – antikoagulační terapie – rivaroxabanÚvod
Rivaroxaban je přímý orální inhibitor faktoru Xa, který je indikován k prevenci tromboembolických příhod u pacientů s nevalvulární fibrilací síní (FS). Poznatky o jeho účinnosti a bezpečnosti vycházejí především z randomizované studie III. fáze klinického výzkumu ROCKET-AF [1]. Tato studie prokázala u 14 264 pacientů s nevalvulární FS, že rivaroxaban je stejně účinný ve snížení rizika cévní mozkové příhody (CMP) a systémové embolizace jako warfarin se srovnatelným rizikem krvácivých příhod. Výjimkou byl výskyt intracerebrálních krvácení a fatálních krvácení, kde výskyt těchto příhod byl významně nižší u pacientů léčených rivaroxabanem [2,3]. U pacientů s chronickým srdečním selháním (CHSS) jsou přítomny všechny tři podmínky vzniku trombózy podle Virchowovy triády: zpomalení krevního toku, poškození cévní stěny a zvýšená srážlivost krve. Zpomalení krevního průtoku je způsobeno nejen snížením srdečního výdeje, ale i dilatací srdečních oddílů a zvýšenou viskozitou krve. I přes tyto skutečnosti je evidence tromboembolických příhod u SS poměrně nízká. Výskyt CMP, plicní a periferní embolie se odhaduje na 2 % ročně, což je méně než výskyt infarktu myokardu (IM) (3 % ročně) a náhlé srdeční smrti (5 – 10 % ročně). Incidence trombotických vaskulárních příhod však může být podhodnocena, protože jsou často klinicky němé. Koronární trombóza může být u pacientů s CHSS příčinou náhlé srdeční smrti a progrese srdeční insuficience. Žilní trombóza a embolie je častější u pacientů s těžkou systolickou dysfunkcí levé komory, u pacientů s ejekční frakcí levé komory pod 20 % se zvyšuje riziko žilní trombózy až 40krát. U srdečního selhání se zvyšuje i riziko nitrosrdeční trombózy, a to jak v levé komoře, tak v levé síni. Prevalence trombu v levé komoře se u pacientů s CHSS odhaduje na méně než 10 %. U pokročilého SS prokazují echokardiografické studie spontánní echokontrast jako nepřímou známku zvýšené viskozity krve [4 – 7]. Riziko tromboembolických příhod významně zvyšuje FS.
Popis případu
Pacient ve věku 68 let s anamnézou diabetes mellitus 2. typu na perorální terapii (PAD), s chronickým onemocněním ledvin, ischemickou chorobou srdeční po IM spodní stěny v roce 1995 a po trojnásobném aortokoronárním bypassu v roce 1996, s poinfarktovou srdeční dysfunkcí a ejekční frakcí levé komory 30% s rozvojem CHSS od roku 2009 měl poprvé evidenci o flutteru síní v roce 2000, kdy podstoupil radiofrekvenční ablaci (RFA) kavotrikuspidálního istmu. V této době byl přechodně léčen antikoagulační terapií antagonistou vitaminu K warfarinem. Při této terapii měl nežádoucí gastrointestinální účinky léčby, terapie warfarinem však byla přerušena až za jeden rok po RFA při opakovaně dokumentovaném sinusovém rytmu. U pacienta došlo od roku 2009 k progresi symptomů srdečního selhání až do funkční třídy NYHA III. Vzhledem k srdeční dysfunkci a šíři QRS komplexu nad 150 ms bylo u pacienta indikováno zavedení srdeční resynchronizační léčby spolu s implantací automatického defibrilátoru. Anamnestické údaje ukazuje tab. 1.
Table 1. Anamnestické údaje pacienta. 
V dalším průběhu byla u pacienta zjištěna perzistující FS, podstoupil elektrickou kardioverzi a následně izolaci plicních žil v červenci 2014. Farmakoterapii pacienta v době zjištění fibrilace síní ukazuje tab. 2. U pacienta byla zahájena terapie warfarinem s cílem INR 2 – 3 (international normalized ratio). Indikace k antikoagulační terapii byla dána zjištěním aktuálního rizika CMP. Rizikové skóre pacienta spolu s rizikem krvácení je uvedeno v tab. 3. K posouzení rizika CMP a rizika krvácení byly použity laboratorní výsledky, které ukazuje tab. 4
Table 2. Farmakologická léčba pacienta před zahájením antikoagulační terapie. 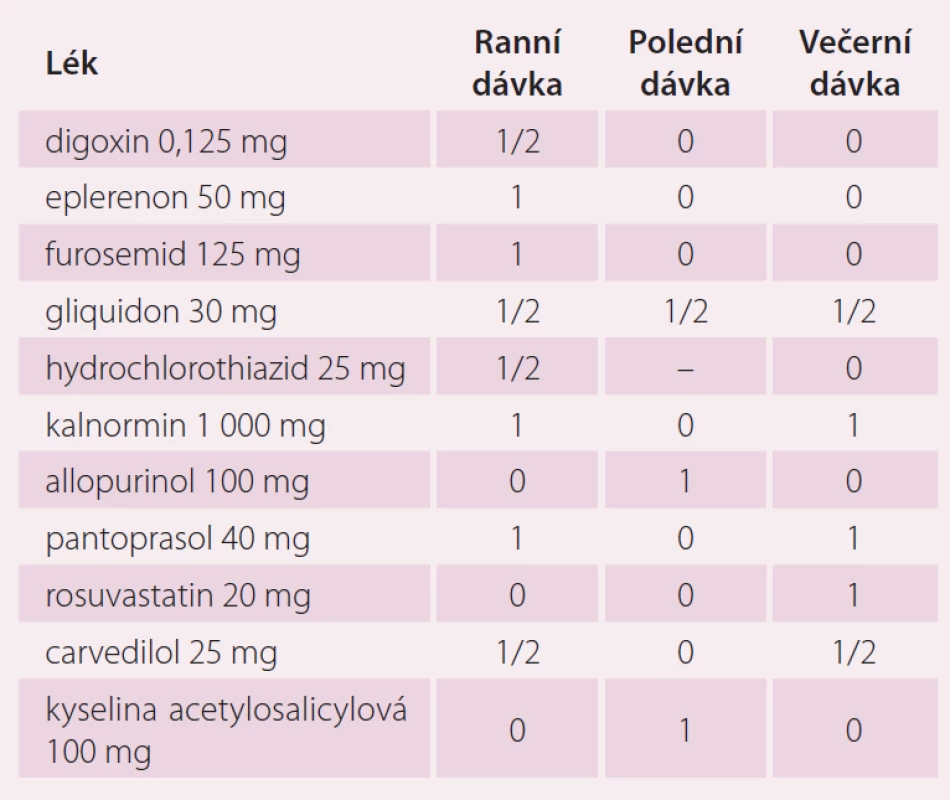
Table 3. CHA<sub>2</sub>DS<sub>2</sub>VASc, HAS-BLED skóre a ATRIA skóre. 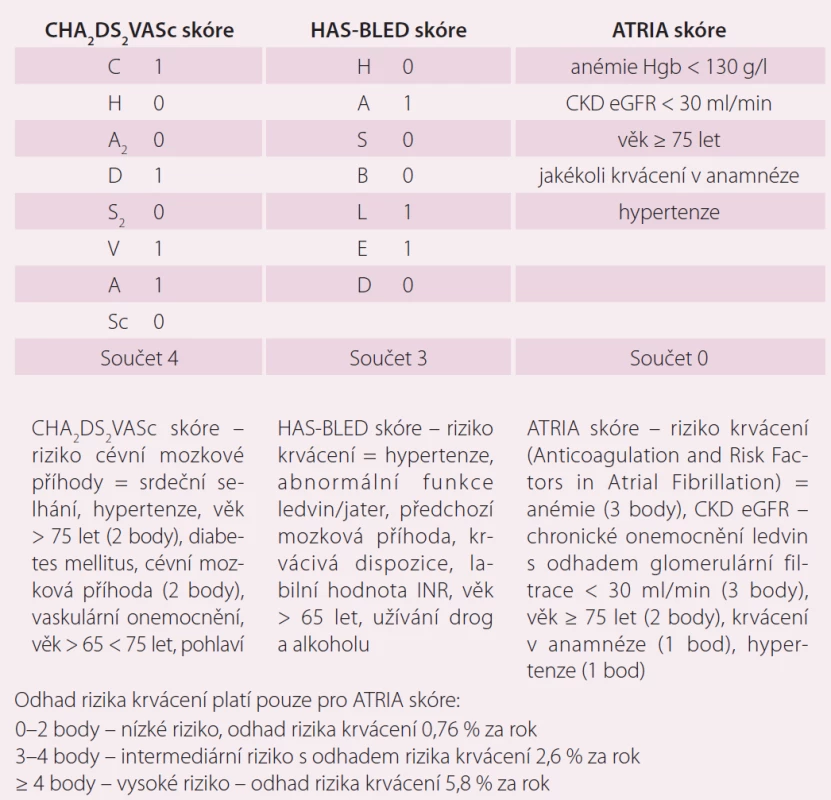
Table 4. Laboratorní výsledky v době diagnózy perzistující fibrilace síní. 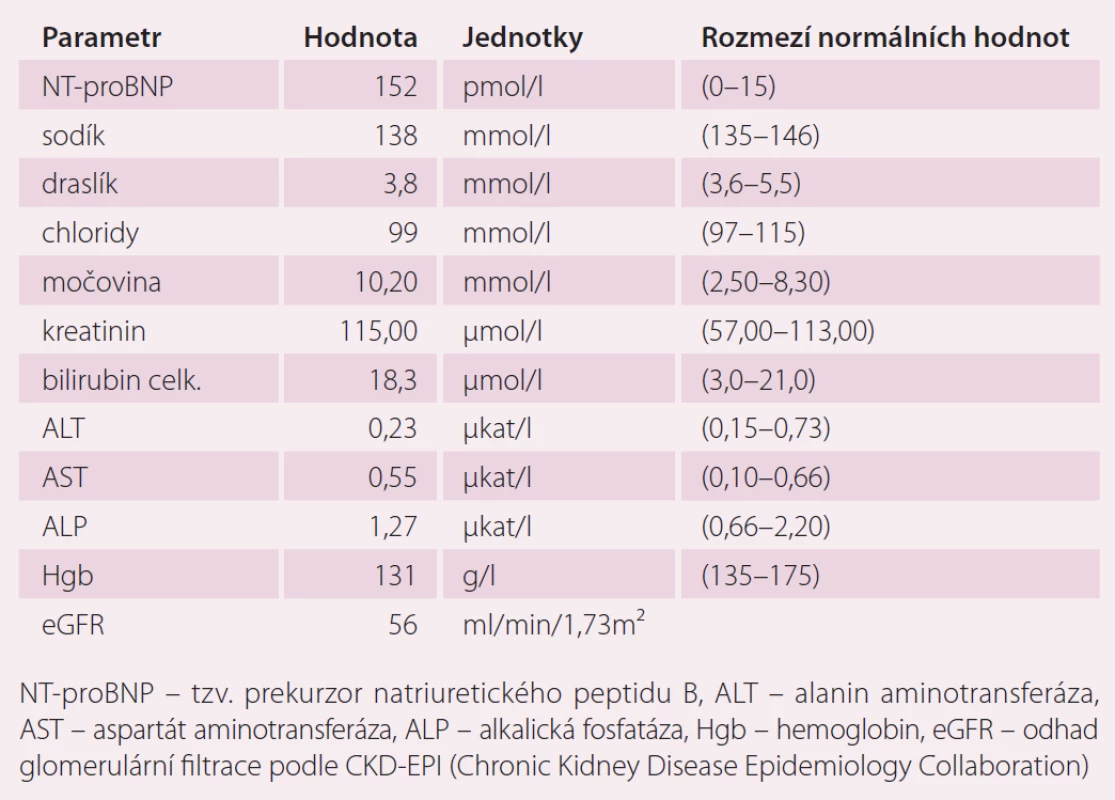
V dalším průběhu pacient špatně toleroval léčbu warfarinem s gastrointestinálními příznaky a při opakovaném měření byla zjištěna opakovaně hodnota INR mimo terapeutické rozmezí 2 – 3. S pacientem byla probrána možnost změny antikoagulační léčby na novou antikoagulační látku (NOAK). Protože pacient jednoznačně preferoval dávkování jednou denně, byla u nemocného zahájena terapie rivaroxabanem v úvodní dávce 20 mg jednou denně. U pacienta v průběhu roku 2015 došlo k recidivě FS, recidiva arytmie byla spojena s epizodami dekompenzace SS vyžadující zvýšení dávek diuretik. Změny koncentrace kreatininu při epizodách kardiální dekompenzace ukazuje tab. 5.
Table 5. Koncentrace kreatininu při epizodách dekompenzace. 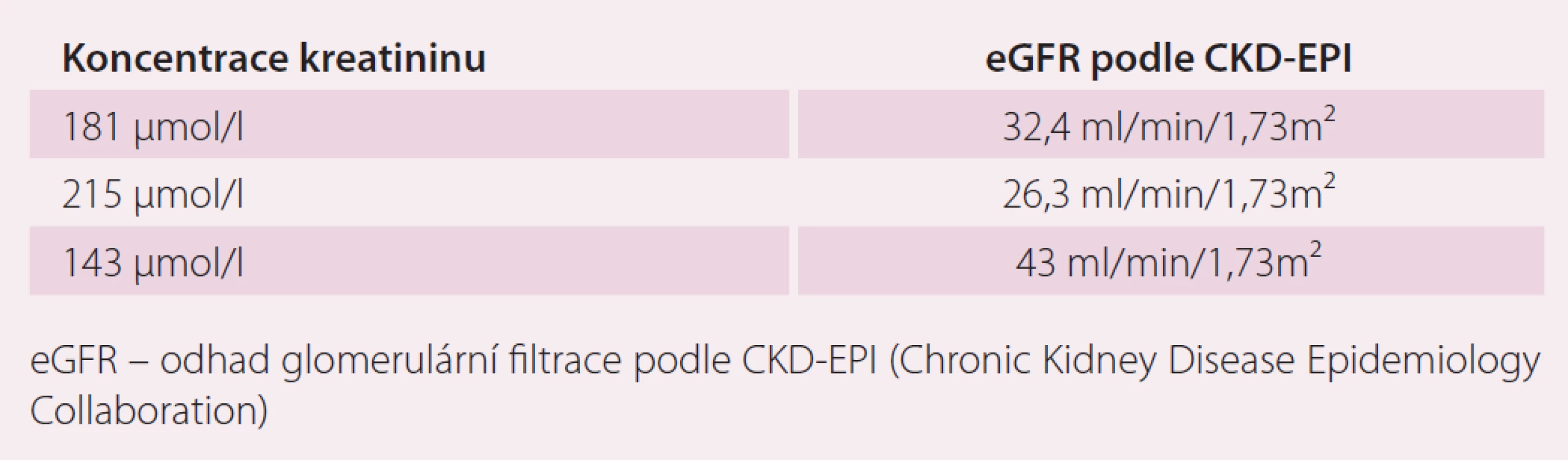
Vzhledem k poklesu odhadované glomerulární filtrace bylo nutné redukovat dávku rivaroxabanu. U pacientů se středně závažnou (clearance kreatininu 30–49 ml/ min) nebo závažnou (clearance kreatininu 15–29 ml/ min) renální nedostatečností platí doporučení pro dávkování: pro prevenci CMP a systémové embolizace u pacientů s nevalvulární FS je doporučené dávkování 15 mg jednou denně. Použití se nedoporučuje u pacientů s clearance kreatininu < 15 ml/ min.
V našem případě pacient pokračuje dávkou 15 mg rivaroxabanu denně. Pacient podstoupil 25. srpna 2015 úspěšnou reizolaci plicních žil a od té doby má trvale sinusový rytmus (resp. síní spouštěnou biventrikulární stimulaci) a nebyl hospitalizován. Při poslední kontrole zůstává hodnota odhadované clearance kreatininu < 50 ml/ min, proto byla ponechána dávka rivaroxabanu 15 mg denně. Pacient při této terapii neměl při dalším sledování žádnou tromboembolickou ani krvácivou nežádoucí příhodu.
Závěr
Rivaroxaban představuje alternativu antikoagulační terapie v prevenci tromboembolických příhod u pacientů s nevalvulární FS a nemožností udržet terapeutické rozmezí při léčbě antagonistou vitaminu K warfarinem a vysokým rizikem, kteří preferují dávkování jednou denně. Vždy je nutné kromě výpočtu rizika cévní mozkové příhody (CHA2DS2VASc skóre) stanovit skóre krvácení. V tomto případě bylo HAS-BLED skóre 3, tedy středně závažné, ale přijatelné riziko pro zahájení antikoagulační terapie. Tento konkrétní případ také ukazuje nedostatky při stanovení rizika krvácení pomocí ATRIA skóre. Podle současných poznatků je HAS-BLED skóre přesnější v odhadu rizika závažných krvácení než skóre ATRIA [8,9]. U pacientů s chronickým srdečním selháním je nutné myslet na možnost dynamických změn ledvinných funkcí v období kardiální dekompenzace.
Podpořeno MZ ČR – RVO (Nemocnice Na Homolce – NNH, 00023884), IG150505.
Doručeno do redakce: 10. 3. 2016
Přijato po recenzi: 21. 3. 2016
doc. MU Dr. Filip Málek, Ph.D., MBA
www.homolka.cz
filip.malek@homolka.cz
Sources
1. Patel MR, Mahaffey KW, Garg J et al. The ROCKET - AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. New J Engl Med 2011; 365 : 883 – 891. doi: 10.1056/ NEJMoa1009638.
2. Špinar J, Vítovec J. Studie ROCKET-AF – konec warfarinu na obzoru? Kardiol Rev Int Med 2011; 13 : 106 – 108.
3. Karetová D, Bultas J. Nová perorální antitrombotika v prevenci a léčbě trombembolizmu. Kardiol Rev Int Med 2012; 14 : 88 – 92.
4. Cleland JG. Anticoagulant and antiplatelet therapy in heart failure. Curr Opin Cardiol 1997; 12 : 276 – 287.
5. Diet F, Erdmann E. Thromboembolism in heart failure: who should be treated? Eur J Heart Fail 2000; 2 : 355 – 363.
6. Dries DL, Rosenberg YD, Waclawiw MA et al. Ejection fraction and risk of thromboembolitic events in patients with systolic dysfunction and sinus rhythm. J Am Coll Cardiol 1997; 29 : 1074 – 1080.
7. Howell MD, Geraci JM, Knowlton AA. Congestive heart failure and outpatient risk of venous tromboembolism: a retrospective, case-control study. J Clin Epidemiol 2001; 54 : 810 – 816.
8. Pisters R, Lane DA, Nieuwlaat R et al. A novel user-friendly score (HAS-BLED) to assess one-year risk of major bleeding in atrial fibrillation patients: The Euro Heart Survey. Chest 2010; 138 : 1093 – 1100. doi: 10.1378/ chest.10-0134.
9. Roldán V, Marín F, Fernández H et al. Predictive value of the HAS-BLED and ATRIA bleeding scores for the risk of serious bleeding in a "real-world" population with atrial fibrillation receiving anticoagulant therapy. Chest 2013; 143 : 179 – 184.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2016 Issue 2-
All articles in this issue
- Dapagliflozin a studie DECLARE – budoucnost léčby diabetes mellitus?
- Fixní kombinační léčba hypertenze
- Léčba hypertenze z pohledu ambulantního lékaře
- Fixní kombinace s hypolipidemiky
- Fixní kombinace antidiabetik
- Fixní kombinace v antiagregační léčbě
- Fixní kombinace v pneumologii
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Použití rivaroxabanu v prevenci cévní mozkové příhody u pacienta s chronickým srdečním selháním a nevalvulární fibrilací síní – kazuistika
- Vedolizumab v léčbě idiopatických střevních zánětů
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fixní kombinace s hypolipidemiky
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Fixní kombinační léčba hypertenze
- Fixní kombinace v pneumologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

