-
Medical journals
- Career
Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
Authors: J. Payer; A. Baňárová
Authors‘ workplace: V. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, CSc.
Published in: Vnitř Lék 2010; 56(7): 702-708
Category: 80th Birthday - Jaroslava Blahoše, MD, DrSc.
Overview
Vplyv testosterónu na kardiovaskulárne ochorenia je diskutovanou otázkou posledných rokov. Testosterón vplýva na cievnu reaktivitu genomickými a negenomickými mechanizmami, má vplyv na funkciu endotelu, produkciu prozápalových cytokínov a lipidové spektrum. Možná úloha sex hormone binding globulínu (SHBG) ako molekuly sprostredkujúcej efekt androgénov prostredníctvom receptorov plazmatickej membrány vyvracia teóriu o účinnosti len voľnej frakcie androgénov, najmä keď klinické štúdie poukazujú na silnú asociáciu medzi SHBG a rizikovými faktormi kardiovaskulárnych ochorení. Výsledky posledných klinických štúdií dokázali, že androgénový deficit je asociovaný s obezitou, inzulínovou rezistenciou, dyslipidémiou a zvýšenou mortalitou u starších mužov. Substitúcia testosterónu zlepšuje vazoreaktivitu a funkciu endotelu a potencionálne môže redukovať kardiovaskulárne ochorenia u mužov. K definitívnemu potvrdeniu tejto teórie zatiaľ chýbajú veľké klinické štúdie.
Kľúčové slová:
testosterón – androgénový deficit – endotelová dysfunkcia – metabolický syndrómÚvod
Úmrtnosť na kardiovaskulárne ochorenia je hlavnou príčinou úmrtnosti vo svete (WHO). Je všeobecne známe, že morbidita a mortalita spôsobená kardiovaskulárnymi ochoreniami je vyššia u mužov – udáva sa 2,5 - až 4-násobne vyššie riziko – a že tento rozdiel zaniká po menopauze [1]. Uznávaným vysvetlením tejto teórie bola úvaha o proaterogénnom potenciáli testosterónu a/alebo o nedostatočnom ochrannom efekte estrogénov u mužov [2,3]. Vplyv testosterónu na kardiovaskulárny systém sa stáva diskutovanou otázkou posledných rokov a názor, že muži trpia kardiovaskulárnymi ochoreniami v skoršom veku ako ženy následkom efektu testosterónu, sú dnes minulosťou. Naopak je zrejmé, že adekvátna hladina endogénneho testosterónu je potrebná na ochranu mužského organizmu pred kardiovaskulárnymi ochoreniami.
Testosterón a jeho vplyv na kardiovaskulárny systém
Testosterón (T) pôsobí na bunky cez jadrové receptory. Účinok spôsobuje buď priamo molekula testosterónu, alebo po jeho premene 5-α-reduktázou jeho potentnejšia forma 5-α-dehydrotestosterón. V niektorých tkanivách – predilekčne v tukovom tkanive, kostiach a mozgu – pôsobí T aj nepriamo – po premene aromatázou na estradiol. T cirkuluje v plazme buď voľný (fT), viazaný na albumín, alebo viazaný na špecifický nosič – sex hormone binding globuline (SHBG). Voľný T a T viazaný na albumín vytvárajú frakciu biologicky dostupného testosterónu. Cirkulujúci T je tvorený testikulárnym T a T nadobličkového pôvodu, ktorý zvyšuje celkovú produkčnú rýchlosť T oproti jeho sekrečnej rýchlosti asi o 5 % [4].
Vplyv testosterónu na kardiovaskulárne ochorenia môžeme patofyziologicky rozdeliť na pôsobenie na cievnu stenu, vaskulárnu reaktivitu, vplyv na jednotlivé elementy v procese aterogenézy a pôsobenie prostredníctvom ovplyvnenia rizikových faktorov kardiovaskulárnych ochorení.
Pôsobenie T na cievnu stenu môže byť priame – účinkom samotného testosterónu, alebo nepriame – po premene na estradiol priamo v bunkách (obr. 1). Účinok T v tkanivách je buď genomický pomocou androgénových receptorov, alebo negenomický. Expresia androgénových receptorov bola dokázaná na bunkách arteriálnej cievnej steny zvierat a ľudí [5,6]. Rovnako bola zistená aj na bunkách hladkých svalov, endotelových bunkách, makrofágoch, megakaryocytoch a krvných doštičkách [7,8,9]. V súčasnosti je diskutovanou otázkou aj negenomické pôsobenie pohlavných hormónov prostredníctvom receptorov na plazmatickej membráne. Jednou z teórií je negenómové pôsobenie prostredníctvom receptorov plazmatickej membrány, ktorých ligandom je SHBG [10]. Bol objavený aj nový typ endocytárneho receptora – megalín, ktorý pravdepodobne tiež sprostredkováva androgénový účinok cez SHBG [11].
Image 1. Metabolizmus a pôsobenie pohlavných hormónov na cievne bunky. Upravené podľa [2]. ![Metabolizmus a pôsobenie pohlavných hormónov na cievne bunky. Upravené podľa [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bee907dada1ea9f9bf5c074b87093fb2.png)
Skorým znakom aterosklerózy je znížená odpoveď cievnej steny reagovať vazodilatačne na hormonálne stimuly. Klinickým následkom tohto mechanizmu sú vazospazmy a syndróm anginy pectoris. Údaje o vplyve T na cievnu reaktivitu sú protichodné (tab. 1). Akishita et al demonštrovali, že vazodilatácia stanovovaná na základe prietoku v koronárnych cievach bola 1,7-krát nižšia u mužov, ktorých hladina voľného testosterónu bola v najnižšom kvartile oproti tým v najvyššom kvartile, a to nezávisle na rizikových faktoroch kardiovaskulárnych ochorení [12]. To je v súlade so zistením, že krátkodobé intrakoronárne podanie testosterónu v suprafyziologických dávkach vedie k vazodilatácii artérií sprostredkovanej bunkami hladkých svalov a iónovými kanálmi, teda nie cez androgénové receptorty (negenomický účinok) [13]. Na druhej strane je dokázané pôsobenie testosterónu na endotelovú dysfunkciu a jeho vplyv na endotelom sprostredkovanú teda genomickú vazoreaktivitu [14]. Foresta et al demonštrovali, že androgény stimujujú endotelové progenitorové bunky zodpovedné za reparáciu endotelu a tento efekt bol inhibovaný flutamidom – blokátorom androgénových receptorov [15]. Foresta tiež zistil, že hladina progenitorových endotelových buniek je nižšia u hypogonadálnych mužov než u eugonadálnych kontrol a že sa zvýši po exogénnom podaní T [16]. V literatúre sú dáta o negatívnej korelácii hladín voľného testosterónu k adhezívnej molekule endotelu VCAM1 a k intimomediálnemu zhrubnutiu ciev. T inhibuje formáciu ateroskleromového plaku a je inverzne asociovaný so závažnosťou rádiologicky dokumentovanej progresie aterosklerózy aorty [17,18].
O vplyve T na makrofágy a trombocyty nie je veľa dát, predpokladá sa genomický účinok spôsobujúci transport LDL a cholesterolu v oboch smeroch – z makrofágu aj do makrofágu. Vo vzťahu k trombocytom je údaj o proagregačnom účinku testosterónu cez zvýšenú produkciu tromboxánu [19].
Ďalším aspektom, ktorý je dôležitý z hľadiska vzťahu T ku kardiovaskulárnym ochoreniam, je jeho vplyv na rizikové faktory kardiovaskulárnych ochorení: diabetes mellitus, obezitu a lipidové spektrum, v sumári vplyv na metabolický syndróm.
Testosterón a metabolický syndróm
Massachutestská prospektívna štúdia (MMAS) [20] bola za posledných 20 rokov jednou z najväčších štúdií korelujúcich hladinu testosterónu a SHBG k riziku vzniku metabolického syndrómu. Vo vzorke 950 mužov s priemerným vekom 52,9 roka boli muži sledovaní priemerne 14,4 roka a vstupná hladina testosterónu a SHBG bola korelovaná s rizikom vzniku metabolického syndrómu. Počas sledovania sa vyskytlo 300 nových prípadov metabolického syndrómu. Muži, ktorých hladiny celkového T a SHBG boli v najnižších kvartiloch, mali vyšší výskyt vzniku metabolického syndrómu (RR 2,59 pre 3. kvartil, 2,64 pre 4. kvartil), avšak táto korelácia platila iba u mužov s BMI pod 25 kg/m2. U mužov, ktorí boli obézni už na začiatku štúdie, sa korelácia nepotvrdila. Obdobne androgénový deficit, definovaný v uvedenej štúdii ako: 1. minimálne 3 klinické symptómy a celkový testosterón pod 200 ng/dl alebo 2. minimálne 3 klinické symptómy a celková hladina testosterónu v sére 200–400 ng/dl a hladina voľného testosterónu menej ako 8,91 ng/dl, bol asociovaný so vznikom metabolického syndrómu u neobéznych mužov (RR 2,51 u mužov s BMI pod 25 kg/m2 vs RR 1,22 u mužov s BMI nad 25 kg/m2). Negatívna korelácia medzi voľným testosterónom a metabolickým syndrómom nebola dokázaná. Nedostatkom tejto štúdie bol fakt, že kritériá metabolického syndrómu neboli dostatočne objektivizované – diabetes mellitus bol stanovený len na základe ústneho podania pacienta – hladina glykémie nalačno nebola meraná, rovnako nebola v úvodnom meraní stanovená hladina TAG (metabolický syndróm bol definovaný ako prítomnosť 3 a viac z nasledovného: obvod pása nad 105 cm, TK 130/85 mm Hg a viac, hladina HDL pod 2,22 mmol/l a pacientom dokumentovaný diabetes mellitus). Tieto faktory mohli viesť k podhodnoteniu počtu pacientov s metabolickým syndrómom v úvode štúdie. MMAS bola podkladom aj pre vytvorenie súboru pacientov porovnávajúcich hladiny pohlavných hormónov s mortalitou [21]. V súbore bolo 1 686 mužov a počas 15,3 roka sa objavilo 395 úmrtí. Korelácia medzi celkovou mortalitou a hladinou pohlavných hormónov nebola dokázaná. Ďalšia štúdia čerpajúca zo súboru mužov MMAS porovnávala koreláciu T a SHBG k rozvoju diabetes mellitus 2. typu [22]. Hladina nízkeho fT v nej predikovala k vzniku diabetes mellitus 2. typu.
Kupelian et al v prierezovej štúdii potvrdili štatisticky signifikantný vzťah metabolického syndrómu ako celku a aj jeho jednotlivých zložiek k hladinám TT, fT a SHBG, a to medzi všetkými sledovanými etnickými skupinami. U analyzovaných 1 885 mužov dokázali najsilnejšiu asociáciu nízkych hladín TT, fT a SHBG s abdominálnou obezitou a dyslipidémiou v zmysle zvýšených TAG a nízkeho HDL a miernejšiu asociáciu s DM 2. typu [23].
Vzťah testosterónu k metabolickému syndrómu potvrdili aj ďalšie práce. Muller et al [24] dokázali štatisticky signifikantne pozitívnu koreláciu medzi hladinami celkového testosterónu, kalkulovaného biologicky dostupného testosterónu a SHBG s inzulínovou senzitivitou u 400 mužov vo veku 40–80 rokov. Prítomnosť metabolického syndrómu negatívne korelovala s hladinami T, bioT a SHBG, a to nezávisle na hodnotách hladiny inzulínu a antropometrických parametroch (pomer pás/boky, BMI).
Veľká austrálska prierezová štúdia korelovala hladinu T, fT a SHBG s metabolickým syndrómom a jeho jednotlivými zložkami u 2 052 mužov. SHBG koreloval negatívne so všetkými zložkami metabolického syndrómu, celkový testosterón so všetkými okrem hypertenzie a voľný testosterón bol asociovaný len s obvodom pása a hladinou TAG. Celková korelácia metabolického syndrómu s TT a SHBG bola štatisticky signifikantná (OR 1,78 pre TT, 2,04 pre SHBG) [25].
Laaksonen et al [26] sledovali 702 mužov v priemere 11 rokov – u 147 sa počas sledovania vyvinul metabolický syndróm a u 57 diabetes mellitus. Muži, ktorých hodnoty TT, kalkulovaného fT a SHBG boli v najnižšom kvartile mali 2,3-násobne vyššie riziko rozvoja metabolického syndrómu, avšak po korekcii na hmotnosť došlo k oslabeniu korelácie, a to najmä pre fT, ktorý s rozvojom diabetu po korekcii na BMI nekoreloval vôbec. Iné štúdie potvrdili negatívnu koreláciu metabolického syndrómu a testosterónu a SHBG aj po korekcii na hmotnosť [27–29].
Keating et al [30] demonštrovali, že androgénová deprivácia pri terapii karcinómu prostaty je asociovaná so zvýšenou incidenciou DM 2. typu a kardiovaskulárnymi ochoreniami. Naopak, u mužov s evidovaným DM 2. typu boli dokázané nižšie hladiny testosterónu [31–33]. Otázkou zostáva, či je nedostatok celkového T pri nedostatku SHBG dôsledok hyperinzulinizmu alebo naopak deficit testosterónu spôsobuje inzulínovú rezistenciu. Patofyziologicky pri hypogonadizme je zvýšená premena testosterónu na estradiol, estradiol u mužov pôsobí proadipogénne a obezita vedie k inzulínovej rezistencii. Na druhej strane hyperinzulinémia znižuje hladinu SHBG, čo spôsobí pokles celkového testosterónu v plazme [2].
V našom doposiaľ nepublikovanom súbore 39 pacientov s akútnym koronárnym syndrómom sme dokumentovali koreláciu celkového testosterónu a SHBG s BMI a obvodom pása. Pre SHBG sme zistili aj inverznú koreláciu s hladinou TAG a s počtom zložiek metabolického syndrómu. Koreláciu voľného testosterónu s jednotlivými zložkami metabolického syndrómu sme nezaznamenali. Tieto predbežné výsledky vyžadujú potvrdenie na väčšom súbore pacientov.
Image 2. Vzťah medzi androgénovým deficitom a metabolickým syndrómom a endotelovou dysfunkciou. Spracované podľa Traish AM, Saad F, Feeley RJ et al. The Dark side of Testosterone Deficiency: III. Cardiovascular Diseae. J of Andrology 2009; 30: 17– 19. 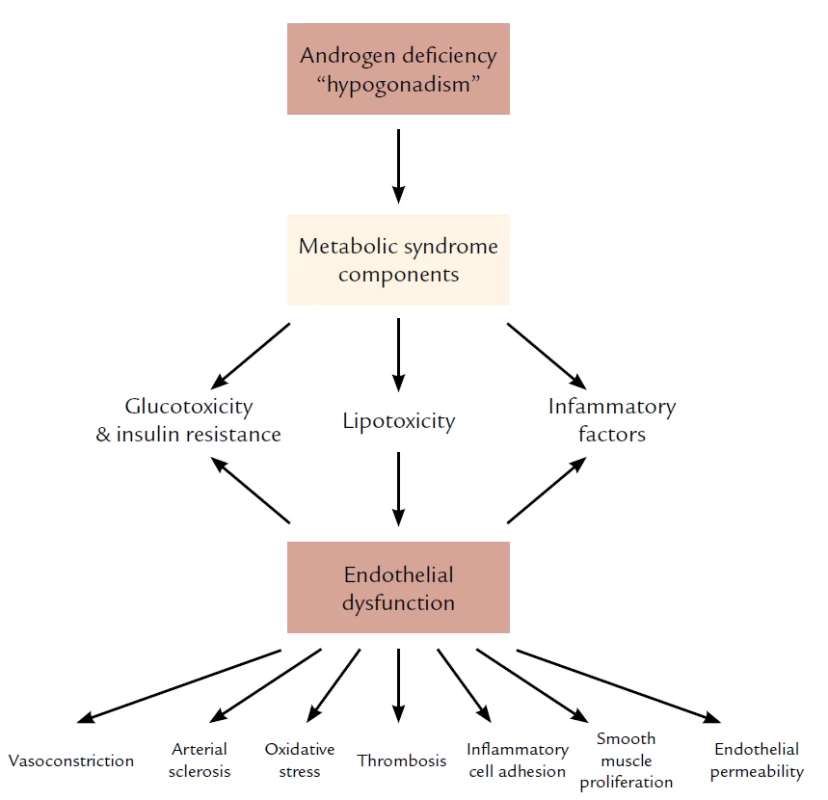
Hladina testosterónu a mortalita u mužov
Prospektívna štúdia Rancho Bernado [34] skúmala príčiny mortality u 794 mužov vo veku 50–91 rokov v rokoch 1984–1987. Sledovaná bola mortalita a príčiny úmrtia počas 11,8 roka. Už pri vstupných meraniach bolo zistené, že muži s nízkou hladinou testosterónu mali vyššie BMI, TK, glykémiu nalačno, TAG a naopak nízke hodnoty HDL. Zo 794 mužov počas sledovania zomrelo 538, pričom muži, ktorých koncentrácie testosterónu spadali do najnižšieho kvartilu, mali o 40 % (pre TT) a 44 % (pre bioT) vyššie riziko úmrtia oproti mužom v najvyššom kvartile. Aj keď údaje korigovali na ďalšie rizikové faktory – DM, kardiovaskulárne ochorenia a metabolický syndróm – výsledky zostali približne rovnaké (tab. 2). Pri skúmaní príčin mortality bolo zaznamenané zvýšené riziko na kardiovaskulárne a respiračné ochorenia, a to aj pri vylúčení mortality v prvých 5 rokov sledovania.
Tromso štúdia [35] bola nórska pro-spektívna štúdia, ktorá sledovala 1 568 náhodne vybratých mužov s prie-merným vekom 59 rokov. Sledované parametre boli hladiny endogénnych pohlavných hormónov vo vzťahu k celkovej mortalite, mortalite na kardiovaskulárne ochorenia, ischemickú chorobu srdca a vzťah hladiny endogénnych pohlavných hormónov k výskytu prvého infarktu myokardu. Štúdia dokázala vyššiu celkovú mortalitu u mužov s hodnotami voľného testosterónu v najnižšom kvartile (RR 1,24, CI 1,01–1,54). Vyššia mortalita na kardiovaskulárne ochorenia ani ischemickú chorobu srdca nebola dokázaná, rovnako výskyt prvého infarktu myokardu nekoreloval s hladinou pohlavných hormónov. Korelácia bola dokázaná len pre hladinu voľného testosterónu, avšak nie pre hladinu celkového testosterónu.
V prospektívnej švédskej štúdii [36] sledujúcej 3 014 mužov dokázali zvýšenú celkovú mortalitu u mužov s nízkymi hladinami voľného aj celkového testosterónu a tiež u mužov s nízkymi hladinami estradiolu.
Iné štúdie nedokázali koreláciu hladiny endogénnych pohlavných hormónov s mortalitou (Caerphilská štúdia [37] a MMAS [21]), avšak v týchto štúdiách bolo významne nižšie percento mortality oproti štúdii Rancho Bernado (19 a 31 % vs 68 %).
Okrem vyššej celkovej mortality sú aj správy o častejšom výskyte cievnej mozgovej príhody a tranzitórnej ischémie mozgu u mužov s nízkymi hladinami celkového testosterónu [38].
SHBG vs voľný testosterón alebo prelom v tzv. „free hormone hypothesis“
V súvislosti s výsledkami niektorých štúdií a názorom, že SHBG a celkový testosterón koreluje s rizikovými faktormi metabolického syndrómu a s mortalitou na kardiovaskulárne ochorenia užšie ako samotný voľný testosterón, ponúka sa otázka vplyvu samotného SHBG na kardiovaskulárne ochorenia. Okrem známeho faktu, že produkcia SHBG je v pečeni znížená pri hyperinzulinizme, a teda negatívna korelácia metabolického syndrómu a SHBG je vysvetliteľná týmto mechanizmom, sa v súčasnosti poukazuje aj na možnosť pôsobenia androgénov v cieľových bunkách práve prostredníctvom SHBG. Hammes et al [11] objavili dôležitosť megalínu – multiproteínového endocytárneho receptora, ktorý je ligandom pre SHBG. V podmienkach in vitro dokázali, že SHBG sa viaže na megalín a že vychytávanie označeného testosterónu v bunkách bolo zablokované megalínovým inhibítorom a nadbytkom SHBG. V štúdiách na myšiach, ktorým zablokovali gén pre megalín došlo k 95% neonatálnej letalite a myši, ktoré prežili, mali buď nezostúpené testes, alebo neotvorenú vagínu, čo sú procesy závisiace na účinku pohlavných hormónov [39]. Iné štúdie zase hovoria o pôsobení SHBG priamo na receptor v cytoplazmatickej membráne, ktorý umožňuje prenos androgénového a estrogénového signálu do bunky pomocou aktivácie cAMP [10,40].
Mortalita a morbidita u pacientov s Klinefelterovým syndrómom
U pacientov s Klinefelterovým syndrómom, a teda deficitom endogénneho testosterónu by sme dľa hypotézy, že deficit testosterónu zvyšuje riziko kardiovaskulárnych ochorení, očakávali, že budú mať vyššiu mortalitu na ischemickú chorobu srdca. Jedna z najväčších prierezových štúdií v Británii sledovala 3 518 pacientov s Klinefeterovým syndrómom [41]. Zaznamenaných bolo 461 úmrtí, pričom najvyššia mortalita bola zaznamená na vaskulárne ochorenia čreva, neurologické a kardiovaskulárne ochorenia. Úmrtie na ICHS však bolo štatisticky signifikantne nižšie oproti ostatnej populácii (RR 0,7). Zvýšená mortalita na kardiovaskulárne ochorenia ako celok bola následkom zvýšeného výskytu mortality na tromboembolické príhody a periférne vaskulárne ochorenia. Výrazným nedostatkom štúdie je však fakt, že autori nemali informácie o liečbe preparátmi exogénneho testosterónu a nebola meraná hladina testosterónu v sére. Nie je teda možné objektivizovať, nakoľko príčiny úmrtí boli asociované s hladinou testosterónu. Naopak v dánskych štúdiách s menším počtom pacientov bola dokázaná zvýšená morbidita na ICHS u pacientov s KS (RR 1,71) [42], avšak v príčine úmrtí dominovali ochorenia infekčné a neurologické oproti kardiovaskulárnym [43].
Substitučná liečba testosterónom
V súvislosti so zistením, že deficit testosterónu je pravdepodobne asociovaný s vyšším rizikovým profilom kardiovaskulárnych ochorení a snáď i mortalitou [34] bola skúmaná substitučná liečba testosterónom jednak na patofyziologickej úrovni vo vzťahu k endotelovej dysfunkcii ako aj na úrovni vzťahu substitučnej liečby T k ovplyvneniu rizikových faktorov kardiovaskulárnych ochorení.
Z hľadiska endotelovej dysfunkcie bol dokázaný pozitívny efekt administrácie T na vazodilatáciu sprostredkovanú NTG po 12 týždňov podávania T [44]. V predklinických štúdiách na potkanoch bol dokázaný výraznejšie poškodený endotel u kastrovaných potkanov a tento vzťah sa čiastočne zlepšil po androgénovej substitúcii [45].
V klinických štúdiách liečba T viedla k predĺženiu času vedúceho k ischémii myokardu. English et al podával transdermálne T v dávke 5 mg denne 46 mužom. U mužov dostávajúcim testosterón došlo po 12 týždňoch k predĺženiu času ischémie dokumentovanej zaznamenaním 1 mm depresie ST segmentu počas záťaže z 309 s na 364 s. Táto zmena bola štatisticky signifikantná v porovnaní s placebom. Rozdiel v subjektívnom vnímaní stenokardií pacientom nebol dokázaný [46].
Dokázaný bol aj efekt podávania T liečby na funkciu myokardu. Pugh et al dokázali, že substitúcia T viedla k zvýšeniu vývrhového objemu srdca a zníženiu vaskulárnej periférnej rezistenicie u mužov s chronickým srdcovým zlyhávaním [47]. V ďalšej štúdii 8-týždňová administrácia T zlepšila perfúziu myokardu v neobliterovaných artériách a zvýšila ejekčnú frakciu srdca, nemala však vplyv na celkovú perfúziu myokardu, endotelovú funkciu a pacientom dokumentovaný klinický korelát – syndróm anginy pectoris [48].
V neposlednom rade sú tu údaje, ktoré poukazujú na zlepšenie jednotlivých rizikových faktorov kardiovaskulárnych ochorení pri liečbe T.
V Sheffieldskej štúdii [49] dokázali, že testosterónová terapia zlepšuje inzulínovú rezistenciu, viscerálnu adipozitu a hypercholesterolémiu u hypogonádnych mužov s DM 2. typu. 24 mužom podávali testosterón v dávke 200 mg 2-krát týždne v priebehu 3 mesiacov, po mesačnej pauze bolo rovnakým spôsobom nasadené placebo. Bol dokázaný štatisticky signifikantný pozitívny vplyv testosterónu na zníženie inzulínovej rezistencie a glykémie nalačno, rovnako aj pokles hladiny celkového cholesterolu a pokles pomeru pás/boky. Vplyv na jednotlivé lipidové frakcie a artériovú hypertenziu nebol preukázaný.
Bhasin popisuje zníženie viscerálnej adipozity, glykémie nalačno a spomaľovanie procesu aterogenézy u mužov, ktorí užívali testosterónovú terapiu, popisuje tiež zvýšenie inzulínovej senzitivity a zlepšenie prietoku koronárnymi cievami [50].
Sumárne je v literatúre popisovaný priaznivý efekt podávania T na všetky zložky metabolického syndrómu: obezitu [51,52], hypertenziu [53], dyslipidémiu [54] a inzulínovú rezistenciu.
Záver
Vzťah medzi hladinou androgénov a rizikom kardiovaskulárnych ochorení je diskutovanou otázkou posledných rokov. Hladina TT a voľného T v rôznej miere koreluje negatívne s jednotlivými zložkami metabolického syndrómu. Otázkou zostáva, či je androgénový deficit následkom alebo príčinou metabolického syndrómu. Inzulínová rezistencia vedie k poklesu SHBG, a teda aj k zníženiu celkovej frakcie plazmatického testosterónu. Na druhej strane sú dôkazy o asociácii metabolického syndrómu a hladiny T nezávisle na hladine inzulínu [24] a zároveň je dokumentované zlepšenie inzulínovej senzitivity po podávaní exogénneho T [49]. Veľké epidemiologické štúdie zistili, že pri deficite T bola zaznamenaná vyššia celková úmrtnosť, kardiovaskulárne ochorenia však neboli hlavnou príčinou úmrtnosti. Výsledky štúdií s podávaním androgénovej substitučnej liečby sa zdajú sľubné, avšak boli zatiaľ zväčša realizované s malým počtom pacientov. K poukázaniu na prínos androgénovej terapie v prevencii kardiovaskulárnych ochorení je potrebná realizácia veľkých dlhodobých randomizovaných placebom kontrolovaných štúdií.
Použité skratky
T – testosterón
TT – celkový (total) testosterón
bioT – biologicky dostupný testosterón
fT – voľný (free) T
BMI – body mass index
RR – risk ratio
OR – odds ratio
HDL – high density lipoproteins
TAG – triacylglyceroly
VCAM1 – vascular cell adhesion molecule-1
prof. MUDr. Juraj Payer, CSc.
www.fnspba.sk
e‑mail: payer@ruzinov.fnspba.sk
Doručeno do redakce: 30. 5. 2010
Sources
1. Lerner DJ, Kannel WB. Patterns of coronary heart disease morbidity and mortality in the sexes: a 26‑year follow‑up of the Framingham population. Am Heart J 1986; 111 : 383–390.
2. von Eckardstein A, Wu FC. Androgens and coronary artery disease. Endocr Rev 2003; 24 : 183–217.
3. Blahoš J, Bleha O. Endokrinologie. 2. vyd. Praha: Avicenum 1988.
4. Kreze A, Langer P, Klimeš I et al. Všeobecná a klinická endokrinológia. Bratislava: Academic Electronic Press 2004 : 423–429.
5. Horwitz KB, Horwitz LD. Canine vascular tissues are targets for androgens, estrogens, progestins and glucocorticoids. J Clin Invest 1982; 69 : 750–758.
6. Hanke H, Lenz C, Hess B et al. Effect of testosterone on plaque development and androgen receptor expression in the arterial vessel wall. Circulation 2001; 103 : 1382–1385.
7. Fujimoto R, Morimoto I, Morita E et al. Androgen receptors, 5 alfa‑reductase activity and androgen dependent proliferation of vascular smooth muscle cells. J Steroid Biochem Mol Biol 1994; 50 : 169–174.
8. Cutolo M, Villaggio B, Barone A et al. Primary cultures of human synovial macrophages metabolize androgens. Ann N Y Acad Sci 1996; 784 : 534–541.
9. Khetawat G, Faraday N, Nealen ML et al. Human megakaryocytes and platelets contain the estrogen receptor beta and androgen receptor (AR): testosterone regulates AR expression. Blood 2000; 95 : 2289–2296.
10. Kahn SM, Hryb DJ, Nakhla AM et al. Sex hormone binding globulin is synthesized in target cells. J Endocrinol 2001; 175 : 113–120.
11. Hammes A, Andreassen TK, Spoelgen R et al. Role of endocytosis in cellular uptake of sex steroids. Cell 2005; 122 : 751–762.
12. Akishita M, Hashimoto M, Ohike Y et al. Low testosterone level is an independent determinant of endothelial dysfunction in men. Hypertens Res 2007; 30 : 1029–1034.
13. Yue P, Chatterjee K, Beale C et al. Testosterone relaxes rabbit coronary arteries and aorta. Circulation 1995; 91 : 1154–1160.
14. Zitzmann M, Brune M, Kornmann B et al. The CAG repeat polymorphism in the AR gene affects high density lipoprotein cholesterol and arterial vasoreactivity. J Clin Endocrinol Metab 2001; 86 : 4867–4873.
15. Foresta C, Zuccarello D, De Toni L at al. Androgens stimulate endothelial progenitor cells through an androgen-mediated pathway. Clin Endocrinol (Oxf) 2008; 68 : 284–289.
16. Foresta C, Caretta N, Lana A et al. Reduced number of circulating endothelial progenitor cells in hypogonadal men. J Clin Endocrinol Metab 2006; 91 : 4599–4602.
17. Fu L, Gao QP, Shen JX. Relationship between testosterone and indexes indicating endothelial function in male coronary heart disease patients. Asian J Androl 2008; 10 : 214–218.
18. Malkin CJ, Pugh PJ, Jones TH et al. Testosterone for secondary prevention in men with ischaemic heart disease? QJM 2003; 96 : 521–529.
19. Ajayi AA, Mathur R, Halushka PV. Testosterone increases human platelet tromboxane A2 receptor density and aggregation responses. Circulation 1995; 91 : 2742–2747.
20. Kupelian V, Page ST, Araujo AB et al. Low sex hormone‑binding globulin, total testosterone, and symptomatic androgen deficiency are associated with development of the metabolic syndrome in nonobese men. J Clin Endocrinol Metab 2006; 91 : 843–850.
21. Araujo AB, Kupelian V, Page ST et al. Sex steroids and all cause and specific mortality in men. Arch Intern Med 2007; 167 : 1252–1260.
22. Stellato RK, Feldman HA, Hamdy O et al. Testosterone, SHBG and the development of type 2 diabetes in middle-aged men: prospective results from the Massachusetts male aging study. Diabetes Care 2000; 23 : 490–494.
23. Kupelian V, Hayes FJ, Link CL et al. Inverse association of testosterone and the metabolic syndrome in men is consistent across race and ethnic group. J Clin Endocrinol Metab 2008; 93 : 3403–3410.
24. Muller M, Grobbee DE, den Tonkelaar I et al. Endogenous sex hormones and metabolic syndrome in aging men. J Clin Endocrinol Metab 2005; 90 : 2618–2623.
25. Chubb SA, Hyde Z, Almeida OP et al. Lower sex hormone binding globulin is more strongly associated with metabolic syndrome than lower total testosterone in older men: the health in men study. Eur J Endocrinol 2008; 158 : 785–792.
26. Laaksonen DE, Nikanen L, Punnonen K et al. Testosterone and SHBG predict the metabolic syndrome and diabetes in middle aged men. Diabetes Care 2004; 27 : 1036–1041.
27. Haffner SM, Valdez RA, Mykkänen L et al. Decreased testosterone and dehydroepiandrosterone sulfate concentrations are associated with increased insulin and glucose concentrations in nondiabetic men. Metabolism 1994; 43 : 599–603.
28. Laaksonen DE, Niskanen L, Punnonen K et al. Sex hormones, inflammation and the metabolic syndrome: a population‑based study. Eur J Endocrinol 2003; 149 : 601–608.
29. Haffner SM, Mykkänen L, Valdez RA et al. Relationship of sex hormones to lipids and lipoproteins in nondiabetic men. J Clin Endocrinol Metab 1993; 77 : 1610–1615.
30. Keating NL, O‘Malley AJ, Freedland SJ. Diabetes and cardiovascular disease during androgen deprivation: observational study of veterans with prostate cancer. J Natl Cancer Inst 2010; 102 : 39–46.
31. Barrett-Connor E. Lower endogenous androgen levels and dyslipidemia in men with non‑insulin‑dependent diabetes mellitus. Ann Intern Med 1992; 117 : 807–811.
32. Andersson B, Mårin P, Lissner L et al. Testosterone concentration in women and men with NIDDM. Diabetes Care 1994; 17 : 405–411.
33. Fukui M, Soh J, Tanaka M et al. Low serum testosterone concentration in middle-aged men with type 2 diabetes. Endocr J 2007; 54 : 871–877.
34. Laughlin GA, Barrett-Connor E, Bergstrom J. Low serum testosterone and mortality in older men. J Clin Endocrinol Metab 2008; 93 : 68–75.
35. Vikan T, Schirmer H, Njølstad I et al. Endogenous sex hormones and the prospective association with cardiovascular disease and mortality in men: the Tromsø study. Eur J Endocrinol 2009; 161 : 435–442.
36. Tivesten A, Vandenput L, Labrie F et al. Low serum testosterone and estradiol predict mortality in elderly men. J Clin Endocrinol Metab 2009; 94 : 2482–2488.
37. Smith GD, Ben-Shlomo Y, Beswick A et al. Cortisol, testosterone, and coronary heart disease: prospective evidence from the Cearphilly study. Circulation 2005; 112 : 332–340.
38. Yeap BB, Hyde Z, Almeida OP et al. Lower testosterone levels predict incident stroke and transient ischemic attack in older men. J Clin Endocrinol Metab 2009; 94 : 2353–2359.
39. Willnow TE, Hilpert J, Armstrong SA et al. Defective forebrain development in mice lacking gp330/megalin. Proc Natl Acad Sci USA 1996; 93 : 8460–8464.
40. Rosner W, Hryb DJ, Kahn SM et al. Interactions of sex hormone‑binding globulin with target cells. Mol Cell Endocrinol 2010; 316 : 79–85.
41. Swerdlow AJ, Higgins CD, Schoemaker MJ et al. Mortality in patients with Klinefelter syndrome in Britain: a cohort study. J Clin Endocrinol Metab 2005; 90 : 6516–6522.
42. Bojesen A, Juul S, Birkebaek NH et al. Morbidity in Klinefelter syndrome, a Danish register study based on hospital discharge diagnoses. J Clin Endocrinol Metab 2006; 91 : 1254–1260.
43. Bojesen A, Juul S, Birkebaek N et al. Increased mortality in Klinefelter syndrome. J Clin Endocrinol Metab 2004; 89 : 3830–3834.
44. Kang SM, Jang Y, Kim JY et al. Effect of oral administration of testosterone on brachial arterial vasoreactivity in men with coronary artery disease. Am J Cardiol 2002; 89 : 862–864.
45. Lu YL, Kuang L, Zhu H et al. Changes in aortic endothelium ultrastructure in male rats following castration, replacement with testosterone and administration of 5‑alpha-reductase inhibitor. Asian J Androl 2007; 9 : 843–847.
46. English KM, Steeds RP, Jones TH et al. Low‑dose transdermal testosterone therapy improves angina threshold in men with chronic stable angina: a randomized, double‑blind, placebo-controlled study. Circulation 2000; 102 : 1906–1911.
47. Pugh PJ, Jones TH, Channer KS. Acute haemodynamic effects of testosterone in men with chronic heart failure. Eur Heart J 2003; 24 : 909–915.
48. Webb CM, Elkington AG, Kraidly MM et al. Effects of oral testosterone treatment on myocardial perfusion and vascular function in men with low plasma testosterone and coronary heart disease. Am J Cardiol 2008; 101 : 618–624.
49. Kapoor D, Goodwin E, Channer KS et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006; 154 : 899–906.
50. Bhasin S. Effects of testosterone administration on fat distribution, insulin sensitivity and atherosclerosis progression. Clin Infect Dis 2003; 37 (Suppl 2): S142–S149.
51. Allan CA, Strauss BJ, Burger HG et al. Testosterone therapy prevents gain in adipose tissue and loss of skeletal muscle in nonobese aging men. J Clin Endocrinol Metab 2008; 93 : 139–146.
52. Haffner SM, Karhapää P, Mykkänen L et al. Insulin resistance, body fat distribution and sex hormones in men. Diabetes 1994; 43 : 212–219.
53. Dubey RK, Oparil S, Imthurn B et al. Sex hormones and hypertension. Cardiovasc Res 2002; 53 : 688–708.
54. Haffner SM, Mykkänen L, Valdez RA et al. Relationship of sex hormones to lipids and lipoproteins in nondiabetic men. J Clin Endocrinol Metab 1993; 77 : 1610–1615.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 7-
All articles in this issue
- Hyperlipoproteinemie a dyslipoproteinemie II. Terapie: Nefarmakologická a farmakologická léčba
- Chronická pankreatitida a skelet
- Nezbytnost soustavného rozvoje rozsáhlého systému péče o zdraví
- Elektrokardiografické markery u pacientov s hypertrofickou kardiomyopatiou
- Mezinárodní kurz NATO pro nácvik a výuku řešení situací s hromadným výskytem raněných
- 12 rokov kontinuálneho medicínskeho vzdelávania na Slovensku
- Hypofyzární adenomy – kam směřuje léčba na počátku 21. století?
- Kyselina oxalová – významný uremický toxín
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Současné možnosti a principy patomorfologické diagnostiky nádorů
- Nátriuretické peptidy pri aortovej stenóze
- Kardiovaskulárne ochorenia u reumatoidnej artritídy
- Zásady péče o pacienty s intermitentními klaudikacemi
- Trnitá cesta metabolického syndromu prosadit se v praxi
- Diabetická osteopatie: onemocnění kdysi sporné a pravděpodobně významné
- Dočkáme se protinádorových vakcín?
- Současné možnosti léčby osteoporózy
- Laboratorní diagnostika a endokrinologie
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Přežití a kvalita života u popálenin
- Technika zaťažovania skeletu so spätnou väzbou v rehabilitácií osteoporotického pacienta (Biomechanická analýza)
- Index pevnosti femuru versus hustota kostného minerálu: nové poznatky (Slovenská epidemiologická štúdia)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní diagnostika a endokrinologie
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Chronická pankreatitida a skelet
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



