-
Medical journals
- Career
Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
: Z. Žilinská 1; M. Chrastina 1; J. Breza 1; M. Drakulová 2
: Urologická klinika s Centrom pre transplantácie obličiek Lekárskej fakulty UK a Univerzitnej nemocnice Bratislava, Slovenská republika, prednosta prof. MUDr. Dr. h. c. Ján Breza, DrSc. 1; SYNLAB. SK s. r. o., Bratislava, Slovenská republika, odborný garant MUDr. Monika Drakulová 2
: Vnitř Lék 2010; 56(7): 774-778
: 80th Birthday - Jaroslava Blahoše, MD, DrSc.
Anémia patrí medzi najčastejšie, multifaktoriálne podmienené komplikácie po transplantácii obličky [1,2]. Na rozvoji potransplantačnej anémie participujú najmä krvné straty pri operácii, deficit zásob sérového železa, zápal, útlm krvotvorby v dôsledku imunosupresie a antivírusovej liečby, použitie inhibítorov angiotenzín‑konvertujúceho enzýmu a/alebo blokátorov receptoru angiotenzínu II, hyperparatyreóza, porušená funkcia transplantovanej obličky a v neposlednom rade vírusové ochorenia [1–3]. Pretrvávajúca aplastická anémia po transplantácii obličky môže byť spôsobená infekciou parvovírusom B19 [1,2,4,5].
Kľúčové slová:
parvovírus B19 – anémia – transplantácia obličky – imunoglobulínyÚvod
Anémia patrí medzi najčastejšie, multifaktoriálne podmienené komplikácie po transplantácii obličky [1,2]. Na rozvoji potransplantačnej anémie participujú najmä krvné straty pri operácii, deficit zásob sérového železa, zápal, útlm krvotvorby v dôsledku imunosupresie a antivírusovej liečby, použitie inhibítorov angiotenzín‑konvertujúceho enzýmu a/alebo blokátorov receptoru angiotenzínu II, hyperparatyreóza, porušená funkcia transplantovanej obličky a v neposlednom rade vírusové ochorenia [1–3]. Pretrvávajúca aplastická anémia po transplantácii obličky môže byť spôsobená infekciou parvovírusom B19 [1,2,4,5].
Charakteristika vírusu
Parvovírus B19 je malý vírus pozostávajúci z jednej špirály DNA (parvo – malý). Prvýkrát bol identifikovaný v roku 1975 Cossartovou et al ako jediný humánny vírus veľkej rodiny Parvoviridae, do ktorej patria vírusové patogény zvierat a hmyzu [6]. Pretože vírus vykazuje tropizmus k prekurzorom erytropoézy, je začlenený do rodu Erythrovirus [7,8]. Parvovírus sa viaže na glykosfingolipid globosid, t.j. P antigén krvných skupín, ktorý sa nachádza najmä na erytroidných progenitorových bunkách [8,9]. Expresia P antigénu bola dokázaná aj na fetálnych myokardiálnych bunkách [10]. Replikácia vírusu prebieha len v erytroidných bunkách, kde vírus pôsobí cytotoxicky [9]. Parvovírusom B19 infikované progenitory erytropoézy podliehajú lýze a apoptóze [11].
Epidemiológia a klinické prejavy
Najčastejšie sa infekcia parvovírusomB19 prenáša priamym kontaktom s chorým (kvapôčková nákaza). Prenos je možný aj krvnými derivátmi, kostnou dreňou alebo solídnym orgánom pri transplantácii, prípadne vertikálne z matky na plod. Parvovírus B19 je častým a celosvetovo rozšíreným pôvodcom infekčných ochorení. Prítomnosť protilátok triedy IgG vzrastá s vekom, protektívne protilátky možno dokázať u 70–85 % dospelej populácie [12,13]. U imunokompetentných jedincov obvykle prebieha vírusová infekcia asymptomaticky alebo pod obrazom nešpecifického infektu horných dýchacích ciest. U detí sa často manifestuje pod obrazom tzv. piatej choroby (erythema infectiosum) [3,14]. V dospelosti býva horúčka sprevádzaná postihnutím kĺbov s artralgiami. Popisuje sa tiež vzťah k autoimunitným ochoreniam (reumatoidná artritída, systémový lupus erythematodes, sklerodermia, dermatomyozitída), vaskulitídam a postihnutiu ďalších orgánových systémov (myokarditída, hepatitída, hemolyticko‑uremický syndróm, pancytopénia, encefalopatia, meningitída, syndróm Guillain‑Barrého, pľúcna fibróza a iné) [3,15–17]. Vážnou komplikáciou je transplacentárny prenos infekcie z matky na plod. Parvovirusová infekcia neimunizovaných žien infikovaných v prvých 20. týždňoch ťarchavosti môže spôsobiť hydrops až úmrtie plodu alebo chronickú anémiu novorodenca [3,9,18]. U pacientov s chronickou hemolytickou anémiou spôsobuje parvovírus P19 aplastické krízy. Chronická útlmová anémia (chronic pure red cell aplasia), aplastické krízy a orgánové komplikácie (pneumónia, hepatitída, myokarditída) sú popisované aj u imunokompromitovaných pacientov s vrodeným alebo získaným deficitom bunkovej imunity infikovaných parvovírusom B19 [1,19–23].
Rizikovou skupinou pre vznik anémie spôsobenej parvovírusom B19 sú pacienti liečení dialýzou. U pacientov s terminálnym zlyhaním funkcie obličiek sa uplatňuje niekoľko predisponujúcich faktorov k parvovírusom indukovanej anémii: porušená imunitná odpoveď, znížená produkcia erytropoetínu, skrátené prežívanie erytrocytov v uremickom prostredí [2,19]. Zdá sa, že aj liečba rekombinantným ľudským erytropoetínom (rh‑EPO) počas nepoznanej infekcie parvovírusom B19 môže byť riziková. Stimulácia erytropoézy podávaním rh‑EPO zvyšuje počet cieľových buniek – erytroblastov, čo môže mať za následok aj vzostup replikácie parvovírusu B19 [4,5].
U pacientov po transplantácii obličky sa v súvislosti s parvovírusovou infekciou popisuje na erytropoetín rezistentná chronická anémia (pure red cell aplasia – PRCA), pancytopénia, nie je vylúčená možnosť priameho poškodenia štepu s glomerulopatiou a dysfunkciou štepu, prípadne aktiváciou cytotoxických T‑lymfocytov spustenie akútnej bunkami sprostredkovanej (celulárnej) rejekcie [3,5,24,25]. Klinické príznaky infekcie sa môžu objaviť v skorom potransplantačnom období (týždne), ale aj roky po transplantácii [26] ako následok primoinfekcie kvapôčkovou nákazou alebo prenosom cez transplantovaný orgán, prípadne reaktiváciou latentnej vírusovej infekcie [27]. U anemických pacientov po transplantácii obličky je popisovaný výskyt infekcie parvovírusom až do 23 % [28].
Diagnostika
Diagnostika parvovírusovej infekcie sa opiera o nález normocytovej normochrómnej anémie (obvykle ťažkého stupňa), ťažký deficit retikulocytov a rezistenciu na liečbu rh‑EPO. Vyšetrenie protilátok triedy IgG, ktoré poukazujú na prekonanú infekciu a triedy IgM, ktoré odrážajú akútnu infekciu, sú málo prínosné pre diagnostiku z dôvodu vysokej premorenosti populácie protektívnymi IgG protilátkami a pre dlhodobé pretrvávanie (niekoľko‑mesačné) IgM protilátok po akútnej infekcii. Pre diagnostiku je rozhodujúci dôkaz replikácie vírusu (dôkaz DNA) v krvi pomocou polymerázovej reťazovej reakcie (PCR) [18,28,29]. Dôkaz replikácie vírusu je možný aj v tkanive (kostná dreň, bioptická vzorka transplantovanej obličky).
Liečba
Neexistuje špecifická antivírusová liečba. U pacientov po transplantácii obličky sa v prípade dokázanej parvovírusovej infekcie odporúča redukovať imunosupresiu s cieľom zlepšiť antivírusovú imunitnú odpoveď [1,21–23,27,30]. Prechodná aplastická kríza vyžaduje symptomatickú liečbu krvnými derivátmi. Liečba erytropetínom je neúčinná [3–5]. U pacientov po transplantácii obličky sa ukázali účinné intravenózne imunoglobulíny v dávke 0,4–0,5 g/kg/deň 5–10 dní po sebe [1,4,11,21–23,26,27]. Imunoglobulíny majú imunomodulačný účinok a sú schopné neutralizovať vírus [31,32]. Pri relapse ochorenia sa odporúča liečbu imunoglobulínmi opakovať [1,4,11,26].
Opis prípadu
Opisujeme prípad 28-ročného pacienta so suspektnou chronickou glomerulonefritídou (biopticky neoverenou), diagnostikovanou v terminálnom štádiu zlyhania obličiek v auguste roku 2008. Ochorenie sa klinicky manifestovalo vysokým tlakom krvi, perimaleolárnymi opuchmi a proteinúriou, sonograficky výrazne zmenšenými obličkami s redukovaným parenchýmom. V októbri roku 2008 bol pacient zaradený do chronického dialyzačného programu, liečený peritoneálnou dialýzou. Okrem vysokého krvného tlaku a laboratórnych príznakov sekundárnej hyperparatyreózy neboli prítomné žiadne vážnejšie komorbidity. V laboratórnych parametroch bol nález sekundárnej normocytovej normochrómnej anémie mierneho stupňa bez potreby substitúcie preparátom železa a liečby erytropoetínom. V septembri roku 2009 pacient podstúpil primárnu transplantáciu obličky od mŕtveho darcu so spomaleným rozvojom funkcie štepu (bez potreby podpornej dialýzy). Vstupná hodnota hemoglobínu (Hb) bola 126 g/l. Indukčná a udržiavacia imunosupresívna liečba pozostávala z trojkombinácie – kortiko-steroidy, mykofenolát mofetil (2 g/deň) a takrolimus (hladina 15 ng/ml). Z dôvodu séropozitivity darcu a séronegativity príjemcu bola v rámci prevencie cytomegalovírusovej (CMV) infekcie začatá profylaktická liečba valgancyklovirom. Pacient demitovaný na 12. pooperačný deň s kreatininémiou 180 μmol/l a Hb 95 g/l. Tri týždne po transplantácii z dôvodu zhoršenej funkcie štepu (227 μmol/l) rehospitalizovaný, urobená biopsia štepu s nálezom akútnej bunkami sprostredkovanej rejekcie (TMR) II A (podľa klasifikácie Banff 2007; C4d 15 %, CMV: negat. P‑53: negat.), potransplantačný B ‑ a T‑lymfocytový cross‑match prietokovou cytometriou negatívny. Indikovaná liečba bolusmi 6-metyprednisolonu (6‑MP) v kumulatívnej dávke 2 000 mg i.v. Do domáceho ošetrenia pacient prepustený so zlepšenou funkciou štepu (kreatinín 165 μmol/l) a hodnotou Hb 104 g/l. Dva mesiace po transplantácii zaznamenaný náhly pokles v červenej krvnej zložke (Hb 71 g/l), retikulocytopénia (0,17 %), vzostup hepatálnych aminotransferáz (AST 1,05 μkat/l, ALT 4,49 μkat/l) a zhoršenie funkcie štepu (kreatinín 222 μmol/l). Siderémia (47,76 μmol/l) a hodnota ferritínu (1 180 μg/l) zvýšené, vitamín B12 (331 pmol/l) a foláty v krvi (40,3 nmol/l) v norme, celkový bilirubín (3,4 μmol/l) v norme, CMV, EBV (Ebstein‑Barrovej vírus), BKV (BK polyomavírus) a HCV (vírus hepatitídy C)DNA v krvi stanovené PCR negatívne, HBsAg negatívny, BKV DNA v moči 3,8 × 109 kópií/ml. Hladina takrolimusu 7,7 ng/ml. Ako príčinu ťažkej útlmovej anémie a hepatopatie sme predpokladali kumuláciu nežiadúcich účinkov mykofenolát mofetilu (MMF) a valgancykloviru. Z uvedeného dôvodu sme znížili dávku MMF na 1 000 mg/deň a prerušili profylaktickú liečbu valgancyklovirom. Do liečby sme pridali Epoetin b 10 000 IU s.c. Tieto úpravy však neviedli k žiadnej pozitívnej odozve, zaznamenávame pozvoľný rozvoj trombocytózy. V profylaxii ponechávame nízkomolekulový heparín. Pretrvávajúca ťažká anémia si vyžiadala symptomatickú liečbu deleukotizovanými erytrocytovými koncentrátmi (spolu 9 TU). Hematológ odporučil zvýšiť dávku rh‑EPO na 30 000 IU týždenne a odoslať krv na vyšetrenie DNA parvovírusu B19.
Popri riešení hematologickej komplikácie pacient podstúpil v úvode rehospitalizácie 2. biopsiu transplantovanej obličky s nálezom akútnej TMR IA (C4d negat., CMV negat., P‑53 negat.; Banff 2007). Indikovali sme antirejekčnú liečbu bolusmi 6‑MP. Po kumulatívnej dávke 750 mg zaznamenaný náhly pokles diurézy z 3 500 na 1 100 ml sprevádzaný vzostupom kreatininémie (508 μmol/l). Na základe sonografického a dopplerovského vyšetrenia štepu vyslovené podozrenie na akútnu trombózu renálnej artérie (obr. 1) pacient urgentne konzultovaný v Národnom ústave srdcových a cievnych chorôb (NÚSCH Bratislava). V spolupráci s Oddelením intenzívnej angiológie Kardiologickej kliniky NÚSCH a Oddelením diagnostickej a intervenčnej rádiológie NÚSCH bola po potvrdení diagnózy vykonaná farmako‑mechanická trombektómia s lokálnou kontinuálnou trombolýzou rekombinantným tkanivovým aktivátorom plazminogénu (rt‑PA) s následnou implantáciou renálneho stentu do renálnej artérie transplantovanej obličky a obnovením pretoku v štepe (obr. 2). Počas akútneho zlyhania štepu bol pacient liečený hemodialýzou (celkovo 13 dní). V tomto období sme obdržali výsledok vyšetrenia DNA parvovírusu B19 – nález kvalitatívne pozitívny. Na základe dostupných informácií sme týždeň po rekanalizácii začali liečbu intravenóznymi imunoglobulínmi (IVIG) v dávke 0,4 g/kg/deň 6 dní po sebe. Okrem vzostupu diurézy a obnovy funkcie štepu sme pri liečbe IVIG zaznamenali stabilizáciu krvného obrazu a vzostup počtu retikulocytov nad referenčné rozmedzie. Pozitívny vývoj stavu pacienta umožnil ukončiť eliminačnú liečbu a substitúciu erytrocytovými koncentrátmi. 24. 12. 2009 sme pacienta prepustili domov, v liečbe bol ponechaný rh‑EPO 10 000 IU s.c./týždeň, klopidogrel 75 mg/deň a nízkomolekulový heparín. 14 dní po ukončení liečby parvovírus B19 DNA (PCR) negatívny, Hb 100 g/l, retikulocyty 2,99 %. Doplnili sme genetické vyšetrenie vrodenej trombofílie s nálezom: faktor V Leiden: heterozygot, MTHFR (C677T) heterozygot, MTHFR (A1298C) heterozygot. Šesť týždňov po ukončení liečby IVIG sme zaznamenali opäť pozitivitu DNA parvovírusu B19 v krvi, avšak bez zjavných klinických príznakov. Štyri mesiace po akútnej trombóze štepu a liečbe IVIG je funkcia štepu zlepšená a stabilizovaná (kreatinín 311 μmol/l, denná diuréza 3 500–4 000 ml), krvný obraz stabilizovaný (Hb 139 g/l), pretrváva retikulocytóza 2,66 %. Pacient pokračuje v liečbe prednisonom 5 mg/deň, MMF 1 000 mg/deň, takrolimom (5,4 ng/ml), pre záchyt CMV virémie sme obnovili liečbu valgancyklovirom. BKV virúria má klesajúcu tendenciu 2,7 × 104 kópií/ml. Vývoj funkcie štepu a hemoglobínu v závislosti od liečebnej intervencie uvádzame na obr. 3.
1. USG nález akútnej trombózy art. renalis transplantovanej obličky (kazuistika – pac., 28 r.; 11 týždňov po transplantácii). 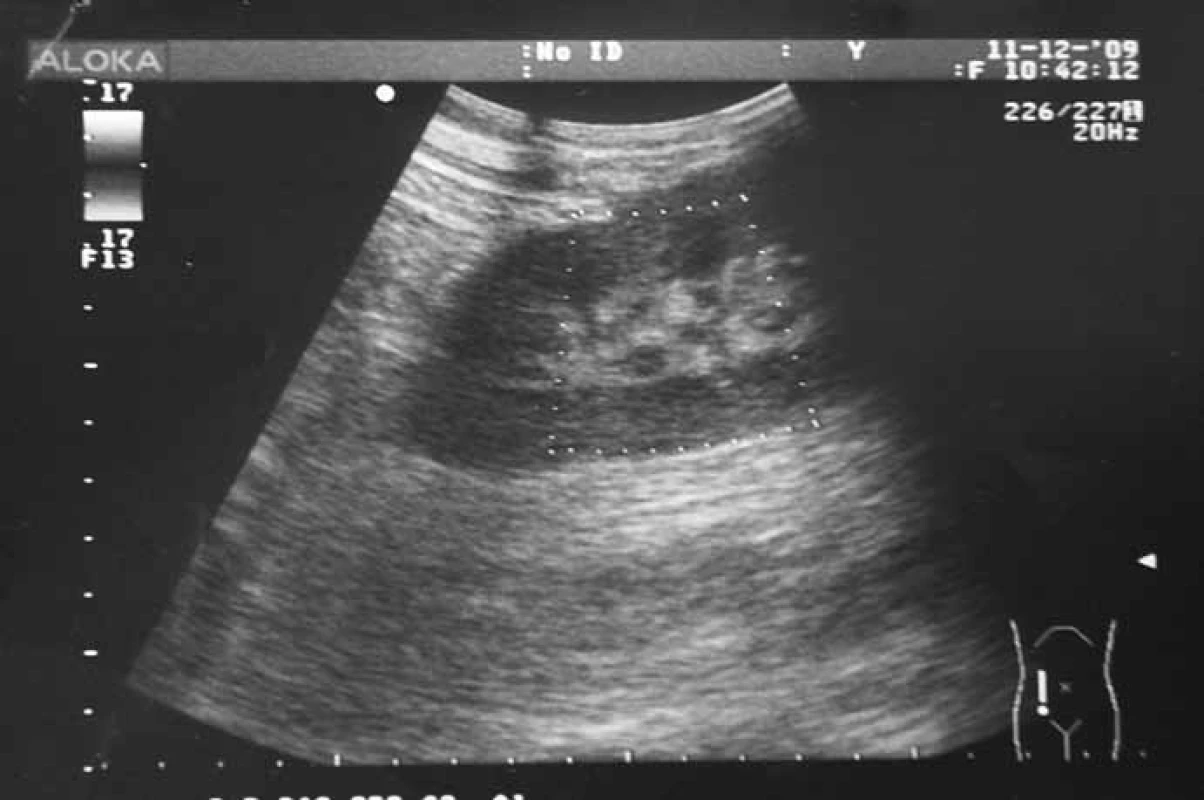
2. USG nález po obnovení prietoku krvi v transplantovanej obličke – stav po farmako-mechanickej trombektómii s lokálnou kontinuálnou trombolýzou rt-PA a implantáciou stentu do renálnej artérie transplantovanej obličky (rovnaký pacient ako obr. 1). 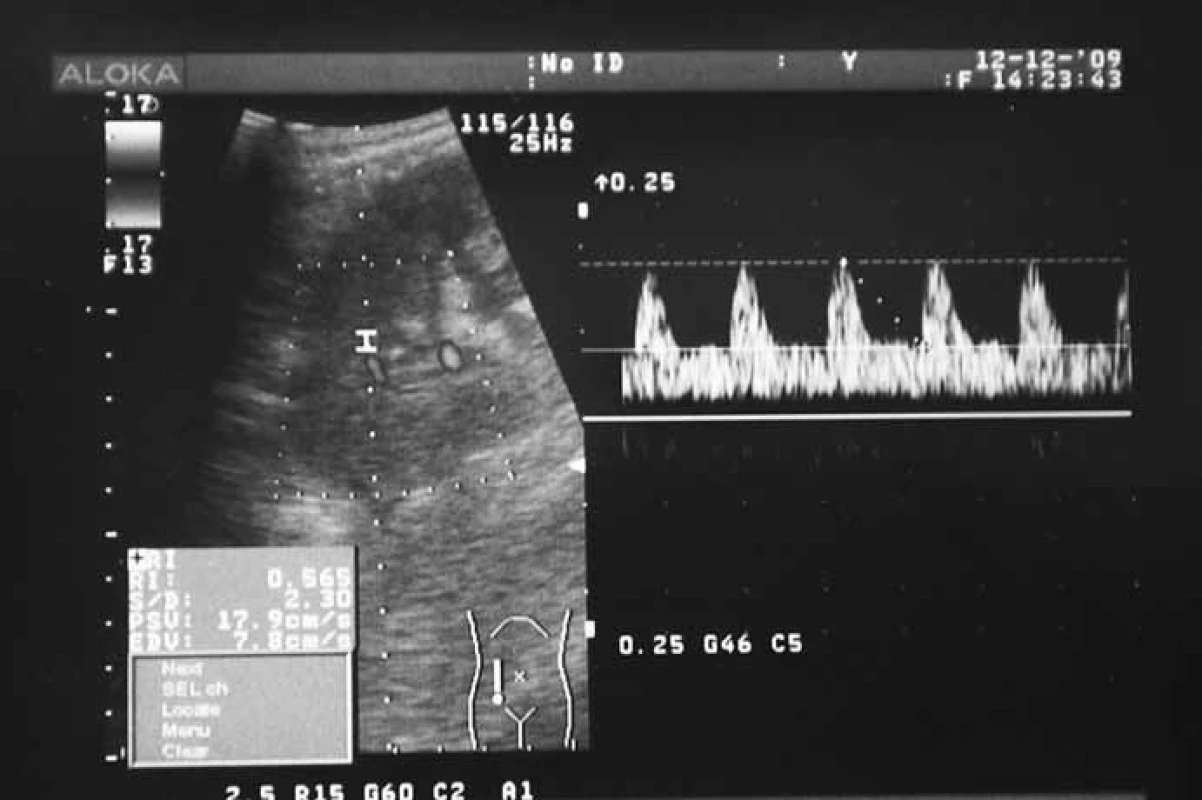
3. Vývoj funkcie štepu a hemoglobínu v závislosti od liečebnej intervencie u pacienta s parvovírusovou infekciou. 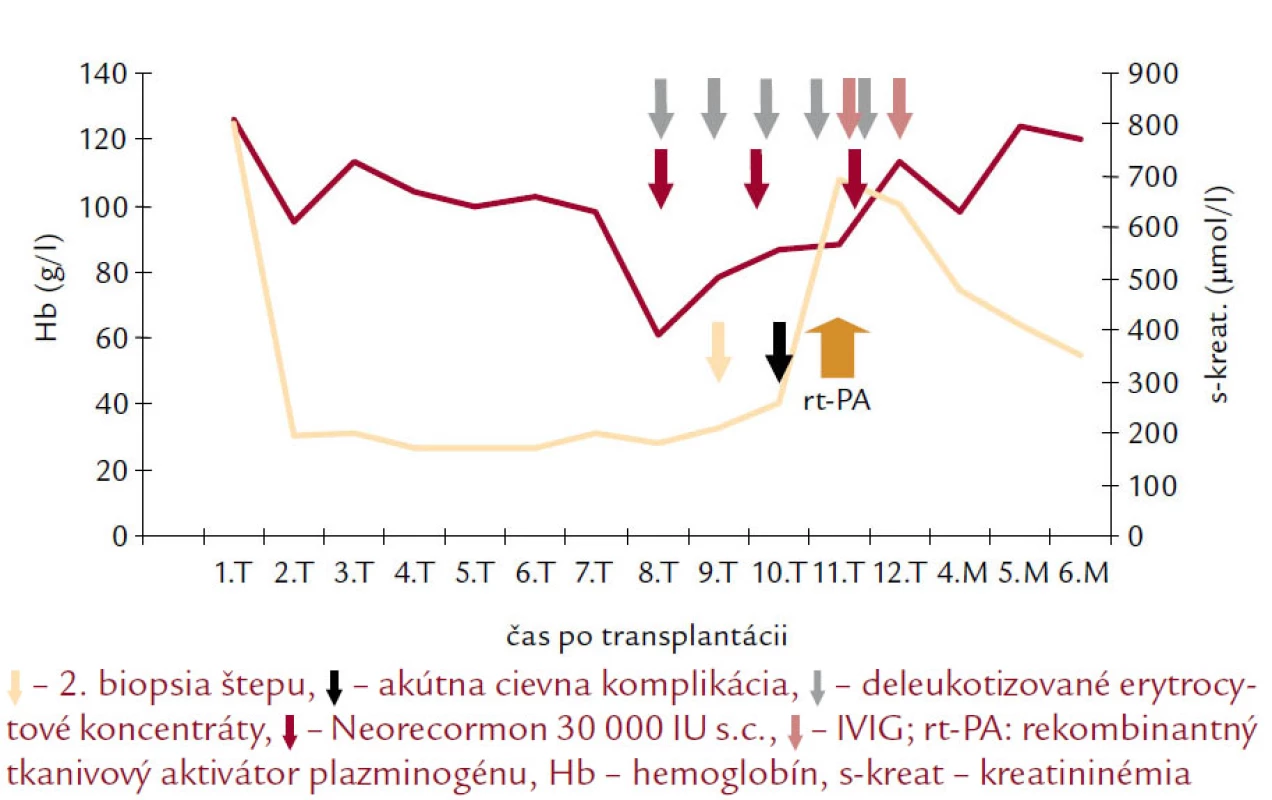
Diskusia
Prezentovali sme prípad parvovírusom indukovanej anémie u pacienta po transplantácii obličky, ktorá vznikla 5 týždňov po kortikosteroidmi liečenej akútnej celulárnej rejekcii. Okrem ťažkej útlmovej anémie s retikulocytopéniou bola infekcia pravdepodobne príčinou aj akútneho hepatocelulárneho poškodenia. Na možný súvis s parvovírusovou infekciou sme spočiatku nemysleli, za patologickými nálezmi sme hľadali obvyklejšie príčiny (nežiadúce účinky imunosupresie a antivirotickej liečby a bežnejšie vírusové ochorenia). Pacienta sme nevhodne liečili vysokými dávkami rh‑EPO, ktorá indukovala trombocytózu. Súčasná liečba bolusmi 6‑MP a nepoznaný vrodený trombofilný stav vyústili do akútnej cievnej komplikácie – trombózy renálnej artérie štepu. Napriek nepriaznivej kumulácii vyššie uvedených faktorov sa podarilo skorou intervenciou štep zachrániť a identifikovať príčinu anémie. V zhode so skúsenosťami iných autorov [1,4,11,21–23,26,27] sme potvrdili účinnosť liečby imunoglobulínmi v liečbe anémie indukovanej parvovírusom B19. Aj keď je prognóza štepu najmä z dôvodu ischemického poškodenia nepriaznivá, uvedený prípad priniesol viacero poučných momentov. U pacientov po transplantácii obličky s útlmovou anémiou zaradiť detekciu DNA parvovírusu B19 medzi prvé diferenciálne diagnostické vyšetrenia. Zvážiť potrebu liečby rh‑EPO a pri chýbajúcej liečebnej odozve nezvyšovať dávky, ale hľadať príčinu rezistencie na erytropoetín. Aktivácia vírusu po transplantácii môže signalizovať „over‑immunosuppression“, preto sa zdá racionálnym zníženie dávky imunosupresív. Pri symptomatickej infekcii je indikovaná liečba imunoglobulínmi. Napokon, potvrdili sme význam skorej dopplerovskej diagnostiky a rýchlej rádiologickej intervencie pri trombóze ciev transplantovanej obličky, ktoré obvykle končia akútnou stratou štepu.
Záver
Relatívne častý výskyt infekcie parvovírusom B19 (23 %) [28] u pacientov po transplantácii obličky upozorňuje na potrebu myslieť na túto komplikáciu najmä v prípadoch pretrvávajúcej útlmovej anémie po transplantácii. Vyšetriť vírusovú DNA možno už v skorom potransplantačnom období, u pacientov s pozitívnym nálezom je vhodné monitorovať perzistujúcu infekciu a podľa možnosti voliť menej agresívny imunosupresívny režim. U pacientov s manifestnou infekciou a PRCA sa odporúča liečba imunoglobulínmi. Pozornosť by sa mala venovať aj anemickým pacientom s terminálnym zlyhaním obličiek, u ktorých sú potrebné vysoké dávky rh-EPO a identifikovať rizikových pacientov ešte pred transplantáciou obličky.
Doručeno do redakce: 5. 5. 2010
MUDr. Zuzana Žilinská
www.nspr.sk/Nemocnica-Kramare
e‑mail: z.zilinska@stonline.sk
Sources
1. Liefeldt L, Buhl M, Schweickert B et al. Eradication of parvovirus B19 infection after renal transplantation requires reduction of immunosuppression and high‑dose immunoglobulin therapy. Nephrol Dial Transplant 2002; 17 : 1840–1842.
2. Winkelmayer WC, Chandraker A. Pottransplantation anemia: management and rationale. Clin J Am Soc Nephrol 2008; 3 (Suppl 2): S49–S55.
3. Waldman M, Kopp JB. Parvovirus B19 and the kidney. Clin J Am Soc Nephrol 2007; 2 (Suppl 1): S47–S56.
4. Arzouk N, Snanoudj R, Beauchamp‑Nicoud A et al. Parvovirus B19‑induced anemia in renal transplantation: a role for rHuEPO in resistance to classical treatment. Transpl Int 2006; 19 : 166–169.
5. Ozeki M, Fukushima T, Ohzeki M et al. A nosocomial parvovirus B19 infection‑induced transient aplastic crisis in a patient with chronic renal failure. Clin Nephrol 2006; 65 : 141–143.
6. Cossart YE, Field AM, Cant B et al. Parvovirus‑like particles in human sera. Lancet 1975; 1 : 72–73.
7. Ozawa K, Kurtzman G, Young N. Productive infection by B19 parvovirus of human erythroid bone marrow cells in vitro. Blood 1987; 70 : 384–391.
8. Heegaard ED, Brown KE. Human parvovirus B19. Clin Microbiol Rev 2002; 15 : 485–505.
9. Brown KE, Green SW, de Mayolo JA et al. Congenital anaemia after transplacental B19 parvovirus infection. Lancet 1994; 343 : 895–896.
10. Finkel TH, Török TJ, Ferguson PJ et al. Chronic parvovirus B19 infection and systemic necrotizing vasculitis: opportunistic infection or aetiological agent? Lancet 1994; 343 : 1255–1258.
11. Beckhoff A, Steffen I, Sandoz P et al. Relapsing severe anaemia due to primary parvovirus B19 infection after renal transplantation: a case report and review of the literature. Nephrol Dial Transplant 2007; 22 : 3660–3663.
12. Kelly HA, Siebert D, Hammond R et al. The age‑specific prevalence of human parvovirus immunity in Victoria, Australia compared with other parts of the world. Epidemiol Infect 2000; 124 : 449–457.
13. Anderson LJ, Török TJ. Human parvovirus B19. N Engl J Med 1989; 321 : 536–638.
14. Martinásková K. Infekčné parvovírusové exantémy detí. Dermatol Prax 2008; 1 : 12–14.
15. Munakata Y, Saito T. Human parvovirus B19 viraemia is associated with neither IgM positivity nor anaemia in patients with rheumatic diseases. Ann Rheum Dis 2006; 65 : 272–273.
16. Kühl U, Pauschinger M, Bock T et al. Parvovirus B19 infection mimicking acute myocardial infarction. Circulation 2003; 108 : 945–950.
17. Krygier DS, Steinbrecher UP, Petric M et al. Parvovirus B19 induced hepatic failure in an adult requiring liver transplantation. World J Gastroenterol 2009; 15 : 4067–4069.
18. Ľubušký M, Pospíšilová D, Hyjánek J et al. Prenatální infekce plodu parvovirem B19. Čes Gynek 2005; 70 : 306–311.
19. Duranay M, Bali M, Sahin M et al. Parvovirus B19 infection and unresponsiveness to erythropoietin therapy in haemodialysis patients. Nephrol Dial Transplant1998; 13 : 779–780.
20. Beske F, Modrow S, Sörensen S et al. Parvovirus B19 pneumonia in a child undergoing allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant 2007; 40 : 89–91.
21. Posfay‑Barbe KM, Michaels MG. Parvovirus B19 in organ transplant recipients. Curr Opin Organ Transplant 2003; 8 : 283–287.
22. Shan YS, Lee PC, Wang JR et al. Fibrosing cholestatic hepatitis possibly related to persistent parvovirus B19 infection in a renal transplant recipient. Nephrol Dial Transplant 2001; 16 : 2420–2422.
23. Lee PC, Hung CJ, Lei HY et al. Parvovirus B19‑related acute hepatitis in an immunosuppressed kidney transplant. Nephrol Dial Transplant 2000; 15 : 1486–1488.
24. Murer L, Zacchello G, Bianchi D et al. Thrombotic microangiopathy associated with parvovirus B 19 infection after renal transplantation. J Am Soc Nephrol 2000; 11 : 1132–1137.
25. Barzon L, Murer L, Pacenti M et al. Investigation of intrarenal viral infections in kidney transplant recipients unveils an association between parvovirus B19 and chronic allograft injury. J Infect Dis 2009; 199 : 372–380.
26. Sturm I, Watschinger B, Geissler K et al. Chronic parvovirus B19 infection‑associated pure red cell anaemia in a kidney transplant recipient. Nephrol Dial Transplant 1996; 11 : 1367–1370.
27. Waldman M, Kopp JB. Parvovirus‑B19‑associated complications in renal transplant recipients. Nat Clin Pract Nephrol 2007; 3 : 540–550.
28. Cavallo R, Merlino C, Re D et al. B19 virus infection in renal transplant recipients. J Clin Virol 2003; 26 : 361–368.
29. Bergallo M, Merlino C, Daniele R et al. Quantitative competitive‑PCR assay to measure human parvovirus B19–DNA load in serum samples. Mol Biotechnol 2006; 31 : 23–29.
30. Shimmura H, Tanabe K, Ishikawa N et al. Discontinuation of immunosuppressive antimetabolite for parvovirus B19‑associated anaemia in kidney transplant patients. Transplant Proc 2000; 32 : 1967–1970.
31. Poelsler G, Berting A, Kindermann J et al. A new liquid intravenous immunoglobulin with three dedicated virus reduction steps: virus and prion reduction capacity. Vox Sang 2008; 94 : 184–192.
32. Modrof J, Berting A, Tille B et al. Neutralization of human parvovirus B19 by plasma and intravenous immunoglobulins. Transfusion 2008; 48 : 178–186.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 7-
All articles in this issue
- Hyperlipoproteinaemia and dyslipoproteinaemia II. Therapy: Non-pharmacological and pharmacological approaches
- Chronic pancreatitis and the skeleton
- Necessity of continuous health system development
- ECG markers in patients with hypertrophic cardiomyopathy
- NATO international advanced course on best way of training for mass casualty situations
- Twelve years of continuing medical education in Slovakia
- Pituitary adenomas – where is the treatment heading at the beginning of the 21st century?
- Oxalic acid – important uremic toxin
- The influence of testosterone on cardiovascular disease in men
- Current options and principles of pathomorphology-based tumour diagnostics
- Natriuretic peptides in patients with aortic stenosis
- Cardiovascular diseases in rheumatoid arthritis
- The principles of care for patients with intermittent claudication
- Distressful journey for the metabolic syndrome to its position in clinical practice
- Diabetic osteopathy: previously disputed but most likely important ailment
- Will vaccines appear on the scene of oncology in the near future?
- Current options for the treatment of osteoporosis
- Laboratory diagnostics and endocrinology
- Parvovirus B19 infection – the cause of severe anaemia after renal transplantation
- Survival and quality of life in burns
- Biofeedback load technique in the rehabilitation of osteoporotic patients (Biomechanical analysis)
- Femur strength index versus bone mineral density: new findings (Slovak epidemiological etudy)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratory diagnostics and endocrinology
- The influence of testosterone on cardiovascular disease in men
- Parvovirus B19 infection – the cause of severe anaemia after renal transplantation
- Chronic pancreatitis and the skeleton
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

