-
Medical journals
- Career
Problematika kardiovaskulární toxicity koxibů a neselektivních NSA
Authors: Š. Forejtová
Authors‘ workplace: Revmatologický ústav, Praha, ředitel prof. MUDr. Karel Pavelka, DrSc.
Published in: Vnitř Lék 2006; 52(7-8): 677-685
Category: 130th Internal Medicine Day - Rheumatology in clinical practice
Overview
Nesteroidní antirevmatika (NSA) patří obecně mezi nejčastěji užívané léky, které podle některých observačních studií ve vyspělých zemích užívá až 20-30 % obyvatelstva. Nejčastějším nežádoucím účinkem nesteroidních antirevmatik je výskyt komplikací v oblasti gastrointestinálního traktu. Koxiby byly vyvinuty jako alternativa podávání konvenčních neselektivních NSA za účelem snížení rizika vzniku gastrointestinálních komplikací při zachování srovnatelného účinku. Otázka možné kardiovaskulární toxicity koxibů i ostatních nesteroidních antirevmatik je v posledních letech stále široce diskutována. Již výsledky studie VIGOR publikované před 6 lety prokazovaly 5krát vyšší výskyt nefatálního infarktu myokardu u jedinců léčených rofekoxibem v porovnání s naproxenem. Poté byly vedeny několikaleté debaty, které střídavě úvahu o možné kardiotoxocitě rofekoxibu, případně potažmo celé skupiny koxibů, podporovaly nebo vyvracely, byla také diskutována otázka o možném kardioprotektivním efektu naproxenu. Výsledky studie APPROVE (Adenoma Polyp Prevention on Vioxx) pak vedly společnost Merck Co., Inc. k dobrovolnému globálnímu stažení rofekoxibu z trhu. Na konci roku 2004 bylo překvapivé zveřejnění výsledků tří studií s celekoxibem, z nichž studie APC (Adenoma Prevention with Celecoxib) prokazovala vyšší kardiovaskulární riziko celekoxibu, zatímco studie PreSAP (Prevention of Adenomatosus Polyps) tyto výsledky nepotvrzovala, ve třetí studii ADAPT (Alzheimer Disease and Prevention Trial) naopak bylo prokázáno 50% zvýšení rizika kardiovaskulární (KV) toxicity u naproxenu. V posledním roce je tedy stále řešena otázka, zda možné zvýšení KV-toxicity je class-efektem skupiny koxibů nebo class-efektem celé skupiny NSA. Řada observačních studií prokazuje vyšší KV-riziko koxibů (především však refokoxibu) i neselektivních NSA včetně naproxenu. Tyto nové skutečnosti vedly americkou FDA (Food and Drug Administration) k vydání prohlášení o vyšším KV-riziku všech koxibů i NSA. EMEA (European Agency for Evaluation of Medicinal Products) zatím stanovisko k podávání NSA nemění, u koxibů je kontraindikace podávání u pacientů s ischemickou chorobou srdeční, cerebrovaskulárním onemocněním a nemocí periferních tepen, zvýšené opatrnosti je potřeba při jejich podávání u rizikových pacientů. K definitivnímu posouzení celé problematiky KV-toxicity NSA i koxibů tak bude potřeba provést dlouhodobé randomizované studie zaměřené na sledování výskytu kardiovaskulárních nežádoucích účinků.
Klíčová slova:
nesteroidní antirevmatika - koxiby - kardiovasulární toxicita - infarkt myokarduÚvod
Nesteroidní antirevmatika (NSA) patří obecně mezi jedny z nejčastěji užívaných léků. Nežádoucí účinky v oblasti horního i dolního gastrointestinálního (GI) traktu vzniklé v souvislosti s jejich podáváním jsou však ve vyspělých zemích nejčastějším důvodem hlášení nežádoucích účinků po lécích [1-5]. Důvodem vyvinutí selektivních inhibitorů cyklooxygenázy-2 (COX-2) neboli koxibů byla snaha snížit riziko vzniku gastrointestinálních (GI) komplikací v porovnání s konvenčními NSA při zachování srovnatelného účinku [6]. Bezpečnost podávání prvních koxibů, tj. celekoxibu a rofekoxibu, v oblasti GI traktu byla prokázána v rozsáhlých klinických studiích, a to ve studii studii VIGOR (The Vioxx Gastrointestinal Outcomes Research) [7] a ve studii CLASS (The Celecoxib Long-term Arthritis Safety Study) [8]. Ve studii VIGOR snižoval rofekoxib v porovnání s naproxenem počet všech potvrzených příhod v oblasti horního GI traktu o 54 %, počet komplikovaných příhod horního GI traktu o 57 % a počet všech krvácení z celého GI traktu dokonce o 62 % [7]. Také ve studii CLASS byl prokázán snížený výskyt vážných nežádoucích GI účinků u pacientů léčených celekoxibem, nicméně ve skupině jedinců, kteří brali současně celekoxib a kyselinu acetylsalicylovou, pokles výskytu symptomatických vředů a vážných komplikací vředů nebyl signifikantní. V recentně publikované studii SUCCESS-1 (SUCCESS: Successive Celecoxib Efficacy and Safety Studies) byl prokázán 8krát nižší výskyt vážných komplikací vředové choroby u jedinců léčených celekoxibem v porovnání s naproxenem a diklofenakem [9].
V souvislosti se studií VIGOR se však poprvé otevřela otázka o kardiovaskulární (KV) bezpečnosti podávání rofekoxibu.
Kardiovaskulární riziko podávání koxibů - klinické studie
Překvapivým výsledkem studie VIGOR byl zvýšený výskyt nefatálního infarktu myokardu u pacientů léčených rofekoxibem. Přepočítáno na tzv. pacientské roky (p.r.) byl výskyt IM v rofekoxibové skupině zjištěn u 20 případů na 2699 p.r. oproti 4 případům na 2699 p.r. u pacientů léčených naproxenem (RR = 0,20 ve prospěch naproxenu; 95% CI - interval spolehlivosti: 0,07-0,58). V září roku 2004 pak výsledky studie APPROVe (Adenomatous Polyp Prevention on Vioxx) vedly společnost Merck Co., Inc. k dobrovolnému globálnímu stažení rofekoxibu z trhu [10]. Studie ověřovala účinek rofekoxibu na recidivu výskytu polypů v tlustém střevě a současně prokázala zvýšené riziko vzniku potvrzených KV-příhod po 18 měsících kontinuálního podávání 25 mg rofekoxibu denně v porovnání s placebovou skupinou (rofekoxib 1,5 % vs placebo 0,78 %). Kardiotoxicitu rofekoxibu potvrdila i metaanalýza 18 randomizovaných a 11 observačních studií, která zjistila, že již koncem roku 2000 bylo možno prokázat zvýšené relativní riziko vzniku KV-příhod při terapii rofekoxibem [11]. Překvapující také bylo zveřejnění výsledků studie APC (Adenoma Prevention with Celecoxib), která prokázala zvýšení výskyt KV-příhod při terapii celekoxibem, zvýšení bylo závislé na dávce (výskyt u placeba 1 %, u Celekoxibu 200 mg 2krát denně 2,3 %, 95% CI 0,9-5,5 %, p ≤ 0,05, u celekoxibu 400 mg 2krát denně byl výskyt 3,4 %, 95% CI 1,4-7,8 % p ≤ 0,05) [12]. V další studii s celekoxibem (PreSAP - Prevention of Adenopatosus Polyps) zvýšené riziko KV-příhod při podávání celekoxibu v porovnání s placebem prokázáno nebylo. Také ve studii ADAPT (The Alzheimer Disease and Prevention Trial) bylo zjištěno, že podávání celekoxibu v dávce 400 mg denně u starších pacientů není spojeno se zvýšeným KV-rizikem. Výsledky této placebem kontrolované studie však poprvé v historii prokázaly 50% vzestup kardiovaskulárních příhod u pacientů, kteří byli léčeni naproxenem, což je v přímém rozporu s teorií o možném kardioprotektivní vliv naproxenu, jež byla široce diskutována v několika posledních letech. Je nutné ovšem podotknout, že tato studie byla předčasně ukončena po zveřejnění výsledků studie APC a nebyla ani koncipována k tomu, aby výskyt KV-příhod sledovala. Všechny 3 studie byly prováděny u různých nesrovnatelných populací a měly odlišné uspořádání, a tudíž je obtížné z jejich výsledků dělat hlubší medicínské závěry.
Také ve studii TARGET (The Therapeutic Arthritis Research and Gastrointestinal Event Trial) s lumirakoxibem nebyl zjištěn signifikantní rozdíl ve výskytu KV-příhod ve skupině léčené lumirakoxibem, ibuprofenem nebo naproxenem [13]. V jedné větvi této studie, která porovnávala bezpečnost podávání lumirakoxibu s naproxenem, byl však pozorován jistý trend k vyššímu výskytu všech KV-příhod a IM ve skupině léčené lumirakoxibem, rozdíl ale nebyl signifikantní. Výskyt kongestivního srdečního selhání v této studii však byl významně nižší u uživatelů lumirakoxibu. Ani metaanalýza 10 kontrolovaných klinických studií s valdekoxibem u pacientů s osteoartrózou a revmatoidní artritidou neprokázala zvýšené riziko vzniku trombotických příhod u valdekoxibu v dávce 10 80 mg po dobu 6-52 týdnů v porovnání s neselektivními NSA a s placebem [14]. Naopak ve 2 studiích u pacientů po prodělaném aortokoronárním bypassu (coronary artery bypass graft - CABG) byl bezprostředně po operaci zjištěn vyšší výskyt KV-příhod u pacientů léčených parekoxibem a valdekoxibem v porovnání s placebovou skupinou, i když rozdíl v první studii byl pouze nesignifikantní [15]. Závěry obou studií vedly FDA (Food and Drug Administration) nejdříve k prohlášení, že valdekoxib i parekoxib jsou kontraindikovány u pacientů po prodělaném CABG, posléze v dubnu roku 2005 přispěly k doporučení stáhnout valdekoxib z trhu.
Další studie s koxiby - metaanalýzy a epidemiologické studie
Od zveřejnění výsledků studie VIGOR byla otázka KV-bezpečnosti rofekoxibu celosvětově široce diskutována. Dodnes se vedou spory o tom, zda je zvýšené kardiovaskulární riziko rofekoxibu důsledkem class-efektu celé skupiny koxibů nebo přímo class efektem celé skupiny NSA. Výsledky jednotlivých klinických i epidemiologických studií týkající se KV-bezpečnosti podávání koxibů jsou značně rozporuplné[16-21], u neselektivních NSA rozsáhlejší klinické studie chybí. Zprávy o jejich KV-účinku vycházely převážně ze starších a spíše ojedinělých populačních observačních studií (tab. 1) [22-26], přičemž v některých z nich se naopak diskutoval jejich možný kardioprotektivní vliv. Recentní práce však spíše podporují teorii o tom, že výskyt KV-příhod zvyšují všechna NSA, a to selektivní i neselektivní.
Table 1. Výskyt tromboembolických příhod pří podávání koxibů a neselektivních NSA: výsledky observačních studií. 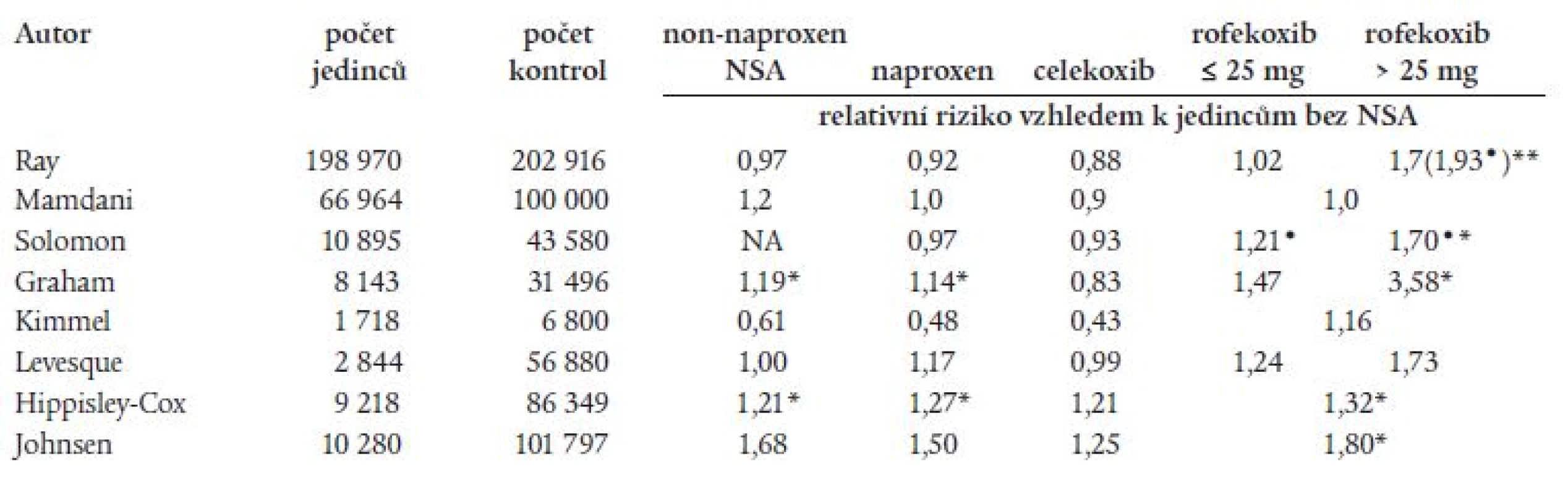
• relativní riziko u nových uživatelů rofekoxibu, * p ≤ 0,05, NA – not aplicable Hypotéza, že rofekoxib může zvyšovat riziko vzniku KV-příhod, nebyla potvrzena metaanalýzou všech ve své době dosud proběhlých studií s tímto preparátem u pacientů se zánětlivými i degenerativními onemocněními a s Alzheimerovou chorobou [16]. Dle výsledků této metaanalýzy, do které bylo zahrnuto více než 28 000 pacientů z 23 studií, nebylo zjištěno, že rofekoxib zvyšuje riziko vzniku KV-příhod.
Autoři jiné metaanalýzy učinili pokus srovnat výskyt KV-příhod u pacientů léčených koxiby s jedinci užívajícími placebo [17]. Porovnávali absolutní počet těchto příhod ve 4 studiích s koxiby (studie VIGOR, CLASS a další dvě menší studie, celkem u více než 18 000 pacientů léčených koxiby) s výskytem KV-příhod u dosud zdravých jedinců užívajících placebo ve 4 studiích ověřujících efekt kyseliny acetylsalicylové v indikaci primární prevence vzniku akutní trombotické příhody (celkem u více než 23 000 jedinců užívajících placebo). Práce Mukherjeeho dospívá k názoru, že rofekoxib i celekoxib mohou mít protrombotický efekt a mohou zvyšovat riziko vzniku KV-příhod, definitivní posouzení však musí být provedeno v prospektivních randomizovaných studiích. Výsledky této analýzy byly široce diskutovány a kritizovány, především s ohledem na limitovanou srovnatelnost sledování v různých studiích pro naprostou rozdílnost jednotlivých populací.
V jiné retrospektivní populační studii vycházející z dat TennCare (Tennessee Medical programme) autoři sledovali výskyt vážných KV-příhod u starších pacientů neléčených NSA a u pacientů užívajících rofekoxib, celekoxib nebo jiná NSA [18]. Ve studii nebylo prokázáno zvýšené riziko vzniku vážných KV-příhod (tj. stav vyžadující hospitalizaci nebo zapříčiňující úmrtí) u pacientů, kteří byli léčeni naproxenem, ibuprofenem celekoxibem nebo rofekoxibem v dávce ≤ 25 mg denně, a to v porovnání s jedinci, kteří NSA neužívali. Pro dávku > 25 mg rofekoxibu však bylo RR 1,70 (95% CI 0,98-2,95; p = 0,058) v porovnání s jedinci bez NSA, mezi novými uživateli rofekoxibu se RR zvýšilo až na 1,93 (95% CI 1,09-3,42; p = 0,024).
Negativní vliv koxibů na KV-aparát naopak nepotvrdila 3letá retrospektivní observační studie Mamdaniho u pacientů starších 65 let [19], ve studii nebyl potvrzen ani kardioprotektivní efekt naproxenu. Jiná retrospektivní observační studie Solomona [20] u pacientů ve věku ≥ 65 let naopak prokázala pro rofekoxib vyšší riziko vzniku IM v porovnání celekoxibem (RR = 1,24; 95% CI 1,05-1,46; p = 0,011) a v porovnání s pacienty, kteří NSA nebrali (RR = 1,14; 95% CI 1,00-1,31; p = 0,054). Dále bylo zjištěno, že riziko vzniku akutního IM bylo úměrné dávce rofekoxibu, zvyšovalo se při dávce > 25 mg rofekoxibu, zároveň bylo vyšší v prvních 90 dnech podávání rofekoxibu. V této studii nebyl prokázán vyšší výskyt IM u pacientů léčených celekoxibem. Také studie Kimmela [21] ukázala na vyšší výskyt nefatálního IM při léčbě rofekoxibem v porovnání celekoxibem (adjustované riziko bylo 2,72, 95% CI 1,24-5,95), v porovnání s neuživateli NSA bylo adjustované riziko pro rofekoxib 1,16 (CI 0,70-1,93) a nebylo signifikantně zvýšené, pro celekoxib pak bylo toto adjustované riziko rovno 0,43 (95% CI 0,23-0,79). Neselektivní NSA byly spojené s redukovaným rizikem vznikem nefatálního IM v porovnání s koxiby: rofekoxib proti naproxenu měl RR 3,39 (95% CI 1,37-8,40), ovšem celekoxib proti ibuprofenu nebo diklofenaku pak měl RR 0,77 (95% CI 0,40-1,48). Studie tak opět neprokázala, že by zvýšený výskyt KV-příhod při rofekoxibu byl tzv. class-efektem všech koxibů.
Novější práce jsou zaměřeny na sledování možné KV-toxicity koxibů i neselektivních NSA. Například rozsáhlá epidemiologické práce, jejíž výsledky prezentoval David Graham v srpnu roku 2004 na mezinárodní konferenci pro farmakoterapii v Bordeaux a dále na zasedání FDA v únoru roku 2005, sledovala zvýšení rizika vzniku akutního infarktu myokardu a náhlé srdeční smrti u současných uživatelů COX-2 selektivních a neselektivních NSA ve srovnání s těmi, kteří užívali tyto léky v minulosti. Zvýšený výskyt těchto příhod byl zaznamenán nejen u rofekoxibu, ale i dalších NSA (graf 1). Práce Grahama publikovaná v časopise Lancet prokázala zvýšený výskyt IM u rofekoxibu v porovnání s celekoxibem, a to v jakékoliv dávce (RR pro rofekoxib v jakékoliv dávce bylo 1,59; 95% CI 1,10-2,32, p = 0,015, pro dávku ≤ 25 mg rofekoxibu bylo RR 1,47, 95% CI 0,99-2,17, p = 0,054 a pro dávku > 25 mg rofekoxibu pak bylo RR 3,58, 95% CI 1,27-10,11, p = 0,016) [27]. Také norská studie, která sledovala vliv NSA na prevenci vzniku karcinomu v ORL oblasti, prokázala současně zvýšenou kardiotoxicitu některých neselektivních NSA [28]. Překvapivé však bylo oznámení nemocnice z Oslo z ledna roku 2006, že výsledky této studie, které uveřejnil v časopise Lancet Sudbø, se zakládaly na zfalšovaných údajích, což znovu vyvolalo vlnu diskusí o celé problematice. A konečně další observační studie z loňského roku [29] neprokázala vyšší kardiotoxicitu u uživatelů koxibu v porovnání s uživateli neselektivních NSA kromě naproxenu, relativní riziko pro rofekoxib bylo 0,99 (95% CI 0,76-1,30), pro celekoxib pak bylo RR o něco vyšší: 1,19 (96% CI 0,93-1,51), rozdíl však nebyl signifikantní. Naopak práce Hippisley-Cox prokázala signifikantní zvýšení IM u pacientů užívajících rofekoxib, diklofenak, ibuprofen, naproxen i celé skupiny neselektivních NSA (tab. 1) [30]. Ve studii, kterou publikovala Levesque, bylo prokázáno vyšší riziko vzniku IM u starších pacientů při podávání rofekoxibu (RR vzhledem k osobám bez NSA bylo 1,24, 95% CI 1,05-1,46), riziko se zvyšovalo u vysokých dávek rofekoxibu: RR = 1,73, 95% CI 1,09-2,76. Současně podávaný aspirin snižoval riziko vzniku IM při podávání nižších dávek rofekoxibu: RR = 1,00, 95% CI 0,77-1,28, při podávání vysokých dávek rofekoxibu aspirin riziko vzniku IM nesnižoval (RR 2,38, 95% CI 1,27-4,39) [31]. Studie Johnsena pak prokazuje zvýšené riziko hospitalizace pro IM u uživatelů rofekoxibu, celekoxibu, jiných selektivních COX-2 inhibitorů, naproxenu i všech konvenčních NSA (tab. 1) [32]. Obecně lze tedy shrnout, že výsledky jmenovaných observačních studií jsou značně kontroverzní, nicméně řada z nich poukazuje na vyšší KV-riziko všech NSA, a to selektivních i neselektivních.
Graph 1. NSA a riziko akutního infarktu myokardu: MediCal (podle Graham D et al. Zasedání FDA 17. 2. 2005). Relativní riziko při IM (95% CI). 
NSA a vznik srdečního selhání
Řada studií se zabývala i problematikou vzniku kongestivního srdečního selhání, z nichž některé byly studie randomizované, kontrolované [33-35], některé byly populační, observační (tab. 2) [36-38]. Výsledky všech uvedených studií se shodují v tom, že celekoxib navozuje vznik kongestivního srdečního selhání méně než rofekoxib nebo neselektivní NSA, podávání rofekoxibu je v tomto směru méně bezpečné než podávání neselektivních NSA. Randomizované studie sledovaly spolu se vznikem srdečního selhání i vznik hypertenze a otoků. Autory jedné rozsáhlé studie byli Mamdani et al, kteří sledovali výskyt kongestivního srdečního selhání u pacientů > 66 let léčených koxiby a neselektivními NSA [36]. Z výsledků studie vyplývá, že pacienti léčení rofekoxibem a neselektivními NSA měli vyšší riziko kongestivního srdečního selhání v porovnání s pacienty, kteří NSA neužívali (RR = 1,8; 95% CI 1,5-2,2 pro refekoxib a RR = 1,4; 95% CI 1,0-1,9 pro neselektivní NSA), zatímco pacienti léčení celekoxibem toto zvýšené riziko vzniku srdečního selhání v porovnání s pacienty bez NSA neměli (RR = 1,0; 95% CI 0,8-1,3). V porovnání s celekoxibem vývoj srdečního selhání zvyšují signifikantně více neselektivní NSA (RR = 1,4; 95% CI 1,0-1,9) i rofekoxib (RR = 1,8; 95% CI 1,4-2,4). Riziko vzniku bylo vyšší u pacientů léčených rofekoxibem v porovnání s neselektivními NSA (RR = 1,5; 95% CI 1,1-2,1). Také novější studie publikovaná v loňském roce [37] sledovala vývoj rekurentního srdečního selhání a smrti u uživatelů rofekoxibu, celekoxibu i neselektivních NSA. V porovnání s celekoxibem bylo relativní riziko vzniku srdečního selhání i smrti vyšší u uživatelů rofekoxibu (RR = 1,27, 95% CI 1,09-1,49) i u uživatelů neselektivních NSA (RR = 1,26, 95% CI 1,00-1,57).
Table 2. Kongestivní srdeční selhání a terapie selektivními a neselektivními NSA: výsledky randomizovaných a observačních studií. 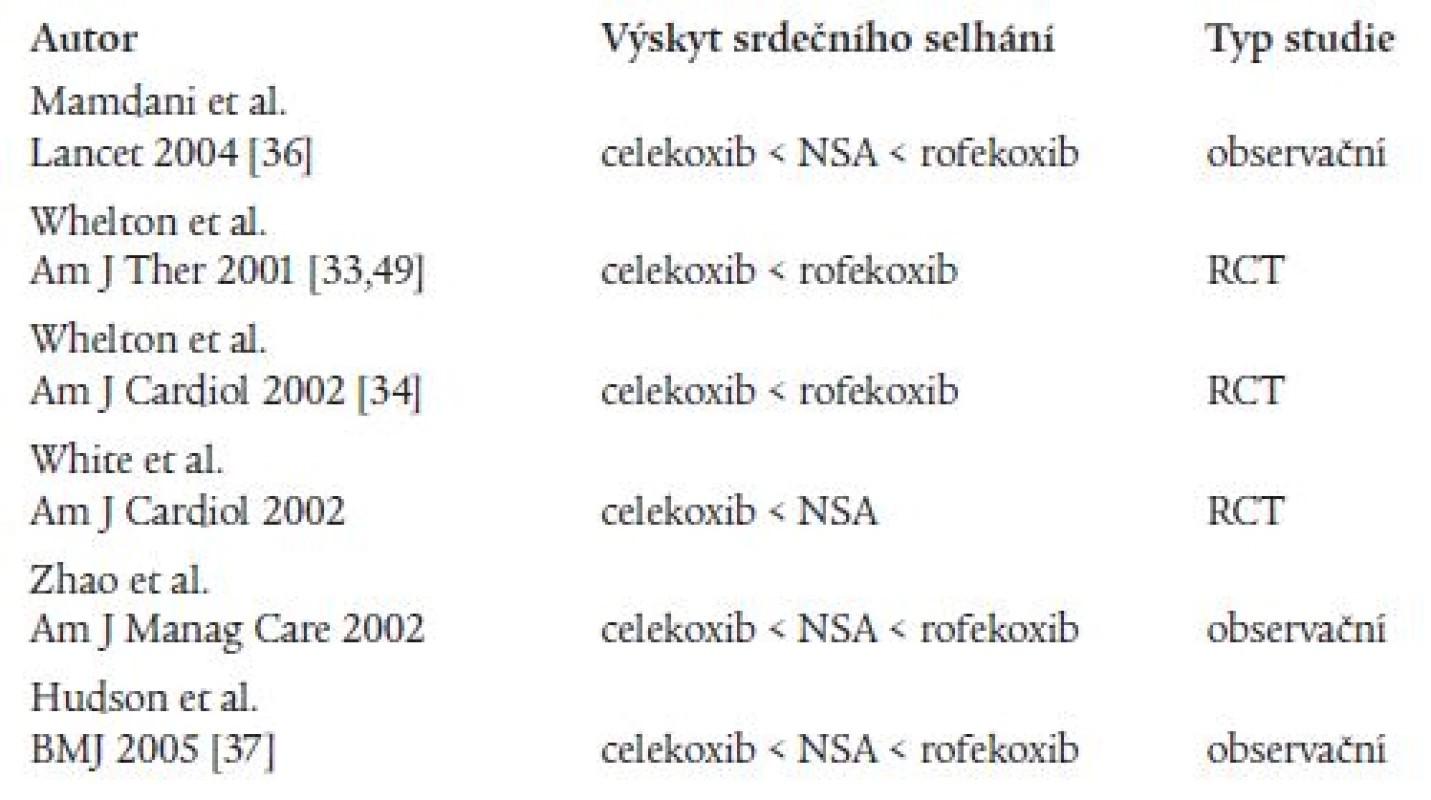
Vliv NSA a koxibů na rozvoj hypertenze
Jedním z faktorů, který se může podílet na vzniku nežádoucích KV-účinků, může být způsoben i vlivem NSA na vývoj hypertenze [38-41]. Vliv NSA a koxibů na výši krevního tlaku je dán úlohou COX-1 a COX-2 v ledvinách. COX-1 se nachází především v glomerulech a v aferentních artreriolách a prostaglandiny (PG), které v ledvinách vznikají působením této cyklooxygenázy, ovlivňují hlavně renální hemodynamiku: podporují dilataci renálních cév, snížení renální vaskulární rezistence a zvýšení renální perfuze. Prostaglandiny produkované COX-2, které se v ledvinách vyskytují hlavně v tlustém ascendentním kanálku Henleovy kličky, v macula densa, v podocytech a v aferentních arteriolách, mají v ledvinách především diuretický a natriuretický efekt. Některé účinky PG v ledvinách, především jejich vliv na udržování homeostázy sodíku a draslíku, se podílejí na kontrole fyziologických funkcí trvale, tj. i u zdravých osob (obr. 1). Naproti tomu PG u zdravých osob nehrají významnou roli v kontrole průtoku krve ledvinami, jejich vliv stoupá především v situacích, kdy dochází k poklesu aktuálního nebo efektivního krevního volumu (krvácení, dehydratace, kongestivní srdeční selhání, cirhóza jater, renální insuficience atd). S funkcí produktů COX-2 je také úzce spjat transport vody a sodíku pod vlivem vazopresinu. Sekreci vazopresinu, který primárně reguluje vstřebávání vody a je současně tzv. antinatriuretickým hormonem, inhibují mimo jiné také produkty COX-2 [42,43]. Podání NSA proto může vést k retenci vody a solí a ke vzniku hypertenze. Víme, že exprese COX-2 se zvyšuje v kůře ledvin v případě vysoké plazmatické koncentrace reninu, tj. při nízkém příjmu sodíku v dietě, při volumové depleci, stenóze renální arterie, aktivní lupusové nefritidě, parciální renální ablaci a při terapii ACE-inhibitory a blokátory receptoru 1 pro angiotenzin II. PG syntetizované pomocí COX-2 jsou součástí zpětnovazebné reakce regulující aktivitu renin-angiotenzinového systému - RAAS [44-46]. V případě snížené aktivity RAAS nebo neschopnosti udržet minerálovou rovnováhu dochází v ledvinách ke zvýšení exprese COX-2 s následnou syntézou PG, které aktivují expresi a uvolňování reninu a vedou současně ke zvýšení aktivity angiotenzinu II a aldosteronu s následným zvýšením tubulární reabsorpce sodíku. Jakmile je navozena intravaskulární volumová rovnováha, dochází ke snížení exprese COX-2 prostřednictvím angiotenzinu II a redukci tvorby reninu. Vzhledem k tomu, že prostaglandiny indukovaná sekrece reninu může navodit zvýšení TK, a to jednak vazokonstrikcí způsobenou angiotenzinem II a dále zvýšením volumu, které je dáno účinkem aldosteronu a ADH, může podávání NSA v určitém momentu navodit naopak snížení TK.
Schéma 1. Role prostaglandinů v ledvinách. 
Z výše uvedeného mechanizmu působení NSA vyplývá, že NSA mohou interferovat s účinky těch antihypertenziv, u kterých je efekt závislý na aktivitě prostaglandinů (ACE-inhibitory, beta-blokátory, diuretika, centrální α2-agonisté, periferní α1-blokátory, blokátory receptoru pro angiotenzin II), zatímco podstatně méně ovlivňují kontrolu TK těmi antihypertenzivy, u kterých je účinek na prostaglandinech nezávislý (blokátory kalciových kanálů) [47].
Riziko nového výskytu hypertenze u starších pacientů sledovala retrospektivní populační studie Salomona [48]. Studie prokázala, že podávání rofekoxibu je spojeno s vyšším rizikem nového výskytu hypertenze v porovnání s celekoxibem, ostatními NSA i placebem. Nebylo zjištěno vyšší riziko výskytu hypertenze u jedinců léčených celekoxibem. Také dvě studie SUCCESS-VI [49] i SUCCESS-VII [33] prokázaly signifikantně vyšší vývoj hypertenze ve skupině léčené rofekoxibem 25 mg 1krát denně v porovnání s celekoxibem 200 mg 1krát denně (v první studii 17 % vs 11 %; p = 0,032; ve druhé studii 14,9 % vs 6,9 %; p < 0,05). Podobné výsledky ukázala retrospektivní studie TK, ve které byl prokázán statisticky významný vzestup systolického TK u pacientů léčených rofekoxibem po dobu 3 měsíců (4,76 mm Hg; p = 0,044), zatímco u pacientů léčených celekoxibem systolický TK nevýznamně poklesl (-1,15 mm Hg) [50]. Ve studii CRESCENT [51] u diabetiků trpících hypertenzí rofekoxib v dávce 25 mg podávaný 6 týdnů vedl k významnému vzestupu systolického TK (ze 130,3 na 134,5 mm Hg; p < 0,001), zatímco ve skupině s celekoxibem a naproxenem zůstal TK nezměněn. Ve skupině s rofekoxibem se při ambulantním monitorování krevního tlaku objevilo po 6 týdnech 30 % hypertoniků, což je významně více než ve skupině s celekoxibem.
Z uvedeného přehledu studií zabývajících se vznikem hypertenze vyplývá, že byl prokázán signifikantně vyšší výskyt hypertenze po terapii rofekoxibem v porovnání s celekoxibem, neselektivním NSA nebo placebem. Také zveřejnění výsledků metaanalýzy 19 randomizovaných studií [52] potvrdilo, že relativní riziko vzniku hypertenze u koxibů v porovnání s placebem bylo o 61 % vyšší, v porovnání s neselektivními NSA toto riziko stoupalo o 25 %, v obou případech však bylo zvýšení relativního rizika statistiky nevýznamné (koxiby vs placebo p = 0,10; koxiby vs NSA p = 0,23). Z dílčích podvýsledků studie také jasně vyplývalo, že podíl rofekoxibu na vzniku hypertenze ve skupině koxibů byl vyšší, než tomu bylo u celekoxibu. Nebylo tedy dosud prokázáno, že by koxiby jako skupina vedly k většímu zvýšení TK než neselektivní NSA. Výsledky dosavadních studií spíše nasvědčují, že TK zvyšují více preparáty s delším biologickým poločasem (rofekoxib, etorikoxib).
NSA a kyselina acetylsalicylová
Bylo prokázáno, že pokud je podán ibuprofen před kyselinou acetylsalicylovou, zablokuje přechodně přístupový kanál cyklooxygenázy-l a zabrání tak ireverzibilní inhibici tvorby tromboxanu, kterou jinak navozuje kyselina acetylsalicylová [53]. V několika studiích bylo skutečně zjištěno, že současné podávání ibuprofenu a kyseliny acetylsalicylové zvyšuje výskyt infarktu myokardu [54-56]. Podobná interakce nebyla prokázána u diklofenaku ani celekoxibu [53,57], zatímco naproxen může účinek kyseliny acetylsalicylové také snižovat [58]. To zřejmě vysvětluje i zvýšení výskytu KV-příhod u pacientů léčených naproxenem ve studii ADAPT.
Inhibitory COX-2 a kardiovaskulární systém
Možné zvýšení kardiotoxicity koxibů bývá obvykle vysvětlováno tím, že koxiby blokují tvorbu prostacyklinu (PGI2 ) s jeho vazodilatačním a antiagregačním účinkem, zatímco tvorbu tromboxanu a ostatních mediátorů s vazokonstrikčním, proagregačním a proaterogenním efektem koxiby na rozdíl od neselektivních NSA neovlivňují (obr. 2). Tato mechanistická teorie má řadu svých zastánců i odpůrců, jisté však je, že je značně zjednodušená, neboť v cévním systému má vazodilatační a antiagregační efekt řada jiných faktorů. Jiní autoři zdůvodňují možné rozdíly v kardiotoxicitě jednotlivých NSA rozdílem mezi sulfonovými (rofekoxib, etorikoxib) a sulfonamidovými (celekoxib, valdekoxib) koxiby a neselektivními NSA [59]. Sulfonové koxiby dle této teorie významně potencují oxidaci částic LDL a snižují plazmatickou antioxidační kapacitu, což má dle zastánců této teorie zásadní vliv na zvýšení výskytu KV-příhod u uživatelů rofekoxibu a etorikoxibu. Další teorie vysvětluje rozdíl ve výskytu KV-příhod u jednotlivých koxibů jejich biologickým poločasem, neboť kratší biologický poločas a rychlejší disociace z aktivního místa COX mohou umožnit rychlejší obnovu endoteliální tvorby PGI2 a zachování rovnováhy prostaglandinů v cévní stěně. Objevují se také zprávy, že některé koxiby mohou mít dokonce kardioprotektivní efekt. Existují práce, které prokazují, že celekoxib zlepšuje endoteliální funkci u pacientů s ischemickou chorobou srdeční a s hypertenzí [60,61], neboť zvyšuje endotel-dependentní vazodilataci a zároveň snižuje koncentraci vysoce senzitivního CRP a oxidovaného LDL, což může dle názoru autorů dokonce zpomalovat vývoj aterosklerózy.
Schéma 2. Úloha cyklooxygenázy v cévním systému ve vztahu k trombotickému procesu. 
Závěr, stanovisko FDA a EMEA
Problematikou koxibů i NSA jako takových s ohledem na KV-riziko se zabývala i americká FDA i evropská komise EMEA (The European Agency for the Evaluation of Medicinal Products). Dle názorů FDA z února roku 2005 užitek při užívání koxibů dosud převažuje nad riziky jejich podávání, a to především s ohledem na jejich vyšší gastrointestinální bezpečnost. Bylo však doporučeno zpřísnit varování pro KV-rizika koxibů a omezit reklamu cílenou na samotného pacienta. Současné podávání kyseliny acetylsalicylové nechrání pacienta před vznikem KV-příhody, proto komise nedoporučovala podávat tuto kombinaci. V dubnu roku 2005 pak FDA konstatovala, že všechna NSA potenciálně zvyšují KV-riziko, některé z nich, jako je naproxen v dávce 2krát denně 500 mg nebo celekoxib v dávce 200 mg denně, se zdají být bezpečnější v porovnání s ostatními NSA (rofekoxibem, valdekoxibem, diclofenakem, nebo ibuprofenem). Valdekoxib FDA doporučila stáhnout z trhu pro nedostatek údajů o KV-bezpečnosti z hlediska dlouhodobého užívání, zatímco bylo prokázáno zvýšené riziko nežádoucích KV-příhod u pacientů po aortokoronárním by-passu. Důvodem doporučení stažení z trhu byly i zprávy o závažných a potenciálně život ohrožujících kožních reakcích. FDA dospěla k názoru, že nebyly shledány prokazatelné výhody pro valdekoxib ve srovnání s ostatními NSAIDs. Zároveň FDA vydala varování o KV a GI-riziku celekoxibu i ostatních NSA a doporučila kontraindikovat je u pacientů s nedávno provedeným CABG. Současně vzhledem k pacientům požadovala doplnění dalších informací v příbalových letácích celekoxibu i všech NSA, včetně volně prodejných přídavků. Doporučila přidat do nich varování o KV a GI-riziku a připojit silnější doporučení o co možná nejnižší dávce, kterou by pacienti měli brát co nejkratší dobu. U celekoxibu doporučila provedení dlouhodobých bezpečnostních studií týkajících se KV-bezpečnosti preparátu v porovnání s naproxenem i ostatními NSA, u neselektivních NSA pak žádala o provedení review kontrolovaných klinických databází. Na svém posledním zasedání FDA v únoru roku 2006, na kterém bylo prezentováno shrnutí dat týkajících se neselektivních NSA, komise konstatovala, že nové výsledky týkající se této problematiky jsou nekonzistentní a nejasné, neumožňující podat přesvědčivou odpověď, proto zatím komise setrvává na svém posledním prohlášení i zvýšeném KV a GI riziku všech NSA.
EMEA naproti tomu v loňském roce konstatovala, že dosud nejsou jednotné důkazy, které by jasně prokazovaly KV-toxicitu všech NSA, a měnily tak její dosavadní stanovisko k NSA. Doporučuje jen zvýšenou opatrnost při jejich podávání. Komise povolila marketing celekoxibu, etorikoxibu a injekčního parekoxibu a zároveň vydala své rozhodnutí ohledně podávání koxibů. Všechny koxiby je kontraindikováno podávat u pacientů s kardiovaskulárním a cerebrovaskulárním onemocněním i s onemocněním periferních tepen, etorikoxib nesmí být podáván u pacientů se špatně korigovanou hypertenzí. Lékaři jsou varováni při předpisu COX-2 selektivních inhibitorů u pacientů s přítomností rizikových faktorů pro vznik ICHS, jako je hypertenze, hyperlipidemie, diabetes mellitus a kouření. Tato komise také doporučuje lékařům podávat co nejnižší účinné dávky koxibů, a to co nejkratší dobu.
Závěrem je nutno zdůraznit, že koxiby byly vyvinuty za účelem snížení rizika vzniku gastrointestinálních komplikací, které pacienty užívající NSA ohrožují. Dle zpráv z poslední doby je pravděpodobné, že možné zvýšení rizika vzniku kardiovaskulárních příhod provází podávání všech NSA, a to bez ohledu na jejich selektivitu. Bude potřeba ale provést shrnutí kontrolovaných klinických databází jednotlivých NSA a současně realizovat dlouhodobé cíleně zaměřené studie, které by hypotézu o KV-toxicitě NSA potvrdily nebo vyloučily.
MUDr. Šárka Forejtová
www.revma.cz
e-mail: fore@revma.cz
Doručeno do redakce: 3. 3. 2006
Sources
1. Talley NJ, Evans JM, Fleming KC et al. Nonsteroidal antiinflammatory drug and dyspepsia in the elderly. Dig Dis Sci 1995; 40 : 1345-1350.
2. Laine L. Nonsteroidal anti-inflammatory drug gastropathy. Gastrointest Endosc Clin N Am 1996; 6 : 489-504.
3. Langman MJ, Weil J, Wainwright P et al. Risk of bleeding peptic ulcer associated with individual nonsteroidal antiinflammatory drugs. Lancet 1994 : 343 : 1075-1078.
4. Allison MC, Howatson AG, Torrance CJ et al. Gastrointestinal damage associated with the use of non-steroidal anti-inflammatory drugs. N Engl J Med 1992; 327 : 749-754.
5. Fries JF, Miller SP, Spitz PW et al. Toward an epidemiology of gastropathy associated with nonsteroidal antirevmatic drug use. Gastroenterology 1989; Suppl: 647-655.
6. Rahme E, Marentette MA, Kong SX et al. Use of NSAIDs, COX-2 inhibitors, and acetaminophen and associated coprescriptions of gastroprotective agents in an elderly population. Arthritis Rheum 2002; 47 : 595-602.
7. Bombardier C, Laine L, Reicin A et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343 : 1520-1528.
8. Silverstein FE, Faich G, Goldstein JL et al. Gastointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis; the CLASS study: a randomized controlled trial. Celecoxib long-therm artrhritis safety study. JAMA 2000; 284 : 1247-1255.
9. Singh G, Fort JG, Goldstein JL et al. Celecoxib versus aproxen and diclofenac in osteoarthritis patients. SUCCESS-1 study. Am J Med 2006; 119 : 255-266.
10. Bresalier RS, Sandler RA, Quan H et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl.J Med 2005; 352 : 1092-1102.
11. Jüni P, Reichenbach S, Sterchi R et al. Risk of cardiovascular events and rofecoxib: cumulative meta-analysis. Lancet 2004; 364 : 2021-2029.
12. Solomon SD, McMurray J, Pfeffer MA et al. Cardiovascular events associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 2005; 352 : 1071-1080.
13. Farkouh ME, Kirshner H, Harrington RA et al. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), cardiovascular outcomes: randomised centrolled trial. Lancet 2004; 364 : 675-684.
14. White WB, Strand V, Roberts R et al. Effect of the cyclooxygenase-2 specific inhibitor valdecoxib versus nonsteroidal antiinflammatory agents and placebo on cardiovascular trombotic events in patients with arthritis. Am J Ther 2004; 11 : 244-250.
15. Ott E, Nussmeier NA, Duke PC et al. Efficacy and safety of the cyclooxygense 2 inhibitors parekoxib and valdekoxib in patiens undergoing coronary artery bypass surgery. J Thorac Cardiovasc Surgery 2003; 125 : 1481-1492.
16. Konstam MA, Weir MR, Reicin A et al. Cardiovascular thrombotic events in controlled clinical trials of rofekoxib. Circulation 2001; 104 : 2280-2288.
17. Mukherjee D, Nissen SE, Topol EJ et al. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 286 : 954-959.
18. Ray WA, Stein CM, Daugherty JR et al. COX-2 selective non-steroidal anti-inflammatory drugs and risk of serious coronary hearth disease. Lancet 2002; 360 : 1071-1073.
19. Mamdani M, Rochon P, Juurlink DN et al. Effect of selective cyclooxygenase 2 inhibitor and naproxen on short-term risk of acute myocardial infarction in the elderly. Arch Intern Med 2003; 24 : 481-486.
20. Solomon DH, Schneeweiss S, Glynn RJ et al. Relationship between selective cyclooxygenase-2 inhibitors and acute myocardial infarction in older adults. Circulation 2004; 109 : 2068-2073.
21. Kimmel SE, Berlin JA, Reilly M et al. Patients exposed to rofecoxib and celecoxib have different odds of nonfatal myocardial infarction. Ann Intern Med 2005; 142 : 157-164.
22. Garcia Rodriquez LA, Varas C, Patrono C. Differential effects of aspirin and non-steroidal antiinflammatory drugs in the primary prevention od myocyrdial infarction in post-menopausal women. Epidemiology 2000; 11 : 382-387.
23. Solomon DH, Glynn RJ, Levin R et al. Nonsteroidal anti-inflammatory drug use and acute myocardial infarction. Arch Intern Med 2002; 162 : 1099-1104.
24. Watson DJ, Rhodes T, Cai B et al. Lower risk of tromboembolic cardiovascular events with naproxen among patients with rheumatoid arthritis. Arch Intern Med 2002; 162 : 1105-1110.
25. Rahme W, Pilote L, LeLorier J. Association between naproxen use and protection against acute myocardial infarction. Arch Intern Med 2002; 162 : 1111-1115.
26. Ray WA, Stein CM, Hall K et al. Nonsteroidal anti-inflammatory drugs and risk of serious coronary heart disease: an observational cohort study. Lancet 2002; 359 : 118-123.
27. Graham DJ, Campen D, Hui R et al. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclooxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet 2005; 365 : 475-481.
28. Sudbø J, Lee JJ, Lippman SM et al. Non-steroidal anti-inflammatori drugs and risk of oral cancer: a nested case-control study. Lancet 2005; 366 : 1355-1366.
29. Shaya FT, Blume SW, Blanchette CM et al. Selective cyclooxygenase-2 inhibition and cardiovascular effects. Arch Intern Med 2005; 165 : 181-186.
30. Hippisley-Cox J, Coupland C. Risk of myocardial infarction in patients taking cyclooxygenase-2 inhibitors or conventional non-steroidal anti-inflammatory drugs: population based nested case control analysis. BMJ 2005; 330 : 1366-1369.
31. Lévesque LE, Brlohy JM, Zhang B. The risk for myocardial infarction with cyclooxygenase-2 inhibitors: a population study of elderly adults. Ann Intern Med 2005; 142 : 481-489.
32. Johnsen A, Larsson H, Tarone R et al. Risk of hospitalization for myocardial infarction aminy users of Rofecoxib, Celecoxib, and other NSAIDs. Arch Intern Med 2005; 165 : 978-984.
33. Whelton A, Fort JG, Puma JA et al. Cyclooxygenase-2 specific inhibitors and cardioreanl function: a randomized, controlled trial of celecoxib and rofecoxib in older hypertensive osteoarthritis patients. Am J Ther 2001; 8 : 85-95.
34. Whelton A, White WB, Bello AE et al. Effects of celecoxib and rofekoxib on blood pressure and edema in patients ≥ 65 years of age with systemic hypertension and osteoarthritis. Am J Cardiol 2002; 90 : 959-963.
35. White WB, Kent J, Tailor A et al. Effects of celecoxib on ambulatory blood pressure in hypertensive patients on ACE inhibitors. Hypertension 2002; 39 : 929-934.
36. Mamdani M, Juurlink DN, Lee DS et al. Cyclooxygenase-2 inhibitors versus non-selective non-steroidal anti-inflammatory drugs and congestive heart failure outcomes in elderly patients: a population-based cohort study. Lancet 2004; 363 : 1751-1756.
37. Hudson M, Hugues R, Pilote L. Differences in outcomes of patients with congestive heart failure precribed celecoxib, rofecoxib, or non-steroidal anti-inflammatory drug: population based study. BMJ 2005; 330 : 1365-1370.
38. Johnson AG, Nguyen TV, Ray RO. Do nonsteroidal antiinflammatory drugs affect blood pressure? A metaanalysis. Ann Intern Med 1994; 121 : 289-300.
39. Van den Hoogen PC, Feskens EJ, Nagelkerke NJ et al. The relation between blood pressure and mortality due to coronary heart disease among men in different parts of the world. Seven Countries Study Research Group. N Engl J Med 2000; 342 : 1-8.
40. Prevention of stroke by anti-hypertensive drug treatment in old persons with isolated systolic hypertension. Final results of the Systolic Hypertension in the Elderly Program (SHEP). SHEP Cooperative Research Group. JAMA 1991; 265 : 3255-3264.
41. Steassen JA, Wang JG, Thijs L. Cardiovascular prevention and blood pressure reduction: a metaanalysis. Lancet 2001; 358 : 1305-1315.
42. Breyer MD, Breyer RM. Prostaglandin E receptors and the kidney. Am J Renal Physiol 2000; 279 (Suppl F): F12-F23.
43. Kammerl MC, Nusing RM, Richthammer W et al. Inhibition of COX-2 counteracts the effects of diuretics in rats. Kidney Intern 2001; 60 : 1684-1691.
44. Horackova M, Schűck O, Komers R et al. Effect of rofecoxib on the glomerular filtration rate, proteinuria and the renin-angiotensin-aldosterone systém in elderly subjects with chronic renal impairment. Int J Clin Pharmacol Ther Toxicol 2005; 43 : 413-419.
45. Harris RC. Cyclooxygenase-2 inhibition and renal physiology. Am J Cardiol 2002; 89 (Suppl D): 10D-17D.
46. Zhang MZ, Harris RC, Mc Kanna JA. Regulation of cyclooxygenase-2 (COX-2) in rat renal cortex by adrenal glucocorticoids and mineralocorticoids. Proc Nat Acad Sci USA 1999; 96 : 15280-15285.
47. De Maria AN, Weir MR. Coxibs-beyond the GI tract: renal and cardiovascular issues. J Pain Symptom Manage 2003; 25S: S41-S49.
48. Solomon DH, Schneeweiss S, Levin R et al. Relationship. between COX-2 specific inhibitors and hypertension. Hypertension 2004; 44 : 1-6.
49. Whelton A, Fort JG, Puma JA et al. Cyclooxygenase-2 specific inhibitors and cardiorenal function: a randomized, controlled trial of celecoxib and rofecoxib in older hypertensive osteoarthritis patients. Am J Ther 2001; 8 : 85-95.
50. Cho J, Cooke C, Proveaux W. A retrospective review of the effect of COX-2 inhibitors on blood pressure change. Am J Ther 2003; 10 : 311-317.
51. Sowers JR et al. The effects of cyclooxygenase-2 inhibitors and nonsteroidal anti-inflammatory therapy on 24-hour blood pressure in patients with hypertension, osteoarthritis and type 2 diabetes mellitus. Arch Intern Med 2005; 165 : 161-168.
52. Aw TJ, Haas SJ, Liew D et al. Meta-analysis of cyclooxygenase-2 inhibitors and teir effects on blood pressure. Ann Intern Med 2005; 165 : 490-496.
53. Catella-Lawson F, Reilly MP, Kapoor SC et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345 : 1809-1817.
54. MacDonald TM, Wei L. Effect of ibuprofen on cardioprotective effect of aspirin. Lancet 2003; 361 : 573-574.
55. Kurth T, Glynn RJ, Walker AM et al. Inhibition of clinical benefits of aspirin on first myocardial infarction by nonsteroidal antiinflammatory drugs. Circulation 2003; 108 : 1191-1195.
56. Hudson M, Baron M, Rahme E et al. Ibuprofen may abrogate the benefits of aspirin when used for secondary prevention of myocardial infarction. J Rheumatol 2005; 32 : 1589-1593.
57. Wilner KD, Rushing M, Walden C et al. Celecoxib does no affect the antiplatelet activity of aspirin in healthy volunteers. J Clin Pharmacol 2002; 42 : 1027-1030.
58. Capone ML, Sciulli MG, Toconelli S et al. Pharmacodynamic interaction of naproxen with low-dose aspirin in healthy subjects. J Am Coll Cardiol 2005; 45 : 1295-1301.
59. Walter MF, Jacob RF, Day CA et al. Sulfone COX-2 inhibitors increase susceptibility of human LDL and plasma to oxidative modification: comparison to sulfonamide COX-2 inhibitors and NSAIDs. Atherosclerosis 2004; 177 : 235-243.
60. Chenevard R, Hűrlmann D, Ruschitzka F et al. Selective COX-2 inhibition improves endotelial function in coronary artery disease. Circulation 2003; 107 : 405-409.
61. Widlanski ME, Price DT, Vita JA et al. Short - and long-term COX-2 inhibition reverses endotelial dysfunktion in patients with hypertension. Hypertension 2003; 42 : 310-315.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 7-8-
All articles in this issue
- Problematika kardiovaskulární toxicity koxibů a neselektivních NSA
- Nesteroidní antirevmatika a ledviny
- Polymyalgia rheumatica a obrovskobunková arteritída: prvé výsledky ročného sledovania.
- Jak pomáhá vyšetřování autoprotilátek v diagnostice a hodnocení autoimunitních revmatických chorob?
- Léčba časné artritidy - doporučení EULAR
- Podiel GD komplikácií vo vzťahu k liečbe NSA vo Slovenskej republike. Ročná prospektívna štúdia.
- Systémový lupus erytematózus
- Nové trendy v diagnostice a léčbě systémové sklerodermie
- Antifosfolipidový syndrom
- Časná diagnostika ankylozující spondylitidy
- Ankylozujúca spondylitída - súčasný stav a nové možnosti liečby
- Patogeneze, diagnostika a léčba dny
- Muskuloskeletální projevy diabetes mellitus
- Současné možnosti diagnostiky a léčby osteoporózy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nesteroidní antirevmatika a ledviny
- Systémový lupus erytematózus
- Ankylozujúca spondylitída - súčasný stav a nové možnosti liečby
- Antifosfolipidový syndrom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

