-
Medical journals
- Career
Agregometrie v sekundární prevenci cévních mozkových příhod. Aspirinová rezistence
Authors: M. Fauknerová 1; P. Osmančík 2; M. Špaček 3; L. Kejst 3; P. Kalvach 1
Authors‘ workplace: FN Královské Vinohrady, Praha Neurologická klinika 3. LF UK 1; FN Královské Vinohrady, Praha Kardiologická klinika 3. LF UK 2; FN Královské Vinohrady, Praha Oddělení klinické hematologie 3
Published in: Cesk Slov Neurol N 2011; 74/107(5): 527-532
Category: Review Article
Overview
Práce poskytuje přehled principů agregace, dostupných metod jejího měření a úskalí interpretace naměřených výsledků. V seznamu osmi agregometrických metod jsou popsány metody měření krvácivosti, optická a impedanční agregometrie, trombelastografie a průtoková cytometrie, jakož i měření metabolitu tromboxanu v moči. Referujeme o podmíněnosti agregačních indukcí, které ovlivňují výsledek. Agregace absolutní je dosud sama o sobě neměřitelná. Efekt prevence aterosklerotických komplikací cestou antiagregační léčby se odvozuje většinou z výsledků studií, jež detekují dopad zredukované trombogeneze a emboligeneze na kliniku. Úprava dávkovacích schémat vychází z těchto sekundárních a odvozených poznatků. Samotná intenzita agregační pohotovosti se pro své obtížné měření prosazuje v těchto rozhodnutích pouze velmi pozvolna. Sumarizujeme též současné pohledy na rezistenci vůči kyselině acetylsalicylové, ve dvou variantách její povahy – rezistenci klinické a laboratorní. Uzavíráme pohledem na budoucí možnosti agregačního monitoringu.
Klíčová slova:
agregace – metody měření – aspirin – kyselina acetylsalicylová – rezistence – prevence iktů – ischemický iktus – trombogenezeÚvod
Trombotické a embolické komplikace aterosklerózy jsou nejčastější příčinou ischemických cévních příhod mozkových i srdečních. V centru preventivní léčby jsou proto léky antiagregační a antikoagulační. Zatímco efekty antikoagulační léčby je možno poměrně spolehlivě monitorovat a podle kontrol upravovat dávku k dosažení adekvátní rovnováhy mezi profitem a rizikem, u léčby antiagregační je sledování přímého efektu velmi obtížné.
Inhibovat agregaci můžeme působením na jejích sedm hlavních aktivátorů:
- a) tromboxan (TX), jenž vzniká působením cyklooxygenázy na arachidonovou kyselinu
- b) trombin
- c) adenosin difosfát (ADP) uvolňovaný z granul destiček
- d) kolagen, jenž aktivuje destičky při obnažení cévní stěny prostřednictvím glykoproteinových receptorů
- e) katecholaminy
- f) smykové napětí
- g) faktor aktivující destičky (Platelet Activating Factor, PAF), jenž se uplatňuje zejména při zánětlivých procesech.
Ze dvou typů cyklooxygenázy (COX-1 a 2), které katalyzují proměnu kyseliny arachidonové na tromboxan, dokáže izoformu 1 úspěšně a ireverzibilně inhibovat kyselina acetylsalicylová (ASA). Ta má také ze všech antiagregačních preparátů nejdelší použití – již přes 100 let (byť v řadě jiných indikací). V posledních 30 letech právě s jejím využitím pro antiagregaci byl proveden největší počet klinických studií; ty výrazně převyšují zkušenosti s dalšími antiagregačními preparáty.
K reverzibilním COX-1 inhibitorům patří sulfinpyrazon, indobufen, flurbiprofen a triflusal. Další preparát dipyridamol působí prostřednictvím inhibice fosfodiesterázy a současně blokuje vychytávání adenosinu, čímž dochází k akumulaci cyklického adenosin monofosfátu (AMP) jako destičkového inhibitoru. Tienopyridiny – tiklopidin a klopidogrel po přeměně v aktivní metabolit selektivně inhibují ADP indukovanou destičkovou agregaci prostřednictvím destičkových receptorů P2Y12. A konečně skupina antagonistů glykoproteinových receptorů IIb/IIIa inhibuje tento receptor jako finální společnou dráhu destičkové agregace, nezávisle na iniciačním stimulu. Patří sem parenterálně podávaný abciximab, tirofiban, eptifibatide a dále perorální preparáty, jako xemilofiban, orbofiban, sibrafiban a lotrafiban [1].
Monitorování účinku ASA antiagregace sledováním výskytu cévních příhod mozkových/srdečních znamená hledání odvozených dopadů v komplexu následků aterosklerózy; tedy hledání ve společném kotli 20–30 různých příčin. Dokud není jasný účinek přímý, totiž dopad na vlastní agregaci, budou se nám v souboru léčených osob vyskytovat mnozí takoví, kteří reagují na léčbu nedostatečně, případně vůbec ne. Vedle nich však též jiní, kteří sice agregaci léčbou potlačili, ale jiné progresivní faktory (např. hemodynamické) je k cévní příhodě mozkové či srdeční přesto přivedly.
Pacienti s aspirinovou rezistencí z léčby profitují méně či vůbec. Přesto jsou tito jedinci vystavováni riziku nežádoucích účinků. Snaha identifikovat ASA rezistentní osoby pomocí laboratorního měření agregace, upravovat jejich terapii a monitorovat efekt léčby je stále spíše akademická záležitost.
Metody měření agregace jsou založeny na principech, které se neobejdou bez indukce, a nemají tudíž absolutní kvantitativní výraz. Výsledky jsou nesourodé a postrádají výstupy o intenzitě agregace nativní a postmedikamentózní. Není tedy známo, jaká dávka změní elementární pohotovost trombocytů k agregaci o kolik procent. Chybí tak možnost rozeznávat spolehlivě non-respondéry od osob adekvátně reagujících. Shrnujeme současné poznatky o možnostech těchto měření.
Princip agregace destiček
Ze dvou neoddělitelných složek hemostázy – agregace a koagulace – je při poranění cévní stěny činnost destiček dějem primárním (obr. 1). Nicméně jednotlivé fáze agregace se prolínají s fázemi koagulace jako dvě vzájemně neoddělitelné složky [2].
Image 1. Princip agregace destiček. Obnažený subendoteliální kolagen při porušení cévní stěny stimuluje trombocyty k adhezi ke stěně cévní prostřednictvím glykoproteinových (GP) receptorů Ia a Ib. Destičky se kontrakcí svého cytoskeletu jednak zakulatí, jednak vysílají dlouhé tenké filopodie. Těmi se mezi sebou zachycují, za pomoci exprimovaných GP receptorů IIb a Ia. Na receptory se váže fibrinogen, polymerizující účinkem trombinu na fibrin. Von Wilebrandův faktor (vWF), produkovaný endotelem, a faktor V, produkovaný rozpadajícími se destičkami, upevňují (spolu s endoperoxidy a tromboxanem vznikajícím z kyseliny arachidonové) dimerické vazby fibrinu mezi destičkami a jejich vazbu na endotel. Primární, do té doby reverzibilní agregace, se tak zpětnovazební, amplifikační smyčkou za vyplavení trombocytárních granul stává ireverzibilní. Účastní se zde dva typy granul: menší denzní obsahují zejména adenosindifosfát, kalcium a serotonin a větší světlejší α granula uvolňující směs proteinů, růstových faktorů, fibrinogen, vWF a faktor V. Za samostatný typ granul považujeme lysozomy. Velmi důležitou látkou jsou fosfolipidy obsažené v povrchové membráně destiček, kde vytvářejí podklad pro vazbu a reakce enzymů koagulačního systému. Ve finálním konglomerátu jsou destičky rozpadlé viskózní metamorfózou do splývajícího koagula [3,26]. ![Princip agregace destiček.
Obnažený subendoteliální kolagen při porušení cévní stěny stimuluje trombocyty k adhezi ke stěně cévní prostřednictvím glykoproteinových (GP) receptorů Ia a Ib. Destičky se kontrakcí svého cytoskeletu jednak zakulatí, jednak vysílají dlouhé tenké filopodie. Těmi se mezi sebou zachycují, za pomoci exprimovaných GP receptorů IIb a Ia. Na receptory se váže fibrinogen, polymerizující účinkem trombinu na fibrin. Von Wilebrandův faktor (vWF), produkovaný endotelem, a faktor V, produkovaný rozpadajícími se destičkami, upevňují (spolu s endoperoxidy a tromboxanem vznikajícím z kyseliny arachidonové) dimerické vazby fibrinu mezi destičkami a jejich vazbu na endotel. Primární, do té doby reverzibilní agregace, se tak zpětnovazební, amplifikační smyčkou za vyplavení trombocytárních granul stává ireverzibilní. Účastní se zde dva typy granul:
menší denzní obsahují zejména adenosindifosfát, kalcium a serotonin a větší světlejší α granula uvolňující směs proteinů, růstových faktorů, fibrinogen, vWF a faktor V. Za samostatný typ granul považujeme lysozomy. Velmi důležitou látkou jsou fosfolipidy obsažené v povrchové membráně destiček, kde vytvářejí podklad pro vazbu a reakce enzymů koagulačního systému. Ve finálním konglomerátu jsou destičky rozpadlé viskózní metamorfózou do splývajícího koagula [3,26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c4e588b80c29a325e1e68f35472dc6de.jpg)
Reverzibilní destičkové odpovědi plní průběžně úlohy při uzavírání stále se tvořících skulin v cévním endotelu primárními agregáty a při zacelování malých defektů v subendotelu pod účinkem růstového faktoru z α granul destiček. Ireverzibilní agregace je pak základem hemostatické funkce destiček. Vznikne při ní destičkový (bílý) trombus neboli provizorní hemostatická zátka; ta ucpává trhliny, především v mikrocirkulaci. Ke své konsolidaci a stabilizaci potřebuje ještě fibrinová vlákna, která trombus zpevní, zachytí erytrocyty, a vzniká tak definitivní trombus.
Destičkové odpovědi jsou děje s dvousměrnou regulací. Musí být řízeny tak, aby v intaktních cévách nedocházelo k adhezi a agregaci trombocytů. Interakci mezi destičkami a cévní stěnou brání normální endotelové buňky tvorbou a uvolňováním inhibitorů. Patří sem látky typu prostaglandinů, nestálý prostacyklin PGI2 a oxid dusnatý (NO), nazývaný také EDRF (Endothelium Derived Relaxing Factor) [3].
Metody měření agregace
Ve světle široké interindividuální variability je velmi obtížné posoudit míru antitrombotického benefitu oproti riziku krvácení. Cílem je udržet rovnováhu v terapeutickém okně, analogicky jako při monitorování antikoagulační terapie [2]. Získat rychlou a jednoduchou metodu schopnou zachytit funkční následky blokády agregace by bylo pro monitorování léčby a usměrnění dávek velmi užitečné. Jak vyplyne z následujícího seznamu osmi metod, daří se tak teprve v posledních letech, avšak pouze s dílčím úspěchem (tab. 1).
Table 1. Přehled testů pro monitorování protidestičkové terapie. 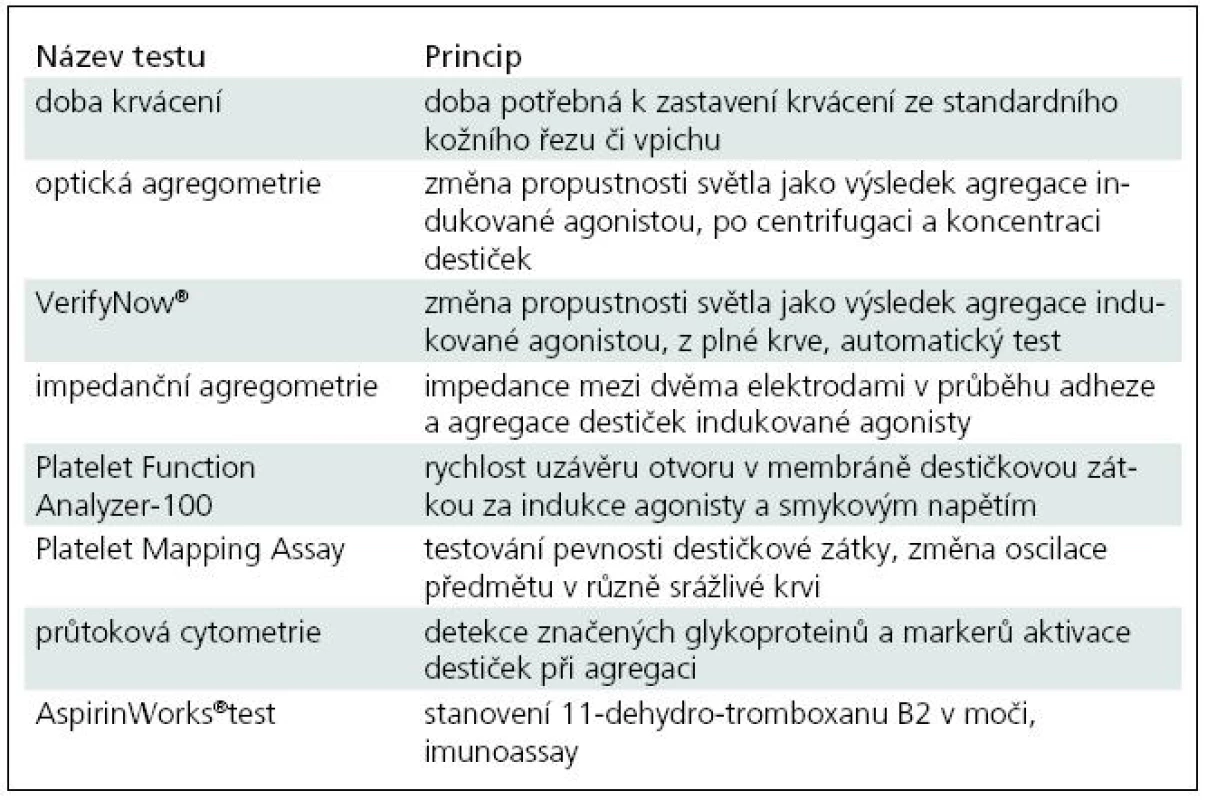
1. Doba krvácení (Duke, Ivy)
Test spočívá ve stanovení doby, během níž dojde na kůži v místě standardního vpichu či řezu ke spontánní zástavě krvácení. Výhodou je studium přirozené hemostázy a role cév v tomto procesu. Limitací testu je nejen invazivita, ale i nepřesný výsledek ovlivněný např. změnou teploty, počtem destiček, červených krvinek, cévní stěnou, trofikou kůže a především nemožností standardizace [4–7].
2. Optická agregometrie
Roku 1960 byl představen dosud zlatý standard testování funkce destiček – optická agregometrie (Light Transmission Aggregometry, LTA). Objevitelé Gustav Born a John O’Brien využili modifikovanou spektrofotometrickou techniku – turbidimetrické měření změn optické denzity. Principem je změna propustnosti světla jako výsledek destičkové agregace indukované agonistou. Přes mnohé výhody se jedná o poměrně nefyziologickou metodu. Dochází ke smíchání separovaných destiček s agonisty, výsledek je ovlivněn koncentrací destiček, výběrem a koncentrací agonisty, centrifugací i preanalytickými procedurami. Vyžaduje velké objemy krve, provedení a interpretace testu jsou obtížné a časově náročné [4,5,7–9].
3. VerifyNow®
Variantou optické agregometrie v moderním pojetí je metoda z 90. let 20. století nazývaná Rapid Platelet – Function Assay (RPFA) [10]. Nyní je již známa spíše jako VerifyNow® (VN) [11]. Jedná se o plně automatický test, který z plné krve měří agregaci destiček, indukovanou agonisty. Přístroj obsahuje turbidimetrický optický detektor, jímž se měří prostupnost světla vzorkem krve v kartridži k jednomu použití. Jsou k dispozici náplně pro měření destičkové odpovědi na tři různá antiagregancia: Aspirin, P2Y12 antagonisty – tienopyridiny a IIb/IIIa antagonisty. K výhodám metody patří plně automatické provedení, rychlost, jednoduchost, možnost realizace na oddělení u lůžka, bez potřeby specializované laboratoře a dostačující malý vzorek krve. Nevýhodou zůstává částečné ovlivnění výsledku hematokritem a počtem destiček; také použití náplní vždy pouze jednorázově a pro specifickou látku [4,9,12]. Ve svých vlastních vyšetřeních jsme nalezli zřetelné snížení agregability po jednorázovém podání 500 mg ASA, jak i.v., tak perorálně. Závislost na dávce a opakování podání je též signifikantní, ač je omezena limitními prahy měření [13].
4. Impedanční agregometrie
Místo detekce optické lze intenzitu krevní precipitace sledovat měřením elektrické vodivosti vzorku pomocí impedanční agregometrie (Impedance Whole Blood Aggregometry, WBA). Mezi dvěma elektrodami se v průběhu adheze a agregace destiček po přidání klasických agonistů sleduje elektrická rezistence. Stačí menší objem, není nutná cetrifugace zkreslující výsledek [4,9].
5. Platelet Function Analyzer-100
Další velká skupina testů byla vyvinuta ve snaze napodobit procesy probíhající během poškození cévní stěny. Široce používanou metodou z této skupiny je Platelet function Analyzer-100 (PFA-100). Destičky se aspirují do tenké kapiláry s membránou s mikroskopickým otvorem. Membrána je obalena agonisty, které společně se smykovým napětím aktivují destičky a formují destičkovou zátku v otvoru membrány. Přístroj měří čas, během něhož destičky uzavřou otvor v membráně, a koreluje jej s celkovým objemem krve použité pro test. PFA-100 bývá nazýván „in vitro bleeding time“, neboť napodobuje fyziologické podmínky [4,7].
6. Thrombelastography®
Další skupina testů studuje roli trombocytů v pevnosti destičkové zátky. Zabývají se jejími fyzikálními vlastnostmi. Hlavním představitelem je Thrombelastography® (TEG) a její nejnovější verze Platelet Mapping Assay. Principem je graficky zaznamenaná oscilace předmětu ve srážlivé krvi, snížená proti krvi nesrážlivé. Používá se plné krve, výsledek je rychlý. V pevnosti zátky se slučuje propojení destičkových funkcí a koagulace. Málo publikovaných studií s touto metodou nedovolilo poznat její kvality dosud tak precizně.
7. Průtoková cytometrie
Výzkumným nástrojem v posledních 20 letech je průtoková cytometrie. V nesrážlivé krvi se značená reagens (monoklonální protilátky) specificky váží k individuálním destičkovým proteinům, granulím a membránovým lipidům. Ze změn na destičkovém povrchu tak nejčastěji měříme P-selectin (CD62P), aktivovaný integrin αIIbβ3 (GP IIb/IIIa, CD41/CD61) a leukocytárně-destičkové agregáty. Dostačuje malý vzorek plné krve a standardizace vyšetření je dobrá. Nevýhodou je cena a obtížná příprava vzorku. Zcela specifickou metodou v rámci průtokové cytometrie je Phosphorylation of Vasodilator – Stimulated Phosphoprotein (VASP). Metoda využívá měření P2Y12 antagonizmu, tedy samotného cíle klopidogrelu na receptoru P2Y12 [4].
8. Měření tromboxanu B2
Doplňkovou metodou pro trombogenní aktivitu zůstává měření tromboxanu B2 jako stabilnějšího metabolitu tromboxanu A2 v krvi a moči. Množství tromboxanu závisí na aktivaci destiček a výhodou je jeho přímá závislost na COX-1 dráze. Nevýhodou je, že destičky se nevyšetřují přímo. V moči stanovujeme 11-dehydro-tromboxan B2 pomocí AspirinWorks® testu. Navíc se zde hlásí i možné ovlivnění renálními funkcemi, a proto je nutná korelace ke kreatininu [4,9].
Obecných laboratorních úskalí při testování destičkových funkcí je několik:
- v různých laboratořích se používají různé koncentrace agonistů, takže standardní rozmezí se liší;
- normální destičkové funkce jsou kalcium-dependentní, tudíž jakákoli antikoagulace s kalciovou chelací může ovlivnit výsledek;
- v testech vyžadujících citrátované krevní vzorky mohou být výsledky ovlivněny teplotou, stářím a manipulací se vzorkem.
Destičky jsou citlivé k arteficiální aktivaci, ale též je možná desenzitizace. Zajištění kvality vzorku správným odběrem a transportem je kruciální před prováděním jakéhokoliv testu destičkové funkce [7].
Zcela zásadní a dosud nepřekonatelnou okolností agregometrie je, že vždy měříme agregaci indukovanou, nikoli spontánní či absolutní. V závislosti na použitém induktoru se výsledek liší. Současně se v účinnosti daného induktoru projeví, nakolik byla právě jeho agregační účinnost podlomena vybraným antiagregačním lékem.
Dle našich výsledků z optické agregometrie (viz podkapitola 2, obr. 2) omezuje ASA v různé míře agregaci indukovanou kolagenem, epinefrinem a kyselinou arachidonovou, naopak neovlivňuje agregaci indukovanou ADP a ristocetinem (látka působící prostřednictvím von Wilebrandova faktoru). Spolehlivější se zdá měření efektu antiagregace induktorem hlavní dráhy daného léku, nicméně vliv dalších induktorů potvrzuje vícečetné možnosti ovlivnění.
Image 2. Použití různých induktorů agregace nativně a při léčbě. a) Během 50–100 sekund po aplikaci induktoru se zvedá křivka optické agregometrie k 75 % plné výkonnosti. Reakce na indukci kolagenem a kys. arachidonovou je fyziologicky pomalejší. Normální agregační křivky při všech induktorech (ristocetin – červená, ADP – žlutá, kyselina arachidonová – zelená, epinefrin – fialová, kolagen – modrá). Nativní agregační pohotovost bez léčby. b) Agregace s indukcí ristocetinem a ADP je zachovaná na 82,6; resp. 66,64 %, na rozdíl od indukce kys. arachidonovou, epinefrinem a kolagenem, při nichž je signifikantně potlačená na 15,97; 11,02; resp. 6,35 %. V tomto případě jde o léčbu kyselinou acetylsalicylovou 100 mg denně. 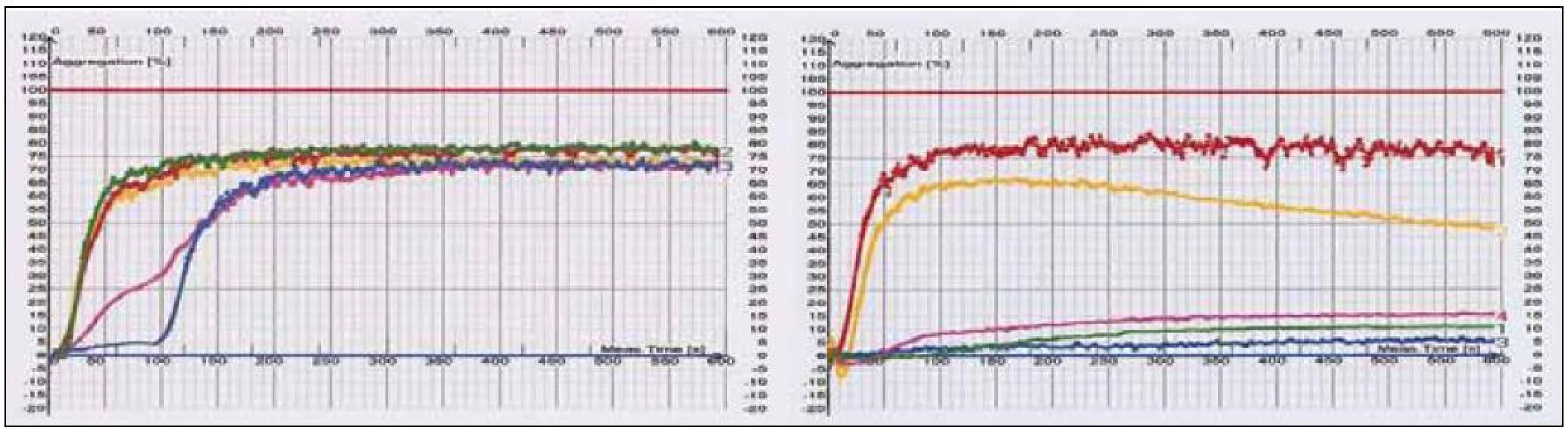
Aspirinová rezistence
Přes chronickou protidestičkovou terapii, kterou užívají miliony pacientů po celém světě, se stále u některých z nich objevují nové aterotrombotické události. Tomu se nedivíme, protože antiagregační léčbou lze rozvoj aterosklerotických komplikací nejvýše zpomalit. Důležitější je však zjistit, u kterých nemocných antiagregace nepůsobí.
Několik studií posledních let ukazuje na možnou souvislost mezi reziduální destičkovou aktivitou měřenou laboratorně a klinickým nezdarem. Vznikla tak teorie, že laboratorně zjištěná rezistence k protidestičkové terapii může být podkladem klinických recidiv.
Ateroskleróza, jak ji známe, je natolik komplexní proces, že blokádou pouze jednoho jejího mechanizmu, tedy vlivu na destičkové funkce, nemůžeme anulovat celý proces a jeho konsekvence. Proto nelze očekávat, že protidestičkové léky ochrání všechny pacienty od aterotrombotických komplikací. To samé platí analogicky i pro hypotenziva nebo hypolipidemika. Nicméně ta můžeme monitorovat a dávky léků titrovat dle efektu. Měření antiagregace nedosáhlo ještě standardizace a je stále pouze pomocným nástrojem i po více než 30 letech intenzivního výzkumu.
Nedostatečný protidestičkový efekt kyseliny acetylsalicylové lze tedy pozorovat buď jako absenci blokády destiček při laboratorním měření agregace nebo klinicky jako trombotické a embolické projevy aterosklerózy vzdor antiagregační terapii.
Rozdělení na klinickou a laboratorní rezistenci určitě neznamená vznik identických skupin rezistentních pacientů. Laboratorní rezistence nemusí končit ischemickými událostmi a pacienti s ischemickou událostí přes protidestičkovou terapii nemusí být laboratorně rezistentní. V určitém variabilním procentu dochází přesto k jejich vzájemnému překryvu [14].
Odhady prevalence aspirinové rezistence se pohybují v širokém rozmezí (5,5–60 % ), což ukazuje jak na rozdíly při stanovování destičkové reaktivity různými laboratorními metodami, tak na různou četnost výskytu u jednotlivých cévních onemocnění [15]. Pokud redukujeme data pouze na ta vycházející ze studií vyšetřujících agregaci indukovanou arachidonovou kyselinou a nebo měřením TX, pohybuje se průměrná prevalence aspirinové rezistence na ASA kolem 6 % [14].
Z vnějších faktorů, které způsobují rezistenci, jsou nejdůležitější „non-compliance“, tedy nedisciplinované narušování léčby. Dále je to kuřáctví, které zvyšuje destičkovou reaktivitu, případně i snižuje sekreci oxidu dusnatého.
Rezistence na ASA byla častěji pozorována u žen a u starších osob [16]. Průběžně vyšší ochota k agregaci je způsobena nižší hladinou testosteronu [17] a vyšším počtem destiček v cirkulaci [6].
Faktory vnitřní představují farmakokinetické a farmakodynamické mechanizmy vzniku rezistence.
- První překážkou může být neadekvátní absorpce aspirinu při podání enterických obalovaných tablet. Kromě vrozených dispozic ve střevní stěně nastává podobná indispozice také při současném podání nesteroidních antirevmatik (NSA). Např. ibuprofen či naproxen interagují s aspirinem kompeticí o cíl acetylace COX. Tato farmakodynamická interakce se neobjevuje u rofecoxibu, celecoxibu a diklofenaku, tedy léků se selektivitou ke COX-2. Pro pacienty na ASA se proto doporučuje užívat z NSA diklofenak, nebo selektivní inhibitory COX-2. Inhibiční efekt samotných NSA na agregaci se liší podle dávky a studie o jeho efektu si zatím protiřečí [1,5,16].
- Aspirinová rezistence může být též důsledkem zvýšené produkce nových, aktivnějších destiček, na něž jedna dávka ASA denně nestačí [12]. Zvýšený destičkový obrat je přítomen například u myeloproliferativních onemocnění či při větších chirurgických výkonech [6]. Rezistence je zde způsobena přechodnou expresí COX-2 v nově formovaných destičkách.
- TX-A2 produkovaný z monocytů či makrofágů může též přispět ke zvýšené agregaci při akutních koronárních syndromech [1]. Navíc monocyty, makrofágy a endotelové buňky poskytují prostaglandin H2 transcelulárně destičkám a obcházejí tak COX-1. Existuje i studie demonstrující zvýšenou tvorbu destičkových eikosanoidů, které podporují uvolňování komponent destičkových granul a indukují nábor destiček z mikroprostředí k tvorbě trombu na základě indukce erytrocyty [5].
- Některé studie tvrdí, že destičky aspirinových non-respondérů jsou citlivější ke kolagenu a hypersenzitivní k ADP [18,19]. Tedy převažují zde na aspirin nereagující dráhy aktivace agregace.
- Aspirin nedokáže ovlivnit agregaci indukovanou katecholaminy; indukce agregace cvičením či mentálním stresem zůstává tedy aspirinem neovlivnitelná [5].
- Ateroskleróza jako zánětlivé onemocnění zvyšuje expresi COX-2 stimulací endotelových buněk a monocyto-makrofágového systému. Vzhledem k tomu, že je COX-2 méně senzitivní k aspirinu, může její větší exprese vést k rezistenci. Navíc destičky, které obsahují COX-2, mohou za určitých podmínek amplifikovat její expresi [14,16].
- Velkou skupinu mezi aspirin rezistentními osobami představují genetické polymorfizmy COX – tzv. Single Nucleotide Polymorphisms (SNPs). Jsou to polymorfizmy COX-1 genu, které ovlivňují část agregace závislou na arachidonové kyselině. Také geny kódující hlavní destičkové glykoproteinové receptory jsou variabilní a jejich polymorfizmus může způsobit pokles inhibičního efektu. Projeví se tak např. zvýšenou destičkovou odpovědí na kolagen nebo poklesem prahu pro aktivaci destiček a uvolňování obsahu z granul [16].
- Aktivátory agregace nezávislé na tromboxanu (ADP, serotonin, trombin, smykové napětí a prozánětlivé proteiny např. CD 40L) mohou též způsobit, že se kyselina acetylsalicylová neprosadí. Podobně izoprostany produkované z kyseliny arachidonové neenzymatickým, na aspirinu nezávislým procesem peroxidace lipidů též zvyšují agregaci a navíc způsobují vazokonstrikci [5]
- Popisuje se též menší účinnost ASA při hypertenzi nad 145 mmHg systoly, při vyšších koncentracích cholesterolu, u pacientů s diabetem a obezitou (metabolický syndrom) [16] (tab. 2).
Table 2. Přehled hlavních mechanizmů aspirinové rezistence. 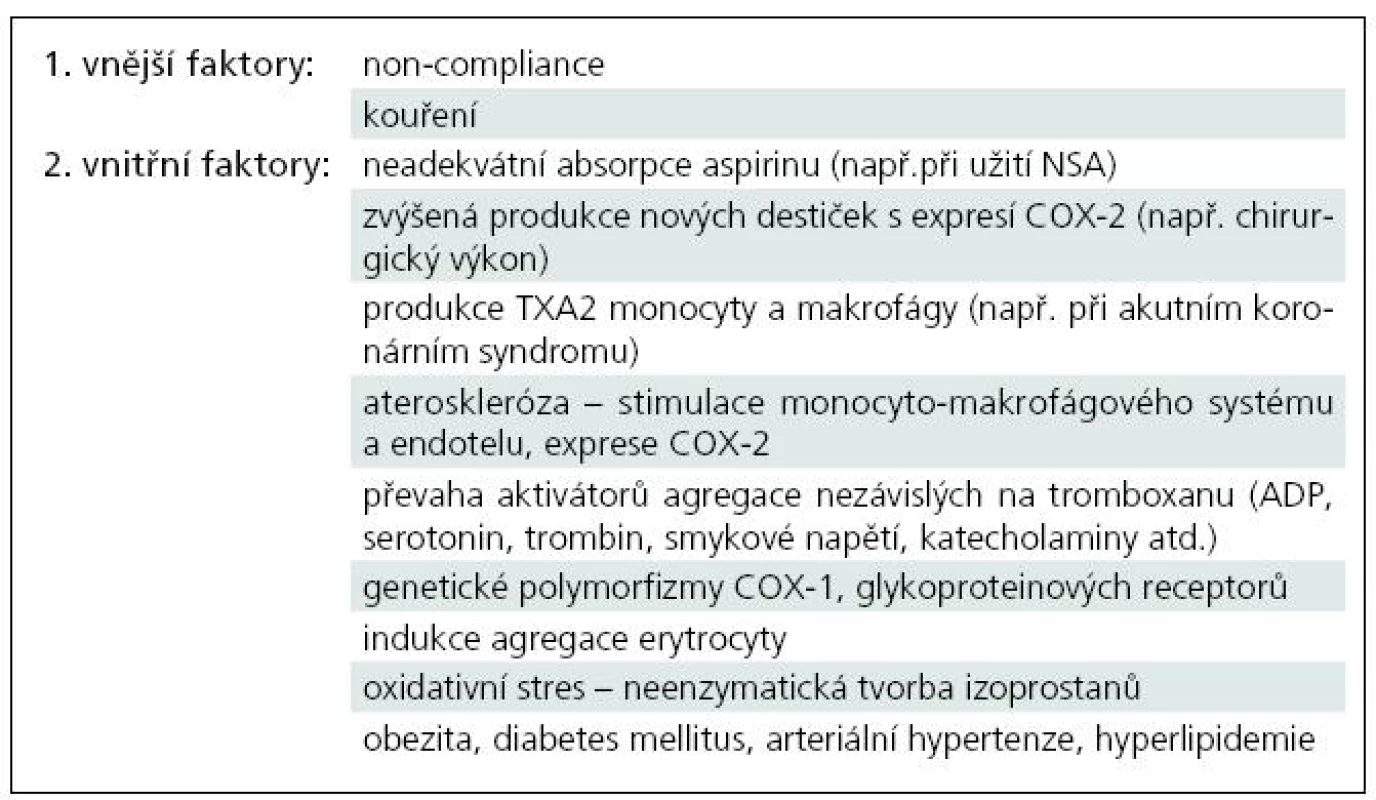
Dostatečný efekt ASA vyžaduje blokádu 95% destičkové COX-1 aktivity. Toho lze u mnohých dosáhnout již 30 mg ASA denně. U respondérů není zvyšování na 80–100 mg zapotřebí, neboť více než kompletní inhibice COX-1 dependentní tvorby TX nelze dosáhnout.
Klasifikovat tzv. selhání léčby při mozkovém iktu za léčby ASA nemá své logické opodstatnění. Podobně jako není zaručeno vymýcení iktů normalizací krevního tlaku nebo cholesterolu, nemůže v celém multifaktoriálním komplexu ani úspěšná antiagregace zaručit trvalé zdraví. Nelze proto propojit termín klinické a obecně aspirinové rezistence [12].
Dosud stanovené hraniční hodnoty, jež rozdělují jednotlivce na respondéry a non--respondéry na ASA, užívají většinou testy s indukcí kyselinou arachidonovou (AA): „LTA platelet aggregometry“(ad 2), „whole blood aggregometry“(ad 4), „Platelet Mapping Assay“(ad 6) a „VerifyNow“(ad 3). Pro monitorování destičkových funkcí v rutinní praxi není dosud konsenzus pro žádný z nich.
Situaci komplikuje navíc fakt, že protidestičkový efekt fixní dávky ASA se může v průběhu času měnit. Byla například pozorována eskalace naměřených hodnot z částečné do kompletní inhibice agregace. Mimoto byla zjištěna i vyšší destičková reaktivita v akutní fázi cévních onemocnění, ale není jasné, zda je tento fenomén příčinou či následkem akutní události.
V současnosti nemáme žádná doporučení pro léčbu odhalené neúplné odpovídavosti, ať už jakoukoliv metodou. Bylo by žádoucí ověřit, zda rezistence na ASA může být překonána zvýšením dávky. Ač laboratorně stanovené hodnoty po zvýšení dávky ASA u původně rezistentních či inkompletně reagujících jedinců potvrzují v určitém procentu překonání rezistence, nebyl tento efekt potvrzen ve velkých populačních studiích. Zde ovšem narážíme na rozdíl mezi laboratorní a klinickou rezistencí. Například dle studie Aspirin Induced Platelet Effect Study (ASPECT) byl laboratorně zaznamenán pokles v destičkové funkci závislý na dávce u pacientů se stabilní ischemickou chorobou srdeční (ICHS) [12,16].
Kromě navýšení dávky je testována výměna léku (např. klopidogrel namísto ASA) či užití jiných nových protidestičkových léků [17]. Existují studie, kde bylo využito přidání klopidogrelu k ASA u pacientů s ICHS, jejichž destičky nebyly samotnou ASA dostatečně inhibovány a touto kombinací byla rezistence překonána [20,21]. Větší destičková reaktivita přes terapii se často vyskytuje u pacientů s metabolickým syndromem a u kuřáků. Je tedy v prvé řadě vždy nutné redukovat veškeré ovlivnitelné rizikové faktory a současně ověřit compliance a možné lékové interakce. Zvážení rizik a přínosů změny protidestičkové terapie s ohledem na výsledky dostupných studií a známé nežádoucí účinky je zatím spíše individuální.
Jsou ASA rezistentní osoby více ohroženy mozkovým ischemickým iktem? Ano, existují studie potvrzující vyšší riziko vaskulárních událostí či smrti. Nicméně tyto studie zvažují častěji spíše celková vaskulární rizika, obsahují malá množství pacientů a často používají nereferenční metody měření agregace a různé dávky ASA [1,16,22–25]. Studie korelující laboratorně zjištěnou aspirinovou rezistenci a výskyt CMP probíhají.
MUDr. Miroslava Fauknerová
Neurologická klinika
3. LF UK a FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: mirkafa@seznam.czPřijato k recenzi: 18. 3. 2011
Přijato do tisku: 2. 5. 2011Poděkování
Tato práce byla podpořena grantem MŠMT VZ 0021620816.
Sources
1. Patrono C, Baigent C, Hirsh J, Roth G. American College of Chest Physicians. Antiplatelet drugs: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133 (Suppl 6): 199S–233S.
2. Bauer J. Antikoagulační terapie v prevenci a léčbě ischemických iktů. Cesk Slov Neurol N 2010; 73/106(5): 480–491.
3. Travníčková E. Fyziologie krve. In: Trojan S (ed). Lékařská fyziologie. 2. přepracované a rozšířené vydání. Praha: Grada Publishing 1996 : 73–106.
4. Harrison P, Frelinger AL 3rd, Furman MI, Michelson AD. Measuring antiplatelet drug effects in the laboratory. Thromb Res 2007; 120(3): 323–336.
5. Pamukcu B. A review of aspirin resistance; definition, possible mechanisms, detection with platelet function tests, and its clinical outcomes. J Thromb Thrombolysis 2007; 23(3): 213–222.
6. Tousoulis D, Siasos G, Stefanadis C. Aspirin resistance: what the cardiologist needs to know? Int J Cardiol 2009; 132(2): 153–156.
7. Harrison P. Platelet function analysis. Blood Rev 2005; 19(2): 111–123.
8. Haubelt H, Anders C, Hellstern P. Can platelet function tests predict the clinical efficacy of aspirin? Semin Thromb Hemost 2005; 31(4): 404–410.
9. Michelson AD. Methods for the measurement of platelet function. Am J Cardiol 2009; 103 (Suppl 3): 20A–26A.
10. Smith JW, Steinhubl SR, Lincoff AM, Coleman JC, Lee TT, Hillman RS et al. Rapid platelet-function assay: an automated and quantitative cartridge-based method. Circulation 1999; 99(5): 620–625.
11. Price JM. Accumetrics VerifyNow system. User manual. USA: Accumetrics Inc 2006; 1–122.
12. Gurbel PA, Bliden KP, DiChiara J, Newcomer J, Weng W, Neerchal NK et al. Evaluation of dose-related effects of aspirin on platelet function: results from Aspirin-Induced Platelet Effect (ASPECT) study. Circulation 2007; 115(25): 3156–3164.
13. Fauknerová M, Petr R, Doležil D, Kalvach P. Stanovení agregace při různých dávkách a schématech podávání kyseliny acetylsalicylové. Cesk Slov Neurol N 2010; 73/106 (Suppl 2): S118.
14. Kuliczkowski W, Witkowski A, Polonski L, Watala C, Filipiak K, Budaj A et al. Interindividual variability in the response to oral antiplatelet drugs: a position paper of the Working Group on antiplatelet drugs resistance appointed by the Section of Cardiovascular Interventions of the Polish Cardiac Society, endorsed by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J 2009; 30(4): 426–435.
15. Gasparyan AY, Watson T, Lip GY. The role of aspirin in cardiovascular prevention: implications of aspirin resistance. J Am Coll Cardiol 2008; 51(19): 1829–1843.
16. Sztriha LK, Sas K, Vecsei L. Aspirin resistance in stroke: 2004. J Neurol Sci 2005; 229–230 : 163–169.
17. Biller J. Aspirin nonresponse in patients with arterial causes of ischemic stroke: considerations in detection and management. J Neurol Sci 2008; 272(1–2): 1–7.
18. Kawasaki T, Ozeki Y, Igawa T, Kambayashi J. Increased platelet sensitivity to collagen in individuals resistant to low-dose aspirin. Stroke 2000; 31(3): 591–595.
19. Macchi L, Sorel N, Christiaens L. Aspirin resistance: definitions, mechanisms, prevalence, and clinical significance. Curr Pharm Des 2006; 12(2): 251–258.
20. Eikelboom JW, Hankey GJ, Thom J, Claxton A, Yi Q, Gilmore G et al. Enhanced antiplatelet effect of clopidogrel in patients whose platelets are least inhibited by aspirin: a randomized crossover trial. J Thromb Haemost 2005; 3(12): 2649–2655.
21. Dropinski J, Jakiela B, Sanak M, Wegrzyn W, Biernat M, Dziedzina S et al. The additive antiplatelet action of clopidogrel in patients with coronary artery disease treated with aspirin. Thromb Haemost 2007; 98(1): 201–209.
22. Grotemeyer KH, Scharafinski HW, Husstedt IW. Two-year follow–up of aspirin responder and aspirin non responder. A pilot-study including 180 post-stroke patients. Thromb Res 1993; 71(5): 397–403.
23. Eikelboom JW, Hirsh J, Weitz JI, Johnston M, Yi Q, Yusuf S. Aspirin-resistant thromboxane biosynthesis and the risk of myocardial infarction, stroke, or cardiovascular death in patients at high risk for cardiovascular events. Circulation 2002; 105(14): 1650–1655.
24. Gum PA, Kottke-Marchant K, Welsh PA, White J, Topol EJ. A prospective, blinded determination of the natural history of aspirin resistance among stable patients with cardiovascular disease. J Am Coll Cardiol 2003; 41(6): 961–965.
25. Grundmann K, Jaschonek K, Kleine B, Dichgans J, Topka H. Aspirin non-responder status in patients with recurrent cerebral ischemic attacks. J Neurol 2003; 250(1): 63–66.
26. Mehta JL, Mohandas B. Aspirin resistance: fact or fiction? A point of view. World J Cardiol 2010; 2(9): 280–288.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2011 Issue 5-
All articles in this issue
- Vývojová porucha koordinace – vývojová dyspraxie
- „Awake“ resekcia supratentoriálnych low-grade gliómov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami
- Kognitivní evokované potenciály
- Hereditární časná forma Alzheimerovy nemoci v důsledku zárodečné mutace p.M139V v genu PSEN1 – kazuistika
- Oboustranná ischemická retinopatie a neuropatie optiku jako izolovaný oční projev vysokohorské nemoci – kazuistika
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí
- Prevence žilní trombózy a plicní embolizace v neurochirurgii
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
- Kognitivní dysfunkce u pacientů s klinickým izolovaným syndromem a roztroušenou sklerózou
- Agregometrie v sekundární prevenci cévních mozkových příhod. Aspirinová rezistence
- Vyšetření očních pohybů v neurologické praxi
- Kalcifikující pseudoneoplazma nervového systému – tři kazuistiky
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vývojová porucha koordinace – vývojová dyspraxie
- Kognitivní evokované potenciály
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

