-
Medical journals
- Career
Feochromocytom: diagnostika a léčba
Authors: Widimský J. Jr 1; T. Zelinka 1; O. Petrák 1; B. Štrauch 1; J. Rosa 1; M. Michalský 2; M. Kasalický 3; L. Šafařík 4; A. Vranková 1; R. Holaj 1
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, III. interní klinika VFN – Centrum pro hypertenzi 1; Univerzita Karlova v Praze, 1. lékařská fakulta, I. chirurgická klinika VFN 2; Ústřední vojenská nemocnice Praha, Chirurgické oddělení 3; Univerzita Karlova v Praze, 1. lékařská fakulta, Urologická klinika VFN 4
Published in: Čas. Lék. čes. 2009; 148: 365-369
Category: Review Article
Overview
Feochromocytom (feo) je adrenální nebo méně často extraadrenální tumor chromafinní tkáně. Jedná se o relativně vzácnější nádor, který však může míti řadu metabolických a kardiovaskulárních komplikací. Neléčený feo může vést až k fatální hypertenzní krizi v průběhu anestezie či jiných forem stresu. Správná diagnostika tohoto onemocnění je proto enormně důležitá. Již 24hodinové monitorování krevního tlaku (TK) může přispět k diagnostice feo díky nálezu zvýšené variability TK a absenci nočního poklesu TK. Feo obsahují velké množství enzymu katechol-O-methyl transferáza (COMT) s následnou excesivní produkcí metabolitů COMT, jako jsou metanefriny. Stanovení plazmatických volných metanefrinů nebo močových frakcionovaných metanefrinů má obvykle vyšší diagnostickou výtěžnost ve srovnání s plazmatickými, popřípadě močovými katecholaminy. V diagnostice adrenálních (extraadrenálních či mnohočetných forem se kromě CT/MR uplatňuje zobrazení pomocí radiofarmaka 123I-metaiodobenzylguanidinu (MIBG) nebo PET značený 18F-fluorodeoxyglukózou. Genetická analýza by se měla provádět u všech potvrzených případů feo, zejména u mladších osob do 50 let věku s ohledem na mutace některých genů zodpovědných za vznik familiárních feo /von Hippel-Lindau (VHL), RET – protoonkogen, mutace genů kodujících B, C a D subjednotky mitochondriální sukcinát dehydrogenázy (SDHB, SDHC, SDHD), mutace typu 1 genu pro neurofibromatózu.
Farmakologická léčba se opírá o podávání blokátorů alfa-receptorů a ve druhé době po 24–48 hodinách je možné přidávat (zejména při sklonu k tachykardii) i blokátory beta-receptorů. Po léčbě dochází rychle k normalizaci TK a je vhodné realizovat následnou laparoskopickou extirpaci tumoru. V případě maligních forem feo nejsou stále k dispozici přesvědčivě účinné léčebné přístupy, neboť v době operace již bývají založeny metastázy špatně reagující na onkologickou léčbu.Klíčová slova:
feochromocytom, krevní tlak, genetická analýza, diagnostika, léčba.Úvod
Feochromocytom (feo) je méně častý nádor chromafinní tkáně, který je lokalizovaný adrenálně (v 80 %), méně často (20 %) extraadrenálně. Většina feo je sporadických, menšina (cca 20 %) je familárních. Feo je považován za vzácnou formu arteriální hypertenze (1, 2). Nálezy z velkých autoptických studií svědčí pro velmi nízký výskyt tohoto tumoru (3). Odhady prevalence feo u hypertenzní populace se pohybují mezi 0,01 % až 0,1 %. Ve specializovaných centrech jsou pochopitelně tato čísla vyšší (4).
Ačkoliv je feo relativně vzácným onemocněním, je jeho správná diagnostika a léčba mimořádně důležitá. Nerozpoznané a neléčené případy feo mohou vést v průběhu anestezie či jiné formy stresu až k fatální hypertenzní krizi (5). Důležitá je i skutečnost, že přibližně 10–11 % všech feo je nacházeno zcela náhodně (incidentalomy) (6).
Feochromocym a krevní tlak
Trvalá (fixovaná) hypertenze bývá častější než paroxyzmální. Nemocní s fixovanou hypertenzí mívají však navíc epizody výrazně zvýšeného krevního tlaku, které mohou být vyvolány různými podněty (fyzická námaha, anestezie, kouření, močení, defekace nebo tlakové podněty na abdominální oblast).
V klinické praxi je vžitá představa, že nemocní s feo mívají často sklon k hypertenzi, rezistentní na farmakologickou léčbu. Epizody zvýšené produkce/uvolňování katecholaminů sice mohou někdy vést ke krátkodobým vzestupům krevního tlaku s TK až přes 250/150 mm Hg, avšak průměrný 24hodinový TK bývá obvkle nižší ve srovnání s jinými formami endokrinní hypertenze typu primárního hyperaldosteronismu nebo Cushingova syndromu anebo ve srovnání s esenciální hypertenzí (7). U většiny feo je rezistence na farmakologickou léčbu vzácná.
Cirkadiánní rytmus TK je u feo vymizelý díky absenci nočního poklesu TK či dokonce v některých případech díky zvýšenému TK v nočních hodinách oproti denní době (7). Tato 24hodinová charakteristika TK pomocí 24hodinového ambulantního monitorování krevního tlaku (AMTK) může být považována za nepřímý diagnostický marker feo, neboť podobné změny 24hodinového profilu TK nejsou pozorovány u dalších forem endokrinní hypertenze (7).
Cirkadiánní změny TK u různých forem endokrinních hypertenzí jsou sumarizovány na obrázku 1.
Image 1. Relativní noční pokles systolického TK u pacientů s endokrinní a esenciální hypertenzí EH – esenciální hypertenze, PA – primární hyperaldosteronismus, PHEO – feochromocytom, CUSH – Cushingův syndrom 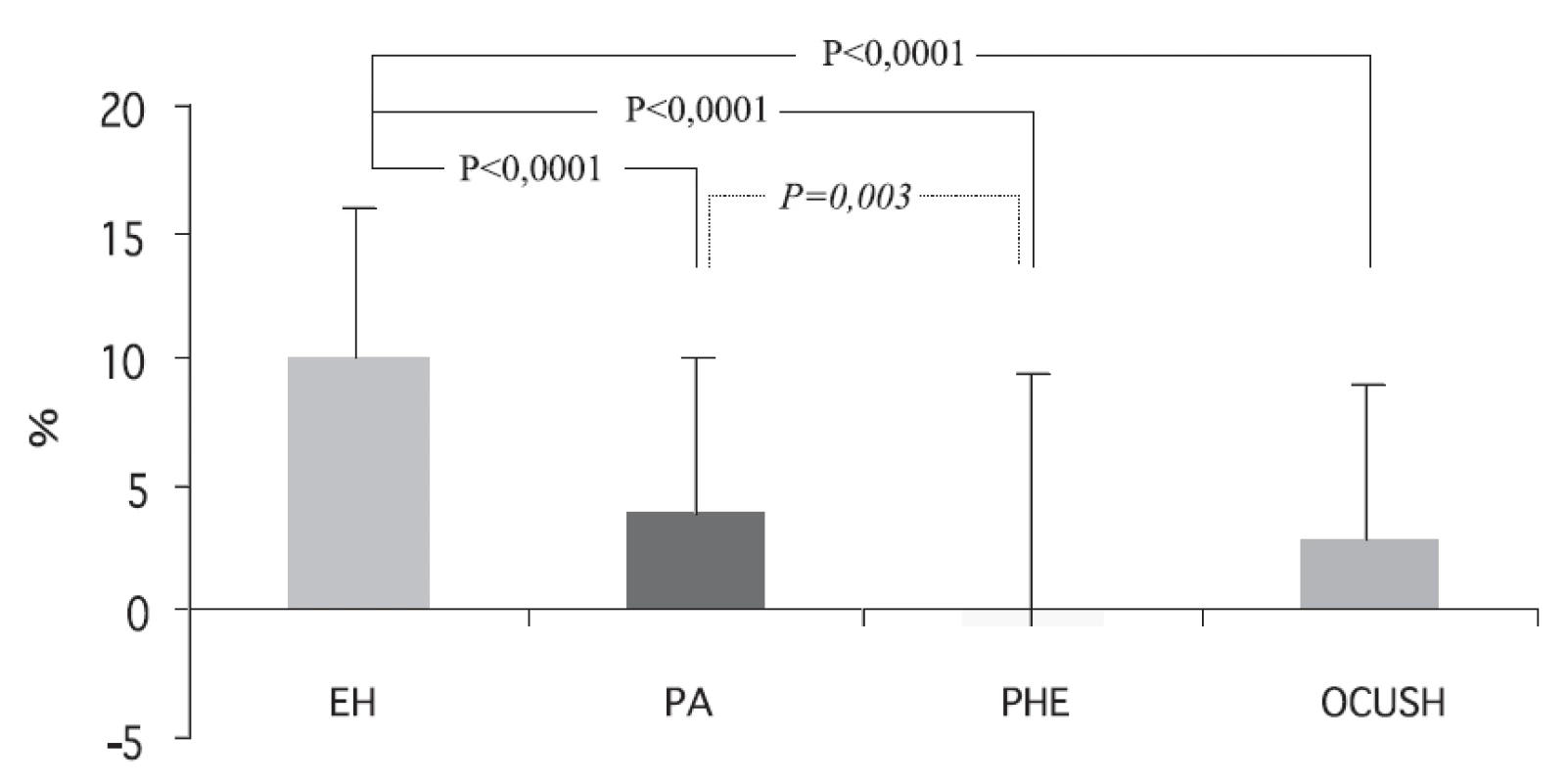
Normotenze se u feo může vyskytovat u asymptomatických nemocných (8), absence zvýšeného TK bývá vysvětlována desensitizací adrenergních receptorů díky dlouhodobě zvýšeným hladinám katecholaminů v cirkulaci. Je zajímavé, že normotenzní případy feo mají rovněž vymizelý pokles TK v nočních hodinách (8).
Katecholaminy jsou u hypertoniků spolu s některými dalšími faktory zodpovědné jak za krátkodobé, tak i dlouhodobé zvýšení krevního tlaku. Stanovení variability TK může být u hypertenzních pacientů užitečné v odhadu kardiovaskulárního rizika, protože se ukazuje, že zvýšená variabilita TK je samostatným rizikovým faktorem kardiovaskulární mortality a morbidity (9). Nadprodukce katecholaminů je u pacientů s feo často spojena s vyšší dlouhodobou variabilitou TK ve srovnání s esenciální hypertenzí. Tato skutečnost je nejmarkantnější u osob s invertovaným cirkadiánním rytmem TK (10). Úspěšné odstranění nádoru vede k normalizaci zvýšené variability TK (11).
Vyšetření pomocí AMTK může tak být u feo diagnosticky přínosné s ohledem na popsané změny 24hodinového rytmu TK a a zvýšenou variabilitu TK.
Diferenciální diagnostika
Feo se vyskytuje u cca 11 % všech náhodně zachycených zvětšení (obr. 2), a je proto třeba ve všech takových případech realizovat podrobnější vyšetření katecholaminů/metabolitů (podrobně viz níže). Diferenciální diagnostické odlišení feo může být užitečné i u celé řady následujících patologických stavů (podrobně viz citace 1, 2): hypertyreóza, mastocytóza, karcinoid, medullární karcinom tyreoidey (familiární feo v rámci MEN), menopauzálního syndromu, ICHS s anginou pectoris, arytmií, nevysvětlitelných bolestí hlavy, úzkostných stavů. Epizodická hypertenze a/nebo klinický obraz imitující feo se může vyskytovat i v souvislosti s užíváním některých farmakologických látek, jako jsou tricyklická antidepresiva, kokain, vysazení centrálně působících antihypertenziv stimulujících alfa2 receptory (I. generace jako alfa-methyl dopa, guanfacin, clonidin), vysazení některých beta-blokátorů, podávání antagonistů dopaminergních receptorů či sympatomimetik. Podrobnější analýza diferenciální diagnostiky feo přesahuje rámec tohoto sdělení.
Image 2. Výskyt feo u pacientů s náhodně zachyceným zvětšením nadledvin (Mansmann G, et al. Endocrine Reviews 2004; 309–340) 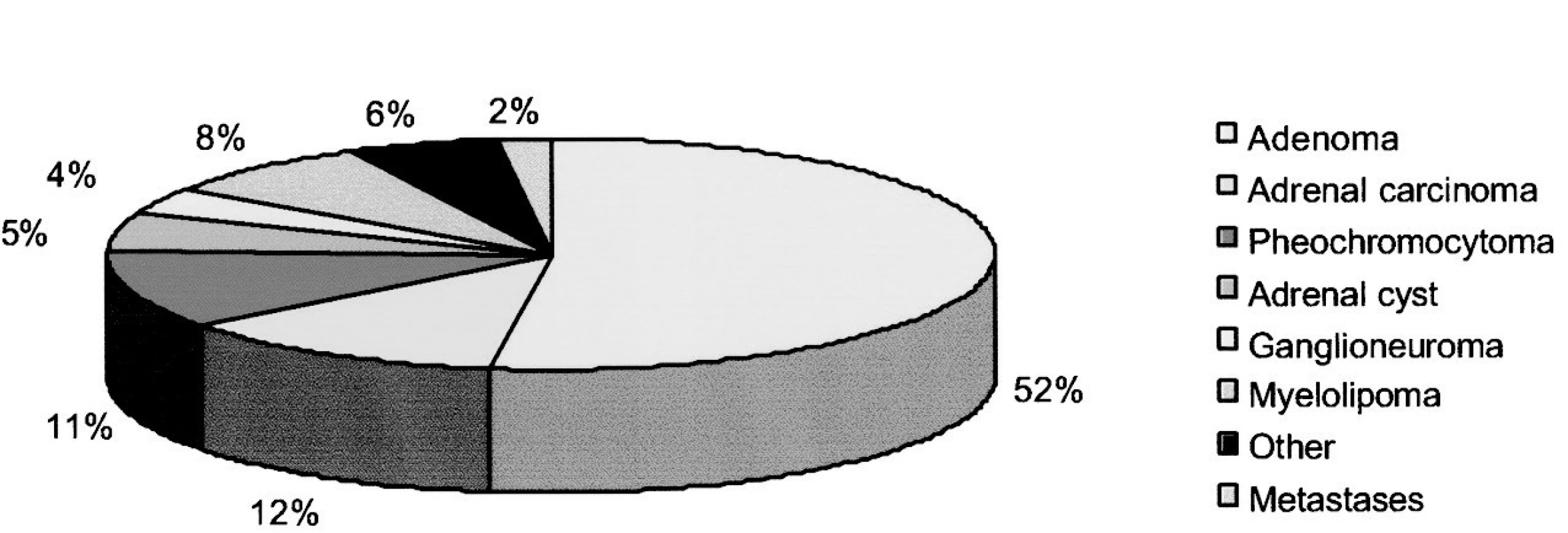
Biochemická diagnostika
V posledních 10 letech došlo k významnému technickému pokroku. Eisenhofer se spolupracovníky (11) popsali vyšší diagnostickou senzitivitu a specificitu stanovení plazmatických metanefrinů, která může být vysvětlena rozdílnou afinitou katecholaminů COMT membrány adrenálních chromaffiních buněk. Tato afinita je v nadledvinách mnohem vyšší oproti COMT v jiných tkáních. Všechny tumory metabolizují katecholaminy na volné metanefriny, avšak ne všechny tumory vedou k hypersekreci katecholaminů (5, 11). Zatímco hladiny katecholaminů v plazmě jsou zvýšeny po minimálních podnětech, jako je úzkost a stres, koncentrace volných metanefrinů jsou těmito vlivy méně ovlivněny.
Multicentrická kohortová studie provedená ve čtyřech centrech u 214 pacientů s potvrzeným feo vedla k závěru, že stanovení volných metanefrinů v plazmě je nejvhodnějším testem v diagnostice feo (12). Zdá se, že toto stanovení anebo měření močových frakcionovaných metanefrinů (oddělené stanovení normetanefrinu a metanefrinu v moči) je testem s nejvyšší diagnostickou citlivostí (12). Tabulka 1 uvádí srovnání senzitivity a specificity různých biochemických testů používaných v diagnostice feo dle Lenderse (12).
Table 1. Senzitivita a specificita biochemických testů používaných pro diagnostiku feo (11) 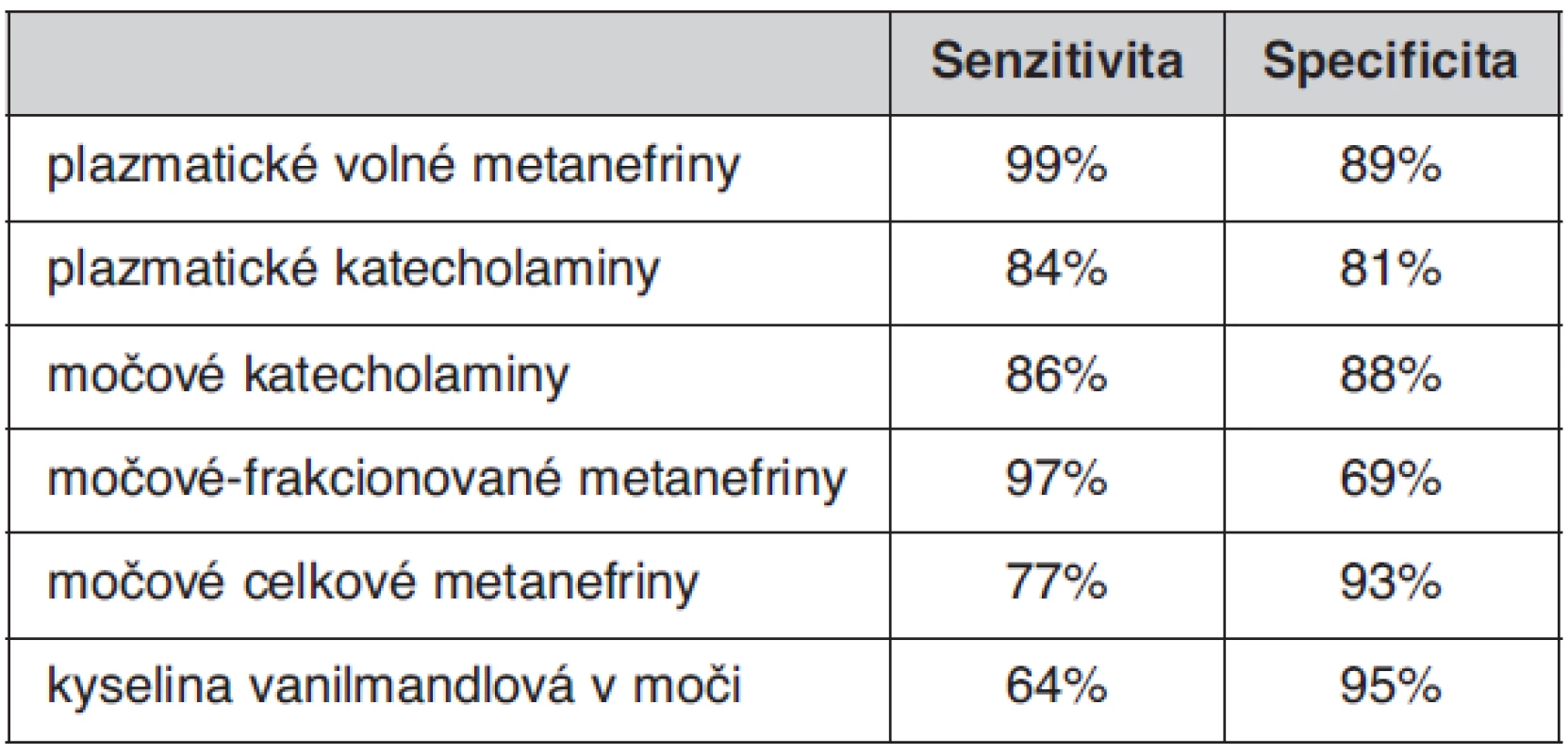
Specificita familiárních feo je vyšší ve srovnání se sporadickými případy. Navzdory velmi vysoké senzitivitě plazmatických/močových metanefrinů je určitým problémem jejich relativně nižší specificita, a proto pozitivní výsledky neznamenají vždy potvrzení diagnózy feo (6, 12). Některé látky navíc mohou interferovat s biochemickými testy feo, a vést tak k falešné pozitivitě výsledků. Nejčastěji se jedná o interferující medikaci typu fenoxybenzaminu, paracetamolu nebo tricyklická antidepresiva (12, 13). Falešně pozitivní výsledky mohou rovněž být vyvolány dietními vlivy a nedodržením odpovídajících podmínek odběrů krve krve/moče, což může být problémem zejména v ambulantních podmínkách.
Někteří další autoři (14) doporučují pro diagnostiku feo provádět více testů s ohledem na komplexní metabolismus katecholaminů. Kombinace stanovení plazmatického norepinefrinu (NE) + epinefrinu (E) se součtem koncentrací obou těchto látek nad 2000 pg/ml a současně měření močových metanefrinů (metanefrin (MNM) + normetanefrin (NM)) s výslednou hladinou nad 1,8 mg/24 hod. mělo diagnostickou přesnost 98% u sporadických i familiárních feo (14). Pochopitelně, provádění kombinace více diagnostických testů je pracnější a ekonomicky nákladnější.
Pracovníci Mayo kliniky doporučují volit diagnostický postup v závislosti na pravděpodobnosti přítomnosti feo (14). Za účelem minimalizace počtu falešně-pozitivních případů doporučují provádět stanovení metanefrinů a katecholaminů ve 24hodinovém sběru moče. V případě důvodného podezření na feo (charakteristické příznaky, rodinná anamnéza feo, familiární syndromy, zvětšení nadledviny) doporučují použít testy s vyšší senzitivitou typu frakcionovaných volných plazmatických metanefrinů (15).
Stanovení kyseliny vanilmandlové (VMA) je v klinické praxi stále velmi rozšířeno. Měření VMA je však zatíženo nižší senzitivitou, protože asi 80 % VMA vzniká z metabolitů NE ze sympatických nervových vláken. Proto zvýšení exkrece VMA močí nemusí znamenat přítomnost feo (2, 6, 12).
Farmakologické testy
Klonidinový test je nejpoužívanějším farmakologickým přístupem odlišujícím zvýšené uvolňování katecholaminů díky zvýšené aktivitě sympatiku od nadprodukce a hypersekrece katecholaminů tkání feo (16). V případě pozitivity tohoto testu je jeho prediktivní hodnota pro diagnostiku feo 97%. Negativní prediktivní hodnota je však relativně nízká (75%). Nověji se proto doporučuje provádět klonidinový supresní test a namísto plazmatického NE měřit koncentrace plazmatického normetanefrinu (17). Tato modifikace vedla ke zlepšení pozitivní a negativní prediktivní hodnoty klonidinového testu na 100 % a 96 % (17). Tento test se tak zdá být nejpřesnější metodou laboratorní diagnostiky feo a měl by býti používán ve sporných a nejasných případech.
Stimulační testy s použitím histaminu nebo glukagonu jsou náročné a potenciálně rizikové. Díky dostupnosti dalších laboratorních testů je jejich diagnostický přínos problematický a v praxi se od jejich realizace ustupuje (2).
Genetické testování
Dříve se odhadovalo, že familární formy feo se vyskytují relativně zřídka, maximálně do 10 % všech případů. Nedávná studie provedená převážně ve střední Evropě na velkém vzorku zdánlivě sporadických forem feo nalezla však relativně vysokou prevalenci (24 %) mutací jednoho ze čtyř genů známých pro výskyt familiárních forem feo (18). Celkově jsou do dnešního dne popsány mutace pěti genů, které mají přímý vztah ke vzniku familiárních feo: VHL vedoucí ke vzniku von Hippel-Lindau syndromu, RET protoonkogen vedoucí ke vzniku mnohočetné endokrinní neoplazie/adenomatózy typu 2 (MEN 2), gen pro neurofibromatózu typu 1 (NF1), asociovaný s von Recklinghausenovou chorobou a mutace genů kodujících B a D a vzácněji C subjednotky mitochondriální sukcinát dehydrogenázy (SDHB, SDHD, SDHC), zodpovědných za vznik familiárních paragangliomů a feo (2). Feo nemusí být u těchto familiárních syndromů vždy přítomné a nebývají obvykle ani první klinickou manifestací těchto onemocnění (2, 19).
Zdá se tak užitečné, aby se genetické analýzy prováděly u všech nemocných s potvrzeným feo, zejména u mladších osob pod 50 let věku (2, 18, 19). Všechny pozitivní případy by pak měly býti celoživotně sledovány.
Zobrazovací metody v diagnostice
Abdominální počítačová tomografie (CT) se stále často používá k lokalizaci tumoru. Zdá se, že aplikace iohexolu za účelem zlepšení kontrastu nevede k ovlivnění koncentrací plazmatických katecholaminů (20). Na obrázku 1 je znázorněna CT diagnostika paragangliomu oblasti pravého glomus caroticum. Magnetická rezonance (T2-weighted MRI) s podáním gadolinia má srovnatelnou diagnostickou přesnost s CT vyšetřením (2, 6), avšak MRI je preferována v diagnostice extra-adrenálních feo, u těhotných osob, dětí, alergií na kontrastní látku anebo v případě renální insuficience. V případě realizace vyšetření CT či MRI není nutná současná blokáda adrenergních receptorů.
U nemocných s podezřením na extraadrenální lokalizaci feo, u větších tumorů nad 5 cm anebo v případě podezření na vícečetné či metastatické feo je indikováno vyšetření pomocí i.v. aplikace radiofarmaka 123I-metaiodobenzylguanidin (MIBG) spíše než 131I-MIBG, které má horší technickou kvalitu (2, 21). Některé látky (labetalol, tricyklická antidepresiva, kalciové blokátory) mohou interferovat s vychytáváním nebo retencí 123I MIBG. V případě negativity 123I-MIBG vyšetření se doporučuje provést PET značený 18F-fluorodeoxyglukozou, eventuálně oktreotidový scan značený 111In. Oba dva tyto posledně uváděné testy mají však nižší specificitu pro feo a nejsou proto doporučovány pro základní vyšetření (2, 21, 22). PET vyšetření pomocí 18F-fluorodopaminu má oproti MIBG scintigrafii (zejména v případě metastatických feo) vyšší diagnostickou výtěžnost (2, 22). 18F-fluorodopamin (a podobné látky, jako je 18F-fluorodopa či 11C-hydroxyefedrin) není však široce dostupný pro klinické využití.
Léčebné přístupy
Benigní formy
Základem terapie je farmakologická blokáda alfa a eventuálně později i beta receptorů jako předoperační příprava s následnou resekcí tumoru. Farmakologická léčba před operací je nezbytná pro snížení rizika a komplikací operačního odstranění tumoru, protože emergentní resekce feo bez blokády alfa-receptorů má vysokou letalitu (2, 6, 21). Používají se selektivní blokátory alfa-1 receptorů s delším poločasem a delším antihypertenzním účinkem (doxazosin nebo terazosin). Fenoxybenzamin je neselektivní, nekompetitivní blokátor alfa-receptorů, který však t.č. není v České dostupný. Nejsou k dispozici žádné randomizované klinické studie, srovnávající fenoxybenzamin s doxazosinem nebo terazosinem.
Labetalol je kombinovaný beta a alfa-blokátor, avšak u feo je méně vhodný k předoperační farmakologické přípravě díky převažující blokádě beta-receptorů. V České republice není navíc t.č. dostupný.
Beta-blokátory se podávají ke kontrole tachykardie a arytmií nejméně 24 hod. po podání alfa-blokátorů. Podání beta-blokátorů v monoterapii může vést u feo k presorické reakci až plicnímu edému díky neoponované alfa-receptory zprostředkované vazokonstrikci (2, 5, 6).
Blokátory kalciových kanálů (BKK) se mohou rovněž použít k inhibici katecholaminy-zprostředkovaného uvolnění intracelulárního kalcia buď samotné (zejména u normotenzních forem feo) anebo v kombinaci s alfa-blokátory (5, 6, 21). Podání samotných BKK sice nevede k ortostatické hypotenzi, avšak je méně výhodné, protože nezabraňuje vzestupům TK u feo (5, 21).
Předoperační léčba pomocí alfa - (a potenciálně i beta-) blokátorů by měla být zahájena nejméně týden, lépe 10–14 dní před plánovaným chirurgickým řešením.
Zdá se, že typ použitého anestetika má pro kontrolu TK v průběhu operace až druhořadý význam (23). Pro kontrolu hypertenzních špiček v průběhu operačního výkonu se používá izosorbid-dinitrát, sodium nitroprussid anebo krátkodobě působící BKK. Pro kontrolu tachyarytmií je výhodný krátkodobě působící beta-blokátor esmolol.
Riziko pooperační hypotenze může být sníženo zvýšeným přísunem soli a tekutin. V pooperačním průběhu se může vyskytovat i hypoglykémie způsobená náhlou hyperinzulinémií.
Pro operační odstranění feo se dnes preferenčně používají laparoskopické metody (23–25). Laparoskopický přístup vede ve srovnání s konvenční operací k nižší pooperační morbiditě, k časnější rehabilitaci se zkrácením doby hospitalizace a ušetřením ekonomických nákladů (23–25). V případě bilaterálních feo se doporučuje provádět „nadledvinovou kůru šetřící“ (adrenal-cortex-sparing) laparoskopickou operaci k prevenci nutnosti celoživotního podávání glukokortikoidů.
Prognóza nemocných po operaci je velmi dobrá, avšak u části nemocných může přetrvávat hypertenze, obvykle však již méně závažná ve srovnání s předoperačním obdobím (26). Po operaci feo se doporučuje provádět dlouhodobé sledování v pravidelných intervalech, neboť recidivy feo se nacházejí u cca 17 % případů. Tyto recidivy jsou častější u extra-adrenálních nebo familiárních forem.
Maligní formy
Feo je považován za maligní v případě přítomnosti metastáz chromafiní tkáně v jiných (neobvyklých) lokalizacích. Vyšší riziko malignity je u velkých nádorů, extraadrenálních či familiárních forem. Klinický průběh maligních forem bývá variabilní s pětiletým přežíváním u 50 % osob.
Bohužel zatím neexistuje jednoznačně úspěšný způsob léčby maligních feo. Nejvíce se osvědčuje chirurgické odstranění nádorové tkáně včetně metastáz. Konzervativní léčba pomocí alfa-blokátorů vede ke kontrole krevního tlaku a symptomů. Bylo popsáno zmenšení tumorózní tkáně po podání metyrozinu, inhibitoru syntézy katecholaminů. Léčba pomocí 131I-MIBG anebo chemoterapie pomocí cyklofosfamidu, vinkristinu a dakarbazinu zhoršuje kvalitu života a vede ke kompletní remisi jen u menšiny nemocných (2, 6). Podle některých pramenů mohou vysoké dávky 131I-MIBG prodloužit přežívání (27), bohužel nám však chybí kontrolní studie díky nízkému výskytu maligních forem feo. Kostní metastázy mohou podle některých názorů příznivě reagovat na iradiaci nebo radiofrekvenční ablaci (2, 5, 11).
Zkratky
AMTK – ambulantní monitorování krevního tlaku
BKK – blokátory kalciových kanálů
COMT – katechol-O-methyl transferáza
CT – počítačová tomografie
E – epinefrin
feo – feochromocytom
MEN – mnohočetná endokrinní neoplazie
MIBG – 123I-metaiodobenzylguanidin
MNM – metanefrin
MRI – magnetická rezonance
NE – norepinefrin
NF – neurofibromatóza
NM – normetanefrin
PET – 18F-fluorodeoxyglukóza
TK – krevní tlak
t.č. – toho času
VMA – kyselina vanilmandlová
VHL – von Hippel-Lindau gen
Práce byla podpořena vědeckým záměrem MSM číslo 0021620808, 21620807 a 21620817.
Adresa pro korespondenci:
prof. MUDr. Jiří Widimský, CSc.
Centrum pro hypertenzi – III. interní klinika 1. LF UK a VFN
U Nemocnice 1, 128 08 Praha 2
e-mail: jiri.widimsky@lf1.cuni.cz
Sources
1. Petrášek J. Feochromocytom. Edice Thomayerova sbírka č. 471. Praha: Avicenum 1976.
2. Pacák K. Current approaches and new advances in pheochromocytoma. DMEV 2008; 2 : 86–93.
3. McNeil AR, Blok BH, Koelmeyer TD, et al. Phaeochromocytoma discovered during coronial autopsies in Sydney, Melbourne and Auckland. Aust NZ J Med 2000; 30 : 648–652.
4. Strauch B, Zelinka T, Hampf M, Bernhardt R, Widimsky J jr. Prevalence of primary hyperaldosteronism in moderate to severe hypertension in the Central Europe region. J Hum Hypertension 2003; 17 : 349–352.
5. Manger WM, Eisenhofer G. Pheochromocytoma. diagnosis and management update. Curr Hypertens Rep 2004; 6 : 477–484.
6. Kaplan NM. Clinical hypertension. Philadelphia, USA: Lippincott Williams & Wilkins 2006; 1–518.
7. Zelinka T, Štrauch B, Pecen L, Widimský J jr. Diurnal blood pressure variation in pheochromocytoma, primary aldosteronism and Cushing’s syndrome. J Human Hypertension 2004; 18 : 107–111.
8. Zelinka T, Widimský J jr, Weisserová J. Diminished circadian blood pressure rhytm in patients with asymptomatic normotensive pheochromocytoma. Physiol Res 2001; 50, 631–634.
9. Kikuya M, Hozawa T, Ohkubo T, Tsuji I, Michimata M, Matsubara M, et al. Prognostic significance of blood pressure and heart rate variabilities. The Ohasama study. Hypertension 2000; 36 : 901–906.
10. Zelinka T, Štrauch B., Petrák O, Holaj R, Vranková A, Weisserová H, Pacák K, Widimský J jr. Increased blood pressure variability in pheochromocytoma compared to essential hypertension patiens. Journal of Hypertension 2005; 23 : 2033–2039.
11. Eisenhofer G, Keiser H, Friberg P, et al. Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-methyltransferase within tumors. J Clin Endocrinol Metab 1998; 83 : 2175–2185.
12. Lenders JW, Pacak K, Walther MM, et al. Biochemical diagnosis of pheochromocytoma. which test is best? JAMA 2002; 287 : 1427–1434.
13. Goldstein DS, Eisenhofer G, Flynn JA, et al. Diagnosis and localisation of pheochromocytoma. Hypertension 2004; 43 : 907–910.
14. Bravo EL, Tagle R. Pheochromocytoma. state of the art and future prospects. Endocr Rev 2003; 24, 539–553.
15. Kudva YC, Sawka AM, Young WF jr, et al. The laboratory diagnosis of adrenal pheochromocytoma. the Mayo Clinic experience. J Clin Endocrinol Metab 2003; 88 : 4533–4539.
16. Bravo EL, Tarazi RC, Fouad FM, Vidt DG, Gifford RW jr. Clonidine-suppression test, a useful aid in the diagnosis of pheochromocytoma. N Engl J Med 1981; 305 : 623–626.
17. Eisenhofer G, Goldstein DS, Walther MM, et al. Biochemical diagnosis of pheochromocytoma. how to distinquish true-from false positive results. J Clin Endocrinol Metab 2003; 88 : 2656–2666.
18. Neumann HP, Bausch B, Mc-Whinney SR, et al. for the Freiburg-Warshaw-Columbus Pheochromocytoma Study Group. Germ-line mutations in nonsyndromic pheochromocytoma. N Engl J Med 2002; 346 : 1459–1466.
19. Amar L, Bertherat J, Baudin E, Ajzenberg C, Bressacde Paillerets B, Chabre O, Chamonitn B, Delemer B, Giraud S, Murat A, Niccoli-Sire P, Richard S, Rohmer V, Sadoul JL, Strompf L, Schlumberger M, Bertagna X, Plouin PF, Jeunemaitre X, Gimenez-Roqueplo AP. Genetic testing in pheochromocytoma or functional paraganglioma. J Clin Oncol 2005; 23 : 8812–8818.
20. Mukherjee JJ, Peppercorn PD, Reznek RH, et al. Pheochromocytoma. effect of nonionic contrast medium in CT on circulating catecholamine levels. Radiology 1997; 202 : 227–231.
21. Lenders JWM, Eisenhofer G, Mannelli M, Pacak K. Pheochromocytoma. Lancet 2005; 366 : 665–675.
22. Pacak K, Eisenhofer G, Carrasquillo JA, Chen CC, Li ST, Goldstein DS. 6-(18F)fluorodopamine positron emission tomographic (PET) scanning for diagnostic localisation of pheochromocytoma. Hypertension 2001; 38 : 6–8.
23. Prys-Roberts C. Pheochromocytoma – recent progress in its management. Br J Anaesth 2000; 85 : 44–57.
24. Janetschek G, Finkenstdt G, Gasser R, et al. Laparoscopic surgery for pheochromocytoma. adrenalectomy, partial resection, excision of paragangliomas. J Urol 1998; 160 : 330–334.
25. Sprung J, O’Hara JF jr, Gill IS, Abdelmalak B, Sarnaik A, Bravo EL. Anesthetic aspects of laparoscopic and open adrenalectomy for pheochromocytoma, Urology 2000; 55 : 339–343.
26. Plouin PF, Chatellier G, Fofol I, Corvol P. Tumour recurrence and hypertension persistance after successful pheochromocytoma operation. Hypertension 1997; 29 : 1133–1139.
27. Rose B, Matthay KK, Price D, et al. High-dose 131I-MIBG therapy for 12 patients with malignant pheochromocytoma. Cancer 2003; 98 : 239–248.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Dlouhodobý elektrokardiogram
- Elektrokardiografie včera a dnes
- Ateroskleróza v dětském věku
- Feochromocytom: diagnostika a léčba
- Hypertenzní krize – současný pohled
- Význam echokardiografie v diagnostice kardiovaskulárních onemocnění u těhotných žen
- Vliv znečištění ovzduší na kardiovaskulární mortalitu
- Budeme léčit srdeční selhání podle plazmatické koncentrace natriuretických peptidů?
- Diagnostika a léčba organického hyperinzulinismu – zkušenosti u 105 pacientů
- Od vědeckého důkazu k moderní vysoce efektivní léčbě alergicky nemocných v současné době
- Endarterektomie nebo stentování karotid: hledání pokračuje
- Diety bohaté na borůvky chrání králičí srdce před ischemickým poškozením
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Feochromocytom: diagnostika a léčba
- Diagnostika a léčba organického hyperinzulinismu – zkušenosti u 105 pacientů
- Hypertenzní krize – současný pohled
- Elektrokardiografie včera a dnes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

