-
Medical journals
- Career
Trombohemoragický syndrom u nemocných s myeloproliferativním onemocněním s trombocytemií
Authors: M. Penka 1; J. Kissová 1; A. Buliková 1; J. Zavřelová 1; J. Ovesná 1; T. Pavlík 2
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc. 1; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, vedoucí pracoviště doc. RNDr. Ladislav Dušek, Ph. D. 2
Published in: Vnitř Lék 2011; 57(3): 306-311
Category: 60th birthday of prof. Mudr. Jiřího Vítovce, CSc, FESC
Overview
Trombohemoragický syndrom je klinický syndrom projevující se současným výskytem krvácení a trombózy. Vyskytuje se v souvislosti s řadou chorobných stavů a je příznačný pro myeloproliferativní choroby, paraproteinemie a jaterní choroby. Dále se objevuje v souvislosti s diseminovanou intravaskulární koagulací a jí podobnými syndromy (tzv. DIC-like syndrom). Trombohemoragický syndrom může být projevem chronických myeloproliferací, zejména jsou-li provázeny trombocytemií. Nejčastěji tedy provází esenciální trombocytemii. U tohoto onemocnění se však ukazuje, že se nemusí jednat o bezprostřední závislost klinické symptomatologie krvácení a trombózy na počtu krevních destiček, jak by se nabízelo, ale že může být důsledkem i jiných změn. Z nich se vedle současné přítomnosti rizikových trombofilních dispozic, kardiovaskulárního rizika, leukocytózy a dalších nabízejí poruchy funkce krevních destiček. Právě poruchám funkce krevních destiček v souvislosti s klinickou symptomatologií krvácení a trombózy je věnována přiložená studie.
Klíčová slova:
trombohemoragický syndrom – trombóza – krvácení – myeloproliferace – trombocytemieÚvod
Trombohemoragický syndrom je klinický syndrom projevující se současným výskytem krvácení a trombózy. Většinou se jedná o souběžný výskyt zmíněné symptomatologie v kratším časovém úseku u jednoho a téhož pacienta, mnohdy v důsledku jedné choroby.
Trombohemoragický syndrom se vyskytuje v souvislosti s řadou chorobných stavů a provází poruchy krevního srážení primární či sekundární geneze. Z těch sekundárních se s ním setkáváme především u myeloproliferativních chorob [5], paraproteinemií a jaterních onemocnění, vyskytuje se též typicky v souvislosti s diseminovanou intravaskulární koagulací a jí podobnými syndromy (tzv. DIC-like syndromy: antifosfolipidový syndrom – APS, mikroangiopatické hemolytické syndromy – MAS, heparinem indukovaná trombocytopenie – HIT apod.).
Jak již bylo řečeno, typický je mimo jiné trombohemoragický syndrom pro chronická myeloproliferativní onemocnění provázená trombocytemií – tedy pro esenciální trombocytemii (ET), pravou polycytemii (polycytemia vera – PV), primární myelofibrózu (PMF), popřípadě i chronickou myelogenní leukemii (CML). U těchto chorob dochází ke vzniku trombózy a krvácení [14], přičemž údaje o jejich výskytu se liší (tab. 1 a 2) [7].
Table 1. Výskyt trombózy a krvácení u ET [1]. ![Výskyt trombózy a krvácení u ET [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0140d830563efe8d1ffadb39c3f34e5f.png)
Table 2. Výskyt 107 trombotických a krvácivých projevů v souboru 672 pacientů českého registru [13]. ![Výskyt 107 trombotických a krvácivých projevů v souboru 672 pacientů českého registru [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/973dc249adc9d75024df0f64d2f2dabb.png)
Klinické projevy nejsou, jak se ukazuje, pouze výrazem kolísání počtu trombocytů, i když s ním souvisejí a jistou závislost na něm, jak trefně znázornil Michiels na modelu „doutníku a klínu“ (obr. 1) [10], vykazují. Klinické projevy jsou však důsledkem i jiných okolností a faktorů či jejich kombinací. Ke krvácení dochází také v důsledku funkční nedostatečnosti krevních destiček, sekundárního von Willebrandova syndromu, současného výskytu koagulačních defektů apod. Ke klinické symptomatologii trombózy dochází u myeloproliferací s trombocytemií především u nemocných s mutací JAK2V617F, dále za současného výskytu kardiovaskulárních rizikových okolností či trombofilních dispozic [17], eventuálně leukocytózy [3]. Podle toho lze stratifikovat nemocné do rizikových pásem – na nízké, střední a vysoké riziko vzniku klinických příznaků (tab. 3)[15] – a dle zařazení nemocné léčit [19]. Sama Česká pracovní skupina pro myeloproliferativní choroby (CZEMP) rozlišuje jen pacienty bez rizika a pacienty s rizikem (tab. 4) [12]. V současné době jsou studovány příčiny vzniku klinické symptomatologie v detailních analýzách [4], proto je pochopitelné, že pozornost poutá, jak bylo již výše naznačeno, i studium funkce krevních destiček [6].
Image 1. Model „doutníku a klínu“ dle [10,12]. ![Model „doutníku a klínu“ dle [10,12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/883197c273cd6854465440263a3e6fb5.png)
Table 3. Prognostické faktory ET (navrženo Tefferim A 1999) [15]. ![Prognostické faktory ET (navrženo Tefferim A 1999) [15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e0ddd2d06ee2566d0874e5c563ce5c82.png)
T – výskyt trombózy, K – výskyt krvácení Table 4. Rizika klinické symptomatologie u nemocných s myeloproliferací. 
Cíl studie
V naší studii jsme se zaměřili na vyhodnocení destičkových funkcí dle výsledků vyšetření PFA-100 a agregace destiček indukované ADP a kolagenem v korelaci s počtem krevních destiček a s výskytem hemoragických a trombotických příhod a na srovnání zmíněných parametrů před zahájením a v průběhu léčby pacientů.
Soubor nemocných a metoda
Soubor nemocných
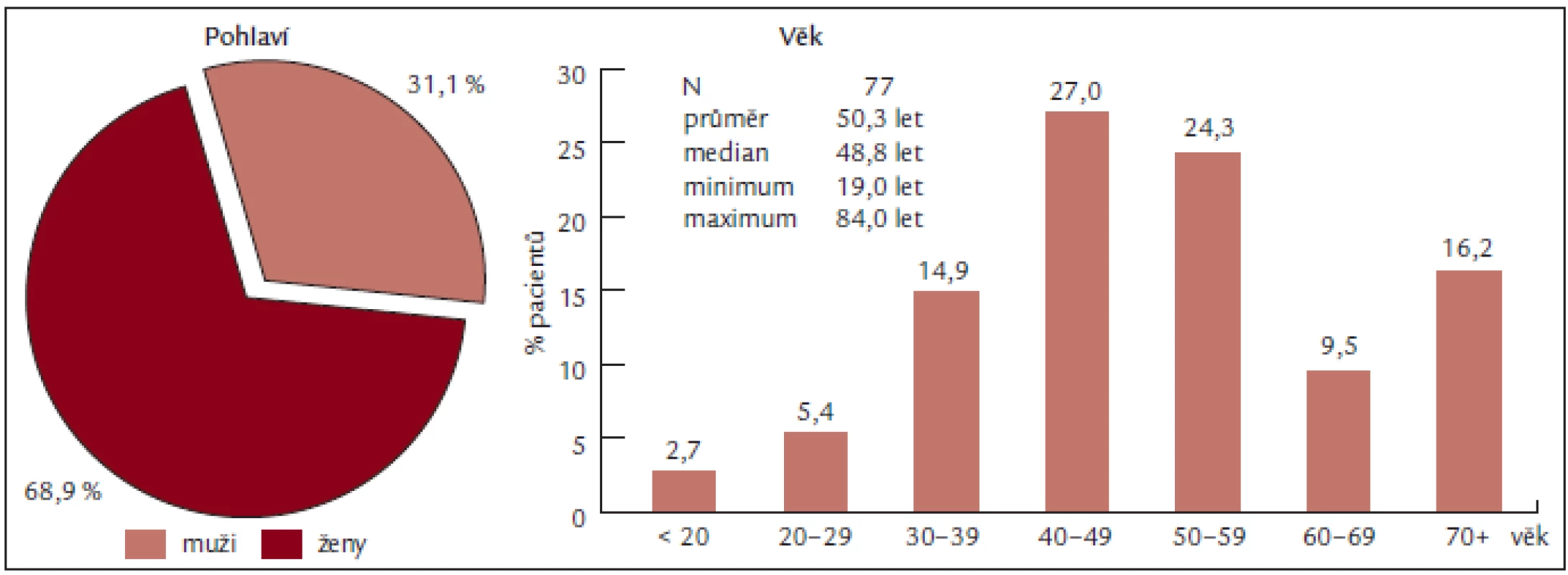
Soubor představuje 77 pacientů, z toho 53 žen a 24 mužů, s věkovým průměrem 50,3 let a mediánem věku 50 let (obr. 2), vyšetřených na Oddělení klinické hematologie FN Brno v letech 2004 až 2008. U všech nemocných byla stanovena diagnóza Ph-myeloproliferativního onemocnění (dle PVSG či WHO 2001) a u všech byla přítomna periferní trombocytemie. K léčbě byl aplikován anagrelide (Thromboreductin) a/nebo hydroxyurea (Litalir).
Panel vyšetření obsahoval:
- stanovení počtu krevních destiček (na plně automatizovaném analyzátoru krevních elementů – normální hodnota 150–350 × 109/l),
- analýzu funkce destiček (platelet function analysis 100 – PFA-100) s indukcí kolagenem/epinephrinem (normální hodnota 85–165 s),
- agregometrii dle Borna po indukci ADP 5 % a kolagenem (normální hodnoty > 60% po obou induktorech).
Vyšetření se provádělo před nasazením léčby a za 3–6 měsíců od jejího zahájení.
Statistické hodnocení
Popis souboru pacientů a sledovaných charakteristik byl proveden pomocí frekvenčních tabulek a standardních popisných statistik: průměru, mediánu, minima, maxima a kvantilů. Pro vizualizaci byly použity krabicové grafy, v případě kategoriálních dat pak kontingenční tabulky. Hodnocení vztahu dvou kategoriálních proměnných binárního charakteru bylo provedeno pomocí Fisherova exaktního testu. Pro stanovení statistické významnosti byla použita standardní hladina α = 0,05. Data byla zpracována v programu Statistica 9 [18].
Výsledky
Před léčbou činila průměrná hodnota krevních destiček 814,2 ± 331,8 × 109/l, průměrná hodnota ADP indukované agregace 41,9 ± 27,2%, kolagenem indukované agregace 55,5 ± 30,8 % a průměrná hodnota PFA-100 byla 167,1 ± 62,2 s (obr. 3 a tab. 5).
Image 3. PFA-100, ADP a kolagenem indukovaná agregace v závislosti na počtu krevních destiček. 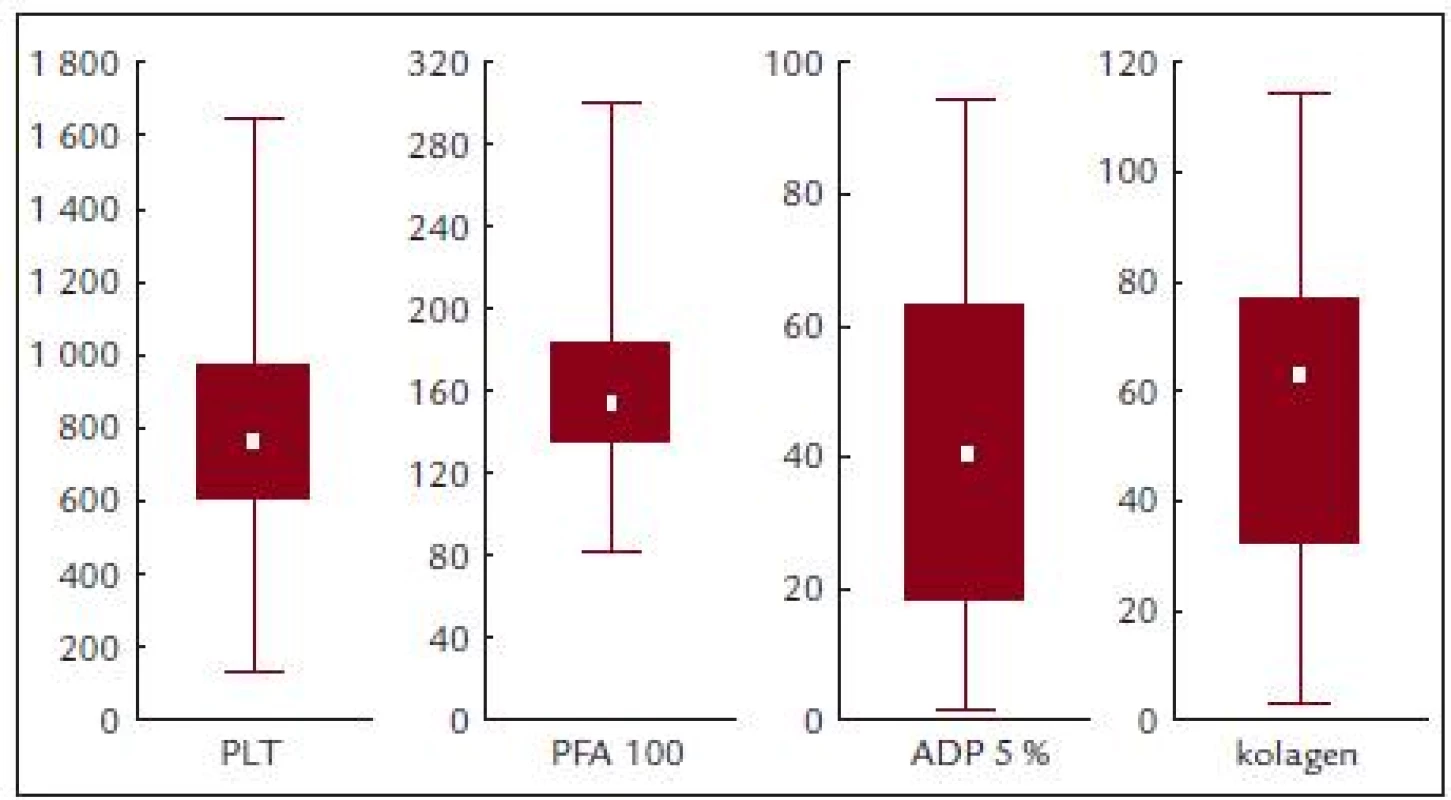
Image 4. ADP indukovaná agregace a výskyt krvácení. 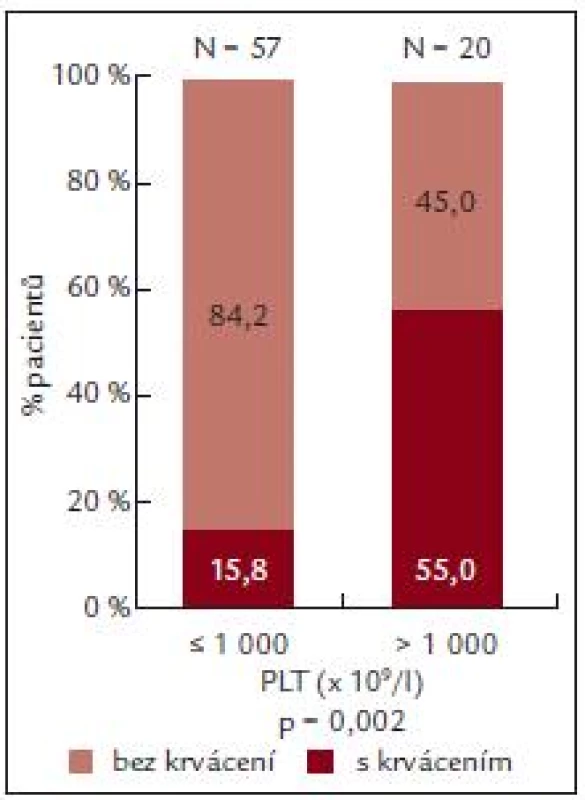
Table 5. ADP a kolagenem indukovaná agregace destiček a PFA-100 v závislosti na počtu krevních destiček. 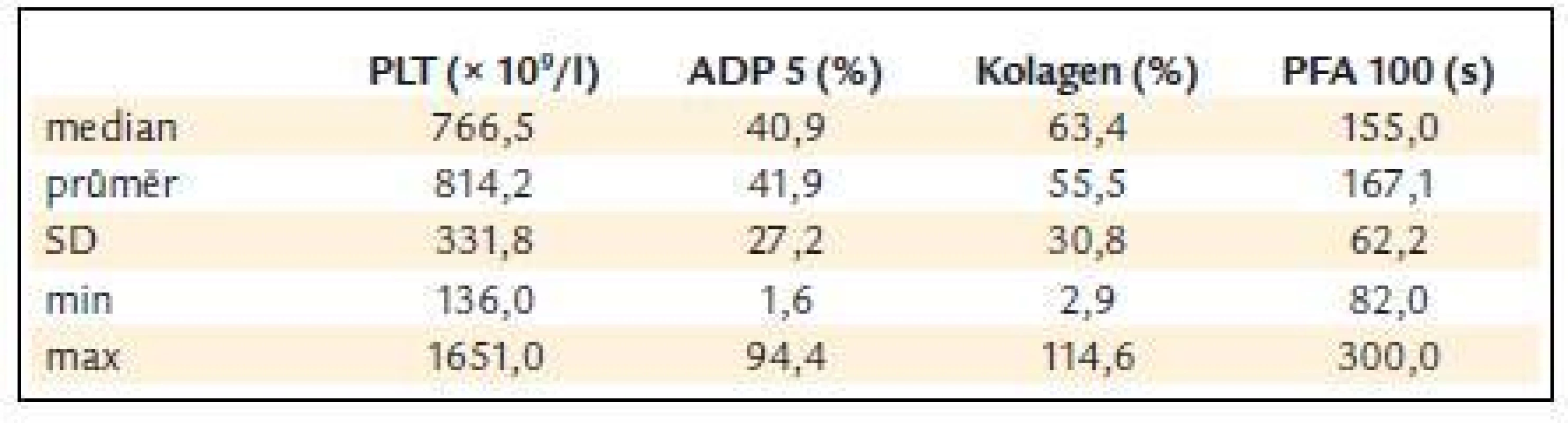
U pacientů s počtem destiček nižším než 1 000 × 109/l byla ADP agregace 39,9 ± 25,9 %, kolagenem indukovaná agregace 55,2 ± 28,7 a PFA-100 172,1 ±± 63,1 s.
U pacientů s počtem destiček vyšším než 1 000 × 109/l byla ADP agregace 49,0 ± 31,3% a kolagenem indukovaná agregace 56,6 ± 37,9 a PFA-100 148,1 ±± 57,4 s (tab. 6).
Table 6. ADP a kolagenem indukovaná agregace destiček a PFA-100 u nemocných s trombocytémií nižší a vyšší než 1 000 x 10<sup>9</sup>/l. 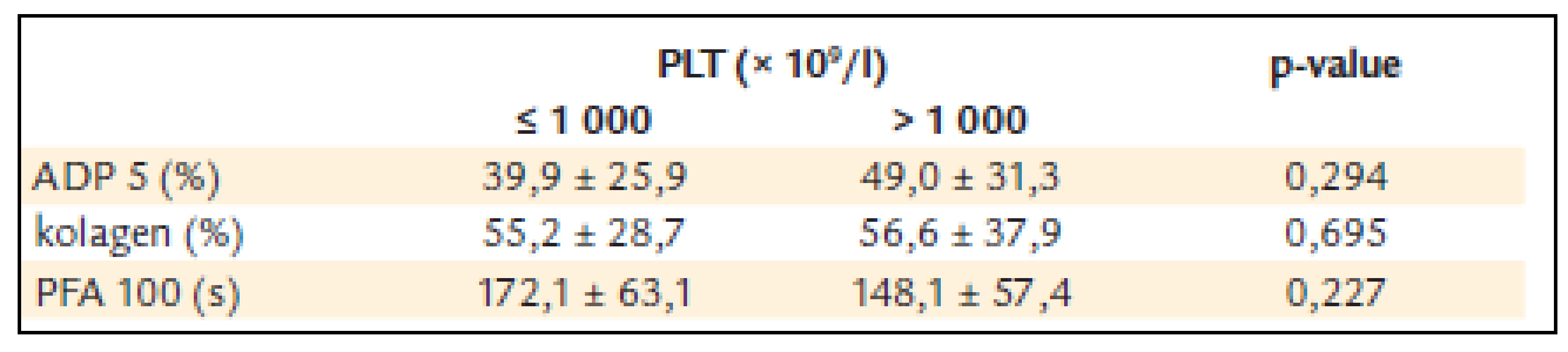
U pacientů s počtem destiček do 1 000 × 109/l byl výskyt krvácení nižší než výskyt krvácení u nemocných s výskytem destiček vyšším než 1 000 × 109/l (n = 20).
U pacientů s výskytem krvácení (n = 20) byla ADP indukovaná agregace 36,8 ± 25,05%, zatímco u pacientů bez krvácení byla ADP agregace 49,76 ± 32,21 % (tab. 7).
Table 7. Krvácení v závislosti na ADP indukované agregaci destiček. 
U pacientů s výskytem trombózy nebyla zjištěna žádná závislost na hodnotách ADP či kolagenem indukované agregace, taktéž zde nebyly zjištěny rozdíly ani ve výsledcích PFA-100.
Současný výskyt krvácení a trombózy byl pozorován u 2 nemocných bez závislosti na agregaci destiček po ADP a kolagenu či PFA-100.
Diskuze
Ze sledování vyplývá, že u našich nemocných je po stimulaci ADP a kolagenem zjišťována nižší průměrná hodnota agregace, a to jak před zahájením léčby, tak i po ní. Podobně i PFA-100 vykazuje subnormální hodnoty, ale ani zde není zjišťován rozdíl u nemocných před léčbou či v jejím průběhu.
Fenomén poruchy destičkové funkce byl však vyjádřen rozdílně u pacientů s počtem destiček vyšším než 1 000 × 109/l a u pacientů s počtem destiček nižším než 1 000 × 109/l (rovněž však statisticky nevýznamně). Byl přitom (neočekávaně) výraznější u nemocných s počtem destiček nižším než 1 000 × 109/l, u nichž se častěji setkáváme s trombózou (viz Michielsův „doutník a klín“ [10]) a kde bychom očekávali normální funkční schopnost krevních destiček.
Naopak, jak by bylo možné očekávat, u nemocných s výskytem krvácení byla zjišťována statisticky významně nižší agregace po ADP než u nemocných bez krvácivých projevů. Briere [2] se nicméně domnívá, že v souvislosti s krvácením nehraje roli porucha funkce krevních destiček, ale spíše různě vystupňovaná porucha charakteru von Wilebrandovy choroby. Z našich výsledků vyplývá, že funkční změny primární hemostázy určitou roli hrát mohou.
Žádné rozdíly nebyly zjištěny mezi skupinou pacientů s počtem destiček vyšším nebo nižším než 400 × 109/l (= limit kompletní léčebné odpovědi), ale počet destiček pod 400 × 109/l během léčby vykazoval nižší procento poruchy ADP indukované agregace v porovnání s pacienty s počtem destiček vyšším než 400 × 109/l (tab. 8) [13], což by odpovídalo předpokladu úpravy poruchy funkce destiček při dosažení kompletní odpovědi hodnocené pouze dle počtu krevních destiček.
Table 8. ADP a kolagenem indukovaná agregace a PFA-100 v závislosti na kolísání počtu krevních destiček pod a nad 400 × 10<sup>9</sup>/l. 
Zajímavým zjištěním ale je, že se hodnoty agregace destiček či PFA-100 nemění ani v důsledku cytoredukční terapie (obr. 5) [13]. Přitom některé výsledky naznačují (viz předchozí odstavec), že se v důsledku léčby upravuje celkový profil nemoci, kdy se při adekvátní kontrole minimalizuje nebezpečí vzniku klinické symptomatologie krvácení či trombózy. Jediným signálem v tomto směru je, že se při kompletní léčebné odpovědi dané snížením počtu krevních destiček snižuje procento patologické agregace indukované ADP [20]. Poněkud odlišná však bude odezva funkce krevních destiček na specifickou antiagregační léčbu [9] a na typ této léčby. Tato okolnost však v naší studii analyzována nebyla.
Image 5. ADP a kolagenem indukovaná agregace a PFA-100 před a během terapie. 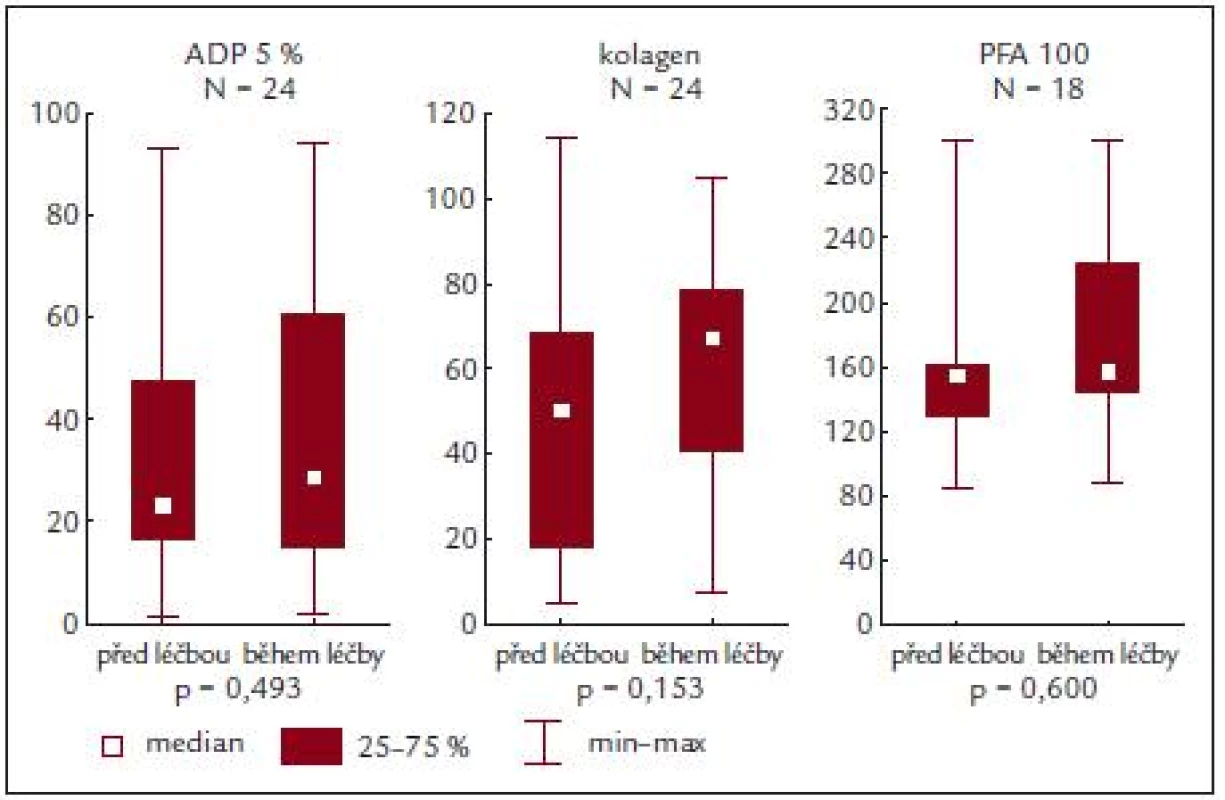
Závěr
Výsledky analýzy některých destičkových funkcí ukazují možnost odhalení rizika vzniku klinické symptomatologie nezávisle na počtu krevních destiček a mohou přispět k zajištění preventivních opatření či specifické léčby [8].
Zatímco některé výsledky vyznívají v očekávaném smyslu, jiné mají nejen neočekávané, ale i protichůdné vyznění, které bude vyžadovat podrobnější studium na větším souboru a vícečetná opakovaní vyšetření při zohlednění známých okolností stavu nemoci (dosažení odpovědi, přítomnost komorbidity či rizikových faktorů [15], souběžná léčba). Zvláště souběžná léčba antiagregancii, kterou nemusejí mít pacienti paušálně podávanou, může velmi významně sledovaný profil měnit.
Destičkové funkce odrážejí tedy i terapeutické konsekvence a, i když neposkytují jednoznačné vysvětlení (nebo právě proto), budou muset být předmětem dalších studií.
Poděkování
Děkuji za spolupráci také MUDr. Jiřímu Schwarzovi, CSc., vedoucímu České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) a všem jejím členům.
prof. MUDr. Miroslav Penka, CSc.
www.fnbrno.cz
e-mail: m.penka@fnbrno.czDoručeno do redakce: 31. 1. 2011
Sources
1. Barbui T, Barosi G, Grossi A et al. Practice guidelines for the therapy of essential thrombocythemia. A statement from the Italian Society of Hematology, the Italian Society of Experimental Hematology and Italian Group for Bone Marrow Transplantation. Haematologica 2004; 89 : 215–232.
2. Brière JB. Essential thrombocythemia. Review. Orphanet J Rare Dis 2007; 2–3 : 1–17.
3. Carobbio A, Antoniovi E, Guglielmelli P et al. Leukocytosis and risk stratification assesment in essential trhobmocythemia. J Clin Oncol 2008; 26 : 2732–2736.
4. Falanga A, Marchetti M, Vignoli A et al. Leukocyte-platelet interaction in patients with essential thrombocythemia and polycythemia vera. Exp Hematol 2005; 33 : 523–530.
5. Gruppo Italiano Studio Policitemia. Polycythemia Vera: The NaTURAL History of 1 213 Patients Folowed for 20 Years. Ann Intern Med 1995; 123 : 656–664.
6. Jensen MK, de Nully Brown P, Lund BV et al. Increase platelet activation and abnormal membrane glycoprotein content and redistribution in myeloproliferative disorders. Br J Haematol 2000; 110 : 116–124.
7. Landolfi R, Cipriani MC, Novarese L. Thrombosis and bleeding in polycythemia vera and essential thrombocythemia: Pathogenetic mechanism and prevention. Best Pract Res Clin Haematol 2006; 19 : 617–633.
8. Landolfi R, Di Gennaro L, Falanga A. Thrombosis in myeloproliferative disorders: pathogenetic facts and speculation. Spotlight review. Leukemia 2008; 22 : 2020–2028.
9. Messa RA. Navigating the Evolving Paradigms in the Diagnosis and Treatment of Myeloproliferative Disorders. Hematology Am Soc Hematol Educ Program 2007; 92 : 355–362.
10. Michiels JJ, Berneman Z, Schroyens W et al. Platelet-mediated thrombotic complications in patients with ET: Reversal by aspirin, platelet reduction, and by coumadin. Blood Cells Mol Dis 2006; 36 : 199–205.
11. Passamonti F, Rumi E, Arcaini L et al. Prognostic factors for thrombosis, myelofibrosis, and leukemia in Essentials trhombocythemia: a study of 605 patients. Haematologica 2008; 93 : 1645–1651.
12. Penka M, Schwarz J, Pytlík R et al. Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející myeloproliferativní onemocnění. Vnitř Lék 2005; 51 : 741–751.
13. Penka M, Schwarz J, Ovesná P et al. Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k prvnímu čtvrtletí roku 2010. Vnitř Lék 2010; 56 : 503–512.
14. Petrides PE, Siegel F. Thrombotic complications in essential trhombocythemia (ET): Clinical Facts and biochemical riddles. Blood Cells Mol Dis 2006; 36 : 379–384.
15. Rosendaal FR. Risk factors for venous thrombosis: prevalence, risk, and interactions. Semin Hematol 1997; 34 : 171–187.
16. Ruggeri M, Gisslinger H, Tosetto A et al. Factor V Leiden mutation carriership and venous thromboembolism in polycythemia vera and essential thrombocythemia. Am J Hematol 2002; 71 : 1–6.
17. Schwarz J, Hrachovinova I, Vorlova Z et al. Thromboembolism in thrombocythemia patients with an additional thrombophilic state. (Abstr. 974). Hematol J 2004; 5 (Suppl 2): S321.
18. StatSoft, Inc. (2009). STATISTICA (data analysis software system), version 9.0. www.statsoft.com
19. Vannucchi AM, Guglielmelli P, Teffer A. Advances in Understanding and Management of Myeloproliferative Neoplasms. Cancer J Clin 2009; 59 : 171–191.
20. Wu KK. Platelet hyperaggregability and thrombosis in patients with thrombocythemia. Ann Intern Med 1978; 88 : 7–11.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 3-
All articles in this issue
- Interna a kardiologie, internisté a kardiologové
- Systolický wall stress ľavej komory srdca pri antihypertenzívnej liečbe
- Dyslipidemie a obezita 2011. Jak spolu souvisejí a v čem se liší
- Autoimunitní pankreatitida a IgG pozitivní sklerotizující cholangitida
- Výskyt aterogénnej dyslipidémie vo vzorke asymptomatických probandov vyšetrením pomocou metódy Lipoprint
- Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
- Vyskytují se v medicíně „módní“ choroby?
- Rostoucí problém – lidský papilomavirus a nádory hlavy/krku
- Mikroalbuminurie. Od diabetu ke kardiovaskulárnímu riziku
- Kotníko-pažní index u nemocných s diabetes mellitus 2. typu
- Trombohemoragický syndrom u nemocných s myeloproliferativním onemocněním s trombocytemií
- Reziduální riziko kardiovaskulárních komplikací a jeho snížení kombinací hypolipidemik
- Síť komplexních onkologických center České republiky
- Variabilita krevního tlaku a arteriální hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikroalbuminurie. Od diabetu ke kardiovaskulárnímu riziku
- Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
- Interna a kardiologie, internisté a kardiologové
- Systolický wall stress ľavej komory srdca pri antihypertenzívnej liečbe
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career