-
Medical journals
- Career
Vliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence
Authors: K. Krylová 1; D. Neumann 1; E. Al Taji 2; Z. Límanová 3; P. Dejmek 2; J. Horáček 4
Authors‘ workplace: Dětská klinika LF UK a Fakultní nemocnice, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Klinika dětí dorostu UK 3. LF a Fakultní nemocnice Královské Vinohrady, Praha přednosta doc. MUDr. F. Votava, CSc. 2; III. interní klinika UK 1. LF a Všeobecné fakultní nemocnice, Praha přednosta prof. MUDr. Š. Svačina, DrSc. 3; IV. interní klinika LF UK a Fakultní nemocnice, Hradec Králové přednosta doc. MUDr. P. Žák, Ph. D. 4
Published in: Čes-slov Pediat 2013; 68 (4): 260-265.
Category: Review
Overview
Článek dává do vztahu fyziologii anatomického a funkčního vývoje štítné žlázy s příjmem jodu těhotnou a vlivem mateřských tyreopatií. Do 14.–16. týdne těhotenství je plod plně závislý na hormonech štítné žlázy matky. Ve 2. a 3. trimestru postupně stoupá tvorba vlastních hormonů štítné žlázy plodu. Zásobení matky jodem je pro plod nezbytné v průběhu celého těhotenství. Tyreopatie matky a její jodový deficit, pokud je v těhotenství měla, zhoršují neurologický vývoj dítěte v případě, že se narodí s kongenitální hypotyreózou.
Klíčová slova:
novorozenec, hormony štítné žlázy, kongenitální hypotyreóza, dysgeneze, dyshormonogeneze, geny, jodový deficitÚVOD
Vývoj štítné žlázy u plodu a její funkci u plodu a novorozence ovlivňují mimo jiné patologické stavy matky, zvlášť zásobení jodem, a mateřské tyreopatie. Časné zjištění poruch mohou umožnit screeningové programy s včasnou intervencí zaměřené na těhotné ženy.
Prenatálně a až do 2 let věku hormony štítné žlázy tyroxin (T4) a trijodtyronin (T3) působí při vývoji nervového systému na diferenciaci a migraci neuronů a glie a na myelinizaci CNS. Jejich deficit ve „vývojových oknech“ [1, 2] poškozuje jednotlivé části mozku s následnými specifickými neurologickými projevy. Prenatálně a postnatálně T4 a T3 ovlivňují růst a diferenciaci tkání, energetickou homeostázu organismu a metabolismus účinkem na transkripci genů. Syntézu a uvolňování hormonů štítné žlázy matky v těhotenství stimuluje současně s TSH i lidský choriový gonadotropin (hCG) [3, 4], takže těhotenské TSH je nižší ve srovnání s negravidními ženami. Ve 2. a 3. trimestru těhotenství je tvorba vlastních hormonů štítné žlázy plodu řízena zpětnovazebně osou hypotalamus - hypofýza - štítná žláza plodu. Hypotalamický tripeptid tyreoliberin (TRH) stimuluje tyreo-stimulační hormon (TSH) adenohypofýzy. TSH se váže na receptory (TSH-R) folikulárních buněk štítné žlázy. Aktivovaný receptor cestou G-proteinu stimuluje vychytávání jodu z krve, jeho oxidaci působením tyreoidální peroxidázy (TPO) a organifikaci do mono - a dijodtyroninů na specifickém zásobním jodoproteinu štítné žlázy tyreoglobulinu (Tg). Mono - a dijodtyroniny jsou spojovány do T3 a T4. Z koloidu folikulů štítné žlázy se po stimulaci TSH uvolňují do oběhu (obr. 1).
Image 1. Schéma tyreoidální hormonogeneze. 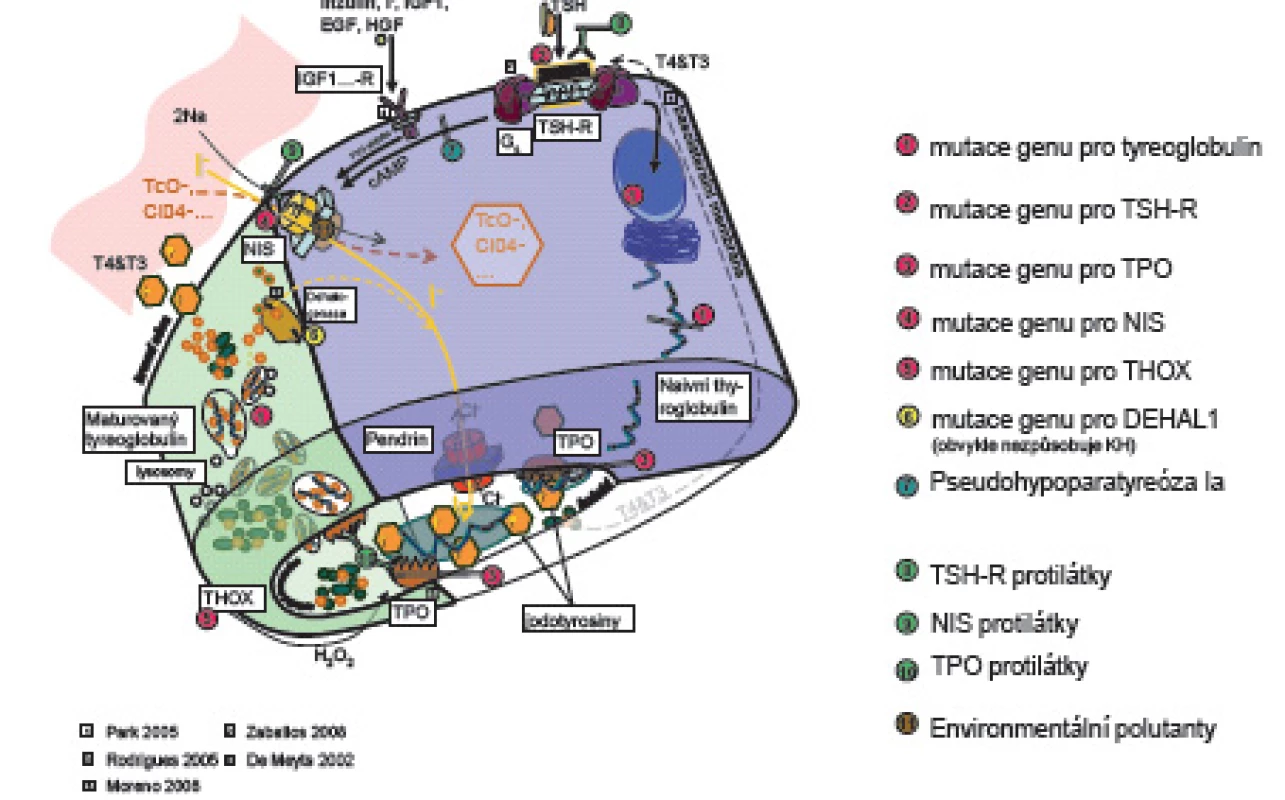
V něm jsou z 99,7 % vázané na tyroxin vážící globulin (TBG – 70 %), transtyretin a albumin. Zbytek (0,03 %) jsou volné, pro tkáně dostupné a účinné hormony (free – fT3, fT4). Volná frakce hormonů negativní zpětnou vazbou působí na hypotalamus a hypofýzu [5]. Tkáňový účinek tyreoidálních hormonů je kontrolován dejodázami DI – DIII. Dejodázy DI a DII mění tyroxin na vlastní receptorový ligand T3, DI převážně v játrech, ledvinách a štítné žláze, DII v CNS, hypofýze a hnědém tuku. DIII mění tyroxin na neúčinný reverzní rT3 a inaktivuje T3. Je přítomna zvláště v CNS, kůži a střevu. Trijodtyronin po vstupu do buněk tkání aktivuje jaderné receptory TR alfa a TR beta. Působením na regulační části cílových genů DNA ovlivňuje transkripci, která je ale ještě dále modifikována působením dalších koaktivátorů a korepresorů [4].
VLIV JODOVÉHO STAVU A TYREOPATIÍ TĚHOTNÝCH NA VÝVOJ PLODU A FUNKCI JEHO ŠTÍTNÉ ŽLÁZY
Jodový stav populace a jednotlivce
Denní potřeba jodu u zdravých netěhotných žen činí přibližně 100 mcg. V těhotenství se zvyšuje o 50 %, aby pokryla požadavky mateřského organismu i plodu. Mateřské mléko obsahuje přibližně 150 mcg/l; nárůst potřeby jodu je v laktaci asi o 115 mcg/den. Více než 90 % požitého jodu se rychle absorbuje v horní části tenkého střeva. Jeho vstřebání může být ovlivněno přítomností strumigenů a mikronutrienty (selen, železo) [6]. Patnáct procent vstřebaného jodu je do 24 hodin uloženo ve štítné žláze, zbytek je vyloučen močí. Zásobení populace jodem lze posoudit měřením jodurie, hladiny TSH a tyreoglobulinu, nebo vyšetřením objemu štítné žlázy. Metoda určující zásobení jodem musí být specifikovaná, záměna výsledků jednotlivých metod a generalizovaná informace vede k nesprávným závěrům [7]. Nejčastěji se jodový stav stanovuje jodurií, pro těhotné je referenční množství (epidemiologická norma) 150–249 mcg/l při 24hodinovém sběru moči. Epidemiologická norma znamená, že při posuzování individuálního případu nelze nízké hodnoty jodurie považovat za obecný deficit [8]. Vyšetření jodurie z jednorázového vzorku je zatíženo diurnálními změnami (až trojnásobné rozdíly hodnot) a rozdíly mezi jednotlivými dny [9]. ICCIDD (International Council for the Control of Iodine Deficiency Disorders) proto k vyloučení diurnální variability doporučuje vždy vyšetření vzorku ranní moči, aby metodika epidemiologických šetření byla standardizována.
Pokud má matka jodový deficit, je plod v každé z fází svého vývoje citlivější k působení dalších faktorů ovlivňujících funkci a vývoj štítné žlázy a jeho neurologický vývoj [10, 11]. Jodový deficit zároveň posunuje hladiny TSH novorozenců směrem k horní hranici normy. Rozlišujeme populaci bez jodového deficitu, populaci s mírným až středním deficitem (epidemiologická norma jodurie 50–149 mcg/l) a populaci s těžkým jodovým deficitem (jodurie <50 mcg/l). V populaci s mírným až středním deficitem jodu je vyšší výskyt novorozenců s kongenitální hypotyreózou [12]. Těžký jodový deficit matky je příčinou nedostatečného přívodu a vytvoření zásob jodu plodu. Nejzávažnějším neurologickým a vývojovým projevem je kretenismus, s formou neurologickou (závažná mentální retardace, strabismus, hluchoněmost, spasticita), myxedematózní formou (méně závažná mentální retardace spolu s klinickým obrazem závažné vrozené hypotyreózy – porucha růstu, otoky, porucha vývoje obličejového skeletu, myxedematózní prosáknutí pokožky) a formou smíšenou [13].
WHO/ICCIDD doporučuje denní příjem jodu 150 mcg pro netěhotné a 250 mcg pro těhotné a kojící ženy [8]. Jedná se o odhad dolní hranice nutričního přívodu jodu, který zabezpečí dostatečné množství jodu pro těhotnou i plod a matku s kojeným novorozencem. Tato doporučení reflektuje i ČR (SZÚ). Těhotné a kojící ženy jsou však považovány za rizikovou skupinu, i když je ČR řazena mezi země s dostatečným zásobením jodem. Je jasné, že jodace soli není dostatečná k pokrytí potřeb v těhotenství. Na nižší dodávce jodu v těhotenství se dále podílí doporučení omezit solení, existence nejodidovaných solí, specifické dietní zvyky (vegetariánství) a nedůsledná preskripce jodidu těhotným zvláště v posledním trimestru těhotenství, kdy jsou omezovány multivitaminy ve snaze zabránit hypertrofii plodu. Navíc existují i multivitaminové přípravky pro těhotné bez jodidu nebo s jeho omezeným množstvím. Situaci potvrzují i studie v dalších zemích bez jodového deficitu. Část těhotných žen má jodový deficit v Austrálii [14], na Slovensku [15] nebo v Nizozemí [16]. Při substituci těhotných jodem je kladen důraz na časný začátek před 10. týdnem těhotenství [17]. Zajištění potřebného příjmu jodu je součástí péče o těhotné a je plně v kompetenci gynekologů; k informovanosti žen mohou přispět i praktičtí lékaři. Pediatři, neonatologové a endokrinologové péči podporují a urgují, v zásadě však v praxi nemají možnost zásobení těhotných jodem ovlivnit.
Tyreopatie těhotných
Změny funkce štítné žlázy jsou nejčastější endokrinopatií těhotných žen. Těhotenská tyreotoxikóza je vzácná (v ČR podle dat Límanové z r. 2011 <0,5 % těhotných) [18], ale pro plod závažná. Snížená funkce štítné žlázy (subklinická a manifestní hypotyreóza) je v ČR diagnostikována podle recentních údajů až u 7–8 % těhotných [18]. Hladiny TSH gravidních jsou významně nižší než mimo těhotenství (posun doleva vlivem hCG) a za fyziologické hodnoty podle ATA (American Thyroid Association) jsou považovány hodnoty 0,1–2,5 mIU/l v prvním trimestru, 0,2–3,0 mIU/l ve druhém a 0,3–3,0 mIU/l ve třetím trimestru. Snížení TSH pod 0,1 mIU/l je nutné posuzovat opatrně s ohledem na vliv hCG a možnost hypertyreózy.
Pro ČR připravila ČES ČLS JEP ve spolupráci s SKLB ČLS JEP „Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility“ [29], která respektují evropské a české zvyklosti přístupu ke gravidním ženám a upravují doporučenou referenční normu pro TSH v I. trimestru těhotenství v ČR na 0,06–3,67 mIU/l [19].
Hypofunkce štítné žlázy matky má vliv na těhotenství (zvýšená mateřská morbidita, hypertenze, sterilita, zamlklá těhotenství, spontánní potraty, abrupce placenty, předčasný porod) a na plod a dítě (intrauterinní růstová restrikce, poruchy neurologického vývoje) [20, 21, 22]. Záleží však na stanovených kritériích považovaných za hypofunkci (TSH >97,5. percentil vs. fT4 <2,5. percentil; délka gestace při vyšetření: 9.–11. týden vs. 13.–15. týden těhotenství). O dopadu hraničních hodnot TSH gravidních žen na neurologický vývoj plodu [23] se vedou diskuse a problematika není zdaleka uzavřena. Izolovaná hypotyroxinemie těhotných je relativně častá, zvláště ve 2. po-lovině těhotenství. Výskyt protilátek proti tyreoidální peroxidáze (anti-TPO) ovlivňuje početí a průběh těhotenství, spontánní potraty jsou dvakrát častější [17]. Pětkrát se zvyšuje riziko přechodu do tyreoidální hypofunkce ženy v době těhotenství a kojení [24].
Mezinárodní [17, 24] a národní doporučení [18, 25, 26] se shodují ve vhodnosti screeningu subklinické hypotyreózy těhotných žen, a to vyšetřením TSH, anti-TPO a ev. fT4. O tom, zda screening má být cílený jen na ženy s rizikovými faktory nebo celoplošný, se stále diskutuje. Prvořadá je informovanost těhotných žen. Obecně by nejen těhotné ženy s rizikovými faktory měly mít o vyšetření funkce štítné žlázy aktivní zájem.
Podle platného postupu ATA [17] a ČES ČLS JEP je včasná léčba L-tyroxinem indikována u manifestní hypotyreózy (TSH >2,5 mIU/l při fT4 pod referenční mezí; nebo TSH >10 mIU/l). Při hypotyreóze léčené již před těhotenstvím se dávkování L-tyroxinu obvykle zvyšuje o 25–80 % s velkou interindividuální variabilitou. Pro léčbu subklinické hypotyreózy (TSH v těhotenství >2,5 mIU/l při referenční hodnotě fT4) nejsou dostatečné EBM důkazy, ale spíše by měla být léčena (podle ATA)/jistě by měla být léčena (podle ČES ČLS JEP). Pozitivita protilátek proti TPO je indikací k pravidelnému sledování funkce štítné žlázy v těhotenství, ale v případě současné subklinické hypotyreózy je důvodem k léčbě. Izolovaná hypotyroxinemie (fT4 <5. percentil při normálním TSH) není indikací k léčbě L-tyroxinem, ale je nutný zvýšený příjem jodu u těhotné. Autoimunitní tyreoiditida těhotné s eufunkcí nebo hypofunkcí může rovněž vést přenosem mateřských protilátek ke vzniku tranzientní hypertyreotropinemie u novorozence (protilátky proti TPO, TSH-receptoru) [27]. Klinicky skutečnou pozitivitu screeningu kongenitální hypotyreózy způsobuje zřídka (<2 %) [28].
ZÁVĚR
Hormony štítné žlázy jsou nezbytné pro normální vývoj plodu a novorozence. Nedostatek jodu a poruchy štítné žlázy matky plod nepříznivě ovlivňují. Dostatečný přívod jodu po celou dobu gravidity předchází možným komplikacím jak u matky, tak u vyvíjejícího se plodu. Doporučený příjem jodu v těhotenství a laktaci je 250 mcg na den. Sledování funkce štítné žlázy v těhotenství je indikované zejména u žen s přítomností rizikových faktorů. Plošný screening těhotných je dosud výjimkou (např. Slovensko), ČES ČLS JEP ho v této formě prosazuje i pro ČR.
V případě prokázané hypotyreózy matky je doporučena včasná léčba L-tyroxinem. U těhotných s pozitivními protilátkami proti TPO a současně zjištěnou subklinickou hypotyreózou by měla být rovněž zahájena léčba. Izolovaná hypotyroxinemie není indikací k léčbě L-tyroxinem, ale je nutný zvýšený příjem jodu těhotnou. V případě autoimunitní tyreoiditidy u těhotné s eufunkcí nebo hypofunkcí může přenosem protilátek dojít ke vzniku tranzientní hypertyreotropinemie u novorozence. Stav obvykle nevede k pozitivitě screeningu na kongenitální hypotyreózu.
Použité zkratky:
DI-DIII – tkáňové dejodázy, g.t. – gestační týden, hCG – lidský choriový gonadotropin, KH – kongenitální hypotyreóza, rT3 – reverzní trijodtyronin, T3 – trijodtyronin, T4 – tyroxin, TBG – tyroxin vážící globulin, Tg – tyreoglobulin, THOX – tyreoidální oxidáza, TPO – tyreoidální peroxidáza, TR – jaderný receptor pro tyreoidální hormony, TRH – tyreoliberin, TSH – tyreostimulační hormon, TSH-R – receptor pro tyreostimulační hormon
Autoři jsou vděčni panu profesoru MUDr. Václavu Zamrazilovi, DrSc., za revizi textu a cenné poznámky.
Podpořeno MZ ČR – RVO (FNHK, 00179906).
Došlo: 2. 12. 2012
Přijato: 1. 5. 2013
MUDr. Kateřina Krylová
Dětská klinika FN
Sokolská tř. 581
500 05 Hradec Králové
Sources
1. Chan S, Kilby MD. Thyroid hormone and central nervous system development. J Endocrinol 2000; 16 : 1–8.
2. Zoeller RT, Rovet J. Timing of thyroid hormone action in the developing brain: clinical observations and experimental findings. J Neuroendocrinol 2004; 16 : 809–818.
3. Ogilvy-Stuart A, Midgley P. Practical Neonatal Endocrinology. Cambridge University Press, 2006 : 1–218. ISBN 978-0-521-83849-8.
4. Raine JE, Donaldson MDC, Gregory JW, et al. Practical Endocrinology and Diabetes in Children. John Wiley & Sons, 2006 : 1–256. ISBN 13 : 978-1-4051-2233-7. ISBN 10 : 1-4051-2233-1.
5. Bursell JDH, Warner JT. Interpretation of thyroid function in chidren. Ped Child Health 2007; 17 : 361–366.
6. Ristic-Medic D, Piskackova Z, Hooper L, et al. Methods of assessment of iodine status in humans: a systemic review. Am J Clin Nutr 2009; S9 : 2052S–2069S.
7. Laurberg P, Andersen S, Bjarnadottir RI, et al. Evaluating iodine deficiency in pregnant women and young infants – complex physiology with a risk of misinterpretation. Public Health Nutr 2007;10 (12A): 1547–1552.
8. Zimmermann MB. The impact of iodised salt or iodine supplementation on iodine status during pregnancy, lactation and infancy. Public Health Nutr 2007; 10 : 1584–1595.
9. Rasmussen LB, Ovesen L, Christiansen E. Day-to-day and within-day variation in urinary iodine excretion. Eur J Clin Nutr 1999; 53 : 401–407.
10. Alvarez-Pedrerol A, Guxens M, Mendez M, et al. Iodine levels and thyroid hormones in healthy pregnant women and birth weight of their offsprings. Eur J Endocrinol 2009; 160 : 423–429.
11. Zimmermann MB. Iodine deficiency in pregnancy and the effect of maternal iodine supplementation on the offspring: a review. Am J Clin Nutr 2009; 89 : 668S–672S.
12. Sullivan KM. Increase in congenital hypothyroidism due to inadequate iodine nutrition? Mol Genet Metab 2008; 93 : 485.
13. Zimmermann MB. The effects of iodine deficiency in pregnancy and infancy. Paediatric Perinatal Epidemiology 2012; 26 (Suppl 1): 108–117.
14. Travers CA, Guttikonda K, Norton CA, et al. Iodine status in pregnant women and their newborns: are our babies at risk of iodine deficiency? MJA 2006; 184 : 617–620.
15. Dluholucký S, Knapková M, Cibirová M, Hrubá F. Hodnotenie zvýšených hladín neonatálneho skríningového TSH na Slovensku. Čes-slov Pediat 2006; 9 : 524–529.
16. Hoogendoorn EH, Hermus AR, De Vegt F, et al. Thyroid function and prevalence of anti-thyroperoxidase antibodies in a population with borderline sufficient iodine intake: influences of age and sex. Clin Chem 2006; 52 : 104–111.
17. Stagnaro-Green A, Abalovich M, Alexander E, et al. Guidelines of the American thyroid association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011; 21 : 1–45.
18. Límanová Z, Springer D. Současné zkušenosti s vyšetřováním tyreopatií v graviditě – výsledky pilotního projektu. Čas Lék čes 2011; 150 : 389–393.
19. Springer D, Zima T, Limanova Z. Reference intervals in evaluation of maternal thyroid function during the first trimestr of pregnancy. Eur J Endocrinol 2009; 160 : 791–797.
20. Herbstmann J, Apelberg BJ, Witter FR, et al. Maternal, infant and delivery factors associated with neonatal thyroid hormone status. Thyroid 2008; 18 : 67–76.
21. LaFranchi S. Thyroid hormone in hypopituitarism, Grave´s disease, congenital hypothyroidism and maternal thyroid disease during pregnancy. Growth Horm IGF Res 2006; 16: S20–S24.
22. Vargová V, Mechírová V, Pytliak M, Tajtáková M. Ochorenia štítnej žľazy matky a vrodené vývojové chyby plodu. Čes Gynek 2008; 73 : 35–40.
23. Lazarus JH, Bestwick JP, Channon S, et al. Antenatal thyroid screening and childhood cognitive function. N Engl J Med 2012; 366 : 493–501.
24. Moleti M, Lo Presti VP, Mattina F, et al. Gestational thyroid function abnormalities in conditions of mild iodine deficiency: early screening versus continuous monitoring of maternal thyroid status. Eur J Endocrinol 2009; 160 : 611–617.
25. Kořenek A. Screening poruch štítné žlázy v graviditě a po porodu. Prakt Gyn 2009; 3 : 137–141.
26. Límanová Z, Laňková J, Zamrazil V. Funkční poruchy štítné žlázy. Praha: Společnost všeobecného lékařství ČLS JEP, 2008 : 1–16. ISBN 978-80-86998-24-4.
27. Parks JS, Lin M, Grosse SD, et al. The impact of transient hypothyroidism on the increasing rate of congenital hypothyroidism in the United States. Pediatrics 2010; 125: S54–S63.
28. Brown RS, Bellisario RL, Botero D, et al. Incidence of transient congenital hypothyroidism due to maternal thyrotropin receptor-blocking antibodies in overone million babies. J Clin Endocrinol Metab 1996; 81 : 1147–1151.
29. Horáček J, Jiskra J, Límanová Z, et al. Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility. Diab Metab Endokrinol Výž 2013; 1 : 38–61.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2013 Issue 4-
All articles in this issue
- Kineticky řízená léčba gentamicinem u kriticky nemocných septických nedonošených novorozenců v prvním týdnu života – otevřená prospektivní studie (část I)
- Prevalencia nadhmotnosti a obezity u študentov bratislavských stredných škôl – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Vliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Hazard a obec
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

