-
Medical journals
- Career
Lze považovat i na začátku třetího tisíciletí primární karcinom vejcovodu za enigma?
Authors: J. Špaček 1; J. Laco 2; J. Petera 3; I. Sedláková 1; A. Řezáč 1
Authors‘ workplace: Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG 1; Fingerlandův ústav patologie LF UK a FN, Hradec Králové, přednosta prof. MUDr. A. Ryška, Ph. D. 2; Klinika onkologie a radioterapie LF UK a FN, Hradec Králové, přednosta prof. MUDr. J. Petera, Ph. D. 3
Published in: Ceska Gynekol 2013; 78(6): 501-508
Category: Original Article
Overview
Cíl práce:
Analýza rozdílů mezi primárním karcinomem vejcovodu a ovariálním karcinomem, snaha poukázat na výjimečnost a specifitu tohoto onemocnění.Typ studie:
Přehledová studie.Název a sídlo pracoviště:
Porodnická a gynekologická klinika, Fingerlandův ústav patologie, Klinika onkologie a radioterapie, LF UK a FN Hradec Králové.Metodika:
Analýza literárního přehledu a vlastních zkušeností zabývající se problematikou primárního karcinomu vejcovodu.Závěr:
Primární karcinom vejcovodu býval považován za vzácný nádor, nicméně u pokročilého onemocnění nemůže ani extenzivní histopatologické vyšetření jednoznačně potvrdit místo primárního původu (vaječník, vejcovod). Tumorigenní potenciál endosalpingu ve vztahu k epitelovým nádorům je mnohem větší, než se původně předpokládalo. Většina high-grade serózních karcinomů „ovaria“ ve skutečnosti vzniká ve sliznici fimbriálního úseku vejcovodu.Klíčová slova:
primární karcinom vejcovodu – karcinom ovaria – BRCA mutace – rizikové faktory – paraaortální lymfadenektomieÚVOD
Primární karcinom vejcovodu je onemocněním, které je, a zejména v minulosti bylo považováno za velmi málo časté, a porovnáme-li tuto entitu s nádory vaječníku, do popředí vystupuje zejména mnohem menší množství údajů, které jsou k dispozici. Nesrovnatelný je jednak počet publikovaných prací, jednak rozsahem daleko menší soubory, než je tomu u ovaria. Z hlediska vzniku karcinomu (nádoru pocházejícího z epitelu) je paradoxem diskrepantní nepoměr mezi vnitřním povrchem sliznice vejcovodu a zevním povrchem vaječníku. Plocha endosalpingu je totiž jeho mnohonásobkem. Jinými slovy, od samého začátku si musíme klást otázku, jaký a kde je skutečný původ nádoru v případě pokročilého onemocnění. Mechanistická představa o vznikajícím nádoru dává tušit, že u tuby může akcelerovat přítomnost časnější symptomatologie, zejména když začíná nádor tento dutý svalový orgán obturovat. Naopak u ovaria, které je volně zavěšeno, probíhá jeho počáteční zvětšování ve většině případů zcela bez povšimnutí, a tím spíše uniká naší pozornosti. To vše a mnohé další vytváří řadu otázek a je možné konstatovat, že primární karcinom vejcovodu představuje v poslední době mimořádně zajímavou a aktuální problematiku. Na jedné straně dominuje minimální incidence časných, a tedy na vejcovod omezených primárních karcinomů tuby, na straně druhé je znám mnohem větší tumorigenní potenciál tohoto orgánu. Sice máme k dispozici omezené údaje, ale mnohé lze předpokládat a vyvozovat. Často přisuzovanou podobnost s ovariálním karcinomem narušují zprávy, které totiž na určité rozdíly poukazují. Nejde sice o zásadní předěl, ale jejich znalost může být užitečná. Cílem tohoto sdělení je poukázat na základní kontroverze, které jsou s touto problematikou spojeny a zároveň ji činí výjimečnou.
ZÁKLADNÍ FAKTA
Diagnóza primárního karcinomu tuby je vymezena pro pacientky, které splňují následující kritéria [10]:
- nádorová hmota musí být ve vejcovodu a musí vycházet z endosalpingu,
- měl by být jasně patrný přechod od benigního do maligního epitelu,
- neměla by být žádná spojitost mezi onemocněním vycházejícím z tuby a z ovaria.
S ohledem na takto striktně definovaná kritéria je potom primární karcinom tuby raritní záležitostí a větší soubory existují pouze v případě multicentrických studií [1, 9, 15]. Na druhé straně však nesmíme zapomínat ani na to, že u pokročilého onemocnění není histopatolog vždy schopen určit jeho skutečný původ. Jinými slovy, mnoho karcinomů, které jsou považovány za primárně ovariálního původu, může v prvopočátku vycházet ze sliznice vejcovodu.
Frekvence výskytu primárního karcinomu vejcovodu se pohybuje mezi 0,3 až 1,6 % gynekologických malignit [15, 22]. Například v České republice však skutečnou incidenci karcinomu tuby lze určit jen velmi obtížně. Vykazuje se pod kódem C57 (zhoubný novotvar jiných a neurčených ženských pohlavních orgánů). Těchto novotvarů bylo v roce 2003 diagnostikováno 63, tj. 1,2 případu na 100 tisíc žen [4]. Údaje z roku 2008 (tab. 1) potom svědčí o narůstajícím počtu případů.
Table 1. Incidence a mortalita karcinomu ovaria a vejcovodu v České republice v roce 2008 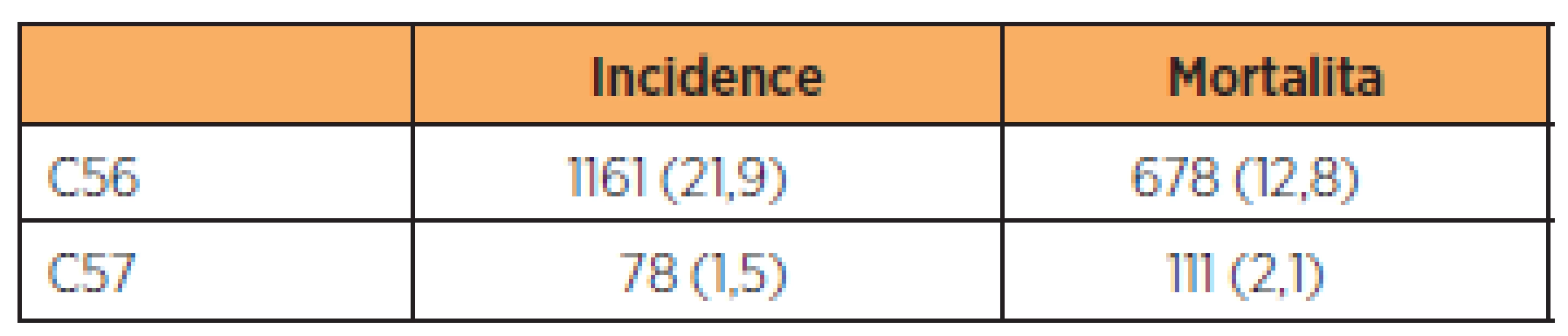
Pozn.: absolutní počet případů v ČR (počet případů na 100 000 žen) /1 rok Nejčastější věkové období je v rozmezí 40 až 65 let [15]. Polovina postižených jsou nulipary kolem 50. roku věku [4]. Faktory, které přispívají ke vzniku onemocnění, nejsou dobře známé. Prognostické vyhlídky zahrnují variabilní šíři, od skličujících předpovědí až po vysoce optimistické odhady, nicméně závěry studií, které se zabývají prognózou pacientek s karcinomem vejcovodu, poukazují spíše na jejich horší prognózu. Nejednotnost v prognostických odhadech u karcinomu tuby může mít kořeny i v tom, že se tyto práce snaží o nemožné. Náročná vstupní kritéria pro primární onemocnění vejcovodu zahrnují však obvykle pouze počáteční stadia. Vzhledem k malému počtu případů a různým způsobům léčby jsou publikované výsledky velmi rozdílné. Pětileté přežití je například uváděno (bez ohledu na stadium) v 38 % případů [19]. Celkové přežití je však nízké a pohybuje se v rozmezí mezi 22 až 57 % [15]. Předoperační diagnóza časného karcinomu tuby není častá a obyčejně je náhodným mikroskopickým nálezem ve fimbriálním úseku tuby, odstraněné z jiných, většinou „benigních“ příčin. Časnější klinická symptomatologie s odpovídající diagnostikou však může zlepšit prognózu pacientky zásadním způsobem. Karcinom bývá v 15 % bilaterální, šíří se ústím vejcovodu do peritoneální dutiny a lymfatickou cestou do ilických a paraaortálních lymfatických uzlin. Možné je šíření přes ligamentum rotundum do třísel, v úvahu přichází též hematogenní metastazování. V 10–25 % případů je výskyt bilaterální, častěji u infertilních pacientek [4]. Prognostické faktory se shodují s karcinomem vaječníku a lze je rozdělit podle více hledisek [24]. Nejdůležitějším prognostickým faktorem je stadium onemocnění a z ovlivnitelných faktorů potom kvalita chirurgické léčby, zejména s ohledem na velikost reziduálního tumoru [23, 24]. Způsob léčby karcinomu vejcovodu a karcinomu ovaria je identický. Stejný je rozsah chirurgické léčby, ale i režimy chemoterapie.
POHLED PATOLOGA
Současná WHO klasifikace nádorů vejcovodu sdílí do určité míry podobné charakteristiky s klasifikací nádorů vaječníků. Jsou zde uvedeny nádory epitelové (benigní, borderline a maligní), smíšené epiteliální mezenchymální nádory (maligní smíšený mülleriánský tumor a adenosarkom), měkkotkáňové nádory (leiomyom, leiomyosarkom), mezoteliální nádory (adenomatoidní tumor), nádory ze zárodečných buněk (zralý a nezralý teratom), nádory řazené do spektra trofoblastické choroby (včetně choriokarcinomu), hematologické malignity (leukémie a lymfomy) a metastázy.
Karcinomy vejcovodu jsou dále děleny analogicky jako karcinom ovarií na serózní, mucinózní, endometroidní, světlobuněčné, transicionální, dlaždicobuněčné a nediferencované. Z nich jsou zdaleka nejčastější karcinomy serózní; ostatní představují skutečné rarity a nebudou proto dále diskutovány [26].
Serózní karcinomy jsou v současné době děleny na dva typy – jednak je to high-grade serózní karcinom (zdaleka nejčastější), tvořící přibližně 95 % všech serózních karcinomů, a podstatně vzácnější low-grade serózní karcinom. Nejde však o dva diferenciační stupně jedné nádorové entity, ale o dva molekulárně geneticky zcela odlišné nádory [18].
V minulosti byl vznik serózních karcinomů ovaria odvozován přímo z ovariální tkáně, resp. z jejího povrchového epitelu nebo z epitelu inkluzních cyst. Předpokládalo se, že hlavní příčinou je opakované poškozování tohoto epitelu při ovulaci [27]. V současné době se však předpokládá, že většina high-grade serózních karcinomů ovaria a peritonea vzniká ve skutečnosti v ampulární části vejcovodu. Impulzem pro formulaci této vpravdě revoluční teorie byl mj. častý nález dysplastických změn, popř. až karcinomu in situ v profylakticky odstraněných vejcovodech žen se zárodečnou mutací tumor supresorových genů BRCA1, event. BRCA2 [8, 14]. Podkladem záchytu těchto časných změn je ovšem pečlivé mikroskopické vyšetření vejcovodu, při kterém se zpracuje celý vejcovod a ampulární část se opakovaně prokrajuje (tzv. protokol SEE-FIM, Sectioning and Extensively Examining the Fimbriated End) [18].
Podle nynějších představ začíná etiopatogeneze high-grade serózního karcinomu opakovaným poškozením DNA sekrečních buněk sliznice ampulární části vejcovodu. Co je přesně příčinou tohoto poškození, proč postihuje predilekčně ampulární část tuby a proč jsou na něj sekreční buňky tak citlivé, není zatím jasné. Dalším stadiem je relativně dobře definovaný prekurzor nazývaný tzv. p53-signature. Tato léze není rozpoznatelná při běžném barvení hematoxylinem-eozinem a k jejímu zjištění je nutný imunohistochemický průkaz proteinu p53. K diagnóze se vyžaduje nejméně 12 konsekutivních p53-pozitivních sekrečních buněk [5].
Přítomnost p53-signature je ovšem ve sliznici vejcovodu relativně častý nález a jen asi polovina těchto lézí obsahuje inaktivující (většinou) mutace tumor supresorového genu TP53, kódujícího protein p53. Zatím se předpokládá, že pouze u malé části p53-signature lézí dochází k jejich progresi za vzniku první v barvení hematoxylinem-eozinem viditelné prekurzorové léze high-grade serózního karcinomu, tj. serózního tubárního intraepiteliálního karcinomu (STIC), který je charakterizován jednoznačnými dysplastickými změnami sekrečních buněk a jejich vysokou mitotickou aktivitou. Jednou z příčin progrese ložisek p53-signature do STIC je vznik somatických inaktivujících mutací genu BRCA1, díky čemuž buňka není schopná opravovat dvouvláknové zlomy DNA [11].
„Konečným“ stadiem STIC je invaze nádorových buněk přes bazální membránu epitelu sliznice tuby za vzniku primárního high-grade serózního karcinomu vejcovodu. Další možností/krokem je implantace nádorových buněk STIC nebo invazivního karcinomu tuby na povrch ovaria a na peritoneum za vzniku high-grade serózního karcinomu těchto orgánů. Důvodem, proč byly v minulosti tyto nádory považovány za primárně ovariální, resp. peritoneální, jsou zejména nevýrazné makroskopické změny vlastního vejcovodu, který proto nebýval tak extenzivně mikroskopicky vyšetřován, a na-opak výrazné zvětšení ovaria, resp. časté masivní postižení omenta [5].
V poslední době se také učinil pokrok v rozpoznání etiopatogeneze vzácnějšího low-grade serózního karcinomu, jenž vzniká ze svých prekurzorů, kterými jsou serózní cystadenom a z něj vznikající serózní borderline tumor. V minulosti se předpokládalo, že serózní cystadenom vzniká z korových inkluzních cyst, odvozených pouze z povrchového epitelu ovaria. Inkluzní cysty jsou však dvojího původu. Ty méně časté zřejmě opravdu vznikají z povrchového epitelu ovarií s jeho následnou tubární metaplazií, podstatně častější jsou však inkluzní cysty vznikající přímo z tubárního epitelu zavzatého do ovulačních stigmat. V tomto případě by celý nádorový proces byl, podobně jako patogeneze high-grade serózního karcinomu, odvozen z epitelu sliznice vejcovodu [27].
Doplňující teorie ještě zdůrazňují význam chronické salpingitidy, vedoucí k tzv. papilární tubární hyperplazii sliznice tuby. Tyto hyperplastické buňky následně mohou implantovat na povrch a do korových částí ovaria za vzniku inkluzních cyst, serózního cystadenomu, serózního borderline tumoru a konečně low-grade serózního karcinomu. Rovněž tak mohou tyto buňky implantovat na peritoneum a/nebo do lymfatických uzlin za vzniku endosalpingiózy, neinvazivních a posléze invazivních implantátů [12].
Image 1. Drobné ložisko průměru 0,6 mm nízce diferencovaného (high-grade) serózního adenokarcinomu ve sliznici fimbriální části tuby jako náhodný mikroskopický nález u 40leté ženy se zárodečnou mutací genu BRCA1. V okolí nádorového ložiska je intenzivní zánětlivý infiltrát (hematoxylin-eozin, původní zvětšení 40×) 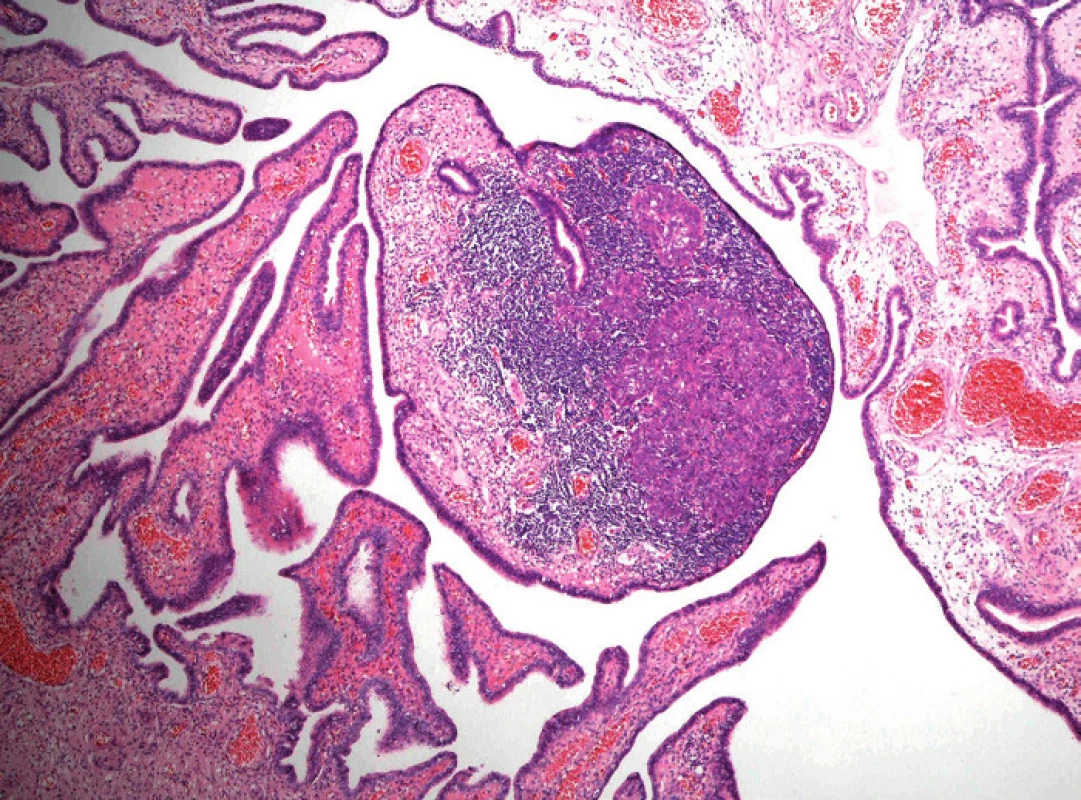
Image 2. Drobné ložisko průměru 0,6 mm nízce diferencovaného (high-grade) serózního adenokarcinomu ve sliznici fimbriální části tuby jako náhodný mikroskopický nález u 40leté ženy se zárodečnou mutací genu BRCA1. V okolí nádorového ložiska je intenzivní zánětlivý infiltrát (hematoxylin-eozin, původní zvětšení 100×) 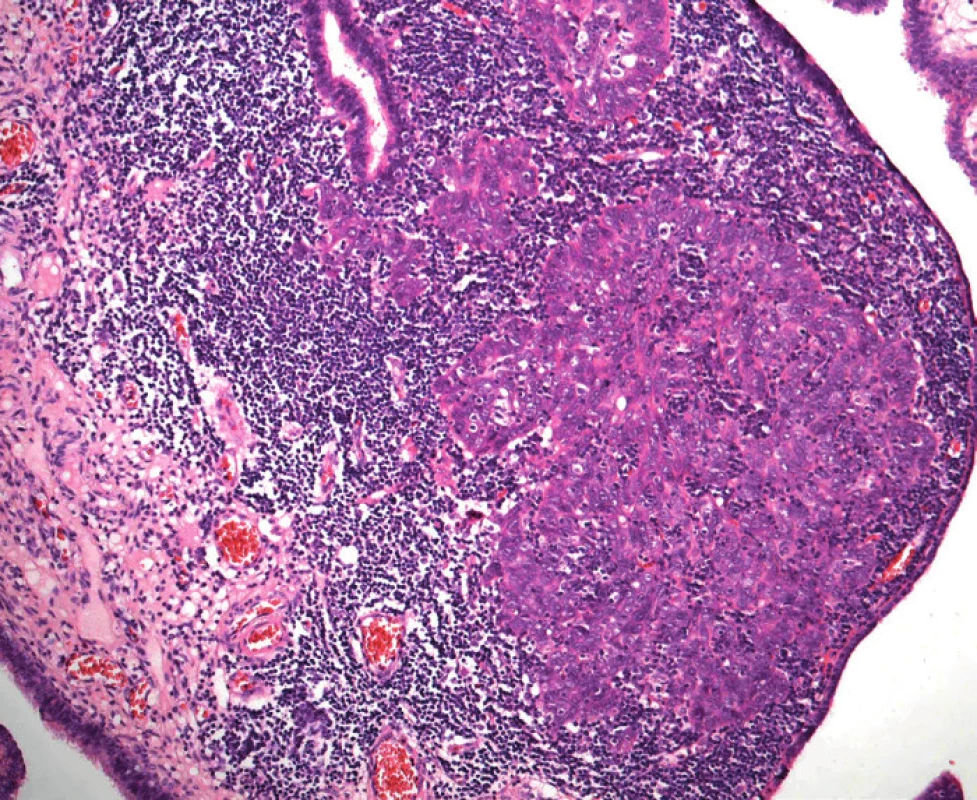
Image 3. Difuzní jaderné exprese markeru WT-1 v nádorových buňkách. Nenádorový tubární epitel je také pozitivní (původní zvětšení 100×) 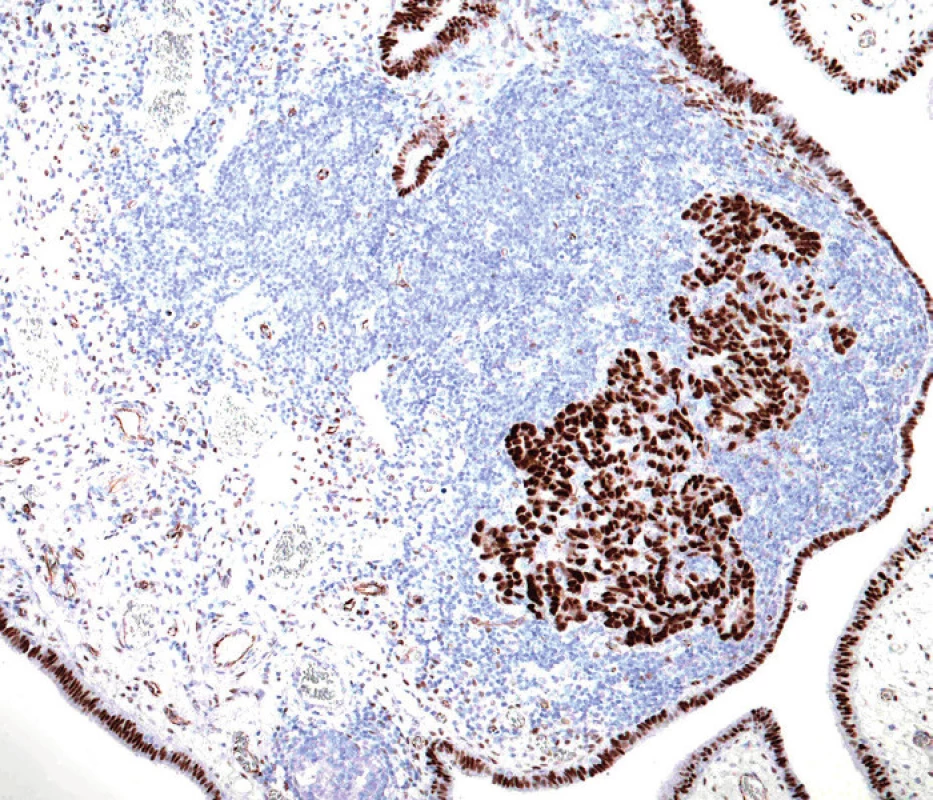
Image 4. Difuzní silná jaderná exprese proteinu p53 v nádorových buňkách nepřímo svědčí pro mutaci genu TP53. V tubárním epitelu je naopak patrna fokální slabá exprese proteinu p53, tzv. wild-type expression, která nepřímo svědčí pro intaktní gen TP53 (původní zvětšení 100×) 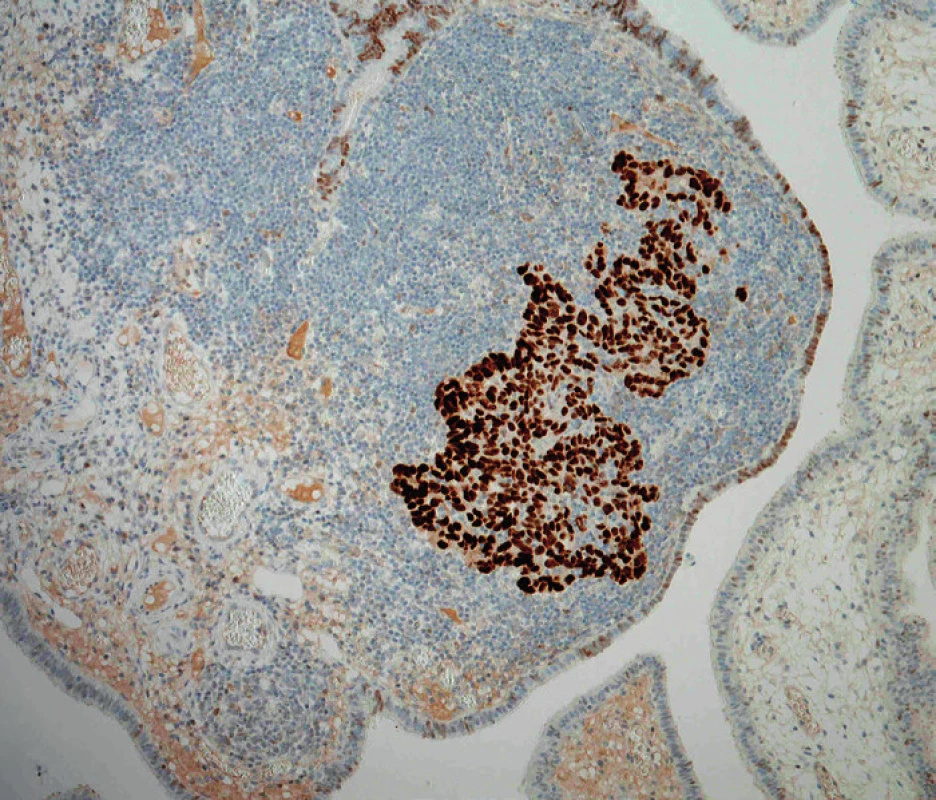
Image 5. Difuzní silná jaderná a cytoplazmatická exprese proteinu p16INK4a v nádorových buňkách, v tomto případě bez vztahu k infekci lidskými papilomaviry (HPV) (původní zvětšení 100×) 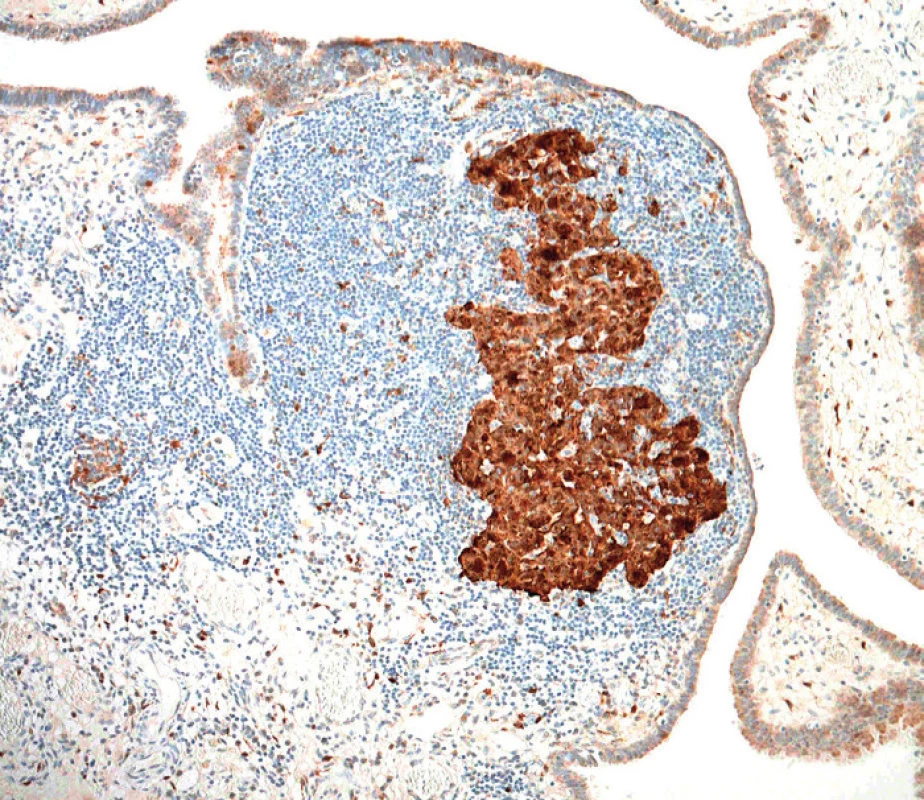
Image 6. Vysoká proliferační aktivita nádorových buněk při průkazu proliferačního markeru Ki-67. Srovnej s minimální proliferační aktivitou normálního tubárního epitelu v okolí (původní zvětšení 100×) 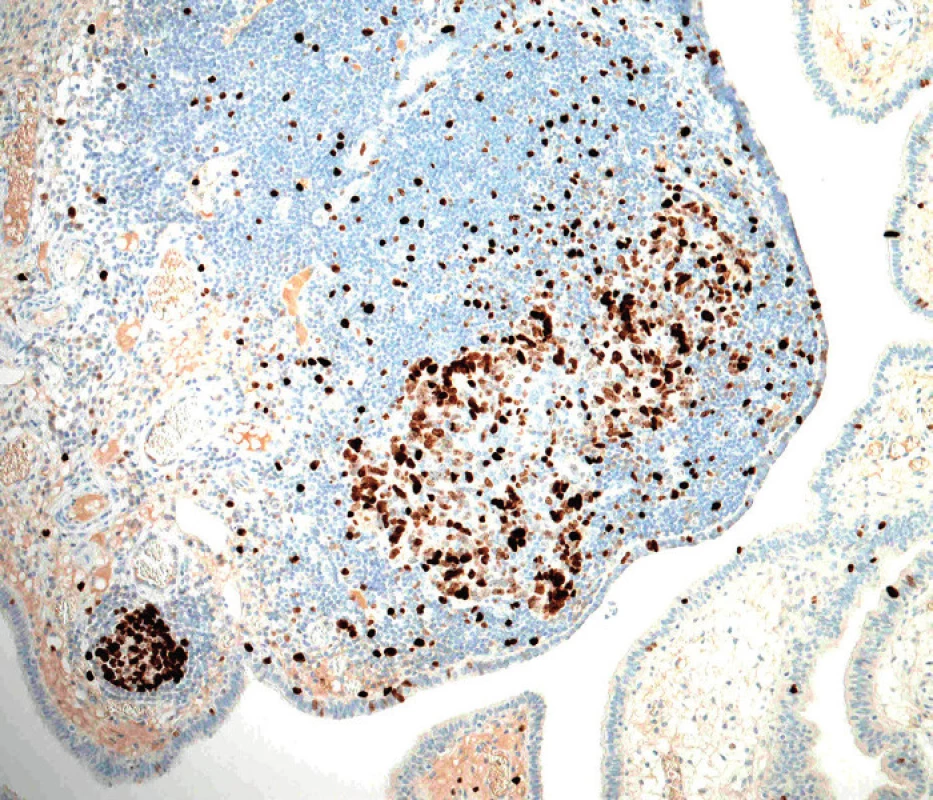
KLASIFIKACE ONEMOCNĚNÍ
Klasifikace onemocnění je obdobná jako u karcinomu ovaria a hodnocení rozsahu onemocnění je u obou orgánů ekvivalentní.
Primární nádor
TX – primární nádor nelze hodnotit
T0 – bez známek primárního nádoru
Tis – karcinom in situ (CIS)
T1 – nádor je omezen na vejcovod(y)
- T1a – nádor je omezen na jeden vejcovod, bez penetrace povrchu serózy
- T1b – nádor je omezen na oba vejcovody, bez penetrace povrchu serózy
- T1c – nádor je omezen na jeden či oba vejcovody, se šířením až k/nebo skrz serózu vejcovodu, nebo s maligními buňkami v ascitu či peritoneálním výplachu
T2 – nádor postihuje jeden nebo oba vejcovod(y) se šířením do pánve
- T2a – šíření a/nebo metastázy do dělohy a/nebo vaječníků
- T2b – šíření na jiné pánevní struktury
- T2c – šíření do pánve (2a nebo 2b) s maligními buňkami v ascitu či v peritoneálním výplachu
T3 – nádor postihuje jeden nebo oba vejcovod(y), s implantací na peritoneum mimo pánev
- T3a – mikroskopické peritoneální metastázy mimo pánev
- T3b – makroskopické peritoneální metastázy mimo pánev 2 cm nebo méně v největším rozměru
- T3c – peritoneální metastázy větší než 2 cm v největším rozměru
Hodnocení regionálních mízních uzlin
Regionálními mízními uzlinami jsou pro vejcovody uzliny pánevní, paraaortální a ingvinální.
Pánevní uzliny: paracervikální, parametriální, hypogastrické (vnitřní ilické a obturatorní), společné a zevní ilické, presakrální a laterální sakrální.
Paraaortální uzliny: horní a dolní paraaortální a preaortální, horní a dolní parakavální a prekavální a horní a dolní interaortokavální.
NX – regionální mízní uzliny nelze hodnotit
N0 – v regionálních mízních uzlinách nejsou metastázy
N1 – metastázy v regionálních mízních uzlinách
Kritérium kategorie pN0
Pro stanovení pN je potřeba vyšetření vzorků z pánevní a/nebo paraaortální lymfadenektomie, které má standardně zahrnovat 10 a více mízních uzlin. Jsou-li mízní uzliny negativní, ale nebylo dosaženo standardně vyšetřovaného počtu, klasifikuje se jako pN0.
Hodnocení vzdálených metastáz
MX – vzdálené metastázy nelze hodnotit
M0 – nejsou vzdálené metastázy
M1 – vzdálené metastázy
Nejčastější místa vzdálených metastáz u karcinomu vejcovodu jsou shodná s karcinomem ovaria.
TNM a FIGO klasifikaci obsahují tabulky 2 a 3.
Table 2. Pro pokročilejší stadia v souvislosti s postižením lymfatických uzlin a vzdálenými metastázami platí, že TNM stadia odpovídají FIGO klasifikaci 
Table 3. Souhrn klasifikací TNM a FIGO 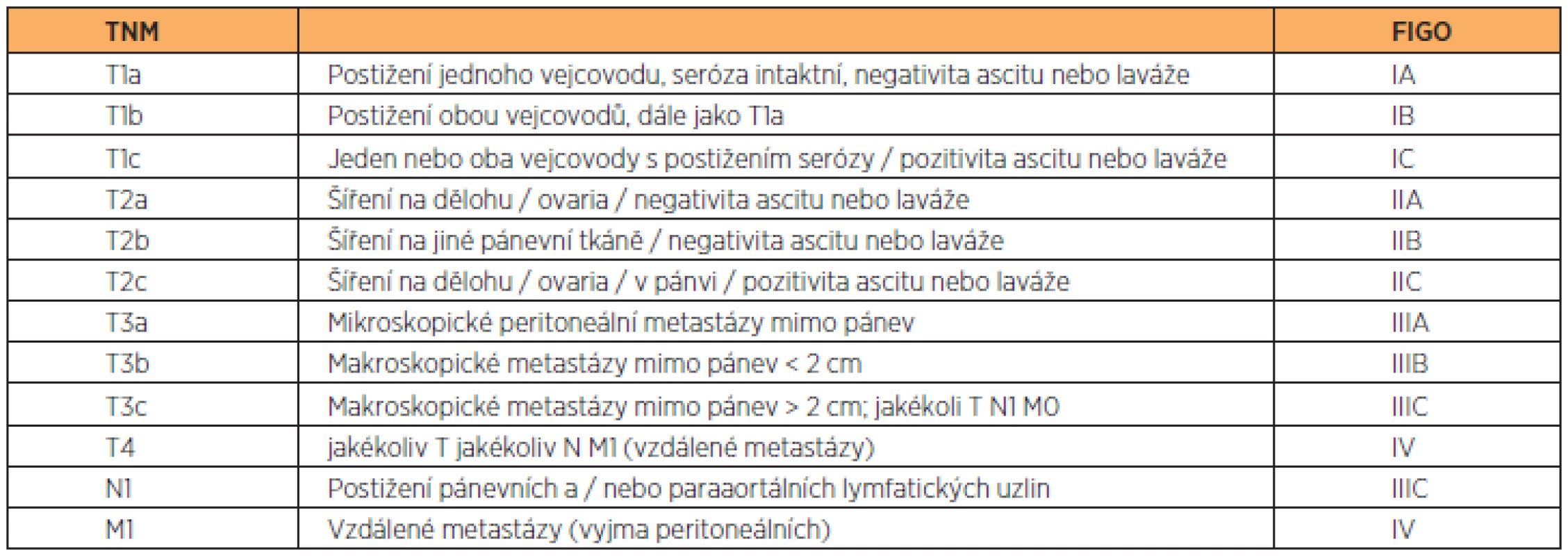
GENETICKÉ ASPEKTY ONEMOCNĚNÍ, VZTAH KARCINOMU VEJCOVODU KE GENETICKÝM MUTACÍM
Mnoho studií spojovalo diagnózu karcinomu vejcovodu s rodinným výskytem karcinomu ovaria. Jde o práce z devadesátých let ještě před objevem genu BRCA1 [21]. V roce 2000 byly potom dva případy karcinomu vejcovodu spojeny s abnormalitou tohoto genu [28]. Histopatologické vyšetření vejcovodů odstraněných v rámci profylaktické chirurgie familiárního ovariálního karcinomu ukazuje dysplastické a maligní změny přibližně u 50 % případů [16]. V jedné observační studii s vysokým rizikem ovariálního karcinomu (n = 87) byl zjištěn dysplastický tubární epitel u 37 % případů, zatímco pouze u jedné pacientky byla zjištěna dysplazie v epitelu inkluzní ovariální cysty. Jako možný byl dokonce postulován původ dysplazií ovaria v tubárním epitelu, který se sem dostane z vejcovodu [17]. Část nádorů vaječníku by pocházela z vejcovodu, což by zároveň vysvětlovalo i současný nepoměr mezi frekvencí výskytu obou těchto nádorů. V další studii byl v rámci profylaktické pánevní chirurgie u 3 ze 30 pacientek s vysokým rizikem vzniku familiálního ovariálního karcinomu diagnostikován karcinom vejcovodu (dvakrát in situ, jednou invazivní) [13]. Ačkoli je karcinom vejcovodu ve všeobecné populaci vzácným onemocněním, u nosiček mutací BRCA1 se počítá až se 120násobným zvýšením rizika vzniku [3]. Pacientky s diagnostikovaným karcinomem vejcovodu mají signifikantně vyšší nosičství zárodečných mutací genů BRCA1 a BRCA2. V jedné studii bylo 16 % ze 44 testovaných žen nosičkami zárodečných mutací a před 55. rokem života se jejich podíl zvýšil na 28 % [2]. Asociace karcinomu tuby s mutací BRCA genů je tedy častá. Následující praktické konsekvence těchto pozorování jsou logické:
- Ženy s karcinomem vejcovodu by měly projít testováním na přítomnost zárodečných mutací BRCA1 a BRCA2.
- Profylaktická chirurgie u nosiček mutací BRCA1 a BRCA2 by měla být směrována proti karcinomu ovaria a tuby. Vzhledem k přítomnosti intramurální části vejcovodu v děloze a k potenciálnímu riziku, které vyplývá z jeho přítomnosti, někteří autoři dokonce navrhují v rámci těchto profylaktických výkonů i provedení hysterektomie.
- Příbuzní pacientek s diagnostikovaným karcinomem vejcovodu mají vyšší riziko vzniku karcinomu prsu a vaječníku.
KLINICKÉ ASPEKTY
Záchyt časného stadia zhoubného nádoru vejcovodu je často náhodným nálezem. Karcinom vejcovodu sice nevyvolává typické příznaky, ale možnost časnější symptomatologie oproti karcinomu ovaria je pravděpodobnější, zejména když začíná nádor vejcovod obturovat. První známky onemocnění připomínají neurčitou adnexální afekci – tlak a bolest v podbřišku, často spojenou s metroragií a masivním vodnatým výtokem (hydrops tubae profluens) [20]. Při běžné gynekologické prohlídce je velmi obtížné toto onemocnění diagnostikovat a pacientky často přicházejí až s příznaky příznačnými pro pokročilejší onemocnění, tedy s pocitem plnosti, zácpou, zvětšujícím se objemem břicha (způsobeným nádorem nebo ascitem) a s neustupující únavou. Na primární nádor vejcovodu je tedy nutno pamatovat zejména u žen ve věku vyšším než 50 let při bolesti a tlaku v podbřišku, krvácení a vodnatém výtoku z pochvy a neurčitém palpačním nálezu.
Některé studie naznačují u karcinomu vejcovodu časnější postižení lymfatického systému a výraznější je též jeho afinita k oblasti para-aortálních lymfatických uzlin. Příkladem je studie zahrnující 19 pacientek, které podstoupily systematickou pánevní a paraaortální lymfadenektomii až k úrovni odstupu levé renální žíly. U 6 pacientek byla provedena systematická lymfadenektomie v rámci primární chirurgie a u 13 z nich byla provedena lymfadenektomie až po aplikované chemoterapii. Nodální postižení mělo 9 pacientek (4 v pánevní oblastia 8 v paraaortální oblasti) [6]. U pacientek s pozitivním nálezem v paraaortální oblasti byla nejčastěji postižena levá paraaortální skupina nad odstupem dolní mezenterické arterie (šestkrát), kde je i nejčastější sídlo metastáz u primárního karcinomu vejcovodu [6]. Při systematické paraaortální lymfadenektomii bývá také tato oblast na získaný počet uzlin nejvýtěžnější [25]. Ve vlastním souboru pacientek s primárním karcinomem vejcovodu (n = 13) toto pozorování potvrzujeme (Špaček, 2013, nepublikované výsledky). V rámci předoperačního stagingu považujeme za velmi důležité vyšetření se zaměřením na oblast retroperitonea (UZ, CT). Na retroperitoneální debulking můžeme být potom dopředu připraveni. Provedení systematické lymfadenektomie by mělo zahrnovat všechny oblasti pánevního a paraaortálního retroperitonea [25]. Aktuální problematikou v souvislosti s karcinomem vejcovodu/ovaria je i problematika profylaktické salpingektomie, podle některých autorů bez ovarektomie. Důvody k jejímu provedení jsou zmíněny v předchozím textu.
ZÁVĚR
V současné době lze říci, že došlo k zásadnímu posunu v náhledu na problematiku primárního karcinomu vejcovodu, jehož výskyt zřejmě nebude tak raritní, jak se původně předpokládalo. S časným stadiem onemocnění, které postihuje pouze vejcovod, se setkáváme vzácně. Naopak u pokročilých nádorů ovariálního původu není možné v rámci histopatologického vyšetření často určit primární místo vzniku, a zůstává tak otevřenou otázkou, jaký podíl těchto karcinomů má svůj skutečný původ v epitelu tuby. Tumorigenní potenciál (sliznice) vejcovodu je však mnohem vyšší a mnoho případů, které jsou diagnostikovány jako primární karcinomy ovaria, může mít svůj původ právě ve sliznici tuby. Lze tak usuzovat, že skutečná incidence karcinomu vejcovodu je mnohem vyšší. Na rozdíl od nádorů ovaria je u primárního karcinomu vejcovodu vyhraněnější genetická podmíněnost, a zejména pak jeho blízký vztah k zárodečným mutacím genu BRCA1. Z hlediska klinického nelze nezmínit výraznější afinitu tohoto onemocnění k postižení lymfatických uzlin, než je tomu u karcinomu vaječníku. Na samý závěr je však nutné konstatovat, že i vzhledem k anatomické blízkosti vejcovodu a ovaria budou tyto dvě jednotky vnímány stále společně, a i když se jisté rozdíly v některých aspektech zviditelňují, základní principy diagnostického a léčebného postupu zůstávají nadále stejné.
Práce vznikla za podpory grantu IGA MZ ČR: NT 14107, programu P37/11 a projektu LM2010004.
Doc. MUDr. Jiří Špaček, Ph.D., IFEPAG
Porodnická a gynekologická klinika
LF UK a FN
Sokolská 581
500 05 Hradec Králové
Sources
1. Alvarado-Cabrero, I., Stolnicu, S., Kiyokawa, T., et al. Carcinoma of the fallopian tube: Results of a multi-institutional retrospective analysis of 127 patients with evaluation of staging and prognostic factors. Ann Diagn Pathol, 2013, 17, p. 159–164.
2. Aziz, S., Kuperstein, G., Rosen, B., et al. A genetic and epidemiological study of carcinoma of the fallopian tube. Gynecol Oncol, 2001, 80, p. 341–345.
3. Brose, MS., Rebbeck, TR., Calzone, KA., et al. Cancer risk estimates for BRCA1 mutation carriers identified in a risk evaluation program. J Natl Cancer Indy, 2002, 94, p.1365–1372.
4. Cibula, D., Petruželka, L., et al. Onkogynekologie. Praha: Grada Publishing, 2009, s. 575–579.
5. D'Angelo, E., Prat, J. Classification of ovarian carcinomas based on pathology and molecular genetics. Clin Trans Oncol, 2010, 12, p. 783–787.
6. Deffieux, X., Morice, P., Thoury, A., et al. Anatomy of pelvic and para-aortic nodal spread in patients with primary fallopian tube carcinoma. J Am Coll Surg, 2005, 200, p. 45–48.
7. Finch, A., Shaw, P., Rosen, B., et al. Clinical and pathologic findings of prophylactic salpingo-oophorectomies in 159 BRCA1 and BRCA2 carriers. Gynecol Oncol, 2006, 100, p. 58–64.
8. Folkins, AK., Longacre, TA. Hereditary gynaecological malignancies: advances in screening and treatment. Histopathology, 2013, 62, p. 2–30.
9. Gadducci, A., Landoni, F., Sartori, E., et al. Analysis of treatment failures and survival of patiens with fallopian tube carcinoma: A Cooperative Task Force (CTF) study. Gynecol Oncol, 2001, 81, p. 150–159.
10. Hu, CY., Taymor, ML., Hertig, AT. Primary carcinoma of the fallopian tube. Am J Obstet Gynecol, 1950, 59, p. 58–67.
11. Kurman, RJ., Shieh, I. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer – shifting the paradigm. Hum Pathol, 2011, 42, p. 918–931.
12. Kurman, RJ., Vang, R., Junge, J., et al. Papillary tubal hyperplasia: the putative precursor of ovarian atypical proliferating (borderline) serous tumors, noninvasive implants, and endosalpingiosis. Am J Surg Pathol, 2011, 35, p. 1605–1614.
13. Leeper, K., Garcia, R., Swisher, E., et al. Pathologic findings in prophylactic oophorectomy specimens in high-risk women. Gynecol Oncol, 2002, 87, p. 52–56.
14. Medeiris, F., Muto, MG., Lee, Y., et al. The tubal fimbria is a preferred site for early adenocarcinoma in women with familial ovarian cancer syndrome. Am J Surg Pathol, 2006, 30, p. 230–236.
15. Moore, KN., Moxley, KM., Fader, AN., et al. Serous fallopian tube carcinoma: A retrospective, multi-institutional case-control comparison to serous adenocarcinoma of the ovary. Gynecol Oncol, 2007, 107, p. 398–407.
16. Piek, JM., vanDiest, PJ., Zweemer, RP., et al. Dysplastic changes in prophylactically removed fallopian tubes in women predisposed to developing ovarian cancer. J Pathol, 2001, 195, p. 451–456.
17. Piek, JM., Verheijen, RH., Kenemens, P., et al. BRCA 1/2-related ovarian cancers are of tubal origin: A hypothesis. Gynecol Oncol, 2003, 90, p. 49.
18. Prat, J. Ovarian carcinomas: five distinct diseases with different origins, genetic alterations, and clinicopathological features. Virchows Arch, 2012, 460, p. 237–249.
19. Sedlis, A. Carcinoma of the fallopian tube. Surg Clin North Am, 1978, 58(1), p. 121–129.
20. Sinha, AC. Hydrops tubae profluens as a presenting symptom in primary carcinoma of the fallopian tube. Br Med J, 1959, 2(5158), p. 976–982, p. 996–1001.
21. Sobol, H., Jacquemier, J., Bonaiti, C., et al. Fallopian tube cancer as a feature of BRCA1-associated syndromes. Gynecol Oncol, 2000, 78, p. 263–266.
22. Stewart, SL., Wike, JM., Foster, Sl., et al. The incidence of primary fallopian tube cancer in United States. Gynecol Oncol, 2007, 107, p. 392–397.
23. Špaček, J., Petera, J., Tesařík, Z. Význam klinických prognostických faktorů v léčbě ovariálního karcinomu. Čes Gynek, 2002, 67, s. 280–285.
24. Špaček, J., Jílek, P., Petera, J., et al. Histopatologické prognostické faktory, sérové markery a vybrané molekulárně bio-logické faktory u ovariálního karcinomu. Čes Gynek, 2002, 67, s. 343–349.
25. Špaček, J., Veselský, Z., Tošner, J., et al. Paraaortální lymfadenektomie v gynekologii. Teoretické principy, základní postupy a praktická doporučení. Čes Gynek, 2003, 68, p. 99–105.
26. Tavassoli, FA., Devilee, P. (eds.). World Health Organization Classification of Tumours. Pathology and genetics of tumours of the breast and female genital organs. Lyon: IARC Press, 2003, p. 203–216.
27. Vang, R., Shih, I., Kurman, RJ. Fallopian tube precursors of ovarian low - and high-grade serous neoplasms. Histopathology, 2013, 62, p. 44–58.
28. Zweemer, RP., van Diest, PJ., Verheijen, RH., et al. Molecular evidence linking primary cancer of the fallopian tube to BRCA1 germline mutations. Gynecol Oncol, 2000, 76, p. 45–50.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 6-
All articles in this issue
- Lze považovat i na začátku třetího tisíciletí primární karcinom vejcovodu za enigma?
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Jaký je aktuální stav diagnostiky vulvovaginálního dyskomfortuv České republice? Pilotní analýza
- Vezikouterinní vlasová píštěl osm let po císařském řezu – kazuistika
- Variabilita v načasování dělení lidských embryí monitorovaných systémem time-lapse v závislosti na věku pacientky
- Je diabetes mellitus rizikový faktor kvasinkového poševního zánětu?
- Proteiny rezistence LRP, Pgp,MRP1, MRP3 a MRP5 u pacientek s karcinomem ovaria
- Transuretrální aplikace polyacrylamid hydrogelu (Bulkamidu®) při léčbě ženské stresové inkontinence močia změny léčebného efektu v závislosti na čase od operace
- Incidence, etiologie a klinický význam trombocytopenie v graviditě
- Epidemiologie, etiologie a diagnostika nykturie
- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Vliv způsobu porodu na ženskou sexualitu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Vliv způsobu porodu na ženskou sexualitu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

