-
Medical journals
- Career
Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
Authors: P. Vítek 1; J. Strenková 2; E. Sedláčková 1; J. Barkmanová 1; J. Mužík 2; O. Louthan 1
Authors‘ workplace: Kooperativní skupina pro neuroendokrinní nádory o. s., Praha2 Institut biostatistiky a analýz, MU, Brno 1
Published in: Klin Onkol 2013; 26(4): 271-280
Category: Original Articles
Overview
Východiska:
Neuroendokrinní nádory se tradičně řadí ke „vzácným“ nádorovým onemocněním. Naproti tomu otázky diagnostiky, léčby a sledování nemocných s neuroendokrinními nádory jsou předmětem rostoucího zájmu, protože prevalence neuroendokrinních nádorů je vysoká. Neuroendokrinní nádory mají mnoho specifik vyžadujících důkladnou zpětnou vazbu na každou intervenci, tzn. sběr a centrální vyhodnocení dat. Kooperativní skupina pro neuroendokrinní nádory o. s. (KSPNN) realizuje od června 2009 registr neuroendokrinních nádorů. Po třech letech je cílem prvního shrnutí zjistit, zda je registr neuroendokrinních nádorů v současné podobě pro další období životaschopný a zda poskytuje účelné výstupy.Materiál a metody:
Registr neuroendokrinních nádorů shromažďuje anonymizované údaje o diagnostice, terapii a sledování nemocných s neuroendokrinními nádory jakékoliv lokalizace. Podmínkou vstupu do registru je morfologická diagnóza podle současné klasifikace WHO 2010, u diagnóz staršího data podle klasifikace WHO 2000. Registr je spravován Institutem biostatistiky a analýz Masarykovy univerzity (Brno). Iniciálně jsou analyzována data zadaná v období červen 2009–říjen 2012.Výsledky:
Podařilo se zaevidovat významnou část nositelů neuroendokrinních nádorů, 742 s validním záznamem, což je cca 14 % předpokládané prevalence. Zároveň v letech 2009 – 2011 registr pokrývá téměř čtvrtinu incidence v ČR. V morfologických diagnózách dominují nálezy s přívlastkem nespecifity – „NS“, na prvním místě „karcinoidní nádor NS“. Nespecifické diagnózy mají právě 3/ 4 subjektů. Výstupem je požadavek na bližší specifikace nálezu a separaci malobuněčného karcinomu, který se zásadně biologicky odlišuje od neuroendokrinního nádoru. Nápadná je polarita evidovaných stadií onemocnění, kdy více než 30 % tvoří stadia I a IV. Toto rozložení pravděpodobně souvisí se způsobem stanovení diagnózy, buď časně a náhodně, nebo pozdně při endokrinní symptomatologii, obvykle ve stadiu IV. Výběrové bias je evidentní.Závěr:
Údaje o terapii odrážejí současné trendy, dominanci chirurgické léčby včetně opodstatněných cytoredukčních výkonů, široké využití somatostatinových analog u pokročilých onemocnění a perzistující postavení chemoterapie u onemocnění s vyšším stupněm malignity. Rozložení terapie v populaci registru dokumentuje, že jsou následovány mezinárodní standardy (ENETS, ESMO, NCCN). Dynamika nárůstu nových subjektů potvrzuje životaschopnost registru. Registr ukazuje požadavek na dokonalé analýzy bioptického materiálu a účinnější typizaci onemocnění. Hlavní a reálný cíl pro další období je udržet trend v nárůstu hlášených dat se záměrem pokrytí většiny incidence.Klíčová slova:
neuroendokrinní nádor – karcinoid – malobuněčný neuroendokrinní karcinom – registr – klasifikace WHO 2010 – somatostatin – incidence – prevalenceÚvod
Neuroendokrinní nádory (NET) se tradičně řadí ke „vzácným“ nádorovým onemocněním. Naproti tomu otázky diagnostiky, léčby a sledování nemocných s NET jsou předmětem rostoucího zájmu. „Vzácnost“ se totiž vztahuje pouze k počtu diagnostikovaných onemocnění. V epidemiologii NET jsou patrná určitá specifika. Reálná incidence známá není. Většina NET pravděpodobně za života nemocného uniká diagnóze. Proti obvyklé incidenci 3 – 4/ 100 tis./ rok v evropské populaci se odhaduje počet nových onemocnění až na 8,4/ 100 tis./ rok. Odhad vychází z ojedinělé a těžko opakovatelné studie na pitvách z reprezentativního vzorku populace [1]. S pokroky v diagnostice lze ještě očekávat trvalý nárůst incidence. Rostoucí trend patrný je.V letech 1973 – 2007 incidence vzrostla koeficientem 3,6 v USA a 3,8 – 4,8 v Evropě [2,3]. Bezpochyby to souvisí vedle pokroku v diagnostice i s vývojem nomenklatury a klasifikace. V důsledku delšího přežívání nemocných je výrazný nepoměr incidence a prevalence. Prevalence ciferně přesahuje až 10násobek ročního počtu nových onemocnění, odhadem do 40/ 100 tis. Prevalence NET (diagnostikovaných za života) pak může být vyšší než prevalence epiteliálních nádorů žaludku a pankreatu dohromady, jak se již stalo v databázi SEER v USA [4,5]. Přitom výrazný podíl nemocných s NET vyžaduje trvalou léčbu nebo sledování. Z hlediska zdravotní péče pak NET nelze považovat za položku typu „vzácné“.
Kromě epidemiologie je ještě řada dalších specifik, která zasahují do léčby a sledování nemocných NET: neuroendokrinní původ je charakteristikou širší skupiny neoplazií, navíc z hlediska mikromorfologie poměrně komplikované. Recentně do jejich diagnostiky vnáší nový systém i nomenklaturu WHO klasifikace 2010 [6]. Nová klasifikace zatím nejlépe odráží prognózu onemocnění a dává dobrý podklad pro určení terapie i sledování nemocných. Hlavní změny jsou tyto:
- Nomenklaturu upravuje poměrně výrazně, zvláště tím, že termín „neuroendokrinní nádor (tumor)“ – NET – omezuje pouze na grading 1 a 2.
- Zavádí souhrnný termín „neuroendokrinní neoplazie“ – NEN – pro všechny stupně gradingu.
- Termín „karcinoid“ úplně mizí z oblasti gastroenteropankreatické.
Pokroky v terapii, rozšíření analog somatostatinu a nástup biologické terapie (tyrosinkinázových inhibitorů) prodlužují periodu léčby a sledování. Až recentně přibývají reprezentativní klinické studie, které jsou základem pro léčebné standardy vyžadované mnohdy přeceňovaným principem „medicíny založené na důkazech“. Tradiční modality, zejména chirurgie, ale také chemoterapie stále udržují své postavení v terapii. Až koncem předchozího desetiletí se vyvíjejí mezinárodní standardy diagnostiky a terapie, včetně standardů Evropské společnosti pro neuroendokrinní nádory (ENETS). Je přinejmenším vhodné je následovat.
Je evidentní, že skupina onemocnění typu NET má tolik specifik, že zaslouží důkladnou zpětnou vazbu na každou intervenci, tzn. sběr a centrální vyhodnocení diagnostických, léčebných i následných dat. I v malé populaci, jako má ČR, bude přínosná deskriptivní statistika a retrospektivní analýza. Flexibilní a parametrický sběr potenciálně umožní i kompatibilitu s podobnými datovými registry v rámci EU.
Dne 22. 4. 2008 bylo založeno občanské sdružení Kooperativní skupina pro neuroendokrinní nádory (KSPNN). Členy tohoto sdružení jsou odborníci zabývající se diagnostikou, léčbou a výzkumem v oblasti NET. Sdružení navazuje na desetiletou tradici předchozí „karcinoidové skupiny“. Cílem činnosti sdružení je dále sjednotit diagnostické a léčebné postupy, vytvořit konzultační centra, dále prosazovat a provádět druhé určení morfologické diagnózy na referenčním pracovišti a vytvořit registr neuroendokrinních nádorů na území ČR. Tento cíl se během následujících tří let stal hlavní činností sdružení [7].
Po třech letech prezentujeme první shrnutí získaných dat. Přirozeně iniciálním cílem je deskriptivní statistika a zpětná vazba zaměřená více na metodiku registru samotného než na diagnostické a terapeutické zásady. Možnosti analýzy léčebných výsledků jsou zatím minimální. Shrnutí by mělo přinejmenším odpovědět na otázku, zda je registr NET v současné podobě do dalšího období životaschopný.
Metodika
Registr NET iniciovaný KSPNN je veden od června roku 2009. Má sponzorskou podporu. KSPNN jako profesní společnost odpovídá za etiku a účelnost sběru dat a vedení registru. Data jsou vlastnictvím jednotlivých participujících pracovišť, KSPNN rozhoduje o použití a zpracování společných výstupů z registru. Registr je provozován Institutem biostatistiky a analýz Masarykovy univerzity (v Brně) (IBA MU), který je odpovědným správcem technologického řešení a garantuje dostupnost služby.
Registr NET shromažďuje anonymizované údaje o diagnostice, terapii a sledování nemocných s neuroendokrinními nádory jakékoliv lokalizace. Podmínkou vstupu do registru je stanovená diagnóza nádorového onemocnění, které se řadí do skupiny neuroendokrinních neoplazií (NEN) podle současné klasifikace WHO 2010. Není žádné omezení stadiem onemocnění, průběhem onemocnění a léčbou. Do registru lze hlásit i onemocnění post mortem, podmínkou je přežívání do roku 2011.
Sběr dat probíhá výhradně elektronicky, cestou formuláře na stránkách http:/ / net.registry.cz.
K zadávacímu formuláři má přístup pouze lékař, který se podílí na diagnostice, terapii nebo sledování nemocných s NET a jehož totožnost a příslušnost byla ověřena správcem registru. Přístup je chráněn přihlašovacím jménem a heslem.
Formulář pro vkládání údajů je členěn na sekci administrativních dat, sekci deskriptivních dat určujících demografické údaje, iniciální diagnózu, rozsah onemocnění a přehled diagnostiky, sekci dat určujících postupně aplikovanou terapii a sekci dat ze sledování nemocného. Formuláře odpovídají konceptu dlouhodobého sledování nemocného a sledování parametrů stavu onemocnění a průběžně se měnící terapie.
Ke shromážděným datům má přístup pouze určený pracovník IBA MU. Výstupy z registru jsou dostupné pro lékaře KSPNN, a to pouze se souhlasem výboru KSPNN. Publikační výstupy jsou podmíněny souhlasem výboru KSPNN. Nositel oprávnění (přístupu) ke vkládání dat sám zodpovídá za správnost všech vložených dat. Jeho odborná erudice se předpokládá na základě identifikace a příslušnosti k pracovišti. Nemocní podepisují informovaný souhlas se zařazením do registru a se zpracováním osobních údajů, přirozeně s výjimkou případů zadávaných post mortem.
Výsledky
V období říjen 2009–říjen 2012 bylo do registru nahlášeno 774 subjektů, z toho 32 s nevalidním záznamem. Předmětem základních statistik může být 742 subjektů – pacientů.
Dynamika hlášení diagnóz
Do registru byla nahlášena onemocnění diagnostikovaná v rozmezí 16 let. Nejstarší diagnóza je z roku 1996. Počet diagnóz z následujících let kontinuálně stoupá a za roky 2009 – 2011 počty diagnóz dosahují 95 – 115 případů (graf 1). Při odhadované incidenci NET v zemích EU a USA cca 4/ 100 tis. byla do registru hlášena cca čtvrtina nově diagnostikovaných onemocnění. Data za rok 2012 nejsou ještě uzavřena. Prevalenci NET lze v ČR jen odhadovat. Prevalence GEP NET je v zemích EU a v USA odhadována na 35/ 100 tis. [6,8]. Odhady prevalence pro bronchiální a plicní NET nejsou [9]. Pokud by bronchiální NET navýšily prevalenci o 1/ 100 tis., pak se dá v populaci ČR prevalence odhadovat na 4 500 nositelů diagnózy NET.
Graph 1. Rozdělění podle data diagnózy. 
V registru je hlášeno 616 žijících nemocných, 98 zemřelých a 28 je ztraceno ze sledování při stavu neznámém. V současné době registr pokrývá odhadem 14 % populace NET.
V registru je hlášeno datum prvních příznaků onemocnění a datum stanovení diagnózy. Interval mezi příznaky a datem diagnózy lze určit u 568 nemocných, u 174 není datum příznaků určeno nebo onemocnění bylo asymptomatické. Rozložení intervalů není gaussovské. Průměr 252 dní je více než trojnásobek mediánu, který dosahuje 75 dní a lépe vypovídá o době do diagnózy. Nejdelší interval je přes 17,5 roku (graf 2).
Graph 2. Rozdělení podle intervalu mezi prvními příznaky a stanovením diagnózy. 
Regionální účast v registru
Při rozdělení předmětného území ČR podle krajů, které odpovídá uspořádání odborných center v krajských a fakultních nemocnicích, je patrná určitá nehomogenita poskytování dat do registru (obr. 1, graf 3). Hlavní město Praha poskytuje 21 % dat, Královéhradecký kraj poskytuje 1,8 % dat. Počet ohlášených subjektů podle příslušnosti do regionu, kraje je od 2 do 12,5/ 100 tis. [průměr 6,9 (SD = 3,0), medián 7,5]. Rozložení je normální (D‘Agostino ‑ Pearson test). Nejvíce ohlášených subjektů je v regionech Praha a Jihočeský kraj, více než 1/ 4 odhadované prevalence. Při porovnání příslušnosti k regionu (bydliště) a původu hlášení (pracoviště) je patrná centralizace subjektů zejména na pracoviště v Praze a v Brně.
Image 1. Regionální účast v registru. 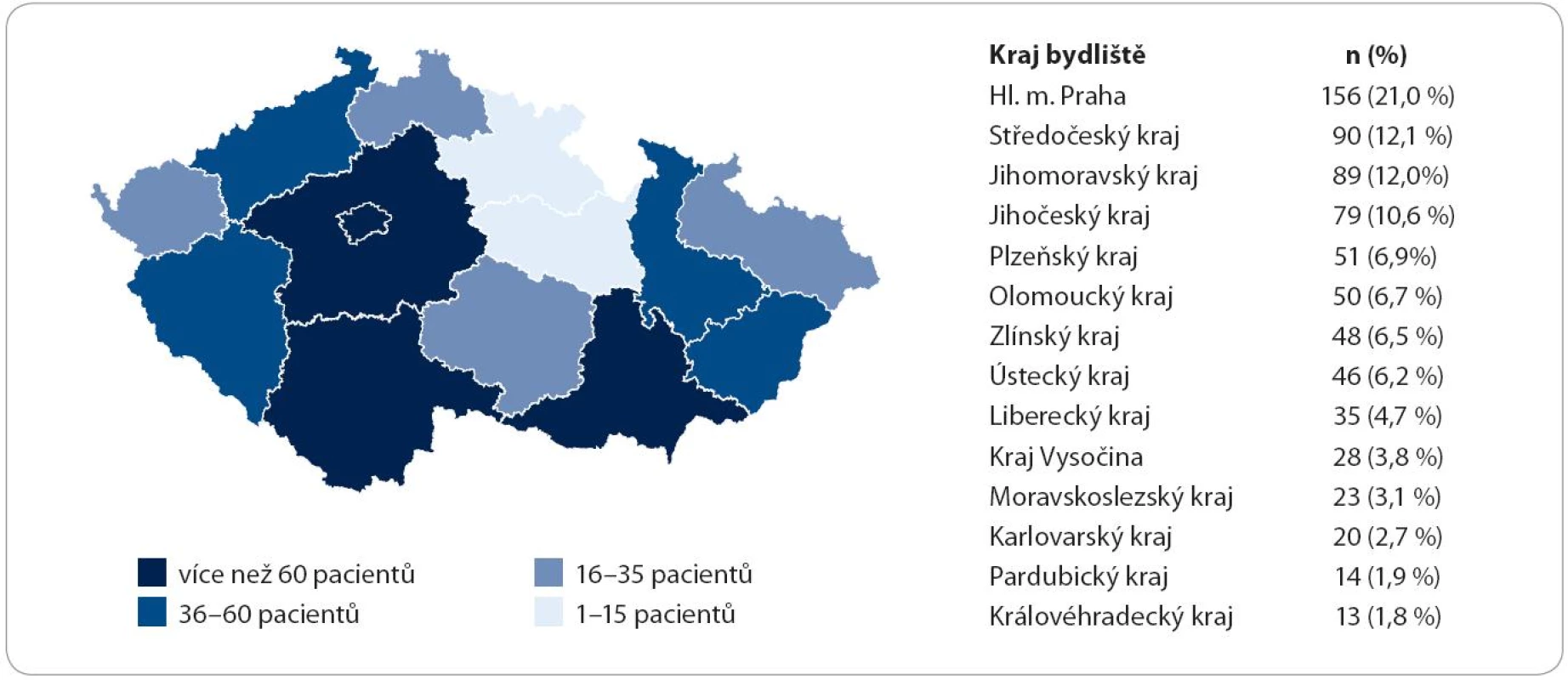
Graph 3. Porovnání dat počtu obyvatel regionů a počtu hlášení z regionů. 
Morfologie
742 registrovaných pacientů s validním záznamem má morfologickou diagnózu (graf 4).
Graph 4. Rozložení morfologických diagnóz. 
Nejčetnější kódy morfologických nálezů s četností nad 50 případů jsou:
- karcinoidní nádor NS M8240/ 3, n = 389 (52,4 %);
- karcinoidní nádor o nejistém maligním potenciálu M8240/ 1 (vázaný k lézím apendixu), n = 102 (13,7 %);
- neuroendokrinní karcinom NS M 8246/ 3,n = 66 (8,9 %);
- malobuněčný karcinom NS M8041/ 3, n = 54 (7,3 %), který se řadí do skupiny neuroendokrinních neoplazií (NEN), ale svým maligním potenciálem nespadá do sledované oblasti NET (neuroendokrinní karcinom grade 3 podle klasifikace WHO 2010).
Tyto čtyři skupiny zahrnují celkem 82,3 % všech subjektů registru. Další skupiny, které zahrnují detailněji typizované nádory nebo vzácnější nádory (inzulinom, gastrinom) tvoří úhrnem 17,6 % souboru a četnosti jsou malé.
V rámci morfologické diagnózy je referován mitotický index proliferační index Ki67. Nálezy jsou referovány u cca poloviny subjektů (46,6 %, resp. 58,7 %). Převažuje nízký mitotický index (< 2) a nízký index Ki67 (v rozmezí 2 – 20).
Lokalizace hlášených diagnóz
Pět nejčastějších lokalizací hlášených neoplazií je podle četnosti v sestupném pořadí: tlusté střevo C18, bronchus a plíce C34, tenké střevo C17, pankreas C25 a žaludek C16 (diagram četnosti, graf 5). Tyto lokalizace tvoří úhrnem 77,1 % hlášených subjektů. Toto rozložení není z hlediska patofyziologie NET jednoznačně deskriptivní. Do skupiny C18 se řadí i lokalizace C18.1 apendix. C34 zahrnuje i neoplazie s histologickým kódováním M8041/ 3 – malobuněčný karcinom.
Graph 5. Lokalizace hlášených diagnóz. 
Stadium onemocnění v době diagnózy
Rozložení stadií (graf 6) je nehomogenní, polarizované – největší podíl tvoří onemocnění st. IV a st. I, 36,7 %, resp. 30,7 %, pouze u 8 % záznamů je stadium onemocnění hodnocené jako „neznámé“.
Graph 6. Rozložení stadií hlášených onemocnění. 
Příznaky a komplikace onemocnění
Klinické projevy endokrinní aktivity (včetně karcinoidního syndromu) jsou hlášené u 172 subjektů (23,2 %), ostatní jsou hlášené jako explicitně nefunkční (67,8 %) nebo jako neznámé. U 3 % subjektů je hlášené karcinoidní srdeční onemocnění, tzn. 14 % z celkového počtu funkčních onemocnění.
Terapie
Shromážděná data o terapii jsou relevantní primárním lokalizacím NET a rozložení stadií v době diagnózy. Tři údaje vypovídají o terapii, která je nyní v ČR běžná a považovaná za standardní: kurativní chirurgický výkon byl realizován u 53,2 % subjektů, analogy somatostatinu bylo nebo je léčeno 31,3 % a chemoterapii mělo 19,5 % subjektů (u jednoho subjektu se může uplatnit i více léčebných modalit). Ostatní léčebné modality jako jiná biologická léčba (např. everolimus), radionuklidy a ablační metodiky (radiofrekvenční ablace) mají méně než 5 % subjektů (graf 7, tab. 1).
Graph 7. Terapie aplikovaná u hlášených NET, rozdělení podle modalit. 
Table 1. Rozdělení medikamentózní terapie. 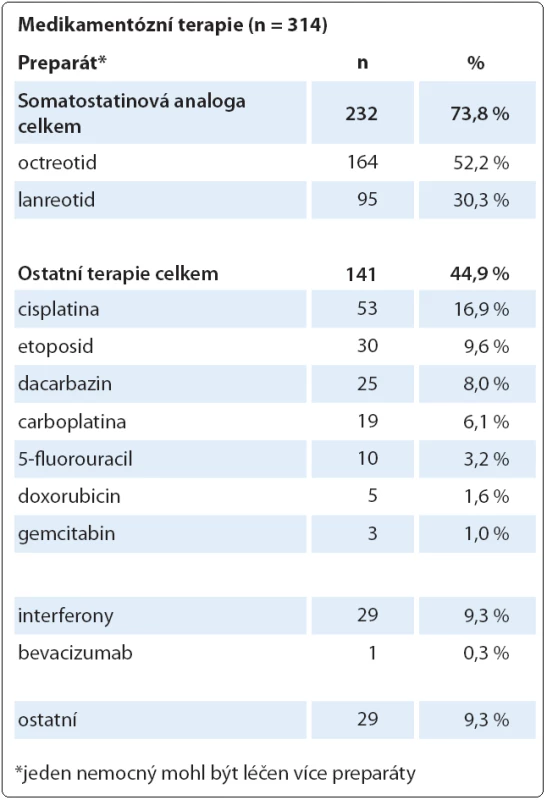
Diskuze
Shrnujeme výsledky po třech letech vedení registru. Za relativně krátkou dobu vedení se v registru podařilo zaevidovat významnou část nositelů NET – cca 14 % předpokládané prevalence a v letech 2009 – 2011 téměř čtvrtinu incidence. Tyto počty jsou zatím daleko od úplné evidence, na niž si ale zájmově pojatý, dobrovolný registr těžko může po pouhých třech letech dělat ambice. Pro potenciální výstupy z registru je ale podstatné, že již nyní představuje dostatečně reprezentativní vzorek pro odhady rozložení typizace nádorů, stadií onemocnění a užívané terapie. Pro další období představuje vzorek pro hodnocení způsobu a efektu terapie. To ostatně bylo a je primárním cílem vedení registru. Tato předběžná analýza by měla hodnotit možnosti vedení registru a dát podklady pro případné korekce ve sběru dat.
V morfologických diagnózách, resp. histologických nálezech, dominují nálezy s přívlastkem nespecificity, NS, na prvním místě je to karcinoidní nádor NS. Úhrnem tvoří podíl nespecifických diagnóz včetně karcinoidního nádoru o nejistém maligním potenciálu právě 75 % registrovaných onemocnění. Podobnou převahu nespecifických nálezů referuje v Evropě i registr Norska, který za období 1993 – 2004 shromáždil 2 030 subjektů v populaci cca 5 mil., a představuje tak více reprezentativní výběr než počínající registr ČR [10].
V tomto významném podílu je prostor pro další typizaci. Hypoteticky mohou být zahrnuty NET specifického obrazu, jehož rozlišení má význam při rozhodování o terapii, i když zatím se otázka volby terapie může zaměřovat hlavně na rozlišení analoga somatostatinu vs chemoterapie. Při nástupu dalších prostředků biologické terapie, zvláště inhibitorů angiogeneze a multikinázových inhibitorů, bude ale bližší typizace nabývat na významu.
Z hlediska účelu vedení registru je diskutabilní i zahrnutí diagnózy malobuněčného karcinomu. Svou prognózou, agresivitou růstu a také možnostmi terapie se dostává mimo oblast NET, pro kterou je vedený registr primárně určen.
Problém se odráží i ve vývoji WHO klasifikace a nomenklatury neuroendokrinních nádorů až do poslední verze z roku 2010 [6]. V poměrně složité nomenklatuře se klade důraz na stanovení gradingu. Zároveň se starý termín karcinoid (v oblasti gastroenteropankreatické již neužívaný) a nový termín neuroendokrinní nádor (tumor) – NET – vztahují pouze k novotvarům grade 1 a 2, zatímco novotvary grade 3 se specifikují termínem „neuroendokrinní karcinom grade 3“. Naproti tomu i novotvary grade 1 a 2 lze v plicní a brochiální oblasti označit termínem „neuroendokrinní karcinom grade 1 a grade 2“, a dokonce „typický karcinoid“ – grade 1, resp. „atypický karcinoid“ – grade 2 (podle klasifikace WHO 2004, resp. klasifikace WHO 2010) [6,11]. Tyto nejasnosti vedly k zavedení pojmu „neuroendokrinní neoplazie“ – NEN – , který zahrnuje léze všech gradingů. Neuroendokrinní karcinom grade 3 odpovídá malobuněčnému karcinomu stejně dobře pojmenovatelnému jako „NEN grade 3“. Je tedy patrné, že z hlediska morfologického malobuněčný karcinom do registru patří, a dokonce by pak byl pro registr vhodnější název „registr NEN“ namísto „registr NET“. Naopak z klinického hlediska malobuněčný karcinom svou problematikou diagnostiky a terapie do vedeného registru nepatří. Zdá se proto účelné malobuněčný karcinom v registru evidovat, ale separátně.
Malá účelnost zařazení malobuněčného karcinomu do registru NET (lépe asi NEN) je patrná, pokud se porovná pětileté přežívání nemocných (tzn. srovnání pětiletého přežívání u neuroendokrinního ca grade 3 vs grade 1): U „typického karcinoidu“ bronchopulmonální oblasti je 87%, u malobuněčného karcinomu je 3 – 5%. Pokud registr eviduje 132 subjektů s lokalizací NET v oblasti bronchu a plíce a zároveň 54 subjektů s morfologickou diagnózou malobuněčného karcinomu (M8041/ 3), pak není malobuněčný karcinom zastoupen proporcionálně a pro potenciální analýzu klinických parametrů včetně výsledků terapie vznikne bias. V evropských zemích a Severní Americe totiž obvykle z celkového počtu bronchopulmonálních nádorů NET tvoří do 1 – 3 % a malobuněčný karcinom do 10 %. Z celkového počtu bronchopulmonálních NEN tvoří malobuněčný karcinom 85 % [12,13]. I proto bude vhodné dále malobuněčný karcinom v registru evidovat, ale přinejmenším separovat.
V lokalizaci hlášených NET má největší podíl tlusté střevo. Z hlediska biologie NET je zásadní odlišit lokalizaci apendixu od tlustého střeva. Při použití číselné klasifikace MKN ‑ 10 je přirozeně apendix součástí tlustého střeva kódem C18.1. Podle četnosti morfologické diagnózy M8240/ 1, která je přímo vázaná k apendixu, je patrné, že 2/ 3 lokalizací v oblasti tlustého střeva do oblasti apendixu spadají. V registraci NET a dalších analýzách pak bude vhodné v MKN ‑ 10 separovat kód C18.1 a vést jej jako lokalizaci se specifickou biologií. Mj. NET apendixu je dobře specifikován separátním morfologickým kódem v klasifikaci WHO 2010, je tudíž logické separátně specifikovat i topografii, byť v systému MKN ‑ 10 je to možné až užitím subklasifikace. Pokud separujeme podle morfologických kódů malobuněčný karcinom z lokalizace bronchiálních nádorů a NET apendixu z lokalizace tlustého střeva, celkově se změní pořadí četnosti diagnóz do více očekávaného tvaru: 1. tenké střevo (n = 126), 2. – 3. pankreas (n = 102), apendix (n = 102), 4. bronchus a plíce (n = 78), 5. žaludek (n = 60), 6. tlusté střevo (n = 50). Zůstává pak jen neobvykle vysoká evidence lokalizací NET v pankreatu. NET rekta zůstávají pak až na 7. místě (n = 31), což může být poněkud překvapivý nález. Nicméně zastoupení NET podle topografie podléhá při srovnání různých registrů Evropy a USA významné variabilitě. Incidence se u jednotlivých lokalizací liší významně, i více než 10násobně, např. právě u rekta (1,05/ 100 tis. USA vs 0,1/ 100 tis. Itálie, colon 0,4/ 100 tis. USA, 0,06/ 100 tis. Rakousko) [14]. Je to zřejmě důsledkem malé reprezentativnosti dílčích údajů z registrů pokrývajících malou část populace.
Stadium onemocnění v době diagnózy je stanovené u 91,8 % hlášených subjektů. V registru jsou zahrnuté diagnózy stanovené od roku 1996. Stadium je proto určené podle různých pravidel určování. Separátní systém určení klinického stadia NET lze aplikovat až od roku 2009 [15]. V předchozím období tudíž bylo stadium onemocnění určené podle zásad pro nádory typu karcinomu relevantní lokalizace, nicméně zásady pro určení stadia IV jsou stejné a nemění se. Nápadná je polarita evidovaných stadií onemocnění, kdy stadium I i stadium IV tvoří každé podíl větší než 30 %. Toto rozložení pravděpodobně souvisí se způsobem stanovení diagnózy: buď časná náhodná diagnóza v resekátu (NET apendixu), nebo až pozdní diagnóza při prezentaci endokrinních příznaků, obvykle ve stadiu IV. Podobné výsledky byly referovány i v registru NET Španělska (R ‑ GETNE) [16] a vysoký podíl pokročilých stadií (44 %) se přičítá převaze referující odbornosti, jíž je klinická onkologie, která se zabývá léčbou pokročilých stadií, a ta to ohlašuje v registru. Tato evidentní výběrová bias se v počátku registru může uplatňovat i v ČR. V registru USA – SEER – je patrné rovnoměrné rozložení stadií a nižší frekvence pokročilých stadií IV (21 %), podobné rozložení v evropských zemích je patrné např. v registru Norska [10]. Nicméně tyto registry mají ve srovnání s počínajícím registrem NET v ČR zásadně delší historii a podléhají menší výběrové bias.
Podíl symptomatických onemocnění 23,2 % souvisí s rozložením stadií i s primární lokalizací. Srovnání s frekvencí symptomatických NET cca 10 % udávané v literatuře [17] je obtížné a podléhá významné bias vlivem referující odbornosti. Pokud referují především onkologové a endokrinologové, kteří léčí pokročilá stadia onemocnění, podíl symptomatických onemocnění stoupá. Této bias podléhají i některé údaje referované v literatuře, které nepocházejí z reprezentativních vzorků populace typu registru a dosahují vysokých hodnot, až 74 % [18]. Přínosný je údaj o výskytu karcinoidního srdečního onemocnění, jehož frekvence se výrazně snižuje v souvislosti se širokým užíváním somatostatinových analog v evropských zemích a USA na hodnotu 10 – 15 % [19]. Zjištěná frekvence 14 % z celkového počtu funkčních onemocnění v registru ČR je relevantní.
Údaje o terapii odrážejí současné trendy v terapii NET, dominanci chirurgické léčby včetně opodstatněných cytoredukčních výkonů, široké využití somatostatinových analog u pokročilých onemocnění a perzistující postavení chemoterapie u onemocnění s vyšším stupněm malignity. Rozložení terapie dobře koreluje s morfologickými nálezy, stadiem onemocnění i s primární lokalizací nádoru. Lze uvést některé jasné vazby: chemoterapie cisplatinou (n = 53) je relevantní frekvenci malobuněčného karcinomu (n = 54), terapie somatostatinovými analogy (n = 232) je relevantní klinickému stadiu IV (n = 267), kurativní chirurgický výkon (n = 395) je relevantní lokalizacím tlustého střeva (včetně apendixu), rekta a žaludku (n = 243) nebo stadiím I – III (n = 470). Rozložení terapie v populaci registru s dominancí chirurgické léčby a somatostatinových analog dokumentuje, že jsou následovány standardy podle mezinárodních doporučení (ENETS, ESMO, NCCN). Až překvapivě podobné (téměř identické) je rozložení terapie ve španělském registru (R ‑ GETNE) [16]u podobně četného vzorku populace NET (n = 837). Určité zkreslení údajů představuje již zmíněné zařazení diagnózy malobuněčného karcinomu, u kterého přirozeně zůstává chemoterapie jako jediná léčebná volba.
Závěr
V současné době není sběr dat do registru dostatečně dlouhý na to, aby bylo možné hodnotit prognostické parametry, účinnost terapie a data přežívání. V tomto směru zatím nelze uskutečnit rigorózní analýzy. Primární analýza, spíše soubor deskriptivních ukazatelů, ale po třech letech fungování registru poskytuje výstupy přínosné pro samotné vedení registru v dalším období. Registr vypovídá o rozložení morfologických obrazů, primárních lokalizací onemocnění a frekvenci symptomů, resp. komplikací, které je relevantní populacím v Evropě a USA. Současně vypovídá o užití terapie podle odborných standardů EU, a to s pozitivními výstupy, jako např. udržení nízké frekvence karcinoidního srdečního onemocnění. Registr ukazuje požadavek na dokonalé analýzy bioptického materiálu a účinnější typizaci onemocnění. Data podporují metodiku druhého čtení bioptického materiálu na referenčním pracovišti. V registru lze doporučit další registraci, ale zároveň oddělení diagnózy malobuněčného karcinomu plic, který se sice řadí k neuroendokrinním neoplaziím, nicméně podléhá zcela jiným zásadám diagnostiky a terapie. K úvaze je i úprava názvu registru (z NET na NEN) v souvislosti s nyní platnou nomenklaturou. Registr je životaschopný a hlavním požadavkem je udržet trend v nárůstu hlášených dat s cílem pokrytí většiny incidence a prevalence.
Podíly na autorství
Jakékoliv výstupy z registru vznikají na základě dat, jimiž přispěli kolegové z následujících pracovišť:
Onkologická klinika 1. LF UK a VFN v Praze; IV. interní klinika 1. LF UK a VFN v Praze; Onkologické oddělení, Nemocnice České Budějovice a. s.; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno; Onkologická klinika 2. LF UK a FN v Motole, Praha; Onkologická klinika LF UP a FN Olomouc; Oddělení klinické onkologie, Krajská nemocnice T. Bati, a. s., Zlín; Klinika TRN LF UK a FN Plzeň; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno; Oddělení radiační a klinické onkologie, Krajská nemocnice Liberec, a. s.; Interní hematologická a onkologická klinika LF MU a FN Brno; Onkologické a radioterapeutické oddělení LF UK a FN Plzeň; Oddělení klinické onkologie, Slezská nemocnice v Opavě, p. o.; Institut onkologie a rehabilitace Na Pleši s. r. o., Nová Ves pod Pleší; Klinika onkologie a radioterapie LF UK a FN Hradec Králové; Oddělení klinické a radiační onkologie, Pardubická krajská nemocnice, a. s.; Interní oddělení, Šumperská nemocnice a. s.; Interní gastroenterologická klinika LF MU a FN Brno; III. interní klinika LF UP a FN Olomouc; Radioterapeutická a onkologická klinika 3. LF UK a FN Královské Vinohrady, Praha; Ústav radiační onkologie, Nemocnice Na Bulovce, Praha; Onkologická klinika 1. LF UK a ÚVN – VFN Praha.
Podpořeno Kooperativní skupinou pro neuroendokrinní nádory, o. s.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Pavel Vítek, Ph.D.
Kooperativní skupina pro neuroendokrinní nádory o. s.
U Nemocnice 2
128 08 Praha 2
e-mail: p-vitek@email.cz
Obdrženo: 21. 3. 2013
Přijato: 25. 4. 2013
Sources
1. Berge T, Linell F. Carcinoid tumors: Frequency in a defined population during a 12‑year period. Acta Pathol Microbiol Scand A 1976; 84(4): 322 – 330.
2. Lawrence B, Gustafsson BI, Chan A et al. The epidemiology of gastroenteropancreatic neuroendocrine tumors. Endocrinol Metab Clin North Am 2011; 40(1): 1 – 18.
3. Ellis L, Shale MJ, Coleman MP. Carcinoid tumors of the gastrointestinal tract: trends in incidence in England since 1971. Am J Gastroenerol 2010; 105(12): 2563 – 2569.
4. The NET Alliance [homepage on the Internet]. Prevalence of NET: More common than one might think, 2011. Available from: http:/ / www.neuroendocrinetumor.com/ health ‑ care‑professional/ prevalence ‑ of ‑ nets.jsp.
5. Balmadrid BL, Thomas CM, Coffman CJ et al. Factors associated with survival of veterans with gastrointestinal neuroendocrine tumors. J Cancer Epidemiol. In press 2012; 2012 : 986708.
6. Hamilton SR, Aaltonen LA (eds). Pathology and genetics of tumors of the digestive system, World Health Organization Classification of Tumors, Pathology and Geetics of Tumors of the Digestive System. Lyon: IARC 2010.
7. Barkmanová J (ed.). Historie registru neuroendokrinních nádorů v České republice. Praha: Farmakon Press 2007 : 5 – 7.
8. Oberg K, Akerström G, Rindl G et al. Neuroendocrine gastroenteropancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2010; 21 (Suppl 5): v223 – v227.
9. Oberg K, Hellman P, Kwekkeboom D et al. Neuroendocrine bronchial and thymic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2010; 21 (Suppl 5): v220 – v222.
10. Hauso O, Gustafsson BI, Kidd M et al. Neuroendocrine tumor epidemiology: contrasting Norway and North America. Cancer 2008; 113(10): 2655 – 2664.
11. Moran CA, Suster S, Coppola D et al. Neuroendocrine carcinomas of the lung: a critical analysis. Am J Clin Pathol 2009; 131(2): 206 – 221.
12. Gustafsson BI, Kidd M, Chan A et al. Bronchoplumonary neuroendocrine tumors. Cancer 2008; 113(1): 5 – 21.
13. The US National Cancer Institute [homepage on the Internet]. Surveillance Epidemiology and End Results (SEER) data base, 1973 – 2004. Available from: http:/ / seer.cancer.gov/ 2007.
14. Fraenkel M, Kim M, Faggiano A et al. The increasing incidence of gastroenteropancreatic neuroendocrine tumors arend the world: a systematic review of the literature. 10th Annual Conference for the Diagnosis and Treatment of Neuroendocrine Tumor Disease, Barcelona 6. – 8. 3. 2013 : 47.
15. ÚZIS ČR [internetová stránka]. Ústav zdravotnických informací a statistiky ČR. TNM klasifikace zhoubných nádorů. Česká republika 2011. Dostupné z: http:/ / www.uzis.cz/ katalog/ klasifikace/ tnm ‑ klasifikace ‑ zhoubnych ‑ novotvaru.
16. Garcia ‑ Carbonero R, Capdevilla J, Crespo ‑ Herrero G et al.Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP ‑ NETs): results from the National Cancer Registry of Spain (RGETNE). Ann Oncol 2010; 21(9): 1794 – 1803.
17. Feldman JM. Carcinoid tumors and the carcinoid syndrome. Curr Probl Surg 1989; 26(12): 835 – 85.
18. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128(6): 1717 – 1751.
19. Bhattacharya S, Toumpanakis C, Burke M et al. Features of carcinoid heart disease identified by 2 - and 3 - dimensional echocardiography and cardiac MRI. Circ Cardiovasc Imaging 2010; 3(1): 103 – 111.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 4-
All articles in this issue
- Moderní zobrazovací techniky pro antracyklinová cytostatika – literární přehled
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Karcinom pankreatu a faktory životního stylu
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Je ten istý tyrozín- kinázový inhibítor efektívny aj po vzniku mozgových metastáz? Kazuistika
- Týdenní vs dvoutýdenní aplikace cetuximabu v léčbě metastatického kolorektálního karcinomu – aktuální klinická data
- Dimenze onkochirurgie
- Synchronní bilaterální testikulární tumor ze zárodečných buněk: kazuistika a přehled literatury
-
Onkologie v obrazech
Giant Metastatic Testicular Tumor
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

