-
Medical journals
- Career
Maligní nádory vulvy
: Luboš Minář; J. Kümmel; Josef Chovanec
: Gynekologicko-porodnická klinika LF MU a FN Brno
: Prakt Gyn 2009; 13(3): 148-152
Zhoubné nádory vulvy tvoří 3–4 % gynekologických malignit. Mohou být úspěšně léčeny, a pokud jsou zachyceny v raném stadiu, jsou často kurabilní. Spinocelulární karcinom vulvy (tvoří přibližně 90 % případů) se etiopatogeneticky dělí na dva základní typy. Typ I je asociován s HR-HPV infekcí a rizikové faktory jsou obdobné jako u karcinomu děložního hrdla, u typu II hrají klíčovou roli kumulované genetické mutace v souvislosti s vyšším věkem a chronická iritace v terénu nedysplastických kožních změn. Prognóza nemoci záleží zejména na stadiu nemoci, velice důležitý je rovněž věk a performance status nemocné, což jsou faktory, které limitují optimální radikalitu chirurgického výkonu jakožto základní léčebné modality. Léčebné možnosti se odvíjejí v závislosti na stadiu nemoci. Chirurgická léčba nebo radioterapie jsou vysoce účinné v časných stadiích. Radioterapie je metodou volby u pokročilých stadií. Chemoterapie u lokálně pokročilého karcinomu vulvy může být indikována jako neoadjuvantní terapie s cílem vytvořit podmínky pro následný radikální chirurgický výkon, u generalizovaných forem onemocnění je užívána se záměrem paliativním.
Klíčová slova:
karcinom vulvy – etiologie – léčbaÚvod
Zhoubné nádory vulvy představují v České republice cca 3–4 % gynekologických malignit. Dlouhodobě se incidence karcinomu vulvy pohybuje v rozmezí 3–4/100 tis. žen/rok. Ročně je diagnostikováno cca 180–200 nových případů zhoubných nádorů vulvy. Před 35. rokem věku se vyskytuje raritně, incidence narůstá od 50 let věku a maxima dosahuje v 7. a 8. decenniu. Mortalita je poměrně vysoká: 1,7–2,4. Dle údajů Národního onkologického registru byla v roce 2005 v ČR incidence karcinomu vulvy 4,12; tj. 216 nových případů, mortalita pak 1,94; což představuje 102 případů [1].
Histologické typy
Nejčastějším histologickým typem zhoubných nádorů vulvy je dlaždicobuněčný karcinom a jeho varianty (bazaliom, verukózní karcinom, „warty“ skvamózní karcinom, adenoidně skvamózní karcinom) – celkem představují 90–94 %. Maligní melanom je zastoupen 4–8 %, epiteliální nádory ze žláz a kožních adnex 1–2 % (adenokarcinom Bartholiniho žlázy, sebaceózní karcinom, karcinom z potních žláz, Pagetova choroba z ektopického parenchymu prsní žlázy). Méně než 1 % jsou nádory mezenchymální (sarcoma botryoides, leiomyosarkom, liposarkom a další varianty) [2].
Etiopatogeneze a rizikové faktory
U spinocelulárního karcinomu se etiopatogeneticky rozlišují dva základní typy. Typ I je asociován s HR-HPV infekcí a rizikové faktory jsou obdobné jako u karcinomu děložního hrdla. Vyskytuje se spíše v premenopauzální periodě, je asociován s perzistencí HR-HPV infekce (zejména typ 16, méně často 31, 33), v okolí často nacházíme změny charakteru intraepiteliální neoplazie a rovněž koincidenci s intraepiteliálními neoplaziemi nebo malignitami v oblasti dolního genitálního traktu – používá se termín LGTNS – Low Genital Tract Neoplasia Syndrom. Mezi kofaktory patří imunodeficience, imunosuprese, poruchy buněčné imunity, kouření, rizikové sexuální chování, STD infekce. Histologicky se často jedná o multifokální léze, s mělkou invazí, lépe diferencované, ve variantách bazaloidní, „warty“. Tvoří cca 25 % z celkového podílu dlaždicobuněčných karcinomů vulvy. U typu II nelze určit etiopatogeneticky jednoznačného činitele, předpokládá se, že klíčovou roli hrají kumulované genetické mutace v souvislosti s vyšším věkem a chronická iritace v terénu nedysplastických kožních změn (lichen sclerosus et atrophicus, dlaždicová hyperplazie). Jako méně přesvědčivé jsou u typu II uváděny další rizikové faktory, jako diabetes mellitus 2. typu a jiné endokrinopatie, menopauza před 45. rokem věku, nízká hladina vitaminu A. Naopak chybí rizikové faktory typické pro typ I související s HR-HPV infekcí. Histologicky se jedná spíše o léze unifokální, s infiltrativním růstem, méně diferencované. Typ II se vyskytuje u pacientek postmenopauzálních, v 6.–9. decenniu a tvoří cca 75 % diagnostikovaných dlaždicobuněčných karcinomů vulvy. Z hlediska rizikových faktorů adenokarcinomů jsou informace o rizikových faktorech nekonzistentní, uváděny jsou např. chronické záněty [3].
Klinické projevy
Nejčastějším příznakem je pruritus, který je samozřejmě nespecifický a vyskytuje se rovněž u nenádorových onemocnění vulvy i prekanceróz. Totéž platí i pro další projevy vulvárního dyskomfortu – pálení, bolestivost, dyspareunie. Možnost skríninku je problematická vzhledem k malé incidenci, nepříznivé věkové distribuci a biologickému chování lézí. Dispenzarizovat se musí všechny pacientky po léčbě intraepiteliálních neoplazií, dosud však není zcela jasný potenciál HG VIN k progresi do invazivního karcinomu; podle literárních údajů se pohybuje mezi 6–10 %. Zvýšenou pozornost je nutno věnovat rovněž pacientkám s nálezem nedysplastických změn vulvy, kde doporučený interval kontrol je jeden rok.
Diagnostika
Spinocelulární karcinom vzniká nejčastěji z epitelu sliznice a kůže od vaginálního introitu k laterální části velkých stydkých pysků (lateralizovaná varianta), méně často je lokalizován v oblasti horní komisury a klitorisu (centrální varianta), nejméně často pak v oblasti zadní komisury a perinea.
Klinické vyšetření se skládá z několika základních částí:
- Klinické vyšetření zahrnuje popis léze (rozměry, povrch – vyvýšení, ulcerace, lokalizace a popis vzdálenosti od uretry, pochvy, rekta) a palpační vyšetření svodné lymfatické, tj. inguinofemorální oblasti (v případě hmatných uzlin popis jejich počtu, velikosti, event. fixace).
- Vulvoskopie má význam zejména u suspektních a nejasných nálezů. Nejvalidnější je popis změn po aplikaci 5% kyseliny octové, kdy po době aplikace alespoň 20 s hodnotíme přítomnost epiteliálních a cévních abnormalit. Někteří autoři používají tzv. Collinsův test, kdy se po aplikaci toluidinové modři provádí omytí 5% kyselinou octovou a abnormální epiteliální léze by měly retinovat modré barvivo. Při popisu změn suspektních z nálezu karcinomu je nutný rovněž popis okolních změn – multifokalita lézí, koincidence s intraepiteliální neoplazií nebo nález dystrofických změn, což je důležité při následné terapeutické rozvaze o lokální radikalitě výkonu [4] (obr. 1).
- Biopsie se provádí ve dvou základních modalitách:
1. Koincidence dysplastických a non dysplastických lézí vulvy. 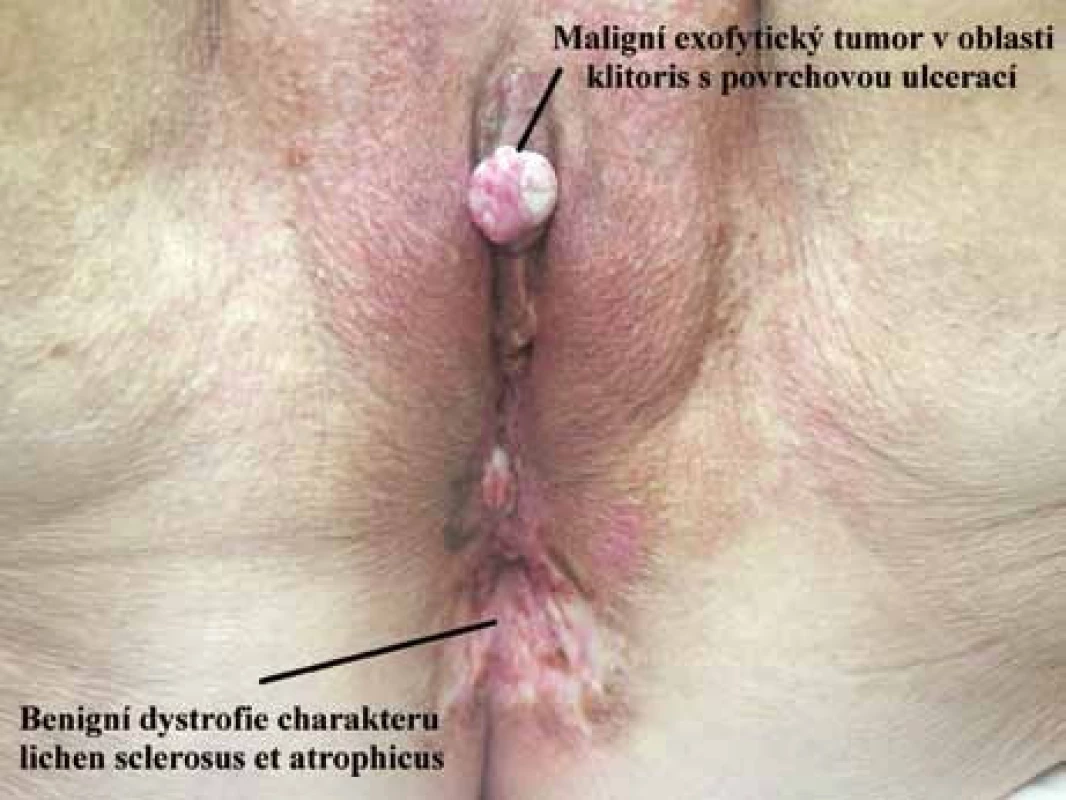
Minibiopsie – ambulantní diagnostický výkon u klinicky evidentního karcinomu z lokalizace, kde není riziko většího krvácení (lateralizovaná léze), a pokud není evidentní nekróza.
Excize – diagnostický, popřípadě diagnosticko terapeutický výkon v celkové anestezii, kdy na základě prebioptických metod je podezření na minimálně invazivní karcinom; provádí se v případě rizika krvácení (oblast klitorisu), v případě suspektních nekróz na povrchu léze a rovněž tehdy, pokud k terapeutické rozvaze potřebujeme přesný údaj o invazi.
Stagingová vyšetření při nálezu invazivního karcinomu se dělí na dvě základní skupiny:
A/Obligatorní – neredukovatelné minimum nutné ke stanovení terapeutické rozvahy
- anamnéza
- somatické + komplexní gynekologické vyšetření, včetně palpačního vyšetření regionální lymfatické oblasti
- základní laboratorní vyšetření s předoperačním interním vyšetřením;
- RTG plic
- ultrazvukové vyšetření inguinofemorální oblasti
Klinické vyšetření tříselných uzlin je omezeno pouze na povrchové uzliny a má nízkou senzitivitu (57 %) i specifitu (62 %). Mezi nejpřesnější stagingová vyšetření ke zhodnocení stavu regionálních lymfatických uzlin patří ultrazvuk. Pomocí vysokofrekvenčních sond lze detekovat uzliny o velikosti 5 mm. Stav lymfatického aparátu se hodnotí komplexně – za suspektní se považuje poměr šíře a délky uzliny menší než dvě, hodnotí se tvar a echogenita uzliny, vaskularizace s indexem rezistence. Pod kontrolou ultrazvukem je možno provádět rovněž biopsii za účelem histologické verifikace eventuálního metastatického postižení, kdy dosahujeme senzitivity až 93 % a specifity téměř 100 %. Dalšími metodami k posouzení stavu lymfatických uzlin jsou CT a NMR, které patří mezi metody selektivní a oproti ultrazvuku se vyznačují nižší senzitivitou (pod 50 %), protože kritéria pro hodnocení metastatického postižení vycházejí pouze z velikosti uzliny (1 cm a více v krátké ose uzliny). Jediná metoda, která zobrazí vnitřní strukturu i nezvětšené uzliny, je lymfangiografie. Její nevýhodou je, že se jedná o metodu invazivní, s nutností preparace lymfatických cév na nártu dolní končetiny a následnou aplikací kontrastní látky. Rovněž nezobrazí uzliny destruované nádorem nebo lymfatika blokovaná nádorovými buňkami, což snižuje senzitivitu metody pod 80 %.
B/Selektivní (fakultativní) – u pokročilejších nálezů k posouzení lokálního rozsahu, operability a případné diseminace nádoru
- rektoskopie – při makroskopickém šíření do konečníku
- uretrocystoskopie – při infiltraci uretry nebo přední klenby poševní
- CT, NMR, lymfografie
- TUM (SCCA) – není prokázána korelace se stadiem onemocnění nebo diferenciací nádoru
Cesty šíření nádoru
A/Lokální
horizontální (plošné) – význam je vyjádřen v TNM klasifikaci
vertikální (invazivní) – koreluje s pozitivitou lymfatických uzlin
šíření do pochvy, uretry, anu – známka pokročilého onemocnění
B/Lymfogenní
- nejčastější způsob diseminace
- regionální lymfatické uzliny – inguinofemorální – povrchní (v průměru 4–6 uzlin) a hluboké (2–3 mediálně od v. femoralis)
- pánevní mízní uzliny – při metastatickém postižení se jedná o přítomnost vzdálených metastáz dle TNM klasifikace
C/Hematogenní
- pozdní a málo časté
- výskyt u pokročilých onemocnění a recidiv (nejčastěji plíce, játra, kosti)
Klasifikace
Jednotlivá stadia karcinomu vulvy jsou definována dle TNM klasifikace a stadií FIGO (International Federation of Gynecology and Obstetrics) [5].
T0: Žádné známky primárního nádoru
Tis/0: Carcinoma in situ
T1/I: Nádor je ohraničen na vulvu nebo vulvu a perineum, 2 cm nebo méně v největším průměru
T1a/IA: Stromální invaze ne více než 1 mm
T1b/IB: Stromální invaze více než 1 mm
T2/II: Nádor je ohraničen na vulvu nebo vulvu a perineum, větší než 2 cm v největším průměru
T3/III: Nádor se šíří na dolní část uretry, pochvu nebo anus a/nebo se jedná o postižení unilaterálních inguinofemorálních uzlin (N1)
T4/IVA: Nádor postihuje sliznici močového měchýře a/nebo rekta, horní část uretry nebo je fixován ke kostem a/nebo infiltruje oboustranně inguinofemorální uzliny (N2)
T4/IVB: Přítomnost vzdálených metastáz včetně postižení pánevních lymfatických uzlin (M1)
Prognostické faktory
Prognostické faktory lze rozdělit na tři základní skupiny. Z prognostických faktorů nádoru se uplatňuje staging a grading tumoru, rovněž do klasifikace ne zcela plně zahrnutá velikost a tloušťka nádoru, hloubka stromální invaze a přítomnost angioinvaze. Velice důležitý je rozsah postižení lymfatických uzlin. Nepříznivým prognostickým faktorem je např. rovněž aneuploidie nádorových buněk, naopak příznivým prognostickým faktorem je výrazná lymfoplazmocytární infiltrace tumoru a jeho okolí. Z faktorů hostitele se uplatňuje věk a performance status nemocné, z faktorů léčby samozřejmě optimální radikalita chirurgického výkonu a adekvátní radioterapie [6].
Terapie
Základní léčebnou modalitou je chirurgická terapie. Radioterapie je nejčastější adjuvantní léčbou a u pokročilých stadií onemocnění u pacientek v dobrém celkovém stavu i léčbou neoadjuvantní. Jako neoadjuvantní léčbu lze využít rovněž chemoterapii, event. konkomitantní chemoradioterapii. Obecně platí, že léčba musí být individualizovaná na základě zhodnocení stagingových vyšetření, která musí vyhodnotit primární nádor, stav lymfatických uzlin a celkový stav pacientky. V chirurgické léčbě se prosazuje příklon ke konzervativnějšímu řešení lokálního nálezu, standardní provádění regionální inguinofemorální lymfadenektomie od invaze větší než 1 mm ze samostatných řezů (obr. 2) a identifikace sentinelových uzlin s následnou omezenou radikalitou v oblasti inguin u časných stadií [7]. Ve stadiu T1a bez angioinvaze (za předpokladu, že se jedná o unifokální lézi) je dostačujícím výkonem excize s volným resekčním okrajem 5 mm. Lymfadenektomie v tomto stadiu není indikována, riziko postižení lymfatických uzlin je do 0,5 %. V případech multifokálního postižení, u pacientek se současným výskytem multifokální VIN nebo benigních dystrofických změn, je možno nález řešit hemivulvektomií nebo simplexní vulvektomií. Ve stadiu T1a s angioinvazí, T1b a T2 je standardním výkonem radikální vulvektomie s bilaterální inguinofemorální lymfadenektomií ze tří samostatných řezů. „Klasická“ radikální vulvektomie, při které jsou odstraněny uzliny a vulva en bloc a nejsou zachovány můstky, je dnes již spíše historickou záležitostí. Tento přístup je spojen s nejvyšší morbiditou a jeho indikace přichází v úvahu jen pro centrálně lokalizované léze s hlubokou invazí v oblasti klitorisu. Naopak usilujeme li o snížení morbidity vzhledem k věku, internímu stavu a interkurentním onemocněním, je možno u lateralizovaných lézí ve stadiu T1a s angioinvazí, T1b a T2 volit excizní výkon v rozsahu radikální excize nebo hemivulvektomie za současného předpokladu intaktnosti dalších partií vulvy i z hlediska přítomnosti intraepiteliálních neoplazií nebo benigních dystrofických změn. Musí být splněn požadavek na alespoň 8 mm volný resekční okraj. Současně je možno realizovat biopsii sentinelové uzliny [8], v případě její pozitivity je pak indikována systematická tříselná lymfadenektomie. U stadií T1b a T2 se udává 20–30% riziko metastatického postižení regionálních mízních uzlin. V případě maligní inguinofemorální lymfadenopatie se četnost postižení pánevních uzlin pohybuje v rozmezí 25–30 %, vysoké riziko hrozí zejména při postižení hlubokých tříselných uzlin. U centrálně lokalizovaných lézí je zvýšené riziko oboustranného postižení tříselných mízních uzlin, možné je také šíření přes interní pudendální cévy přímo do pánevních mízních uzlin, predilekčně do oblasti obturatorní fossy. V případě maligní tříselné lymfadenopatie by měla být při optimálním rozsahu chirurgického stagingu součástí výkonu i pánevní lymfadenektomie, která se provádí jako součást suprapubické fáze radikální vulvektomie z extraperitoneálního přístupu. V případě bioptické verifikace pozitivity tříselné uzliny lze zvážit laparoskopickou exploraci s pánevní lymfadenektomií v první fázi ještě před vlastní inguinofemorální lymfadenektomií. U lokálně pokročilých nálezů T3, event. T4 u mladších pacientek v dobrém celkovém stavu, je možno indikovat rozšířené resekční výkony, tj. parciální kolpektomii při šíření na distální část pochvy, resekci distální části uretry při postižení jejího zevního ústí (obr. 3, 4), širokou kožní a slizniční resekci s plastikou anu při infiltraci análního otvoru. Při rozsáhlejších resekčních výkonech je nezbytností přítomnost plastického chirurga, kdy ve spolupráci s ním je možné řešit i rozsáhlé defekty tkáně, využívají se Z plastiky, přesuny kožních nebo svalově kožních laloků, nejčastěji s využitím m. gracilis nebo m. rectus abdominis. Pro přísně selektovanou skupinu nemocných přicházejí v úvahu i výkony exenterační v kombinaci s bilaterální inguinofemorální a pánevní lymfadenektomií [9]. Rovněž je možno využít koncept neoadjuvantní léčby s cílem zmenšení nádoru a následného chirurgického výkonu s nižší radikalitou. Nevýhodou je nejistá reakce objemného nádoru na chemoterapii a v případě radioterapie zhoršení kvality kůže a tkání pro budoucí operační výkon [10].
2. Stav po superficiální exenteraci inguiny. 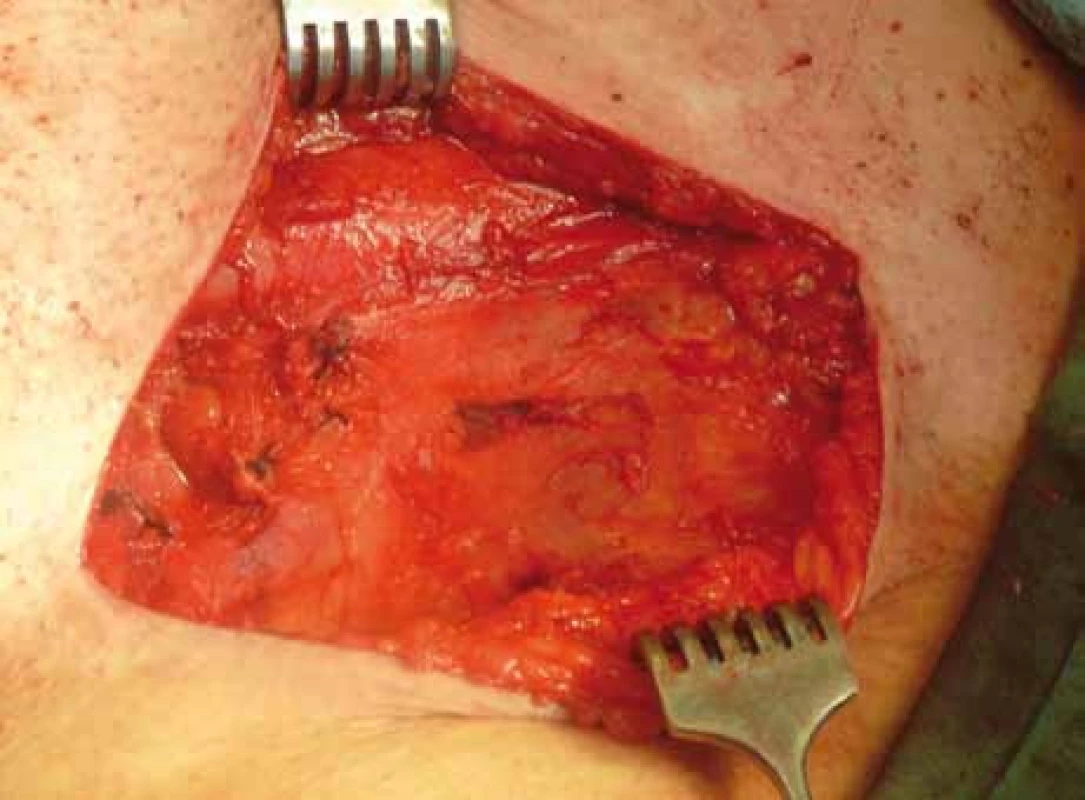
3. Karcinom vulvy st. III s infiltrací zevního ústí uretry a poševního introitu. 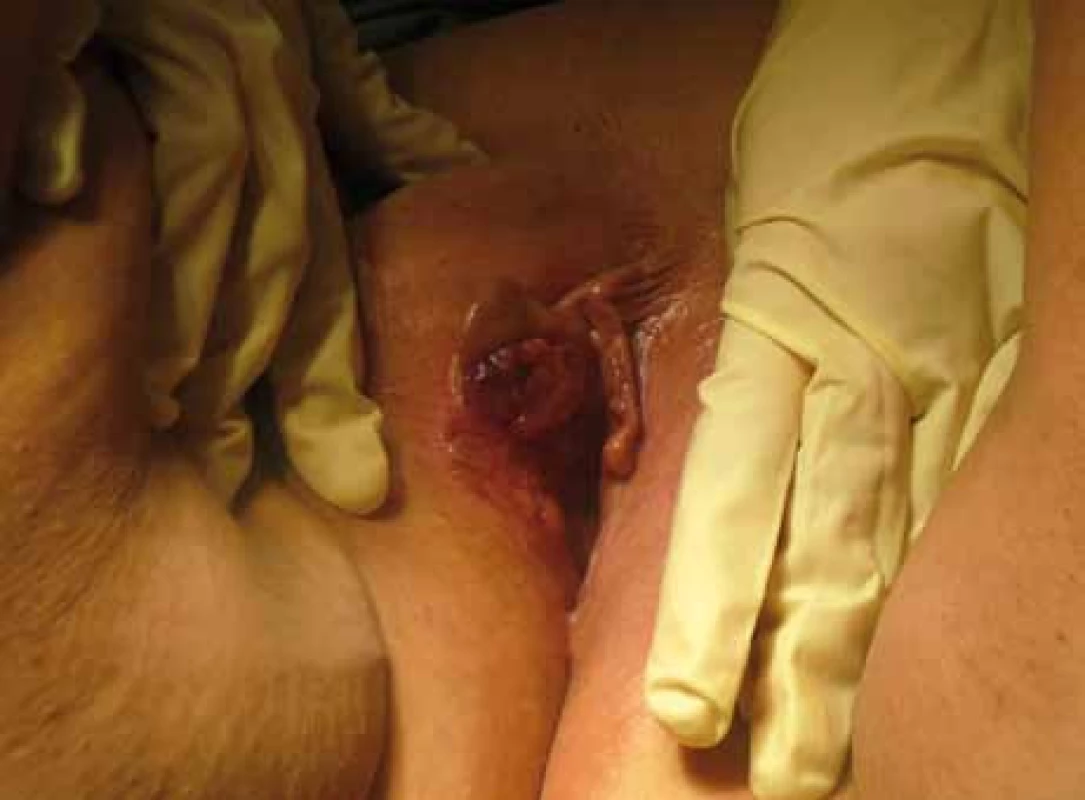
4. Karcinom vulvy st. III – stav po resekčním výkonu. 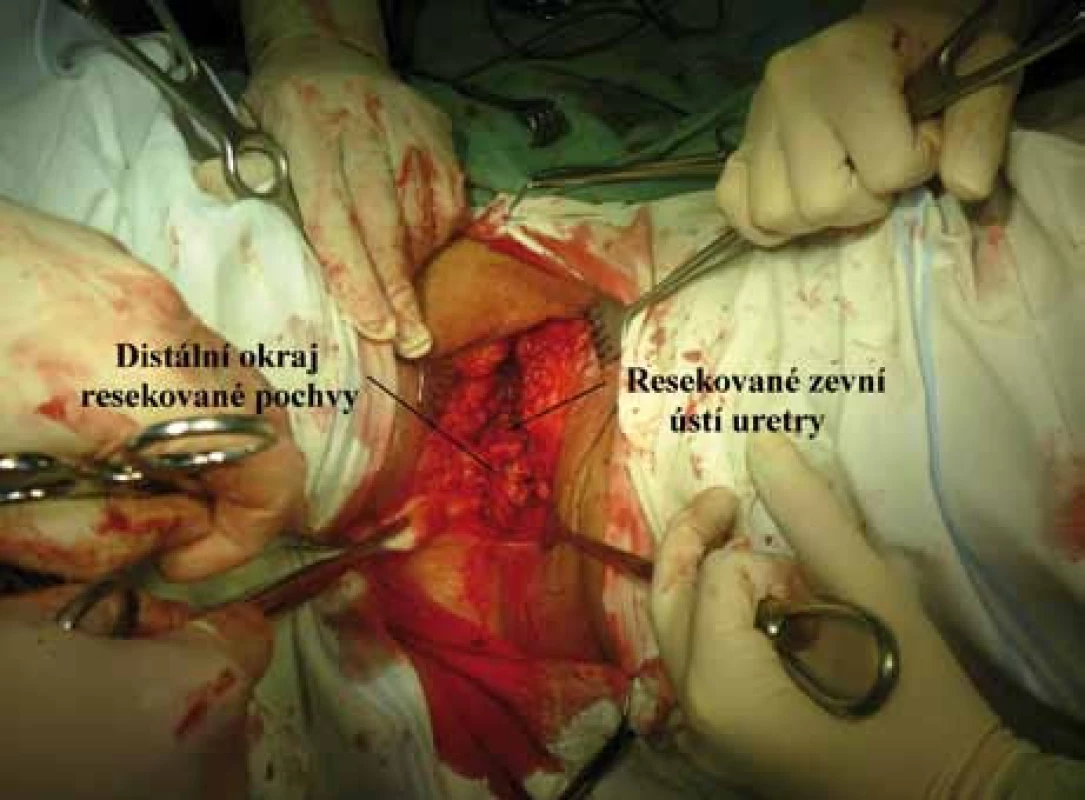
Radioterapie může být využita v léčebné strategii jako léčba adjuvantní, kurativní, neoadjuvantní a paliativní. Adjuvantní radioterapie je indikována v případě nedostatečného resekčního okraje, při tumorech v největším průměru nad 4 cm a u lokálně pokročilých nádorů T3, T4. Pooperační radioterapie na oblast uzlin (inguinofemorálních a pánevních) je indikována při jejich metastatickém postižení (s výjimkou jedné mikrometastázy) a při neadekvátní chirurgické intervenci (pro zhodnocení pN0 je nutný zisk minimálně šesti lymfatických uzlin). Jako neoadjuvantní léčba se využívá u lokálně pokročilých nádorů T3, T4 a u fixovaných tříselných uzlin, u mladších nemocných v dobrém stavu event. i v konkomitanci s chemoterapií. V případě kontraindikace chirurgického výkonu se užívá dle stadia onemocnění jako léčba primární – kurativní, nebo paliativní. V lokálních recidivách lze využít k reiradiaci intersticiální brachyterapii [11–13].
Chemoterapie u malignit vulvy nepatří k základním léčebným modalitám. Využívá se jednak jako neoadjuvantní terapie u lokálně pokročilých onemocnění, jednak k potenciaci účinku radioterapie; poslední indikací je systémová léčba generalizovaného onemocnění se vzdálenými metastázami. U spinocelulárních karcinomů je základním cytostatikem cisplatina, případně její kombinace s 5-fluorouracilem, u adenokarcinomů je základem platinový derivát v kombinaci s taxany nebo antracykliny [14].
Závěr
Karcinom vulvy je dobře kurabilní ve svých časných stadiích, naopak prognóza pro pokročilá stadia a recidivy této nemoci je poměrně nepříznivá. Pro úspěšnou léčbu karcinomu vulvy jsou nutné určité předpoklady. V případě indikace chirurgické léčby musí operaci provádět zkušený operatér s onkogynekologickou erudicí. Výkon musí být proveden na pracovišti, které operatérovi poskytuje široké operační zázemí včetně diagnostického komplementu a dostupnosti konziliárních vyšetření. Je li primární léčbou radioterapie, pacientka je indikována do péče zkušeného radioterapeuta, který musí danou léčbu velmi často přísně individualizovat. Aby byly splněny tyto předpoklady, je jasné, že léčba musí být centralizována a prováděna v onkogynekologických centrech na základě mezioborové spolupráce.
as. MUDr. Luboš Minář
MUDr. Jan Kümmel
prim. MUDr. Josef Chovanec, Ph.D.
Gynekologicko-porodnická klinika LF MU a FN Brno
Sources
1. Novotvary 2003 ČR, 2006. ÚZIS ČR, NOR ČR.
2. Motlík J, Živný J. Patologie v ženském lékařství. Praha: Grada Publishing 2001.
3. Rob L, Pluta M, Robová H et al. Zhoubné nádory vulvy. Mod Gyn Por 2000; 9(4): 624–633.
4. Apgar BS, Brotzman GL, Spitzer M. Colposcopy, principles and practice: an integrated textbook and atlas. Philadelphia: Saunders 2002.
5. Benedet JL, Bender H, Jones H 3rd et al. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO committee on Gynecologic Oncology. Int J Gynaecol Obstet 2000; 70(2): 209–262.
6. Raspagliesi F, Hanozet F, Ditto A et al. Clinical and pathological prognostic factors in squamous cell carcinoma of the vulva. Gynecol Oncol 2006; 102(2): 333–337.
7. Rob L. Současné trendy v léčbě gynekologických zhoubných nádorů. Gynekologie po promoci 2006; 6(2): 47–51.
8. Levenback C, Burke TW, Gershenson DM et al. Intraoperative lymphatic mapping for vulvar cancer. Obstet Gynecol 1994; 84(2): 163–167.
9. Cibula D. Chirurgická léčba gynekologických malignit. Mod Gyn Por 2007; 16(3): 533.
10. Gaducci A, Cionini L, Romanini A et al. Old and new perspectives in the management of high‑risk, locally advanced or recurrent, and metastatic vulvar cancer. Crit Rev Oncol Hematol 2006; 60 : 227–241.
11. Šlampa P a kol. Radiační onkologie v praxi. Brno: MOÚ 2004.
12. Šlampa P a kol. Radiační onkologie. 2. vyd. Brno: MOÚ 2007.
13. Novotný J, Vítek P, Petruželka L. Klinická a radiační onkologie pro praxi. Praha: Triton 2005.
14. Geisler JP, Manahan KJ, Buller RE. Neoadjuvant chemotherapy in vulvar cancer: Avoiding primary exenteration. Gynecol Oncol 2006; 100(1): 53–57.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 3-
All articles in this issue
- Are the caesarian section and birthweight associated with alergies?
- Screening of disturbances of thyroid gland during pregnancy and postpartum
- Malignant tumors of vulva
- Lichen sclerosus.
- Lymfoedema of the upper extremity after breast cancer therapy.
- Antichlamydial antibodies occurrence in men and women.
- Forensic aspects of assisted reproduction within the legislation context of the Czech and Slovak Republics.
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lichen sclerosus.
- Malignant tumors of vulva
- Screening of disturbances of thyroid gland during pregnancy and postpartum
- Forensic aspects of assisted reproduction within the legislation context of the Czech and Slovak Republics.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

