-
Medical journals
- Career
Současný přístup k léčbě pacientů s metastatickým kolorektálním karcinomem
Authors: J. Halámková 1,2; J. Tomášek 1; S. Rybníčková 3; D. Adámková Krákorová 1; B. Bencsiková 1; I. Kiss 1
Authors‘ workplace: Klinika komplexní onkologické péče Lékařské fakulty MU a MOÚ Brno, přednosta prof. MU Dr. Rostislav Vyzula, CSc. 1; Ústav lékařské etiky Lékařské fakulty MU Brno, přednosta doc. Mgr. Josef Kuře, Dr. phil. 2; Oddělení radiologie Masarykova onkologického ústavu Brno, přednostka prim. MU Dr. Helena Bartoňková 3
Published in: Vnitř Lék 2013; 59(10): 903-908
Category: Review
Overview
Kolorektální karcinom je jedním z nejčastějších zhoubných nádorů. I přes stálou propagaci prevence přetrvává kolem 20 – 30 % onemocnění diagnostikovaných v metastatickém stadiu a přibližně u 50 – 60 % nemocných dojde k pozdní diseminaci. U 80 – 90 % z nich jsou metastázy již neresekabilní. I když je chirurgická léčba základní léčebnou modalitou, lze nyní využitím moderní biologické léčby v kombinaci s chemoterapií dosáhnout dlouhodobé kompletní remise i v případě pokročilého nádoru a tak významně prodloužit život pacientů s tímto onemocněním, 5 let se tak u pacientů v pokročilých stadiích onemocnění, kteří podstoupili metastazektomii, dožívá 40 – 50 % z nich a 10 let až 25 % těchto nemocných, u kterých medián celkového přežití v případě podání pouze systémové léčby dosahuje kolem 24 měsíců.
Klíčová slova:
kolorektální karcinom – jaterní metastázy – konverzní léčba – cílená terapieÚvod
Kolorektální karcinom patří v České republice k nejčastějším zhoubným novotvarům, představuje kolem 15 % všech onkologických onemocnění. Jedná se o nejčastější nádorové onemocnění trávicího traktu. V roce 2009 jeho incidence dosáhla 93/ 100 000 u mužů a 62/ 100 000 u žen [1]. I přes stálou propagaci prevence kolorektálního karcinomu přetrvává kolem 20 – 30 % onemocnění diagnostikovaných v metastatickém stadiu (mCRC) v podobě synchronních metastáz nejčastěji v játrech [2] a přibližně u 50 – 60 % nemocných s kolorektálním karcinomem dojde k pozdní diseminaci a vzniku metachronních metastáz, z nichž kolem 80 – 90 % má metastázy v játrech již neresekabilní [3]. Jedinou reálnou nadějí na víceleté prodloužení života v dobré kvalitě nebo úplné vyléčení poskytuje chirurgická léčba v kombinaci se systémovou protinádorovou terapií [4]. Celkové 5leté přežití je u pacientů, kteří podstoupili metastazektomii, 40 – 50 % a 10 let se tak dožívá až 25 % těchto nemocných [5,6]. K chirurgické léčbě jsou indikováni všichni nemocní, u nichž lze podle předoperačních nálezů očekávat radikální (kurativní) výkon odstraňující veškerou nádorovou tkáň (R0 resekce). Vždy však musíme zhodnotit dlouhodobou prognózu pacienta a na základě negativních prognostických kritérií vyloučit ty pacienty, kteří by z chirurgické léčby neměli prospěch.
Po zhodnocení prognózy je pacient zařazen do jedné z následujících skupin:
- pacient inoperabilní s nepředpokládanou konverzí metastáz v operabilní,
- pacient primárně inoperabilní s předpokládanou konverzí metastáz v operabilní a
- pacient primárně operabilní.
V minulosti bylo podání neoadjuvantní systémové terapie v první řadě indikováno u pacientů s neresekabilními jaterními metastázami s cílem zmenšení ložisek a konverze těchto metastáz v resekabilní [7]. V posledních letech se však dostává do popředí i u pacientů s primárně resekabilními ložisky, kdy je cílem eliminovat okultní ložiska nádoru a zhodnotit léčebnou odpověď na podávanou chemoterapii, která je pak podávána i v adjuvantní indikaci po resekci jaterních ložisek. Rychlá progrese nádoru v případě agresivního průběhu většinou kontraindikuje chirurgické řešení, z kterého by pravděpodobně pacient neměl žádný prospěch.
Před rokem 2000 byla farmakologická léčba kolorektálního karcinomu omezena na režimy na bázi 5 - fluorouracilu a leukovorinu (kombinace FUFA). Zavedení nových cytostatik (oxaliplatina, irinotekan, kapecitabin) a jejich kombinací do praxe výrazným způsobem rozšířilo léčebné možnosti. Kombinační režimy oxaliplatina v kombinaci s fluorouracilem a leukovorinem (FOLFOX) a irinotekan ve stejné kombinaci (FOLFIRI) mají vyšší účinnost vyjádřenou prodlouženým přežitím než samotná kombinace FUFA, navíc lze oba režimy podat navzájem sekvenčně (FOLFOX/ FOLFIRI nebo FOLFIRI/ FOLFOX). Těmito cytostatiky lze dosáhnout až 50 % objektivních léčebných odpovědí s mediánem přežití kolem 24 měsíců [8 – 11]. Režimy FOLFOX a FOLFIRI jsou tzv. kontinuální. 5 - fluorouracil je v těchto režimech podáván kontinuální infuzí 48 hod. Fluorouracil lze plně nahradit perorálním kapecitabinem, což pozitivně ovlivní kvalitu života pacienta (např. režim XELOX). Případně lze využít kombinace všech výše uvedených cytostatik v režimu FOLFOXIRI, u kterého bylo dosaženo resekability o 9 % více oproti samotné kombinaci FOLFIRI s mediánem celkového přežití 23,4 měsíce vs 16,7 měsíce (p = 0,026). Zásadní nevýhodou tohoto režimu je však poměrně významná toxicita [12].
Obecně patří kolorektální karcinom mezi onemocnění se střední senzitivitou k chemoterapii, a proto se právě zde dostává stále více do popředí biologická (cílená) léčba, která se stala výrazným zlomem v léčbě pokročilého kolorektálního karcinomu. Kromě již v praxi běžně užívaných preparátů, jako jsou bevacizumab, cetuximab či panitumumab, se objevují zcela nové léky, jako aflibercept či regorafenib.
Bevacizumab (Avastin®) je rekombinantní humanizovaná monoklonální protilátka antiVEGF (vaskulární endoteliální růstový faktor), která zabraňuje interakci mezi VEGF a tyrozinkinázovými receptory VEGFR1 a VEGFR2, které hrají významnou roli při regulaci angiogeneze. Z nežádoucích účinků se mohou vyskytnout např. hypertenze, arteriální tromboembolie, krvácení, zhoršené hojení ran, proteinurie či velmi vzácně perforace střeva. Je třeba být obezřetní u pacientů, kteří jsou léčení antikoagulancií. Bevacizumab se aplikuje obvykle v intravenózní infuzi v dávce 5 mg/ kg, ve 2. linii 10 mg/kg každé 2 týdny či 7,5 mg/ kg každé 3 týdny. Účinnost bevacizumabu trvá u pacientů s metastatickým kolorektálním karcinomem také po první progresi, kdy je změněna chemoterapie a bevacizumab ponechán. Tento postup vede oproti samotné chemoterapii 2. linie k prodloužení jak celkového přežití (OS), tak přežití bez progrese (PFS) [13].
Na rozdíl od některých dalších biologických preparátů bevacizumab nemá prediktor odpovědi na léčbu.
Toto však není případ inhibitorů EGFR, jejichž efekt lze predikovat na základě vyšetření stavu onkogenů rodiny RAS v nádoru či metastáze. Patří sem onkogeny KRAS a NRAS. V nádorech s mutovanou verzí je RAS trvale aktivován, v nádorech s nemutovanou verzí RAS (wild type – wt ‑ RAS) je protein kódovaný RAS onkogeny pouze přechodně aktivován přes EGFR. Navázáním antiEGFR protilátky tak dojde k inaktivaci této signální dráhy. Průkaz wild typu RAS je podmínkou pro indikaci léčby panitumumabem, význam NRAS u cetuximabu doposud nebyl prokázán a pro jeho indikaci stačí průkaz wt-KRAS.
Cetuximab (Erbitux®) je chimerická monoklonální antiEGFR protilátka IgG1. Kompetitivně se váže na extracelulární doménu EGFR. Z nežádoucích účinků jde především o akneiformní exantém, jehož výskyt bývá spojen s lepší léčebnou odpovědí. Závažným nežádoucím účinkem je však anafylaktoidní reakce při aplikaci, která může být až život ohrožující. Cetuximab se podává v nasycovací dávce 400 mg/ m2 a v další dávce se pokračuje obvykle 250 mg/ m2 1krát týdně.
Panitumumab (Vectibix®) je rekombinantní plně humánní monoklonální protilátka IgG2 - k s afinitou k EGFR. Z nežádoucích účinků se mohou objevit průjem, hypokalemie, hypokalcemie či hypomagnezemie, proto je nutné monitorovat hladiny iontů. Nejčastější jsou však kožní příznaky v podobě vyrážky, může se vyskytnout také intersticiální pneumonitida či plicní fibróza. Alergická reakce na podání bývá výjimečná vzhledem k tomu, že se jedná o monoklonální protilátku humánního typu. Panitumumab je aplikován v dávce 6 mg/ kg každé 2 týdny.
Aflibercept (Zaltrap®), označovaný též jako VEGF Trap (doslova „past na VEGF“), je rekombinantní fúzní protein, který se skládá z VEGF ‑ vazebných částí tvořených extracelulárními doménami lidských VEGF receptorů 1 a 2, fúzovaných k Fc části lidského IgG1. Tato protilátka váže veškerý cirkulující VEGF. Mechanizmus účinku je tedy obdobný bevacizumabu, stejně tak jako nežádoucí účinky. Podává se v dávce 4 mg/ kg 1krát za 14 dní. Ve studii VELOUR byl testován ve 2. linii v kombinaci s FOLFIRI u pacientů po selhání léčby založené na oxaliplatině zahrnující i pacienty léčené bevacizumabem, prodloužení celkového přežití však bylo v porovnání s placebem 1,4 měsíce (13,5 měsíce vs 12,1 měsíce; HR 0,82; CI 95% 0,71 – 0,94; p = 0,003), čas do progrese byl 6,90 vs 4,67 měsíce (p = 0,00007) a celková odpověď 19,8 % vs 11,1 % (p = 0,0001) [14].
Regorafenib (Stivarga®) je multikinázový inhibitor VEGFR, FGFR, PDGFR, BRAF, KIT a RET – receptorů a proteinů zahrnutých do procesů nádorového růstu, tvorby mikroprostředí nádoru a angiogeneze. Ve studii CORRECT prodloužil ve srovnání s placebem celkové přežití taktéž o 1,4 měsíce (6,4 měsíce vs 5,0 měsíců; HR 0,77; CI 95% 0,64 – 0,94; p = 0,005) [15]. Podává se perorálně v dávce 160 mg denně 3 týdny s následnou týdenní pauzou ve 4týdenních cyklech. Nejčastějšími nežádoucími účinky jsou únava, průjem, hypertenze a syndrom palmoplantární dysestezie.
Image 1. Metastáza kolorektálního karcinomu v levém laloku jater. 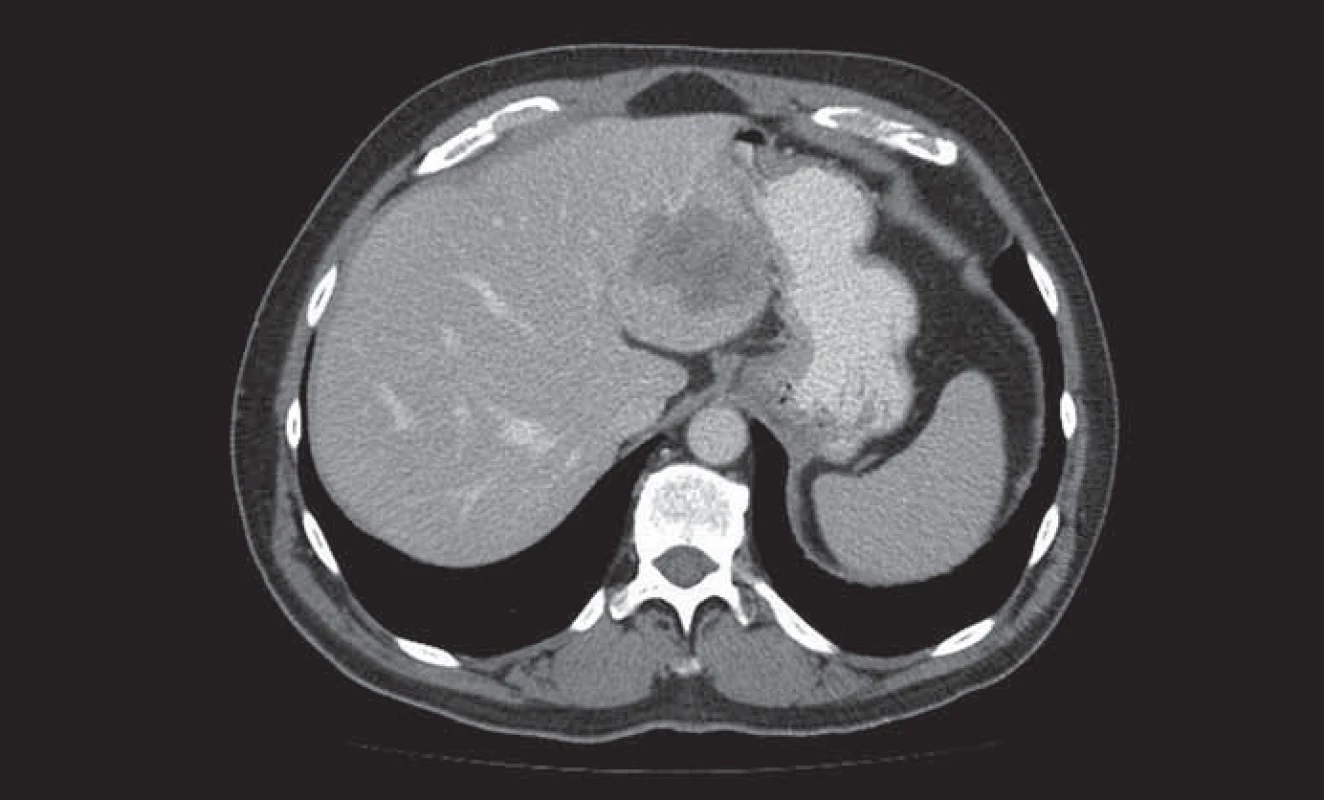
Image 2. Tatáž metastáza v levém laloku jater zmenšena po neoadjuvantní léčbě chemobioterapií. 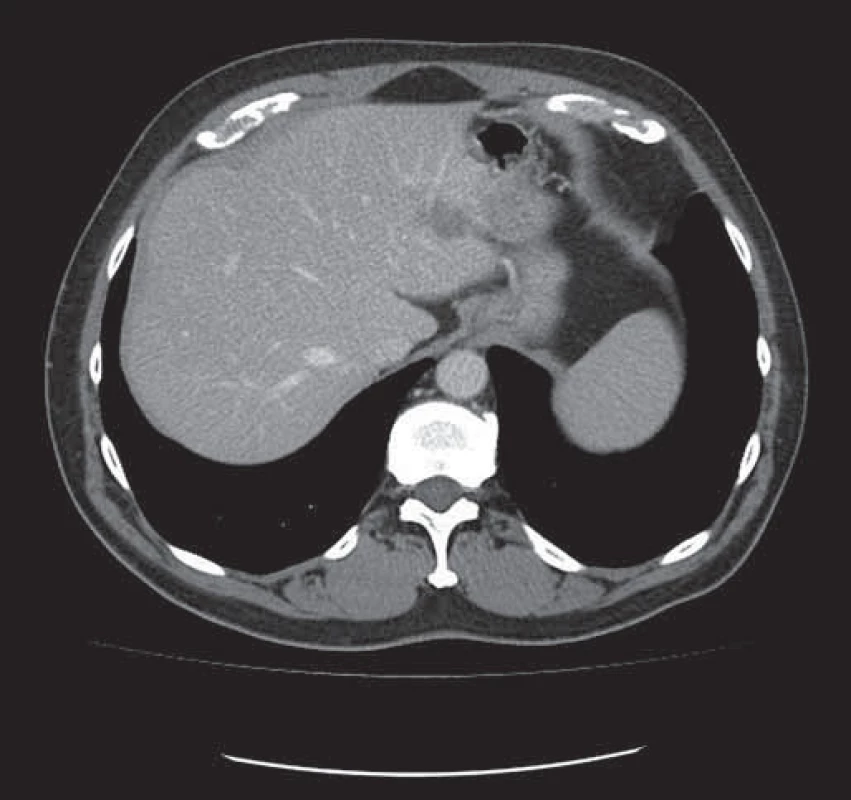
Image 3. Stav po extraanatomické resekci metastázy levého laloku jater – viditelné svorky resekční linie. 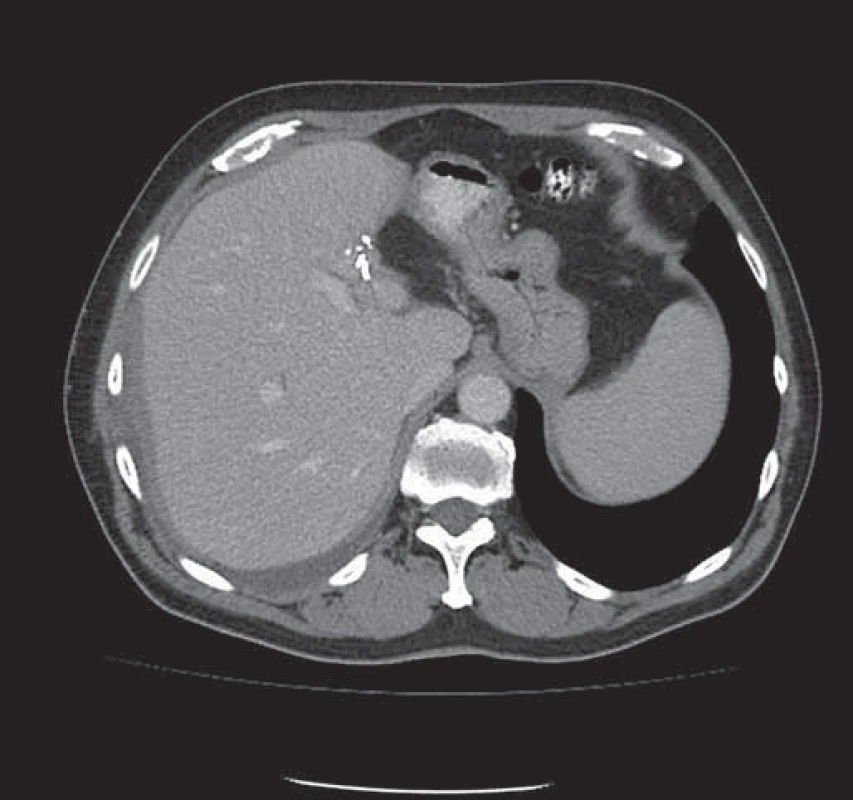
Konverzní léčba primárně neresekabilních jaterních metastáz
Asi u 10 – 25 % nemocných jsou jaterní metastázy primárně resekabilní nebo hraničně resekabilní, 3/ 4 případů jsou pak hodnoceny jako neresekabilní. Tam, kde je radikální resekce možná, je 5leté přežití dosaženo ve 40 – 50 % [16,17]. U těch pacientů, kde potenciální konverze na resekabilní onemocnění není očekávatelná, je hlavním cílem léčby založené především na chemoterapii/ chemobioterapii prodloužení života v jeho dostatečné kvalitě. Pro ty, u kterých je plánován do budoucna chirurgický výkon, je základní myšlenkou jeho dobré načasování. Nepřiměřeně dlouhé čekání na nejvhodnější léčebnou odpověď systémové terapie může v konečném důsledku potenciálně resekabilní onemocnění proměnit v navždy neresekabilní. Proto je žádoucí pravidelné hodnocení efektu léčby nejlépe ve 2měsíčních intervalech, prolongovaná cytotoxická léčba vede ke zvýšení morbidity resekcí a může vyústit i ve vymizení metastáz na zobrazovacích metodách (tzv. missing metastases) s velkým rizikem vitálního rezidua.
Recentně byla konverze v resekabilní onemocnění studována ve srovnání režimů FOLFIRI a FOLFOX v kombinaci s antiEGFR inhibitorem (cetuximab) ve studii II. fáze CELIM. Retrospektivně bylo zjištěno, že v léčebném rameni s cetuximabem se možnost resekability zvyšuje z 32 % až na 60 % (p < 0,0001). Zásadním prognostickým faktorem je však počet metastáz. V této studii byl medián přežití bez známek onemocnění ve skupině pacientů s 1 – 4 metastázami 16,8 měsíce, u 5 – 10 metastáz byl DFS 8,2 měsíce a v případech s více než 10 metastázami byl DFS jen 2 měsíce. Dalším signifikantním prognostickým faktorem je dosažená léčebná odpověď. Pacienti s metastatickým postižením pouze v oblasti jater mají lepší prognózu než pacienti s postižením dalších orgánů [18]. Zdá se, že cetuximab v kombinaci s chemoterapií nezvyšuje toxicitu vyvolanou cytostatickou léčbou samotnou. Jeho výhodou je, že nemá na rozdíl od bevacizumabu vliv na hojení ran, a proto není třeba přerušovat léčbu před chirurgickým výkonem, ani nezvyšuje riziko krvácivých komplikací.
Na kongresu ASCO (Americká společnost pro klinickou onkologii) byla v letošním roce prezentována studie FIRE ‑ 3, která byla zaměřena na 1. linii léčby mCRC s wt ‑ KRAS. Ve studii byl zkoumán efekt cetuximabu v kombinaci s FOLFIRI a srovnávacím ramenem byl režim FOLFIRI s bevacizumabem. Primárním cílem studie bylo dokázat, že v rameni s cetuximabem bude dosaženo vyšší léčebné odpovědi, tohoto cíle však dosaženo nebylo, léčebná odpověď byla v obou ramenech obdobná (FOLFIRI + cetuximab 62,0 % vs FOLFIRI + bevacizumab 58,0 %; p = 0,183), také doba přežití bez progrese (PFS) se významně nelišila (10,0 vs 10,3 měsíce). Vzhledem k těmto výsledkům byl poněkud překvapivý statisticky významný rozdíl v celkovém přežití ve prospěch režimu s cetuximabem (28,7 vs 25,0 měsíce; p = 0,017). Křivky přežití se od sebe oddělují po 24 měsících, přičemž medián doby léčby 1. linií nedosáhl ani v jednom rameni půl roku (4,8 vs 5,3 měsíce). Co bylo příčinou lepšího výsledku při podání cetuximabu v 1. linii bylo a ještě bude předmětem diskuzí. Mohla to být jak léčba 1. linií, tak rozdílná léčba v dalších liniích již mimo studii [19]. Studie testující kombinace FOLFOX + cetuximab a FOLFOX + bevacizumab v současné době probíhají.
Chirurgickou léčbu mohou doplnit metody intervenční radiologie. Jedná se jednak o předoperační embolizaci větve portální žíly jaterního laloku postiženého metastázami s cílem hypertrofie zdravého jaterního parenchymu druhého laloku, která je indikována v případech, kdy budoucí zbývající jaterní parenchym ( future liver remnant – FLR) tvoří 30 % u pacientů s normální jaterní funkcí a méně než 40 % u pacientů po předchozí extenzivní chemoterapii či jiném onemocnění ovlivňujícím jaterní funkci [20,21]. Kromě toho však mají význam v přísně indikovaných případech i lokální ablační metody v podobě radiofrekvenční ablace (RFA) či méně častější chemoembolizace (TACE). Provedení RFA však nemůže být doporučeno místo chirurgické léčby, kromě pacientů, kteří z nějakých důvodů nemohou chirurgickou léčbu absolvovat. RFA může být kombinována s resekčním výkonem s cílem eradikace nádoru. Vždy by však měly být ošetřeny všechny metastázy. Ablace pouze některých ložisek průběh onemocnění podstatně neovlivní.
Neoadjuvantní léčba primárně resekabilních jaterních metastáz
Pacienti v dobrém klinickém stavu s jednou metastázou pod 2 cm velikosti by měli být indikováni k primární metastazektomii [22]. U pacientů s větším postižením, byť primárně operabilních, se však zdá, že neoadjuvantní systémová léčba má své využití. V těchto případech je indikována z důvodu usnadnění operačního výkonu, a tím i zvýšení počtu pooperačních kompletních remisí, zkrácení doby rekonvalescence, k léčbě mikrometastáz a jako test chemorezistence nádoru.
Tento postup u primárně resekabilních metastáz je podpořen výsledky studie EORTC 40983 a navíc nerandomizovanou studií XELOX (oxaliplatina/ kapecitabin)/ FOLFOX [23].
Ve studii EORTC 40983, ve které byl testován efekt perioperačního podání chemoterapie FOLFOX 4 (6 cyklů před a 6 cyklů po chirurgickém výkonu) v porovnání s chirurgickým výkonem samotným, bylo zařazeno celkem 364 pacientů a u celkového počtu 303 pacientů, kteří absolvovali resekci jater, se čas do progrese ve 3 letech zvýšil o 9,2 %, z 33,2 % pacientů, kteří absolvovali pouze chirurgickou léčbu, na 42,4 % těch, kteří byli léčeni navíc i chemoterapií [17].
V červnu tohoto roku (2013) byla taktéž na konferenci ASCO prezentována studie New EPOC, která se věnovala neoadjuvantní léčbě resekabilních jaterních metastáz pacientů s mCRC wt ‑ KRAS. Šlo o akademickou studii III. fáze britských autorů. Zařazeni byli pacienti s technicky resekabilními metastázami, resekabilita mohla být hodnocena i jako hraniční. Pacienti byli randomizováni do ramene s chemoterapií samotnou (obvyklé režimy na bázi oxaliplatiny nebo irinotekanu, u malého procenta byl použit kapecitabin) nebo chemoterapií s cetuximabem. Do studie bylo zařazeno jen 272 pacientů a pak byla studie zastavena pro inferioritu ramene s cetuximabem [24]. Výsledky studie zatím nebyly publikovány in extenso, interpretace výsledků je tak obtížná. Pro praxi lze učinit závěr, že k neoadjuvantní léčbě technicky resekabilních metastáz CRC je lépe podat chemoterapii samotnou. V současnosti probíhá studie fáze III, která má ověřit přínos preoperační chemoterapie oproti pooperační chemoterapii samotné, výsledky však zatím nebyly publikovány.
U pacientů s resekabilními metastázami je však třeba rozlišit, zda se jedná o synchronní, tedy současný výskyt společně s primárním tumorem. V těchto případech jsou následující možnosti postupu:
- Resekce primárního nádoru a synchronní, případně následná metastazektomie následovaná adjuvantní léčbou, kdy synchronní operační zákrok je spojen s vyšší pooperační morbiditou [17,25 – 27].
- Neoadjuvantní léčba v délce 2 – 3 měsíce samostatně či v kombinaci s cílenou léčbou následovaná synchronní nebo postupnou kolektomií s metastazektomií. Současná resekce prima a metastáz se však nedoporučuje u předpokládaných velkých jaterních resekcí. Celková doba systémové léčby by neměla přesáhnout 6 měsíců. Resekce jater jako 1. krok je indikována v případě, že postižení jater je významnější než primární tumor, který je současně asymptomatický, a to zvláště pokud se jedná o karcinom rekta, který vyžaduje předoperační kombinační léčbu s radioterapií a následně provedení resekce rekta s anastomózou a zachováním svěrače [26,27].
V případě zahájení léčby neoadjuvantní terapií můžeme otestovat senzitivitu nádoru na podávanou kombinaci. V případě regrese bude mít pacient pravděpodobně velký prospěch z pokračování stejné léčby pooperačně, tedy adjuvantně. Menší část pacientů nemá z neoadjuvantní léčby benefit a dochází u nich k progresi onemocnění. Jedná se o pacienty s agresivním biologickým chováním tumoru, který je rezistentní k chemoterapii, případně biologické léčbě, a je otázkou, zda by tito pacienti měli benefit z okamžité chirurgické léčby.
Resekční výkony na játrech bývají spojeny s častou pooperační morbiditou, nejvhodnějším kandidátem je tedy pacient s nenarušenou funkcí nepostižené části jaterního parenchymu. Měli bychom tedy myslet na možné hepatální nežádoucí účinky systémové léčby, která primárně neresekabilnímu onemocnění často předchází, a to zvláště venookluzivní onemocnění jater při léčbě oxaliplatinou či vyšší riziko vzniku steatózy či steatohepatitidy u pacientů léčených irinotekanem [28]. Paradoxně přidání bevacizumabu do kombinace s režimem na bázi oxaliplatiny může riziko hepatopatie snížit [29]. Při podávání kombinací s bevacizumabem však nelze opomenout riziko krvácení či zhoršení hojení a regenerace jaterního parenchymu. V současné době se doporučuje odstup nejméně 4 týdny před chirurgickým výkonem obecně a až 8 týdnů od poslední aplikace bevacizumabu při elektivním výkonu na játrech [30].
Adjuvantní léčba po resekci metastáz jater
Po kurativní resekci by ve většině případů měla následovat adjuvantní léčba, konkrétní režim však není standardizován. Použití cílené léčby v adjuvanci je opodstatněné pouze v případech, kdy v předoperačním podání došlo při stejné léčbě k regresi metastáz. Jsou zkoušeny nejrůznější kombinace jak systémové, tak lokoregionální intraarteriální léčby. Portier et al v randomizované studii fáze III prokázali prodloužení času bez známek onemocnění u pacientů léčených adjuvantní kombinací FUFA po chirurgické resekci oproti chirurgické léčbě samotné [31], což svědčí ve prospěch podání adjuvantní léčby po resekci metastáz. Volba režimu však závisí na klinickém stavu pacienta, celkové předléčenosti a na odpovědi na případnou předoperační terapii.
Byly publikovány i studie sledující efekt intraarteriální lokoregionální chemoterapie, která může být podána cestou a. hepatica, obvykle v kombinaci se systémovou aplikací chemoterapie, jedná se však zatím o experimentální postup.
Závěr
Každý pacient s metastatickým kolorektálním karcinomem, u nějž lze předpokládat následnou léčbu, by měl být odeslán do onkologického centra, které má zkušenosti s podáním biologické léčby a ve kterém pracuje multidisciplinární onkologický tým za přítomnosti klinického onkologa, radioterapeuta, chirurga, gastroenterologa a radiologa s možností přizvání i dalších specialistů. Na základě posouzení rizikových faktorů a zhodnocení možnosti konvertability inoperabilního onemocnění v operabilní je pak zváženo podání systémové chemoterapie v kombinaci s biologickou léčbou. Díky multioborovému přístupu při využití nových možností společného působení chemoterapie a cílené biologické léčby lze v současnosti významně prodloužit život pacientům s kolorektálním karcinomem v dobré kvalitě i u pokročilých stadií onemocnění.
Tato práce byla financována z institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu v roce 2013.
MU Dr. Jana Halámková, Ph.D.
www.mou.cz
e‑mail: jana.halamkova@mou.cz
Doručeno do redakce: 15. 4. 2013
Přijato po recenzi: 6. 6. 2013, aktualizováno 5. 9. 2013
Sources
1. Ústav zdravotnických informací a statistiky ČR, Národní zdravotnický informační systém (NZIS), Národní onkologický registr (NOR), [online, citace 24. 3. 2013]. Dostupné z: http:/ / www.uzis.cz/ publikace/ novotvary ‑ 2009.
2. Muratore A, Zorzi D, Bouzari H et al. Asymptomatic colorectal cancer with un ‑ resectable liver metastases: immediate colorectal resection or up ‑ front systemic chemotherapy? Ann Surg Oncol 2007; 14 : 766 – 770.
3. Alberts SR, Horvath WL, Sternfeld WC et al. Oxaliplatin, fluorouracil, and leucovorin for patients with unresectable liver ‑ only metastases from colorectal cancer: a North Central Cancer Treatment Group phase II study. J Clin Oncol 2005; 23 : 9243 – 9249.
4. Vyzula R, Žaloudík J. Rakovina tlustého střeva a konečníku, vybrané kapitoly. Praha: Maxdorf 2007.
5. Rees M, Tekkis PP, Welsh FK et al. Evaluation of long‑term survival after hepatic resection for metastatic colorectal cancer: a multifactorial model of 929 patients. Ann Surg 2008; 247 : 125 – 135.
6. Fong Y, Fortner J, Sun RL et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1,001 consecutive cases. Ann Surg 1999; 230 : 309 – 321.
7. Leonard GD, Brenner B, Kemeny NE. Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 2005; 23 : 2038 – 2048.
8. Rothenberg M, Oza A, Bigelow R et al. Superiority of oxaliplatin and fluorouracil ‑ leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil ‑ leucovorin: Interim results of a phase III trial. J Clin Oncol 2003; 21 : 2059 – 2069.
9. Saltz L, Cox JV, Blanke C et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 2000; 343 : 905 – 914.
10. Van Cutsem E, Hoff PM, Harper P et al. Oral capecitabine vs intravenous 5 – flourouracil and leucovorin: Integrated efficacy data and novel analyses from two large, randomised phase III trials. Br J Cancer 2004; 90 : 1190 – 1197.
11. Van den Eynde M, Hendlisz A. Treatment of colorectal liver metastases: a review. Rev Recent Clin Trials 2009; 4 : 56 – 62.
12. Falcone A, Ricci S, Brunetti I et al. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first‑line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007; 25 : 1670 – 1676.
13. Bennouna J, Sastre J, Arnold D et al. ML18147 Study Investigators. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 tril. Lancet Oncology 2013; 14 : 29 – 37.
14. Van Cutsem E, Tabernero J, Lakomy R et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin‑based regimen. J Clin Oncol 2012; 30 : 3499 – 3506.
15. Grothey A, Van Cutsem E, Sobrero A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo ‑ controlled, phase 3 trial. Lancet 2013; 381 : 303 – 312.
16. Masi G, Cupini S, Marcucci L et al. Treatment with 5 - fluorouracil/ folinic acid, oxaliplatin, and irinotecan enables surgical resection of metastases in patients with initially unresectable metastatic colorectal cancer. Ann Surg Oncol 2006; 13 : 58 – 65.
17. Nordlinger B, Sorbye H, Glimelius B et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 2008; 371 : 1007 – 1016.
18. Folprecht G, Gruenberger T, Bechstein WO et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol 2010; 11 : 38 – 47.
19. Heinemann V, Fischer von Weikersthal L, Decker T et al. Randomized comparison of FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first‑line treatment of KRAS ‑ wild type metastatic colorectal cancer: German AIO study KRK ‑ 0306 (FIRE ‑ 3). J Clin Oncol 2013; 31 (Suppl): abstract LBA3506.
20. Zorzi D, Laurent A, Pawlik TM et al. Chemotherapy‑associated hepatotoxicity and surgery for colorectal liver metastases. Br J Surg 2007; 94 : 274 – 286.
21. Wicherts DA, De Haas RJ, Andreani P et al. Impact of portal vein embolization on long‑term survival of patients with primarily unresectable colorectal liver metastases. Br J Surg 2010; 97 : 240 – 250.
22. Schmoll HJ, Van Cutsem E, Stein A et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalised approach to clinical decision making. Ann Oncol 2012; 23 : 2479 – 2516.
23. Nordlinger B, Van Cutsem E, Gruenberger T et al. Combination of surgery and chemotherapy and the role of targeted agents in the treatment of patients with colorectal liver metastases: recommendations from an expert panel. Ann Oncol 2009; 20 : 985 – 992.
24. Primrose JN, Falk S, Finch ‑ Jones M et al. A randomized clinical trial of chemotherapy compared to chemotherapy in combination with cetuximab in k ‑ RAS wild‑type patients with operable metastases from colorectal cancer: The new EPOC study. J Clin Oncol 2013; 31 (Suppl): abstract 3504.
25. Reddy SK, Pawlik TM, Zorzi D et al. Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi‑institutional analysis. Ann Surg Oncol 2007; 14 : 3481 – 3491.
26. De Jong MC, Van Dam RM, Maas M et al. The liver ‑ first approach for synchronous colorectal liver metastasis: a 5‑year single‑centre experience. HPB (Oxford) 2011; 13 : 745 – 752.
27. Šubrt Z, Ferko A, Čečka F et al. Současné možnosti chirurgické léčby ložiskového postižení jater a pankreatu. Vnitř Lék 2011; 57 : 356 – 363.
28. Fernandez FG, Ritter J, Goodwin JW et al. Effect of steatohepatitis associated with irinotecan or oxaliplatin pretreatment on resectability of hepatic colorectal metastases. J Am Coll Surg 2005; 200 : 845 – 853.
29. Ribero D, Wang H, Donadon M et al. Bevacizumab improves pathologic response and protects against hepatic injury in patients treated with oxaliplatin‑based chemotherapy for colorectal liver metastases. Cancer 2007; 110 : 2761 – 2767.
30. Gruenberger B, Tamandl D, Schueller J et al. Bevacizumab, Capecitabine, and Oxaliplatin as Neoadjuvant Therapy for Patients With Potentially Curable Metastatic Colorectal Cancer. J Clin Oncol 2008; 26 : 1830 – 1835.
31. Portier G, Elias D, Bouche O et al. Multicenter randomized trial of adjuvant fluorouracil and folinic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol 2006; 24 : 4976 – 4982.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 10-
All articles in this issue
- Prevalencia hyponatriémie u hospitalizovaných na internej klinike
- Vplyv 14 dní trvajúcej pravidelnej telesnej záťaže na koncentrácie tried a podtried lipoproteínových partikúl u mladých probandov so sedavým spôsobom života
- Vysoce riziková chronická lymfocytární leukemie – charakteristika a léčebné možnosti
- Metody vyšetřování mikrocirkulace kůže
- Současný přístup k léčbě pacientů s metastatickým kolorektálním karcinomem
- Manažment dyslipidémií – prítomnosť a budúcnosť. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- Infekční endokarditida na trikuspidální chlopni u intravenózní narkomanky
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metody vyšetřování mikrocirkulace kůže
- Infekční endokarditida na trikuspidální chlopni u intravenózní narkomanky
- Současný přístup k léčbě pacientů s metastatickým kolorektálním karcinomem
- Manažment dyslipidémií – prítomnosť a budúcnosť. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

