-
Medical journals
- Career
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres
Authors: F. Koukolík
Authors‘ workplace: Primář: MUDr. František Koukolík DrSc. ; Oddělení patologie a molekulární medicíny, Národní referenční laboratoř prionových chorob, Thomayerova nemocnice, Praha
Published in: Prakt. Lék. 2012; 92(6): 311-316
Category: Editorial
Overview
Počátkem 20. století rozšířil Walter Cannon představu Clauda Bernarda o pružně stabilním „vnitřním prostředí“ objevem odpovědi sympatoadrenální osy na stres. V padesátých letech minulého století popsal Hans Selye obecný adaptační syndrom. Sterling a Eyer formulovali v roce 1988 pojem alostázu a alostatickou zátěž: klíčem všech procesů stresu je mozek. Odpověď na jednotlivý stresor monitoruje, koordinuje a kalibruje distribuovaný, dynamický a plastický neuronální obvod. Tyto procesy (alostáza) mohou být krátkodobě adaptivní, dlouhodobě (alostatická zátěž) mohou být maladaptivní. Souhrnnou odpověď na stres zprostředkovávají obvody limbického koncového mozku, hypotalamu a mozkového kmene. Jednotlivé přenašečové, peptidové a steroidní mediátory stresu užívají časové a prostorové niky, které se překrývají. Existují vztahy k socioekonomickému statusu, zdraví a nemocem. Akutní stres přesouvá prioritu ke zpracovávání emočně významných podnětů na vrub výkonu pracovní paměti. Meditační výcvik zaměřený na tlumení stresu ovlivňuje intrinsickou konektivitu mozku.
Klíčová slova:
stres, alostáza, alostatická zátěž, mozekÚvod
Moderní zkoumání stresu navazuje na představu stabilního vnitřního prostředí vytvořenou v roce 1878 Claudem Bernardem. Roku 1920 ji rozšířil Walter Cannon, fyziolog Harvardovy university, popisem sympato-adrenální odpovědi na zátěž: aktivita sympatiku zvýší hladinu adrenalinu, následuje zvýšení krevního tlaku, zrychlení srdeční akce, stoupne glykemie, urychlí se krevní srážlivost, mobilizuje se kosterní svalstvo, utlumí zažívání. Cannon r. 1932 pro tyto procesy, jejichž cílem je ustavení původní rovnováhy v narušeném systému, užil pojem homeostáza. Měl za to, že jde o lokální události nezávislé na činnosti mozku (6).
V roce 1950 ukázal Hans Selye (36), že adaptivní odpověď organismu na zátěž kromě mechanismu popsaného Cannonem zahrnuje činnost osy hypotalamus – hypofýza, což označil pojmem obecný adaptační syndrom, OAS (GAS, general adaptation syndrome). Ten se vyvíjí ve třech stupních:
- poplach, charakterizovaný růstem aktivity „stresové osy“ hypotalamus–hypofýza–nadledviny: paraventrikulární jádro hypotalamu je aktivováno zátěží, zvýší sekreci CRH (hormonu uvolňujícího kortikotropin, corticotropin releasing hormone zvaného též CRF, corticotropin releasing factor). CRH aktivuje přední lalok hypofýzy, jenž uvolní ACTH (adrenocorticotropin releasing hormone), který přiměje kůru nadledvin k uvolnění kortikosteroidů (u člověka kortisolu). Kortisol mobilizuje energetické rezervy. Následuje
- rezistence, při níž odpověď organizmu vyrovnává vliv stresoru, příznaky stresu se zmírňují, případně mizí. Jestliže stres pokračuje a překoná obranu, přichází
- vyčerpání, příznaky se obnovují, jestliže tlak pokračuje, následuje smrt. Selye uvažoval o „společném mediátoru“, neuronálním nebo endokrinním, který integruje místní vstupy a vysílá signály aktivující OAS v celém těle.
Selyeho práce, z níž plyne, že stresující podněty nejsou specifické (může jít o vliv tepla, chladu, infekci, krvácení, stejně jako o psychosociální podněty), ovlivnila medicínu, biologii, psychologii i sociologii.
Alostáza a alostatická zátěž
Rozsáhlá následující literatura popisující vliv psychosociálního stresu (přehled 9) překročila Cannonovu homeostázu i Selyeho obecný adaptační syndrom. Sterling a Eyer (42) r. 1988 užili pojem alostáza, který říká, že kontrolu všech fyziologických regulačních odpovědí na zátěž plynoucí z prostředí u bdělého jinak nedotčeného organismu zprostředkovává mozek, jenž je oním Selyeho společným mediátorem. Experimenty testující homeostázu totiž nebraly v úvahu činnost mozku.
McEwen a Stellar (28) r. 1993 zavedli pojem alostatická zátěž (allostatic load), který odpovídá fyziologickým „nákladům“ spjatým s dlouhodobými adaptivními přesuny v řadě systémů, jejichž smyslem je uvést tlak zevního prostředí do dynamické rovnováhy s fungováním organismu. Alostatická zátěž odpovídá opotřebení (wear and tear). Příkladem je vyčerpání imunitního systému chronickým stresem, jehož důsledkem je snížená odolnost vůči infekcím a růst pravděpodobnosti vzniku maligního nádoru. Jedním z důvodů je život na nízkých stupních sociální hierarchie skupiny, což se týká zvířat i lidí (17, 25).
Alostáza a plasticita mozku
Neuroplasticita (plasticita mozku) je pojem označující proměny stavby a funkce mozku, které jsou výsledkem „zkušeností“, učení, zevní signalizace. Přesnější by bylo užívat pojem v množném čísle, protože jde o události probíhající na všech studovaných úrovních, od molekulární po makroskopickou. Vztah alostázy a plasticity mozku se dosud nejrozsáhleji zkoumá v hipokampu (3, 12) a amygdale (29), z čehož neplyne, že by ostatní mozkové struktury na alostatickou zátěž neodpovídaly.
Důsledkem opakovaného nebo chronického stresu je u pokusných zvířat remodelace hipokampu: zkrácení dendritů neuronů, pokles počtu dendritických spin, pokles neurogeneze ve fascia dentata. Efekt je reverzibilní a je důsledkem vyšší hladiny glukokortikoidů, excitačních aminokyselin a dalších mediátorů a modulátorů. Trvalejším důsledkem tohoto poškození hipokampu je poškození deklarativní i prostorové paměti, kromě toho dochází k narušení činnosti stresové osy hypothalamus – hypofýza – nadledvina. Sapolsky (34) v tomto směru formuloval hypotézu glukokortikoidové kaskády stárnutí hipokampu.
Někteří pacienti s chronickou depresí, nemocní s posttraumatickou stresovou poruchou a Cushingovou nemocí mají zmenšený hipokampus, což lze zvrátit léčbou (37, 39, 40). Vyšší hladina prožívaného stresu trvajícího přibližně 20 let se u postmenopauzálních žen projevila zmenšeným objemem hipokampu a části laterální prefrontální kůry (10). U zdravých lidí žijících v blízkosti newyorského světového obchodního centra zničeného teroristy 11. 9. 2001 byl tři roky po útoku zjištěn menší objem hipokampu a s hipokampem propojených oblastí amygdaly a prefrontální kůry (9).
Jak u lidí, tak u zvířat se přitom prokazuje, že typ odpovědi hipokampu na stres má dědičnou složku, takže na stejnou míru stresu odpovídají různí lidé různě. Objem hipokampu zdravých nositelů met/val neurotrofického faktoru odvozeného z mozku (BDNF) je menší, než je objem korových oblastí nositelů val/val alely (4, 43).
Je pravděpodobné, že se na plasticitě hipokampu podílí obousměrné propojení mozek – ostatní organismus. Mediátorem jsou proinflamatorní cytokiny, například interleukin-6, marker systémového zánětu, jehož hladina je u lidí ve středním věku v negativní korelaci s kognitivním výkonem a objemem hipokampu a prefrontální šedé hmoty (26, 27).
Funkcí amygdaly je rychlé vyhodnocování emočního významu proměn prostředí. Amygdala propojuje percepci s kognicí, koordinuje periferní fyziologickou aktivitu s proměnami chování (20). Stejné stresory mohou na hipokampus a amygdalu působit opačně: jestliže při experimentálním imobilizačním stresu atrofují dendrity neuronů hipokampálního sektoru CA3, v basolaterálním jádru amygdaly, dendrity hypertrofují (46). Chronický stres poškozuje kognitivní funkce, na kterých se podílí aktivita hipokampu, zvyšuje však míru strachu, která odpovídá aktivitě amygdaly. Individuální rozdíly odpovědi amygdaly na emočně významné podněty odpovídají fyziologickým proměnným, které se sdružují s rizikem srdečních a cévních onemocnění, změnám ve výši krevního tlaku podmíněným stresujícími podněty i diurnálním proměnám sekrece kortisolu. Lidé, u nichž byla zjištěna vyšší reaktivita amygdaly na stresující sociální podněty, například hněvivý nebo ustrašený výraz ve tváři, mají vyšší stupeň preklinické atherosklerózy (11).
Experimenty na zvířatech prokazují, že alostatické procesy ovlivňují orbitální a mediální prefrontální kůru jakož i přední kůru cingulární. Zdejší neurony mají receptory pro hormony kůry nadledvin. U lidí žijící na dolních příčkách socioekonomického žebříčku v USA, což se považuje za příčinu chronického stresu, byl prokázán úbytek šedé hmoty v předním cingulárním závitu (10).
Stručný přehled neuroplastických změn mozku v důsledku stresu je uveden v tab. 1.
Table 1. Neuroplastická odpověď na chronický stres (Ulrich-Lai) 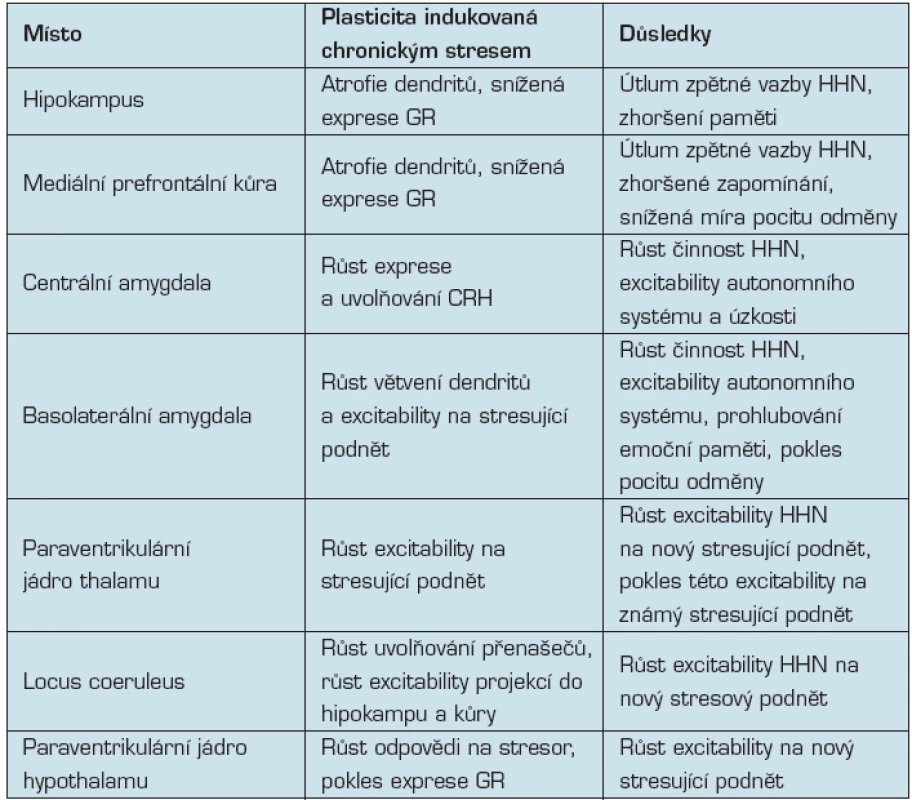
CRH - corticotropin releasing hormone HHN - osa hypothalamus-hypofýza-nadledvina GR - glukokortikoidový receptor Mechanismus stresu
Druh a trvání odpovědi na stres jsou podmíněny řadou faktorů: trváním stresu (akutní/chronický), druhem stresu (fyzický/psychologický), dobou, kdy začne stresor působit (den/noc), věkem zvířete nebo člověka, pohlavím a genetickým pozadím. Mediátory stresu ovlivňující mozek jsou početné: noradrenalin, dopamin, serotonin, CRH (hormon uvolňující kortikotropin, corticotropin-releasing hormone), urokortiny, vasopresin, orexin, dynorfin, kortikosteroidy a neurosteroidy (14, 15, 44; obr. 1). Účinky mediátorů se časoprostorově odlišují. Topografie míst, v nichž mediátory stresu ovlivňují mozek nejvíce, tzv. hotspots, jsou na obr. 2.
Image 1. Ovlivnění a mediátory stresu (15) 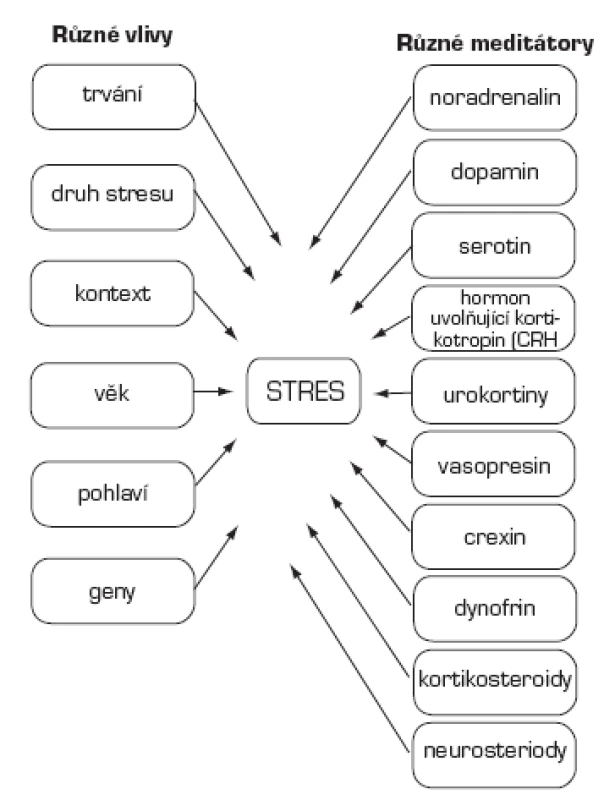
Image 2. „Hot spots“: místa, kde mozek ovlivňují stresové mediátory v největší míře. Červeně: PFC - prefrontální kůra, DR - dorzální raphé, LC - locus coeruleus, NTS - nc.tractus solitarius, BLAM CAM, MAM - bazolaterální, centrální, mediální jádro amygdaly, BNst - bed nucleus stria terminalis, PVH - paraventrikulární jádro hypotalamu Modře: beta 1 NR - beta 1 noradrenergní, CRH1 - hormon (faktor) uvolňující kortikotropin 1, CRH2 - hormon (faktor) uvolňující kortikotropin 2, MR - receptory mineralokortikoidů,GR - receptory glukokortikoidů 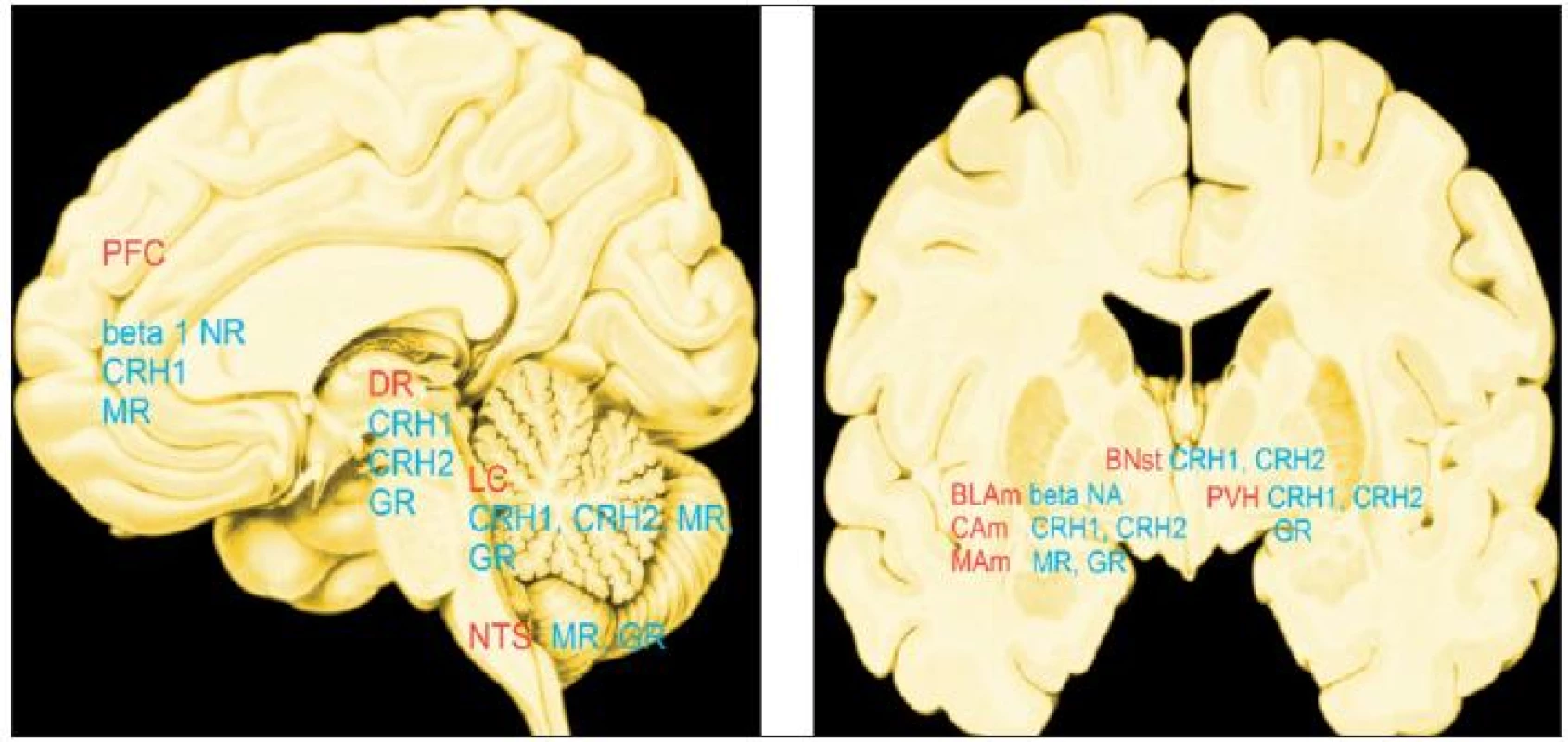
Tělesné stresory, jejichž příkladem je ztráta krve nebo chlad, aktivují kmenové a hypotalamické struktury, psychosociální stresory ovlivňují systémy, které zpracovávají emoce, zejména amygdalu a prefrontální kůru, dále oblasti, na jejich funkci záleží učení a paměť (hipokampální formace) a oblasti, jejich činnost slouží k rozhodování (prefrontální kůra). Nelze je oddělit: fyzické stresory mají psychologickou odezvu a opačně.
Monoaminy: krátce po zapůsobení stresoru se v řadě neuronálních populací mozku uvolňují noradrenalin, dopamin a serotonin (22). Míra uvolňování záleží na denní době, kontrolovatelnosti případného nového působení stresoru i na pohlaví. Například serotonergní neurony raphé se výrazně aktivují jen v situaci, které je nekontrolovatelná. Uvolnění monaminů je rychlé, ovlivňují hipokampus, nc. accumbens, amygdalu, prefrontální kůru a pravděpodobně i řadu dalších oblastí mozku. Efekt je rychlý, odpovídá přibližně délce působení stresoru. Předpokládá se, že uvolňování noradrenalinu přesouvá pozornost od jednotlivých smyslových informací k obecnému zaměření na prostředí. Uvolňování dopaminu v průběhu mírnějšího stresu v prefrontální kůře zlepšuje rozhodování. Uvolňování serotoninu redukuje úzkost, která následuje po stresu (1).
Neuropeptidy: CRH se v průběhu stresu uvolňuje z axonálních zakončení eminentia medialis hypotalamu a váže se na receptory v hypofýze. Kromě toho se uvolňuje v amygdale, hipokampu a locus coeruleus. Účinek nastupuje během sekund díky vazbě na dva receptory a to CRH1 a CRH2. Vazba ovlivňuje vydávání impulzů, genovou expresi i chování. Vasopresin interaguje s CRH a spouští uvolňování ACTH z hypofýzy (15).
Kortikosteroidy se uvolňují cirkadiánně, v pulsech. Váží se na mineralokortikoidní a glukokortikoidní receptory, jejichž distribuce v mozku je rozmanitá. První jsou vysoce exprimovány v neuronech hipokampu a laterálního septa, méně v některých jádrech amygdaly, paraventrikulárním jádru hypotalamu a neuronech locus coeruleus, jenž je součástí mesencefala. Tyto oblasti jsou součástí obvodu, jenž zpracovává neuroendokrinní, emoční a kognitivní odpověď na stres a jejich distribuce se překrývá s distribucí CRH1 (13). Vazba na kortikosteroidní receptor ovlivňuje buněčné jádro, kde reguluje genový přepis. Steroidní efekt se tedy projevuje nejdříve po několika hodinách od chvíle vazby a trvá hodiny až dny. V hipokampu mineralokortikoidní vazba se zpožděním tlumí neuronální excitabilitu a negativně ovlivňuje plasticitu synapsí, což slouží jako negativní zpětná vazba regulace behaviorální odpovědi na stresor.
Důsledky vazby glukokortikoidů závisí na věku. Stres v dětství i v dospělosti ovlivňuje počet a funkci glukokortikoidních receptorů v hipokampu (14, 40). V basolaterální amygdale jsou důsledky glukokortikoidní vazby excitační, nikoli inhibiční, jako je tomu v hipokampu. Jeden mediátor ovlivňující jeden receptor tedy může mít rozmanité účinky podle toho, kde se naváže.
Odpověď na stres probíhá v mozku jak v prostoru, tak v čase. Monoaminergní signalizace, účinek noradrenalinu, serotoninu a dopaminu, stejně jako účinek CRH je rychlá, označuje se někdy jako „první vlna“, probíhá v sekundách až hodinách. Rychlá akce těchto mediátorů stresu zvýší bdělost, pozornost a vylepší volbu strategie, která má stres zvládnout. „Druhá vlna“, dlouhodobější, ovlivňující paměť, je podmíněna ovlivněním činnosti genů a přičítá se účinku kortikosteroidů vážících se na glukokortikoidní receptory (obr. 3). Nicméně i v průběhu rychlé „první vlny“ ovlivňuje vazba monoaminů a peptidů některé transkripční faktory, takže i v průběhu této doby je ovlivňována funkce genomu. Opačná možnost – rychlý efekt v průběhu „druhé vlny“ byla doložena také, takže jejich hranice jsou neostré.
Image 3. Průběh stresu v čase (15) 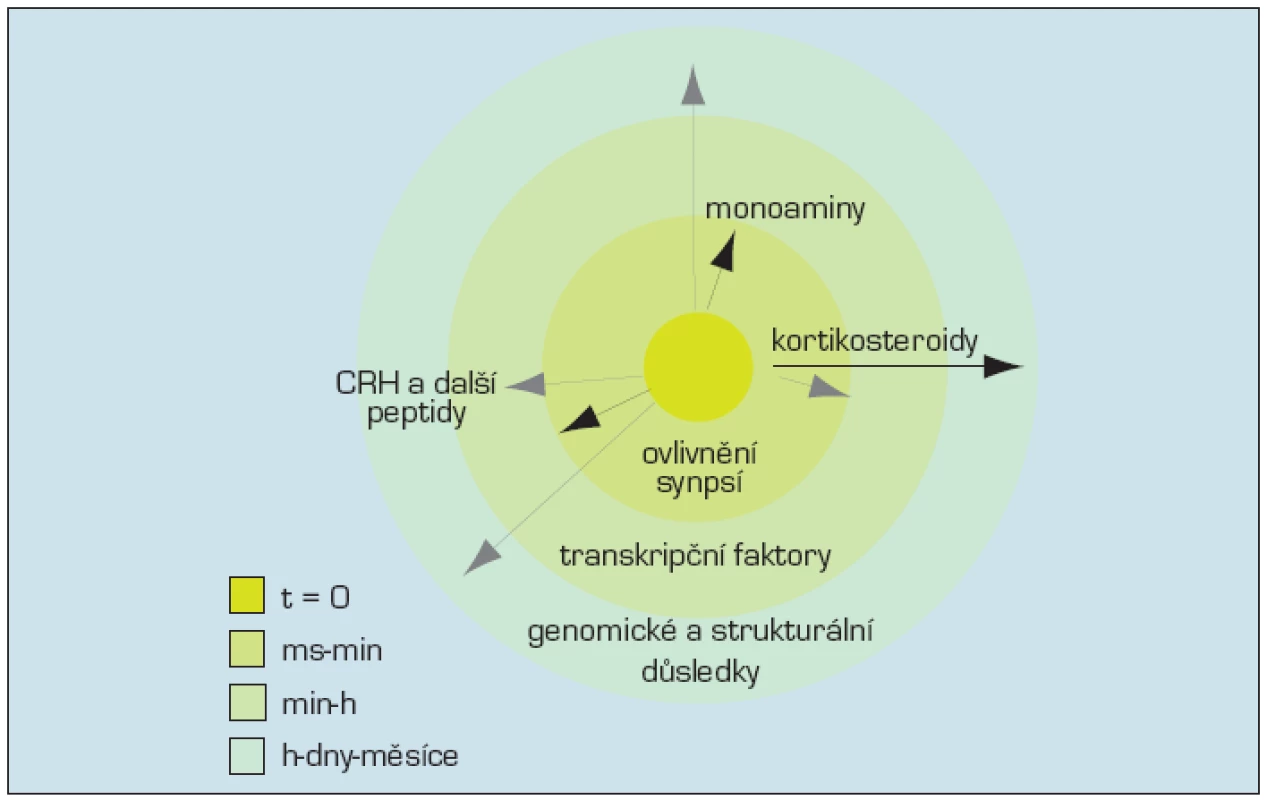
Mezi jednotlivými mediátory stresu byla doložena přímá interakce: v neuronech locus coeruleus a jejich projekčních oblastech, včetně hipokampu a amygdaly, interagují monoaminergní mediátory s CRH, opioidy a kortikosteronem. Výsledkem je modulace odpovědi na stres počínaje bezprostřední fyziologickou odpovědí po ukládání informací do emoční paměti (45, 41).
V průběhu života ovlivňuje stres mozek různým způsobem
Početné experimenty se zvířaty i studium lidí ukazují, že je ovlivnění mozku stresem odlišné v období prenatálním, postnatálním, v průběhu dospívání, dospělosti a v průběhu stárnutí (24, 23).
Úzkost, deprese a terapie matky glukokortikoidy může mít vztah k nízké porodní váze a/nebo k dítěti, které je ve vztahu k délce gestace malé. Mateřský stres, deprese a úzkost mají vztah ke zvýšené bazální aktivitě osy hypothalamus–hapofýza–nadledviny (HHN) u potomků ve věku 6 měsíců, 5 let a 10 let (31). Důsledkem mateřského stresu a deprese v průběhu těhotenství spjatého s expozicí plodu mateřským glukokortikoidům mohou být neurologické a behaviorální odchylky vývoje dítěte: poruchy chování, spánku, pozornosti s hyperaktivitou, deprese a další afektivní poruchy. Nízká porodní váha dítěte ženského pohlaví v kombinaci s nedostatečnou mateřskou péčí je v asociaci se sníženým objemem hipokampu v dospělosti (5).
Důsledkem separace dítěte a matky, například v jednodenních nebo vícedenních jeslích, je zvýšená hladina glukokortikoidů dítěte, záleží však na denní době, ve které se provádí odběr a na kvalitě péče. Labilita osy HHN je u dětí, které mají štěstí na citlivé rodiče, menší, odpověď na stresor kratší (2). Pravděpodobnost, že v průběhu adolescence onemocní depresí a/nebo pravděpodobnost, že budou mít labilnější osu HHN, je u dětí matek, které byly v jejich raném dětství depresivní, vyšší. Těžká deprivace, například pobyt v sirotčinci, zanedbávání a zneužívání však způsobí nižší bazální sekreci glukokortikoidů – hypokortisolismus. Ten se však citlivou péčí lze během 10 týdnů vrátit k normě. Stres v raném dětství je v asociaci s epigenetickou regulací funkce glukokortikoidových receptorů, což prokázalo vyšetřování mozku obětí sebevraždy, které porovnalo tyto receptory u lidí v dětství stresovaných a nestresovaných (30).
V průběhu adolescence je u lidí zvýšená jak bazální, tak stresem podmíněná aktivita osy HHN. Pravděpodobné je, že lidský adolescentní mozek je na hladinu glukokortikoidů, tedy na stres, zvýšeně citlivý. Exprese glukortikoidových i mineralokortikoidových receptorů je v prefrontální kůře adolescentních mozků vyšší než v dětství, rané dospělosti a ve stáří (33). Hladina bazální sekrece glukokortikoidů u adolescentů vyrůstajících v bídě je vyšší, než u kontrolní populace a je blízká hladinám zjištěným u adolescentů, jejichž matky byly v době jejich raného dětství depresivní. U adolescentů nebylo zjištěno zmenšení objemu hipokampu coby důsledek tělesného nebo sexuálního zneužívání. Zmenšený objem šedé hmoty frontální kůry a přední části g. cinguli u adolescentů vystavených chronickému stresu však zjištěn byl (7). Frontální kůra, která se v průběhu dospívání vyvíjí dramaticky, je tedy na stres vysoce citlivá. Hipokampus je v tomto životním období na rozdíl od prvních dvou let života citlivý jen málo.
V dospělosti ovlivňuje stres lidský mozek podobně jako mozek pokusných zvířat. Na rozdíl od pokusných zvířat však akutní zvýšení hladiny glukokortikoidů výrazně zvyšuje aktivitu emoční paměti, porovná-li se její výkon s ukládáním a vybavováním emočně neutrálních informací (23). Objem hipokampu je u lidí s depresí a posttraumatickým stresovým syndrom menší, odpovídá tomu výkon deklarativní paměti. Menší objem hipokampu u žen s velkou depresí je v asociaci s psychologickou traumatizací v dětství, u žen s depresí, které takto traumatizovány nebyly, rozdíl vůči kontrolám zjištěn nebyl (47).
Hladina glukokortikoidů je u zdravých lidí ve stáří vyšší než v dospělosti. Její korelace s objemem hipokampu je negativní. Podobně negativně jsou ovlivněna struktura a funkce prefrontální kůry.
Stres a pracovní paměť
Pracovní paměť je pojem užívaný pro krátkodobou paměť. Ve zjednodušeném popisu má tři složky:
- fonologickou smyčku,
- vizuospaciální náčrtník,
- centrální řídící složku.
Fonologická smyčka je systém, v němž se ukládají zvukové neřečové a řečové informace, které se, pokud nejsou opakovány, ztrácejí během dvou až tří sekund. Kapacita pracovní paměti je omezená. PET dokládá, že činnost fonologické smyčky souvisí s aktivací levostranné kůry v bezprostředním okolí Sylviovy rýhy (perisylviánské kortexy). Vizuospaciální náčrtník je vázán na činnost zrakové kůry týlních laloků i kůry temenních a čelních laloků. Centrální řídící složka je vázána na činnost předních a dorzolaterálních částí prefrontální kůry (20).
Pracovní paměť lze chápat jako integrátor smyslových informací vstupujících do mozku. Jakékoli hrubší narušení činnosti pracovní paměti z jakéhokoli důvodu je tedy závažné. Stres činnost pracovní paměti poškozuje. Zvyšuje citlivost vůči potenciálně ohrožujícím situacím, takže omezuje schopnost držet irelevantní emoční informaci mimo vědomí. Současně snižuje míru prefrontální aktivace, která je pro zdárnou činnost pracovní pamětí nutná.
Častou zkušenost většiny lidí – poruchu krátkodobé paměti v důsledku stresu – experimentálně otestovala Oei et al. (32). Zdravé mladé muže zatížila Sternbergovým testem krátkodobé paměti. Rozptylujícími podněty byly emočně negativní a neutrální obrázky z Mezinárodního systému afektivních obrázku (IAPS, International affective picture system). Stres byl indukován protokolem TSST (Trier Social Stress Task), který konzistentně zvyšuje hladinu kortisolu ve slinách. Vyšetřovaní lidé v průběhu tohoto testu 10 minut anticipují pětiminutový slovní projev a stejně dlouhý aritmetický úkol před „komisí“ tvořenou třemi psychology, jeden její člen koriguje chybné odpovědi výrokem: „Špatně, znovu!“, na tabuli přitom viditelně zaznamenává skóre. Účastníci pokusu byli vystaveni sociálnímu stresu před vstupem do skeneru. Uvnitř skeneru, to byly hladiny kortisolu v jejich slinách vysoké, byli vystaveni zátěži krátkodobé paměti s užitím emočně negativních a neutrálních obrázků.
Emočně zatěžující rozptylující podněty vyvolávaly po akutním sociálním stresu vyšší míru aktivace „ventrálních“ afektivních oblastí mozku (pravé amygdaly a dolního čelního závitu oboustranně) spojenou s nižší mírou deaktivace „dorzálních“ řídících oblastí mozku (pravé dorsolaterální prefrontální kůry a temenní kůry oboustranně). Akutní stres tedy přesouvá činnost mozku k přednostnímu zpracovávání emočně významných podnětů na úkor pracovní paměti.
Meditace tlumí odpověď na stresující podněty
Meditace „cílená na celou mysl“ (mindfulness meditation; výstižněji by se dala pojmenovat „meditace cílená na sebeuvědomování“) je standardizovaný typ meditace, který tlumí stres. Osmitýdenní výcvik (Mindfullness-Based Stress Reduction; 16) mění u zdravých lidí typ odpovědi na afektivní podněty (8). V průběhu této meditace jedinec soustředí pozornost na právě probíhající niternou a zevní zkušenost, například na dýchání, myšlenky, zvuky, interoceptivní prožitky, tedy na opak řešení problémů nebo „putování mysli“. Pozornost je věnována proměnlivé povaze smyslové zkušenosti, kromě toho je přesouvána mezi jednotlivými smyslovými modalitami.
Meditace zvyšuje aktivitu čelní kůry v oblastech, které patří do systému orientované pozornosti. Kromě toho zvyšuje tloušťku kůry přední insuly, jež se podílí na interocepci. Podobně zvyšuje tloušťku kůry senzorických korových oblast a prefrontálních Brodmanových oblastí 9 a 10. Ty integrují emotivitu s poznáváním. Meditace tohoto druhu tedy ovlivňuje korové oblasti patřící do obvodů pozornosti a zpracovávání interoceptivních a exteroceptivních informací.
Existují sítě niterné, neboli intrinsické konektivity mozku. Synonymem jejich označení je sítě klidového stavu (resting state networks, 35). Mezi ně patří:
- Intrinsický (defaultní) systém (19). Jeho činnost je podkladem sebeuvědomování včetně autoreferenční paměti.
- Řídící kontrolní síť, která odpovídá za rozlišení významu podnětu.
- Lateralizovaná frontoparietální síť odpovídající za pracovní paměť a orientovanou pozornost.
- Sítě, které zpracovávají smyslové informace, a to mediální a laterální zraková, sluchová a senzoricko – motorická (38).
Připomínám, že mozek není „soustava center“, ale soustava „konektomů“, neuronálních sítí velkého rozsahu. Lze předpokládat, že meditace cílená na sebeuvědomování mění funkci těchto sítí, což přispívá ke zvýšené odolnosti vůči stresujícím podnětům. Kilpatricková et al. (18) proto požádala zdravé ženy ve věku 21 až 55 let, které neměly meditační zkušenost, aby jednak prošly osmitýdenním výcvikem, jednak vytvořily kontrolní skupinu. Výcvik v porovnání s kontrolní skupinou:
- zvýšil funkční konektivitu uvnitř sluchové a zrakové sítě;
- zvýšil funkční konektivitu mezi sluchovou kůrou a korovými oblasti, jejichž činnost odpovídá za orientovanou pozornost a intrinsickým (defaultním) systémem odpovídajícím za jáství;
- prohloubil antikorelaci mezi činností zrakové a sluchové kůry;
- prohloubil antikorelaci mezi činností zrakové kůry a korovými oblastmi sloužícími orientované pozornosti jakož i defaultním systémem.
Osm týdnů výcviku v tomto typu meditace tedy mění intrinsickou funkční konektivitu mozku způsobem, jenž mění orientovanou pozornost, zpracovávání smyslových informací a vědomí vlastních smyslových zkušeností.
MUDr. František Koukolík, DrSc.
Oddělení patologie a molekulární medicíny
Národní referenční laboratoř prionových chorob
Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4-Krč
E-mail: frantisek.koukolik@ftn.cz
Sources
1. Adamec R., Holmes A., Blundell J. Vulnerability to lasting anxiogenic effects of brief exposure to predator stimuli: sex, serotonin and other factors relevance to PTSD. Neurosci Biobehav Rev 2008; 32, p. 1287–1292.
2. Albers E.M., Riksen-Walraven J.M., Sweep J.C., et al. Maternal behavior predicts infant cortisol recovery from mild everyday stressor. J Child Psychol Psychiatry 2008; 49, p. 97–103.
3. Bremner J.D., Randall P., Scott T., et al. MRI-based measurement of hippocampal volume in patients with posttraumatic stress. Am J Psychiatry 1995; 152, p. 624–629.
4. Bueller J.A., Aftab M., Sen S., et al. BDNF Val66 Met al.lele is associated with reduced hippocampal volume in healthy subjects. Biol Psychiatry 2006; 59, p. 812–815.
5. Buss C., Lord C., Wadiwalla M., et al. Maternal care modulates the relationship between prenatal risk and hippocampal volume in women but not in men. J Neurosci 2007; 27, p. 2592–2595.
6. Cannon W.B. Stresses and strains of homeostasis. Am J Med Sci 1935; 189, p. 1–14.
7. Cohen R.A., Grieve S., Hoth K.F., et al. Early life stress and morphometry of the adult anterior cingulate cortex and caudate nuclei. Biol Psychiatry 2006, 59, p. 975–982.
8. Farb N.A., Anderson A.K., Mayberg H., et al. Minding one´s emotion: mindfullness training alters the neural expression of sadness. Emotion 2010; 10, p. 25–33.
9. Ganzel B.L., Morris P.A., Wethington E. Allostasis and the human brain: integrating models of stress from the social nad life sciences. Psychol Rev 2010; 117, p. 134–174.
10. Gianaros P.J., Horenstein J.A., Cohen S., et al. Perigenual anterior cingulate morphology covaries with perceived social standing. Soc Cogn Affect Neurosci 2007; 2, p. 161–173.
11. Gianaros P.J., Hariri A.R., Sheu K.L., et al. Preclinical atherosclerosis covaries with individual differences in reactivity and functional connectivity of the amygdala. Biol Psychiatry 2009; 65, p. 943–950.
12. Gould E., McEwen B.S., Tanapat P., et al. Neurogenesis in the dentate gyrus of the adult tree shrew is regulates by pychosocial stress and NMDA receptor activation. J Neurosci 1997; 17, p. 2492–2498.
13. Chen Y., Brunson K.L., Muller M.B., et al. Immunocytochemical distribution of corticotropin-releasing hormone receptor type-1 (CRF 1)-like immunoreactivity in the mouse brain: light microscopy analysis using an antibody directed against the C-terminus. J Comp Neurol 2000; 420, p. 305–323.
14. Joëls M., Karst H., Krugers H.J., et al. Chronic stress: implications for neuronal morphology function and neurogenesis. Front Neuroendocrinol 2007; 28, p. 72-96.
15. Joëls M., Baram T.Z. The neuro-symphony of stress. Nat Rev Neurosci 2009; 10, p. 459–466.
16. Kabat-Zinn J. Full catastrophe living: using the wisdom of your body and mind to face stress, pain and illness. New York, N. Y: Dell Publishing, 1990.
17. Kaplan J.R., Adams M.R., Anthony M.S., et al. Dominant social status and contraceptive hormone treatment inhibit atherogenesis in premenopausal monkeys. Arterioscler Thromb Vasc Biol 1995; 15, p. 2094–2100.
18. Kilpatrick L.A., Sueynobu B.Y., Smith S.R., et al. Impact of mindfulness-based stress Reduction training on intrinsic brain connectivity. NeuroImage 2011; 56, p. 290–298.
19. Koukolík F. Já. O mozku, vědomí a sebeuvědomování. Praha: Karolinum, 2012/2013 (v tisku).
20. Koukolík F. Funkční systémy lidského mozku. Norma a poruchy. 3. rozšířené a přepracované vydání. Praha: Galén, 2012.
21. Lazar S.W., Kerr, C.E., Wasserman R.H., et al. Meditation experience is associated with increases cortical thickness. Neuroreport 2005; 16, p. 1893–1897.
22. Linhorst A.C., Reul J.M. Stress and the brain: solving the puzzle using microdialysis. Pharmacol Biochem Behav 2008; 90, p. 163–173.
23. Lupien S., Fiocco A., Wan N., et al. Stress hormones and human memory function across the lifespan. Psychoneuroendocrinology 2005; 30, p. 225–242.
24. Lupien S., McEwen B.S., Gunar M.R., et al. Effects of stress throughout the lifespan on the brain, behaviour and cognition Nat Rev Neurosci 2009; 10, p. 434–445.
25. Marmot M. Social differentials in health within and between populations. Daedalus 1994; 123, p. 197–216.
26. Marsland A.L., Petersen K.L., Sathanoori R., et al. Interleukin-6 covaries inversely with cognitive performance among middle-aged community volunteers. Psychosom Med 2006; 68, p. 895–903.
27. Marsland A.L., Gianaros P.J., Abramowich S.M., et al. 2 Inteleukin-6 covaries inversely with hippocampal grey matter volume in middle aged adults. Biol Psychiatry 2008; 64, p. 484–490.
28. McEwen B.S., Stellar E. Stress and the individual. Arch Intern Med 1993; 153, p. 2093–2101.
29. McEwen B.S., Gianaros P.J. Stress and allostasis-induced brain plasticity. Annu Rev Med 2011; 62: p. 431–445.
30. McGowan P.O., Sasaki A, D´Alesio A.C., et al. Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse. Nature Neurosci 2009; 12, p. 342–348.
31. O’Connor T.G., Ben Shlomo Y., Heron J. Prenatal anxiety predicts individual differences in cortisol in pre-adolescent children. Biol Psychiatry 2005; 58, p. 211–217.
32. Oei NYL, Veer I.M., Wolf O.T., et al. Stress shifts brain activations towards ventral „affective“ areas durign emotional distraction. SCAN 2012; 7: p. 404–412.
33. Perlman W.R., Webster M.J., Herman M.M., et al. Age-related differences in glucocorticoid receptor mRNA levels in the human brain. Neurobiol Aging 2007; 28, p. 447–458.
34. Sapolsky R., Krey J., McEwen B.S. The neuroendocinology of stress and aging: the glucocorticoide cascade hypothesis. Endocr Rev 1986; 7, p. 284–301.
35. Seeley W.W., Menon V, Schatzberg A.F., et al. Dissociable intrinsic connectivity networks for salience processing and executive control. J Neurosci 2007; 27, p. 2349–2356.
36. Selye H. The stress of life. New York: McGraw-Hill Book Co, 1956.
37. Sheline Y.I. Neuroimaging studies of mood disorder effects on the brain. Biol Psychiatry 2003; 54, p. 338–352.
38. Smith S.M., Fox P.T., Miller K.L., et al. Correspondence of the brai´s functional architecture during activations and rest. Proc Natl Acad Sci USA 2009, 106, p. 13040–13045.
39. Starkman M.N., Gebarski S.S., Berent S., et al. Hippocampal formation volume, memory dysfunction, and cortisol levels in patients with Cushing´s syndrome. Biol Psychiatry 1992; 32, p. 756–765.
40. Starkman M.N., Giordani B., Gebarski S.S., et al. Decrease in cortisol reverses human hippocampal atrophy following treatment of Cushing´s disease. Biol Psychiatry 1999; 46, p. 1595–1602.
41. Starkman M.N., Giordani B., Gebarski S.S., et al. Improvement in learning associated with increases in hippocampal formation volume. Biol Psychiatry 2003; 53, p. 223–238.
42. Sterling P., Eyer J. Allostasis: a new paradigm to explain arousal pathology. In: Fisher S, Reason J (Eds.) Handbook of life stress, cognition, and health. Chichester, UK: John Wiley and Sons, 1988, p. 62–649.
43. Szesko O.R., Lipsky R., Menscthel C., et al. Brain-derived neurotrophic factor val66met polymorphism and volume of the hippocampal formation. Mol Psychiatry 2005; 10, p. 631–636.
44. Ulrich-Lai Y.M., Herman J.P. Neural regulation of endocrine and autonomic stress response. Nat Rev Neurosci 2009; 10, p. 397–409.
45. Valentino R.J., Van Bokstaele E. Convergent regulation of locus coeruleus activity as an adaptive response to stress. Eur J Pharmacol 2008; 583, p. 194–203.
46. Vyas A., Mitra R., Rao B.S.S., et al. Chronic stress induces constraining patterns of dendritic remodeling in hippocampal and amygdaloid neurons J Neurosci 2002; 22, p. 6810–6818.
47. Vythilingam M., Heim Ch., Newport J., et al. Childhood trauma associated with smaller hippocampal volume in women with major depression. Am J Psychiatry 2002, 159, p. 2072–2080.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2012 Issue 6-
All articles in this issue
-
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres - Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
- Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
- Hypertenze, spánek a syndrom obstrukční spánkové apnoe
- Vek ako potenciálny faktor ovplyvňujúci patologické ukazovatele a prognózu ochorenia u pacientov s karcinómom obličky
- Budúcnosť nanotechnológie v medicíne a stomatologii
- Vztah konzumace alkoholu a kouření cigaret
- Prevence návykových nemocí v rodině
- Informovaný souhlas u seniorů v dlouhodobé péči
- Mezinárodní výzkum problematiky paliativní péče u pacientů s demencí
- Porovnání péče soukromých a ambulantních porodních asistentek
- Primární zdravotní péče novou kategorií impaktovaných časopisů databáze Journal Citation Reports
-
Základy kognitivní, afektivní a sociální neurovědy
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
-
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres - Vztah konzumace alkoholu a kouření cigaret
- Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

