-
Medical journals
- Career
Herpes zoster v České republice – epidemiologie a klinické projevy
: J. Smetana 1; M. Salavec 2; V. Boštíková 1; R. Chlíbek 1; P. Boštík 3; I. Hanovcová 1; M. Vacková 1; P. Matulková 1; M. Špliňo 1
: Katedra epidemiologie, Fakulta vojenského zdravotnictví UO, Hradec Králové 1; Katedra dermatovenerologie, Lékařská fakulta UK Hradec Králové, Klinika nemocí kožních a pohlavních, FN Hradec Králové 2; Centrum pokročilých studií, Fakulta vojenského zdravotnictví UO, Hradec Králové 3
: Epidemiol. Mikrobiol. Imunol. 59, 2010, č. 3, s. 138-146
Herpes zoster (pásový opar) je virová kožní infekce projevující se jednostranným lokalizovaným vezikulózním exantémem spojeným s významnou bolestivostí. Původcem je varicella-zoster virus (VZV), který při primoinfekci způsobuje plané neštovice, následně v organismu latentně přetrvává a při reaktivaci vyvolává herpes zoster. Mezi nejvýznamnější komplikace patří postižení nervového systému (zejména postherpetická neuralgie) a oka. Základem léčby jsou antivirotika. Dosud je registrována jediná očkovací látka.
Výskyt pásového oparu v České republice je sporadický, incidence je dlouhodobě stabilní. V letech 1990–2008 byla průměrná roční incidence 6306 případů (61,3 případů/100 000 obyvatel), s minimem 5511 případů (53,5/100 000) v roce 1991 a maximem 6894 případů (67,6/100 000) v roce 2002. Byl zaznamenán 1,4krát vyšší výskyt u žen (69,9/100 000) než u mužů (49,5/100 000). Z pohledu věku je výrazně vyšší riziko rozvoje onemocnění u starších osob. V roce 2008 byl vrchol incidence ve věkové skupině > 70 let (155,0/100 000). Vzestup počtu případů onemocnění začíná ve věkové skupině 45–49 let. Výskyt herpes zoster nevykazuje známky sezonnosti.Klíčová slova:
herpes zoster – incidence – Česká republika – klinické projevy – komplikace.Úvod
Herpes zoster je kožní virová infekce projevující se lokalizovaným vezikulózním exantémem a bolestivostí. Původcem onemocnění je varicella--zoster virus (VZV), který je odpovědný za rozvoj dvou klinicky odlišných onemocnění – varicelly (plané neštovice) a herpes zoster (pásový opar). Varicella je generalizovaným onemocněním a obrazem primoinfekce, která proběhne zpravidla v dětském věku. Naproti tomu herpes zoster je charakteristický výsevem kožních eflorescencí v okrscích inervovaných senzitivními větvemi mozkových či spinálních nervů, je výsledkem endogenní reaktivace VZV a probíhá častěji v dospělém věku.
Etiologie a patogeneze
Varicella-zoster virus je humánní herpetický DNA virus čeledi Herpesviridae, ze skupiny alfa herpesvirů, kam se ještě řadí herpes simplex virus typ 1 a 2 (HSV 1 a 2). Jedná se o vysoce nakažlivý neurotropní virus schopný vyvolávat infekce kůže, sliznic a nervového systému. Virus má schopnost po primární nákaze zůstat různě dlouho latentní a po reaktivaci vyvolat onemocnění. Molekulární hmotnost VZV je udávána 100.106 daltonů, průměr virionu 150–200 nm. Dvošroubovicová DNA se skládá z přibližně 125000 párů bází obklopených kapsidou ze 162 kapsomér [8, 40]. Kapsida je uložena v lipidovém obalu, z něhož vystupují glykoproteiny. Nejznámější z nich je glykoprotein E, který se podílí na vstupu do buněk a umožňuje další šíření viru [4]. Popis kompletního genomu VZV byl poprvé zveřejněn v roce 1986 Davidsonem a Scottem [7]. První izolace viru z tekutiny puchýřků byla provedena Wellerem a Stoddardem v roce 1952 [47].
Při primoinfekci dochází k přechodu virů z kožních afekcí do senzorických nervových zakončení a následně postupují axonálním transportem ke spinálním a kraniálním senzorickým gangliím. Zde dochází k latentní infekci, která je většinou dlouhodobě inaktivní. V případě reaktivace viry putují podél senzorických nervů, kde způsobují neuritidu, opět do kůže. V keratinocytech se replikují a působí zánětlivé změny s nekrózou [3, 24, 26]. Z historického hlediska byl v pochopení patogeneze onemocnění významný objev von Bärensprunga z roku 1848, který prokázal centrum onemocnění ve spinálních gangliích (ganglionitis acuta posterior).
Reaktivaci viru umožňuje oslabení imunitního systému. Klíčovou roli v ochraně proti VZV hraje buňkami zprostředkovaná imunita. Její pokles má úzkou souvislost s incidencí a závažností onemocnění u starších osob. Prodělaný herpes zoster způsobuje stimulaci buněčné imunity, a proto je opakované onemocnění u imunokompetentních osob vzácné [23]. Naproti tomu u imunosuprimovaných osob je opakovaný výskyt možný [17].
Epidemiologie VZV
Herpes zoster není primární infekcí. K jeho rozvoji může dojít v různém časovém odstupu po VZV primoinfekci. Studie prokázaly, že více než 90 % dospělých vykazuje sérologické známky předchozí VZV infekce [48]. Přibližně 99,5 % populace USA ve věku nad 40 let je sérologicky pozitivních [22]. V Itálii je ve věkových kategoriích 20–39 let a > 40 let VZV séroprevalence udávána 91%, respektive 98,4% [11]. Rovněž v České republice data ze sérologického přehledu z r. 1996 uvádějí s věkem se zvyšující promořenost VZV, která již u 5–10letých dětí dosahuje 70–80 % a ve vyšších věkových skupinách je až 90–98% [36]. Stejně jako v jiných zemích nebyly nalezeny signifikantní rozdíly v promořenosti mužů a žen. Všechny osoby, které se již setkaly s VZV, jsou v riziku rozvoje herpes zoster. U 10 až 30% séropozitivních osob dochází v průběhu života k reaktivaci latentní nákazy a rozvoji onemocnění pásovým oparem [42]. Řada studií prokázala častější výskyt u žen než u mužů [20, 30, 31]. Herpes zoster nevykazuje známky sezonnosti a není spojen s epidemickým výskytem jako u varicelly.
Reaktivace VZV a rozvoj pásového oparu je ovlivněna řadou rizikových faktorů, které vedou k potlačení imunity a umožňují klinickou manifestaci onemocnění. Jedním z nejvýznamnějších je věk. Výskyt herpes zoster ovšem není vázán pouze na jednu specifickou věkovou skupinu. Jedná se o onemocnění, které se může objevit v kterémkoli věku. U dětí se však vyskytuje vzácně a jeho incidence je ve srovnání se starší populací velice nízká. S věkem dochází k postupnému nárůstu incidence, vrcholu bývá dosaženo v nejvyšších věkových kategoriích u osob starších 60–70 let [6, 32]. Více než polovina postižených bývá starší 60 let. Data z Velké Británie z let 1994–2001 potvrzují nárůst incidence od 45 let věku s vrcholem v nejvyšších věkových skupinách u mužů i žen. Riziko onemocnění pásovým oparem v průběhu očekávané doby života byla pro muže ve věku 45 let kalkulována na 22 % a pro ženy 32 % [20]. Spolu s věkem roste i riziko závažnějšího průběhu, rozvoje komplikací a nutnosti hospitalizace [14]. Postherpetická neuralgie se u osob starších 70 let objevuje až u 25–50 % postižených [39]. Zatímco věk je příčinou přirozeného poklesu výkonnosti imunitního systému, existuje celá řada stavů vedoucích k imunosupresi, která je dalším rizikovým faktorem reaktivace VZV. Patří mezi ně řada nemocí (leukémie, lymfomy, malignity solidních orgánů, HIV infekce apod.), ale i léčebné postupy (transplantace kostní dřeně i solidních orgánů, chemoterapie, radioterapie apod.) [33]. U těchto stavů je incidence herpes zoster signifikantně vyšší [16, 37, 40]. Průběh bývá závažnější, častěji dochází ke komplikacím a recidivám. Infekce přetrvává více týdnů a vykazuje horší odpověď na antivirovou léčbu. Pásový opar může být i první manifestací HIV infekce. V případě výskytu závažného klinického průběhu, recidiv nebo komplikací je proto vhodné na výše zmíněná onemocnění myslet.
Herpes zoster se nemůže přenášet z člověka na člověka. Kožní léze však obsahují VZV a ten může být přenesen na jedince, kteří s ním nikdy nebyli v kontaktu. Tím u nich hrozí riziko rozvoje varicelly. VZV se u lokalizovaného pásového oparu přenáší těsným kontaktem s lézemi ve fázi kožních puchýřků [46]. Jakmile dojde ke vzniku krust, přestává být nemocný nakažlivý. Přenos viru vzduchem není vyloučen [41].
Incidence herpes zoster v České republice
Výskyt pásového oparu je sporadický, incidence v České republice je dlouhodobě stabilní. V letech 1990–2008 se pohybovala od minima 5511 případů (53,5 případů/100 000 obyvatel) v roce 1991 do maxima 6894 případů (67,6/100 000) v roce 2002 (graf 1). Průměrná roční incidence byla v tomto období 6306 případů (61,3/100 000). Incidence herpes zoster je odlišná u mužů a žen, dlouhodobě byl zaznamenán vyšší výskyt u žen než mužů (graf 2). Průměrná roční incidence byla v letech 1990–2008 u žen 69,9/100 000, zatímco u mužů pouze 49,5/100 000. Incidence u žen byla 1,4krát vyšší než u mužů. Onemocnění se může objevit v každém věku. Výrazně vyšší riziko rozvoje pásového oparu je u starších osob. Vrchol incidence byl v roce 2008 u osob starších 70 let (155,0/100 000), přičemž průměrná incidence byla 61,3/100 000 (graf 3). K vzestupu počtu případů došlo ve věkové kohortě 45–49 let. Vyšší nemocnosti než celková průměrná roční incidence v roce 2008 dosáhly osoby starší 50 let. Vrchol roční incidence u dětí a dospívajících byl v roce 2008 ve věkové kategorii 10–14 let (49,4/100 000). Celkem bylo v roce 2008 hlášeno 6391 případů. Z klinických forem hlášených do systému Epidat převládá podle předpokladu nekomplikovaný herpes zoster. Z komplikací bylo v roce 2008 hlášeno nejčastěji neurologické postižení (meningitida, encefalitida a jiné CNS komplikace – 30, 21, respektive 20 případů), oční postižení (94 případů) a generalizovaný herpes zoster (13 případů). V trendu výskytu komplikací v letech 1997–2008 je v případě neurologických komplikací a očních postižení patrný jednoznačně vzestupný trend (graf 4).
1. Herpes zoster, Česká republika, 1990–2008, absolutní počty případů Zdroj: Epidat, Státní zdravotní ústav, Praha Graph 1. Herpes zoster, Czech Republic, 1990–2008, absolute numbers of cases [Source: Epidat, National Institute of Public Health, Prague] ![Herpes zoster, Česká republika, 1990–2008, absolutní počty případů
Zdroj: Epidat, Státní zdravotní ústav, Praha
Graph 1. Herpes zoster, Czech Republic, 1990–2008, absolute numbers of cases
[Source: Epidat, National Institute of Public Health, Prague]](https://pl-master.mdcdn.cz/media/image/77bfc7c1ca5b98a2cc561424bdde7d8e.png?version=1537790269)
2. Herpes zoster, Česká republika, 1990–2008, počet případů na 100 000 obyvatel podle pohlaví Zdroj: Epidat, Státní zdravotní ústav, Praha Graph 2. Herpes zoster, Czech Republic, 1990–2008, numbers of cases per 100,000 population by sex [Source: Epidat, National Institute of Public Health, Prague] ![Herpes zoster, Česká republika, 1990–2008, počet případů na 100 000 obyvatel podle pohlaví
Zdroj: Epidat, Státní zdravotní ústav, Praha
Graph 2. Herpes zoster, Czech Republic, 1990–2008, numbers of cases per 100,000 population by sex
[Source: Epidat, National Institute of Public Health, Prague]](https://pl-master.mdcdn.cz/media/image/c30a5acd69b1e2651707aa7836783e13.png?version=1537790269)
3. Herpes zoster, Česká republika, 2008, počet případů na 100 000 obyvatel podle věku Zdroj: Epidat, Státní zdravotní ústav, Praha Graph 3. Herpes zoster, Czech Republic, 2008, numbers of cases per 100,000 population by age [Source: Epidat, National Institute of Public Health, Prague] ![Herpes zoster, Česká republika, 2008, počet případů na 100 000 obyvatel podle věku
Zdroj: Epidat, Státní zdravotní ústav, Praha
Graph 3. Herpes zoster, Czech Republic, 2008, numbers of cases per 100,000 population by age
[Source: Epidat, National Institute of Public Health, Prague]](https://pl-master.mdcdn.cz/media/image/970af0cb03e598cd8f9d46a76b9d60cf.png?version=1537790269)
4. Herpes zoster, Česká republika, 1997–2008, trend počtů vybraných komplikací Neurologické komplikace = meningitida, encefalitida a jiné CNS komplikace Zdroj: Epidat, Státní zdravotní ústav, Praha Graph 4. Herpes zoster, Czech Republic, 1997–2008, trends in selected complications Neurological complications = meningitis, encephalitis and other complications of CNS [Source: Epidat, National Institute of Public Health, Prague] ![Herpes zoster, Česká republika, 1997–2008, trend počtů vybraných komplikací
Neurologické komplikace = meningitida, encefalitida a jiné CNS komplikace
Zdroj: Epidat, Státní zdravotní ústav, Praha
Graph 4. Herpes zoster, Czech Republic, 1997–2008, trends in selected complications
Neurological complications = meningitis, encephalitis and other complications of CNS
[Source: Epidat, National Institute of Public Health, Prague]](https://pl-master.mdcdn.cz/media/image/b3b0912ada2d464ff0891b11cfe9b093.png?version=1537790269)
Klinický obraz a průběh onemocnění
Onemocnění začíná prodromálními symptomy. U postižených se objevují zpravidla lokální trvalé či intermitentní příznaky charakterů bolesti, dysestezie, parestezie, svědění a povrchového pálení v oblasti postižených dermatomů a následného výsevu eflorescencí. Z dalších symptomů můžeme zaznamenat zvýšenou teplotu až horečku, bolesti hlavy, otok lymfatických uzlin, malátnost a únavu. Při postižení oblasti hlavy se mohou objevit bolesti zubů, krku a eventuálně ztuhnutí šíje. Začínají nejčastěji několik dnů až 3 týdny před rozvojem vlastních kožních projevů [2, 52].
Vlastní herpes zoster začíná výsevem jednostranného erytému v linii štěpitelnosti kůže, zpravidla ohraničeného na 1–3 dermatomy, s následným rozvojem makulopapulózních změn. V oblasti erytému a papul se během několika hodin objevují výsevy puchýřků uspořádaných ve skupinkách a šířících se k periferii erytému. K výsevům dochází v průběhu 3–5 dnů a jsou výrazem replikace viru. Puchýřky mohou splývat (obr. 1), jejich kryt je poměrně pevný, k praskání dochází spíše výjimečně. V průběhu dalších 3 dnů se objevují pustuly, které postupně vysychají a objevují se žlutohnědavé krusty. Při postižení sliznic dutiny ústní se objevují afty, ploché eroze a ulcerace (intaktní puchýř na sliznici je velmi vzácný). Ke zhojení ložisek dochází po 2–4 týdnech výše popsaných změn, bez vzniku jizev. U závažnějších průběhů (herpes zoster necroticans nebo herpes zoster haemorrhagicus) se mohou jizvy objevit. Jsou značně rozdílné jak do počtu, tak do velikosti. Navíc mohou delší dobu přetrvávat hypestezie, hypalgezie nebo dysestezie v jizvách.
1. Vzhled bulózních eflorescencí u zoster thoracicus Fig. 1. Bullous eruption in herpes zoster thoracicus 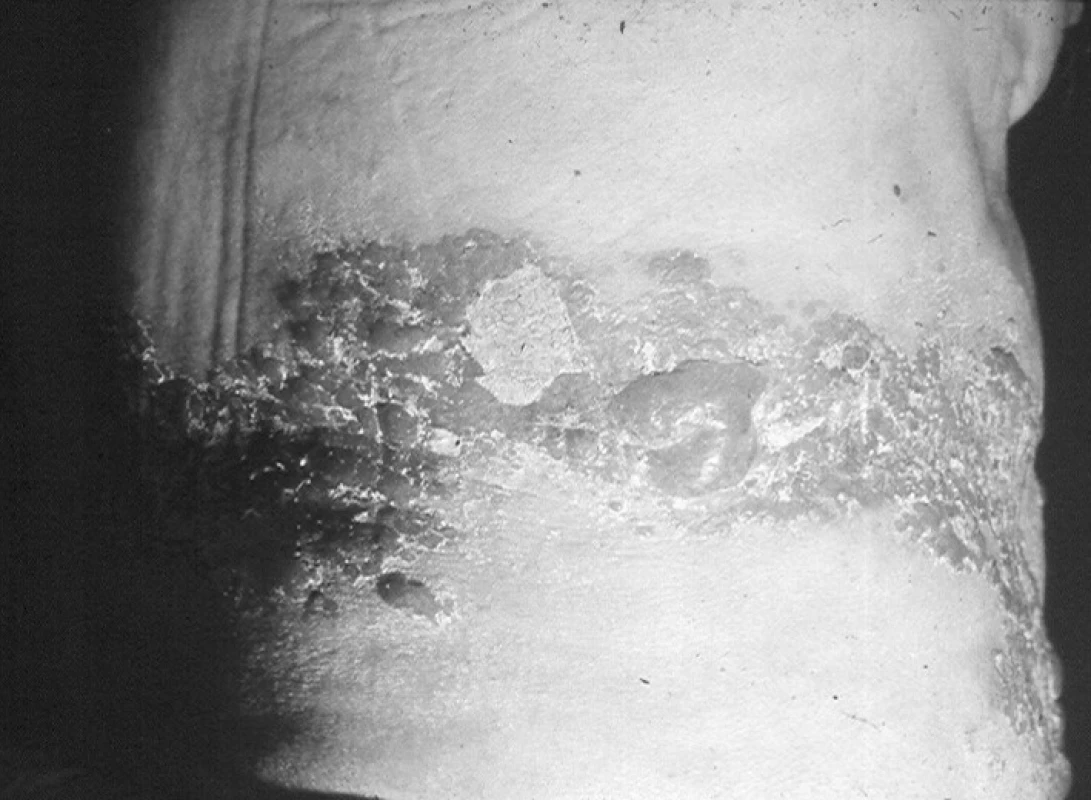
Herpes zoster se může objevit v každém dermatomu, nejčastěji jej ovšem zjišťujeme v oblastech inervovaných mezižeberními nervy a horními větvemi trojklaného nervu. Při postižení jednoho segmentu hovoříme o zoster segmentalis, multisegmentální postižení je označováno jako zoster multiplex unilateralis. Bilaterální postižení bylo prokázáno u méně než 1 % případů imunokompetentních osob [34, 52].
Komplikace herpes zoster
Komplikace se odráží v podobě různých klinických manifestací a závisí především na lokalizaci postižení, věku pacienta a stavu imunitního systému. Komplikované průběhy onemocnění jsou častější u starších osob. Mezi nejčastější patří bakteriální superinfekce v oblasti kožních lézí, komplikace neurologické (neuralgie, paréza lícního nervu, meningoencefalitida, myelitida, ložiskové nebo difuzní postižení mozku spojené s vaskulitidami), oční a viscerální (pneumonie, enterokolitida, myokarditida, pankreatitida) [12, 15, 16, 27]. Popisovány jsou i kožní reakce jako např. jizvení včetně keloidních jizev, nespecifická granulomatózní dermatitida, granulomatózní vaskulitida, tuberkuloidní granulomy, akneformní změny, kontaktní dermatitida a psoriáza [13, 17, 25, 35].
Herpetická neuralgie
Herpes zoster začíná a zpravidla i končí bolestivostí různé intenzity. Akutní bolestivost se objevuje před kožními výsevy a během kožních výsevů, chronické bolesti po odhojení kožních změn. Termínem postherpetická neuralgie rozumíme přetrvávající bolesti po určitém časově definovaném intervalu. Kdy ovšem končí akutní fáze bolestivosti a začíná chronická je sporné [25]. Crooks et al. nově definují bolestivost u herpes zoster jako zoster asociovanou bolestivost (ZAP – zoster associated pain) od začátku až po konec onemocnění [5]. Takto tedy ZAP zahrnují prodromální bolesti, akutní bolesti i postherpetickou neuralgii [9, 10].
Akutní bolesti, nejčastěji popisované jako ostré či bodavé, udává 60–90 % nemocných. Jsou definovány jako bolesti objevující se před rozvojem kožních změn či v jeho průběhu. Většina pacientů udává střední až závažné bolesti s trváním až do 1 měsíce. Příčinou těchto bolestí je akutní ganglionitida s fokální nekrózou. Navíc lze zjistit periferní mononeuritidu a dermální leukocytoklastickou vaskulitidu [9]. Během výsevu kožních změn dochází k zesílení akutní bolesti, poté bolest pomalu regreduje, většinou paralelně s odhojením kožních lézí.
Chronické bolesti asociované s herpes zoster, tzv. postherpetické neuralgie (PHN), které bývají popisovány jako pálící typ bolestí, se většinou objevují během kožního výsevu. Mohou se však objevit až po odhojení kožních projevů. Definice PHN se u různých autorů liší. Typicky jsou jako postherpetická neuralgie charakterizovány bolesti přetrvávající 3–6 měsíců a déle po nástupu kožních projevů. Incidence PHN kolísá v závislosti na definici. Trvat může i roky. Chronické bolesti se objevují nejčastěji u starších jedinců (> 50 let věku) a bývají intenzivnější a časově prodloužené u žen [52]. Intenzita a trvání chronických bolestí jsou mimo jiné závislé i na intenzitě kožních změn a akutních bolestí [18]. Postherpetická neuralgie může výrazně ovlivňovat kvalitu života postižených (poruchy spánku, nálady, snížená pracovní výkonnost, psychické potíže až deprese apod.), a pacient tak často končí v péči psychiatra.
Neurologické komplikace
Motorické parézy se vyskytují u 1–5 % pacientů. Diagnostikována může být myelitida, generalizovaná polyneuritida (Guillain-Barrého typ) a segmentální parézy, často v oblasti krční či lumbální. Až 70 % pacientů vykazuje úplnou remisi [27].
U závažných průběhů, často při postižení první větve trojklaného nervu nebo v případě generalizovaného herpes zoster, je prokázáno vyšší riziko rozvoje meningoencefalitidy či myelitidy. K takovým komplikacím může docházet již před vznikem kožních projevů až do 2 měsíců po odhojení kožních změn.
Generalizovaný herpes zoster
U 17–35 % pacientů s lokalizovanou formou herpes zoster nacházíme menší počet puchýřů mimo oblast postiženého dermatomu. Generalizovaný herpes zoster je definován průkazem více než 50 lézí mimo primárně postižený dermatom. K výsevu dochází nejčastěji v průběhu 1 týdne po začátku kožních změn. Tyto výsevy jsou dány hematogenním šířením VZV. U imunosuprimovaných osob existuje vyšší riziko vzniku generalizovaného herpes zoster [34, 37]. Tato komplikace může být v případě závažné diseminace s hemoragickými splývajícími lézemi či při postižení vnitřních orgánových systémů (plíce, játra) život ohrožující.
Herpes zoster ophtalmicus
Při postižení první větve trojklaného nervu dochází k postižení oka. Tento typ herpes zoster je často provázen hemoragickými a gangrenózními změnami. Okolí očí je intenzivně zarudlé a edematózně prosáklé. Připojuje se preaurikulární lymfadenitida. Oční komplikace dále zahrnují např. konjunktivitidu, ptózu víček, keratitidu, skleritidu, iridocyklitidu, uveitidu, chorioretinitidu, okrajové ulcerace víček a sekundární glaukom [24]. Incidence jedné či více očních komplikací se pohybuje v rozmezí 20–40 % [2, 34]. PHN zde bývá poměrně častá, prolongovaná, většinou těžce probíhající a její incidence stoupá s věkem pacienta.
Herpes zoster oticus
Herpes zoster oticus je charakterizován postižením druhé a/nebo třetí větve trojklaného nervu [45]. Klinická manifestace zahrnuje vedle typických kožních změn parézu lícního nervu, zhoršení sluchu, závratě, tinnitus, hluchotu a přítomnost silné bolesti. Postižení sliznice dutiny ústní aftózními změnami, erozemi, ulceracemi a gingivitidou je pozorováno téměř ve všech případech.
Diagnostika
Diagnóza pásového oparu je většinou stanovena podle klinického obrazu. V prodromálním stadiu je však stanovení diagnózy obtížné. U pacientů lze zjistit různé bolestivé symptomy a parestezie, které mohou být falešně diagnostikovány v závislosti na lokalizaci jako řada jiných diagnóz (erysipel, dermatitida, vředová choroba dvanáctníku, ledvinné koliky, lumboischialgie, infarkt myokardu, apendicitida, infekce herpes simplex, reakce na hmyzí píchnutí, cholecystitida apod.).
Základní hematologická a biochemická laboratorní vyšetření jsou pro potvrzení diagnózy akutního herpes zoster málo významná. Laboratorně se vyskytuje mírná neutropenie. K potvrzení diagnózy může být využit mikroskopickými průkaz viru, průkaz specifických protilátek, průkaz virové DNA pomocí PCR a přímý průkaz viru v buněčných kulturách [17, 38].
Při mikroskopickém průkazu může být virus prokázán z tekutiny puchýře elektron-mikroskopickými (negativní barvení u klinicky atypických onemocnění dospělých) či imunofluorescenčními technikami.
Sérologické testy zahrnují ELISA test, komplement fixační reakci a imunofluorescenční testy. Sérologickými testy detekujeme protilátky třídy IgM nebo IgG [44]. Problém sérologických testů představují možné zkřížené reaktivity, zejména s HSV, eventuálně i s EBV (Epstein-Baarové virus). Navíc jsou sérologické průkazy nepříliš spolehlivé vzhledem k rekurentnímu charakteru infekce.
Vedoucí místo dnes zaujímá polymerázová řetězová reakce (PCR) detekující přítomnost virové nukleové kyseliny (VZV DNA) v dodaném klinickém materiálu (stěry z kožních lézí, periferní krev, vezikulózní materiál, mozkomíšní mok apod.). Vysoká detekční citlivost a obdržení výsledků během několika hodin po odběru klinického materiálu umožňují včas nasadit antivirovou léčbu.
Lze také využít metodu přímé detekce viru na tkáňových kulturách. Tato tzv. gold standard metoda je ale metodou zdlouhavou, pracnou a její citlivost rozhodně nedosahuje citlivosti PCR metod, proto je od ní již v současnosti upouštěno.
Histopatologicky by bylo možné prokázat tenký kryt puchýřku, ložiskovou kolikvaci buněk malpigické vrstvy a balonovou degeneraci buněk stratum basale. Perivaskulárně a v papilách koria je přítomen zánětlivý infiltrát.
Léčba
Cílem terapie pásového oparu je omezení replikace viru a diseminace onemocnění (léčba akutní virové infekce) a současně léčba a prevence s herpes zoster asociovaných akutních a chronických bolestí. Základem je aplikace antivirotik. Mezi doporučovaná systémová antivirotika patří acyklovir, valacyklovir, famcyklovir a brivudin. Používání lokálních antivirotik nemá význam. Včasným zahájením léčby do 72 hodin po výsevu prvních kožních změn [19], popř. již při podezření na vyvíjející se herpes zoster, dochází k příznivému ovlivnění průběhu onemocnění (nižší závažnost a zkrácení doby trvání). Rovněž se udává snížení intenzity postherpetické neuralgie, i když názory na tento účinek nejsou zcela jednoznačné. U acykloviru byla účinnost a bezpečnost ověřena řadou placebem kontrolovaných studií. Woodem et al. byl metaanalýzou prokázán jeho signifikantní efekt v redukci bolestivosti [51], avšak jiné studie efekt redukce doby trvání postherpetických neuralgií neprokázaly [28, 43]. Zvláště důležité je časné zahájení léčby u pacientů nad 50 let věku, s výrazným kožním postižením, s významnou bolestivostí, u osob s lokalizací postižení v oblasti hlavy a u imunosuprimovaných pacientů.
Nezbytnou součástí léčby je analgetická terapie. Jejím základem je podávání paracetamolu nebo nesteroidních analgetik/antiflogistik (indometacin a diklofenak) po dobu několika dnů. V případě trvání intenzivních bolestí se přistupuje k aplikaci silnějších analgetik, eventuálně i invazivních přístupů. Je nutné dbát, aby léčba bolesti byla včas zahájena, správně dávkována a podávána dostatečně dlouhou dobu. K podávání antidepresiv nebo antiepileptik se přistupuje u silných bolestí, zejména u postherpetických neuralgií, nereagujících na předcházející analgetika a nesteroidní antiflogistika. Přesto se u řady pacientů nedaří bolest dostatečně tlumit [21].
Dále se můžeme se setkat se systémovou aplikací kortikosteroidů, která by měla v kombinaci s antivirotiky vést k redukci zánětu, rychlejšímu hojení a snížení akutní bolestivosti. Avšak výsledky studií analyzujících efekt steroidní terapie nejsou jednotné [15, 32, 49, 50]. Systémově mohou být v případě sekundární bakteriální infekce podávána antibiotika. Antihistaminika redukují svědění. Vitaminy (především skupiny B) se stále doporučují, jejich efekt však není zcela jasný.
Součástí léčby je adjuvantní či samostatná lokální terapie, která však vlastní herpes zoster významně neovlivňuje a její smysl je všeobecně sporný. Podle stavu onemocnění se podávají vysušující externa, eventuálně jiné lokální přípravky s obsahem antiseptik nebo antibiotik k zabránění superinfekce. Externa s obsahem zincum oxidatum se nedoporučují aplikovat u zoster ophtalmicus (mohou zhoršit existující postižení při očním kontaktu), ani pro aplikaci do vlasové části hlavy.
Prevence
Cestou, jak zabránit rozvoji herpes zoster, je očkování. Předpokládá se, že jestliže s věkem dochází k poklesu imunity proti VZV, dojde po aplikaci vakcíny k obnovení imunity, což povede k ochraně proti pásovému oparu a jeho komplikacím. Vakcinace je určena především pro rizikové skupiny osob, kam patří jedinci starší 50 let, osoby před očekávanou imunosupresivní léčbou apod.
Doposud jedinou registrovanou vakcínou proti pásovému oparu je živá atenuovaná vakcína Zostavax (Sanofi Pasteur MSD). K její registraci došlo v roce 2006, v České republice však zatím není dostupná. O jejím dovozu se uvažuje. Vzhledem k centrální evropské registraci je její použití v České republice nyní již možné. Tato živá očkovací látka obsahuje oslabený varicella-zoster virus (kmen Oka/Merk), který byl pomnožen na lidských diploidních buňkách (MRC-5). Vakcína je určena k prevenci herpes zoster a postherpetické neuralgie související s herpes zoster u osob ve věku 50 let a starších. V klinické studii Shingles Prevention Study byla účinnost vakcíny Zostavax proti výskytu herpes zoster 51%, proti postherpetické neuralgii 67% [1, 29]. Mezi kontraindikace podání vakcíny se mimo jiné řadí primární a získané stavy imunodeficience (např. akutní a chronická leukémie, lymfomy, imunosuprese v důsledku HIV infekce) a imunosupresivní terapie.
Vzhledem k těmto kontraindikacím a tomu, že imunosuprimovaní jsou v riziku rozvoje herpes zoster, vývoj nových vakcín pokračuje. Cestou jsou rekombinantní subjednotkové vakcíny s adjuvantním systémem. Jedním z vhodných kandidátů na vakcinální antigen je výše zmíněný glykoprotein E, který je součástí obalu VZV virionu a hraje významnou roli v průběhu infekce.
Závěr
Vzhledem k počtům hlášených případů (roční incidence v letech 1990–2008 průměrně 6306 případů na 100 000 obyvatel), nepatří jistě herpes zoster mezi vzácné diagnózy. Jestliže navíc přihlédneme k riziku poměrně závažných komplikací s rizikem snížené kvality života po prodělaném onemocnění (postherpetická neuralgie), patří toto onemocnění do kategorie těch, na které bychom měli být připraveni. Jednoznačným rizikovým faktorem pro rozvoj pásového oparu je věk. Nejvyšší incidence bývá u osob starších 60–70 let. K nárůstu rizika onemocnění dochází již přibližně od 50. roku života. Druhým významným rizikovým faktorem je imunosuprese jakékoli etiologie. Při posuzování vlivu pohlaví byl v České republice v letech 1990–2008 zaznamenán 1,4krát vyšší výskyt herpes zoster u žen než mužů. V posledních letech byl zaznamenán stoupající trend výskytu komplikací, zejména neurologických a očního postižení. Prevencí rozvoje onemocnění je očkování. Proto by měl být dovoz vakcíny, která je nyní v podstatě nedostupná, co nejdříve realizován tak, aby zejména osoby starší 50 let získaly možnost účinné ochrany před tímto závažným onemocněním.
Poděkování: Autoři děkují MUDr. Č. Benešovi (SZÚ Praha) za spolupráci a poskytnutí potřebných statistických informací.
MUDr. Jan Smetana, Ph.D.
Katedra epidemiologie
Fakulta vojenského zdravotnictví UO
Třebešská 1575
500 01 Hradec Králové
e-mail: smetana@pmfhk.cz
Sources
1. Adams, E. N., Parnasy, S., Baptista, P. Herpes zoster and vaccination: a clinical review. Am. J. Health Syst. Pharm., 2010, 1, 67, 9, p. 724–727.
2. Beutner, K. R., Friedman, D. J., Forszpaniak, C. et al. Valaciclovir compared with acyclovir for improved therapy for herpes zoster in immunocompetent adults. Antimicrob. Agents Chemother., 1995, 39, p. 1547–1553.
3. Cohrs, R. J., Gilden, D. H., Mahalingam, R. Varicella zoster virus latency, neurological disease and experimental models: an update. Front Biosci., 2004, 91, p. 751–762.
4. Cole, N. L., Grose, C. Membrane fusion mediated by herpesvirus glycoproteins: the paradigm of varicella/zoster virus. Rev. Med. Virol., 2003, 13, 4, p. 207–222.
5. Crooks, R. J., Jones, D. A., Fiddian, A. P. Zoster-associated chronic pain: an overview of clinical trial with acyclovir. Scand. J. Infect. Dis. Suppl., 1991, 80, p. 62–68.
6. Černý, Z. Changes in the incidence and clinical manifestations of herpes zoster. Čas. Lék. česk., 1996, 135, 8, p. 244–248.
7. Davidson, A. J., Scott, J. E. The complete DNA sequence of varicella-zoster virus. J. Gen. Virol., 1986, 67, p. 1759–1816.
8. Doerr, H. W., Rabenau, H. Dermatotrope Herpesviren. Infektionsbiologie, Epidemiologie und Diagnostik, Chemotherapie, 1996, 1, p. 1–8.
9. Dworkin, R. H., Carrington, D., Cunningham, A. et al. Assessment of pain in herpes zoster: lessons learned from antiviral trials. Antiviral. Res., 1997, 33, p. 73–85.
10. Dworkin, R. H., Portenoy, R. L. Pain and its persistence in Herpes zoster. Pain, 1996, 67, p. 241–251.
11. Gabutti, G., Rota, M. C., Guido, M., Donno, A., Bela, A. et al. The epidemiology of Varicella Zoster Virus infection in Italy. BMC Public Health, 2008, 8, p. 372.
12. Gauthier, A., Breuer, J., Carrington, D., Martin, M., Rémy, V. Epidemiology and cost of herpes zoster and post-herpetic neuralgia in the United Kingdom. Epidemiol. Infect., 2009, 137, 1, p. 38–47.
13. Gibney, M. D., Nahass, G. T., Leonardi, C. L. Cutaneous reactions following herpes zoster infections: report of three cases and a review of the literature. Br. J. Dermatol., 1996, 134, p. 504–509.
14. Gil, A., Gil, R., Alvaro, A., Martín, M., González, A. Burden of herpes zoster requiring hospitalization in Spain dutiny a seven-year period (1998–2004). BMC Infectious Diseases, 2009, 9, p. 55.
15. Gilden, D. Varicella Zoster Virus and Central Nervous System Syndromes. Herpes, 2004, 11, supl. 2, p. 89A–94A.
16. Griffiths, P. D. Herpesviruses and AIDS. J IHMF, 1994, 1, 1, p. 5–11.
17. Gross, G., Schöfer, H., Wassilew, S.W. et al. Herpes zoster guideline of the German Dermatology Society (DDG). J. Clin. Virol., 2003, 26, p. 277–289.
18. Hope-Simpson, R. E. Postherpetic neuralgia. Gen. Pract., 1975, 25, p. 571–575.
19. Huff, J. C., Drucker, J. L., Clemmer, A. et al. Efficacy of oral acyclovir on pain resolution in herpes zoster: a reanalysis. J. Med. Virol., 1993, Suppl. 1, p. 93–96.
20. Chapman, R. S., Cross, K. W., Fleming, D. M. The incidence of shingles and its implications for vaccination policy. Vaccine, 2003, 21, p. 2541–2547.
21. Christo, P. J., Hobelmann, G., Maine, D. N. Post-herpetic neuralgia in older adults: evidence-based approaches to clinical management. Drugs Aging, 2007, 24, p. 1–19.
22. Kilgore, P. E., Kruszon-Moran, D., Seward, J. F. et al. Varicella in Americans from NHANES III: implications for control through routine immunization. J. Med. Virol., 2003, 70, Suppl. 1, p. 111–118.
23. Levin, M. J., Smith, J. G, Kaufhold, R. M., Barber, B. et al. Decline in varicella-zoster virus (VZV) – specific cell-mediated imunity with increasing age and boosting with a high dose VZV vaccine. J. Infect. Dis., 2003, 188, p. 1336–1344.
24. Liesegang, T. J. Varicella zoster viral disease. Mayo Clin. Proc., 1999, 74, p. 983–998.
25. Lilie, H. M., Wassillew, S. W. Varicella-Zoster Virus. Contrib. Microbiol., 1999, 3, p. 111–128.
26. Lungu, O., Annunziato, P. W. Varicella-zoster virus, latency and reactivation. Contrib. Microbiol., 1999, 3, p. 61–75.
27. Malin, J. P. Zoster und Nervensystem. Deutsch. Med. Wochenschr, 1996, 121, p. 635–648.
28. McKendrick, M. W., Care, C., Burke, C. et al. Oral acyclovir in herpes zoster. J. Antimicrob. Chemother., 1984, 14, p. 661–665.
29. Mick, G. Vaccination: a new option to reduce the burden of herpes zoster. Expert Rev. Vaccines, 2010, 9, 3, Suppl., p. 31–35.
30. Opstelten, W., Van Essen, G. A., Schellevis, F., Verheij, T. J. et al. Gender as an independent risk factor for herpes zoster: a population-based prospective. Ann. Epidemiol., 2006, 1006, 16, p. 692–695.
31. Oxman, M. N., Levin, M. J., Johnson, G. R. et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N. Engl. J. Med., 2005, 352, p. 2271–2284.
32. Pasqualucci, A., Pasqualucci, V., Galla, F. et al. Prevention of post-herpetic neuralgia: acyclovir and prednisolone versus epidural local anesthetic and methylprednisolone. Acta Anaesthesiol. Scand., 2000, 44, p. 910–918.
33. Pospíšilová, A. Herpes zoster. Med. Pro Praxi, 2009, 6, 1, p. 38–41.
34. Ragozzino, M. W., Melton, L. J., Kurland, L. T. et al. Population-based study of herpes zoster and its sequelae. Medicine, 1982, 61, p. 310–316.
35. Requena, L., Kutzner, H., Escalonilla, P. et al. Cutaneous reaction at sites of herpes zoster scars: an expanded spectrum. Br. J. Dermatol., 1998, 138, p. 161–168.
36. Roubalová, K., Seman, J. Sérologický přehled protilátek proti herpetickým virům CMV, BV, VZV. Zprávy CEM, 1998, 7, příloha 1, s. 29–31.
37. Rusthoven, J. J., Ahlgren, P., Elhakim, T. et al. Risk factors for varicella zoster disseminated infection among adult cancer patients with localized zoster. Cancer, 1988, 62, p. 1641–1646.
38. Sauerbrei, A. Virologische und serologische Diagnostik des Herpes zoster. PEG DVV, 2. Konsensus Konferenz zur Therapie und Diagnostik des Herpes zoster, 2002, p. 64–78.
39. Scott, F., Johnson, R., Leedham-Green, M. et al. The burden of herpes zoster: A prospective population based study. Vaccine, 2006, 24, p. 1308–1314.
40. Straus, S. S., Ostrove, J. M., Inchauspé, G. et al. Biology, natural history, treatment and prevention. Ann. Int. Med., 1988, 108, p. 221–237.
41. Suzuki, K., Yoshikawa, T., Tomikata, A., Matsunaga, K., Asano, Y. Detection of aerosolized varicella-zoster virus DNA in patients with localized herpes zoster. J. Infect. Dis., 2004, 189, 6, p. 1009–1012.
42. Thomas, S. L., Hall, A. J. What does epidemiology tell us about risk factors for herpes zoster? Lancet Inf. Dis., 2004, 4, p. 26–33.
43. Van den Broek, P. J., Van der Meer, J. W., Mulder, J. D. et al. Limited value to acyclovir in the treatment of uncomplicated herpes zoster: a placebo-controlled study. Infection, 1984, 12, p. 338–341.
44. Van Loon, A. M., Van der Logt, J. T., Heessen, F. W., Heeren, M. C. et al. Antibody – capture ELISA that use enzyme-labelled antigen for detection of virus specific IgM, A and G in patients with varicella or herpes zoster. Epidemiol. Infect., 1992, 108, 1, p. 165–174.
45. Vest, C., Munneke, J. A., Smith, R. Herpes zoster oticus: uncommon but recognizable cause of facial paralysis. Postgrad. Med., 1979, 65, p. 143–150.
46. Weaver, B. A. Herpes Zoster Overview: Natural History and Incidence. J. Am. Osteopath. Assoc., 2009, 109, Suppl. 2, p. S2–S6.
47. Weller, T. H., Stoddard, M. B. Intranuclear inclusion bodies in cultures in human tissue inoculated with varicella vesicle fluid. J. Immunol., 1952, 68, p. 311.
48. Whitley, R. J., Gnann, J. W. Herpes zoster: focus on treatment in older adults. Antiviral. Res., 1999, 44, p. 145–154.
49. Whitley, R. J., Weiss, H., Gnann, J. W., Tyring, S., Mertz, G. J. et al. Acyclovir with and without prednisone for the treatment of herpes zoster. A randomized, placebo-controlled trial. The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Ann. Intern. Med., 1996, 125, 5, p. 376–383.
50. Wood, M. J., Johnson, R. W., McKendrick, M. W., Taylor, J., Mandal, B. K., Crooks, J. A randomized trial of acyclovir for 7 days or 21 days with and without prednisolone for treatment of acute herpes zoster. N. Engl. J. Med., 1 1994, 330, 13, p. 896–900.
51. Wood, M. J., Kay, R., Dworkin, R. H. et al. Oral acyclovir therapy accelerates pain resolution in patients with Herpes zoster: a meta-analysis of placebo-controlled trials. Clin. Infect. Dis., 1996, 22, p. 341-347.
52. Wutzler, P., Meister, W. Herpes zoster – Symptomatologie, demographische daten und prognostische faktoren. Dtsch. Ärztebl., 1997, 17, p. 1129–1133.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2010 Issue 3-
All articles in this issue
- The Use of Molecular Genetics Techniques in Clinical Microbiology – Final Report from the Workshop of the Molecular Microbiology Working Group TIDE
- Examination of Mosquitoes Collected in Southern Moravia in 2006–2008 Tested for Arboviruses
- Tick-Borne Encephalitis in the East Bohemia Region and its Microbiological Diagnostic Pitfalls
-
Lipophilic Yeasts of the Genus Malassezia and Skin Diseases.
I. Seborrhoeic Dermatitis - Pernicious Anaemia – Diagnostic Benefit of the Detection of Autoantibodies against Intrinsic Factor and Gastric Parietal Cells Antigen H+/K+ ATPase
- Prevalence of Anti-Epstein-Barr Virus Antibodies in Children and Adolescents with Secondary Immunodeficiency
- Herpes zoster in the Czech Republic – Epidemiology and Clinical Manifestations
- A Simple Method for the Detection of CD154 (CD40L) on Peripheral Blood Lymphocytes
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Lipophilic Yeasts of the Genus Malassezia and Skin Diseases.
I. Seborrhoeic Dermatitis - Pernicious Anaemia – Diagnostic Benefit of the Detection of Autoantibodies against Intrinsic Factor and Gastric Parietal Cells Antigen H+/K+ ATPase
- Herpes zoster in the Czech Republic – Epidemiology and Clinical Manifestations
- Prevalence of Anti-Epstein-Barr Virus Antibodies in Children and Adolescents with Secondary Immunodeficiency
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

