-
Medical journals
- Career
Doporučení pro diagnostiku a léčbu uveitidy asociované s juvenilní idiopatickou artritidou: Česko-slovenská adaptace evropských doporučení SHARE
Authors: H. Malcová 1; T. Dallos 2; K. Bouchalova 3; I. Brejchová 4; M. Brichová 5; B. Bušányová 6; J. Fabianová 7; J. Fráňová 8; A. Furdová 9; K. Jarošová 10; K. Kobrová 11; B. Kostolná 6; E. Košková 12; M. Lokaj 13; M. Macků 8; J. Melocíková 14; M. Michaličková 5; L. Minxová 15; D. Moravčíková 14; D. Němcová 16; T. Pískovský 17; E. Říhová 5; M. Schüller 7; E. Skalická 18; P. Svozílková 5; D. Tomčíková 6; V. Vargová 19; E. Vrtíková 12; P. Doležalová 16; prof. MUDr. Jarmila Heissigerová, Ph.D., MBA 5
Authors‘ workplace: Oddělení revmatologie dětí a dospělých, Fakultní nemocnice Motol, Praha, ČR 1; Detská klinika LF UK v Bratislave a NÚDCH, Bratislava, SR 2; Dětská klinika, LF UP a FN Olomouc, ČR 3; Nemocnice České Budějovice, ČR 4; Oční klinika VFN a 1. LF UK, Praha, ČR 5; Klinika detskej oftalmológie LF UK a NÚDCH, Bratislava, SR 6; NUTPCHaHCH Vyšné Hágy I, Vysoké Tatry, SR 7; Pediatrická klinika LF MU a FN Brno, ČR 8; Očná klinika LFUK v Bratislave a UNB, Bratislava, SR 9; Revmatologický ústav, Praha, ČR 10; Dětská klinika Masarykovy nemocnice, Ústí nad Labem, ČR 11; Národný ústav reumatických chorôb, Piešťany, SR 12; Dětská oční klinika LF MU a FN Brno, ČR 13; II. detská klinika SZU DFNsP, Banská Bystrica, SR 14; Dětská klinika LF UK a FN Hradec Králové, ČR 15; Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze, ČR 16; Klinika dětského lékařství, Fakultní nemocnice Ostrava, ČR 17; Dětská klinika LF UK a FN Plzeň, ČR 18; Klinika detí a dorastu, LF UPJŠ Košice, SR 19
Published in: Čes-slov Pediat 2020; 75 (5): 303-319.
Category:
Overview
Úvod: Juvenilní idiopatická artritida (JIA) je nejčastější revmatické onemocnění v dětském věku a uveitida je jeho nejvýznamnější extraartikulární manifestací. Doporučení založená na důkazech jsou k dispozici jen omezeně, a proto se management uveitidy asociované s JIA opírá většinou o zkušenosti ošetřujícího lékaře. V důsledku toho se léčebné postupy mohou jak na národní, tak i mezinárodní úrovni velmi lišit. Proto byla v roce 2012 v rámci mezinárodního projektu SHARE (Single Hub and Access Point for Paediatric Rheumatology in Europe) zahájena snaha o optimalizaci a zveřejnění doporučení pro péči o děti a mladé dospělé s revmatickými chorobami, která by usnadnila klinickou praxi pediatrům a (dětským) revmatologům.
Cíl: Přeložit publikovaná mezinárodní doporučení SHARE pro diagnostiku a léčbu uveitidy asociované s JIA a adaptovat je pro použití v České a Slovenské republice.
Metody: Mezinárodní doporučení byla vyvinuta podle standardní metodiky Evropské ligy proti revmatismu (EULAR) skupinou devíti zkušených dětských revmatologů a tří odborníků z oblasti oftalmologie. Vycházela ze systematického přehledu literatury získaného z definovaných literárních zdrojů, které byly hodnoceny formou online průzkumu a následně diskutovány za využití nominální skupinové techniky. K přijetí doporučení došlo na základě dosažení ≥80% shody mezi experty.
Výsledky: Celkem bylo přijato 22 doporučení SHARE: 3 doporučení pro diagnostiku, 5 pro hodnocení aktivity onemocnění, 12 terapeutických a 2 doporučení pro další vývoj. Překlad originálního textu byl aktualizován a modifikován údaji specifickými pro český a slovenský systém zdravotní péče a doplněn o návrh protokolu oftalmologické dispenzarizace pacientů s JIA a algoritmus léčby.
Závěr: Cílem iniciativy SHARE je zlepšit a sjednotit péči o dětské pacienty s revmatickými chorobami v celé Evropě. Proto byla formulována doporučení pro diagnostiku a léčbu uveitidy asociované s JIA založená na důkazech a shodě předních evropských odborníků na tuto problematiku.
Doporučení byla vypracována pro Pracovní skupinu dětské revmatologie při ČPS a SPS a Českou a Slovenskou oftalmologickou společnost.
Klíčová slova:
juvenilní idiopatická artritida (JIA) – uveitida – doporučení
ÚVOD
V roce 2012 byla v rámci projektu SHARE (Single Hub and Access Point for Paediatric Rheumatology in Europe) zahájena snaha o optimalizaci a zveřejnění doporučení pro péči o děti a mladé dospělé s revmatickými chorobami, která by usnadnila klinickou praxi pediatrům a (dětským) revmatologům. Evropská liga proti revmatismu (EULAR) přijala již řadu doporučení z oblasti dětské revmatologie (např. pro juvenilní dermatomyozitidu) [1] připravených podle standardizovaného postupu [2], který je obecně používaným nástrojem pro tvorbu doporučení: Appraisal of Guidelines for Research & Evaluation [3].
Juvenilní idiopatická artritida (JIA) je nejčastější revmatické onemocnění u dětí a uveitida je nejčastějším a potenciálně nejzávažnějším extraartikulárním projevem. Mezinárodně přijatá doporučení pro diagnostiku a léčbu uveitidy asociované s JIA nejsou k dispozici, i když existují některá národní doporučení, např. německá a španělská [4, 5]. Péče o tyto pacienty je tedy často založena na osobní zkušenosti lékaře a jak popsal rozsáhlý výzkum odborníků v této oblasti, při diagnostice i léčbě uveitidy existují v klinické praxi značné rozdíly [6]. S rychlým vývojem nových léčebných možností JIA vzrůstá také potřeba jasných doporučení pro management uveitidy, která by byla založena na nejlepších dostupných důkazech a odborné expertize (v případě nedostatku evidence z klinických studií), a která by pomohla lékařům pečujícím o pacienty s uveitidou při JIA. Takto vytvořená doporučení je potřeba nadále pravidelně aktualizovat. Zatímco použití většiny přípravků v léčbě artritidy je podloženo důkazy v podobě provedených klinických studií, pro pacienty s uveitidou odpovídající data chybějí, nebo není úroveň důkazů pro léčbu uveitidy dostatečně silná pro jejich zavedení do klinické praxe.
Uveitida v rámci JIA bývá nejčastěji chronická přední, zpravidla asymptomatická, ale někdy se můžeme setkat i s akutní přední uveitidou, především při artritidě s entezitidou [7, 8].
Table 1. Doporučení pro diagnostiku a screening uveitidy asociované s juvenilní idiopatickou artritidou (JIA). 
• Shoda uvádí procento odborníků, kteří se shodli na doporučení během závěrečného kola hlasování.
• L – úroveň důkazů; 1A – metaanalýza kohortových studií; 1B – metaanalýza studií případů a kontrol; 2A – kohortové studie: 2B – studie případů a kontrol; 3 – nekomparativní popisné studie; 4 – názor experta;
• S – síla důkazů: A – na základě důkazů úrovně 1; B – založené na úrovni 2 nebo extrapolované z úrovně 1; C – založené na úrovni 3 nebo extrapolované z úrovně 1 nebo 2; D – založené na úrovni 4 nebo extrapolované z úrovně 3 nebo 4.Table 2. Doporučení pro monitorování aktivity onemocnění. 
• Shoda uvádí procento odborníků, kteří se shodli na doporučení během závěrečného kola hlasování.
• L – úroveň důkazů: 1A – metaanalýza kohortových studií; 1B – metaanalýza studií případů a kontrol; 2A – kohortové studie; 2B – studie případů a kontrol; 3 – nekomparativní popisné studie; 4 – názor experta;
• S – síla důkazů: A – na základě důkazů úrovně 1; B – založené na úrovni 2 nebo extrapolované z úrovně 1; C – založené na úrovni 3 nebo extrapolované z úrovně 1 nebo 2; D – založené na úrovni 4 nebo extrapolované z úrovně 3 nebo 4.Cílem expertní skupiny bylo vytvořit doporučení/strategie za účelem:
► zabránit nebo snížit pravděpodobnost rozvoje uveitidy u pacientů s JIA a minimalizovat riziko poškození zraku;
► vytvořit strategii managementu léčby, která účinně potlačí aktivitu zánětu a zabrání rozvoji komplikací vedoucích k ireverzibilnímu poškození zraku.
METODIKA
Na tvorbě doporučení pro uveitidu asociovanou s JIA se podílela skupina 12 odborníků (AH, BV, CP, CE, SC-G, IF, JdB,JA, KW, RG, YU, NW – viz poděkování) v dětské revmatologii (n = 9) a oftalmologii (n = 3). Doporučení vznikla za použití standardizované metodiky EULAR, která definuje způsoby stanovení nejlepší praxe na základě dosažení shody mezi experty podložené publikovanými důkazy [2, 3]. Pro česko-slovenskou adaptaci překladu (HM) byla vytvořena pracovní skupina 30 odborníků zastupujících českou a slovenskou pracovní skupinu dětské revmatologie při České, resp. Slovenské pediatrické společnosti (n = 19) a Českou a Slovenskou oftalmologickou společnost (n = 11).
Systematické vyhledávání literatury
Během února 2015 dva pracovníci týmu SHARE nezávisle na sobě systematicky vyhledávali publikace z let 1970–2014 obsahující termín JIA (včetně známých synonym) v elektronických databázích PubMed/MEDLINE, Embase a Cochrane. Tři odborníci (TC, AP, VB) pak na základě předdefinovaných kritérií vybrali články týkající se vyšetření a/nebo léčby uveitidy asociované s JIA, které předali k hodnocení validity. Základními kritérii bylo vyloučení přehledových článků a kazuistik s méně než 3 dětskými pacienty.
Table 3. Doporučení pro léčbu uveitidy asociované s juvenilní idiopatickou artritidou (JIA). 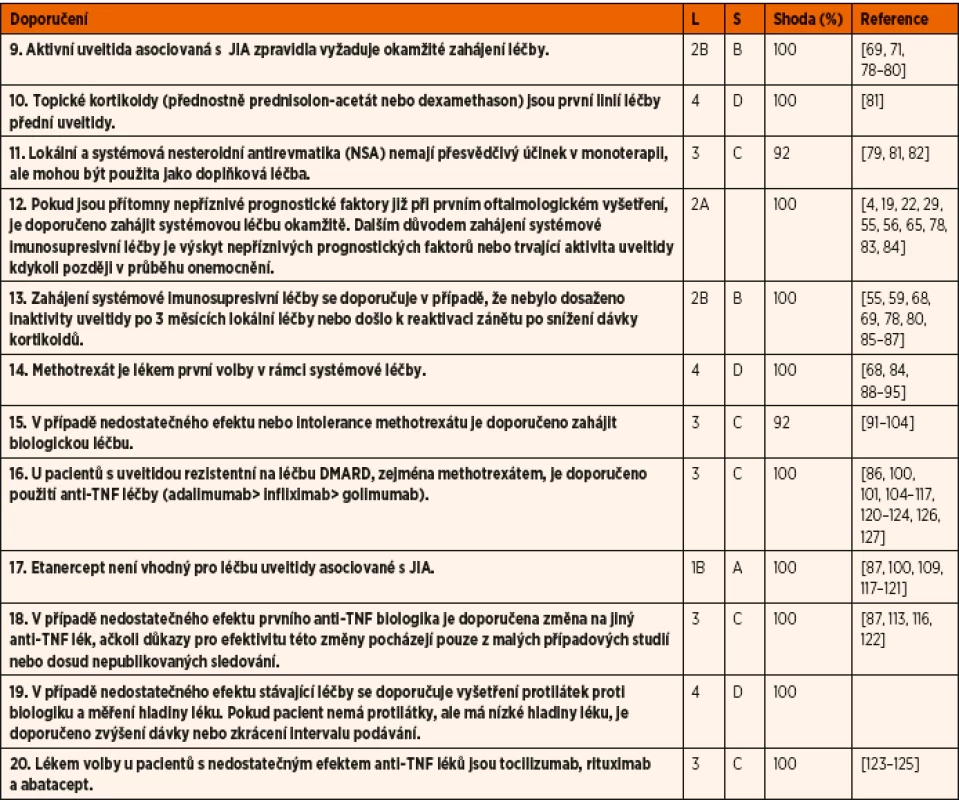
• Shoda uvádí procento odborníků, kteří se shodli na doporučení během závěrečného kola hlasování.
• L – úroveň důkazů: 1A – metaanalýza kohortových studií; 1B – metaanalýza studií případů a kontrol; 2A – kontrolované studie bez randomizace; 2B – kvaziexperimentální studie; 3 –, popisné studie; 4 – názor experta;
• S –, síla důkazů: A – na základě důkazů úrovně 1; B – založené na úrovni 2 nebo extrapolované z úrovně 1; C – založené na úrovni 3 nebo extrapolované z úrovně 1 nebo 2; D – založené na úrovni 4 nebo extrapolované z úrovně 3 nebo 4.
DMARD – chorobu modifikující protirevmatické léky; NSA – nesteroidní protizánětlivé léky; TNF – tumor nekrotizující faktorTable 4. Doporučení pro budoucí vývoj. 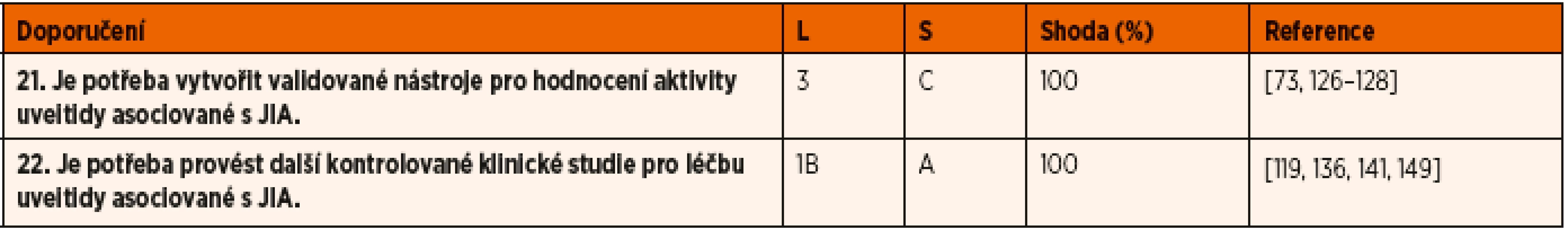
• Shoda uvádí procento odborníků, kteří se shodli na doporučení během závěrečného kola hlasování.
• L – úroveň důkazů: 1A – metaanalýza kohortových studií; 1B – metaanalýza studií případů a kontrol; 2A – kohortové studie; 2B – studie případů a kontrol; 3 – nekomparativní popisné studie; 4 – názor experta (diagnostické studie); 1A – metaanalýza randomizovaných kontrolovaných studií; 1B – randomizované kontrolovaná studie; 2A – kontrolované studie bez randomizace; 2B – kvaziexperimentální studie; 3 – popisné studie; 4 – názor experta (terapeutické studie);
• S – síla důkazů: A na základě důkazů úrovně 1; B – založené na úrovni 2 nebo extrapolované z úrovně 1; C – založené na úrovni 3 nebo extrapolované z úrovně 1 nebo 2; D – založené na úrovni 4 nebo extrapolované z úrovně 3 nebo 4. úroveň důkazů.Posouzení validity publikací
Vybrané články byly náhodně rozděleny mezi dvojice odborníků, kteří nezávisle na sobě posuzovali každou jednotlivou publikaci a hodnotili její obsah a metodologickou kvalitu. Data byla extrahována a hodnocena pomocí předem stanoveného skórovacího systému pro diagnostické a terapeutické studie. Neshody byly řešeny diskusí mezi oběma odborníky nebo stanoviskem třetího odborníka. Úroveň důkazu a síla doporučení byly stanoveny na základě adaptovaných klasifikačních tabulek pro diagnostické, terapeutické a epidemiologické studie [9–11].
Tvorba doporučení
V souladu se standardním postupem EULAR byly formulovány hlavní výsledky a závěry každé publikace spolu s jejich validitou a úrovní důkazů. Tyto podklady byly shrnuty pěti odborníky (TC, GS, YU, RG, JdB) a použity k formulování provizorních doporučení, která byla dále přehodnocena panelem expertů (IF, NW, JdB). Souhrn důkazů byl předložen společně s každým předběžným doporučením odborné komisi. Doporučení byla systematicky diskutována a revidována za použití nominální skupinové techniky pro dosažení konsensu (Nominal Group Technique, NGT) [12] na konferenci 12 odborníků v březnu 2017. Proces NGT byl moderován nehlasujícím expertem (AR). Doporučení byla přijata, pokud bylo dosaženo ≥80% (10 z 12) shody mezi odborníky (včetně všech tří oftalmologů).
VÝSLEDKY
Rešerše literatury
Systematická rešerše literatury přinesla celkem 1323 publikací, po vyřazení duplicit zbylo 1259 unikátních článků. Po dalším přehodnocení na základě vstupních a vylučovacích kritérií zůstalo 176 článků, které byly zpracovávány dále v plném znění a postoupeny k hodnocení odbornou komisí. Z nich pak bylo finálně vybráno 117 pro tvorbu těchto doporučení.
Doporučení
Následující oddíly obsahují jednotlivá doporučení odborné komise podpořená publikovanými daty [13–128]. Tabulky 1–4 shrnují tato doporučení, úroveň důkazů, které poskytují, sílu doporučení a procento odborníků, kteří se na doporučení shodli.
Výchozí stav
JIA je nejčastější chronické revmatické onemocnění dětského věku s incidencí 8,2 (7,5–9,0)/100 000 dětí mladších 16 let za rok a prevalencí přibližně 70,2 (16–140)/100 000 [129–130]. Rozdíly v prevalenci jsou přisuzovány odlišné koncepci zahrnutých studií. Obecně se předpokládá, že celosvětově se incidence liší jen minimálně [130]. Incidence uveitidy asociované s JIA se odhaduje na přibližně 1/100 000 a existují určité důkazy, že je nižší v orientálních populacích pacientů s JIA [7, 131].
Strukturální komplikace uveitidy asociované s JIA, které mohou vést až k nevratné poruše zraku, zahrnují kataraktu, glaukom, zonulární keratopatii, makulární edém, edém papily optického nervu, odchlípení sítnice a následky chronické hypotonie. Průběh uveitidy asociované s JIA je obvykle pozvolný, může být chronický nebo recidivující, nejčastěji se však jedná o chronické relabující onemocnění trvající několik let. Ve většině případů začíná jako přední uveitida, vzácně se rozvine panuveitida. Uveitida asociovaná s JIA se objevuje nejčastěji ve věkové skupině 3–7 let a bývá obvykle asymptomatická. V případě silného zánětu duhovky však může vést k obtížím, jako jsou bolest a zarudnutí oka nebo změny šíře zornice či její zneokrouhlení. Tyto projevy, pokud je zaznamenají rodiče, mohou dovést dítě k návštěvě očního specialisty. U malých dětí se setkáváme s poruchou vizu jen výjimečně, ve velmi těžkých případech, a pak se obvykle jedná o následek nevratného poškození oka. Rizikovými faktory pro rozvoj chronické přední uveitidy jsou přítomnost antinukleárních protilátek (ANA), oligoartikulární forma JIA a časná manifestace artritidy. Časná identifikace těchto rizikových pacientů je prioritou pro cílený screening. Tento text se zabývá pouze chronickou přední uveitidou asociovanou s JIA, nikoli akutní přední uveitidou, se kterou se setkáváme u pacientů s pozitivním antigenem HLA B27 a artritidou spojenou s entezitidou.
Pokud jsou u pacienta přítomny oční komplikace již při prvním vyšetření, v době diagnózy uveitidy, je na místě časná a agresivní léčba. Vzhledem k variabilnímu průběhu onemocnění se však mohou významné komplikace rozvinout i po letech od zahájení léčby. Mezi odborníky stále panuje značná nejednotnost v otázce načasování a indikace navyšování léčby z důvodu trvající aktivity [132, 133].
DOPORUČENÍ PRO DIAGNÓZU A SCREENING
Screening uveitidy asociované s JIA
Každého pacienta s JIA je vhodné oftalmologicky vyšetřit podle aktuálního protokolu dispenzarizace pacientů s JIA. Takový protokol by měl být k dispozici ve všech centrech pečujících o pacienty s JIA [42], přičemž není nezbytně nutné, aby screeningové vyšetření probíhalo ve stejném zařízení jako revmatologická péče. Je obzvláště důležité, aby všichni pacienti, u nichž je vyjádřeno podezření na JIA, byli co nejdříve oftalmologicky vyšetřeni, není nutné čekat na potvrzení diagnózy artritidy v revmatologickém centru. Odpovědností každého dětského revmatologa je zajistit, aby pacient s JIA byl odeslán ke screeningovému vyšetření. Proto je potřeba vybudovat síť oftalmologických pracovišť, která se budou cíleně věnovat screeningovému vyšetření dětí s podezřením na JIA a následné dispenzarizaci pacientů s potvrzenou diagnózou (tab. 1). Dosud publikovaná sdělení naznačují, že původně zvažované rizikové faktory pro vznik chronické uveitidy v populaci pacientů s JIA (časný nástup artritidy, pozitivní ANA a oligoartikulární podtyp JIA) jsou nedostatečné. Ačkoli byla již publikována řada screeningových protokolů, experti se shodují, že žádný z nich není jednoznačně lepší než ostatní [5, 23, 26, 61, 74].
Zatím nebyly identifikovány žádné nové specifické genetické markery, kromě již dříve publikovaných HLA podtypů asociovaných s oligoartikulární JIA a uveitidou [14]. V současné době neexistují důkazy pro to, že by genotypizace byla přínosem pro zlepšení efektivity stávajících screeningových programů. Navzdory pokrokům v subtypizaci ANA protilátek v případě jiných revmatických chorob nedošlo k pokroku v porozumění asociace ANA protilátek s rizikem rozvoje uveitidy u JIA pacientů [28, 34, 35, 41, 60, 67]. K dispozici jsou publikace o roli protilátek proti jaderným strukturám (jako jsou histony a chromatin [21, 41, 52–54, 64, 77]) a také očním antigenům [13, 33, 51, 75]. Dvě studie popsaly, že děti s vyšší zánětlivou aktivitou (sedimentace erytrocytů) v době manifestace oligoartritidy nebo polyartritidy měly zvýšené riziko rozvoje uveitidy [27, 31]. Protokol oftalmologické dispenzarizace pacientů s JIA by měl být přizpůsoben aktuálním možnostem léčby, především časné systémové léčby pro artritidu [57, 61, 62, 64]. Zavedení nových biomarkerů a genotypizace v budoucnu budou moci zlepšit vymezení rizikové populace pro screening.
Monitorování v průběhu choroby (tab. 2)
Riziko rozvoje a/nebo relapsu uveitidy trvá i v průběhu nemoci u pacientů, kteří zpočátku dobře reagují na léčbu. Pravidelná oftalmologická dispenzarizace pacientů s JIA je nezbytnou součástí péče. Odborníci se shodují, že frekvence oftalmologického sledování by měla být závislá na závažnosti očních projevů a měla by vycházet ze vzájemné úzké spolupráce revmatologa se zkušeným oftalmologem.
Dispenzarizace po ukončení léčby pro uveitidu
Methotrexát (MTX) je imunosupresivní lék volby u pacientů s uveitidou při JIA (viz doporučení č. 14, tab. 3). Po dosažení dlouhodobé remise uveitidy je obvykle snaha léčbu MTX ukončit. Není zatím jasné, jak dlouhá by měla být optimální doba trvání remise předtím, než začneme s vysazováním topické i systémové léčby. Pacienti po ukončení léčby MTX mají zvýšené riziko manifestace nebo relapsu uveitidy, hlavně během prvního roku po vysazení, a to i za předpokladu, že ukončení léčby předcházela dlouhá doba inaktivity očního zánětu. V nedávno publikované studii došlo u většiny pacientů během 24 měsíců po ukončení léčby k relapsu aktivity uveitidy [67–70]. Proto by měli být všichni pacienti po ukončení léčby MTX (pro artritidu nebo uveitidu) vyšetřováni oftalmologem každé tři měsíce po dobu minimálně 1 roku. Zatím není také jasné, který z léků je lepší vysazovat dříve (MTX nebo biologika), pokud je pacient léčen kombinací. Relapsy uveitidy po vysazení MTX bývají méně časté u starších pacientů a také u těch, kteří byli léčeni delší dobu [67]. Odborníci se shodují, že ke snižování dávky MTX a jiné systémové léčby by mělo dojít nejdříve po 2 letech inaktivity bez podávání topických kortikoidů [134].
V pravidelném monitorování pacienta je nezbytné pokračovat i po ukončení léčby, především u těch pacientů, kde předcházela dlouhodobá léčba topickými nebo systémovými léky, která udržovala kontrolu nad onemocněním. Odborníci doporučují oftalmologické kontroly po vysazení veškeré léčby minimálně každé 3 měsíce ještě po dobu alespoň 1 roku. Zatím nemáme dostatek vědecky podložených důkazů o účinných screeningových strategiích, které by zajistily pacientovi spolehlivě dlouhodobou nebo celoživotní remisi.
NÁVRH PROTOKOLU OFTALMOLOGICKÉ DISPENZARIZACE PACIENTŮ S JIA V ČESKÉ A SLOVENSKÉ REPUBLICE
Navrhovaný protokol oftalmologické dispenzarizace odlišuje frekvenci kontrol podle typu JIA. Systémová a polyartikulární séropozitivní JIA mají obecně velmi nízké riziko uveitidy, u entezopatické formy bývá uveitida akutní, symptomatická. Proto je u těchto forem JIA doporučena pravidelná oftalmologická kontrola á 6 měsíců. Frekvence kontrol u oligoartikulární, polyartikulární séronegativní a psoriatické artritidy se liší podle 2 kategorií rizika: za dítě s vysokým rizikem uveitidy se považuje pacient s minimálně 1 ze 2 rizikových faktorů: věk manifestace JIA <6 let a ANA pozitivita, za dítě se standardním rizikem uveitidy se pak považuje pacient, který nesplňuje kritéria zvýšeného rizika (nemá ani 1 ze 2 rizikových faktorů) (tab. 5).
#648859
Každý pacient s nově zjištěnou JIA by měl absolvovat oftalmologické vyšetření bezodkladně, jsou-li přítomny klinické známky uveitidy (zarudnutí, absence nebo asymetrie fotoreakce, anamnéza fotofobie apod.), nebo do 1 měsíce od stanovení diagnózy JIA, jestliže nejsou přítomny klinické známky uveitidy. Dítě s nově zjištěnou JIA s vysokým rizikem uveitidy, u kterého z důvodu jeho (opakované) nespolupráce při oftalmologickém vyšetření není možno s jistotou vyloučit uveitidu, je indikováno k oftalmologickému vyšetření v celkové anestezii. U dítěte jakéhokoliv věku s JIA s vysokým rizikem uveitidy anebo uveitidou v anamnéze, u kterého byla ukončena dlouhodobá imunosupresivní léčba, se frekvence oftalmologických vyšetření zvyšuje na 3měsíční intervaly na dobu minimálně 1 roku. Každé dítě s JIA bez ohledu na rizikové faktory a typ JIA musí do věku 18 let absolvovat oftalmologické vyšetření minimálně dvakrát za rok. U dítěte, u kterého byla jednou diagnostikována uveitida, se frekvence oftalmologických kontrol řídí aktivitou onemocnění podle doporučení oftalmologa, ale je minimálně jednou za 3 měsíce bez ohledu na věk dítěte, subtyp JIA a přítomnost rizikových faktorů.
Oftalmologickým vyšetřením v kontextu tohoto protokolu se rozumí kompletní vyšetření včetně biomikroskopie předního segmentu obou očí a vyšetření očního pozadí v mydriáze. Součástí pravidelného očního sledování pacientů s JIA je i měření nitroočního tlaku (NOT) a věkově specifické vyšetření vizu. Vyšetření by mělo probíhat v oftalmologické ambulanci spolupracující s ambulancí dětské revmatologie, která má zkušenosti s dětskými pacienty s uveitidou.
DOPORUČENÍ PRO HODNOCENÍ AKTIVITY UVEITIDY ASOCIOVANÉ S JIA
Hlavním cílem je včasná diagnostika a účinná léčba, které mohou předejít poškození zraku. To je následkem především komplikací zánětu, jako jsou glaukom, makulární edém, hypotonie bulbu a amblyopie. Strukturální poškození se může objevit ještě před stanovením diagnózy nebo vzniká v dalším průběhu následkem nedostatečně kontrolované zánětlivé aktivity anebo terapie kortikoidy. Studie opakovaně potvrdily, že hlavní rizikové faktory poškození zraku jsou následující: pozdní stanovení diagnózy s již vytvořenými komplikacemi, potřeba chirurgických zákroků, celková délka sledování [4, 68, 78]. Pro některé komplikace se jeví jako rizikové i mužské pohlaví a nekavkazská rasa [18, 19, 37, 56, 65, 71].
Cílem imunosupresivní léčby je proto snížení aktivity hodnocené pomocí dohodnutých parametrů, které zahrnují počet zánětlivých buněk a stupeň zákalu (flare) v přední komoře a přítomnost makulárního edému. Vhodnost jednotlivých parametrů se může lišit podle stupně poškození nebo stadia onemocnění [13, 5]. V jedné studii bylo zvýšení počtu buněk v přední komoře spojeno s horší prognózou, zatímco imunoterapie byla asociována se sníženým rizikem ztráty zraku, zejména v případě 20/50 nebo horšího výsledku (HR 0,40, P< 0,01) [78]. Jiné studie popisují flare v přední komoře jako lepší prediktor poškození zraku [63]. V současné době nejsou k dispozici žádné validované biomarkery, které by mohly být použity pro predikci závažnosti onemocnění nebo strategii léčby uveitidy a tato oblast vyžaduje další výzkum (tab. 4) [24, 32, 34, 35, 40, 44, 49, 75–80]. Dokud nebudou validovány spolehlivé biomarkery, je management uveitidy závislý především na opakovaném očním vyšetření. V budoucnu by však monitorování aktivity uveitidy mohlo zahrnovat genovou expresi a proteomické profilování séra, leukocytů periferní krve a sklivce; měření reaktantů akutní fáze; HLA typizaci a testování ANA protilátek [74].
Doporučení odborných společností (Německé oftalmologické společnosti, Společnosti pro dětskou a adolescentní revmatologii a Německé společnosti pro revmatologii) zdůrazňují, že makulární edém, oční hypotonie a pseudorubeóza jsou často spojeny s chronickým zánětem, tyto nálezy by měly vést k zahájení (nebo posílení) léčby i v případě absence buněk v přední komoře [4]. Expertní skupina také doporučuje, aby cílem léčby uveitidy při JIA byla absence buněk v přední komoře, ačkoli toho v praxi nemusí být jednoduché dosáhnout (tab. 6). S ohledem na závěry pracovní skupiny pro standardizaci nomenklatury uveitidy (SUN) vypracovala mezinárodní skupina MIWGUC (Multinational Interdisciplinary Working Group for Uveitis in Childhood) soubor ukazatelů aktivity uveitidy, které mohou poskytnout základ pro hodnocení závažnosti onemocnění a jeho průběhu, rizika strukturálního poškození, úrovně poškození zraku a posouzení efektu léčby [74]. Jejich přínos by byl neocenitelný v klinických studiích, je však potřeba navržené parametry validovat pro dětský věk [136]. Základem rozhodnutí o managementu léčby zůstává dobrá komunikace mezi oftalmologem a dětským revmatologem. Nedávno publikované pokyny pro management neinfekční uveitidy u dospělých obsahují některé důležité zásady pro léčbu panuveitidy ve všech věkových skupinách [137].
Table 5. Parametry navrhované pro hodnocení aktivity uveitidy asociované s JIA (vypracováno skupinou MIWGUC [74, 153]). ![Parametry navrhované pro hodnocení aktivity uveitidy asociované s JIA (vypracováno skupinou MIWGUC [74, 153]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/702c996f5ab5b2d48286b4f8fae1eef5.png)
*Vhodné dokumentovat, ačkoli nepatří k hodnocení aktivity.
SUN – Standardizovaná nomenklatura uveitidy
EYEQL – The Effects of Youngsters’ Eyesight QOLDOPORUČENÍ PRO LÉČBU UVEITIDY ASOCIOVANÉ S JIA
Aktivní uveitida vyžaduje okamžité zahájení léčby. Při srovnávání dvou souborů pacientů s nově diagnostikovanou JIA pacienti, u kterých byla časně zahájena agresivní léčba a byli intenzivně sledováni, vykazovali s odstupem deseti let méně komplikací spojených s poškozením zraku [80]. Faktory spojené s lepšími výsledky jsou: časné zahájení imunosupresivní terapie v mladším věku [69] a léčba imunosupresivy obecně [71, 78].
Lékem první volby pro akutní i chronickou přední uveitidu jsou topické kortikoidy (přednostně prednisolon nebo dexamethason) [4, 5, 81, 129]. Děti s JIA a uveitidou jsou často léčené topickými kortikoidy dlouhodobě, což zvyšuje riziko rozvoje komplikací, především katarakty a glaukomu. Jedna studie prokázala, že zvýšené riziko rozvoje katarakty spojené s podáváním vysokých dávek topických kortikoidů bylo nezávislé na aktivitě uveitidy nebo přítomnosti zadních synechií [81]. Riziko se zvyšovalo s počtem kapek lokálních kortikoidů. Z analýzy dat vyplývá, že dlouhodobé podávání nízkých dávek topických kortikoidů (≤3 kapek denně) (0,5 až 15 let, medián 4 roky) je spojeno s nízkým rizikem rozvoje katarakty [81]. Při podávání 2 a méně kapek denně se katarakta během jednoho roku prakticky nevyskytla. Neexistují důkazy, které by naznačovaly, že méně účinné topické kortikoidy jsou spojeny s nižším rizikem nežádoucích účinků u těchto pacientů (tab. 3). Systémové kortikoidy se snažíme u dětí podávat minimálně, především z důvodu rizika poruchy růstu a osteopenie; ve výjimečných případech se používají pro dosažení rychlé kontroly zánětu nebo při makulárním edému.
V jedné retrospektivní studii bylo hodnoceno používání topických nesteroidních antirevmatik (NSA) v léčbě chronické uveitidy u 14 pacientů, 8 s JIA a 6 s idiopatickou iridocyklitidou [82]. U všech pacientů došlo ke snížení aktivity uveitidy po přidání NSA ke stávajícímu léčebnému režimu, což umožnilo snížení dávky kortikoidů. Tyto údaje naznačují, že terapie NSA může mít doplňkovou úlohu v léčbě chronické uveitidy u dětí, nesteroidní antirevmatika by se však neměla podávat v monoterapii.
Ke snížení rizika komplikací v případech, kdy topická léčba nevede k remisi očního zánětu nebo pacient vyžaduje vysoké dávky topických kortikoidů, se doporučuje zahájení systémové imunosupresivní léčby. Jak bylo zmíněno dříve, u pacientů s vícečetným rizikem ztráty zraku je vhodné zahájit systémovou léčbu velmi časně [129]. V případě přítomnosti nepříznivých prognostických faktorů u aktivní uveitidy je možné zahájit systémovou léčbu okamžitě, již při prvním oftalmologickém vyšetření. Některé studie doporučují zahájení agresivní imunosupresivní léčby u vysoce rizikových pacientů ještě předtím, než se objeví známky rozvoje komplikací [27, 39]. Mezi nepříznivé prognostické faktory patří: uveitida předcházející manifestaci artritidy [19, 22, 74]; přítomnost zadních synechií [55, 68, 74, 75]; mužské pohlaví [19, 22, 55]; zonulární keratopatie, glaukom a katarakta [55]; poruchy vizu iniciálně, hypotonie, makulární edém a denzní opacity sklivce [55]; trvající aktivita v průběhu sledování (tab. 3). Věk v době nástupu uveitidy se nezdá být významným rizikovým faktorem [22, 56].
Definice selhání léčby
Selhání léčby by mělo vést ke změně dávky léku, způsobu podávání nebo charakteru léku, přičemž je potřeba zohlednit skutečnost, že doba do dosažení optimálního účinku se v případě jednotlivých léků může lišit a také máme k dispozici pouze omezený počet léčebných modalit. V retrospektivní studii, kde bylo hodnoceno 23 pacientů s uveitidou při JIA neodpovídající na léčbu topickými kortikoidy, došlo u všech pacientů ke zlepšení po zahájení systémové imunosupresivní léčby [86]. Pacienti, u kterých byla zahájena léčba během 4–30 měsíců po manifestaci uveitidy, dosáhli lepšího výsledku ve srovnání s pacienty, kteří dostali imunosupresivní léčbu po 3 a více letech (P <0,005 pravé a levé oko dohromady, P = 0,0075 pro lepší oko, P = 0,0375 pro horší oko). Tato data jsou podporována závěry studie SITE, která uvádí, že u pacientů s uveitidou a JIA, kteří byli léčeni imunosupresivními léky v terciárním centru, se snížilo riziko ztráty zraku o zhruba 60 % [78].
Expertní skupina doporučuje zahájení systémové imunosupresivní léčby, pokud není dosaženo inaktivity uveitidy po 3 měsících léčby topickými kortikoidy, nebo dojde k reaktivaci zánětu po snížení jejich dávky. Výhody časného zahájení imunosupresivní léčby jsou dnes dobře známé a u pacientů, kteří dosáhli remise uveitidy, byla obecně zahájena systémová léčba dříve v průběhu onemocnění ve srovnání s pacienty s relapsem uveitidy [55, 59, 68, 78–87]. Na základě znalostí o účinnosti a bezpečnosti MTX z řady studií doporučuje odborná skupina u pacientů s uveitidou asociovanou s JIA tento lék jako imunosupresivum první volby [68, 84, 88–90]. Upřednostňuje se subkutánní aplikace a dávka 10–15 mg/m2 1krát týdně [138]. Vyšší dávky MTX (15–20 mg/m2/týden) vedou k dosažení remise v kratší době ve srovnání s dávkami MTX <15 mg/m2/týden při srovnatelném výskytu nežádoucích účinků [139].
U pacientů s uveitidou, často v případě selhání MTX, byl zvažován efekt dalších imunosupresiv, jako je azathioprin, sulfasalazin, mykofenolát mofetil, cyklosporin a leflunomid [91, 95]. Jednalo se však většinou o studie s malým počtem pacientů a v případě cyklosporinu byla klinická účinnost nedostatečná a autoři originálního článku poznamenávají, že má jen omezenou efektivitu v této indikaci [94]. Výsledky s dalšími imunosupresivy byly povzbudivější, ale na ještě menším počtu pacientů [91–93, 95]. Mohly by být alternativou MTX při jeho intoleranci nebo nedostatečném efektu, zejména však v kombinaci s biologickou léčbou. U dětí existuje mnoho důkazů o lepší účinnosti MTX v ovlivnění artritidy u JIA ve srovnání s jinými konvenčními syntetickými imunosupresivy. Na rozdíl od toho u dospělých pacientů je podávání různých imunosupresivních léků běžné bez preference MTX [91–95]. Odborníci se shodují, že u dětí i dospělých s uveitidou, která nedostatečně reaguje na podávání MTX (nebo jiného z klasických imunosupresiv), je vhodné zahájit biologickou léčbu. Roste počet studií, které podporují zahájení biologické léčby v případě refrakterní uveitidy [93–108], zatím největší evidenci má adalimumab. Další z biologických léků, jejichž použití v léčbě uveitidy je popisováno v literatuře, jsou infliximab, golimumab, abatacept, tocilizumab a rituximab [96–108, 123–125].
Používání blokátorů tumor nekrotizujícího faktoru (TNF) v léčbě uveitidy je založené na jejich prokázané účinnosti u řady systémových zánětlivých chorob včetně JIA, revmatoidní artritidy a Crohnovy choroby [109]. Výjimkou je etanercept, rekombinantní dimerický fúzní protein, který antagonizuje TNF-α a má prokázanou účinnost u polyartikulární JIA [118]. V případě léčby uveitidy byl však etanercept spojen s vysokým rizikem relapsů uveitidy [87, 100, 109, 117–121], proto není doporučeno etanercept používat v léčbě uveitidy asociované s JIA [140].
Existuje velmi málo studií, které by srovnávaly jednotlivé biologické preparáty navzájem. Jedna studie zjistila, že u dětí s refrakterní chronickou uveitidou asociovanou s JIA je infliximab významně lepší než etanercept [100]. V jiné malé studii byl adalimumab účinnější než infliximab, jestliže byl použit jako TNF-α blokující léčba první volby [106]. Adalimumab versus infliximab byl účinnější v dosažení remise a měl lepší bezpečnostní profil u pacientů s uveitidou a JIA i v dlouhodobém sledování [102, 107]. Na základě randomizované kontrolované studie SYCAMORE srovnávající adalimumab s placebem u pacientů s JIA uveitidou po selhání MTX byl adalimumab jako první biologikum schválen pro léčbu chronické přední uveitidy u dětí [136]. Data z této studie podpořila později další randomizovaná studie ADJUVITE prokazující efekt adalimumabu na JIA uveitidu po selhání topických kortikoidů a MTX [141]. Expertní skupina proto doporučuje zahájení anti-TNF terapie (v pořadí adalimumab> infliximab> golimumab) u pacientů s uveitidou refrakterní na léčbu konvenčními chorobu modifikujícími léky (csDMARD), zejména MTX [86, 100–127].
Závěry studií na malých počtech pacientů ukazují, že pokud je léčba jedním z TNF-α blokátorů nedostatečně účinná, je vhodné provést změnu na jiný přípravek téže skupiny [87, 113, 116, 122]. Účinnost a bezpečnost adalimumabu byla hodnocena u 26 dětí s JIA rezistentní na současnou terapii (syntetická konvenční DMARD v 17 případech a anti-TNF léky v 9 případech). Změna na adalimumab měla příznivý vliv na kontrolu onemocnění u 17 (65,4 %) pacientů [113]. V jiné studii bylo 17 pacientů s těžkou refrakterní uveitidou (rezistentní na etanercept, infliximab, adalimumab, rituximab nebo abatacept) převedeno na golimumab a u 14 bylo dosaženo zlepšení, 12 z těchto pacientů mělo při posledním vyšetření inaktivitu (průměrná doba trvání 22 měsíců, interval 6–29 měsíců) [116]. Dhingra a kol. publikovali předběžné důkazy o tom, že u 7 pacientů s refrakterní uveitidou změna na jiné biologikum (období 5–24 měsíců) vedla k lepší kontrole nitroočního zánětu [122]. Při revizi literatury sice nebyly zjištěny žádné přímé důkazy o vlivu nízkých hladin léků nebo tvorby protilátek proti lékům (anti-drug antibodies, ADA) na klinickou účinnost biologické léčby u pacientů s uveitidou, nicméně odborná skupina zohlednila nálezy z jiných klinických studií a dospěla k závěru, že v případě ztráty účinnosti v průběhu léčby je potřeba provést vyšetření ADA a hladiny léku [142, 143]. Pokud pacient nemá přítomné protilátky, ale má nízkou hladinu léku, je vhodné zvážit zvýšení dávky nebo zkrácení intervalu podávání [144]. Konkomitantní podávání imunosupresivních léků, především MTX, naopak potlačuje tvorbu ADA [145].
Na základě údajů z menších studií (viz doporučení 18, tab. 3) u pacientů s uveitidou a JIA, kteří jsou refrakterní ke konvenčním syntetickým lékům a alespoň jednomu léku ze skupiny blokátorů TNF, lze zvážit podávání jiného biologika, např. abatacept, rituximab nebo tocilizumab [123–125]. Účinnost intravenózního tocilizumabu v léčbě JIA uveitidy po selhání nebiologických DMARDs a minimálně jednoho anti-TNF biologika prokázaly dvě menší retrospektivní studie [146–147]. Existuje stále více důkazů o pozitivním efektu tocilizumabu v ovlivnění makulárního edému při uveitidě [125, 148]. Aktuálně probíhá studie ověřující účinnost a bezpečnost subkutánního tocilizumabu u dětí s uveitidou při JIA refrakterní k anti-TNF terapii [149].
Optimální doba pro provádění chirurgických zákroků u dětí s komplikacemi na podkladě refrakterní uveitidy nebyla v rámci těchto doporučení diskutována vzhledem k nedostatku evidence. Aktuální údaje však ukazují, že je ještě stále významný počet dětí s uveitidou, které vyžadují chirurgický zákrok z důvodů vzniklých komplikací [150].
Na základě evropských doporučení SHARE se pracovní skupina zahrnující autory tohoto článku shodla na léčebném algoritmu pro léčbu uveitidy asociované s JIA v České a Slovenské republice, který je uveden ve schématu 1.
Schéma 1. Léčebný algoritmus doporučený pro léčbu uveitidy asociované s JIA v ČR a SR. Adaptováno podle Heiligenhaus Seminars in Arthritis and Rheumatism (2019) [152], Clarke Pediatric Rheumatol (2016) [7] a Bou Rheumatol Int (2015) [5]. Cílem na všech úrovních je minimalizovat dávku topických kortikoidů na ≤2 kapky denně za dosažení počtu buněk v přední komoře ≤0,5+ (max. 1–5 buněk v poli). Legenda: hod – hodiny, PK – přední komora, měs – měsíc, MTX – methotrexát, SUN –Standardizovaná nomenklatura uveitidy, tý – týden ![Schéma 1. Léčebný algoritmus doporučený pro léčbu uveitidy asociované s JIA v ČR a SR. Adaptováno podle Heiligenhaus Seminars in Arthritis and Rheumatism (2019) [152], Clarke Pediatric Rheumatol (2016) [7] a Bou Rheumatol Int (2015) [5]. Cílem na všech úrovních je minimalizovat dávku topických kortikoidů na ≤2 kapky denně za dosažení počtu buněk v přední komoře ≤0,5+ (max. 1–5 buněk v poli). Legenda: hod – hodiny, PK – přední komora, měs – měsíc, MTX – methotrexát, SUN –Standardizovaná nomenklatura uveitidy, tý – týden](https://pl-master.mdcdn.cz/media/image_pdf/667d8de00d333870a9edaa4432dc48ba.png?version=1599827331)
DOPORUČENÍ OHLEDNĚ BUDOUCÍCH PLÁNŮ PRO UVEITIDU ASOCIOVANOU S JIA
Odborné společnosti cítí potřebu provádění dalších klinických a longitudinálních studií s cílem porovnat přínos a náklady spojené s léčbou chronické uveitidy asociované s JIA [74]. K dosažení tohoto cíle navrhuje skupina MIWGUC soubor parametrů pro hodnocení aktivity uveitidy za účelem standardizace dat a srovnávání výsledků (tab. 6). Jednotlivé body by měly být odsouhlaseny jak výzkumnými pracovníky, tak pa - cienty. Přestože se na navrženém souboru parametrů členové pracovní skupiny jednomyslně shodují, nedají se zatím obecně použít v praxi, dokud neprojdou validací. Poté by mohly poskytnout jednotné hodnocení v případě intervenčních studií. Zhoršení zraku má významný dopad na kvalitu života (QOL) pacientů s uveitidou asociovanou s JIA, významně ovlivňuje sociální, emoční a ekonomické aspekty života, stejně tak jako schopnost jednotlivce provádět každodenní činnosti [126–128]. V současné době probíhá validace užitečného nástroje pro měření vlivu uveitidy na QOL, jedná se o „The Effects of Youngsters’ Eyesight QOL“. Mezi odborníky panuje shoda o potřebě dalších kontrolovaných klinických studií u dětí s uveitidou při JIA tak, aby se zvýšila evidence v oblasti diagnostiky, screeningu, aktivity onemocnění a léčby a aby mohla být zajištěna optimální péče o tyto pacienty.
DISKUSE
Po systematickém studiu literatury, za použití Nominální skupinové techniky, pod záštitou SHARE a EULAR, bylo přijato celkem 22 doporučení pro diagnostiku a screening, monitorování aktivity, léčbu a budoucí plány u dětí s uveitidou asociovanou s JIA. Tato doporučení byla přijata na základě minimálně 80% shody odborníků. Doporučení vytvořená experty na základě dostupné evidence by měla pomoci zlepšit poskytování optimální péče pacientům především tam, kde důkazy jsou založené jen na omezeném počtu subjektů a rychle se mění.
Je třeba poznamenat, že úroveň důkazů u těchto doporučení byla obecně poměrně nízká, 13 z 22 doporučení má úroveň 3 nebo 4, 7 úroveň 2 a pouze dvě úroveň 1. Mnoho nových léků, zejména z oblasti biologik, bylo zavedeno až v poslední době a další výzkum v této oblasti následuje. V době, kdy proběhlo vyhledávání dat pro doporučení SHARE, nebyly k dispozici téměř žádné kontrolované klinické studie u dětí s uveitidou při JIA. Až po vydání doporučení SHARE byly publikovány výsledky randomizované kontrolované studie (RCT) SYCAMORE [136] srovnávající adalimumab s placebem u dětí s uveitidou při JIA, které užívaly stabilní dávky MTX. Studie vedla k schválení indikace adalimumabu pro léčbu chronické přední uveitidy u dětí od 2 let Evropskou lékovou agenturou (EMA, European Medicines Agency) v roce 2017. Výsledky studie nejsou v rozporu s doporučením skupiny odborníků, naopak posilují doporučení 15 v tabulce 3: „V případě nedostatečného efektu nebo intolerance methotrexátu se doporučuje přidat nebo změnit léčbu za biologickou.“ Jediným rozdílem je, že toto doporučení je nyní podpořeno spíše důkazy úrovně 1 než důkazy na úrovni 3. V poslední době byla publikována další menší RCT s adalimumabem prokazující jeho účinnost v léčbě uveitidy asociované s JIA, v této studii byl jako primární cíl hodnocení použit flare [141]. I další biologické léky jsou nadále studovány s ohledem na účinnost v léčbě uveitidy při JIA, například JAK inhibitory [151]. Závěry těchto prací nejsou zahrnuty v originálních doporučeních článku SHARE publikovaných v roce 2017, proto je nutno stávající doporučení pro uveitidu asociovanou s JIA pravidelně aktualizovat tak, aby poskytovala stále nejvyšší úroveň evidence. Adalimumab nemá v ČR na rozdíl od SR schválenou úhradu zdravotní pojišťovny pro podávání u pacientů s JIA uveitidou a jeho podávání je tedy zatím možné pouze v režimu zvláštní úhrady. Aplikace doporučení v praxi vyžaduje úzkou spolupráci lékařů s plátci zdravotní péče.
Poděkování
Iniciativa SHARE byla schválena Výkonným výborem Evropské společnosti pro pediatrickou revmatologii a Mezinárodní společností systémových autoimunitních nemocí.
Autoři česko-slovenské adaptace doporučení děkují autorům originálního textu:
Tamas Constantin1, Ivan Foeldvari2, Jordi Anton3, Joke de Boer4, Severine Czitrom-Guillaume5, Clive Edelsten6, Raz Gepstein7, Arnd Heiligenhaus8,9, Clarissa A Pilkington10, Gabriele Simonini11, Yosef Uziel12, Sebastian J Vastert13, Nico M Wulffraat13, Anne-Mieke Haasnoot4, Karoline Walscheid8, Annamária Pálinkás1, Reshma Pattani6, Zoltán Györgyi1, Richárd Kozma1, Victor Boom14, Andrea Ponyi1, Angelo Ravelli15, Athimalaipet V Ramanan16
12nd Department of Pediatrics, Semmelweis University, Budapest, Hungary
2Klinikum Eilbek, Hamburger Zentrum für Kinder-und Jugendrheumatologie, Hamburg, Germany
3Department of Pediatric Rheumatology, Hospital Sant Joan de Déu, Universitat de Barcelona, Barcelona, Spain
4Department of Ophthalmology, University Hospital Utrecht, Utrecht, The Netherlands
5Service de médecine des adolescents, CHU Bicêtre, AP-HP, 78, rue du Général-Leclerc, Paris, France
6Department of Ophthalmology, Great Ormond Street Hospital, London, UK
7Department of Ophthalmology, Meir Medical Center, Kfar Sava, Israel
8Department of Ophthalmology, Uveitis-Center, and Ophtha Lab, at St. Franziskus Hospital, Muenster, Germany
9University of Duisburg-Essen, Duisburg, Germany
10Department of Rheumatology, Great Ormond Street Hospital, London, UK
11Department of Paediatrics, Rheumatology Unit, Anna Meyer Children’s Hospital, University of Florence, Florence, Italy
12Department of Paediatrics, Meir Medical Center, Sackler School of Medicine, Tel-Aviv University, Tel Aviv, Israel
13Department of Pediatric Rheumatology and Immunology, Wilhelmina Children’s Hospital, University Medical Center Utrecht and University of Utrecht, Utrecht, The Netherlands
14Department of Internal Medicine, St. Antonius Hospital, Nieuwegein, The Netherlands
15Università degli Studi di Genova and Istituto Giannina Gaslini, Genoa, Italy
16University Hospitals Bristol NHS Foundation Trust & Bristol Medical School, University of Bristol, Bristol, UK
Došlo: 4. 3. 2020
Přijato: 4. 3. 2020
Korespondující autor:
MUDr. Hana Malcová, Ph.D.
Oddělení revmatologie
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: hana.malcova@fnmotol.cz
Sources
1. Enders FB, Bader-Meunier B, Baildam E, et al. Consensus-based recommendations for the management of juvenile dermatomyositis. Ann Rheum Dis 2017; 76 : 329–340.
2. van der Heijde D, Aletaha D, Carmona L, et al. 2014 Update of the EULAR standardised operating procedures for EULAR-endorsed recommendations. Ann Rheum Dis 2015; 74 : 8–13.
3. Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Can Med Assoc J 2010; 182: E839–842.
4. Heiligenhaus A, Michels H, Schumacher C, et al. Evidence-based, interdisciplinary guidelines for anti-inflammatory treatment of uveitis associated with juvenile idiopathic arthritis. Rheumatol Int 2012; 32 : 1121–133.
5. Bou R, Adán A, Borrás F, et al. Clinical management algorithm of uveitis associated with juvenile idiopathic arthritis: interdisciplinary panel consensus. Rheumatol Int 2015; 35 : 777–785.
6. Zierhut M, Heiligenhaus A, deBoer J, et al. Controversies in juvenile idio-pathic arthritis-associated uveitis. Ocul Immunol Inflamm 2013; 21 : 167–179.
7. Clarke SLN, Sen ES, Ramanan AV. Juvenile idiopathic arthritis-associated uveitis. Pediatric Rheumatology 2016; 14 : 27.
8. Sen ES, Dick AD, Ramanan AV. Uveitis associated with juvenile idio-pathic arthritis. Nat Rev Rheumatol 2015; 11 : 338–348.
9. Zhang W, et al. EULAR evidence based recommendations for gout. Part I: diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT). Ann Rheum Dis 2006; 65 : 1301–1311.
10. Zhang W, Doherty M, Bardin T, et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65 : 1312–1324.
11. Dougados M, Betteridge N, Burmester GR, et al. EULAR standardised operating procedures for the elaboration, evaluation, dissemination, and implementation of recommendations endorsed by the EULAR standing committees. Ann Rheum Dis 2004; 63 : 1172–1176.
12. Van de Ven AH, Delbecq AL. The nominal group as a research instrument for exploratory health studies. Am J Public Health 1972; 62 : 337–342.
13. Uchiyama RC, Osborn TG, Moore TL. Antibodies to iris and retina detected in sera from patients with juvenile rheumatoid arthritis with iridocyclitis by indirect immunofluorescence studies on human eye tissue. J Rheumatol 1989; 16 : 1074–1078.
14. Giannini EH, Malagon CN, Van Kerckhove C, et al. Longitudinal analysis of HLA associated risks for iridocyclitis in juvenile rheumatoid arthritis. J Rheumatol 1991; 18 : 1394–1397.
15. Malagon C, Van Kerckhove C, Giannini EH, et al. The iridocyclitis of early onset pauciarticular juvenile rheumatoid arthritis: outcome in immunogenetically characterized patients. J Rheumatol 1992; 19 : 160–163.
16. Murray KJ, Szer W, Grom AA, et al. Antibodies to the 45 kDa DEK nuclear antigen in pauciarticular onset juvenile rheumatoid arthritis and iridocyclitis: selective association with MHC gene. J Rheumatol 1997; 24 : 560–567.
17. Berk AT, Koçak N, Ünsal E. Uveitis in juvenile arthritis. Ocul Immunol Inflamm 2001; 9 : 243–251.
18. Zulian F, Martini G, Falcini F, et al. Early predictors of severe course of uveitis in oligoarticular juvenile idiopathic arthritis. J Rheumatol 2002; 29 : 2446–2453.
19. Chia A, Lee V, Graham EM, et al. Factors related to severe uveitis at diagnosis in children with juvenile idiopathic arthritis in a screening program. Am J Ophthalmol 2003; 135 : 757–762.
20. Chen CS, Roberton D, Hammerton ME. Juvenile arthritis-associated uveitis: visual outcomes and prognosis. Can J Ophthalmol 2004; 39 : 614–620.
21. Nordal EB, Songstad NT, Berntson L, et al. Biomarkers of chronic uveitis in juvenile idiopathic arthritis: predictive value of antihistone antibodies and antinuclear antibodies. J Rheumatol 2009; 36 : 1737–1743.
22. Kalinina Ayuso V, Ten Cate HA, van der Does P, et al. Male gender as a risk factor for complications in uveitis associated with juvenile idiopathic arthritis. Am J Ophthalmol 2010; 149 : 994–999.
23. Saurenmann RK, Levin AV, Feldman BM, et al. Risk factors for development of uveitis differ between girls and boys with juvenile idiopathic arthritis. Arthritis Rheum 2010; 62 : 1824–1828.
24. Angeles-Han ST, Pelajo CF, Vogler LB, et al. Risk markers of juvenile idiopathic arthritis-associated uveitis in the Childhood Arthritis and Rheumatology Research Alliance (CARRA) Registry. J Rheumatol 2013; 40 : 2088–2096.
25. Cole TS, Frankovich J, Iyer S, et al. Profiling risk factors for chronic uveitis in juvenile idiopathic arthritis: a new model for EHR-based research. Pediatr Rheumatol Online J 2013; 11 : 45.
26. Calandra S, Gallo MC, Consolaro A, et al. Female sex and oligoarthritis category are not risk factors for uveitis in Italian children with juvenile idiopathic arthritis. J Rheumatol 2014; 41 : 1416–1425.
27. Pelegrín L, Casaroli-Marano R, Antón J, et al. Predictive value of selected biomarkers, polymorphisms, and clinical features for oligoarticular juvenile idiopathic arthritisassociated uveitis. Ocul Immunol Inflamm 2014; 22 : 208–212.
28. Egeskjold EM, Johansen A, Permin H, et al. The significance of antinuclear antibodies in juvenile rheumatoid arthritis associated with chronic bilateral iridocyclitis. Acta Paediatr Scand 1982; 71 : 615–620.
29. Cabral DA, Petty RE, Malleson PN, et al. Visual prognosis in children with chronic anterior uveitis and arthritis. J Rheumatol 1994; 21 : 2370–2375.
30. Haas JP, Truckenbrodt H, Paul C, et al. Subtypes of HLA-DRB1*03, *08, *11, *12, *13 and *14 in early onset pauciarticular juvenile chronic arthritis (EOPA) with and without iridocyclitis. Clin Exp Rheumatol 1994; 12 (Suppl 10): S7–14.
31. Kotaniemi K, Kotaniemi A, Savolainen A. Uveitis as a marker of active arthritis in 372 patients with juvenile idiopathic seronegative oligoarthritis or polyarthritis. Clin Exp Rheumatol 2002; 20 : 109–112.
32. Zeggini E, Packham J, Donn R, et al. Association of HLA-DRB1*13 with susceptibility to uveitis in juvenile idiopathic arthritis in two independent data sets. Rheumatology 2006; 45 : 972–974.
33. Bloom JN, Ni M, Moore TL, et al. Serum antiocular antibodies in patients with juvenile rheumatoid arthritis. J Pediatr Ophthalmol Strabismus 1993; 30 : 243–248.
34. Campanilho-Marques R, Bogas M, Ramos F, et al. Prognostic value of antinuclear antibodies in juvenile idiopathic arthritis and anterior uveitis. Results from a systematic literature review. Acta Reumatol Port 2014; 39 : 116–122.
35. de Boer J, Steijaert A, van den Bor R, et al. Development of macular edema and impact on visual acuity in uveitis associated with juvenile idiopathic arthritis. Ocul Immunol Inflamm 2015; 23 : 67–73.
36. Ducos de Lahitte G, Terrada C, Tran TH, et al. Maculopathy in uveitis of juvenile idiopathic arthritis: an optical coherence tomography study. Br J Ophthalmol 2008; 92 : 64–69.
37. Edelsten C, Lee V, Bentley CR, et al. An evaluation of baseline risk factors predicting severity in juvenile idiopathic arthritis associated uveitis and other chronic anterior uveitis in early childhood. Br J Ophthalmol 2002; 86 : 51–56.
38. Glass D, Litvin D, Wallace K, et al. Early-onset pauciarticular juvenile rheumatoid arthritis associated with human leukocyte antigen-DRw5, iritis, and antinuclear antibody. J Clin Invest 1980; 66 : 426–429.
39. Grassi A, Corona F, Casellato A, et al. Prevalence and outcome of juvenile idiopathic arthritis-associated uveitis and relation to articular disease. J Rheumatol 2007; 34 : 1139–1145.
40. Heiligenhaus A, Niewerth M, Ganser G, et al. Prevalence and complications of uveitis in juvenile idiopathic arthritis in a population-based nation-wide study in Germany: suggested modification of the current screening guidelines. Rheumatology 2007; 46 : 1015–1019.
41. Ingegnoli F, Del Papa N, Comina DP, et al. Autoantibodies to chromatin: prevalence and clinical significance in juvenile rheumatoid arthritis. Clin Exp Rheumatol 2004; 22 : 499–501.
42. Kanski JJ. Screening for uveitis in juvenile chronic arthritis. Br J Ophthalmol 1989; 73 : 225–228.
43. Kodsi SR, Rubin SE, Milojevic D, et al. Time of onset of uveitis in children with juvenile rheumatoid arthritis. J Aapos 2002; 6 : 373–376.
44. Kotaniemi K, Sihto-Kauppi K. Occurrence and management of ocular hypertension and secondary glaucoma in juvenile idiopathic arthritis-associated uveitis: An observational series of 104 patients. Clin Ophthalmol 2007; 1 : 455–459.
45. Marvillet I, Terrada C, Quartier P, et al. Ocular threat in juvenile idiopathic arthritis. Joint Bone Spine 2009; 76 : 383–388.
46. Mathur G, Biswas J. Systemic associations of anterior uveitis in a tertiary care ophthalmic centre in south India. Int Ophthalmol 2012; 32 : 417–421.
47. McGill NW, Gow PJ. Juvenile rheumatoid arthritis in Auckland: a long term follow-up study with particular reference to uveitis. Aust N Z J Med 1987; 17 : 305–308.
48. Melin-Aldana H, Giannini EH, Taylor J, et al. Human leukocyte antigen-DRB1*1104 in the chronic iridocyclitis of pauciarticular juvenile rheumatoid arthritis. J Pediatr 1992; 121 : 56–60.
49. Merayo-Lloves J, Power WJ, Rodriguez A, et al. Secondary glaucoma in patients with uveitis. Ophthalmologica 1999; 213 : 300–304.
50. Miller ML, Fraser PA, Jackson JM, et al. Inherited predisposition to iridocyclitis with juvenile rheumatoid arthritis: selectivity among HLA--DR5 haplotypes. Proc Natl Acad Sci U S A 1984; 81 : 3539–3542.
51. Murray P. Serum autoantibodies and uveitis. Br J Ophthalmol 1986; 70 : 266–268.
52. Neuteboom GH, Hertzberger-ten Cate R, de Jong J, et al. Antibodies to a 15kD nuclear antigen in patients with juvenile chronic arthritis and uveitis. Invest Ophthalmol Vis Sci 1992; 33 : 1657–1660.
53. Ohno S, Char DH, Kimura SJ, et al. HLA antigens and antinuclear antibody titres in juvenile chronic iridocyclitis. Br J Ophthalmol 1977; 61 : 59–61.
54. Ostensen M, Fredriksen K, Kass E, et al. Identification of antihistone antibodies in subsets of juvenile chronic arthritis. Ann Rheum Dis 1989; 48 : 114–117.
55. Paroli MP, Abbouda A, Restivo L, et al. Juvenile idiopathic arthritis--associated uveitis at an Italian tertiary referral center: clinical features and complications. Ocul Immunol Inflamm 2015; 23 : 74–81.
56. Paroli MP, Speranza S, Marino M, et al. Prognosis of juvenile rheumatoid arthritisassociated uveitis. Eur J Ophthalmol 2003; 13 : 616–621.
57. Reininga JK, Los LI, Wulffraat NM, et al. The evaluation of uveitis in juvenile idiopathic arthritis (JIA) patients: are current ophthalmologic screening guidelines adequate? Clin Exp Rheumatol 2008; 26 : 367–372.
58. Sabri K, Saurenmann RK, Silverman ED, et al. Course, complications, and outcome of juvenile arthritis-related uveitis. J Aapos 2008; 12 : 539–545.
59. Saurenmann RK, Levin AV, Feldman BM, et al. Prevalence, risk factors, and outcome of uveitis in juvenile idiopathic arthritis: a long-term follow up study. Arthritis Rheum 2007; 56 : 647–657.
60. Schaller JG, Johnson GD, Holborow EJ, et al. The association of antinuclear antibodies with the chronic iridocyclitis of juvenile rheumatoid arthritis (Still’s disease). Arthritis Rheum 1974; 17 : 409–416.
61. Sim KT, Venning HE, Barrett S, et al. Extended oligoarthritis and other risk factors for developing JIA-associated uveitis under ILAR classification and its implication for current screening guideline. Ocul Immunol Inflamm 2006; 14 : 353–357.
62. Southwood TR, Ryder CA. Ophthalmological screening in juvenile arthritis: should the frequency of screening be based on the risk of developing chronic iridocyclitis? Br J Rheumatol 1992; 31 : 633–634.
63. Wakefield D, Herbort CP, Tugal-Tutkun I, et al. Controversies in ocular inflammation and immunology laser flare photometry. Ocul Immunol Inflamm 2010; 18 : 334–340.
64. Wittemann B, Neuer G, Michels H, et al. Autoantibodies to nonhistone chromosomal proteins HMG-1 and HMG-2 in sera of patients with juvenile rheumatoid arthritis. Arthritis Rheum 1990; 33 : 1378–1383.
65. Woreta F, Thorne JE, Jabs DA, et al. Risk factors for ocular complications and poor visual acuity at presentation among patients with uveitis associated with juvenile idiopathic arthritis. Am J Ophthalmol 2007; 143 : 647–655.
66. Zannin ME, Buscain I, Vittadello F, et al. Timing of uveitis onset in oligoarticular juvenile idiopathic arthritis (JIA) is the main predictor of severe course uveitis. Acta Ophthalmol 2012; 90 : 91–95.
67. Kalinina Ayuso V, van de Winkel EL, Rothova A, et al. Relapse rate of uveitis post-methotrexate treatment in juvenile idiopathic arthritis. Am J Ophthalmol 2011; 151 : 217–222.
68. Papadopoulou C, Kostik M, Böhm M, et al. Methotrexate therapy may prevent the onset of uveitis in juvenile idiopathic arthritis. J Pediatr 2013; 163 : 879–884.
69. Saboo US, Metzinger JL, Radwan A, et al. Risk factors associated with the relapse of uveitis in patients with juvenile idiopathic arthritis: a preliminary report. J Aapos 2013; 17 : 460–464.
70. Shakoor A, Esterberg E, Acharya NR. Recurrence of uveitis after discontinuation of infliximab. Ocul Immunol Inflamm 2014; 22 : 96–101.
71. Dana MR, Merayo-Lloves J, Schaumberg DA, et al. Visual outcomes prognosticators in juvenile rheumatoid arthritis-associated uveitis. Ophthalmology 1997; 104 : 236–244.
72. Arocker-Mettinger E, Asenbauer T, Ulbrich S, et al. Serum interleukin 2-receptor levels in uveitis. Curr Eye Res 1990; 9 (Suppl 1): 25–29.
73. Kalinina Ayuso V, de Boer JH, Byers HL, et al. Intraocular biomarker identification in uveitis associated with juvenile idiopathic arthritis. Invest Ophthalmol Vis Sci 2013; 54 : 3709–3720.
74. Heiligenhaus A, Foeldvari I, Edelsten C, et al. Proposed outcome measures for prospective clinical trials in juvenile idiopathic arthritis-associated uveitis: a consensus effort from the multinational interdisciplinary working group for uveitis in childhood. Arthritis Care Res 2012; 64 : 1365–1372.
75. Walscheid K, Hennig M, Heinz C, et al. Correlation between disease severity and presence of ocular autoantibodies in juvenile idiopathic arthritis-associated uveitis. Invest Ophthalmol Vis Sci 2014; 55 : 3447–3453.
76. Manzotti F, Orsoni JG, Zavota L, et al. Autoimmune uveitis in children: clinical correlation between antinuclear antibody positivity and ocular recurrences. Rheumatol Int 2002; 21 : 127–132.
77. Massa M, De Benedetti F, Pignatti P, et al. Lack of temporal association of iridocyclitis with IgG reactivities to core histones and nucleosome subparticles in pauciarticular juvenile chronic arthritis. Br J Rheumatol 1995; 34 : 507–511.
78. Gregory AC, Kempen JH, Daniel E, et al. Risk factors for loss of visual acuity among patients with uveitis associated with juvenile idiopathic arthritis: the Systemic Immunosuppressive Therapy for Eye Diseases Study. Ophthalmology 2013; 120 : 186–192.
79. Yuce BY, Yilmaz SG, Kose S, et al. Outcome of pediatric uveitis at an university clinic. Turk J Ophthalmol 2013; 43 : 395–401.
80. Kotaniemi K, Sihto-Kauppi K, Salomaa P, et al. The frequency and outcome of uveitis in patients with newly diagnosed juvenile idiopathic arthritis in two 4-year cohorts from 1990-1993 and 2000-2003. Clin Exp Rheumatol 2014; 32 : 143–147.
81. Thorne JE, Woreta FA, Dunn JP, et al. Risk of cataract development among children with juvenile idiopathic arthritis-related uveitis treated with topical corticosteroids. Ophthalmology 2010; 117 : 1436–1441.
82. Olson NY, Lindsley CB, Godfrey WA. Nonsteroidal anti-inflammatory drug therapy in chronic childhood iridocyclitis. Am J Dis Child 1988; 142 : 1289–1292.
83. Wolf MD, Lichter PR, Ragsdale CG. Prognostic factors in the uveitis of juvenile rheumatoid arthritis. Ophthalmology 1987; 94 : 1242–1248.
84. Sijssens KM, Rothova A, Van De Vijver DA, et al. Risk factors for the development of cataract requiring surgery in uveitis associated with juvenile idiopathic arthritis. Am J Ophthalmol 2007; 144 : 574–579.
85. Foster CS, Barrett F. Cataract development and cataract surgery in patients with juvenile rheumatoid arthritis-associated iridocyclitis. Ophthalmology 1993; 100 : 809–817.
86. Yu EN, Meniconi ME, Tufail F, et al. Outcomes of treatment with immunomodulatory therapy in patients with corticosteroid-resistant juvenile idiopathic arthritis-associated chronic iridocyclitis. Ocul Immunol Inflamm 2005; 13 : 353–360.
87. Foeldvari I, Nielsen S, Kümmerle-Deschner J, et al. Tumor necrosis factor alpha blocker in treatment of juvenile idiopathic arthritis-associated uveitis refractory to second-line agents: results of a multinational survey. J Rheumatol 2007; 34 : 1146–1150.
88. Shetty AK, Zganjar BE, Ellis GS, et al. Low-dose methotrexate in the treatment of severe juvenile rheumatoid arthritis and sarcoid iritis. J Pediatr Ophthalmol Strabismus 1999; 36 : 125–128.
89. Foeldvari I, Wierk A. Methotrexate is an effective treatment for chronic uveitis associated with juvenile idiopathic arthritis. J Rheumatol 2005; 32 : 362–365.
90. Heiligenhaus A, Mingels A, Heinz C, et al. Methotrexate for uveitis associated with juvenile idiopathic arthritis: value and requirement for additional anti-inflammatory medication. Eur J Ophthalmol 2007; 17 : 743–748.
91. Goebel JC, Roesel M, Heinz C, et al. Azathioprine as a treatment option for uveitis in patients with juvenile idiopathic arthritis. Br J Ophthalmol 2011; 95 : 209–213.
92. Huang JL, Hung IJ, Hsieh KH. Sulphasalazine therapy in chronic uveitis of children with chronic arthritis. Asian Pac J Allergy Immunol 1997; 15 : 71–75.
93. Sobrin L, Christen W, Foster CS. Mycophenolate mofetil after methotrexate failure or intolerance in the treatment of scleritis and uveitis. Ophthalmology 2008; 115 : 1416–1421.
94. Tappeiner C, Roesel M, Heinz C, et al. Limited value of cyclosporine A for the treatment of patients with uveitis associated with juvenile idiopathic arthritis. Eye 2009; 23 : 1192–1198.
95. Molina C, Modesto C, Martín-Begué N, et al. Leflunomide, a valid and safe drug for the treatment of chronic anterior uveitis associated with juvenile idiopathic arthritis. Clin Rheumatol 2013; 32 : 1673–1675.
96. Rajaraman RT, Kimura Y, Li S, et al. Retrospective case review of pediatric patiens with uveitis treated with infliximab. Ophthalmology 2006; 113 : 308–314.
97. Vazquez-Cobian LB, Flynn T, Lehman TJA. Adalimumab therapy for childhood uveitis. J Pediatr 2006; 149 : 572–575.
98. Biester S, Deuter C, Michels H, et al. Adalimumab in the therapy of uveitis in childhood. Br J Ophthalmol 2007; 91 : 319–324.
99. Gallagher M, Quinones K, Cervantes-Castaneda RA, et al. Biological response modifier therapy for refractory childhood uveitis. Br J Ophthalmol 2007; 91 : 1341–1344.
100. Tynjala P, Lindahl P, Honkanen V, et al. Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis 2007; 66 : 548–550.
101. Kotaniemi K, Säilä H, Kautiainen H. Long-term efficacy of adalimumab in the treatment of uveitis associated with juvenile idiopathic arthritis. Clin Ophthalmol 2011; 5 : 1425–1429.
102. García-De-Vicuńa C, Díaz-Llopis M, Salom D, et al. Usefulness of adalimumab in the treatment of refractory uveitis associated with juvenile idiopathic arthritis. Mediators Inflamm 2013; 2013 : 1–6.
103. Magli A, Forte R, Navarro P, et al. Adalimumab for juvenile idiopathic arthritis associated uveitis. Graefes Arch Clin Exp Ophthalmol 2013; 251 : 1601–1606.
104. Zholobova E, Galstian L, Nikolaeva MN, et al. Effectiveness of adalimumab in the treatment of juvenile idiopathic arthritis associated with uveitis. Pediatric Rheumatology 2014; 12 (Suppl 1): O5.
105. Simonini G, Taddio A, Cattalini M, et al. Prevention of flare recurrences in childhood refractory chronic uveitis: an open-label comparative study of adalimumab versus infliximab. Arthritis Care Res 2011; 63 : 612–618.
106. Simonini G, Taddio A, Cattalini M, et al. Superior efficacy of Adalimumab in treating childhood refractory chronic uveitis when used as first biologic modifier drug: Adalimumab as starting anti-TNF-α therapy in childhood chronic uveitis. Pediatr Rheumatol Online J 2013; 11 : 16.
107. Cecchin V, Zannin ME, Ferrari D, et al. Longterm safety and efficacy of adalimumab and infliximab for uveitis associated with juvenile idio-pathic arthritis. J Rheumatol 2018; 45 : 1167–1172.
108. William M, Faez S, Papaliodis GN, et al. Golimumab for the treatment of refraktory juvenile idiopathic arthritis-associated uveitis. J Ophthalmic Inflamm Infect 2012; 2 : 231–233.
109. Smith JR, Levinson RD, Holland GN, et al. Differential efficacy of tumor necrosis factor inhibition in the management of inflammatory eye disease and associated rheumatic disease. Arthritis Rheum 2001; 45 : 252–257.
110. Richards JC, Tay-Kearney ML, Murray K, et al. Infliximab for juvenile idiopathic arthritis-associated uveitis. Clin Exp Ophthalmol 2005; 33 : 461–468.
111. Kahn P, Weiss M, Imundo LF, et al. Favorable response to high-dose infliximab for refractory childhood uveitis. Ophthalmology 2006; 113 : 860–864.
112. Tynjälä P, Kotaniemi K, Lindahl P, et al. Adalimumab in juvenile idiopathic arthritisassociated chronic anterior uveitis. Rheumatology 2008; 47 : 339–344.
113. Trachana M, Pratsidou-Gertsi P, Pardalos G, et al. Safety and efficacy of adalimumab treatment in Greek children with juvenile idiopathic arthritis. Scand J Rheumatol 2011; 40 : 101–107.
114. Díaz-Llopis M, Salom D, Garcia-de-Vicuńa C, et al. Treatment of refractory uveitis with adalimumab: a prospective multicenter study of 131 patients. Ophthalmology 2012; 119 : 1575–1581.
115. Lerman MA, Burnham JM, Chang PY, et al. Response of pediatric uveitis to tumor necrosis factor – α inhibitor. J Rheumatol 2013; 40 : 1394–1403.
116. Miserocchi E, Modorati G, Pontikaki I, et al. Long-term treatment with golimumab for severe uveitis. Ocul Immunol Inflamm 2014; 22 : 90–95.
117. Saeed MU, Raza SH, Goyal S, et al. Etanercept in methotrexate-resistant JIA-related uveitis. Semin Ophthalmol 2014; 29 : 1–3.
118. Schmeling H, Horneff G. Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatology 2005; 44 : 1008–1011.
119. Smith JA, Thompson DJ, Whitcup SM, et al. A randomized, placebo-controlled, double-masked clinical trial of etanercept for the treatment of uveitis associated with juvenile idiopathic arthritis. Arthritis Rheum 2005; 53 : 18–23.
120. Saurenmann RK, Levin AV, Feldman BM, et al. Risk of new-onset uveitis in patients with juvenile idiopathic arthritis treated with anti-TNFalpha agents. J Pediatr 2006; 149 : 833–836.
121. Kakkassery V, Mergler S, Pleyer U. Anti-TNF-alpha treatment: a possible promoter in endogenous uveitis? observational report on six patients: occurrence of uveitis following etanercept treatment. Curr Eye Res 2010; 35 : 751–756.
122. Dhingra N, Morgan J, Dick AD. Switching biologic agents for uveitis. Eye 2009; 23 : 1868–1870.
123. Zulian F, Balzarin M, Falcini F, et al. Abatacept for severe anti-tumor necrosis factor alpha refractory juvenile idiopathic arthritis-related uveitis. Arthritis Care Res 2010; 62 : 821–825.
124. Heiligenhaus A, Miserocchi E, Heinz C, et al. Treatment of severe uveitis associated with juvenile idiopathic arthritis with anti-CD20 monoclonal antibody (rituximab). Rheumatology 2011; 50 : 1390–1394.
125. Mesquida M, Molins B, Llorenç V, et al. Long-term effects of tocilizumab therapy for refractory uveitis-related macular edema. Ophthalmology 2014; 121 : 2380–2386.
126. Angeles-Han ST, Griffin KW, Lehman TJ, et al. The importance of visual function in the quality of life of children with uveitis. J Aapos 2010; 14 : 163–168.
127. Angeles-Han ST, Griffin KW, Harrison MJ, et al. Development of a vision-related quality of life instrument for children ages 8-18 years for use in juvenile idiopathic arthritis-associated uveitis. Arthritis Care Res 2011; 63 : 1254–1261.
128. Ezzahri M, Amine B, Rostom S, et al. The uveitis and its relationship with disease activity and quality of life in Moroccan children with juvenile idiopathic arthritis. Clin Rheumatol 2013; 32 : 1387–1391.
129. Prakken B, Albani S, Martini A. Juvenile idiopathic arthritis. Lancet 2011; 377 : 2138–2149.
130. Thierry S, Fautrel B, Lemelle I, et al. Prevalence and incidence of juvenile idiopathic arthritis: a systematic review. Joint Bone Spine 2014; 81 : 112–117.
131. Yu HH, Chen PC, Wang LC, et al. Juvenile idiopathic arthritis-associated uveitis: a nationwide population-based study in Taiwan. PLoS One 2013; 5 : 8.
132. Shen CC, Yeh KW, Ou LS, et al. Clinical features of children with juvenile idiopathic arthritis using the ILAR classification criteria: a community-based cohort study in Taiwan. J Microbiol Immunol Infect 2013; 46 : 288–294.
133. Heiligenhaus A, Heinz C, Edelsten C, et al. Review for disease of the year: epidemiology of juvenile idiopathic arthritis and its associated uveitis: the probable risk factors. Ocul Immunol Inflamm 2013; 21 : 180–191.
134. Sen, ES, Ramanan AV. Juvenile idiopathic arthritis-associated uveitis, Best Pract Res Clin Rheumatol 2017; 31 : 517–534.
135. Ramanan AV, Guly C. Adalimumab for childhood onset uveitis. Ann Rheum Dis 2018; 77: 961–962.
136. Ramanan AV, Dick AD, Jones AP, et al. Adalimumab plus Methotrexate for Uveitis in Juvenile Idiopathic Arthritis. N Engl J Med 2017; 376 : 1637–1646.
137. Dick AD, Rosenbaum JT, Al-Dhibi HA, et al. Guidance on Noncorticosteroid Systemic Immunomodulatory Therapy in Noninfectious Uveitis: Fundamentals Of Care for UveitiS (FOCUS) Initiative. Ophthalmology 2018; S0161–6420 : 32446–6.
138. Ferrara G, Mastrangelo G, Barone P, et al. Methotrexate in juvenile idiopathic arthritis: advice and recommendation from the MARAJIA expert consensus meeting. Pediatr Rheumatol Online J 2018; 16 : 46.
139. Wieringa WG, Ambrust W, Legger GE, et al. Efficacy of high-dose methotrexate in pediatric non-infectious uveitis. Ocul Immunol Inflamm 2019; 27 (8): 1305–1313.
140. LaMattina KC, Koreishi AF. What is new in pediatric uveitis? Curr Opin Ophtalmol 2018; 29 : 412–418.
141. Quartier P, Baptiste A, Despert V on behalf of the ADJUVITE Study Group, et al. ADJUVITE: a double-blind, randomised, placebo-controlled trial of adalimumab in early onset, chronic, juvenile idiopathic arthritis-associated anterior uveitis. Ann Rheum Dis 2018; 77 : 1003–1011.
142. Leinonen ST, Aalto K, Kotaniemi KM, et al. Anti-adalimumab antibodies in juvenile idiopathic arthritis-related uveitis. Clin Exp Rheumatol 2017; 35 : 1043–1046.
143. Skrabl-Baumgartner A, Erwa W, Muntean W, et al. Anti-adalimumab antibodies in juvenile idiopathic arthritis: frequent association with loss of response. Scand J Rheumatol 2015; 44 : 359–362.
144. Correll CK, Bullock DR, Cafferty RM, et al. Safety of weekly adalimumab in the treatment of juvenile idiopathic arthritis and pediatric chronic uveitis. Clin Rheumatol 2018; 37 : 549–553.
145. Skrabl-Baumgartner A, Seidel G, Langer-Wegscheider B, et al. Drug monitoring in long-term treatment with adalimumab for juvenile idio-pathic arthritis-associated uveitis. Arch Dis Child 2019; 104 : 246–250.
146. Calvo-Río V, Santos-Gómez M, Calvo I, et al. Anti-Interleukin-6 Receptor Tocilizumab for Severe Juvenile Idiopathic Arthritis-Associated Uveitis Refractory to Anti-Tumor Necrosis Factor Therapy: A Multicenter Study of Twenty-Five Patients. Arthritis Rheumatol 2017; 69 : 668–675.
147. Tappeiner C, Mesquida M, Adán A, et al. Evidence for Tocilizumab as a treatment option in refractory uveitis associated with juvenile idio-pathic arthritis. J Rheumatol 2016; 43 : 2183–2188.
148. Mesquida M, Molins B, Llorenç V, et al. Twenty-four month follow-up of tocilizumab therapy for refractory uveitis-related macular edema. Retina 2018; 38 : 1361–1370.
149. Ramanan A, Dick AD, Jones AP, et al. A phase II trial protocol of tocilizumab in ati-TNF refraktory patients with JIA-associated uveitis (the APTITUDE trial). BMC Rheumatol 2018; 2 : 1.
150. Ferrara M, Eggenschwiler L, Stephenson A, et al. The Challenge of Pediatric Uveitis: Tertiary Referral Center Experience in the United States. Ocul Immunol Inflamm 2018; 15 : 1–8.
151. Pleyer U, Algharably EA, Feist E, et al. Small molecules as therapy for uveitis: a selected perspective of new and developing agents. Expert Opin Pharmacother 2017; 18 : 1311–1323.
152. Heiligenhaus A, Minden K, Tappeiner C, et al. Update of the evidence based, interdisciplinary guideline for anti-inflammatory treatment of uveitis associated with juvenile idiopathic arthritis. Semin Arthritis Rheum 2019; 49 (1): 43–55.
153. Foeldvari I, Klotsche J, Simonini G, et al. Proposal for a definition for response to treatment, inactive disease and damage for JIA associated uveitis based on the validation of a uveitis related JIA outcome measures from the Multinational Interdisciplinary Working Group for Uveitis in Childhood (MIWGUC). Pediatr Rheumatol Online J 2019; 17 (1): 66.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 5-
All articles in this issue
- Pandemie COVID-19 z pohledu dětské kliniky krajské nemocnice
- Bolesti břicha způsobené retrokaválním ureterem
- Anémie u dětí s nespecifickými střevními záněty
- Péče o děti s infantilním hemangiomem léčené systémově propranololem
- Doporučení pro diagnostiku a léčbu uveitidy asociované s juvenilní idiopatickou artritidou: Česko-slovenská adaptace evropských doporučení SHARE
- Prof. MUDr. Jiří ZEMAN, DrSc. – jubileum
- Zprávy
- Lucia Časnocha Lúčanová: Infekcie novorodencov
- Inhibitory angiotenzin konvertujícího enzymu u dětských kardiologických pacientů – současné zkušenosti a praxe
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prof. MUDr. Jiří ZEMAN, DrSc. – jubileum
- Pandemie COVID-19 z pohledu dětské kliniky krajské nemocnice
- Anémie u dětí s nespecifickými střevními záněty
- Bolesti břicha způsobené retrokaválním ureterem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

