-
Medical journals
- Career
Talasemické syndromy
: L. Sulovská 1; M. Divoká 2; D. Pospíšilová 1
: Dětská klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc 1; Hemato-onkologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc 2
: Čes-slov Pediat 2017; 72 (8): 457-463.
Věnováno panu profesorovi Hrodkovi, zakladateli moderní dětské hematologie v České republice
Talasémie tvoří heterogenní skupinu vrozených poruch červené krevní řady. Příčinou je nerovnováha globinových řetězců v molekule hemoglobinu, která vede k neefektivní erytropoéze v kostní dřeni a ke zkrácení životního cyklu erytrocytů. Klinická a laboratorní manifestace je značně rozdílná a závisí na počtu postižených globinových genů. Jedinci s nosičstvím talasemické alely jsou asymptomatičtí a nacházíme u nich jen mikrocytózu erytrocytů a u některých snížení hladiny hemoglobinu. Těžší formy talasémií jsou provázeny závažnou mikrocytární anémií s vystupňovanou hemolýzou a s tím souvisejícími komplikacemi. Diagnostika talasémií spočívá v analýze hemoglobinového spektra a v detekci kauzální mutace molekulárně genetickými metodami. Léčba nositelů talasemické alely většinou není nutná, u těžších forem talasémie spočívá v pravidelné substituci erytrocytárními koncentráty a léčbě přidružených komplikací. Kauzální terapií je transplantace kmenových buněk krvetvorby a genová terapie. U vybraných párů je dostupná prenatální diagnostika.
Klíčová slova:
α-talasémie, β-talasémie, diagnostika, molekulárně genetické metodyÚVOD
Talasémie tvoří heterogenní skupinu geneticky podmíněných onemocnění červené krevní řady vedoucích k mikrocytární anémii. Společným rysem pro všechny talasemické syndromy je defektní či chybějící syntéza jednoho nebo více globinových řetězců v molekule hemoglobinu. Jedná se o kvantitativní poruchu syntézy globinu, při které nedochází ke změně pořadí aminokyselin v řetězci.
U zdravých lidí je molekula hemoglobinu (Hb) tvořená čtyřmi podjednotkami, z nichž každá je složená z hemové skupiny (stejné pro všechny typy hemoglobinů), a z globinového řetězce, který zastoupením jednotlivých aminokyselin určuje typ hemoglobinu. Existuje celkem šest různých globinových řetězců: alfa (α), beta (β), gamma (γ), delta (δ), epsilon (ε), zeta (ζ). Více než 95 % Hb dospělého člověka tvoří hemoglobin A (HbA), který je složený ze dvou α a dvou β řetězců (αα/ββ). Minoritně jsou pak u dospělého člověka zastoupeny HbA2 (αα/δδ) a fetální HbF (αα/γγ). V průběhu ontogeneze se vyskytují embryonální Hb Gower–1 (ζζ/εε), Hb Gower–2 (αα/εε) a Hb Portland (ζζ/γγ), které jsou postupně ve druhém trimestru nahrazovány fetálním HbF. Vyšší afinita embryonálních Hb a fetálního Hb ke kyslíku zaručuje dostatečnou oxygenaci tkání plodu.
Syntéza jednotlivých globinových řetězců je přísně regulovaná. Geny pro šest různých globinových řetězců jsou lokalizované na chromozomu 11 v HBB lokusu („β-like“ řetězce: ε, γ, δ a β) a na chromozomu 16 v HBA lokusu („α-like“ řetězce: ζ a α) a jsou seřazeny v pořadí, v jakém jsou během ontogeneze exprimované. Pokud není syntéza globinů narušená, pak poměr α - a β-řetězců v molekule hemoglobinu je roven 1,00 ± 0,05. V případě pacientů s talasémií je tento poměr narušený sníženou (α+ - nebo β+-talasémie) nebo úplnou absencí jednoho z řetězců (α0 - nebo β0-talasémie), což vede k akumulaci nadbytečných nepostižených globinových řetězců. Tyto řetězce nemohou být spárované s odpovídajícím „partnerem“, dochází k jejich spontánní aglutinaci a tvorbě inkluzí, které narušují fyziologii hematopoézy [1]. Typ postiženého globinového řetězce určuje i typ talasémie – nejčastěji α-talasémie a β-talasémie. Vzácně se vyskytují jiné typy např. δβ-talasémie, které nejčastěji vznikají v důsledku delece příslušných úseků DNA s následnou fúzí a vznikem hybridních δ/β genů (např. hemoglobinová varianta Hb Lepore s talasemickým fenotypem).
EPIDEMIOLOGIE
Talasémie postihuje přibližně 7 % celosvětové populace, ale její nejvyšší výskyt je koncentrovaný do oblasti Středomoří, zemí Blízkého východu, Indie, jihovýchodní Asie a severní Afriky (obr. 1) [2]. Mluvíme o takzvaném talasemickém pásu. Mezi evropské oblasti s nejvyšší prevalencí β-talasémie patří Řecko, Kypr a Sardinie (6–19 %). Vysoká koncentrace mutovaných alel v oblasti talasemického pásu vede proto k častějšímu výskytu dvojitých heterozygotních nosičů talasemické alely nebo ke kombinaci talasemického nosičství s jiným typem hemoglobinopatie u jednoho pacienta. V důsledku globalizace a migrace dochází také v posledních letech k rozšíření talasemických alel i do oblastí dříve postižených minimálně, mezi které můžeme zařadit i Českou republiku [3, 4]. V zemích s vysokým výskytem talasémie je zároveň vysoká prevalence malárie a uvádí se, že přítomnost talasemické alely jedincům poskytuje určitou selektivní výhodu [5]. Například genotyp αα/α - je spojený s o 40 % nižším rizikem úmrtí na malárii při srovnání se zdravou populací, u genotypu α-/α - je toto riziko nižší až o 60 % [6]. Přesný mechanismus této rezistence k onemocnění malárií dosud není známý, pravděpodobně se podílí snížení replikační schopnosti plazmodia v postižených erytrocytech a zvýšená destrukce infikovaných erytrocytů [7, 8].
1. Světová distribuce talasémie. Nejvíce postižené oblasti tvoří tzv. talasemický pás, který zahrnuje oblasti Středomoří, zemí Blízkého východu, Indie, jihovýchodní Asie a severní Afriky. Převzato a upraveno [2]. Fig. 1. World distribution of thalassemia. The most affected areas form the so-called thalassemic belt, which includes the Mediterranean, the Middle East, India, Southeast Asia and North Africa. Adapted by [2]. ![Světová distribuce talasémie. Nejvíce postižené oblasti tvoří tzv. talasemický pás, který zahrnuje oblasti Středomoří, zemí Blízkého východu, Indie, jihovýchodní Asie a severní Afriky. Převzato a upraveno [2].
Fig. 1. World distribution of thalassemia. The most affected areas form the so-called thalassemic belt, which includes the Mediterranean, the Middle East, India, Southeast Asia and North Africa. Adapted by [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3bf12aad05cb0f4d5cc5ef925b71e722.jpg)
α-TALASÉMIE
V lidském haploidním genomu se nachází dva α-globinové geny (HBA2, HBA1), normální diploidní genotyp je tedy αα/αα. Tato sada čtyř funkčních genů může být v důsledku mutace snížena o 1, 2, 3 nebo 4 kopie genu (obr. 2). Nejčastěji se jedná o deleci funkčního genu, méně často poruchu syntézy globinového řetězce způsobuje bodová mutace.
2. Genotypové varianty delečních α-talasémií. Nahoře vlevo: normální diploidní genotyp. Nahoře vpravo: heterozygot pro α⁺-talasémii, tzv. němé (nebo tiché) nosičství. Uprostřed: u homozygotů pro α⁺-talasémii (nejčastěji delece dvou genů, –α/–α) nebo u heterozygotů pro α⁰-talasémii (– –/αα) hovoříme o nosičství α-talasémie. Dole vlevo: ztráta tří α-globinových genů (dvojití heterozygoti pro α⁺-talasémii a α⁰-talasémii, nejčastěji – – /–α), vede k chorobě HbH se středně těžkou anémií a s produkcí HbH (β4). Při inkubaci s briliant-kresylovou modří nacházíme v erytrocytech precipitovaný HbH. Dole vpravo: chybění čtyř α-globinových genů, tj. homozygotní stav pro α⁰-talasémii (– –/– –), není slučitelné s životem a vede ke vzniku fetálního hydropsu nebo syndromu Hb Bart’s (γ4). Upraveno podle [9]. ![Genotypové varianty delečních α-talasémií. Nahoře vlevo: normální diploidní genotyp. Nahoře vpravo: heterozygot pro α⁺-talasémii, tzv. němé (nebo tiché) nosičství. Uprostřed: u homozygotů pro α⁺-talasémii (nejčastěji delece dvou genů, –α/–α) nebo u heterozygotů pro α⁰-talasémii (– –/αα) hovoříme o nosičství α-talasémie. Dole vlevo: ztráta tří α-globinových genů (dvojití heterozygoti pro α⁺-talasémii a α⁰-talasémii, nejčastěji – – /–α), vede k chorobě HbH se středně těžkou anémií a s produkcí HbH (β4). Při inkubaci s briliant-kresylovou modří nacházíme v erytrocytech precipitovaný HbH. Dole vpravo: chybění čtyř α-globinových genů, tj. homozygotní stav pro α⁰-talasémii (– –/– –), není slučitelné s životem a vede ke vzniku fetálního hydropsu nebo syndromu Hb Bart’s (γ4). Upraveno podle [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fe7db077f6dc38f939e6a4ebced658de.jpg)
α-talasémie minima nebo také tiché nosičství α-talasémie je způsobena delecí jednoho α-globinového genu. Většinou se neprojeví ani při klinickém vyšetření, ani při vyšetření krevního obrazu. Elektroforéza Hb je normální. Jedinou možností identifikace těchto jedinců je analýza DNA. Předpokládá se, že výskyt v České republice je častý [9].
α-talasémie minor (nosičství α-talasémie) je způsobeno delecí dvou genů, která může postihnout jeden chromozom (αα/--, cis forma), nebo jeden gen na každém chromozomu (α-/α, trans forma). Nosičství α-talasémie se může manifestovat mírnou anémií, mikrocytózou a hypochromázií erytrocytů (tab. 1). Na rozdíl od pacien-tů s β-talasémií minor nedetekujeme při vyšetření hemoglobinového spektra zvýšenou hladinu HbA2 [10].
Ztráta tří funkčních genů pro α-globinový řetězec způsobuje nadbytek β-globinových řetězců, které spontánně agregují do tetramerů (β4). Výsledkem je HbH, který je nestabilní a má vysokou afinitu ke kyslíku. Pacienti s HbH bývají symptomatičtí již při narození, protože α-globin je součástí i HbF. Po narození proto bývá přítomná anémie a ikterus. Intrauterinně volné γ řetězce agregují do tetramerů (Hb Bart‘s), při elektroforéze Hb v prvních týdnech života je jeho frakce detekovatelná v koncentraci 20–40 %. Pacienti jsou postiženi mírnou až středně těžkou anémií (70–100 g/l), v dospělosti se manifestují i důsledky chronické hemolýzy – hepatosplenomegalie, ikterus, cholecystolitiáza. Dysregulace metabolismu železa (Fe) u těchto pacientů vede v pozdějším věku k hemosideróze jater a myokardu i přesto, že většina pacientů nevyžaduje transfuze erytrocytárních koncentrátů [10, 11, 12].
α-talasémie major je důsledkem delece všech čtyř genů pro α-globinový řetězec. Je neslučitelná s extrauterinním životem. Již intrauterinně totiž dochází k tvorbě Hb Bart‘s, který má desetinásobně vyšší afinitu ke kyslíku. Chronická hypoxie způsobuje závažné poruchy vývoje plodu a v důsledku srdečního selhávání vede k prosáknutí všech tkání (fetální hydrops) [9]. Většina plodů umírá intrauterinně. V literatuře bylo popsáno několik případů živě narozených dětí, které však umírají během prvních hodin života [13]. Současně dochází k ohrožení života matky toxémií, polyhydramnionem, akutním hemoragickým šokem aj. [10, 14].
β-TALASÉMIE
Gen pro β-globinový řetězec (HBB) je lokalizovaný na chromozomu 11 v lokusu HBB pouze v jedné kopii (na rozdíl od genů pro α-globin), normální diploidní genotyp je tedy označen β/β. Na rozdíl od α-talasémií jsou β-globinové geny nejčastěji postiženy bodovými mutacemi, malými inzercemi, méně často pak rozsáhlými delecemi. Historicky byly β-talasémie děleny podle klinického průběhu na formu minor, intermedia a major. Zavedení DNA sekvenování identifikuje i pacienty s tzv. tichým nosičstvím β-talasémie. Tito pacienti mají v jednom genu pro β-globinový řetězec mutaci, která vede jen k velmi diskrétnímu snížení produkce β-řetězců, což se při vyšetření krevního obrazu neprojeví [10, 15].
Heterozygotní mutace postihující gen pro β-globinový řetězec vede k β-talasémii minor. Tito pacienti mají obvykle výraznou mikrocytózu, hypochromii erytrocytů, kompenzatorní erytrocytózu a mohou mít mírnou anémii. V nátěru periferní krve se vyskytují různé formy patologických tvarů erytrocytů (poikilocyty, eliptocyty, terčovité erytrocyty) a může být přítomné bazofilní tečkování. Většina nosičů β-talasemické alely má zvýšenou hladinu HbA2 (tab. 1). U části pacientů je přítomná hepatomegalie a splenomegalie. Slezina je hmatná u méně než 20 % jedinců, při ultrazvukovém vyšetření mají tito pacienti slezinu větší o 29–67 % než zdravé kontroly [16, 17]. Naprostá většina pacientů během svého života nevyžaduje podání transfuze.
1. Typické hodnoty krevního obrazu u nosičů talasemické alely. 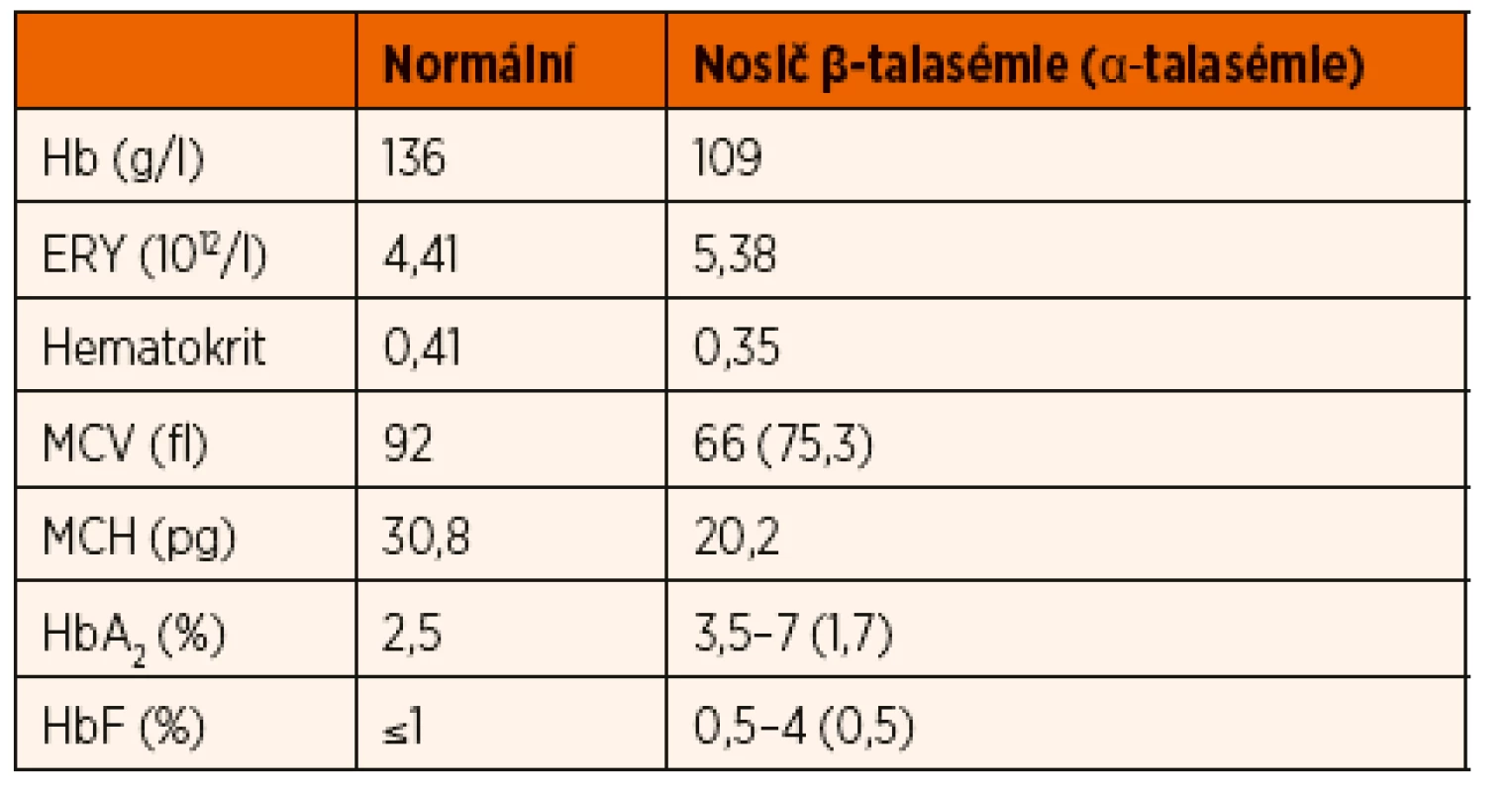
Hb – hemoglobin; ERY – počet erytrocytů; MCV – střední objem erytrocytů; MCH – střední koncentrace hemoglobinu v erytrocytech; HbA₂ – hemoglobin A₂; HbF – fetální hemoglobin β-talasémie intermedia je definovaná závažnější anémií, než jakou nacházíme u pacientů s talasémií minor. K udržení stabilní hladiny hemoglobinu a kvality života pacienti nevyžadují pravidelnou substituci erytrocytárními koncentráty, na rozdíl od pacientů postižených talasémií major. U většiny pacientů s β-talasémií intermedia se hladina hemoglobinu pohybuje nad 70 g/l. Genotyp pacientů je značně heterogenní, od homozygotní formy mutací vedoucích k mírnému snížení syntézy řetězců až po dvojité heterozygotní mutace s různým dopadem na syntézu globinu [18, 19].
Klinická manifestace β-talasémie intermedia je velmi rozdílná – různě závažná anémie s charakteristickými talasemickými rysy (mikrocytóza, hypochromie, erytrocytóza, patologické morfologické odchylky erytrocytů v nátěru periferní krve). Pacienti s tímto typem talasémie i přes absenci chronické erytrocytární substituce trpí komplikacemi z přetížení Fe. Akumulace Fe je pravděpodobně způsobena alterací regulace příjmu Fe ze stravy. Klíčový význam má v tomto případě neefektivní erytropoéza, která přes dosud neobjasněnou signální dráhu snižuje hladinu hepcidinu s následným zvýšením příjmu Fe ze stravy [20, 21]. Přetížení Fe se u těchto pacientů objevuje o 10–20 let později než u pacientů s pravidelným podáváním transfuzí. V následujících letech lze očekávat, že intenzivní výzkum v oblasti terapeutických zásahů do regulace metabolismu Fe povede ke zlepšení prognózy pacientů.
U nosičů β-talasemické alely se můžeme setkat s klinickým obrazem talasémie intermedia také v případě, kdy současné postižení α-globinových genů (triplikace) prohloubí vzájemný nepoměr α - a β-globinových řetězců [22].
β-talasémie major je nejzávažnějším talasemickým syndromem, který je slučitelný s postnatálním životem. Absence nebo výrazné snížení produkce β-globinových řetězců je důsledkem přítomnosti homozygotní nebo dvojitě heterozygotní formy mutace HBB genu. Volné, nespárované α-řetězce jsou nestabilní, spontánně agregují do tetramerů a vytváří nerozpustná inkluzní tělíska, která poškozují erytroidní progenitory v kostní dřeni. Zralé erytrocyty uvolněné do cirkulace mají zkrácený životní cyklus a podléhají předčasnému rozpadu v monocyto-makrofágovém systému sleziny a jater [23]. Intrauterinně a během prvních měsíců života jsou homozygotní jedinci asymptomatičtí, protože dominantním hemoglobinem je HbF a jeho syntéza není ovlivněna. Při následném postnatálním fyziologickém snižování syntézy HbF a neadekvátním zvyšování HbA se objevuje závažná mikrocytární, hypochromní anémie. Naprostá většina pacientů je diagnostikovaná od 6. měsíce do 2 let věku.
Klinický obraz a laboratorní nálezy u pacientů s β-talasémií major jsou kombinací čtyř patologických jevů – anémie, chronické hemolýzy, expanze erytropoézy a zvýšeného obratu Fe. Mikrocytární anémie je závažná, při diagnóze se u pacientů hladiny Hb pohybují nezřídka mezi 20–30 g/l, v nátěru periferní krve pozorujeme kromě mikrocytů (střední objem erytrocytů pod 65 fl) i výraznou anizocytózu a četné morfologické odchylky tvaru erytrocytů – terčovité erytrocyty, eliptocyty, jaderné erytrocyty (obr. 3). Bývá také přítomno bazofilní tečkování. Osmotická rezistence erytrocytů je zvýšená [24]. Chronická hypoxie způsobuje extramedulární expanzi erytropoézy – v játrech, slezině, ledvinách a také tumoriformních masách v mediastinu nebo retroperitoneu [25]. Kostní abnormality jsou dalším důsledkem expanze erytropoézy. Nejznatelnější jsou v obličeji – prominence a zvětšení maxily, relativně malý nos a vystupující horní řezáky (facies talasemica). V plochých kostech lebky se rozšiřuje dřeňová dutina a ztenčuje se kompakta kosti. Při vyšetření kostní dřeně talasemických jedinců nacházíme typickou erytroidní hyperplazii (poměr myeloidní a erytroidní řady může dosahovat poměru 1 : 20, zatímco u zdravých lidí se tento poměr pohybuje 1,5–3 : 1) [11]. Chronicky probíhající hemolýza se projevuje ikterickým zbarvením kůže a sklér, splenomegalií s hepatomegalií a tvorbou žlučových kamenů.
3. Typické nálezy v nátěru periferní krve u pacientky s β-talasémií major. V nátěru je patrná značná poikilocytóza, nacházíme četné terčovité erytrocyty (targetcells, černá šipka), ojediněle zachyceny slzičkovitý erytrocyt (dakryocyt, bílá šipka) a akantocyt (šedá šipka). (A. Lapčíková, Hemato-onkologická klinika, FN a LF Univerzity Palackého v Olomouci) Fig. 3. Typical findings in peripheral blood smear in a patient with β-thalassemia major. Peripheral blood smear demonstrates poikilocytosis, target cells (black arrow), rarely dacryocyte (white arrow) and acantocyte (grey arrow). 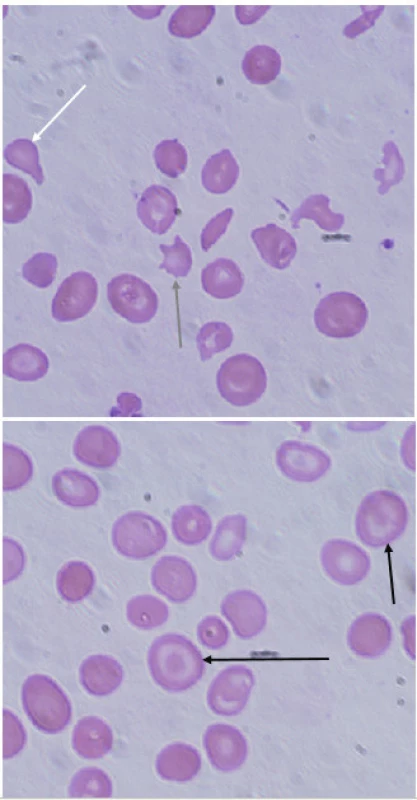
Zvýšený obrat Fe při expanzi erytropoézy a exogenní přívod Fe transfuzemi mají za následek poruchu funkce životně důležitých orgánů. Sekundární hemosideróza postihuje zejména játra, slezinu, myokard a endokrinní žlázy. U části pacientů zejména v rozvojových zemích je hepatopatie dále zhoršovaná koincidencí talasémie s infekční virovou hepatitidou B nebo C [10, 11]. Kardiální postižení se projevuje poruchami srdečního rytmu, ischemickou chorobou srdeční, dilatací levé komory a srdečním selháváním, které je nejčastější příčinou úmrtí pacientů [26]. Endokrinopatie zahrnují hypogonadismus (40–55 %), růstovou retardaci (33 %), diabetes mellitus (6–13 %), hypothyreózu a hypoparathyreózu (10–11 %). Časně zahájená chelatační léčba zamezí progresi postižení, není však dosud jasné, jestli již vzniklé změny jsou reverzibilní [27, 28]. Kvalitu života pacientů s talasémií major výrazně ovlivňuje bolest. Multicentrická prospektivní studie s účastí 258 subjektů dokumentuje negativní vliv bolesti na kvalitu života jednotlivce. 81 % pacientů pociťovalo v posledním roce bolesti. Nejčastěji se jednalo o bolesti hlavy, střední a dolní části zad a bolesti nohou. Při regresní analýze výskyt bolesti koreloval s věkem, ne však s tíží anémie, typem talasémie, počtem transfuzí, chelatační léčbou ani kostní denzitou [29].
DIAGNOSTIKA TALASÉMIÍ V ČESKÉ REPUBLICE
Typické nálezy v krevním obraze a nátěru periferní krve, jak byly popsány výše, jsou diagnosticky cenné, je však třeba je doplnit o další speciální hematologické a molekulárně genetické metody k potvrzení diagnózy. Mezi nejrozšířenější metody patří elektroforéza Hb, pomocí které lze identifikovat pacienty s abnormálním hemoglobinovým spektrem (obr. 4). Další používanou metodou je chromatografické stanovení hladiny HbA2, která může být až dvojnásobně zvýšená u pacientů s β-talasémií minor, někteří z těchto jedinců mají zároveň zvýšenou frakci HbF, kterou lze poměrně přesně kvantifikovat pomocí metody alkalické denaturace. U homozygotů pro β0-talasémii detekujeme pouze HbF a případně normální nebo jen mírně zvýšený HbA2. Na molekulární úrovni lze prokázat bodové mutace v rámci HBB genu pomocí Sangerova sekvenování. Deleční formy β-talasémií analyzujeme pomocí metody MLPA (Multiplex Ligation Probe Amplification). Dosud již bylo identifikováno přes 300 delečních a bodových mutací vedoucích k β-talasémii.
4. Elektroforéza Hb, polyakrylamidový gel barvený Coomasie blue. Na obrázku zobrazené jednotlivé frakce hemoglobinového spektra: HbA, HbF, u některých vzorků je patrná výrazněji frakce HbA₂, jedná se o nosiče β-talasemické alely. Červená šipka ukazuje pacienta s abnormálním hemoglobinovým spektrem, jedná se o nosiče alely pro HbE (hemoglobinová varianta s talasemickým fenotypem). HbE putuje stejnějako frakce HbA₂, k jeho potvrzení je nutná sekvenační analýza HBB genu. (M. Divoká, Hemato-onkologická klinika, FN a LF Univerzity Palackého v Olomouci) Fig. 4. Hemoglobin electrophoresis in polyacrylamide gel stained with Coomasie blue. Hemoglobin electrophoresis showing the fractions of hemoglobin: HbA, HbF. More significant HbA₂ fraction in some samples demonstrates β-talasemia minor. The red arrow showing abnormal hemoglobin spectrum in a patient with hemoglobin E trait (hemoglobin variant with thalassemic phenotype). HbE fraction co-migrates with HbA₂. To confirm the Hb variant, HBB gene sequencing analysis is required. 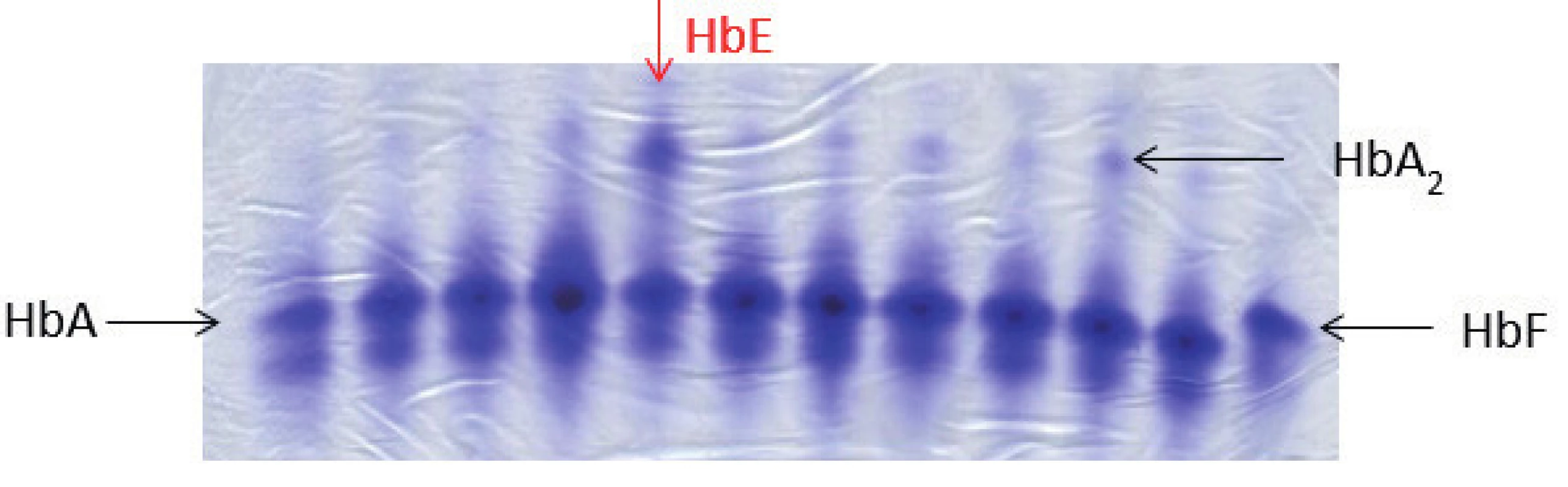
U pacientů s inaktivací tří α-globinových řetězců lze prokázat precipitovaný HbH v erytrocytech inkubací s briliant-kresylovou modří, po obarvení můžeme pozorovat v erytrocytech inkluze tvořené shlukem volných β-globinových řetězců. Kauzální mutace způsobující α-talasémie se detekují pomocí molekulárně genetických metod. Většina mutací má charakter delecí (ztráta určitého úseku DNA), k jejich potvrzení se používá nejčastěji metoda MLPA nebo multiplexní polymerázová řetězová reakce. Nedeleční formy α-talasémií způsobené bodovou mutací v HBA genu lze detekovat podobně jako u β-talasémií pomocí Sangerova sekvenování.
LÉČBA
Pacienti s talasémií minor většinou nevyžadují žádnou léčbu. Zejména v zemích, kde se nosičství talasémie vyskytuje minoritně (včetně České republiky), jsou často tito pacienti mylně léčeni preparáty Fe. Mikrocytární a hypochromní anémie je v tomto případě považována za anémii sideropenickou. Nosičství talasémie je pak diagnostikované až při neadekvátní odpovědi na tuto léčbu. Základem terapie těžších forem β-talasémie je substituce erytrocytárními koncentráty. Pacienti s β-talasémií intermedia vyžadují léčbu transfuzemi erytrocytů v dětství a v době dospívání jen ojediněle a k pravidelné substituční terapii, pokud vůbec musí být zahájena, dospějí až po ukončení druhé dekády života. Nemocní s β-talasémií major zahajují pravidelnou transfuzní léčbu většinou ihned po stanovení diagnózy, tedy v časném dětství. Časové rozmezí podávání jednotlivých erytrocytárních koncentrátů je 2–4 týdny.
Pravidelný přívod Fe transfuzemi a neefektivní erytropoézou zprostředkovaná hyperabsorpce Fe u pacientů s talasémií intermedia a talasémií major způsobují sekundární hemosiderózu [30, 31]. Klíčovou roli v tomto procesu sehrává molekula hepcidinu, hlavní regulační protein metabolismu Fe v lidském těle. Suprese syntézy hepcidinu erytropoetickou aktivitou kostní dřeně je pravděpodobně nadřazená signálům o stavu zásob Fe v organismu [32]. Toto snížení hladiny hepcidinu je zodpovědné za přetížení Fe u pacientů s talasémií intermedia, kteří nejsou závislí na transfuzní terapii [21]. Na druhé straně u pacientů s β-talasémií major je primární příčinou přetížení Fe pravidelné podávání erytrocytárních koncentrátů. Hladiny hepcidinu u těchto pacientů jsou vyšší než u pacientů s talasémií intermedia, což je pravděpodobně způsobeno supresivním efektem podávaných transfuzí na erytropoetické signály kostní dřeně účastnících se regulace syntézy hepcidinu [33]. Alterace metabolismu Fe i přes absenci klinických příznaků byla popsána i u nositelů talasemické alely [34, 35]. Pacienti s laboratorními nebo klinickými známkami přetížení Fe proto vyžadují podávání chelatačních látek k vyvázání nadbytečného Fe. V praxi jsou používány 3 typy chelatačních látek: deferoxamin, deferiprone, deferasirox. Indikace k podávání jednotlivých preparátů závisí zejména na věku pacienta a toleranci jednotlivých léků.
Léčba přidružených komplikací u pacientů s talasémií vyžaduje multidisciplinární přístup zahrnující péči kardiologickou, endokrinologickou, ortopedickou a chirurgickou.
Kurativní léčbou talasémie jsou transplantace kmenových buněk krvetvorby (HSCT) a genová terapie. První HSCT byla provedena již v roce 1982 a od té doby byla využita k léčbě talasémie u více než 3000 pacientů [36, 37]. Overall event-free survival je 80–97 % v závislosti na pokročilosti onemocnění. Nejvhodnějším dárcem je zdravý HLA shodný sourozenec [38]. Genová terapie talasémie je pak jedinou možností kurativní léčby pro pacienty, kteří nenajdou vhodného dárce k transplantaci. S úspěchem byla poprvé použita u pacienta s nosičstvím β-talasémie v kombinaci s hemoglobinopatií HbE v roce 2010. Celkem nyní probíhají tři klinické studie zahrnující 7 pacientů, u všech byl použitý lentivirový vektor se schopností začlenit funkční gen pro β-globinový řetězec do genomu pacienta. Tato léčba je zatím experimentální, protože chybí dostupné informace o vlivu zásahu do genetické informace pacientů na mutagenezi [39].
ZÁVĚR
V České republice je onemocnění talasémií relativně vzácnou příčinou mikrocytární anémie v dětské populaci. S rozšiřující se migrační vlnou lze však očekávat nárůst diagnostikovaných pacientů – zejména pacientů s nosičstvím talasemické alely. Pacienti s mikrocytární anémií, jejíž příčinou není sideropenie a která nevykazuje adekvátní odpověď na léčbu preparáty železa, by proto měli být podrobněji hematologicky vyšetřeni ve specializovaném centru. S nárůstem migrace v Evropě dále také souvisí potřeba prenatálního vyšetření, pokud existuje podezření na výskyt hemoglobinopatie v rodině.
MUDr. Lucie Sulovská, Ph.D.
Dětská klinika
FN a LF UP
I. P. Pavlova 6
775 20 Olomouc
e-mail: luciesulovska@email.cz
Sources
1. Schechter AN. Hemoglobin research and the origins of molecular medicine. Blood 2008; 112 (10): 3927–3938.
2. Williams TN, Weatherall DJ. World distribution, population genetics, and health burden of the hemoglobinopathies. Review. Cold Spring Harb Perspect Med 2012; 2 (9): a011692.
3. Angastiniotis M, Modell B. Global epidemiology of hemoglobin disorders. Ann N Y Acad Sci 1998; 850 : 251–269.
4. Weatherall DJ, Clegg, JB. Inherited haemoglobin disorders: an increasing global health problem. Bull World Health Org 2001; 79 : 704–712.
5. Mockenhaupt FP, Ehrhardt S, Gellert S, et al. Alpha(+)-thalassemia protects African children from severe malaria. Blood 2004; 104 : 2003–2006.
6. Williams TN, Wambua S, Uyoga S, et al. Both heterozygous and homozygous α + thalassemia protect against severe and fatal Plasmodium falciparum malaria on the coast of Kenya. Blood 2005; 106 : 368–371.
7. Pattanapanyasat K, Yongvanitchit K, Tongtawe P, et al. Impairment of Plasmodium falciparum growth in thalassemic red blood cells: further evidence by using biotin labeling and flow cytometry. Blood 1999; 93 : 3116–3119.
8. Ayi K, Turrini F, Piga A, et al. Enhanced phagocytosis of ring-parasitized in sickle trait and beta-thalassemia trait. Blood 2004; 104 : 3364–3371.
9. Divoký V, Indrák K, Mojzíková R. Hemoglobinopatie: talasémie a strukturní Hb varianty. In: Pospíšilová Š, Dvořáková D, Mayer J (Eds). Molekulární hematologie. Praha: Galén, 2013 : 270–283.
10. Mehta RP, Keohane EM. Thalassemias. In: Rodak BF, Fritsma GA, Keohane OA. Hematology: Clinical Principles and Appplications. 4th ed. Missouri: Elsevier, 2012 : 408–425.
11. Benz EJ, Schrier SL Landaw SA. Clinical manifestation and diagnosis of the talassemias. www.uptodate.com. Last updated: Dec 17, 2014.
12. Lorey F, Charoenkwan P, Witkowska HE, et al. Hb H hydrops foetalis syndrome: a case report and review of literature. Br J Haematol 2001; 115 (1): 72-78.
13. Carr S, Rubin L, Dixon D et al. Intrauterine therapy for homozygous alpha-thalassemia. Obstet Gynecol 1995; 85 (5 Pt 2): 876–879.
14. Chui DH, Waye JS. Hydrops fetalis caused by alpha-thalassemia: an emerging health care problém. Blood 1998; 91 (7): 2213–2222.
15. Thein SL. Pathophysiology of beta thalassemia – a guide to molecular therapies. Hematology Am Soc Hematol Educ Program 2005 : 31–37.
16. Tassiopoulos T, Rombos Y, Konstantopoulos K, et al. Spleen size in beta-thalassaemia heterozygotes. Haematologia (Budap) 1995; 26 (4): 205–209.
17. Karimi M, Bagheri MH, Tahmtan M, et al. Prevalence of hepatosplenomegaly in beta thalassemia minor subjects in Iran. Eur J Radiol 2009; 69 (1): 120–122.
18. Galanello R, Cao A. Relationship between genotype and phenotype: thalassemia intermedia. Ann N Y Acad Sci 1998; 850 : 325–333.
19. Taher AT, Musallam KM, Karimi M, et al. Overview on practices in thalassemia intermedia management aiming for lowering complication rates across a region of endemicity: the OPTIMAL CARE study. Blood 2010; 115 (10): 1886–1892.
20. Tanno T, Bhanu NV, Oneal PA, et al. High levels of GDF15 in thalassemia suppress expression of the iron regulatory protein hepcidin. Nat Med 2007 Sep; 13 (9): 1096–1101.
21. Origa R, Galanello R, Ganz T, et al. Liver iron concentrations and urinary hepcidin in beta-thalassemia. Haematologica 2007; 92 (5): 583–588.
22. Oron V, Filon D, Oppenheim A, et al. Severe thalassaemia intermedia caused by interaction of homozygosity for alpha-globin gene triplication with heterozygosity for beta zero-thalassaemia. Br J Haematol 1994; 86 (2): 377–379.
23. Olivieri NF. The beta-thalassemias. Review. N Engl J Med 1999 Jul 8; 341 (2): 99–109. Erratum in: N Engl J Med 1999; 341 (18): 1407.
24. Sirichotiyakul S, Tantipalakorn C, Sanguansermsri T, et al. Erythrocyte osmotic fragility test for screening of alpha-thalassemia-1 and beta-thalassemia trait in pregnancy. Int J Gynaecol Obstet 2004; 86 : 347–350.
25. Dragean CA, Duquesne L, Theate I, et al. Extramedullary haemopoiesis and spinal cord compression. Lancet 2011; 377 (9761): 251.
26. Pepe A, Meloni A, Rossi G, et al. Cardiac complications and diabetes in thalassaemia major: a large historical multicentre study. Br J Haematol 2013; 163 (4): 520–527.
27. Fung EB, Harmatz PR, Lee PD, et al. Multi-Centre Study of Iron Overload Research Group. Increased prevalence of iron-overload associated endocrinopathy in thalassaemia versus sickle-cell disease. Br J Haematol 2006; 135 (4): 574–582.
28. Vogiatzi MG, Macklin EA, Trachtenberg FL, et al. Thalassemia Clinical Research Network. Differences in the prevalence of growth, endocrine and vitamin D abnormalities among the various thalassaemia syndromes in North America. Br J Haematol 2009; 146 (5): 546–556.
29. Haines D, Martin M, Carson S, et al. Thalassemia Clinical Research Network. Pain in thalassaemia: the effects of age on pain frequency and severity. Br J Haematol 2013; 160 (5): 680–687.
30. Rachmilewitz EA, Giardina PJ. How I treat thalassemia. Blood 2011; 118 (13): 3479–3488.
31. Goss C, Giardina P, Degtyaryova D, et al. Red blood cell transfusions for thalassemia: results of a survey assessing current practice and proposal of evidence-based guidelines. Transfusion 2014; 54 (7): 1773–1781.
32. Ganz T, Nemeth E. The hepcidin-ferroportin system as a therapeutic target in anemias and iron overload disorders. Hematology Am Soc Hematol Educ Program 2011; 2011 : 538–542.
33. Pasricha SR, Frazer DM, Bowden DK, et al. Transfusion suppresses erythropoiesis and increases hepcidin in adult patients with β-thalassemia major: a longitudinal study. Blood 2013; 122 (1): 124–133.
34. Guimarães JS, Cominal JG, Silva-Pinto AC, et al. Altered erythropoiesis and iron metabolism in carriers of thalassemia. Eur J Haematol 2015; 94 (6): 511–518.
35. Jones E, Pasricha SR, Allen A, et al. Hepcidin is suppressed by erythropoiesis in hemoglobin E β-thalassemia and β-thalassemia trait. Blood 2015; 125 (5): 873–880.
36. Thomas ED, Buckner CD, Sanders JE, et al. Marrow transplantation for thalassaemia. Lancet 1982; 2 (8292): 227–229.
37. Angelucci E, Baronciani D. Allogeneic stem cell transplantation for thalassemia major. Haematologica 2008; 93 (12): 1780–1784.
38. Lucarelli G, Gaziev J. Advances in the allogeneic transplantation for thalassemia. Blood Rev 2008; 22 (2): 53–63.
39. Finotti A, Breda L, Lederer CW, et al. Recent trends in the gene therapy of β-thalassemia. J Blood Med 2015; 6 : 69–85.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 8-
All articles in this issue
- Current options for assessment of platelet function in neonates
- Thalassemias
- Thalassemias and hemoglobin variants in children
- Protein concentration in human milk after preterm delivery
- Pancreatic exocrine insufficiency in superior artery mesenteric syndrome – Wilkie syndrome: rationale and practical considerations on exocrine dysfunction after surgical attacks
- Brain abscess – a rare but a serious infection in childhood
- Sitosterolemia: clinical, biochemical and molecular characteristics in a 3 years old boy with marked hypercholesterolemia
- Chronic otitis media in childhood
- Professor Otto Hrodek, MD, D.Sc. – 95 years
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Thalassemias
- Chronic otitis media in childhood
- Brain abscess – a rare but a serious infection in childhood
- Thalassemias and hemoglobin variants in children
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

