-
Medical journals
- Career
Hemolyticko-uremický syndrom – nejčastější příčina akutního renálního selhání u dětí
Komplexnost patofyziologie a nové možnosti diagnostiky a terapie atypických forem
Authors: M. Malina; J. Janda; T. Seeman
Authors‘ workplace: Pediatrická klinika UK 2. LF a FN Motol, Praha přednosta prof. MUDr. J. Lebl, CSc.
Published in: Čes-slov Pediat 2010; 65 (11): 648-653.
Category: Review
Overview
Hemolyticko-uremický syndrom je závažnou chorobou ze skupiny trombotických mikroangiopatií, kam se dále řadí trombotická trombocytopenická purpura a HELLP syndrom (zkratka anglického Hemolysis, Elevated Liver enzymes, Low Platelets, syndrom kombinující jaterní postižení a hematologické změny spojovaný s těhotenstvím). Projevuje se triádou anémie, trombocytopenie a akutního renálního selhání. U dětí je HUS jednou z nejčastějších příčin akutního selhání ledvin.
Pro klasickou formu HUS, tzv. D+ HUS, je charakteristické infekční průjmové předchorobí, kdy zhruba v 75 % případů jde o infekci enterohemoragickými kmeny Escherichia coli (EHEC) produkujícími Shiga-like toxin. V 90 % případů D+ HUS se funkce ledvin po překonání akutního stavu i zcela upravují a nemoc nemá relabující charakter. V řadě případů se ale po delší době objevují poruchy glomerulární filtrace včetně chronické renální insuficience.
Existuje cca 10 % pacientů, u nichž dochází k relapsům onemocnění nebo k remisi ani nedojde. Projevy a reakce na léčbu bývají u těchto atypických forem (aHUS) značně odlišné a mají většinou i velmi těžký průběh. V poslední době byla prokázána spojitost mezi mutacemi v genech pro proteiny regulující komplementovou kaskádu a rozvojem aHUS. Do současné doby se podařilo prokázat 6 genů, jejichž mutace jsou spojené s rozvojem aHUS a vysvětlují cca 60 % těchto onemocnění.Klíčová slova:
atypický hemolyticko-uremický syndrom, molekulární genetika, eculizumab, transplantace ledvin a jaterÚvod
Historie hemolyticko-uremického syndromu (HUS) se píše od roku 1955, kdy Gasser se svými kolegy popsal pět malých dětí s příznaky akutního renálního selhání, trombocytopenie a neimunní hemolytické anémie [1]. V originální práci bylo použito názvu v plurálu – Hämolytisch-urämische Syndrome, jako kdyby autoři tušili, že nepůjde o jednoduchou patofyziologickou a anatomickou entitu, ale spíše o různé syndromy. Nicméně popsaná triáda příznaků definuje hemolyticko-uremický syndrom doposud. Publikační priorita je poněkud komplikovaná překryvem příznaků HUS s trombotickou trombocytopenickou purpurou (TTP) popsanou Moschcowitzem již v roce 1925 ve formě kazuistiky u mladé dívky [2].
V současnosti se obě klinické diagnózy společně s HELLP syndromem (zkratka anglického Hemolysis, Elevated Liver enzymes, Low Platelets, syndrom kombinující jaterní postižení a hematologické změny spojovaný s těhotenstvím) slučují pod patofyziologicky shrnující název trombotické mikroangiopatie. Příčinou klinických projevů je totiž značné poškození endotelu drobných arteriol a kapilár. Histologicky jsou léze endotelu shodné u všech těchto tří syndromů. Dochází k otoku endoteliálních buněk, ztrátě jejich krycí funkce, vzniku intravaskulárních trombů s konzumpcí značného množství trombocytů a rozvoji anémie z mechanické destrukce erytrocytů a narušení jejich morfologie při snaze proniknout tromby obturovanými cévami. HUS je pak v krevním obraze charakterizován hemolytickou anémií s anisocytózou, schistocyty až fragmentocyty a trombocytopenií. Při HUS je nejvíce postižen endotel ledvin. U HUS způsobeného shiga toxinem je tato náchylnost endotelu ledviny patofyziologicky osvětlena (viz dále), u atypických forem je stále tématem rozsáhlého výzkumu. Projevy poškození endotelu se však neomezují jen na ledviny a často jsou stejně poškozeny další orgány s bohatou mikrocirkulací (nejčastěji mozek, srdce a gastrointestinální trakt).
Incidence a klasifikace
Incidence HUS se pohybuje u dětí kolem 1–2 případů na 100 000 dětí. HUS je nejčastější příčinou akutního selhání ledvin u kojenců a batolat (0,3–0,4/100 000 dětí)[3]. HUS se klinicky dělí na takzvaný D+ HUS a D - HUS. Tato klasifikace vychází z popisu příznaku prodromálního stadia onemocnění. Typické formě D+ HUS předchází kolitida s výskytem krvavého průjmu (z anglického diarrhoea = D), po které následují příznaky hemolytické anémie, trombocytopenie a akutního selhání ledvin.
Kromě těchto primárních HUS, jejichž patofyziologie bude rozvedena níže, je známo sekundární poškození s příznaky HUS/TTP asociované s mnoha bakteriálními (pneumokoky [4]) či virovými infekcemi. Projevy HUS mohou být též nežádoucími účinky některých léků, jako cytostatika mitomycinu C či imunosupresiva cyklosporinu. HUS může též být paraneoplastickým projevem maligního tumoru [5]. V letošním roce též byla potvrzena spekulovaná asociace HUS s těhotenstvím [6].
D+ HUS
D+ HUS tvoří 90 % všech HUS u dětí. Vyskytuje se nejčastěji ve věkové skupině dětí od 3 do 6 let. Patofyziologicky zpočátku nebylo jasné, co přímo tuto formu HUS způsobuje, obviňováno bylo mnoho patogenů a byla nalezena řada asociací HUS s různým bakteriálními a hlavně virovými infekcemi. Opravdového viníka – určité kmeny E. coli se podařilo odhalit až po delší době. Dnes je za původce typického HUS považována infekce kmeny E. coli produkujícími Shiga-like toxin (dříve vero-cytotoxin), nejčastěji jde o sérotyp O157:H7, ale producentem toxinu jsou i jiné kmeny (např. některé řazené dříve k enteropatogenním E. coli vyvolávajícím závažné dětské průjmy) [7]. Zdrojem infekce je většinou hovězí skot, jehož střevo je u 15 % kolonizováno těmito bakteriemi. Vektorem jsou poté většinou živočišné produkty těmito kmeny kontaminované, např. nedostatečně tepelně upravené hovězí maso, nepasterizované mléko a mléčné produkty, ale někdy i rostlinné produkty, např. kontaminovaná zelenina (jednu z největších epidemií vyvolal sterilovaný špenát [8]).
Shiga-like toxin překvapivě bakterie sama neprodukuje do vnějšího prostředí a k jeho uvolnění dochází až po usmrcení bakterie. Z toho též vycházelo doporučení nepodávat pacientům s HUS v akutní fázi antibiotika [9]. Podrobná metanalýza však toto podezření nepotvrdila a aktivace lýzy bakterie a uvolnění toxinu je stále předmětem výzkumu [10]. Toxin z usmrcených bakterií poté prochází povrchem enterocytů a prostupuje dále do krevního řečiště, kde se váže na endotel bohatý na specifický glykoproteinový receptor globotriaosylceramidu (Gb3). Tento receptor je exprimován především na endotelu glomerulů, následkem je glomerulopatie s projevy akutního selhání ledvin.
Prognóza pacientů s D+ HUS je v akutním stadiu příznivá, mortalita se pohybuje pouze okolo 5 % [3]. Tato forma nerelabuje, ale při dlouhodobém sledování se v řadě případů objevuje postupný pokles glomerulární filtrace a stav může progredovat do chronické renální insuficience [3b]. Základem terapie je zvládnutí akutního stavu renálního selhání, dialýza, symptomatická terapie a překlenutí akutní doby, než dojde k obnovení funkce ledvin.
Atypický D - HUS
Atypický D - HUS (= aHUS, nebo též D - HUS) tvoří cca 10 % případů dětí s HUS [3]. Nemá specifický věk manifestace. Vyskytuje se u novorozenců i dospělých. Nepředchází mu většinou prodromální stadium hemoragické kolitidy (i když její přítomnost nevylučuje aHUS). Má většinou výrazně těžší průběh s extrarenálními komplikacemi a jeho dlouhodobá prognóza je také významně horší. Až u 90 % dětí první ataka D - HUS vede k reziduálnímu poškození ledvin a až u 50 % případů progreduje postižení do obrazu chronické renální insuficience a terminálního selhání ledvin, které vyžaduje dlouhodobou léčbu dialýzou nebo transplantaci ledviny. Navíc 25 % případů atypického D - HUS končí fatálně již při první atace. Některé formy D - HUS často rekurují, a to bohužel i po transplantaci ledviny [3, 11].
Již od sedmdesátých let se tušilo, že atypický HUS je vyvolán aktivací alternativní cesty komplementu [12]. Konzumpce C3 složky komplementu a normální hladiny C4 složky v séru pacientů s aHUS pro to jasně svědčily. Též histologické nálezy biopsií ledvin ukazovaly lokální aktivace komplementu až k jeho lytické složce [13] (depozice C3 v arteriolách a glomerulech a zvýšené množství finální lytické složky C5b–9 v místech intravaskulárních trombů).
Přesné důkazy, proč je alternativní složka komplementu takto neregulovatelně stimulována, se objevily až v devadesátých letech díky rozvoji metod molekulární genetiky. S ní přišel přímo skokový nárůst objevů na poli atypického HUS. Do současnosti bylo identifikováno několik genů, jejichž mutace jsou zodpovědné za familiární a sporadické formy atypického HUS. Prvním objeveným mutovaným genem asociovaným s aHUS byl gen pro regulátor komplementu faktor H [14]. Úplný nedostatek či funkční porucha tohoto proteinu vede k nekontrolované aktivaci alternativní cesty komplementu. V rychlém sledu následovaly objevy dalších asociovaných genů. V současné době je známo šest genů, jejichž změny jsou zodpovědné za vznik D - HUS (mutace v genech pro faktor H, faktor I, faktor B, MCP/CD46, C3 a trombomodulin) [14–18]. Přehled příčin D - HUS je uveden v tabulce 1.
Table 1. Přehled příčin D- HUS. 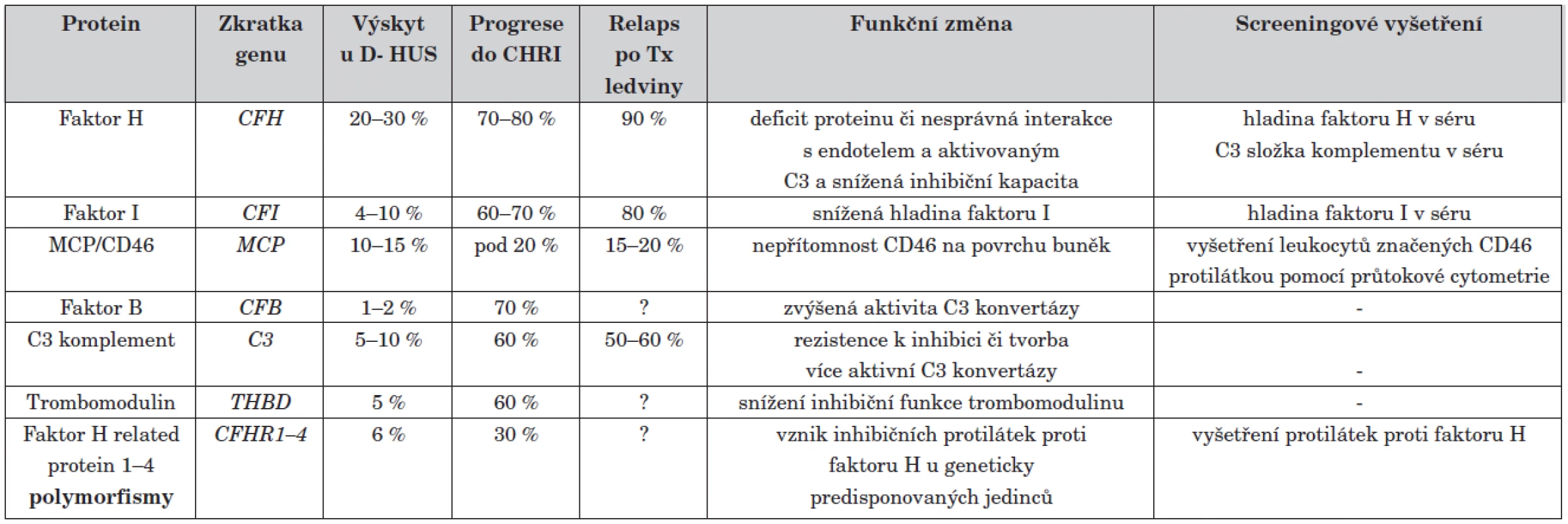
? – velmi malý vzorek pacientů, předpokládá se spíše vysoká tendence, CHRI = chronická renální insuficience, Tx = transplantace Jednotlivé formy se od sebe značně liší svým průběhem. Mutace v některých genech způsobují velmi závažné vrozené formy HUS s velmi špatnou prognózou (geny pro faktor H, faktor B, C3), jiné mutace, např. v genu MCP mají lepší prognózu s minimem relapsů po transplantaci ledviny.
Situace etiologie aHUS se ještě zkomplikovala po nálezu inhibičních protilátek proti faktoru H [19]. Tyto autoprotilátky pravděpodobně vznikají u geneticky predisponovaných jedinců s určitými polymorfismy genů jako následek prolomení imunitní tolerance (tab. 1) [20].
Diagnostika D - HUS
Jak vyplývá z tabulky 1, znalost genetického pozadí onemocnění je nezbytná nejen pro přesné zařazení pacienta do definované etiologické skupiny, ale hlavně pro upřesnění jeho prognózy. S objevem nových možností terapie pro určité genetické formy začíná být toto vyšetření zcela zásadní, zvláště při plánování zařazení pacienta do transplantačního programu. Tato vyšetření jsou velmi náročná časově i finančně a dosud nebyla v ČR dostupná. Pediatrická klinika v Motole v poslední době spolupracuje s ÚHKT (Ústav hematologie a krevní transfuze) ve snaze zavádět některé metody v ČR.
V současnosti diagnostika stojí na molekulárně genetickém vyšetření přímým sekvenováním všech genů asociovaných s aHUS. Je známo, že existují pacienti, kteří mají mutaci ve více než jednom genu a tudíž nález mutace v jednom genu není důvodem ukončení diagnostického procesu. V současné době se daří prokázat genetickou anomálii v asociovaných genech až u 60 % pacientů. Většina mutací je heterozygotních a penetrance se zdá být relativně nízká, kolem 50 %. Často se najde mutace u jednoho z rodičů či sourozence, který je kompletně zdravý. Tato nízká penetrance nemoci ji vyčleňuje ze standardního konceptu monogenní choroby. Zdá se, že mutace je pouze predisponujícím faktorem a ke spuštění nemoci je třeba více genetických a externích faktorů [21]. Pro nízkou penetranci je i eticky obtížné určit indikaci k prenatální diagnostice. Po spouštěcích faktorech se nyní intenzivně pátrá.
Vzhledem k velké časové náročnosti vyšetření se též pracuje na rychlých screeningových vyšetřeních pro předběžné určení etiologie. Tato vyšetření jsou shrnuta v tabulce 1.
Základem vyšetření by mělo být získání vzorku séra, plazmy, EDTA krve a DNA od pacienta v akutním stavu před započetím plazmaferézy. Po vyslovení podezření ze základních diagnostických parametrů (klasické příznaky HUS, vyloučení EHEC infekce a přítomnosti shiga toxinu a sekundárního HUS, nízké C3, normální C4) se započíná s vyšetřením sekvenováním od nejčetnějších známých genů po méně četné. Zároveň se testuje sérum pacienta na deficit faktoru H, provádí se screening protilátek proti faktoru H a vyšetření hladin ostatních regulátorů komplementu (faktor I, faktor B). Rychlým diagnostickým testem pro vyšetření mutací MCP je průtoková cytometrie mononukleárů a granulocytů z periferní krve označených protilátkou proti CD46 [3].
Terapie D - HUS
Dlouhá léta se ví o příznivém efektu plazmaferézy, jejíž použití je v akutní fázi doporučeno co nejdříve od manifestace nemoci a opakované plazmaferézy se doporučují s cílem dosáhnout klinické i laboratorní remise. Předpokládá se, že plazmaferéza odstraní mutované faktory a protilátky proti faktorům komplementu a nahradí je dostatečným množstvím normálních proteinů komplementové kaskády.
Plazmaferéza je výrazně efektivnější než pouhé infuze plazmy a navíc nezatěžuje pacienta excesivním přívodem tekutin, který je u pacientů v renálním selhání nevhodný. Přes svou nespornou účinnost je ale extrémně zatěžující a není trvalým řešením. Navíc u některých forem aHUS není dostatečně účinná. MCP/CD46 je povrchová molekula endotelu, která se plazmaferézou nedá odstranit či nahradit. Též odstranění v cirkulaci abundantních a mutací hyperaktivovaných molekul, jako C3 nebo faktor B, je i při masivní plazmaferéze neefektivní [22, 23].
Nové možnosti léčby D - HUS
Dalším zkoušeným terapeutickým postupem s dlouhodobým efektem by mohla být kombinovaná transplantace jater a ledvin. Jedná se o zajímavé řešení pro faktory produkované v játrech, jako například faktor H. První dva pokusy s touto terapií skončily bohužel fatálně pro rychlý rozvoj akutní rejekce jaterního transplantátu [24]. Vybuzený komplement reagoval přehnaně na transplantát, který se velmi rychle odhojil. Po této zkušenosti další kohorta osmi pacientů byla před transplantací připravena masivní opakovanou plazmaferézou, která pokračovala i po transplantaci. Výsledky byly po této úpravě velmi dobré a sedm z osmi pacientů dlouhodobě přežívá bez relapsu onemocnění [25, 26].
V současné době jsou ve fázi testování látky, které by mohly působit přímo na „místě činu“, tedy v komplementové kaskádě a její regulaci. Dvě nezávislé skupiny testují rekombinantní a purifikovaný faktor H pro pacienty s jeho deficiencí [27]. Další skupiny se pokouší o léky, které se cíleně směřují do míst s vysokou aktivací komplementu a působí inhibičně na jeho alternativní cestu.
Velká naděje se nyní vkládá do monoklonální protilátky Eculizumab vyvinuté pro léčbu paroxysmální noční hemoglobinurie, která blokuje komplement na úrovni faktoru C5 a netlumí odstraňování imunokomplexů ani opsonizaci, ale pouze lytickou schopnost komplementu. První výsledky u dospělých a větších dětí se zdají být slibné. Eculizumab byl u D - HUS poprvé použit u pacientky s C3 mutací s opakovanými relapsy, která odmítla pokračování pravidelných plazmaferéz. Po podání jedné dávky došlo k zastavení aktivace komplementu a pacientčin stav se stabilizoval [28]. Existují i dvě recentní publikace o použití Eculizumabu u dětských aHUS pacientů s dobrým výsledkem [29, 30]. V letošním roce též vyšla krátká zpráva o prvním profylaktickém použití Eculizumabu při transplantaci ledviny u dítěte s mutací ve faktoru H [31]. Problémem této terapie je vysoká cena preparátů a pravděpodobně i nutnost podávat lék u některých pacientů celoživotně. Tomuto by se alespoň u některých mutací dalo předejít kombinovanou transplantací jater a ledvin s přípravnou terapií Eculizumabem.
Závěr
Je možné konstatovat, že molekulárně genetická diagnostika těchto vzácných onemocnění může být modelovým případem, jak odhalit jejich podstatu a pokusit se je cíleně léčit. Navíc upřesněné poznání systému komplementu a jeho regulace umožňuje pochopení jeho role v dalších pochodech. Komplement totiž hraje významnou roli například v mnoha imunitních mechanismech boje se závažnými infekcemi a též má zásadní roli v transplantační medicíně. Je možné, že patologické mechanismy popsané u pacientů s atypickým HUS přispějí k lepšímu pochopení těchto pochodů a možná otevřou i terapeutické možnosti pro další léčbu častějších onemocnění a umožní efektivnější transplantace (experimentálně se uvažuje např. o užití Eculizumabu při transplantacích ledvin k zastavení rejekce) [32].
Jelikož se jedná o velmi vzácné onemocnění, jeho studium je limitováno dosažením dostatečně reprezentativního vzorku pacientů. Mezinárodní spoluprací se však v posledních letech podařilo odhalit některé patofyziologické mechanismy zodpovědné za vznik tohoto závažného a obávaného onemocnění a zdá se, že terapeutické možnosti jsou již jen krůček od standardního použití. Dobrou zprávou je fakt, že pracoviště dětské nefrologie v ČR jsou zapojena do multicentrických mezinárodních studií, jejichž výsledky dávají naději, že se znalosti i naše terapeutické možnosti významně posunou směrem vpřed a umožní dětem s D - HUS co nejpodrobnější diagnostiku a nejmodernější léčbu.
Podporováno grantem IGAMZČR reg. č. NT11457 a VZ MŠMT ČR reg. č. 0021620819.
Věnováno k životnímu jubileu prof. MUDr. Miroslava Šašinky, DrSc.
Došlo: 16. 8. 2010
Přijato: 14. 10. 2010
MUDr. Michal Malina
Pediatrická klinika UK 2. LF
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: michal.malina@lfmotol.cuni.cz
Sources
1. Gasser C, et al. Hemolytic-uremic syndrome: bilateral necrosis of the renal cortex in acute acquired hemolytic anemia. Schweiz Med. Wochenschr. 1955; 85(38–39): 905–909.
2. Moschcowitz E. An acute febrile pleiochromic anemia with hyaline thrombosis of the terminal arterioles and capillaries: an undescribed disease. 1925. Mt Sinai J. Med. 2003; 70(5): 352–355.
3. Noris M, Remuzzi G. Atypical hemolytic-uremic syndrome. N. Engl. J. Med. 2009; 361(17): 1676–1687.
3b. Bláhová K, Janda J, Kreisinger J, Matejková E, Sedivá A. Long-term follow-up of Czech children with D+ hemolytic-uremic syndrome. Pediatr. Nephrol. 2002; 17(6): 400–403.
4. Copelovitch L, Kaplan BS. Streptococcus pneumoniae associated hemolytic-uremic syndrome: classification and the emergence of serotype 19A. Pediatrics 2010; 125(1): e174–182.
5. Besbas N, et al. A classification of hemolytic uremic syndrome and thrombotic thrombocytopenic purpura and related disorders. Kidney Int. 2006; 70(3): 423–431.
6. Fakhouri F, et al. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J. Am. Soc. Nephrol. 2010; 21(5): 859–867.
7. Mark Taylor C. Enterohaemorrhagic Escherichia coli and Shigella dysenteriae type 1-induced haemolytic uraemic syndrome. Pediatr. Nephrol. 2008; 23(9): 1425–1431.
7b. Zimmerhackl LB, Rosales A, Hofer J, Riedl M, Jungraithmayr T, Mellmann A, Bielaszewska M, Karch H. Enterohemorrhagic Escherichia coli O26:H11-associated hemolytic uremic syndrome: Bacteriology and clinical presentation. Semin. Thromb. Hemost. 2010 Sep; 36(6): 586–593.
8. Grant J, et al. Spinach-associated Escherichia coli O157:H7 outbreak, Utah and New Mexico, 2006. Emerg. Infect. Dis. 2008; 14(10): 1633–1636.
9. Zhang X, et al. Quinolone antibiotics induce Shiga toxin-encoding bacteriophages, toxin production, and death in mice. J. Infect. Dis. 2000; 181(2): 664–670.
10. Safdar N, et al. Risk of hemolytic uremic syndrome after antibiotic treatment of Escherichia coli O157:H7 enteritis: a meta-analysis. JAMA 2002; 288(8): 996–1001.
11. Loirat C, Fremeaux-Bacchi V. Hemolytic uremic syndrome recurrence after renal transplantation. Pediatr. Transplant. 2008; 12(6): 619–629.
12. Stuhlinger W, et al. Letter: Haemolytic-uraemic syndrome: evidence for intravascular C3 activation. Lancet 1974; 2(7883): 788–789.
13. Barre P, et al. Hemolytic uremic syndrome with hypocomplementemia, serum C3NeF, and glomerular deposits of C3. Arch. Pathol. Lab. Med. 1977; 101(7): 357–361.
14. Warwicker P, et al. Genetic studies into inherited and sporadic hemolytic uremic syndrome. Kidney Int. 1998; 53(4): 836–844.
15. Noris M, et al. Familial haemolytic uraemic syndrome and an MCP mutation. Lancet 2003; 362(9395): 1542–1547.
16. Fremeaux-Bacchi V, et al. Complement factor I: a susceptibility gene for atypical haemolytic uraemic syndrome. J. Med. Genet. 2004; 41(6): e84.
17. Goicoechea de Jorge E, et al. Gain-of-function mutations in complement factor B are associated with atypical hemolytic uremic syndrome. Proc. Natl. Acad. Sci. U.S.A. 2007; 104(1): 240–245.
18. Delvaeye M, et al. Thrombomodulin mutations in atypical hemolytic-uremic syndrome. N. Engl. J. Med. 2009; 361(4): 345–357.
19. Dragon-Durey MA, et al. Anti-factor H autoantibodies associated with atypical hemolytic uremic syndrome. J. Am. Soc. Nephrol. 2005; 16(2): 555–563.
20. Moore I, et al. Association of factor H autoantibodies with deletions of CFHR1, CFHR3, CFHR4, and with mutations in CFH, CFI, CD46, and C3 in patients with atypical hemolytic uremic syndrome. Blood 2010; 115(2): 379–387.
21. Sánchez-Corral P, Melgosa M. Advances in understanding the aetiology of atypical Haemolytic Uraemic Syndrome. Br. J. Haematol. 2010; 150(5): 529–542.
22. Taylor CM, et al. Clinical practice guidelines for the management of atypical haemolytic uraemic syndrome in the United Kingdom. Br. J. Haematol. 2010; 148(1): 37–47.
23. Ariceta G, et al. Guideline for the investigation and initial therapy of diarrhea-negative hemolytic uremic syndrome. Pediatr. Nephrol. 2009; 24(4): 687–696.
24. Remuzzi G, et al. Hemolytic uremic syndrome: a fatal outcome after kidney and liver transplantation performed to correct factor H gene mutation. Am. J. Transplant. 2005; 5(5): 1146–1150.
25. Jalanko H, et al. Successful liver-kidney transplantation in two children with aHUS caused by a mutation in complement factor H. Am. J. Transplant. 2008; 8(1): 216–221.
26. Saland JM, Ruggenenti P, Remuzzi G. Liver-kidney transplantation to cure atypical hemolytic uremic syndrome. J. Am. Soc. Nephrol. 2009; 20(5): 940–949.
27. Fakhouri F, et al. Treatment with human complement factor H rapidly reverses renal complement deposition in factor H-deficient mice. Kidney Int. 2010; 78(3): 279–286.
28. Chatelet V, et al. Safety and long-term efficacy of eculizumab in a renal transplant patient with recurrent atypical hemolytic-uremic syndrome. Am. J. Transplant. 2009; 9(11): 2644–2645.
29. Mache CJ, et al. Complement inhibitor eculizumab in atypical hemolytic uremic syndrome. Clin. J. Am. Soc. Nephrol. 2009; 4(8): 1312–1316.
30. Gruppo RA, Rother RP. Eculizumab for congenital atypical hemolytic-uremic syndrome. N. Engl. J. Med. 2009; 360(5): 544–546.
31. Zimmerhackl LB, et al. Prophylactic eculizumab after renal transplantation in atypical hemolytic-uremic syndrome. N. Engl. J. Med. 2010; 362(18): 1746–1748.
32. Sheerin NS. Should complement activation be a target for therapy in renal transplantation? J. Am. Soc. Nephrol. 2008; 19(12): 2250–2251.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2010 Issue 11-
All articles in this issue
- Prenatální kardiologie v České republice
- Vrozené srdeční vady a jejich rizikové faktory
- Současné trendy v léčbě invaginací u dětí
- Imunoglukan P4H® v prevencii recidivujúcich infekcií dýchacích ciest v detskom veku
-
Hemolyticko-uremický syndrom – nejčastější příčina akutního renálního selhání u dětí
Komplexnost patofyziologie a nové možnosti diagnostiky a terapie atypických forem - Projekt screeningu a krátké intervence v ordinaci praktického lékaře pro děti a dorost, vedoucí k snížení zneužívání návykových látek v adolescenci
- Henochova-Schönleinova purpura – diagnostika a léčba z pohledu současných poznatků
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Henochova-Schönleinova purpura – diagnostika a léčba z pohledu současných poznatků
-
Hemolyticko-uremický syndrom – nejčastější příčina akutního renálního selhání u dětí
Komplexnost patofyziologie a nové možnosti diagnostiky a terapie atypických forem - Současné trendy v léčbě invaginací u dětí
- Imunoglukan P4H® v prevencii recidivujúcich infekcií dýchacích ciest v detskom veku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

