-
Medical journals
- Career
Role elektrické „power“ morcelace v minimálně invazivní gynekologické operativě
Authors: B. Boudová 1,2; Adéla Richtárová 1; Filip Frühauf 1; Daniela Fischerová 1; Michal Mára 1
Authors‘ workplace: Gynekologicko porodnická klinika 1. LF UK a VFN v Praze 1; Gynekologicko-porodnické oddělení, Oblastní nemocnice Trutnov a. s. 2
Published in: Ceska Gynekol 2022; 87(4): 289-294
Category: Review Article
doi: https://doi.org/10.48095/cccg2022289Overview
Cíl: Podat aktuální pohled na problematiku laparoskopické elektrické morcelace. Metodika: Rešerše dostupné literatury na vybrané téma. Výsledky: Laparoskopická morcelace byla zavedena do gynekologické operativy v 90. letech. V roce 2014 bylo americkým Úřadem pro kontrolu potravin a léčiv vydáno negativní stanovisko stran jejího užívání pro riziko možného rozsevu maligních buněk. Od té doby se použití morcelace snížilo, a to především ve Spojených státech. Některé zdravotnické organizace a instituce započaly nové výzkumy stran bezpečnosti této chirurgické metody. Po dalších letech mnohé z nich přistupují k morcelaci opět smířlivě za dodržení určitých podmínek. Závěr: Morcelace má prostor v laparoskopické operativě i v roce 2022 za předpokladu správné selekce pacientek a případně využití možnosti chráněné „in-bag“ morcelace.
Klíčová slova:
laparoskopie – myomektomie – hysterektomie – morcelace
Úvod
Přednosti minimálně invazivní chirurgie v léčbě benigních gynekologických onemocnění jsou nezpochybnitelné a již desítky let uznávané [1–3]. Laparoskopická myomektomie, poprvé popsaná Kurtem Semmem v roce 1979 [4], je stále považována za zlatý standard v léčbě symptomatických děložních myomů u pacientek s neuzavřenými reprodukčními plány. Dle Cochranovy databáze jsou pro pacientky v případě benigního nálezu minimálně invazivní operace (vaginální a laparoskopická hysterektomie) nadřazeny otevřené abdominální hysterektomii, a to vzhledem k rychlejší rekonvalescenci a návratu do běžného života [5]. Minimálně invazivní operace zvětšené dělohy s sebou ale v obou případech, ať už se jedná o dělohu šetřící, či odstraňující výkon, přináší problematiku extrakce odoperované tkáně.
Elektrický „power“ morcelátor byl poprvé v gynekologii popsán v roce 1993 [6]. Jedná se o cylindrický ostrý nůž, který se zavádí místo trokaru, a za jeho pomoci je možné intraabdominálně rozřezat a následně po kouskách extrahovat tkáň bez nutnosti výraznějšího rozšíření laparoskopických incizí (obr. 1). Morcelátory jsou vyráběny o různých průměrech (12–20 mm) s možností nastavení otáček 100–1 200 za minutu [7]. Jedná se o přístroj, který zkracuje operační čas a vzhledem k absenci doplňující minilaparotomie či kolpotomie k extrakci tkáně přispívá k zachování všech výhod minimálně invazivní chirurgie. Nejčastěji je tato technika (obr. 2) využívaná při laparoskopické hysterektomii pro objemnou myomatózní dělohu (zejména při úzké pochvě vaginálně nerodivších žen), laparoskopické myomektomii a laparoskopické supracervikální hysterektomii.
Image 1. Laparoskopický elektrický morcelátor o průměru 20 mm.
Fig. 1. Laparoscopic power morcellator with a diameter of 20 mm.
Image 2. Laparoskopická morcelace myomu.
Fig. 2. Laparoscopic morcellation of myoma.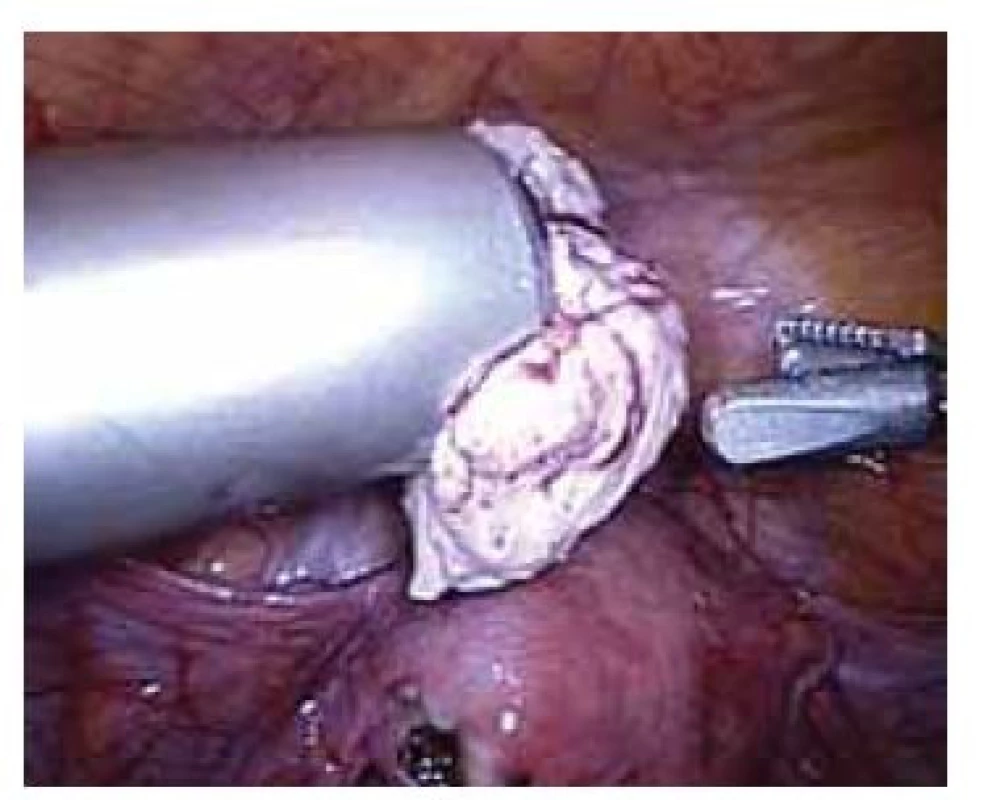
Historie kontroverze používání elektrického morcelátoru
Americký úřad pro kontrolu potravin a léčiv (FDA – Food and Drug Administration) schválil použití morcelátoru v gynekologii v květnu roku 1995. Již dříve byl tento přístroj schválen pro použití v urologii či obecné chirurgii a již v 90. letech minulého století zněla doporučení jasně; v případě maligního onemocnění má být morcelátor použit v kombinaci s odpovídajícím ochranným sáčkem [8].
V prosinci roku 2013 zveřejnil Wall Street Journal případ anestezioložky bostonské nemocnice, jež podstoupila hysterektomii s následnou morcelací dělohy pro předpokládané myomy. Výsledky histologického vyšetření ukázaly, že se jednalo o leiomyosarkom. Článek poukazoval na fakt, že morcelace mohla kvůli rozsevu buněk zhoršit stadium, a tak i prognózu nemocné lékařky. Po medializaci této kazuistiky FDA započal s přehodnocováním elektrické morcelace a v dubnu roku 2014 vydává nové prohlášení, které varuje před použitím elektrické morcelace u děložních myomů ať už v případě myomektomie, či hysterektomie. Varování bylo podloženo analýzami výskytu neočekávaného sarkomu v případě morcelace, jež uváděly riziko sarkomu 1 : 351 a riziko leiomyosarkomu 1 : 498. Tato čísla byla výrazně varovnější než dříve uváděná, která hovořila o riziku sarkomu 1 : 1 000 až 1 : 10 000 [9,10]. Prohlášení FDA mělo zásadní vliv na minimálně invazivní gynekologickou operativu ve Spojených státech a zároveň nastartovalo novou éru analýz dat a vylepšování bezpečnosti morcelace.
Neonkologická rizika morcelace
Morcelace je jako každý jiný lékařský úkon spojena s určitým rizikem komplikací. Odhlédneme-li na chvíli od onkologických aspektů morcelace, musíme si uvědomit, že morcelátor je ostrý nástroj, při jehož použití nelze vyloučit závažné poranění okolních tkání. Podle dat shromážděných v přehledovém článku z roku 2014 vycházejících z databáze FDA je incidence poranění okolních orgánů naštěstí velmi nízká a za 20 let užívání tohoto přístroje bylo zaznamenáno celkem 55 hlášení. V některých případech došlo k poranění dvou a více orgánových systémů, nejčastěji se jednalo o poranění střeva (31 případů) či cévního systému (27 případů). Další případy poranění okolních orgánů, např. ledviny, ureteru, močového měchýře či bránice, byly registrovány pouze v rámci několika ojedinělých kazuistik. Bylo zaznamenáno šest úmrtí připisovaných komplikacím spojeným s morcelací. I sami autoři článku hovoří o podhodnocení incidence poranění okolních orgánů v průběhu morcelace, nicméně i tak lze konstatovat, že tyto komplikace jsou vzácné. Podle záznamů z databáze MAUDE (Manufacturer and User Facility Device Experience) byly komplikace nejčastěji spojeny s nezkušeností operatéra a nedostatkem kontroly, dále pak s nepřehledným operačním polem či s poruchou samotného přístroje [7].
Mezi další možné komplikace patří riziko rozsevu buněk morcelované tkáně a s tím související výskyt parazitárního leiomyomu v případě hladkosvalových buněk a endometriózy či adenomyózy v případě buněk endometria. Riziko vzniku parazitární leiomyomatózy se dle literatury pohybuje kolem 0,1–0,9 % [11,12], přičemž ve většině případů je její výskyt vázán na premenopauzální stav pacientky. Riziko pooperačního výskytu endometriózy se pohybuje okolo 1,4 % [11].
Onkologická rizika morcelace
Porušení pouzdra maligního nádoru či jeho rozřezání vede k tzv. upstagingu onemocnění, a tím může dojít ke zhoršení prognózy. Tento fakt je již dlouhodobě známý např. ve stagingu karcinomu ovaria [13]. Proto v případě již stanoveného maligního onemocnění v předoperační diagnostice dominuje často otevřená operativa či užívání ochranných sáčků (tzv. endobag). U patologií děložního těla (s výjimkou zhoubného nádoru endometria) je ale předoperační diagnostika svízelná. Neexistují žádné postupy, které by byly schopny předoperačně s jistotou odlišit děložní benigní mezenchymový nádor od maligního, tj. sarkomu. Sonografie, která je dominantní zobrazovací metodou v gynekologii, dokáže rozpoznat rizikové znaky a vyslovit podezření na suspektní myometriální lézi, avšak zcela odlišit sarkom od myomu či jiné patologie neumí, což platí i pro magnetickou rezonanci [14–16]. V předoperační diagnostice by mohla pomoci předoperační biopsie myometriální patologie, která ale zatím nepatří mezi běžná předoperační vyšetření. Senzitivita a specificita tohoto vyšetření v identifikaci sarkomu v dostupné literatuře dosahuje až 92, resp. 100 % [17]. Tato diagnostická metoda s sebou sice nese mnohá úskalí, kvůli nimž není zařazena do běžného vyšetřovacího algoritmu, ale v rukou erudovaného gynekologa a patologa by mohla nabídnout validní pomoc v plánování managementu pacientek se suspektním děložním tumorem. Naopak biopsie endometria aspirační pipelou, kyretáží či hysteroskopií, která hraje nezastupitelnou roli v diagnostice endometriálních patologií [18], má v diagnostice myometriálních lézi jen malou výtěžnost. V případě záchytu leiomyosarkomu je senzitivita v literatuře udávána 36 % [19].
Incidence neočekávaného sarkomu
Děložní leiomyom je nejčastějším benigním ženským nádorem s výskytem až u 70 % žen [20]. Oproti tomu děložní sarkom patří mezi raritní onkologická onemocnění a jeho incidence se pohybuje mezi 0,5 a 3 případy na 100 000 žen za rok [21–23]. Podstatnou otázkou ale zůstává, jaké je riziko sarkomu v případě morcelace předpokládaného myomu. Jak již bylo zmíněno výše, FDA v roce 2014 uveřejnila riziko neočekávaného leimyosarkomu při operaci pro myomy ze svých analýz až 1 : 498, v roce 2017 toto riziko upravuje na 1 : 750 až 1 : 570 [24]. V reakci na prohlášení FDA vyšlo od roku 2014 několik metaanalýz hodnotících riziko neočekávaného sarkomu či přímo leiomyosarkomu, z nichž převážná většina shromáždila retrospektivní data. Pritts et al uvádí ve své metaanalýze riziko leiomyosarkomu 0,51/1 000 výkonů, a budou-li brány v potaz pouze prospektivní studie, toto riziko vychází na 0,12/1 000 výkonů, tj. jeden případ na přibližně 8 300 operací [25]. Výsledky největší metaanalýzy pak zveřejnila americká Agentura pro výzkum a kvalitu ve zdravotnictví (AHRQ – Agency for Healthcare Research and Quality) v roce 2017, která uvádí riziko leiomyosarkomu 1 : 10 000 až 1 : 770 [26].
Vliv morcelace na onkologické onemocnění
Medializovaná kazuistika s morcelací děložního leiomyosarkomu vzbudila rozruch především z důvodu možného zhoršení prognózy u pacientek, jimž byl morcelován maligní děložní nádor. Mimo konvenční benigní leiomyomy může v průběhu minimálně invazivní operace dojít k morcelaci hladkosvalového tumoru s nejistým maligním potenciálem (STUMP – smooth muscle tumor of uncertain malignant potential) či sarkomu. Mezi maligní mezenchymální nádory se řadí leiomyosarkom jakožto nejčastější zástupce, dále pak endometriální stromální sarkomy (LG-ESS – low-grade endometrial stromal sarcoma, HG-ESS – high-grade endometrial stromal sarcoma), nediferencovaný stromální sarkom a velmi vzácný adenosarkom [27]. Podle dostupných dat z literatury nemá morcelace signifikantní vliv na prognózu v případě STUMP, LG-ESS či nediferencovaného sarkomu [28]. V prvních dvou případech (STUMP, LG-ESS) se jedná o tumory s velmi dobrou prognózou, kterou morcelace nijak nezhoršuje. Opačně je tomu u nediferencovaného sarkomu, neboť se jedná o nádor s velmi špatnou prognózou, a to bez ohledu na použití morcelace. Odlišná situace je tak pouze u leiomyosarkomu, u něhož byl prokázán negativní vliv morcelace na celkové přežití, které je po morcelaci tumoru signifikantně nižší [26,29]. Pětileté přežití u pacientek s leiomyosarkomem po elektrické morcelaci bylo 30 %, po morcelaci pomocí skalpelu 59 % a bez použití morcelace 60 % [26]. Data získaná o vlivu morcelace na prognózu pacientek s děložním sarkomem jsou ale limitovaná, a to retrospektivním charakterem studií a dále malým počtem pacientek v souborech.
Další aspekty morcelace
Varování FDA se odrazilo na volbě chirurgického přístupu, a to převážně v prvních letech po jeho vydání [30]. V případě hysterektomií byl zaznamenán nárůst laparotomické operativy ve srovnání s minimálně invazivní, což se nejvíce projevilo u supracervikální hysterektomie. Před rokem 2014 dominoval u tohoto výkonu přístup laparoskopický proti otevřenému (71 vs. 29 %), přičemž v prvním roce po FDA varování se tento rozdíl prakticky vyrovnal (53,7 vs. 46,3 %) [31]. Nutno ale zdůraznit, že navýšení otevřené operativy s sebou může přinášet jiné komplikace. Siedhoff et al publikovali studii [32], která popisuje modelovou situaci založenou na metaanalýzách a přehledových článcích. V hypotetických kohortách 100 000 postmenopauzálních žen indikovaných k hysterektomii pro předpokládané myomy v průběhu 5 let byla jedna větev výsledků počítána pro otevřenou hysterektomii (skupina A) a druhá pro laparoskopickou hysterektomii s morcelací (skupina B). Ve skupině B byla popisována celkově vyšší mortalita z důvodu přítomnosti leiomysarkomů (86 vs. 71 : 100 000), oproti tomu byla ve skupině A vyšší mortalita na komplikace přidružené k operaci (32 vs. 12 : 100 000), což v celkovém součtu vychází v neprospěch laparotomické operativy (o pět úmrtí více), nehledě na fakt, že většina nefatálních komplikací, např. hernie, infekce operační rány či tromboembolická nemoc, byla taktéž častěji zastoupena ve skupině s otevřenou operací. Rutstein et al následně na tuto analýzu navázali s výpočtem předpokládaných finančních nákladů na zdravotní péči, přičemž laparoskopická hysterektomie vycházela o 2 193 dolarů na pacientku méně [33]. Tuto modelovou situaci podporuje i jiná studie analyzující data z 603 amerických nemocnic, která popisuje signifikantní vzestup výskytu pooperačních komplikací po hysterektomii v prvních 30 dnech po operaci v období po vydání varování FDA [34].
Dalším faktem je, že rozsev buněk v dutině břišní je popisován i při konvenční laparotomické myomektomii či při laparoskopické myomektomii s následnou extrakcí tkáně v ochranném sáčku minilaparotomií [35,36]. Lze tedy říci, že určité riziko zhoršení stadia maligního nádoru s sebou přináší již samotná myomektomie. Při elektrické morcelaci je riziko rozsevu ještě zvýrazněno, a proto byly vyvinuty systémy chráněné tzv. in-bag morcelace. Jedná se o morcelaci uvnitř ochranného sáčku, který je možné využít při vaginální či abdominální morcelaci. Pro laparoskopii byly vytvořeny různé systémy využívající jeden či více portů [37]. Mezi nevýhody použití morcelačních sáčků patří prodloužení operačního času a přítomnost rozsevu buněk již před započetím morcelace z důvodu porušení pouzdra nádoru při myomektomii [38,39].
Morcelace v roce 2022
Ve světle všech doposud dostupných informací už v roce 2017 vyšlo doporučení Evropské společnosti gynekologické onkologie (ESGO – European Society of Gynaecological Oncology), které je ve shodě s následně publikovaným vyjádřením FDA z února 2020 stran použití elektrické morcelace [18,40]. Obě odborné skupiny dávají důraz na správnou selekci pacientek na podkladě předoperačního vyšetření. Kromě běžného gynekologického vyšetření je třeba posoudit přítomnost rizikových faktorů a zejména vyhodnotit výsledky zobrazovacích metod. Hlavním rizikovým faktorem je rostoucí věk, s nímž roste také riziko neočekávaného sarkomu. Věk pacientek > 50 let je spojen se signifikantně vyšším rizikem leiomyosarkomu. Mezi další rizikové faktory patří černošská rasa, u níž je popisována dvojnásobná incidence leiomyosarkomu oproti kavkazské rase, předchozí ozařování pánve, dlouhodobé užívání tamoxifenu (> 5 let) či mutace genu pro fumaráthydratázu spojená s Reedovým syndromem (hereditární leiomyomatóza a renální karcinom) [41]. Pacientka by měla být informována jednak o rizicích morcelace, zároveň pak o rizicích laparotomie. Za splnění těchto podmínek je použití morcelace u nízkorizikové pacientky přípustné. Je-li morcelace nutná, je u hysterektomie preferována vaginální a při nutnosti abdominální extrakce tkáně by měla být upřednostněna chráněná morcelace. Dále se doporučuje dutinu břišní po výkonu opakovaně vypláchnout, což může snížit množství rozesetých buněk [42]. Souhlasné stanovisko s použitím morcelace za dodržování určitých pravidel vydaly i další společnosti, např. Mezinárodní společnost pro gynekologickou endoskopii (ISGE – Internation Society for Gynecologic Endoscopy), Americká společnost gynekologů a porodníků (ACOG – American College of Obstetricians and Gynecologists) či Americká asociace gynekologické laparoskopie (AAGL – American Association of Gynecologic Laparoscopists) [23,43,44].
Závěr
Onkologická bezpečnost použití elektrické morcelace v případě objemných děložních myomů operovaných minimálně invazivní chirurgií byla v posledních letech často zpochybňována. Na základě výsledků recentních metaanalýz mezinárodní odborné společnosti umožnily využití této metody se všemi svými benefity v klinické praxi, ovšem za podmínek minimalizace rizika přítomnosti a rozsevu zhoubného nádoru. Správná selekce pacientek s nízkým rizikem přítomnosti děložního sarkomu a případné využití nových ochranných systémů hrají zásadní roli v bezpečnosti této metody.
ORCID autorů
B. Boudová 0000-0003-0444-7160
A. Richtárová 0000-0001-7635-4858
F. Frühauf 0000-0002-4161-1890
D. Fischerová 0000-0001-8222-3141
M. Mára 0000-0001-8222-3141
Doručeno/Submitted: 4. 3. 2022
Přijato/Accepted: 13. 5. 2022
MUDr. Barbora Boudová
Gynekologicko-porodnické oddělení
Oblastní nemocnice Trutnov a. s.
Maxima Gorkého 77
541 01 Trutnov
Sources
1. Mais V, Ajossa S, Guerriero S et al. Laparoscopic versus abdominal myomectomy: a prospective, randomized trial to evaluate benefits in early outcome. Am J Obstet Gynecol 1996; 174 (2): 654–658. doi: 10.1016/s0002-9378 (96) 70445-3.
2. Silva BA, Falcone T, Bradley L et al. Case-control study of laparoscopic versus abdominal myomectomy. J Laparoendosc Adv Surg Tech A 2000; 10 (4): 191–197. doi: 10.1089/1092 64200421568.
3. Wiser A, Holcroft CA, Tulandi T et al. Abdominal versus laparoscopic hysterectomies for benign diseases: evaluation of morbidity and mortality among 465,798 cases. Gynecol Surg 2013; 10 : 117–122. doi: 10.1007/s10397-013-0781-9.
4. Semm K. New methods of pelviscopy (gynecologic laparoscopy) for myomectomy, ovariectomy, tubectomy and adnectomy. Endoscopy 1979; 11 (2): 85–93. doi: 10.1055/s-00 28-1098329.
5. Aarts JW, Nieboer TE, Johnson N et al. Surgical approach to hysterectomy for benign gynaecological disease. Cochrane Database Syst Rev 2015; 2015 (8): CD003677. doi: 10.1002/14651858.CD003677.pub5.
6. Steiner RA, Wight E, Tadir Y et al. Electrical cutting device for laparoscopic removal of tissue from the abdominal cavity. Obstet Gynecol 1993; 81 (3): 471–474.
7. Milad MP, Milad EA. Laparoscopic morcellator-related complications. J Minim Invasive Gynecol 2014; 21 (3): 486–491. doi: 10.1016/j.jmig.2013.12.003.
8. Kamp J, Burton TM. How FDA approved hysterectomy tools it now disfavors. Wall Street Journal. 2014 [online]. Available from: https: //www.wsj.com/articles/how-fda-approved-hysterectomy-tools-it-now-disfavors-1418700 781.
9. Bose D. Fate of laparoscopic morcellation post-FDA warning: a literature review. Int J Med Res Rev 2016; 4 (10): 1871–1878. doi: 10.17511/ijmrr.2016.i10.26.
10. Laparoscopic uterine power morcellation in hysterectomy and myomectomy: FDA Safety Communication. Silver Spring: US Food and Drug Administration. 2014 [online]. Available from: https: //wayback.archive-it.org/7993/20170722215727/https: //www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm424443.htm.
11. Tulandi T, Leung A, Jan N. Nonmalignant sequelae of unconfined morcellation at laparoscopic hysterectomy or myomectomy. J Minim Invasive Gynecol 2016; 23 (3): 331–337. doi: 10.1016/j.jmig.2016.01.017.
12. Van der Meulen JF, Pijnenborg JM, Booms - ma CM et al. Parasitic myoma after laparoscopic morcellation: a systematic review of the literature. BJOG 2016; 123 (1): 69–75. doi: 10.1111/ 1471-0528.13541.
13. Šišovská I, Minář L, Felsinger M et al. Novinky ve FIGO stagingu karcinomu ovaria, tuby a peritonea. Ceska Gynekol 2017; 82 (3): 230–236.
14. Ludovisi M, Moro F, Pasciuto T et al. Imaging in gynecological disease (15): clinical and ultrasound characteristics of uterine sarcoma. Ultrasound Obstet Gynecol 2019; 54 (5): 676–687. doi: 10.1002/uog.20270.
15. Sun S, Bonaffini PA, Nougaret S et al. How to differentiate uterine leiomyosarcoma from leiomyoma with imaging. Diagn Interv Imaging 2019; 100 (10): 619–634. doi: 10.1016/j.diii.2019.07.007.
16. Van den Bosch T, Dueholm M, Leone FP et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet Gynecol 2015; 46 (3): 284–298. doi: 10.1002/uog.14 806.
17. Kawamura N, Ichimura T, Ito F et al. Transcervical needle biopsy for the differential diag - nosis between uterine sarcoma and leiomyoma. Cancer 2002; 94 (6): 1713–1720. doi: 10.1002/cncr.10382.
18. Halaska MJ, Haidopoulos D, Guyon F et al. ESGO Council. European Society of Gynecological Oncology statement on fibroid and uterine morcellation. Int J Gynecol Cancer 2017; 27 (1): 189–192. doi: 10.1097/IGC.0000000000000 911.
19. Hinchcliff EM, Esselen KM, Watkins JC et al. The role of endometrial biopsy in the preoperative detection of uterine leiomyosarcoma. J Minim Invasive Gynecol 2016; 23 (4): 567–572. doi: 10.1016/j.jmig.2016.01.022.
20. Stewart EA, Cookson CL, Gandolfo RA et al. Epidemiology of uterine fibroids: a systematic review. BJOG 2017; 124 (10): 1501–1512. doi: 10.1111/1471-0528.14640.
21. Hosh M, Antar S, Nazzal A et al. Uterine sarcoma: analysis of 13,089 cases based on surveillance, epidemiology, and end results database. Int J Gynecol Cancer 2016; 26 (6): 1098–1104. doi: 10.1097/IGC.0000000000000720.
22. Sehnal B, Benková K, Kmoníčková E et al. Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi. Cesk Patol 2014; 50 (2): 100–105.
23. Soto-Wright V, McLellan R. Chapter 46 – Uterine Sarcomas. In: Bieber EJ, Sanfilippo JS, Horowitz IR (eds). Clinical gynecology. Philadelphia: Churchill Livingstone 2006 : 677–685.
24. ACOG committee opinion no. 770: uterine morcellation for presumed leiomyomas. Obstet Gynecol 2019; 133 (3): e238–e248. doi: 10.1097/AOG.0000000000003126.
25. Pritts EA, Vanness DJ, Berek JS et al. The prevalence of occult leiomyosarcoma at surgery for presumed uterine fibroids: a meta-analysis. Gynecol Surg 2015; 12 (3): 165–177. doi: 10.1007/s10397-015-0894-4.
26. Hartmann KE, Fonnesbeck C, Surawicz T et al. Management of uterine fibroids. 2017 [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK537742/.
27. Oliva E, Carcangiu ML, Carinelli SG, et al. Tumours of the uterine corpus: mesenchymal tumours. In: Kurman RJ, Carcangiu ML, Herrington CS (eds). World Health Organisation Classification of Tumours of the Female Reproductive Organs. 4th ed. Lyon: International Agency for Research on Cancer 2014 : 135–147.
28. Raspagliesi F, Bogani G, Lorusso D. The impact of morcellation on survival outcomes of undiagnosed uterine sarcoma. Gynecol Oncol Rep 2018; 23 : 37–38. doi: 10.1016/j.gore.2018.01.007.
29. Park JY, Park SK, Kim DY et al. The impact of tumor morcellation during surgery on the prognosis of patients with apparently early uterine leiomyosarcoma. Gynecol Oncol 2011; 122 (2): 255–259. doi: 10.1016/j.ygyno.2011.04.021.
30. Stentz NC, Cooney LG, Sammel M et al. Changes in myomectomy practice after the U.S. food and drug administration safety communication on power morcellation. Obstet Gynecol 2017; 129 (6): 1007–1013. doi: 10.1097/AOG.0000000000002035.
31. Jorgensen EM, Modest AM, Hur HC et al. Hysterectomy practice patterns in the postmorcellation era. Obstet Gynecol 2019; 133 (4): 643–649. doi: 10.1097/AOG.000000000000 3181.
32. Siedhoff MT, Wheeler SB, Rutstein SE et al. Laparoscopic hysterectomy with morcellation vs abdominal hysterectomy for presumed fibroid tumors in premenopausal women: a decision analysis. Am J Obstet Gynecol 2015; 212 (5): 591.e1–591.e8. doi: 10.1016/j.ajog.2015.03. 006.
33. Rutstein SE, Siedhoff MT, Geller EJ et al. Cost-effectiveness of laparoscopic hysterectomy with morcellation compared with abdominal hysterectomy for presumed myomas. J Minim Invasive Gynecol 2016; 23 (2): 223–233. doi: 10.1016/j.jmig.2015.09.025.
34. Multinu F, Casarin J, Hanson KT et al. Practice patterns and complications of benign hysterectomy following the FDA statement warning against the use of power morcellation. JAMA Surg 2018; 153 (6): e180141. doi: 10.1001/jamasurg.2018.0141.
35. Sandberg EM, van den Haak L, Bosse T et al. Disseminated leiomyoma cells can be identified following conventional myomectomy. BJOG 2016; 123 (13): 2183–2187. doi: 10.1111/1471-0528.14265.
36. Takeda A, Tsuge S, Shibata M et al. Identification of leiomyoma cell sheets in peritoneal washings retrieved by an intraoperative red blood cell salvage device during laparoscopic-assisted myomectomy with in-bag manual tissue extraction: a pilot study. J Minim Invasive Gynecol 2018; 25 (7): 1266–1273. doi: 10.1016/j.jmig.2018.03.026.
37. Taylan E, Sahin C, Zeybek B et al. Contained morcellation: review of current methods and future directions. Front Surg 2017; 4 : 15. doi: 10.3389/fsurg.2017.00015.
38. Frascà C, Degli Esposti E, Arena A et al. Can in-bag manual morcellation represent an alternative to uncontained power morcellation in laparoscopic myomectomy? A randomized controlled trial. Gynecol Obstet Invest 2018; 83 (1): 52–56. doi: 10.1159/000477171.
39. Lambat Emery S, Pluchino N, Petignat P et al. Cell spillage after contained electromechanical morcellation using a specially designed in-bag system for laparoscopic myomectomy: prospective cohort pilot study. J Minim Invasive Gynecol 2019; 26 (7): 1351–1356. doi: 10.1016/j.jmig.2019.01.014.
40. Food and Drug Administration. UPDATE: the FDA recommends performing contained morcellation in women when laparoscopic power morcellation is appropriate. 2020 [online]. Available from: https: //www.fda.gov/medical-devices/safety-communications/update-fda-recommends-performing-contained-morcellation-women-when-laparoscopic-power-morcellation.
41. Halaska MJ, Gracia M, Laky R et al. Morcellation of the uterus: is there any place? Curr Oncol Rep 2020; 22 (7): 68. doi: 10.1007/s11912 - 020-00927-6.
42. Yu SP, Lee BB, Han MN et al. Irrigation after laparoscopic power morcellation and the dispersal of leiomyoma cells: a pilot study. J Minim Invasive Gynecol 2018; 25 (4): 632–637. doi: 10.1016/j.jmig.2018.01.027.
43. Brown J. AAGL advancing minimally invasive gynecology worldwide: statement to the FDA on power morcellation. J Minim Invasive Gynecol 2014; 21 (6): 970–971. doi: 10.1016/j.jmig.2014.08.780.
44. Sizzi O, Manganaro L, Rossetti A et al. Assessing the risk of laparoscopic morcellation of occult uterine sarcomas during hysterectomy and myomectomy: literature review and the ISGE recommendations. Eur J Obstet Gynecol Reprod Biol 2018; 220 : 30–38. doi: 10.1016/j.ejogrb.2017.10.030.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2022 Issue 4-
All articles in this issue
- Bariéry českých žen v účasti na screeningu karcinomu děložního hrdla
- Gravidita v jizvě po císařském řezu – retrospektivní analýza případů z let 2012–2021
- Vaskularizovaná léze myometria
- Pacientka s primárním adenokarcinomem apendixu metastazujícím do ovaria
- SARS-CoV-2 placentitida jako příčina intrauterinního úmrtí plodu u pacientky s infekcí covid-19 a probíhajícím HELLP syndromem
- Cefalothorakoomfalopagus – vzácný typ spojených dvojčat z pohledu patologa
- Unilaterálna makrocystická dysplázia a kontralaterálna agenéza obličky u monoamniálneho dvojčaťa
- Dělohu zachovávající operace adenomyózy a její vliv na reprodukční výsledky
- Role elektrické „power“ morcelace v minimálně invazivní gynekologické operativě
- Perforace dělohy při nitroděložních výkonech a její řešení
- Srovnání protokolu zrychleného zotavení s konvenční péčí u pacientů podstupujících urogynekologickou operaci
- Embolie plodovou vodou – přehled a multicentrická případová analýza
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perforace dělohy při nitroděložních výkonech a její řešení
- Dělohu zachovávající operace adenomyózy a její vliv na reprodukční výsledky
- Embolie plodovou vodou – přehled a multicentrická případová analýza
- Gravidita v jizvě po císařském řezu – retrospektivní analýza případů z let 2012–2021
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

