-
Medical journals
- Career
Condylomata acuminata (genitální bradavice)
: F. Rob; Z. Kružicová; D. Vaňousová; J. Hercogová
: Centrum pro HPV, Dermatovenerologická klinika 2. LF UK, FN Motol a Nemocnice Na Bulovce, Praha, přednostka prof. MUDr. J. Hercogová
: Ceska Gynekol 2014; 79(5): 399-406
Infekce humánními papilomaviry je nejčastější virovou sexuálně přenosnou infekcí, postihuje hlavně mladší sexuálně aktivní populaci. Condylomata acuminata jsou jedním z nejčastějších projevů této infekce. Přestože nejde o život ohrožující onemocnění, je hlavním problémem jeho obtížná léčba a časté recidivy, které mohou pacienta traumatizovat a ovlivňovat nejen jeho sexuální život. V současné době existuje velké množství léčebných postupů, ale žádný není 100% účinný. Vzhledem k širokému spektru charakteru projevů a jejich různé lokalizaci je nutno přistupovat ke každému pacientovi individuálně. Proto i v současnosti je hlavní zbraní proti tomuto onemocnění prevence, tedy bezpečné sexuální chování a nověi vakcinace.
Klíčová slova:
condylomata acuminata, HPV infekce, diagnostika, prevence, léčbaÚVOD
Condylomata acuminata (CoA) jsou měkké výrůstky kůže a sliznic, které způsobují humánní papilomaviry. CoA patří do kategorie sexuálně přenosných chorob, i když jsou možné i jiné způsoby přenosu. Postihují převážně mladé sexuální aktivní jedince, nicméně nakazit se jimi lze v jakémkoli věku. Díky vysoké nakažlivosti a častým rekurencím však mohou pacienty i přes svůj benigní charakter velmi obtěžovat, a proto je nutné pacienty poučit o preventivních opatřeních, včetně nově dostupné vakcinace proti HPV infekci.
HPV INFEKCE
Humánní papilomaviry (HPV) jsou nejčastější virovou sexuálně přenosnou infekcí, během života se jimi infikuje až 70 % sexuálně aktivní populace. Příznaky však mají pouze 1–2 % infikovaných osob, neboť drtivá většina infekcí proběhne inaparentně a je spontánně vyčištěna naším imunitním systémem. Humánní papilomaviry patří mezi DNA viry, jsou druhově a tkáňově specifické. Dnes jich je známo více než dvě stě typů, přes čtyřicet z nich infikuje kůži genitálu a okolí. HPV se replikují v bazální vrstvě vícevrstevného dlaždicového epitelu, kde mohou transformovat a imortalizovat lidské keratinocyty, a způbovat tak nádorové bujení. Podle onkogenního potenciálu se dělí na low risk HPV (LR-HPV) typy 6, 11, 40, 42, 43, 44, 51, 54, 61… a na high risk HPV (HR-HPV) 16, 18, 31, 33, 35, 39, 45, 51 a další. LR-HPV se nacházejí pouze v epizomální formě, a nemohou tak integrovat do lidského genomu, jsou ale odolnější a lehce infikují i intaktní vícevrstevný epitel. Přenos je proto možný například i při petingu. HR-HPV se dokážou integrovat do buněčného genomu, a mohou tak způsobovat maligní transformaci, jsou však celkově náchylnější k vlivům vnějšího prostředí a k uchycení potřebují traumatizaci (mikrotraumatizaci) nebo metaplazii (oblast přechodu epitelů, např. na děložním hrdle a análním kanále) epitelu. Různé typy HPV způsobují různá onemocnění, jejich výčet je uveden v tabulce 1.
1. Přehled onemocnění způsobených HPV 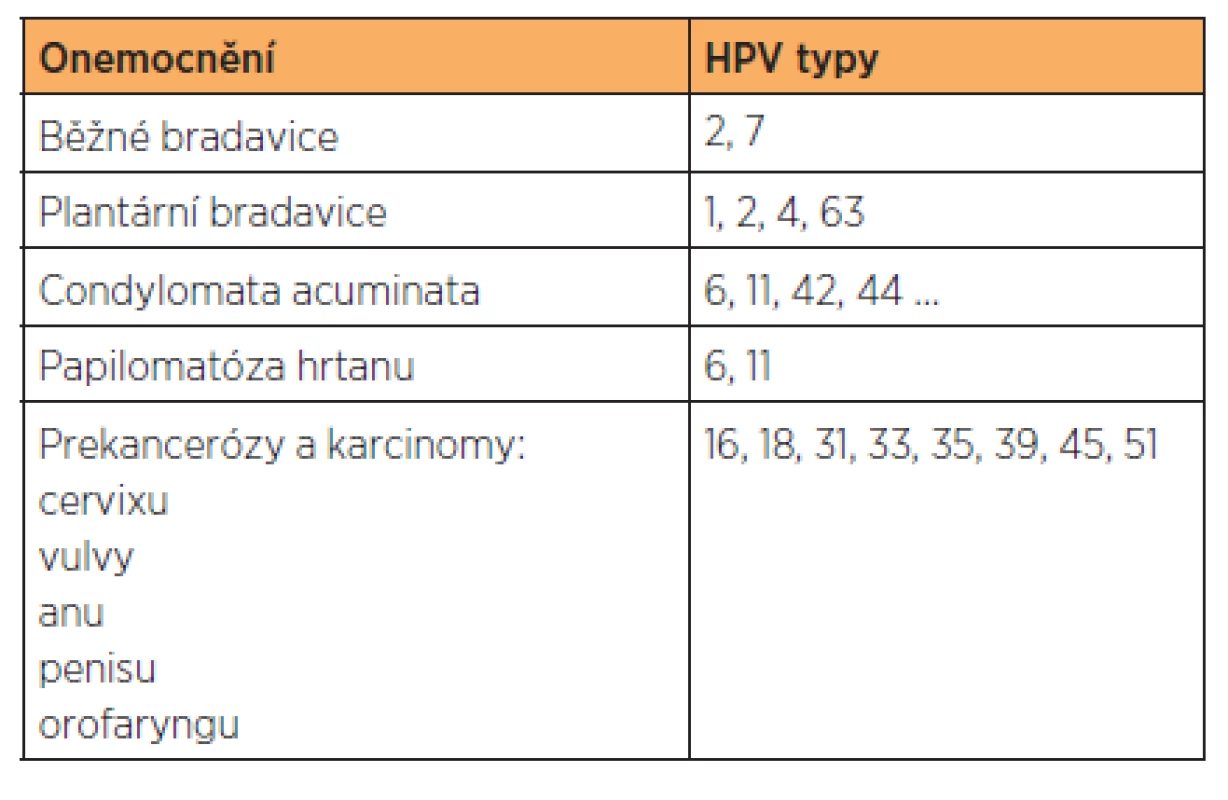
EPIDEMIOLOGIE A INCIDENCE COA
Genitální bradavice jsou onemocněním převážně mladých sexuálně aktivních lidí. Incidence v nejčastěji postižené populaci, mezi 17–33lety, se pohybuje okolo 1 %, s maximem mezi 20.–24. rokem života, kde incidence stoupá ke dvěma procentům [3, 9, 15].
Z histopatologických studií je známo, že více než 90 % CoA je způsobeno HPV typy 6 a 11, patřícími do skupiny LR-HPV [17, 27]. CoA nejsou prekancerózou, ale mohou být koinfikována HR-HPV typy, a způsobovat tak prekancerózy a karcinomy.
Ani přes zvyšující se povědomí o tomto onemocnění není veřejnost stále příliš dobře obeznámena s problematikou HPV infekce, a pokud ano, potom jde spíše o roli HPV při vzniku karcinomu děložního hrdla. Proto se setkáváme s pacienty, kterým kvůli nedostatečné informovanosti a častým recidivám způsobuje toto onemocnění psychosociální obtíže, a to hlavně problémy v partnerských vztazích a sexuálním životě. Výjimkou však není ani vznik těžkých depresivních stavů [13].
MECHANISMUS VZNIKU CoA
HPV infikují bazální vrstvu vícevrstevného epitelu, jejich průniku napomáhá traumatizace a přechod dlaždicového s cylindrickým epitelem, který se nachází například v oblasti děložníhohrdla a análního kanálu. Zde se všechny typy HPV replikují v jádrech hostitelských buněk. U LR-HPV se virus ve formě plazmidu v cytoplazmě replikuje extrachromozomálně, a nemůže tak působit maligní karcinogenezi.
TRANSMISE CoA
HPV se přenášejí přímým kontaktem kůže či sliznic. Nejčastější cestou přenosu je vaginální a anální styk, přenos při orálním sexu je také možný, ale podstatně méně častý. Jak již bylo výše řečeno, mikrotraumata v epitelu usnadňují průnik virionů do bazálních buněk epidermis. Podstatně menší část případů je způsobena přenosem z rukou na genitál, infekce plodu je možná během vaginálního porodu, pokud matka má anogenitální CoA [29]. Klinicky manifestní CoA jsou více nakažlivá než subklinické formy.
KLINICKÝ OBRAZ
Vzhled CoA závisí na lokalizaci a charakteru epitelu, na kterém projevy vznikají. Genitální bradavice se mohou projevovat jako malé papuly, květákovité noduly, keratózy nebo plaky. Poslední zmiňovaná forma se vyskytuje nejčastěji na děložním hrdle, jako plochá vyvýšená ložiska bělavého epitelu. Barva eflorescencí může oscilovat od růžové, červené až k hnědé, podle fototypu kůže pacienta. Projevy mohou být solitární, seskupené, izolované nebo splývat do rozsáhlejších plaků. Extenzivní rozsah mohou CoA mít u imunosuprimovaných pacientů. V drtivé většině případů jsou CoA asymptomatické a pacienty obtěžuje spíše kosmetická stránka. Projevy však mohou svědit až bolet, v některých případech při mechanické iritaci během soulože může dojít ke krvácení z erodovaných projevů nebo dráždivé projevy mohou způsobovat dyspareunii. Pokud CoA dosáhnou extrémních rozměrů v lokalizacích, jako je uretra nebo anus, mohou způsobovat až příznaky obstrukce. Predilekčními místy CoA je u mužů frenulum, corona glandis, glans penis, předkožka, kořen penisu, šourek. U žen to bývají labia minora et majora, klitoris, oblast periuretrální, perineum, vagina, cervix. U obou pohlaví navíc mohou být CoA lokalizována v ústí uretry, v uretře, v močovém měchýři, dále na perineu, perianaálně, v análním kanálu, v rektu a v nosohltanu. Pokud je přítomno genitální nebo perigenitální postižení, je vždy vhodné zkontrolovat i perianální krajinu (obr. 1–4).
1. Condylomata acuminata na vulvě 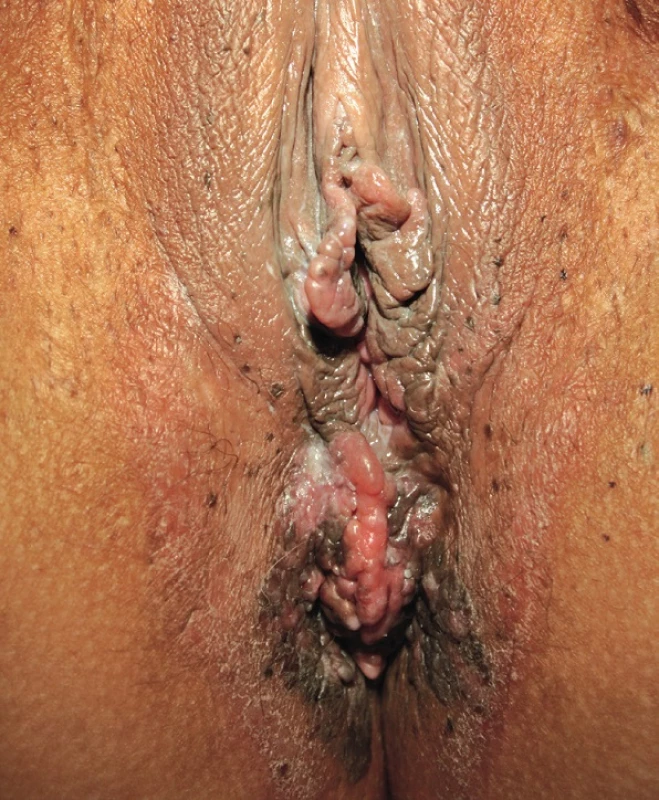
2. Condylomata acuminata u dítěte 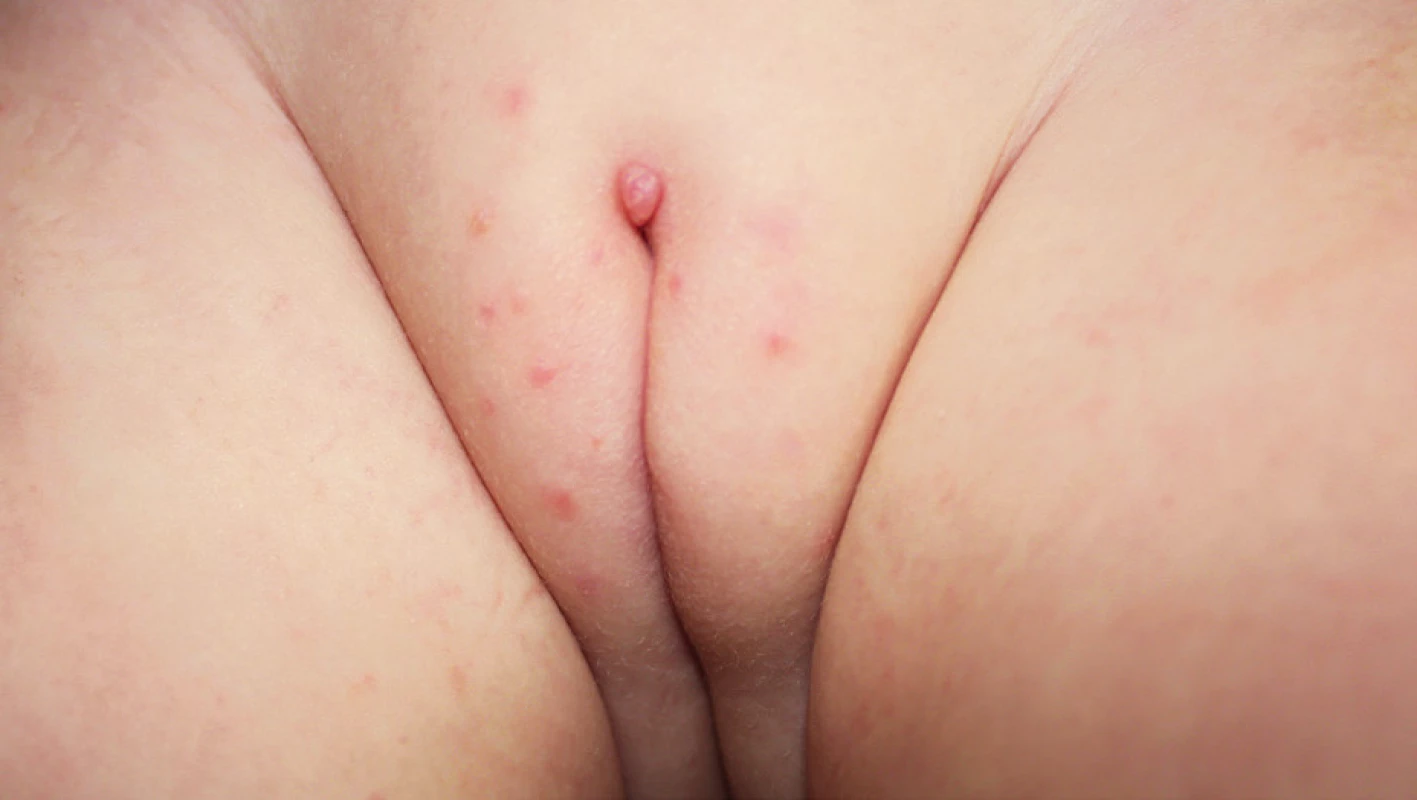
3. Perianální condylomata acuminata 
4. Rozsáhlá condylomata acuminata na vulvě 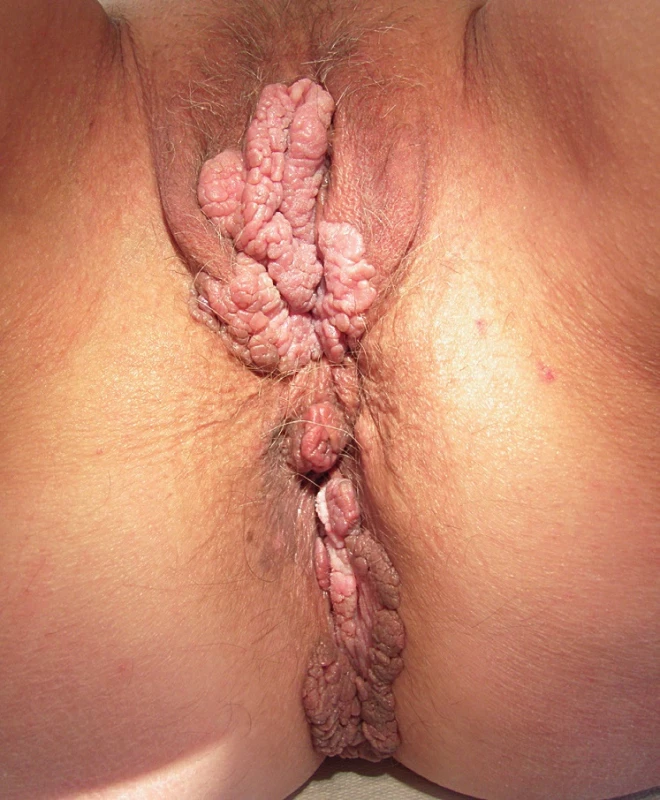
DIFERENCIÁLNÍ DIAGNÓZA
Může zahrnovat běžné anatomické struktury, jako mazové žlázy a papuly penisu. Seboroické keratózy, folikulitidu, měkké fibromy, postskabietické uzly, psoriázu, pigmentové névy, lichen planus, mollusca contagiosa a angiokeratomy. Nejtěžším a současně nejdůležitějším diferen-ciálně diagnostickým problémem jsou kondylomata lata, projevy sekundárního stadia syfilis. Ty jsou narozdíl od špičatých CoA plochá s přisedlou bazí.
DIAGNOSTIKA CoA
Klinický vzhled a lokalizace projevů většinou dostačují k určení správné diagnózy. Léze lze zviditelnit aplikací roztoku 3–5% kyseliny octové, která se aplikuje na tamponu či vatové štětičce na 10–15 sekund a následně se hodnotí, zda léze zbělá, či nikoliv. Efekt octové kyseliny během několika minut vyprchá, a proto je možné aplikaci znovu opakovat. Zbělání kůže či sliznic však není specifické pouze pro HPV infekci, a proto nemůže být využito v rámci screeningu. Pokud si však nejsme jisti, je vhodné provést biopsii s následným histopatologickým vyšetřením získaného vzorku. K histopatologickému vyšetření bychom měli taktéž přistoupit, pokud projevy ulcerují nebo krvácejí, nereagují na terapii, či dokonce dochází k progresi i přes probíhající léčbu. Vždy by měla být histologie provedena při lokalizaci projevů na děložním hrdle a u imunosuprimovaných pacientů. Případy, ve kterých bychom měli přistoupit k histopatologickému vyšetření, jsou shrnuty v tabulce 2. Dostupná jsou i další vyšetření, která však pro běžnou diagnostiku nejsou vhodná. Cytologické vyšetření je vhodné při cervikální lokalizaci kondylomat či výskytu kondylomat v análním kanále, v ostatních lokalizacích je však výtěžnost tohoto vyšetření podstatně menší. Detekce DNA HPV se provádí pomocí polymerázové řetězové reakce (PCR), ale stejně jako sérologické vyšetření není pro rutinní vyšetření vhodná. Vedle laboratorních vyšetření však nesmíme opomenout ani odběr kvalitní venerologické anamnézy, neboť CoA jsou často vedlejším nálezem při vyšetřování jiných sexuál-ně přenosných infekcí [28]. U pacientů proto doporučujeme odebrat sérologii na syfilis a HIV.
2. Indikace k histopatologickému vyšetření 
PRŮBĚH ONEMOCNĚNÍ
U většiny nemocných se CoA vytvoří dva až šest měsíců po infekci s mediánem kolem tří měsíců. Maximální délka inkubační doby je dvanáct až dvacet měsíců [10]. Neléčené genitální bradavice mohou dále progredovat a zvětšovat se, zůstat stacionární nebo regredovat. Ke spontánní regresi dochází asi v 10–30 % případů do tří měsíců od vzniku projevů, tento mechanismus je zprostředkován buněčnou imunitou. I přes vymizení klinicky patrných CoA může infekce subklinicky perzistovat po celý život. Rekurence nastávají častěji na podkladě reaktivace viru než reinfekce, neboť v makroskopicky zdravé perilezionální kůži mohou HPV perzistovat. Rekurence mohou postihovat jak imunologicky zdravé, tak imunokompromitované jedince [4].
PREVENCE CoA
Vzhledem k vysoké nakažlivosti a častým rekurencím je v současnoti akcentována role prevence genitálních bradavic. Musíme zde rozeznávat rozdíly v HR - a LR-HPV infekci. Zatímco před HR-HPV způsobující prekancerózy a karcinomy je celoživotní sexuální abstinence dostatečnou ochranou, u LR-HPV typů, které se mohou přenášet i z rukou na genitál (například při petingu) je možná i nesexuální cesta přenosu. Nižší počet sexuálních partnerů, sexuální zdrženlivé chování a užívání kondomu jsou proto pouze částečně projektivní. Kondom nechrání stoprocentně, neboť místa kůže, která nejsou chráněna kondomem, mohou být subklinicky infikována HPV. Nicméně i přesto používání kondomu zcela jednoznačně doporučujeme vzhledem k jeho 100% ochraně před jinými závažnými sexuálně přenosnými nemocemi, jako je kapavka, chlamydie, syfilis, HIV. Přes všechny známé rizikové a projektivní faktory, které jsou uvedeny v tabulce 3, je dnes nejdůležitější prevencí očkování [4].
3. Protektivní a rizikové faktory pro HPV infekci 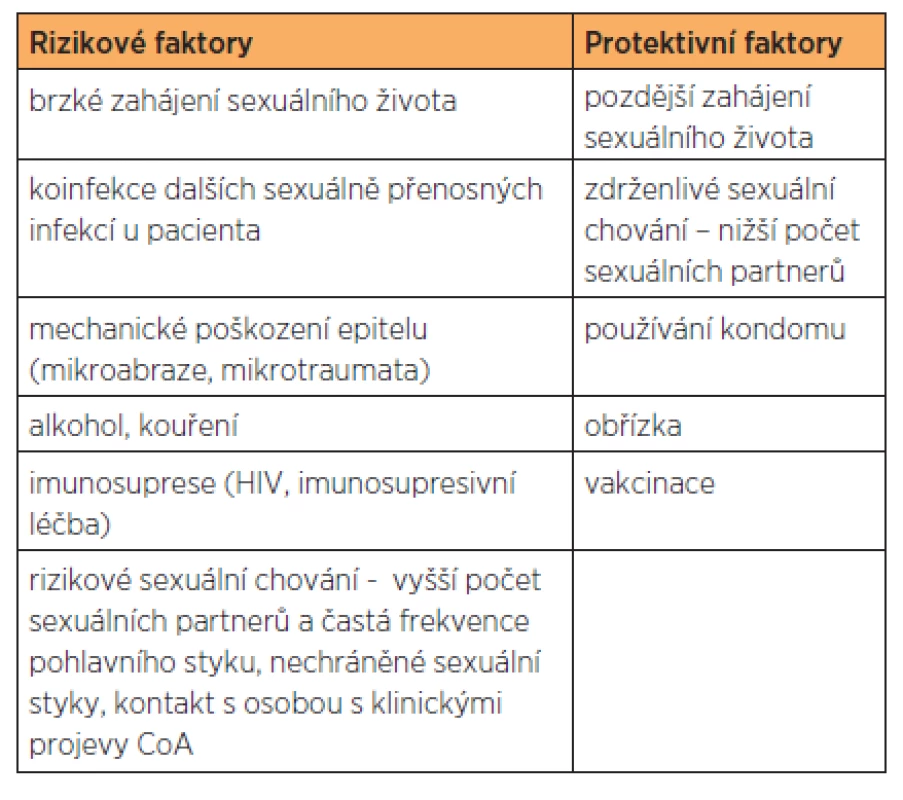
VAKCINACE
V současnosti jsou k dispozici dvě vakcíny. Na nových preparátech, které by pokrývaly širší spektrum typů HPV, se intenzivně pracuje, ale jejich uvedení do klinické praxe je vzdálenou budoucností. Vakcíny nechrání pouze proti dvěma, respektive čtveřici typů HPV, ale vzhledem ke zkřížené protektivitě chrání i proti méně častým příbuzným typům. Bivalentní vakcína chrání proti HPV 16 a 18, nechrání tak proti vzniku genitálních bradavic, podle klinických studií se ale zdá, že tato vakcína má větší protektivitu proti prekancerózám a karcinomům (podle některých studií až 93 %). Kvadrivalentní vakcína pokrývá HPV 6, 11, 16 a 18, snižuje proto riziko onemocnění CoA o více než 90 % a karcinomu děložního hrdla o 70 %.
Očkovat se doporučuje dívky mezi 12. a 15. rokem, před zahájením sexuálního života. V České republice jsou od dubna 2012 obě vakcíny pro dívky mezi 13. a 14. rokem plně hrazeny zdravotní pojišťovnou. Očkovací schéma u obou vakcín zahrnuje tři aplikace během půl roku, u bivalentní vakcíny je očkovací schéma 0, 1 a 6 měsíců (nově možno pouze ve dvou dávkách), u kvadrivalentní 0, 2 a 6 měsíců. K tomu, aby dívka měla vakcinaci plně hrazenou, musí první aplikaci stihnout před 14. rokem života. Rozhodnutí o typu aplikované vakcíny je dnes ponecháno na rodičích dívky, nejčastěji na základě konzultace s lékařem. Vakcinace je možná i u starších žen, pokud si vakcínu samy zaplatí, u kvadrivalentní vakcíny je možné očkovat ženy do 45 let věku a chlapce mezi 16. a 26. rokem. U bivalentní vakcíny je indikace pouze pro ženy do 25 let. Vakcinace pro chlapce je jednoznačně výhodnější kvadrivalentní vakcínou, protože kromě karcinomu penisu a anu je chrání i proti CoA. Nejlepší je aplikace vakcíny před zahájením sexuálního života, můžeme ji však aplikovat i u starších mužů.
Na výsledky, které vakcinace přinese v České republice, si budeme muset počkat. Snížení incidence genitálních bradavic lze očekávat během několika let, zatímco u karcinomu děložního čípku je to spíše otázka desítek let.
První výsledky jsou dostupné z Austrálie [8], která od roku 2007 zavedla plošné očkování dívek ve věku 12–13 let kvadrivalentní vakcínou a vakcinace byla nabídnuta i mladým dívkám a ženám mezi 13. a 26. rokem. V současnosti je tak v Austrálii ve věkové kohortě 12–15 let proočkováno více než 70 % dívek. Během pěti let od zavedení vakcinace poklesl vznik genitálních bradavic u žen do 26 let o více než 73 %. Současně však byl zaznamenán i výrazný pokles incidence CoA u chlapců ve stejné věkové skupině, a to o 44 % [8, 26]. S přihlédnutím k těmto impozantním výsledkům bylo proto v roce 2012 rozhodnuto i o plošné vakcinaci chlapců mezi 12. a 13. rokem.
OBECNÉ ZÁSADY TERAPIE
Vzhledem k tomu, že eradikace HPV infekce není dosud možná (HPV nejsou citlivé na virostatická léčiva), cílem léčby je odstranění klinicky manifestních kondylomat a zmírnění příznaků, subklinické formy se neléčí. Obecně lze říci, že úspěšnější bývá terapie u menších lézí a trvají-li méně než jeden rok. U pacientů se snažíme kromě odstranění klinicky viditelných lézí snížit možnost dalšího přenosu infekce, a vylepšit tak i sebevědomí pacienta. Dnes existuje mnoho způsobů léčby CoA, žádný z nich však není stoprocentně účinný, a proto některá pracoviště zahajují terapii kombinací více metod [7, 12, 21]. Původní směr převažující nemocniční léčby tohoto onemocnění je v posledních letech, hlavně ve Spojených státech a západní Evropě, nahrazován terapií, kterou si pacient aplikuje doma a dochází pouze na pravidelné kontroly. V našich podmínkách stále více převládá léčba aplikovaná lékařem. Při volbě léčebné modality je však nutné zohlednit více hledisek a to dle lokalizace, velikosti postižené plochy, našich zkušeností a samozřejmě také compliance a přání pacienta. Vždy je však nutné poučit pacienta, že po dobu terapie a tři měsíce po prodělané terapii by měl mít pouze chráněný styk, neboť traumatizovaný epitel je ideální půdou pro reinfekci. Pravidelné kontroly po ukončení léčby nejsou nutné, je však vhodná alespoň jedna kontrola tři měsíce po ukončení terapie.
ZEVNÍ TERAPIE APLIKOVANÁ PACIENTEM
Imiquimod 5%, krém (Aldara) – patří mezi lokální imunomodulátory, mechanismus účinku spočívá v lokálním uvolnění cytokinů (IF, TNF, IL). Krém si aplikuje pacient 3× týdně na noc po dobu 4–8 týdnů (maximálně 16 týdnů), ošetřovaná plocha by se měla po 6–10 hodinách po aplikaci omýt. Podle různých studií je účinnost tohoto preparátu 56–84 %. Rekurence jsou uváděny u 20 % případů. Pro tuto diagnózu však není lék hrazen pojišťovnou, a proto si ho musí pacient platit [25].
Podofylotoxin 0,5%, gel (Wartec) – pacient si aplikuje gel 2× denně po tři dny, poté čtyři dny vynechá. Tuto terapii lze opakovat až čtyřikrát, a pokud projevy nevymizí, je třeba zvážit jinou formu léčby. Preparát je kontraindikován v graviditě. Při maximálním počtu opakování se účinnost léčby pohybuje kolem 77 %. Rekurence nastávají podle studií v 23–65 %.
Sinekatechin 10%, mast (Veregen) – tento přípravek je novinkou na českém trhu. Jde o výtažek z listů zeleného čaje, který má protizánětlivé, antiproliferativní a antioxidativní účinky. Je zatím indikován pouze k léčbě extragenitálních bradavic. Účinnost přípravku se pohybuje podle provedených studií kolem 53 % s udávaným rizikem rekurence mezi 4–6 % [25].
ZEVNÍ TERAPIE APLIKOVANÁ LÉKAŘEM
Kryoterapie tekutým dusíkem pomocí vatové štětičky nebo spreje se provádí 1× za týden nebo 1× za 2 týdny, délka aplikace závisí na velikosti a lokalizaci projevů (většinou třikrát po dobu 10 sekund). Levná metoda, která obvykle nevyžaduje anestezii a nevede k jizvení. Výhodou metody je , že jde použít prakticky vždy, v místě ošetření však mohou vznikat hypopigmentace. Úspěšnost metody je udávána v 79–88 % s rizikem rekurence ve 20–40 % případů.
Podofylin 10–25%, tinktura – maximální dávka je 0,5 ml nebo 10 cm2 ošetřená plocha během jednoho sezení. Je nutné za 1–6 hodin po aplikaci roztok z důvodu možné iritační kontaktní dermatitidy až vzniku nekózy smýt a opakovat. Terapie se provádí jednou týdně nebo za 4–5 dnů. Pokud ani šest ošetření nevede k regresi, je lepší změnit způsob léčby. Přípravek je kontraindikován v graviditě. Účinnost při opakovaném užívání dosahuje až 79 %. Rekurence jsou uváděny v 5–30 % případů.
Kyselina trichloroctová (80–90 %) se aplikuje na léze, neutralizuje se bikarbonátem sodným. Opakování je možné jednou týdně, opět se doporučuje změnit terapii, pokud je šest aplikací bez efektu. Po maximálním počtu aplikací se účinnost pohybuje kolem 80 % s rizikem rekurence přibližně u třetiny pacientů.
Chirugické metody – výhodou těchto metod je zkrácení celého léčebného procesu na jednu ambulantní návštěvu, a proto bývá mnoha pacienty preferována. Zákrok se většinou provádí v lokální anestezii a k odstranění projevů můžeme použít abrazi ostrou lžičkou nebo kyretou, prosté excize skalpelem, tangenciální nebo „shave“ excizi. Úspěšnost se pohybuje kolem 80 % s rizikem rekurencí přibližně u čtvrtiny pacientů.
Elektrokauterizace je účinná, ale bolestivá. Provádí se v lokální anestezii, je kontraindikována u pacientů s kardiostimulátorem. Její účinnost je vysoká, pohybuje se mezi 60–90 %, z výše uvedených důvodů však nepatří mezi metody první volby.
CO2 laser či jiné ablační lasery (Er/YAG) – výhodou je velká přesnost, která omezí poškození okolní tkáně a vede k dobrému kosmetickému efektu, nízký počet rekurencí, nevýhodou této metody je její cena. Je velmi vhodná zejména u extenzivního rozsahu CoA.
Selektivní fototermolýza lasery (pulzní barvivový laser 585 nm, Nd:YAG 532 nm, Nd:YAG 1064 nm nebo intenzivní pulzní světlo 570–590 nm) je indikována u refrakterních případů. Tyto lasery působí trombózu subepiteliálních kapilár.
ALTERNATIVNÍ LÉČEBNÉ METODY
Interferon se používal jak k topické, tak intralezionální léčbě, není účinnější než běžně užívané metody a vzhledem k jeho vysoké cenně a bolestivosti aplikace se dnes považuje za metodu obsolentní [7, 10].
Fotodynamická terapie (PDT) funguje na principu zvýšeného vychytávání porfyrinů mitoticky aktivní tkání, která po ozáření viditelným světlem vede k tvorbě volných radikálů, a tím k destrukci nádorových buněk. Terapie je primárně určena k léčbě aktinických keratóz a povrchového bazocelulárního karcinomu. V ČR je k dispozici preparát Metvix krém (methyl-aminolevulinát). Krém se aplikuje v okluzi chránící před světlem na tři hodiny, poté se plocha ozáří zdrojem záření (580–680 nm) v dávce 100 J/cm2 [18].
5-fluorouracil (Verrumal) – cytostatikum působící blokádu syntézy DNA. V ČR je k dispozici jako 0,5% roztok, který je primárně určen pro léčbu negenitálních bradavic. Přípravek může působit kontaktní dermatitidu, v případě intrauretrálního užití striktury močové trubice.
NEŽÁDOUCÍ ÚČINKY LÉČBY
Ošetřovaná kůže může svědit, pálit, bolet, být oteklá, mohou se na ní tvořit puchýře, erytém, krusty a v případě některých špatně aplikovaných modalit terapie, zejména chirurgických, může dojít i k jizvení. Po aplikaci imiquimodu a kryalizace jsou popsány případy vzniku hypopigmentací [16].
TERAPIE VAGINÁLNÍCH CoA
Pacientka by vždy měla být raději odeslána na specializované gynekologické pracoviště k vyloučení high-grade léze.
Vhodné léčebné metody:
- A) CO2 laser;
- B) terapie tekutým dusíkem: kryokauter by se neměl nepoužívat, aby nedošlo k perforaci vaginální stěny a vytvoření píštěle;
- C) kyselina trichloroctová 80–90%.
TERAPIE CoA NA CERVIXU
Vždy bychom měli před zahájením terapie odebrat biopsii k vyloučení high-grade léze, a proto bychom měli pacientku raději odeslat na specia-lizované gynekologické pracoviště k provedení expertního kolposkopického vyšetření a biopsie. Poraněním cervixu při biopsii často nastartujeme lokální imunitní odpověd orgranismu, která vede následně k regresi projevů. Vhodné léčebné metody:
- A) laserová ablace (LEEP);
- B) mělká konizace.
TERAPIE CoA URETRÁLNÍHO ÚSTÍ A URETRY
Terapii bychom raději měli svěřit do rukou urologa-specialisty, který má s léčbou zkušenosti. Léčba v této lokalizaci je náročná a hrozí zde velké riziko poškození močové trubice s následnými strikturami. Léčba kondylomat uretrálního ústí je stejná jako terapie CoA vnějšího genitálu, nicméně musíme dbát zvýšené opatrnosti. Při uretrální lokalizaci jsou metodou volby laserové metody, kterých lze využít při cystoskopii, dále se provádí elektrokauterizace kličkou. Pokud má terapie špatné výsledky, následuje chirurgický zákrok, při kterém je někdy nutné provést rekonstukční plastiku uretry.
TERAPIE ANÁLNÍCH CoA
Léčbu je vhodné svěřit specialistovi se zkušenostmi s touto terapií, neboť mnoho pacientů s análními kondylomaty má CoA i v rek-tu. Proto bychom měli vždy vyloučit postiženírektální sliznice, pacienta vyšetřit digitálně per rectum, případně provést anoskopii. Vhodné léčebné metody:
- A) kryoterapie tekutým dusíkem;
- B) kyselina trichloroctová 80–90%;
- C) v případě excesivního postižení – chirurgické odstranění.
TERAPIE CoA V TĚHOTENSTVÍ
Během těhotenství může dojít k nárůstu CoA, který je dán zvýšenou vaskularizací oblasti a snížinou imunitní odpovědí těhotné ženy [2]. CoA nezvyšují riziko potratu ani předčasného porodu, jejich anamnéza u matky v průběhu těhotenství je však výrazným rizikovým faktorem pro vznik laryngeání papilomatózy a kondylomat u dítěte. Při vaginálním porodu může dojít k jejich mechanickému poškození a následnému krvácení, lze proto uvažovat o provedení císařského řezu [23].
Podofylin a podofylotoxin jsou v těhotenství kontraindikovány. Imiquimid není výrobcem doporučován pro nedostatek klinických dat, i přesto že jeho teratogenita nebyla prokázána. Zbylé metody lze užít podle lokalizace projevů.
- A) kryoterapie tekutým dusíkem/CO2 laser (lze do 30. týdne těhotenství);
- B) kyselina trichloroctová 80–90%;
- C) chirurgické metody.
TERAPIE CoA U DĚTÍ
Stejně jako u dospělé populace se i u dětí prevalence onemocnění zvyšuje, proto bývá tato problematika stále častější na dermatovenerologických pracovištích. Vždy bychom měli ověřit, zda nejde o případ sexuálního zneužívání dítěte, obzvláště v případě dětí starších 4 let, kdy nesexuální přenos CoA je málo pravděpodobný [1, 24]. Pokud toto podezření máme, měli bychom u dítěte vyloučit ostatní pohlavní choroby a informovat příslušné úřady. Nesexuální cesta infekce může nejspíše proběhnout již prenatálně formou ascendentní infekce nebo častěji perinatálně při vaginálním porodu u HPV infikované matky [2, 14]. U dětí je veliká šance, že ve více než 75 % dojde do dvou let ke spontánní regresi projevů, proto po tuto dobu lze vyčkávat s terapií [14]. Léčba by měla být zahájena v případě, že se CoA dále šíří, způsobují klinické obtíže nebo pokud trvají déle než dva roky. Vzhledem k zákazu klinických studií u dětí mladších než 12 let neexistují relevantní data, tudíž nevíme, která metoda léčby je nejúčinnější, proto musíme ke každému pacientovi přistupovat individuálně.
- A) kryoterapie tekutým dusíkem;
- B) chirurgické a laserové metody;
- C) imiquimod 5% krém (u dětí nad 12 let).
TERAPIE CoA U IMUNOKOMPROMITOVANÝCH (HIV) PACIENTŮ
V této skupině je vzhledem ke snížené buněčné imunitě vznik CoA podstatně častější než u imunokompetentní populace. Do této skupiny patří pa-cienti s HIV/AIDS, osoby po transplantaci orgánů, se systémovými a onkologickými chorobami, pacienti při imunosupresivní a biologické léčbě. U těchto pacientů musíme počítat s tím, že CoA mohou být v excesivním rozsahu a dorůstat velkých rozměrů. Terapie se neliší od imunologicky kompetentní populace, vzhledem ke změněné imunitě však může mít menší účinek a jsou častější rekurence. Tito pacienti mají také zvýšené riziko vzniku těžkých dysplazií a karcinomů, proto je vhodná dispenzarizace, popřípadě odebrání biopsie z podezřelých ložisek [6, 10, 19]. Výběr metody je podle lokalizace, stejně jako u imunokompetentní populace, raději terapii zahajujeme rovnou kombinací více metod, vzhledem k očekávanému menšímu účinku terapie a vyššímu riziku rekurencí. Je nutné pečlivé sledování pacienta s pravidelními kontrolami.
TERAPIE REKURENTNÍCH CoA
Patří k nejsvízelnějším případům v dermatovenerologické praxi, neboť v některých případech mohou CoA rekurovat i po aplikaci velkého počtu léčebných modalit, obzvláště u imunokompromitovaných pacientů. Na našem pracovišti těmto pacientům doporučujeme vakcinaci kvadrivalentní vakcínou v očkovacím schématu 0., 2. a 6. měsíc, neboť se zdá, že tím snížíme počet rekurencí a zabráníme vzniku nových projevů v ještě neinfikovaných lokalizacích vytvořením zvýšené buněčné imunity proti HPV infekci [20].
BUDOUCNOST LÉČBY A PREVENCE CoA
Díky plošnému očkování se dá v několika příštích letech očekávat prudké snížení výskytu CoA, následované za delší dobu snížením incidence rakoviny děložního hrdla a dalších HPV asociovaných karcinomů. Zájem farmaceutických firem je dnes upřen na vývoj terapeutických vakcín proti HPV infekci, jejich tvorba je však teprve v počátcích a uvedení do klinické praxe je spíše hudbou vzdálené budoucnosti.
MUDr. Filip Rob
Dermatovenerologická klinika
2. LF UK a Nemocnice Bulovka
Budínova 2
180 00 Praha 8
Sources
1. Allen, AL., Siegfried, EC. The natural history of condyloma in children. J Am Acad Dermatol, 1998, 39, p. 951–955.
2. Armbruster-Moraes, E., Ioshimoto, LM., et al. Presence of human papillomavirus DNA in amniotic fluids of pregnant women with cervical lesions. Gynecol Oncol, 1994, 54, p. 152–158.
3. Brown, DR., Schroeder, JM., et al. Detection of multiple human papillomavirus types in condylomata acuminata lesions from otherwise healthy and immunosuppressed patients. J Clin Microbiol, 1999, 37, p. 3316–3322.
4. Chelimo, C., Wouldes, TA., Cameron L., et al. Risk factors for and prevention of human papillomaviruses (HPV), genital warts and cervical cancer. J Infect, 2012, 26, p. 310–316.
5. Culton, DA., Morrell, DS., Burkhart, CN. The management of condyloma acuminata in the pediatric population. Pediatr Ann, 2009, 38, p. 368–372.
6. Dvořáková, K., Hercogová, J., et al. Kožní projevy u HIV-pozitivních pacientů. Čes-slov Derm, 2001, 5, s. 227–236.
7. French, L., Nashelsky, J. Clinical inquiries. What is the most effective treatment for external genital warts? J Farm Pract, 2002, 51(4), p. 313.
8. Garland, SM., Skinner, SR., et al. Adolescent and young adult HPV vaccination in Australia: achievements and challenges. Prev Med, 2011, 53, p. 29–35.
9. Garland, SM., Steben, M., Sings, HL., et al. Natural history of genital warts: analysis of the placebo arm of 2 randomized phase III trials of a quadrivalent human papillomavirus (types 6, 11, 16, and 18) vaccine. J Infect Dis, 2009, 199, p. 805–814.
10. Gormley, RH., Kovarik, CL. Human papillomavirus-related genital disease in the immunocompromised host: Part I. J Am Acad Dermatol, 2012, 66, p. 86.
11. Hamouda, T., Freij, MA., Saleh, M. Management of genital warts in pregnancy. Clin Exp Obstet Gynecol, 2012, 39, p. 242–244.
12. Hercogová, J. Codylomata acuminata. Farmakoterapie, 2006, 2, s. 1.
13. Hernandez, BY., Wilkens, LR., et al. Transmission of human papillomavirus in heterosexual couples. Emerg Infect Dis., 2008, 14, p. 888–894.
14. Jones, V., Smith, SJ., Omar, HA. Nonsexual transmission of anogenital warts in children: a retrospective analysis. Sci World J, 2007, 7, p. 1896–1899.
15. Koutsky, L. Epidemiology of genital human papillomavirus infection. Am J Med., 1997, 102, p. 3–8.
16. Mashiah, J., Brenner, S. Possible mechanisms in the induction of vitiligo-like hypopigmentation by topical imiquimod. Clin Exp Dermatol, 2008, 33, p. 74–76.
17. Mortensen, GL., Larsen, HK. The quality of life of patients with genital warts: a qualitative study. BMC Public Health, 2010, 10, p. 113.
18. Morton, CA., et al. Guidelines for topical photodynamic therapy: update. Br J Dermatol, 2008, 159, p. 1245–1266.
19. Rob, F., Kružicová, Z., Vaňousová, D., Hercogová, J. Con -
dylomata acuminata. Čs Dermat, 2012, 4, s. 212–219.
20. Rob, F., Kružicová, Z., Vaňousová, D., Hercogová, J. Prevence a léčba genitálních bradavic. Lék Listy, 2013, 3, s. 17–20.
21. Rozehnalová, Z., Hercogová, J. Současné postavení imiquimodu v dermatologii. Farmakoterapie, 2007, 8, s. 211–214.
22. Scheinfeld, N., Lehman, DS. An evidence-based review of medical and surgical treatments of genital warts. Dermatol Online J., 2006, 12(3), p. 5.
23. Silverberg, MJ., Thorsen, P. Condyloma in pregnancy is strongly predictive of juvenile-onset recurrent respiratory papillomatosis. Obstet Gynecol, 2003, 101, p. 645–652.
24. Sinclair, KA., Woods, CR., et al. Anogenital and respiratory tract human papillomavirus infections among children: age, gender, and potential transmission through sexual abuse. Pediatrics, 2005, 116, s. 815–825.
25. Stockfelth, E., Beti, H., Orasan, R. Topical Polyphenon E in the treatment of external genital and perianal warts: a randomized controlled trial. Br J Dermatol, 2008, 158(6), p. 1329–1338.
26. Tabrizi, SN., Garland, SM., et al. Fall in human papillomavirus prevalence following a national vaccination program. J Infect Dis, 2012, 206, p. 1645–1651.
27. Tachezy, R., Smahelova, J. Human papillomavirus genotype distribution in Czech women and men with diseases etiologically linked to HPV. PloS One, 2011, 6, Epub 2011, Jul 13.
28. Vaňousová, D., Bernardová, J., Sýkorová, B. Uretritidy z pohledu dermatovenerologa. Postgraduální medicína, 2010, 4, s. 466–472.
29. Worwoski, KA., Berman, SM. Sexually transmitted diseases treatment guidelines 2010. MMWR Recomm Rep., 2010, 59, p. 1–110.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 5-
All articles in this issue
- Vaginal breech delivery after 36 week of pregnancy in a selected group of pregnancy – analysis of perinatal results in years 2008–2011
- The influence of breach position of the second twinon perinatal outcomes in vaginal births of bichorial - biamniotic twins after 33rd week of gravidity
- Preeclampsia in pregnancy – prediction, prevention and further management
- Psychosomatic aspects and antipsychotics medication in ethiopathogenesis of endometrial carcinoma
- Genetic aspects of pelvic floor defects and stress urinary incontinence in women
- Incidence and therapy of lymphoceles after pelvic and paraaortic lymph node dissection – our file
- Extramammary Paget´s disease of the vulva – a case report
- Condylomata acuminata (genital warts)
- Herbal therapy during pregnancy – myths and facts
- Eminent gynecologists and obstetricians from Klatovy and surroundings
-
Establishment and evaluation of a post caesarean acute pain service in a perinatological center:
retrospective observational study - Tailoring surgical treatment of cervical precancerosis
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Condylomata acuminata (genital warts)
- Preeclampsia in pregnancy – prediction, prevention and further management
- Vaginal breech delivery after 36 week of pregnancy in a selected group of pregnancy – analysis of perinatal results in years 2008–2011
- Extramammary Paget´s disease of the vulva – a case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

