-
Medical journals
- Career
Současné možnosti diagnostiky vulvovaginálních infekcí
: J. Mašata 1; A. Jedličková 2; M. Poislová 2; D. Mašátová 2; A. Martan 1
: Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc. 1; ÚKBLD, Klinická mikrobiologie a antibiotické centrum VFN a 1. LF. UK, Praha, přednosta prof. MUDR. T. Zima, DrSc. 2
: Ceska Gynekol 2010; 75(2): 111-117
Cíl studie:
Cílem práce byl popis současných možností adekvátní diagnostiky poruch poševního prostředí.Typ studie:
Souhrn.Pracoviště:
Gynekologicko-porodnická klinika, 1. LF UK a VFN Praha, ÚKBLD, Klinická mikrobiologie a antibiotické centrum 1. LF UK a VFN Praha.Materiál a metodika:
Prezentace literárních údajů a vlastních zkušeností při diagnostice poruch poševního prostředí.Závěr:
Vulvovaginální infekce jsou jedním z nejčastějších problémů, s kterými se setkáváme v běžné každodenní gynekologické praxi. Většina pacientek s tímto onemocněním vyžaduje pouze jednoduché vyšetření a léčbu. Pro poskytnutí adekvátní péče ženám s urogenitálními infekcemi je nezbytné, abychom pochopili základní patofyziologii vulvovaginálních obtíží. Základním krokem je správná diagnostika onemocnění, nejlépe na základě klinického vyšetření, včetně stanovení pH, KOH testu a nativní mikroskopie. Naše rozhodnutí jsou často ovlivněna klinickými dogmaty, která se opakují v učebnicích gynekologie. Hodnocení barveného preparátu nadále patří k základním diagnostickým metodám, které považujeme za zlatý standard.Klíčová slova:
vulvovaginální infekce, barvení podle Grama, bakteriální vaginóza, aerobní vaginitis, vulvovaginální kandidóza, trichomoniáza.ÚVOD
Vulvovaginální infekce jsou jedním z nejčastějších problémů, s kterými se setkáváme v běžné každodenní gynekologické praxi. Většina pacientek s tímto onemocněním vyžaduje pouze jednoduché vyšetření a léčbu. Přesto u části žen je obtížné stanovit správnou diagnózu nebo špatně odpovídají na standardní léčbu [15]. Klasicky se projevují výtokem, svěděním nebo pálením zevních rodidel. Onemocnění můžeme dělit podle původce na virové, bakteriální, kvasinkové nebo parazitární. Do této skupiny infekčních onemocnění se zařazuje trichomoniáza, vulvovaginální kandidóza, bakteriální vaginóza (BV), aerobní vaginitida [5] (nově popsaná v roce 2002, vydělila se od BV), atrofická vaginitida, herpes genitalis a relativně nově (v roce 1994) popsaná poševní laktobacilóza [11].
Významně se také rozšířily diagnostické možnosti. Vedle klasických vyšetřovacích metod – kultivace, mikroskopického vyšetření (barvené preparáty, nativní preparát), cytologie, poševního pH testu s hydroxidem draselným (KOH) – se rozvíjejí i nové metody, jako je stanovení přítomnosti protilátek, průkaz antigenů, genů nebo nukleových kyselin.
Při vyšetřování poševních výtoků se diagnostika částečně přesouvá z laboratoří do ambulancí. Klasické hodnocení tzv. mikrobního poševního obrazu dává falešně negativní nebo neúplnou informaci. Klasické pojetí mikrobních poševních obrazů tak, jak je ještě často v České republice používáno, bylo jistě ve své době velkým přínosem. Vzhledem k pokroku ve výzkumu a k současnému pojetí etiologie vulvovaginitid je v současnosti toto hodnocení barvených preparátů obsolentní. Neznamená to však, že hodnocení barveného preparátu stěru z pochvy nepatří nadále k základním diagnostickým metodám. Nadále se považuje za zlatý standard při diagnostice vaginálních infekcí. V praxi je možné používat klinické hodnocení, stanovení poševního pH, mikroskopické vyšetření nativního preparátu, test s KOH a využívat možnosti hodnocení barvených preparátů.
Cílem tohoto sdělení je podat přehled běžných současných vyšetřovacích možností pro diagnostiku poševních výtoků.
ANAMNÉZA
Diagnóza vulvovaginální infekce by měla být stanovena na základě anamnézy, klinického vyšetření a laboratorních testů. U každé ženy s vulvovaginální infekcí bychom měli stanovit etiologickou diagnózu.
Správně odebraná anamnéza může být důležitým vodítkem ke stanovení diagnózy. Primárně bychom měli odlišit pacientky s akutním, nebo recidivujícím onemocněním. Každá z těchto pacientek vyžaduje odlišný přístup. Kromě základní anamnézy bychom neměli opomenout následující otázky (tab. 1, 2) [16], které mohou být důležitým vodítkem ke stanovení diagnózy při akutních, nebo chronických obtížích. Dotázat se musíme nejen na lokalizaci obtíží, ale i na přidružené příznaky, jako bolesti v podbřišku, dysurické obtíže a jiné. Důležitou informaci nám přináší i dotaz na začátek příznaků, zvláště ve vztahu k poslední menstruaci (například aktivace trichomonádové infekce těsně po menstruaci, výskyt obtíží v druhé polovině cyklu při rekurentní vulvovaginální kandidóze (cave – laktobacilóza může mít obdobné příznaky ve stejné fázi menstruačního cyklu). Neměli bychom se také opomenout zeptat, zda obtíže nenastaly po změně sexuálního partnera, nebo na vztah obtíží k pohlavnímu styku.
1. Otázky vhodné k doplnění anamnézy při akutním onemocnění 
První dvě otázky nás mohou navést, na co se máme zaměřit při fyzikálním vyšetření, další 3 nám mohou pomoci vysvětlit původ obtíží. Poslední otázku klademe po vyšetření a zahajujeme tak základní dialog s pacientkou. 2. Otázky vhodné k doplnění anamnézy při chronických obtížích 
První dvě otázky nás mohou navést, na co se máme zaměřit při fyzikálním vyšetření. Třetí otázka nás nepřímo může upozornit na rekurentní vulvovaginální kandidózu. 4 a 5. otázka nás opět upozorňuje na možnou příčinu obtíží, nebo příčinu exacerbace onemocnění. Další 3 nám mohou pomoci vysvětlit původ obtíží. Poslední otázku klademe po vyšetření, a zahajujeme tak základní dialog s pacientkou. Diagnóza onemocnění by neměla být postavena pouze na základě anamnestických údajů.
Typickým příkladem je vulvovaginální kandidóza. Naneštěstí se velmi často stává, že je diagnóza stanovena pouze na základě telefonické konzulatace s pacientkou, aniž by byla fyzikálně vyšetřena [7]. Podobné příznaky může vyvolat celá řada infekčních i neinfekčních onemocnění. Dalším problémem je stanovení diagnózy samotnou pacientkou a samoléčba (možnost zakoupení antimykotik bez lékařského předpisu). V některých studiích bylo prokázáno, že u více než poloviny žen, které si takto samy stanovily diagnózu, nebyly kvasinky prokázány jako kauzální agens onemocnění. V jedné z nejlépe provedených studií [19] byla vulvovaginální kandidóza kultivačně prokázána pouze u 37,4 % žen, které byly přesvědčeny, že mají kvasinkovou infekci.
Neméně důležitý je i dotaz na alergii, polinózu, asthma bronchiale, atopický ekzém nebo chronickou sinusitidu. Na základě těchto dotazů můžeme identifikovat ženy s rizikem alergické vulvovaginitidy, kde může nasedat kvasinková superinfekce.
KLINICKÉ VYŠETŘENÍ
Kromě gynekologického vyšetření je důležité i zhodnocení celkového fyzického stavu pacientky.
Chybou je i přecenění klinického nálezu. Typické příznaky pro daná onemocnění nejsou u všech pacientek a příznaky různých onemocnění se často překrývají.
Pro správné stanovní diagnózy vulvovaginální infekce potřebujeme minimální množství diagnostických pomůcek. Přesto část lékařů, kteří poskytují ambulantní léčbu, nemá potřebné vybavení pro kompletní vyšetření žen s vulvovagilními infekcemi. K základnímu vybavení by měly patřit pH testační papírky. Optimální by bylo mít k dispozici mikroskop, podložní a krycí sklíčka. Dále bychom měli mít k dispozici fyziologický roztok, 10% roztok KOH, 4% roztok kyseliny octové, vatové štětičky, plastikové špátle, kolposkop, bioptické klíšťky. Nezbytnou součástí vybavení je mít i správné odběrovky na klasické kultivační vyšetření, odběrovky na speciální kultivace (trichomonas, kvasinky, mykoplazmata a jiné), transportní média, speciální odběrovky pro vyšetření amplifikačními technikami (například polymerázová řetězová reakce – PCR), nebo hybridizaci.
VYŠETŘENÍ VULVY A POCHVY
Vyšetření by mělo být zahájeno pečlivou aspekcí vulvy. Zavedením zrcadel před vyšetřením vulvy se můžeme připravit o celou řadu důležitých informací, které nás vedou ke stanovení správné diagnózy. Všímáme si zarudnutí vulvy, přítomnosti kondylomat, herpetických lézí nebo dalších příznaků infekčních onemocnění. Při podezření na syndrom vulvární vestibulitidy bychom neměli opomenout provést štětičkový test (bolestivost v místě dotyku vatovým tamponem u žen s vulvární vestibulitidou) [9]. Klinický nález nemůžeme také přeceňovat. V jedné studii bylo prokázáno, že pouze u poloviny žen, u kterých lékaři diagnostikovali na základě klinického vyšetření vulvovaginální kanidózu, byly kvasinky kultivačně nebo PCR prokázány [14].
Nadměrný výtok také neznamená jasně přítomnost infekce. Tři čtvrtiny žen se syndromem vulvární vestibulitidy udávají nadměrný výtok a jsou často opakovaně bez efektu léčeny pro kvasinkovou infekci.
Hnisavý výtok může být i příznakem cervikální infekce.
STANOVENÍ POŠEVNÍHO pH A AMINOVÝ TEST
Stanovení pH je zásadní při vyšetření žen s vulvovaginálními obtížemi. Normální mikrobiální osídlení pochvy je možné do pH 4,5 (obr. 1). Nad touto hranicí fyziologické osídlení pochvy není prakticky možné.
1. Mikrobiální osídlení pochvy při normálním pH 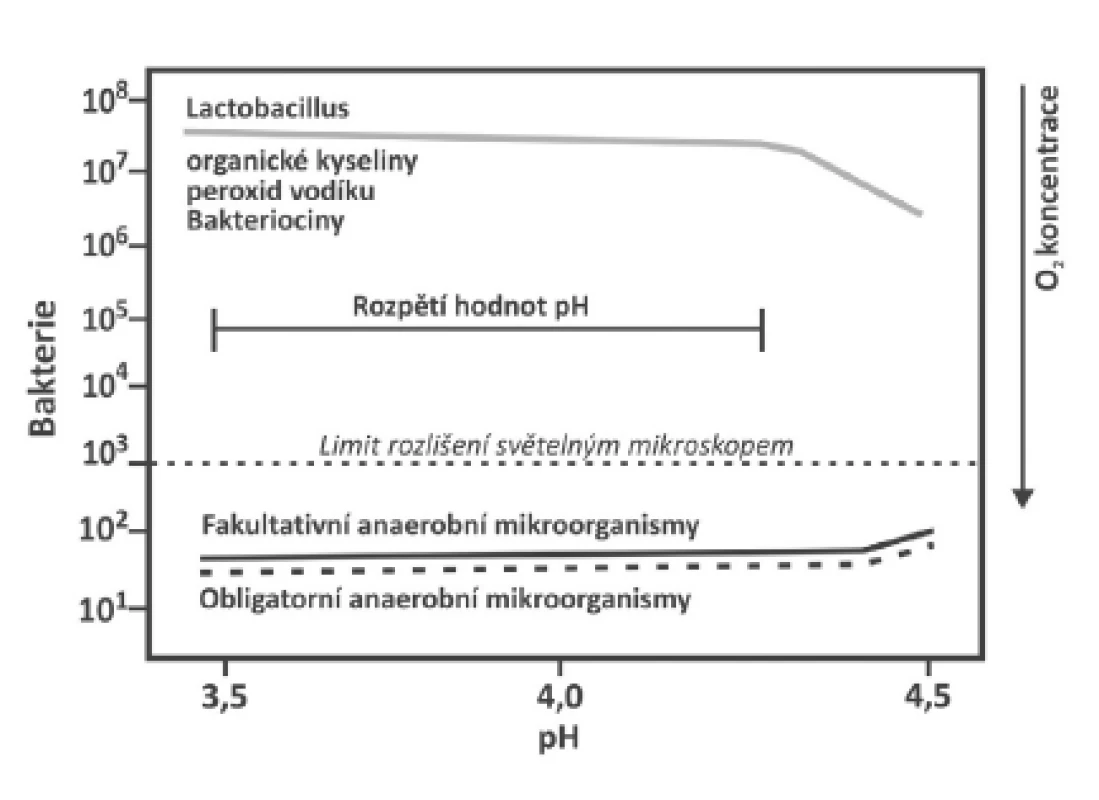
Při normálním pH (3,5-4,5) je pochva dominantě osídlena laktobacily, které produkují různé organické kyseliny, H2O2, a bakteriociny a tak se podílejí na potlačení růstu ostatních bakterií, které jsou ve velmi nízkých koncentracích. Bakterie – koncentrace bakterií na gram poševního sekretu Zjednodušený přístup k použití pH (obr. 2) je často zavádějící a může vést k nesprávné diagnóze.
2. Simplifikovaný přístup pro využití pH pro rychlé stanovení poruch poševního prostředí 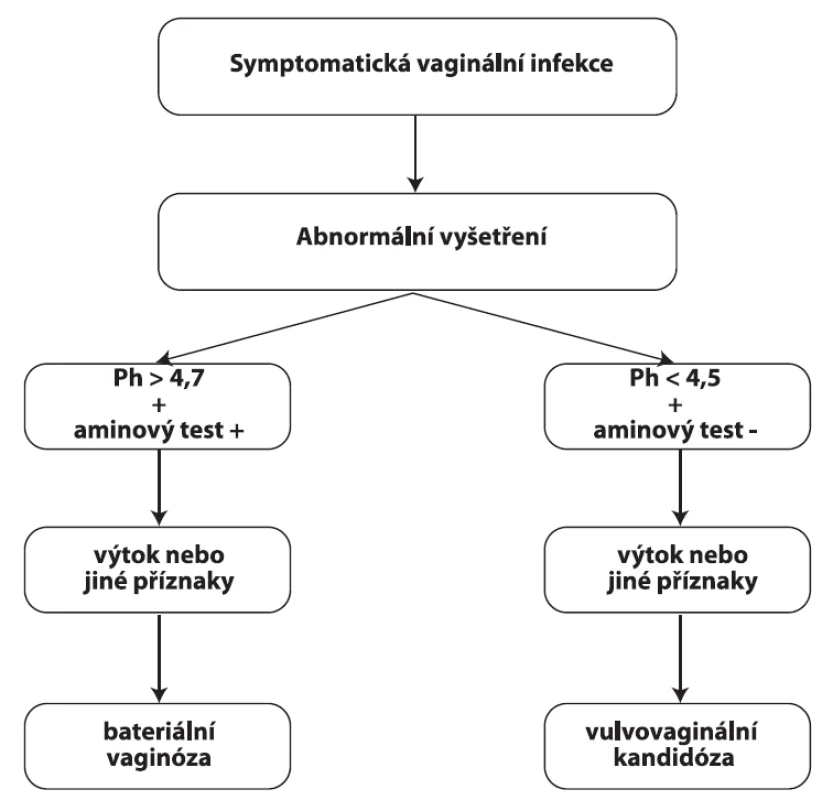
Zásadité poševní prostředí je typické pro bakteriální vaginózu [1], symptomatickou trichomoniázu, aerobní vaginitidu [5], atrofickou vaginitidu nebo hnisavý zánět na podkladě nedostatku estrogenů. Poševní pH je také vyšší u cervikálních infekcí (gonokokové a chlamydiové infekce a jiné). I při stanovení poševního pH je nutné dodržet určitý postup, abychom mohli co nejpřesněji stanovit diagnózu. Cervikální hlen je alkalický, především uprostřed cyklu. Poševní pH proto stanovujeme přiložením testačního papírku na přední nebo postranní poševní stěnu, abychom se vyhnuli kontaktu s cervikálním hlenem. Dalším možnou chybou je použití vody z vodovodu ke zvlhčení zrcadel (voda je alkalická).
Pro odběr vzorku na nativní mikroskopické vyšetření je optimální použít plastikovou špátli. Vatová štětička nasává určitou část vzorku a dále mohou být přítomny na sklíčku i vlákna, které může méně zkušený zaměnit s kandidami. Naopak sterilní vatová štětička je vhodná pro nátěr vzorku na sklíčko pro vyšetření barveného preparátu (při použití špátle se vytvoří shluk, který se po obarvení velmi obtížně hodnotí).
Aminový test je založen na faktu, že biogenní aminy se snáze uvolňují při alkalickém pH. Po přidání 10% KOH ucítíme typický rybí zápach (aminový test).
Stanovení pH má 100% senzitivitu při diagnostice BV a trichomoniázy, aminový test má 84% senzitivitu a 47% specificitu při diagnostice trichomoniázy, 88% senzitivitu a 53% specificitu při diagnostice BV. Na základě pH nelze též odlišit bakteriální vaginózu od aerobní vaginitidy, ale u aerobní vaginitidy je aminový test negativní. Tyto dva jednoduché testy jsou přesto vhodné jako screeningová vyšetření při diagnostice vaginálních infekcí.
MIKROSKOPICKÉ VYŠETŘOVACÍ METODY
Správné využití mikroskopického vyšetření je nejdůležitější součástí při stanovení správné diagnózy. Optimální je využití mikroskopu přímo v ambulanci gynekologa, které umožní okamžité stanovení diagnózy. Pro mnohé je použití mikroskopického vyšetření časově náročné a také ne každá ambulance je vybavena mikroskopem.
V našich podmínkám se ve většině případů za mikroskopické vyšetření považuje hodnocení mikrobních obrazů (MOP) z barveného preparátu (viz výše). Pro praxi by bylo přínosné hodnocení nativního preparátu. Nativní preparát připravíme tak, že vzorek materiálů, který odebereme nejlépe z přední poševní stěny, naneseme nejlépe plastikovou špátlí. Po přidání kapky fyziologického roztoku se preparát překryje krycím sklíčkem a prohlíží se pod světelným mikroskopem při zvětšení 400x. V zorném poli se hodnotí přítomnost a počet leukocytů, epitelie, eventuálně přítomnost klíčových buněk (clue cells). Hodnotí se i přítomné bakterie (koky, tyčinky). Ve fázovém kontrastu lze zachytit pohyblivé mikroorganismy (trichomonády, mobilunci). Velmi důležitou součástí mikroskopického vyšetření nativního preparátu je vyšetření biologického vzorku po přidání 10% KOH (místo fyziologického roztoku). Hydroxid draselný rozpustí prakticky všechny buněčné formy. Neporušené zůstanou pouze kvasinky. Test je důležitý pro diagnostiku vulvovaginální kandidózy.
U žen se symptomatickou vulvovaginální kandidózou lze v nativním preparátu diagnostikovat přítomnost blastospor nebo pseudohyf přibližně ve 30-50 %. Po použití 10% KOH se senzitivita vyšetření zvyšuje, přesto minimálně u třetiny pacientů neprokážeme přítomnost kvasinek při nativním mikroskopickém vyšetření. Vhodné je potvrdit mikroskopickou diagnózu kultivačním vyšetřením. Důležitá je kombinace mikroskopického vyšetření nativního preparátu a stanovení pH poševního sekretu (obr. 3).
3. Rychlý diagnostický postup pro ambulatorní stanovení poševní infekce 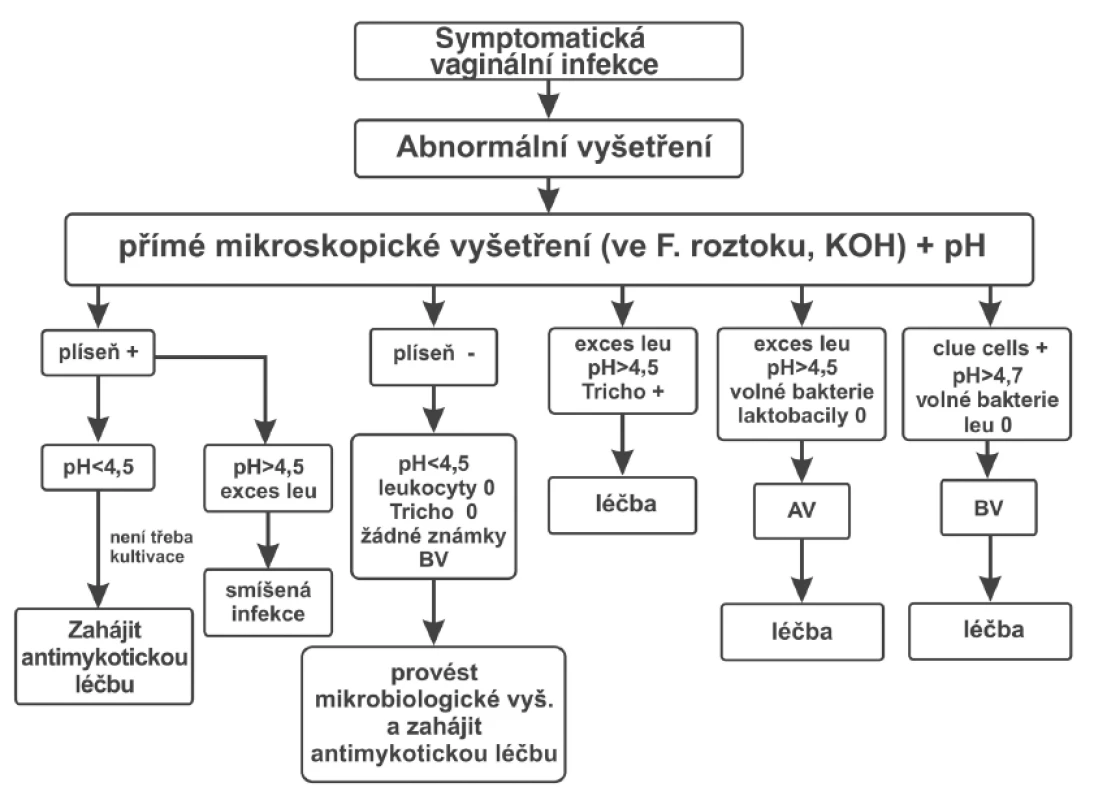
leu – leukocyty; F. – fyziologický; AV – aerobní vaginitis; BV – bakteriální vaginóza; Tricho – Trichomonas vaginalis Pozitivní nález trichomonád v nativním preparátu je dostačující pro diagnostiku trichomoniázy, negativní nález v nativním preparátu však nevylučuje trichomoniázu. Senzitivita vyšetření nativního preparátu pro diagnostiku trichomoniázy se pohybuje mezi 50-75 %. Vhodným barvením pro průkaz trichomonád je barvení podle Giemsy, kdy se senzitivita pohybuje mezi 50-90 % (záleží na zkušenosti).
Při nativní mikroskopii základem pro stanovení diagnózy BV je přítomnost „clue cells“. Dalším vodítkem pro stanovení diagnózy je snížení počtu laktobacilů. Podle některých autorů je nativní mikroskopie citlivější pro stanovení množství laktobacilů než barvené preparáty [4, 6].
Bakteriální vaginózu lze diagnostikovat vyšetřením barveného nátěru z pochvy. V literatuře jsou popisovány dvě metody hodnocení nátěru barveného podle Grama, novější podle Nugenta a kol. a starší metoda popsaná Spiegelem et al. [22]. Hodnocení podle Nugenta [18] je přesnější pro dignostiku BV [20].
Komplexní využití barvených preparátů pro diagnostiku poruch poševního prostředí přesahuje rámec tohoto sdělení. Hodnocení barveného preparátu nadále patří k základním diagnostickým metodám, které považujeme za zlatý standard.
Změny poševní flóry a přítomnost „clue cells“ lze také diagnostikovat při vyšetření cytologického stěru z cervixu. Při hodnocení cytologického nátěru podle návrhu Bethesda systému z roku 2001 se popisuje posun v bakteriálně flóře, který ukazuje na BV [21].
Vyšetření cytologického nátěru z cervixu má relativně vysokou senzitivitu pro záchyt trichomoniázy (kolem 70 %), ale nízkou specificitu. Při pozitivním nálezu v cytologickém nátěru se v populaci s vysokou prevalencí trichomoniázy (nad 20 %) doporučuje pacientku přeléčit bez nutnosti dalších vyšetření. V populaci, kde se prevalence onemocnění pohybuje kolem 10 %, záleží na rozhodnutí klinika, zda bude pacientku léčit, nebo potvrdí diagnózu jinou metodou. V populaci s nízkou prevalencí do 1 % (odpovídá prevalenci v České republice) se při pozitivním nálezu v cytologickém nátěru doporučuje potvrdit diagnózu kultivačně.
Cytologie není diagnostickou metodou pro průkaz mykotické infekce. Cytolog musí při popisu preparátu vyhodnotit i přítomnost houbovitých organismů morfologicky odpovídajících Candida sp., přítomnost bakterií morfologicky odpovídajících Actinomyces sp. Součástí hodnocení je i eventuální přítomnost buněčných změn spojených s herpetickou infekcí.
KULTIVACE
Kultivace je důležitá pro vyšetření přítomnosti kandid, ale pro rutinní diagnózu vulvovaginální kandidózy není nezbytná. U pacientek, které mají typické příznaky, normální pH a pozitivní mikroskopické vyšetření, není nutné kultivaci provádět, s výjimkou případů, kde předpokládáme rezistentní organismy. Přesto kombinace kultivačního a mikroskopického vyšetření je velmi cenná a je to i velmi dobrá kontrola pozitivního mikroskopického nálezu. Nezbytné je kultivační vyšetření u recidivující vulvovaginální kandidózy, kde za prvé musíme potvrdit diagnózu a za druhé vyloučit přítomnost rezistentních kvasinek.
Na druhé straně můžeme kvasinky kultivačně nebo PCR prokázat minimálně až u 20 % zdravých žen ve fertilním období zcela bez známek infekce [10].
Pro klinickou praxi jsou výsledky klasického kultivačního vyšetření často nespolehlivé a velmi těžko se interpretují. Některé mikroorganismy vyžadují speciální prostředí pro svůj růst a v běžné klinické praxi se obtížně detekují. Hlavním důvodem kritiky výsledku klasické kultivace je stanovení role mikroorganismu zachyceného při vzniku infekce.
Velmi častou chybou při léčbě žen s rekurentními nebo přetrvávajícími obtížemi po selhání prvotní léčby je nasazení celkové antibiotické léčby na základě výsledku kultivačního vyšetření – izolovaná bakterie s citlivostí. Ve většině případů tato léčba pacientce nepomůže, naopak může klinické příznaky zhoršit.
Typickým příkladem je kultivační průkaz gardnerel. Gardnerely vyžadují speciální kultivační média. Dříve se předpokládalo, že kultivační průkaz gardnerel znamená jasnou diagnózu bakteriální vaginózy. Současná kultivační média dovolují detekci gardnerel až u 60 % zdravých žen, které bakteriální vaginózu nemají. Kultivační průkaz vysokého počtu gardnerel má také pouze 40% pozitivní prediktivní hodnotu pro diagnózu bakteriální vaginózy. Kultivace na přítomnost gardnerel není vhodná ani pro zjištění výsledku léčby bakteriální vaginózy (i po úspěšné léčbě bakteriální vaginózy můžeme u mnoha žen prokázat přítomnost gardnerel). Kultivační nález mobilunci v poševním sekretu má obdobný význam. Mobilunci jsou v pochvě zdravé ženy přítomny mnohem častěji než se dříve předpokládalo (až ve 40 %). M. curtisii je u zdravých žen vzácnější [17].
Kultivace na speciálních médiích zůstává zlatým standardem pro diagnostiku trichomoniázy (senzitivita 95 %).
Klasická kultivace se uplatňuje i při diagnostice Neisseria gonorrhoeae, zvláště v případech, kdy je nutné stanovit citlivost k antibiotikům.
Některé další grampozitivní bakterie – streptokoky skupiny A (Streptococcus pneumoniae) a koaguláza pozitivní Staphylococcus aureus nejsou součástí běžné poševní flóry. Nález je nutné porovnat s klinickým stavem a posoudit jejich možnou úlohu při vzniku obtíží.
Kultivační screening na přítomnost streptokoků skupiny B (GBS) je důležitý v 35.–37. týdnu gravidity pro prevenci neonatální infekce. Kultivačně můžeme GBS zachytit i mimo graviditu, často jsou přítomny při aerobní vaginitidě. Jejich přítomnost však diagnózu aerobní vaginitidy nepotvrzuje a ani není indikací k léčbě.
Kultivační vyšetření má důležitou roli při recidivujících vulvovaginálních infekcích.
Především speciální kultivace pro průkaz plísní a některých aerobních, anaerobních bakterií. Interpretace výsledků anaerobních kultivací je složitá. V rámci kultivačního vyšetření by bylo vhodné vyšetřovat i kvantitativní stanovení množství přítomných organismů.
NEKULTIVAČNÍ METODY
Testy jsou založeny na průkazu přítomnosti bakteriálních antigenů (DFA, EIA), nukleových kyselin (hybridizační a amplifikační metody). Výše jmenovaná vyšetření jsou velice citlivá.
V běžné praxi, vzhledem k ceně, se pro diagnostiku běžných vulvovaginálních infekcí nepoužívají. Svůj význam mají spíše pro vědecké účely. Nezastupitelnou úlohu hrají při diagnostice virových onemocnění HPV a HSV infekce a pro průkaz cervikálních infekcí – chlamydií a kapavky. V praxi se běžně používají hybridizační techniky, které mají relativně nižší senzitivitu i specificitu. Amplifikační techniky (PCR - polymerázová řetězová reakce) jsou vysoce senzitivní a specifické a jsou citlivější než klasické kultivační metody i než hybridizace. Pro záchyt infekce Ch. trachomatis je tento test optimální [23]. PCR technika se také běžně používá pro záchyt N. gonorrhoeae, Trichomonas vaginalis, Mycoplasma hominis, Ureaplasma urealyticum a kandid.
Jinou možností je stanovení přítomnosti bakteriálních metabolitů v poševním sekretu (stanovení přítomnosti putrescinu, kadaverinu, kyseliny jantarové). Testy se opět používají spíše pro vědecké účely při diagnostice bakteriální vaginózy.
RYCHLÉ DIAGNOSTICKÉ TESTY
Rychlé diagnostické testy jsou velmi vhodnou pomůckou pro lékaře, kteří nemají mikroskop.
K dispozici jsou rychlá vyšetření (na základě DNA proby), které během hodiny prokáží přítomnost candid, trichomonád a gardnerel (AFIRM). K dispozici je i další test, který prokazuje zvýšené pH a přítomnost trimethylaminu (Fem Exam) a pro detekci prolinaminopeptidázy (PipActivity Test Card) [3].
MOLEKULÁRNÍ ANALÝZA
Molekulární analýza poševní bakteriální flóry u zdravých žen a nemocných žen nám podá komplexní informaci o mikrobiálním osídlení [12, 24]. Klasické kultivační techniky nejsou schopné identifikovat plné spektrum bakterií, zachytí jenom ty organismy, které nejlépe rostou na kultivačním médiu.
Na základě těchto technik byla například identifikována nová bakterie – Atopobium vaginae, která je přítomna u žen s bakteriální vaginózou a je rezistentní na metronidazol [8].
TESTOVÁNÍ GENOVÝCH POLYMORFISMŮ
Genový polymorfismus je velmi častý jev. Dosud byly popsány dva genové polymorfismy, která mají vztah k vulvovaginálním obtížím. Prokázána byla asociace mezi homozygotním výskytem alely 2 intronu 1 receptoru pro agonistu IL1-ra a syndromem vulvární vestibulitidy [13]. Rekuretní vulvovagniální kandidóza může být spojena s polymorfismem mannose-binding lectinu (MBL) na kodonu 54 exonu 1 [2].
ZÁVĚR
Pro poskytnutí adekvátní péče ženám s urogenitálními infekcemi je nezbytné, abychom pochopili základní patofyziologii vulvovaginálních obtíží. Základním krokem je správná diagnostika onemocnění. Naše rozhodnutí jsou často ovlivněna klinickými dogmaty, která se opakují v běžných učebnicích gynekologie. Mezi typické příklady patří stanovení diagnózy na základě telefonického rozhovoru, kdy pacientka udává výtok, pálení a dyskomfort. Diagnózu také nelze stanovit na základě vyšetření v zrcadlech. Ve většině případech gynekologové zvažují vulvovaginální kandidózu a bakteriální vaginózu nebo trichomoniázu. Klasické kultivační vyšetření, kromě průkazu kandidové infekce, hraje minimální roli při diagnostice vaginálních infekcí. Velmi častou chybou při léčbě žen s rekurentními nebo přetrvávajícími obtížemi po selhání prvotní léčby je nasazení celkové antibiotické léčby na základě výsledku kultivačního vyšetření – izolovaná bakterie s citlivostí. Ve většině případů tato léčba pacientce nepomůže, naopak může klinické příznaky zhoršit.
Hodnocení barveného preparátu nadále patří k základním diagnostickým metodám, které považujeme za zlatý standard.
Práce byla vypracována s podporou IGA MZ ČR, grant NR/ 9441-3, GIGH -0751 - 00-3-223.
Doc. MUDr. Jaromír Mašata, CSc.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 00 Praha 2
e-mail: masata@volny.cz
Sources
1. Amsel, R., Totten, P., Spiegel, C., et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med 1983, 74, 1, p. 14-22.
2. Babula, O., Lazdane, G., Kroica, J., et al. Relation between recurrent vulvovaginal candidiasis, vaginal concentrations of mannose-binding lectin, and a mannose-binding lectin gene polymorphism in Latvian women. Clin Infect Dis 2003, 37, 5, p. 733-737.
3. CDC. CDC, Sexually transmitted diseases. Treatment guidelines. 2002, 51, RR-6, p. 1-80.
4. Donders, G., Vereecken, A., Salembier, G., et al. Assessment of vaginal lactobacillary flora in wet mount and fresh or delayed Gram’s stain. Infect Dis Obstet Gynecol 1996, 4, 1, p. 2-6.
5. Donders, G., Vereecken, A., Bosmans, E., et al. Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginitis. BJOG 2002, 109, 1, p. 34-43.
6. Donders, GG., Vereecken, A., Dekeersmaecker, A., et al. Wet mount microscopy reflects functional vaginal lactobacillary flora better than Gram stain. J Clin Pathol 2000, 53, 4, p. 308-313.
7. Ferris, D., Dekle, C., Litaker, M. Women’s use of over-the-counter antifungal medications for gynecologic symptoms. J Fam Pract 1996, 42, 6, p. 595-600.
8. Ferris, M., Masztal, A., Aldridge, K., et al. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis. BMC Infect Dis 2004, 4, 5.
9. Friedrich, E. The vulvar vestibule. J Reprod Med 1983, 28, 11, p. 773-777.
10. Giraldo, P., von Nowaskonski, A., Gomes, FA., et al. Vaginal colonization by Candida in asymptomatic women with and without a history of recurrent vulvovaginal candidiasis. Obstet Gynecol 2000, 95, 3, p. 413-416.
11. Horowitz, B., Mardh, P., Nagy, E., et al. Vaginal lactobacillosis. Am J Obstet Gynecol 1994, 170, 3, p. 857-861.
12. Hugenholtz, P., Goebel, BM., Pace, NR. Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity. J Bacteriol 1998, 180, 18, p. 4765-4774.
13. Jeremias, J., Ledger, W., Witkin, S. Interleukin 1 receptor antagonist gene polymorphism in women with vulvar vestibulitis. Am J Obstet Gynecol 2000, 182, 2, p. 283-285.
14. Ledger, W., Polaneczky, M., Yih, M., et al. Difficulties in the diagnosis of Candida vaginitis. Infect Dis Clin Pract 2000, 9, 4, p. 66-69.
15. Ledger, W., Monif, G. A growing concern: inability to diagnose vulvovaginal infections correctly. Obstet Gynecol 2004, 103, 4, p. 782-784.
16. Ledger, W., Witkin, S. Vulvovaginal infections. London: Manson Publishing 2007, p. 128.
17. Mašata, J., Jedličková, A., et. al. Infekce v gynekologii a porodnictví. Praha: Maxdorf 2004, s. 371.
18. Nugent, RP., Krohn, MA., Hillier, SL. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J Clin Microbiol 1991, 29, 2, p. 297-301.
19. Ross, R., Lee, M., Onderdonk, A. Effect of Candida albicans infection and clotrimazole treatment on vaginal microflora in vitro. Obstet Gynecol 1995, 86, 6, p. 925-930.
20. Schwebke, J., Hillier, S., Sobel, J., et al. Validity of the vaginal Gram stain for the diagnosis of bacterial vaginosis. Obstet Gynecol 1996, 88, 4 Pt 1, p. 573-576.
21. Solomon, D., Davey, D., Kurman, R., et al. The 2001 Bethesda System: Terminology for Reporting Results of Cervical Cytology. JAMA 2002, 287, 16, p. 2114-2119.
22. Spiegel, CA., Amsel, R., Holmes, KK. Diagnosis of bacterial vaginosis by direct Gram stain of vaginal fluid. J Clin Microbiol 1983, 18, 1, p. 170-177.
23. Witkin, SS., Jeremias, J., Toth, M., et al. Detection of Chlamydia trachomatis by the polymerase chain reaction in the cervices of women with acute salpingitis. Am J Obstet Gynecol 1993, 168, 5, p. 1438-1442.
24. Zhou, X., Bent, SJ., Schneider, MG., et al. Characterization of vaginal microbial communities in adult healthy women using cultivation-independent methods. Microbiology 2004, 150, 8, p. 2565-2573.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 2-
All articles in this issue
- Aquaporins and the regulation of amniotic fluid circulation
- Peripartum hysterectomy – an audit in Slovakia in 2007
- Monitoring of endothelial activation markers during physiological pregnancy
- New Single-Incision Sling System MiniArc in treatment of the female stress urinary incontinence
- Significance of hysteroscopic resection in diagnostics of endometrial cancer
- Recommendation for hormone replacement therapy in postmenopause
- Current possibilities for diagnosis of vulvovaginal infection
- Correlation between stress urinary incontinence or urgency and anterior compartment defect before and after surgical treatment
- Prolene mesh comparing with sacrospinal fixation in the treatment of genital prolapse in women. Prospective multicentre randomized study
- Changes in the length of implanted mesh after reconstructive surgery of the anterior vaginal wall
- Assessment of routine surveillance of patients after primary treatment for cervical cancer in stage I. and II.: retrospective analysis
- Survey of contraceptive behaviour and attitude of Czech women towards different types of contraception
- Subcutaneous treatment for common variable immunodeficiency in pregnant women
- 20th World Congress on Ultrasound in Obstetrics and Gynecology
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Current possibilities for diagnosis of vulvovaginal infection
- Recommendation for hormone replacement therapy in postmenopause
- Significance of hysteroscopic resection in diagnostics of endometrial cancer
- New Single-Incision Sling System MiniArc in treatment of the female stress urinary incontinence
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

