-
Medical journals
- Career
Proteomika a biomarkery karcinomu endometria
Authors: M. Kacerovský; J. Tošner
Authors‘ workplace: Porodnická a gynekologická klinika FN Hradec Králové, přednosta doc. MUDr. J. Tošner, CSc. ; Lékařská fakulta Hradec Králové, Univerzita Karlova, Praha
Published in: Ceska Gynekol 2009; 74(4): 274-278
Category: Original Article
Overview
Cíl studie:
Popis nových biomarkerů karcinomu endometria s využitím proteomických technik.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Lékařská fakulta Hradec Králové, Univerzita Karlova Praha. Porodnická a gynekologická klinika FN Hradec Králové.Metodika:
Shrnutí literárních údajů o nových biomarkerech karcinomu endometria za využití proteomického přístupu.Závěr:
Práce sumarizuje výsledky klinických a vědeckých prací zaměřených na biomarkery karcinomu endometria.Klíčová slova:
proteomika, karcinom endometria, biomarker.ÚVOD
Karcinom endometria (CAE) patří mezi nejběžnější malignity ženského genitálního traktu. Společné pětileté přežití pro všechna stadia je kolem 80 %. Každoročně je diagnostikováno asi 142 000 nových případů; přibližně 42 000 žen ročně na toto onemocnění zemře. Jeho incidence je velmi závislá na zeměpisné lokalizaci. V Evropě a Severní Americe se vyskytuje 10krát častěji než v rozvojových zemích [24]. Aktuální studie potvrzují, že vznik CAE je charakterizovaný mnohonásobnými patogenetickými kroky s rozmanitými genetickými a epigenetickými interakcemi [12, 30]. Rozsáhlá škála těchto dějů charakterizuje jeho iniciaci, rozvoj i následek, včetně DNA metylace [29], ovlivnění exprese, mutace p53 [26], K-ras [33] a BRAF [23]. Při studiu změn spojených s těmito procesy se využívá globální analýzy genové exprese [12] spolu se screeningem genů zodpovědných za proces karcinogeneze pomocí DNA microarray přístupu [22]. Zdokumentováno a následně využito k diagnostice, predikci prognózy, či klasifikaci CAE již bylo několik nových markerů, např. CD171 [8], PTEN [34] a aktivátor urokináza plazminogenového receptoru [20]. Přestože je prognóza CAE v porovnání s jinými zhoubnými nádory relativně příznivá, stále trvá urgentní potřeba exaktního objasnění molekulárních mechanismů základů vzniku CEA. Ve světle současných poznatků je zřejmé, že společně s intenzivnějším poznáním možných genetických a epigenetických alterací zde existují faktory související s molekulárními změnami translačních a posttranslačních modifikací, ale také intracelulární změny v průběhu nádorové iniciace a růstu. Tyto faktory však nemohou být stanoveny jen množstvím RNA, či studiem variací nukleotidových sekvencí. Asociace mezi proteinovými alteracemi a zhoubností nádoru lze lépe studovat analýzou nádorového proteomu než samotnou genomikou a transkriptomikou [25].
BIOMARKER
Podle definice FDA je biomarker charakteristika, jež je objektivně měřitelná, použitelná jako indikátor normálního biologického procesu, patologického procesu, nebo odpovědi na farmakologickou intervenci. Z biologického hlediska je biomarker molekula (velká část má povahu proteinů), jejíž přítomnost, event. kvantitativní charakteristika je stanovitelná nejčastěji pomocí specifických monoklonálních protilátek automatizovanými systémy ELISA, RIA apod. Ideální biomarker by měl splňovat několik bazálních předpokladů: vysokou specifičnost k danému onemocnění, velkou orgánovou/tkáňovou specifičnost a dostatečnou míru citlivosti. Dalším důležitým faktorem je korelace laboratorního parametru s rozsahem poškození tkáně či orgánu, jeho přijatelná dynamika v čase a stanovení cut off hodnoty. Nelze však v žádném případě opomíjet možnost standardizace jeho stanovení, snadnou interpretaci lékařem i pacientem. V neposlední řadě je také velmi důležité i ekonomické hledisko [14].
PROTEOMICKÉ PŘÍSTUPY K ODHALENÍ NOVÉHO BIOMARKERU
Definovat proteiny, které mají prokazatelný vztah k dané chorobě (kandidátní proteiny).
Porovnat kandidátní proteiny a výběr proteinu splňujícího v co největší míře požadavky na ideální biomarker.
Klinické ověření.
Vytvoření soupravy pro stanovení biomarkeru.
PROTEOMICKÉ TECHNOLOGIE VYUŽÍVANÉ K NALEZENÍ NOVÝCH BIOMARKERŮ
Gelová dvourozměrná elektroforéza
Historicky první a stále převládající efektivní proteomickou technologií je dvojrozměrná polyakrylamidová elektroforéza rozdělující směs proteinů v gelové matrici na základě jejich izoelektrických bodů a molekulových hmotností. Vybrané proteinové skvrny, „spoty“, jsou z gelu vyříznuty, štěpeny proteolyticky a chemicky. Výsledné peptidy jsou analyzovány hmotnostní spektrometrií (MS – Mass Spectrometry) s cílem identifikovat původní protein [14].
Proteinové profilování
MALDI–TOF–MS (matrix assisted laser desorption/ionization–time of flight–mass spectrometry)
Hmotnostní spektrometrie je založena na rozdělení nabitých částí podle jejich molekulových hmotností v elektrickém či magnetickém poli. K ionizaci vzorku se využívá laser. Směs matrice a vzorku na vhodném nosiči (např. nerezové destičce) je zasažena pulsem laseru. Matrice energii pulsu absorbuje a její rozklad ionizuje molekuly vzorku. Ionty analyzované látky jsou urychleny silným elektrickým polem a vstupují do vakua trubice detektoru letu, kde se pohybují rychlostí danou jejich hmotností a nábojem. Zde je měřena doba letu částice, z níž se vypočte poměr molekulové hmotnosti a náboje částice [14].
Li a kol. studoval rozdílnou proteinovou expresi u CAE a normálního endometria. K vyšetření vzorků nejprve využil gelovou dvourozměrnou elektroforézu. U CAE získal průměrně 782±28 proteinových „spotů“. Statisticky významnou rozdílnou proteinovou expresi definoval takto:
- více než 2,5násobný rozdíl v intenzitě,
- nález u nejméně tří vzorků.
V souladu s těmito kritérii nalezl a analyzoval pomocí MALDI-TOF-MS 112 proteinových spotů. Výsledkem bylo 99 rozdílných proteinů. Většina z nich (79 z 99) byla lokalizována v cytoplazmě a podílela se na buněčných funkcích ovlivněných karcinogenezí; včetně metabolismu (20 %), buněčné transformace (14 %), složení proteinů (12 %), buněčné proliferace a apoptózy (8 %), signální transdukce (6 %) a dalších. Dvacet jedna proteinů vyskytujících se více než 4krát bylo vybráno za kandidátní proteiny spojené s karcinogenezí CAE. Mezi ně patří např. thioredoxin, peroxidáza, mutant desmin, cyclophilin A, stathmin 1, glutathion S transferáza P, calcyphosin (CAPS), PEBP-1, epidermal fatty acid binding protein (E-FABP), triose-phosphate izomeráza 1, heat shock protein 27, transferin a jiné (viz tabulku 1) [17].
Table 1. Proteiny nalezené pomocí MALDI-TOF-MS 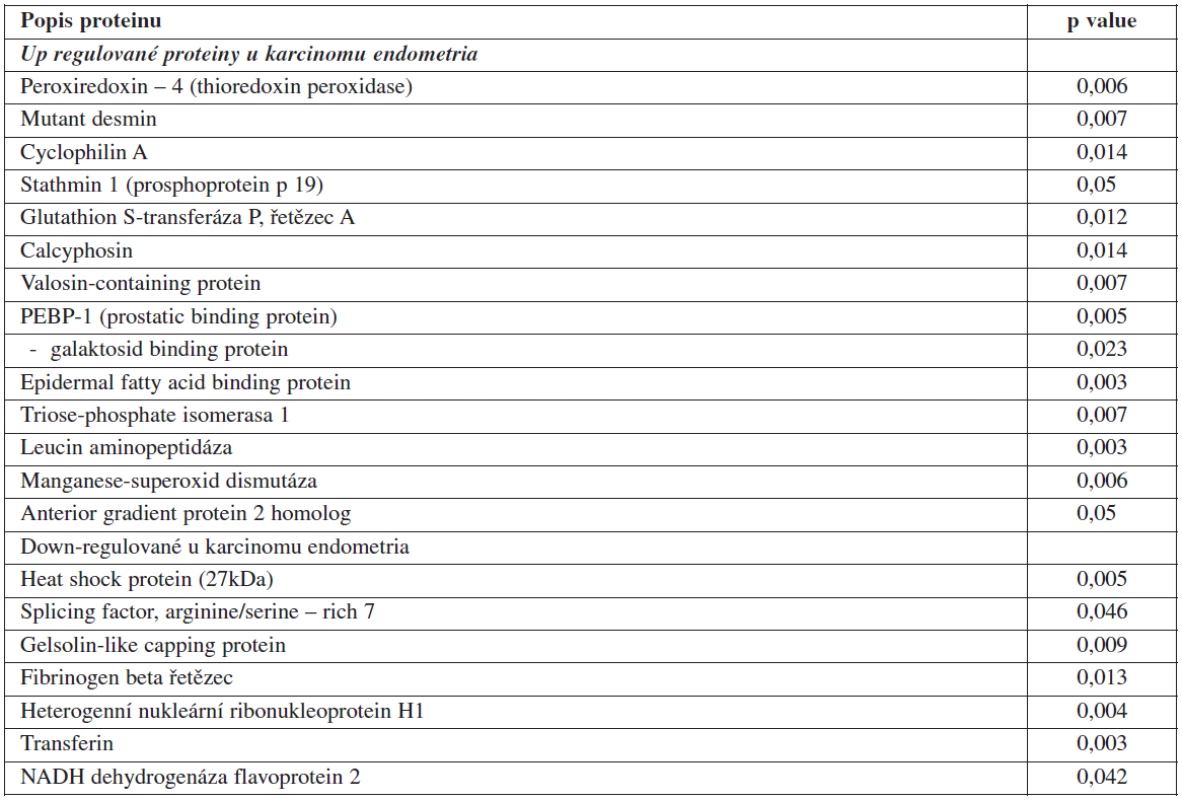
Rozdílně diferencované proteiny CAE identifikované pomocí MALDI-TOF-MS. [13] Nejvýznamnější kandidátní proteiny nalezené pomocí MALDI-TOF-MS:
Epidermal fatty acid binding protein (E-FABP) měl u CAE zvýšenou hladinu 6,6krát. Podílí se zřejmě na buněčné signální činnosti ovlivňující diferenciaci, regulaci růstu a genovou expresi [4].
Calcyphosin (CAPS) byl u CAE zvýšen 3,66krát. Jedná se o kalcium vázající protein, iniciálně identifikovaný jako hlavní fosforylovaný substrát pro cAMP dependentní proteinovou kinázu v souvislosti se stimulací buněk štítné žlázy thyrotropinem [16]. Recentní proteomická práce nalezla overexpresi CAPS u ependymomů ve srovnání s ostatními neuroektodermálními tumory [5]. Ačkoliv jeho přesná funkce zůstává stále zcela neobjasněná, aktivity v cAMP signalizaci, buněčné proliferaci či diferenciaci podporují jeho roli v důležitých aspektech karcinogeneze.
Cyclophilin A je dalším potenciálním prognostickým a terapeutickým biomarkerem. Splňuje následné kritéria:
- je primárně zahrnut do procesu endometriální karcinogeneze;
- vykazuje signifikantní rozdíly mezi normálním endometriem a nádorovou tkání;
- dobře je identifikovatelný hmotnostní spektrometrií;
- jeho všudypřítomná overexprese v karcinomové tkáni.
Ve vzorcích CAE byl více než 27krát up-regulován ve srovnání s normálním endometriem. Lokalizace v cytoplazmě a buněčném jádru potvrzuje, že za jeho zvýšenou expresi jsou zodpovědné nádorové buňky a není způsobena zánětlivou odpovědí v okolím stromatu. Cyclophilin A je členem imunofilinové rodiny, jde o 18 kDa protein s rozsáhlou šíří funkcí. Iniciálně je přítomen intracelulárně, ale v odpovědi na zánětlivou stimulaci byla nalezena jeho sekrece z buněk [10, 13]. Overexprese cyclophilinu A je signifikantně vyšší u špatně diferencovaných typů CAE. Analýzy přežití ukazují, že jeho vyšší hladiny jsou spojeny s kratší dobou přežití. Nastiňují tak možné využití cyclophilinu A jako biomarkeru pro diagnostiku a terapeutickou odpověď. Exprese cyclophilinu A v nádorových buňkách hraje důležitou roli při apoptóze, zejména aktivací kaspáz a participací apoptózu indukujícího faktoru. Howard ve své experimentální práci popsal supresi růstu tumoru a utlumení proliferace nádorových buněk u karcinomu plic inhibicí cyclophilinu A [9]. Jeho overexprese byla popsána u karcinomu plic [2], karcinomu pankreatu [27], hepatocelulárního karcinomu [18], bukálního skvamocelulárního karcinomu [14] i u metastazujících karcinomů močového měchýře a prsu [21].
„Shotgun“ proteomika
S rozvojem tandemové hmotnostní spektrometrie je spojen tzv.„shotgun“ přístup. Tandemovou spektrometrii si lze představit jako dva spektrometry sériově spojené kolizní celou, ve které dochází k fragmentacím. Při shotgun technice je směs proteinů o různé komplexitě štěpena specifickou proteázou. Vzniklé peptidy jsou nejprve separovány a následně analyzovány tandemovým hmotnostním spektrometrem. Dnes se však stále více zaměřují na kvantitativní a komparativní analýzy, u kterých je potřeba určit a porovnat vzájemnou koncentraci proteinů v jednotlivých vzorcích. Dominují zde dva přístupy. Kvantifikace label free (bez značení) a pomocí značení stabilními izotopy. Mezi značícími technikami získávají dnes převahu postupy umožňující analyzovat více vzorků v jednom experimentu. Sem patří např. technika iTRAQ (Isobaric Tag Relative and Absolute Quantification), která umožňuje analýzu až čtyř až osmi vzorků v jednom experimentu [14].
Shotgun přístup například použil ve své práci DeSouza [7]. Srovnával vzorky karcinomu endometria s normálním proliferačním a sekrečním endometriem. Zde s velkou výhodou využil přednosti iTRAQ metody, která umožňuje analyzovat čtyři rozdílné vzorky v jednom experimentu. To optimálně korespondovalo s možností analyzovat současně proliferační, sekreční endometrium i dva rozdílné morfologické a patofyziologické typy CAE. Dobře diferenciovaný, estrogen dependentní typ I, jež má lepší prognózu. Oproti tomu typ II je hormonálně independentní, s agresivnějším chováním a horšími klinickým výsledky. Celkem se podařilo identifikovat 1187 proteinů. Z této kohorty bylo definováno několik potenciálních kandidátních proteinů.
Nejvýznamnější kandidátní proteiny definované pomocí „shotgun“ přístupu:
Pyruvát kináza M1/M2 má zvýšenou hladinu ve vzorcích CEA. Jde o potenciální užitečný marker k diferenciaci obou typů CAE a normálního endometria. Pyruvát kináza (konkrétně typ M2) je primárně přítomna v dimerické formě v nádorech [27]. Izoforma M2 se po iniciální expresi ve fetálním období vyskytuje převážně jen v proliferujících buňkách a nádorech [19]. Pyruvát kináza v kombinaci s CEA, CA 72-4 a CA 19-9 zvyšuje senzitivitu detekce kolorektálního, žaludečního a jícnového karcinomu [32].
Polymerický imunoglobulinový receptor (PIGR) je zvýšeně exprimován u CAE. PIGR je součástí systému imunitní odpovědi a je typicky secernován epiteliálními buňkami. Jeho původní úlohou je transport dimerických IgA protilátek z bazolaterálního povrchu epitelu na apikální povrch, kde dochází k uvolnění exokrinní sekreci epiteliálními buňkami [31]. Zvýšená hladina je především u typu I CAE. Overexprese PIGR může rezultovat v efektivní inhibici angiogeneze a působí preventivně proti invazivitě tumoru. Makrofágy usnadňují progresi tumoru umožněním angiogeneze a zvýšením motility nádorových buněk. Proto inhibice migrace polymorfonukleárů overexpresí PIGR vede k útlumu angiogeneze, inhibici progrese invaze tumoru a brání vzniku metastáz; což jsou typické vlastnosti u nízce agresivního typu I CAE [3].
WAP four disulfide core domain protein 2 (WFDC2) patří k rodině proteinů charakterizovaných jako inhibitory proteináz. Overexprese WFDC2 je přítomna v různých buněčných liniích, včetně ovariální, renální, plicní, střevní a prsní. V sekreční fázi endometria je WFDC2 up-regulován. Jeho zvýšená hladina je velmi časným markerem karcinomu ovaria, dokonce lepším než CA 125. U clear cell tumorů však zvýšená hladina není přítomna. Proto je vhodným markerem pouze pro epiteliální typy karcinomu ovaria. Tento aspekt se odráží i u CAE, kdy je jeho zvýšen jen u typu I CAE a nikoliv typu II [1].
Mucin 5B je také potenciálním markerem CAE. Muciny jsou obecně spjaty s různými karcinomy, kde se účastní promoce invaze nádorových buněk a metastázování. Vyšší hladiny mucinu 5B vykazují karcinomy plic pacientů - kuřáků. Tito pacienti mají častější pooperační relapsy [38].
Clusterin je antiapoptotický glykoprotein podílející se na rezistenci některých buněk k spouštěčům programované buněčné smrti. Zvýšené hladiny clusterinu byly nalezeny u některých maligních nádorů, např. karcinomu močového měchýře, prostaty a jater. Inhibice exprese clusterinu zlepšuje senzitivitu tumoru k chemoterapii. Užívání tamoxifenu zvyšuje hladinu clusterinu, což může vysvětlovat vzestup CAE u postmenopauzálních žen podstoupivších tamoxifenovou terapii pro karcinom prsu [39].
Macrophage capping protein (Cap-G) a leucin aminopeptidáza (LAP3) mají zvýšenou expresi u typu II CAE. Cap-G patří do gelsolinové rodiny proteinů; aktivací Ca2+ jsou zodpovědné za „čepičku“ na konci aktinového vlákna [37]. Tím Cap-G ovlivňuje strukturu aktinových vláken uvnitř buňky. Je zřejmě jedním z proteinů podílejících se na mechanismu metastazování tumoru. To vysvětluje jeho overexpresi; je především u agresivních CAE typu II. O LAP3 toho zatím příliš známo není. Overexprese je specificky spojena nejen s CAE, a také se špatnou prognózou [28].
Chaperonin 10 (CPN10), calgizzarin, transgelin a faktor inhibice migrace (MIF) mají také rozdílné hladiny ve vzorcích CEA a normálního endometria. Byly již popsány v souvislosti i s jinými nádory [6, 36].
ZÁVĚR
Proteomický přístup umožňuje nalezení proteinů s rozdílnou expresí v nádorové a zdravé tkáni. Z této skupiny se rekrutují kandidátní proteiny, které lze označit jako potenciální biomarkery. Všechny nově nalezené biomarkery však potřebují striktní a přesné ověření před jejich eventuálním vstupem do klinické praxe.
MUDr. Marian Kacerovský
Sokolská 581
500 05 Hradec Králové
kacermar@fnhk.cz
Sources
1. Bouchard, D., Morriset, D., Bourbonnais, Y., Tremblay, GM. Comprehensive analysis of HE4 expression in normal and malignit human tussues. Mod Pathol, 2006, 63, p. 847-853.
2. Campa, MJ., Wang, MZ., Howard, B., et al. Protein expression profiling identifies macrophage migration inhibitory factor and cyclophilin A as potential molecular targets in nonsmall cell lung cancer. Cancer Res, 2003, 63, p.1652-1656.
3. Condeelis, J., Pollard, JW. Macrophages: obligate partners for tumor cell migration, invasion and metastasis. Cell, 2006, 124, p. 263-266.
4. Das, R., Hammamieh, R, Neil, R., Melhem, M. Expression pattern of fatty acid binding proteins in human and carcinoma prostate cells and tissues. Clin Cancer Res, 2001, 7, p. 1706-1715.
5. de Bont, JM., den Boer, ML., Kros, JM., et al. Identification of novel biomarkers in pediatric primitive neuroectodermal tumors nad ependymomas by proteome wide analysis. J Neuropathol Exp Neurol, 2007, 66, p. 505-516.
6. DeSouza, L., Diehl, G., Rodriques, MJ., et al. Search for cancer markers from endometrial tissues using differentially labeled tags iTRAQ and cICAT with multidimensional liquid chromatografy and tandem mass spektrometry. J Proteome Res, 2005, 4, p. 377-386.
7. DeSouza, LV., Grigull, J., Ghanny, S., et al. Endometrial carcinoma biomarker discovery and verification using differentially tagged clinical samples with multidimensional liquid chromatografy and tandem mass spectrometry. Molecular&Cellular Proteomics, 2007, 6, p. 1170-1182.
8. Fogel, M., Huszar, M., Altevogt, P., Ben, AA. L1 (CD 171) as a novel biomarker for ovarian and endometrial carcinomas. Expert Rev Mol Diagn, 2004, 4, p. 455 - 462.
9. Howard, BA., Furumain, R., Campa, MJ., et al. Stable RNA interference-mediated suppression of cyclophilin A diminishes non-small-cell lung tumor growth in vivo. Cancer Res, 2005, 65, p. 8853-8860.
10. Huang, CM., Ananthaswamy, HN., Barnes, S., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics, 2006, 6, p. 6107-6116.
11. Chen, J., He, QY., Yuen, AP., Chiu, JF. Proteomics of buccal squamous cell carcinoma: the involvement of multiple pathways in tumorogenesis. Proteomics, 2004, 4, p. 2465-2475.
12. Ioachin, E. Immunohistochemical tumour markers in endometrial carcinoma. Eur J Gynaecol Oncol, 2005, 26, p. 363-371.
13. Jin, ZG., Melaragno, MG., Liao, DF., et al. Cyclophilin A is a secreted growth factor induced by oxidative stress. Circ Res, 87, p. 789-796.
14. Kacerovský, M., Tošner, J., Lenčo, J., Tambor, V. Proteomika a karcinom ovaria. Čes Gynek, 2009, 74, s. 163-170.
15. Konstantakopoulos, N., Montgomery, KG., Chamberlein, N., et al. Changes in gene expressions elicited by physiological concentrations of genistein on human endometrial cancer. Mol Carcinog, 2006, 45, p. 752-763.
16. Lecocq, R., Lamy, R., Erneux, C., Dumont, JE. Rapid purification and identification of calcyphosine, a CA2+ - binding protein phoshorylated by protein kinase A. Biochem J, 1995, 306, p. 147-151.
17. Li, Z., Zhao, X., Bai, S., et al. Proteomics identification of cyclophilin A as a potential prognostic factor and therapeutic target in endometrial carcinoma. Molecular & Cellular Proteomics, 2008, 7, p. 1810-1823.
18. Lim, SO., Park, SJ., Kim, W., et al. Proteome analysis of hepatocellular carcinoma. Biochem Biophys Res Commun, 2002, 291, p. 1031-1037.
19. Mazurek, S., Boschek, CB., Hugo, F., Eigenbrodt, E. Pyruvate kinase type M2 and its role in tumor growth and spreading. Semin Cancer Biol, 2005, 15, p. 300-308.
20. Mermarzadeh, S., Kozak, KR., Chang, L., et al. Urokinase plasminogen activator receptor: prognostic biomarker for endometrial cancer. Proc Natl Acad Sci USA 2002, 99, p. 10647-10652.
21. Meza-Zepeda, LA. Forus, A., Lygren, B., et al. Positional cloning identifies a novel cyclophylin as a candindate amplified oncogene in 1q21. Oncogene, 2002, 21, p. 2261-2269.
22. Okada, H., Nakajima, T, Yoshimura, T., et al. Microarray analysis of genes controled by progesterone in human endometrial stromal cells in vitro. Gynecol Endocrinol, 2003, 17, p. 271-280.
23. Pappa, KI, Choleza, M, Markari, S., et al. Consistent absence of BRAF mutations in cervical and endometrial cancer despite KRAS station status. Gynecol Oncol, 2006, 100, p. 596-600.
24. Parkin, DM., Pisani, P, Ferlay, J. Global cancer statistics. CA Cancer J Clin, 1999, 49, p. 33-64.
25. Petricoin, EF., Zoon, KC. Kohn, EC. Barrett, JC. Clinical proteomics: translating benchside promise into bedside reality. Nat Rev Drug Discover, 2002, 1, p. 683-695.
26. Ragni, N., Ferrero, S., Prefumo, F., et al. The association between p53 expression, stage and histological features in endometrial cancer. Eur J Obstet Gynecol Reprod Bio, 2005, 123, p. 111-116.
27. Shen, J., Person, MD., Zhu, J., et al. Protein expression profiles in panceratic adenocarcinoma compared with normal panceratic tissue and tissue affected by pancreatitis as detected by two-dimensional gel electrophoresis and mass spectrometry. Cancer Res, 2004, 64, p. 9018-9026.
28. Shibata, K., Kikkawa, F., Kondo, C., et al. Placental leucine aminopeptidase expression is associated with chemosenzitivity in human endometrial carcinona. Gynecol Oncol, 2004, 95, p. 307-313.
29. Shih, MC., Yek, KT., Tang, KP., Chen, JC. Promoter methylation in circadian genes of endometrial cancers detected by methylation-specific PCR. Mol Carcinog, 2006, 45, p. 732-740.
30. Shiozawa, T., Konishi, I. Early endometrial carcinoma: clinicopathology, hormonal aspects, molecular genetics, diagnosis and treatment. Int J Clin Oncol, 2006, 11, p. 13-21.
31. Schjerven, H., Brandtzaeg, P., Johansen, FE. Mechanism of IL-4 mediated up-regulation of the polymeric Ig receptor: role of STAT6 in cell type specific delayed transcriptional response. J Immunol, 2000, 165, p. 3898-3906.
32. Schneider, J., Bitterlich, N., Schultze, G. Improved senzitivity in the diagnostic of gastrointestinal tumors by fuzzy logic-based tumor marker profiles including the tumor M2-PK. Anticancer res. 2005, 25, p. 1507-1515.
33. Tu, Z., Gui, L., Wang, J., et al. Tumorigenesis of K-ras station in human endometrial carcinoma via upregulation of estrogen receptor. Gynecol Oncol, 2006, 101, p. 274-279.
34. Uegaki, I., Kanamori, Y., Kigawa, J., et al. PTEN positive and phosphorylated – Akt - negative expression is a predictor of survival for patients with advanced endometrial cancer. Oncol Rep, 2005, 14, p. 389-392.
35. Ugurel, S., Bell, N., Sucker, A., et al. Tumor type M2 pyruvate kinase (TUM2-PK) as a novel plasma tumor marker in melanoma. Int J Cancer, 2005, 117, p. 825-830.
36. Yang, EC., Guo, J., Diehl, G., et al. Protein expression profilig of endometrial malignancies revers a new tumor marker:chaperonin 10. J Proteome Res. 2004, 3, p. 636-643.
37. Young, CL., Feierstein, A., Southwick, FS. Calcium regulation of actin filament capping and monomer binding by macrophage capping protein. J Biol Chem, 1994, 269, p. 11997-14002.
38. Yu, CJ., Yang, PC., Shun, CT., et al. Overexpression of MUC5 genes is associated with early postoperative metastasis in non-small cell lung cancer. Int J Cancer, 1996, 69, p. 457-465.
39. Zierau, O., O’Sullivan, J., Morrisey, C., et al. Tamoxifen exerts agonistic effects on clusterin and complement C3 gene expression in RUCA-I primary xenografts and metastases but normal uterus. Endocr Relat Cancer, 2004, 11, p. 823-830.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 4-
All articles in this issue
- Mediolaterální epiziotomie a poranění análního sfinkteru
- Chemoterapie během těhotenství
- Preeklampsie – některé možnosti predikce
- Ischemizující metody léčby děložních myomů
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
- Proteomika a biomarkery karcinomu endometria
- Markery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Prognostické faktory u mezenchymálních a smíšených nádorů děložního těla
-
Operování přirozenými tělními otvory
Hybridní transvaginální cholecystektomie - Placenta adherens partim accreta – ojedinělé možnosti terapie
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Placenta adherens partim accreta – ojedinělé možnosti terapie
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

