-
Medical journals
- Career
Diabetes mellitus 2. typu a kvalita kosti
Authors: MUDr. Raška Ivan, Ph.D.
Authors‘ workplace: III. interní klinika 1. LF UK a VFN v Praze
Published in: Clinical Osteology 2018; 23(3): 120-125
Category:
Diabetes mellitus 2. typu (DM2T) patří k častým onemocněním zejména u osob s nadváhou a obezitou. Diabetická neuropatie, retinopatie či nefropatie jsou dobře známé komplikace diabetu. V poslední době se dostávají do širšího povědomí také komplikace diabetu spojené s poruchou kostního metabolizmu. Bylo prokázáno, že pacienti s DM2T mají zvýšené riziko nízkozátěžových zlomenin včetně zlomenin kyčle.
Overview
Diabetes mellitus 2. typu (DM2T) patří k častým onemocněním zejména u osob s nadváhou a obezitou. Diabetická neuropatie, retinopatie či nefropatie jsou dobře známé komplikace diabetu. V poslední době se dostávají do širšího povědomí také komplikace diabetu spojené s poruchou kostního metabolizmu. Bylo prokázáno, že pacienti s DM2T mají zvýšené riziko nízkozátěžových zlomenin včetně zlomenin kyčle. Navzdory zvýšenému riziku zlomeniny mají pacienti s DM2T normální, nebo dokonce zvýšenou kostní denzitu. V patogenezi zvýšené kostní fragility (diabetické osteopatie) se uplatňuje zejména porucha kvality kosti, kterou doposud neumíme neinvazivně hodnotit. Předmětem studia jsou další biochemické a zobrazovací parametry, které umožní včas rozpoznat pacienty s DM2T se zvýšeným rizikem zlomeniny. Pacienty s DM2T se zvýšeným rizikem zlomeniny je zapotřebí aktivně vyhledávat a zahájit u nich adekvátní preventivní či léčebná opatření. Článek podává stručný přehled o aktuálních poznatcích a odlišnostech kostního metabolizmu u pacientů s DM2T.
Klíčová slova:
AGEs – osteoporóza – sklerostin – zlomeniny
Úvod
Diabetes mellitus 2. typu (DM2T) zvyšuje riziko zlomenin. Vestergaard et al poukázali na zvýšené riziko nízkozátěžových zlomenin včetně zlomeniny kyčle u pacientů s DM2T [1]. Podle recentní metaanalýzy DM zvyšuje riziko všech zlomenin včetně zlomeniny kyčle, kotníků a pažní kosti [2]. Na zvýšeném riziku zlomeniny se u pacientů s DM2T podílí především porucha kvality kosti, která závisí na mnoha faktorech počínaje geometrií kosti až po kostní mikroarchitekturu, složení organické matrix, aktivity kostních buněk a dalších faktorů. Navzdory zvýšenému riziku zlomeniny mají pacienti s DM2T normální, nebo dokonce zvýšenou kostní denzitu [3]. Riziko zlomeniny je proto u diabetiků 2. typu často podceňováno. Dvouenergiová rentgenová absorbciometrie (DXA) hodnotí obsah kostního minerálu v kosti, ale nikoli její kvalitu. Kostní mikroarchitekturu lze hodnotit pomocí dalších zobrazovacích metod, jako je CT (HR-periferní CT, micro-CT), HR-MRI a dalších. V klinické praxi se však u diabetiků jeví jako perspektivní hodnocení tzv. trabekulárního kostního skóre (Trabecular bone score – TBS). Velká retrospektivní studie zahrnující více než 29 000 postmenopauzálních žen prokázala, že TBS představuje u subpopulace pacientek s DM2T nezávislý prediktor zlomenin [4]. Hodnocení TBS by tak mohlo zlepšit management pacientů s DM2T. Při podezření na přítomnost vertebrální zlomeniny lze pomocí kostní denzitometrie bez větší radiační zátěže zhodnotit také morfologii obratlů, eventuálně stupeň vertebrální zlomeniny využitím softwaru pro VFA (Vertebral Fracture Assessment).
Rizikové faktory zlomenin u pacientů s DM2T
Rizikové faktory zlomenin u pacientů s DM2T mají komplexní charakter. Lze je rozdělit do 2 základních skupin – rizikové faktory pro diabetickou osteopatii a rizikové faktory pádu. Některé rizikové faktory jsou pro obě skupiny společné, mnohdy se navzájem ovlivňují a potencují. Rizikové faktory zlomenin u pacientů s DM2T jsou přehledně uvedeny v tab. 1.
Table 1. Rizikové faktory zlomenin u pacientů s DM2T 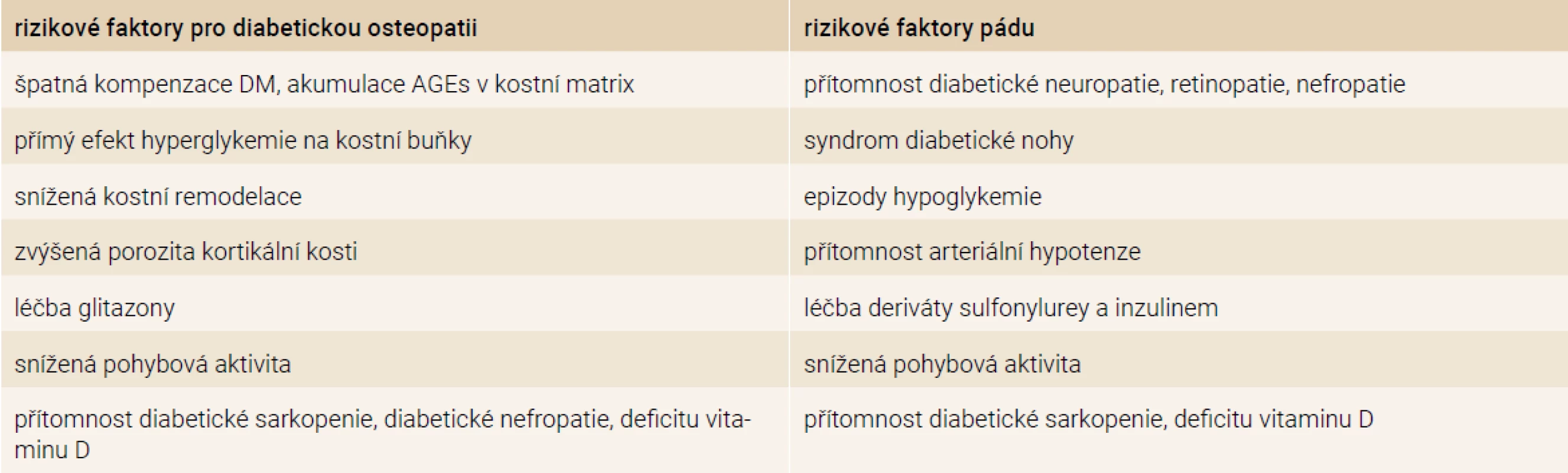
AGEs – produkty pozdní glykace/Advanced Glycation Endproducts Diabetická osteopatie – patogeneze a rizikové faktory
S horšící se kompenzací DM roste akumulace pokročilých produktů glykace (Advanced Glycation Endproducts – AGEs), které narušují kvalitu kosti tím, že vytvářejí příčné vazby mezi kolagenními vláky [5], negativně ovlivňují maturaci a funkci osteoblastů [6], a tím ovlivňují také kostní remodelaci [7]. Jedním z markerů AGEs je pentosidin, jehož zvýšené koncentrace v moči jsou u pacientů s DM2T spojovány se zvýšeným rizikem zlomeniny [8]. Bylo zjištěno, že solubilní receptor pro pokročilé produkty glykace (soluble Receptor for Advanced Gylcation Endproducts – sRAGE) potlačuje účinky AGEs. Nízké sérové koncentrace sRAGE asociovaly se zvýšeným rizikem vertebrálních zlomenin u pacientů s DM2T [9].
Také samotná hyperglykemie přímo ovlivňuje kostní buňky. Bylo zjištěno, že hyperglykemie inhibuje osteoklastogenezi [10]. In vitro studie prokázaly, že hyperglykemie vede také k inhibici diferenciace mezenchymálních buněk v osteoblasty [11]. Diskutuje se, že celkový efekt hyperglykemie na osteoblasty a osteoklasty vede k hypermineralizaci kostní matrix a porušení kostní resorpce již mineralizované kosti, která může způsobovat zvýšenou kostní denzitu u diabetiků 2. typu [12].
Dle rozsáhlé metaanalýzy je u pacientů s DM2T pozorována snížená kostní remodelace, která by mohla být zodpovědná za vyšší lomivost kosti [13]. Laboratorně můžeme prokázat snížení biochemických markerů kostní remodelace (např. PINP, osteokalcinu a βCTX). Jeden z faktorů, který ovlivňuje kostní remodelaci, je pohybová aktivita, která je u pacientů s DM2T často snížená. Pravidelná fyzická aktivita je nezbytná nejen k dosažení optimální kompenzace diabetu, ale rovněž pro zajištění rovnováhy v kostní remodelaci a udržení optimální svalové síly a hmoty. Kostní remodelace se přizpůsobuje zatížení skeletu, odstraňuje starou nebo poškozenou kost a nahrazuje ji kostí novou. Hraje tedy velmi důležitou roli v udržení správné kvality kosti. Klíčovou roli v aktivaci kostní remodelace v reakci na pohybovou aktivitu mají osteocyty – mechanosenzory, které citlivě reagují na aktuální zatížení skeletu. Odpověď kosti na mechanickou zátěž je zprostředkovaná Wnt/beta cathenin signální dráhou, která v konečném důsledku vede k aktivaci kostní formace. Sklerostin je produkt osteocytů, který antagonizuje Wnt/beta cathenin signální dráhou a potlačuje kostní novotvorbu [14]. U postmenopauzálních žen s DM2T byly popsány vyšší sérové koncentrace sklerostinu oproti ženám bez DM [15]. Vliv pravidelné pohybové aktivity na koncentraci sklerostinu u pacientek s DM2T jsme potvrdili i vlastní prací. Postmenopauzální ženy s DM2T s menší pohybovou aktivitou (méně než 2 hodiny chůze denně) měly vyšší sérové koncentrace sklerostinu než pacienti s vyšší pohybovou aktivitou [16].
Osteocyty produkují kromě sklerostinu také protein z rodiny fibroblastových růstových faktorů – FGF23 (Fibroblast Growth Factor 23), který se významně podílí na metabolizmu fosfátů a vitaminu D. FGF23 ovlivňuje plazmatické koncentrace fosfátů. V proximálním tubulu ledviny snižuje zpětnou absorpci a zvyšuje vylučování fosfátů. Právě molekula FGF23 se stává v poslední době cílem výzkumu i u pacientů s DM, neboť se odkrývají některé souvislosti s inzulinovou rezistencí a asociací s některými adipokiny, jako je rezistin [17].
Dalším z faktorů, který ovlivňuje vznik diabetické osteopatie, je zvýšená porozita kortikální kosti [18]. Současné poznatky o kortikální porozitě a mikroarchitektuře kosti hodnocené pomocí HRpCT jsou nejednoznačné a je třeba dalších studií, které by nás utvrdily v jejich využití k identifikaci rizika zlomeniny u diabetiků 2. typu. [19,20].
Rizikové faktory pádů u pacientů s DM2T
Již samotná přítomnost diabetické retinopatie, neuropatie, syndromu diabetické nohy, ale také epizod hypoglykemie a hypotenze zvyšují náchylnost k pádům, a tím i k riziku zlomenin.
Velmi důležitou roli v patogenezi zvýšeného rizika zlomeniny u pacientů s DM2T hraje snížená pohybová aktivita, která ovlivňuje nejen kvalitu kosti, ale také tělesné složení a rozložení tukové, svalové a kostní hmoty v těle. Některé studie prokázaly větší úbytek svalové hmoty a svalové síly u starších pacientů s DM2T oproti zdravým kontrolám [21]. Podle některých autorů tvoří diabetická sarkopenie další chronickou komplikaci diabetu [22]. Také v patogenezi diabetické sarkopenie se uplatňuje akumulace AGEs [23]. V naší skupině pacientek s DM2T jsme prokázali signifikantně nižší procentuální zastoupení svalové hmoty v oblasti dolních končetin u diabetiček 2. typu oproti zdravým kontrolám. Zajímavým výsledkem bylo zjištění, že pacientky s DM2T a s anamnézou zlomeniny měly signifikantně nižší procentuální zastoupení svalové hmoty v oblasti dolních končetin oproti diabetičkám bez anamnézy zlomeniny [24]. Je zapotřebí další výzkum k ověření vztahu svalové hmoty, zejména v oblasti dolních končetin, a redukce rizika zlomeniny v závislosti na stupni pohybové aktivity.
Neméně důležitou roli v patogenezi rizika pádů a zlomenin u pacientů s DM2T hrají nutriční faktory, zejména nedostatek vitaminu D. Nevhodné stravovací návyky, nedostatek slunečního záření, obezita, renální insuficience a také genetická predispozice tvoří rizikové faktory nedostatku vitaminu D [25]. Podle některých studií se prevalence deficitu nebo insuficience vitaminu D pohybuje u pacientů s DM2T v rozmezí v 70–90 % [26–28]. Udávaná prevalence deficitu vitaminu D závisí na stanoveném rozdílném referenčním rozmezí deficitu či insuficienci vitaminu D. V naší skupině pacientek s DM2T byl nedostatek vitaminu D (definovaný jako sérová koncentrace 25-hydroxyvitaminu D pod 30 ng/ml) zjištěn až u 89 % diabetiček nesuplementovaných vitaminem D. Vysokou prevalenci nedostatku vitaminů D (45 %) jsme prokázali rovněž u diabetiček 2. typu suplementovaných nízkou dávkou vitaminu D (500 až 1 000 IU vitaminu D3 denně) [29]. Tato data svědčí pro nutnost suplementace vitaminu D v adekvátní dávce. Z hlediska udržení kvality kosti a také svalové síly je zapotřebí dbát na adekvátní přísun kvalitních bílkovin v potravě zejména u starší populace diabetiků [30]. Některé práce poukazují rovněž na důležitost střevního mikrobiomu jak v prevenci, tak v léčbě DM2T [31].
Vliv léčby diabetes mellitus na kost
Intenzivně se zkoumá efekt antidiabetické léčby na kost a riziko zlomeniny. Lékem první volby v léčbě DM2T je metformin. Metformin má dle většiny studií příznivý vliv na kost a je asociován se sníženým, nebo neutrálním efektem na riziko zlomeniny u pacientů s DM2T [32,33]. Studie zabývající se vlivem léčby deriváty sulfonylurey na kost prokazují jak neutrální [34], tak zvýšené [35] i snížené riziko zlomeniny [32]. Z klinické praxe je známo, že deriváty sulfonylurey zvyšují riziko epizod hypoglykemie a s tím související zvýšenou incidenci pádů a zlomenin, zejména u starších pacientů. Nejznámější negativní vliv na kost mají z antidiabetik glitazony. Bylo zjištěno, že léčba glitazony vede ke snížení kostní denzity a zvýšení rizika zlomeniny. Jejich působení přes PPARγ receptory negativně ovlivňuje diferenciaci mezenchymálních kmenových buněk na osteoblasty, a naopak podporuje jejich diferenciaci na adipocyty [36]. Tato léčba by měla být indikována pouze u těch pacientů, u kterých není riziko zlomenin vysoké.
K relativně novějším možnostem léčby diabetu patří léčba inkretiny. Léčba inhibitory dipeptidylpeptidázy 4 (DPP4) je spojována s ambivalentním efektem na riziko zlomeniny, zejména na podkladě krátkodobých studií. K ověření efektu inhibitorů DPP4 na kost jsou zapotřebí další, zejména dlouhodobé studie. Z dosavadních výsledků studií zabývajících se efektem další antidiabetické léčby ze skupiny inkretinů – agonisty glukagonových receptorů GLP1RA (Glucagon-Like Peptide 1 Receptor Agonists) plyne neutrální efekt na riziko zlomeniny. I v této oblasti je zapotřebí další výzkum. Nicméně volba této skupiny antidiabetik se z hlediska rizika zlomeniny jeví jako bezpečná [12].
Z modernější léčby diabetu je věnována pozornost gliflozinům – inhibitorům SGLT2 (Sodium-Glucose Linked Transporter). Glifloziny zvyšují glykosurii, a proto byly vysloveny obavy ze zvýšené kalciurie s doprovodným zvýšeným rizikem zlomeniny. Analýza studie s kanagliflozinem přinesla nepříznivé výsledky pro populaci starších diabetiků se zvýšeným kardiovaskulárním rizikem ve smyslu zhoršení kostní denzity v oblasti celkového proximálního femoru a vyššího výskytu zlomenin v oblasti předloktí [37]. Studie s empaglifozinem a dapagliflozinem však zvýšené riziko zlomeniny neprokázala [38–40]. Jsou zapotřebí další studie, které by jednoznačně určily vliv léčby glifloziny na riziko zlomeniny. Efekt antidiabetické léčby na kost je sumarizován v tab. 2.
Table 2. Efekt antidiabetické léčby na riziko zlomeniny. Upraveno podle [12] ![Efekt antidiabetické léčby na riziko
zlomeniny. Upraveno podle [12]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1f4f45f142c1e9bc7cb809dec1e163f5.png)
↑- zvýšené riziko zlomeniny ↓- snížené riziko zlomeniny → – neutrální efekt na riziko zlomeniny
DPP4 – dipeptidylpeptidáza 4 – GLP1RA – agonisté receptoru glukagon- like peptide 1/ Glucagon-Like Peptide 1 Receptor Agonists – SGLT2 – Sodium-Glucose Linked TransporterVýpočet rizika zlomeniny FRAX u pacientů s DM2T
K hodnocení 10letého rizika zlomeniny se používá nástroj FRAX, který využívá validované faktory rizika zlomenin, jako je věk, BMI, pohlaví, předchozí anamnéza nízkotraumatické zlomeniny, anamnéza zlomeniny v oblasti kyčle u rodičů, kouření v současnosti, léčba glukokortikoidy, onemocnění revmatoidní artritidou, příjem alkoholu 3 a více jednotek za den, či přítomnost sekundární osteoporózy. Bylo zjištěno, že u pacientů s DM2T je výpočet FRAX podhodnocen [41]. FRAX ve svém výpočtu nezahrnuje riziko pádů, které hraje v patogenezi zvýšeného rizika zlomeniny u pacientů s DM2T významnou roli. Při zohlednění kostní denzity ve výpočtu FRAX je výsledek nadhodnocen také zvýšenou hodnotou kostní denzity, která u populace diabetiků 2. typu nevypovídá o zhoršené kvalitě kosti. Vzhledem k těmto omezením se předpokládá úprava FRAX a zařazení DM2T do dotazníku jako jednoho z dalších rizikových faktorů.
Prevence a léčba zlomenin u diabetiků
Klinická praxe potvrzuje známý fakt, že základem prevence všech typů diabetických komplikací je dobrá kompenzace diabetu. Vhodná životospráva, dietní opatření a pravidelný pohyb tvoří základní pilíře prevence a léčby diabetu. Ke snížení rizika pádů je zapotřebí zejména kompenzace krevního tlaku, korekce vízu, léčba diabetické neuropatie a prevence epizod hypoglykemie. Je nezbytný dostatečný přísun kalcia a vitaminu D stejně jako adekvátní přísun kvalitních bílkovin. Důležité je také posouzení vlivu specifické farmakoterapie diabetu na kost, zvážení jejich rizik a přínosů (tab. 2).
U pacientů se zvýšeným rizikem zlomeniny je indikována farmakoterapie cílená na kost. V krátkodobých studiích byla antiresorpční terapie stejně účinná u diabetiků jako u pacientů bez diabetu [42,43]. Jelikož je u pacientů s DM2T dokumentován nízký kostní obrat, je účinnost a pravděpodobně také bezpečnost dlouhodobé antiresorpční léčby limitována. U pacientů s DM bude proto jistě vhodné užití osteoanabolické léčby teriparatidem [44]. Algoritmus pro zahájení léčby osteoporózy u pacientů s DM2T byl nedávno navržen pracovní skupinou International Osteoporosis Foundation (IOF) pro diabetes, který ukazuje schéma [45]. Jedná se o algoritmus vytvořený mezinárodní pracovní skupinou IOF, který bude potřeba modifikovat dle aktuálních možností dané země. V ČR je aktuálně léčba osteoporózy hrazena z veřejného zdravotního pojištění pouze u osob s denzitometricky prokázanou osteoporózou nebo při anamnéze prodělané nízkozátěžové zlomeniny. Indikaci k léčbě u rizikových skupin, jako je DM, je však vhodné denzitometrická kritéria posunout do hodnot osteopenie.
Schéma. Algoritmus pro zahájení léčby osteoporózy u pacientů s DM2T. Upraveno podle [45] ![Schéma. Algoritmus pro zahájení léčby osteoporózy u pacientů s DM2T. Upraveno podle [45]](https://pl-master.mdcdn.cz/media/image/e95dc8af9c6a0e95e8669c8d8c16b711.png?version=1558005478)
Poznámky: Specifické rizikové faktory zlomeniny pro DM jsou dle pracovní skupiny IOF pro diabetes [45] určeny jako:
■ trvání diabetu > 5 let;
■ antidiabetická léčba inzulinem, tiazolidindiony a pravděpodobně glifloziny
■ glykovaný hemoglobin > 7 %
■ přítomnost mikrovaskulárních komplikací: periferní a autonomní neuropatie, retinopatie, nefropatie
V ČR aktuálně není léčba osteoporózy hrazena při denzitometrickém nálezu osteopenie, nebo pouze na základě výpočtu nástrojem FRAX.Závěr
Pacienti s DM2T mají zvýšené riziko zlomeniny. Měření denzity kostního minerálu dostatečně nevypovídá o riziku zlomeniny u pacientů s DM2T vzhledem k tomu, že v patogenezi zvýšeného rizika zlomeniny se u diabetiků uplatňuje zejména porucha kvality kosti. Ze zobrazovacích metod je možné využití analýzy TBS a předpokládá se i zařazení DM jako rizikového faktoru do FRAX. V širším kontextu je potřeba se zaměřit na kompenzaci diabetu, léčbu diabetu, trvání diabetu, přítomnost deficitu vitaminu D, stupeň kostní remodelace, anamnézu zlomenin, přítomnost pádů či stupeň fyzické aktivity. Pacienty s DM2T se zvýšeným rizikem zlomeniny je zapotřebí aktivně vyhledávat a zahájit u nich adekvátní preventivní či léčebná opatření.
Práce byla podpořena MZ ČR – RVO VFN64165.
Received | Doručeno do redakce | Doručené do redakcie 4. 10. 2018
Accepted | Přijato po recenzi | Prijaté po recenzii 2. 11. 2018
MUDr. Ivan Raška, PhD.
Sources
- Vestergaard P, Rejnmark L, MosekildeL. Diabetes and its complications and their relationship with risk of fractures in type 1 and 2 diabetes. Calcif Tissue Int 2009; 84(1): 45–55. Dostupné z DOI: <http://doi: 10.1007/s00223–008–9195–5>.
- Wang H, Ba Y, Xing Q et al. Diabetes mellitus and the risk of fractures at specific sites: a meta-analysis. BMJ Open 2019; 9(1): e024067. Dostupné z DOI: <http://doi: 10.1136/bmjopen-2018–024067>.
- Vestergaard P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes – a meta-analysis. Osteoporos Int 2007; 18(4):427–444. Dostupné z DOI: <http://doi: 10.1007/s00198–006–0253–4>.
- Leslie WD, Aubry-Rozier B, Lamy O et al. Manitoba Bone Density Program. TBS (trabecular bone score) and diabetes-related fracture risk. J Clin Endocrinol Metab 2013; 98(2): 602–609. Dostupné z DOI: <http://doi: 10.1210/jc.2012–3118>.
- Garnero P. The contribution of collagen crosslinks to bone strength. Bonekey Rep 2012; 1 : 182. Dostupné z DOI: <http://doi: 10.1038/bonekey.2012.182>.
- Kume S, Kato S, Yamagishi S et al. Advanced glycation end-products attenuate human mesenchymal stem cells and prevent cognate differentiation into adipose tissue, cartilage, and bone. J Bone Miner Res 2005; 20(9): 1647–1658. Dostupné z DOI: <http://doi: 10.1359/JBMR.050514>.
- Yamagishi S. Role of advanced glycation end products (AGEs) in osteoporosis in diabetes. Curr Drug Targets 2011; 12(14): 2096–2102.
- Schwartz AV, Garnero P, Hillier TA et al. Pentosidine and increased fracture risk in older adults with type 2 diabetes. J Clin Endocrinol Metab 2009; 94(7): 2380–2386. Dostupné z DOI: <http://doi: 10.1210/jc.2008–2498>.
- Yamamoto M, Yamaguchi T, Yamauchi M et al. Low serum level of the endogenous secretory receptor for advanced glycation end products (esRAGE) is a risk factor for prevalent vertebral fractures independent of bone mineral density in patients with type 2 diabetes. Diabetes Care 2009; 32(12):2263–2268. Dostupné z DOI: <http://doi: 10.2337/dc09–0901>.
- Xu J, Yue F, Wang J et al. High glucose inhibits receptor activator of nuclear factorκB ligand-induced osteoclast differentiation via downregulation of vATPase V0 subunit d2 and dendritic cellspecific transmembrane protein. Mol Med Rep 2015; 11(2): 865–870. Dostupné z DOI: <http://doi: 10.3892/mmr.2014.2807>.
- Deng X, Xu M, Shen M et al. Effects of Type 2 Diabetic Serum on Proliferation and Osteogenic Differentiation of Mesenchymal Stem Cells. J Diabetes Res 2018; 2018 : 5765478. Dostupné z DOI: <http://doi: 10.1155/2018/5765478>.
- Starup-Linde J, Hygum K, Langdahl BL. Skeletal Fragility in Type 2 Diabetes Mellitus. Endocrinol Metab (Seoul) 2018; 33(3): 339–351. Dostupné z DOI: <http://doi: 10.3803/EnM.2018.33.3.339>.
- Hygum K, Starup-Linde J, Harsløf T et al. Mechanisms in endocrinology: Diabetes mellitus, a state of low bone turnover – a systematic review and meta-analysis. Eur J Endocrinol 2017; 176(3):R137-R157. Dostupné z DOI: <http://doi: 10.1530/EJE-16–0652>.
- Lin C, Jiang X, Dai Z et al. Sclerostin mediates bone response to mechanical unloading through antagonizing Wnt/beta-catenin signaling. J Bone Miner Res 2009; 24(10):1651–1661. Dostupné z DOI: <http://doi: 10.1359/jbmr.090411>.
- Zhou YJ, Li A, Song YL et al. Role of sclerostin in the bone loss of postmenopausal chinese women with type 2 diabetes. Chin Med Sci J 2013; 28(3): 135–139.
- Raška I, jr, Rašková M, Zikán V et al. Prevalence and Risk Factors of Osteoporosis in Postmenopausal Women with Type 2 Diabetes Mellitus. Cent Eur J Public Health 2017; 25(1): 3–10. Dostupné z DOI: <http://doi: 10.21101/cejph.a4717>.
- Nakashima A, Yokoyama K, Kawanami D et al. Association between resistin and fibroblast growth factor 23 in patients with type 2 diabetes mellitus. Sci Rep 2018; 8(1): 13999. Dostupné z DOI: <http://doi: 10.1038/s41598–018–32432-z>.
- Burghardt AJ, Issever AS, Schwartz AV et al. High-resolution peripheral quantitative computed tomographic imaging of cortical and trabecular bone microarchitecture in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab 2010; 95(11): 5045–5055. Dostupné z DOI: <http://doi: 10.1210/jc.2010–0226>.
- Farr JN, Khosla S. Determinants of bone strength and quality in diabetes mellitus in humans. Bone 2016; 82 : 28–34. Dostupné z DOI: <http://doi: 10.1016/j.bone.2015.07.027>.
- Samelson EJ, Demissie S, Cupples LA et al. Diabetes and Deficits in Cortical Bone Density, Microarchitecture, and Bone Size: Framingham HR-pQCT Study. J Bone Miner Res 2018; 33(1): 54–62. Dostupné z DOI: <http://doi: 10.1002/jbmr.3240>.
- Kalyani RR, Tra Y, Yeh HC et al. Quadriceps strength, quadriceps power, and gait speed in older U.S. adults with diabetes mellitus: results from the National Health and Nutrition Examination Survey, 1999–2002. J Am Geriatr Soc 2013; 61(5):769–775. Dostupné z DOI: <http://doi: 10.1111/jgs.12204>.
- Trierweiler H, Kisielewicz G, Hoffmann Jonasson T et al. Sarcopenia: a chronic complication of type 2 diabetes mellitus. Diabetol Metab Syndr 2018; 10 : 25. Dostupné z DOI: <http://doi: 10.1186/s13098–018–0326–5>.
- Mori H, Kuroda A, Araki M et al. Advanced glycation end-products are a risk for muscle weakness in Japanese patients with type 1 diabetes. J Diabetes Investig 2017; 8(3): 377–382. Dostupné z DOI: <http://doi: 10.1111/jdi.12582>.
- Raška I, jr, Rašková M, Zikán V et al. Body composition is associated with bone and glucose metabolism in postmenopausal women with type 2 diabetes mellitus. Physiol Res 2017; 66(1): 99–111.
- Penckofer S, Kouba J, Wallis DE et al. Vitamin D and diabetes: let the sunshine in. Diabetes Educ 2008; 34(6): 939–940; 942; 944 passim. Dostupné z DOI: <http://doi: 10.1177/0145721708326764>.
- Tahrani AA, Ball A, Shepherd L et al. The prevalence of vitamin D abnormalities in South Asians with type 2 diabetes mellitus in the UK. Int J Clin Pract 2010; 64(3): 351–355. Dostupné z DOI: <http://doi: 10.1111/j.1742–1241.2009.02221.x>.
- Miñambres I, Sánchez-Quesada JL, Vinagre I et al. Hypovitaminosis D in type 2 diabetes: relation with features of the metabolic syndrome and glycemic control. Endocr Res 2015; 40(3): 160–165. Dostupné z DOI: <http://doi: 10.3109/07435800.2014.982326>.
- Muscogiuri G, Nuzzo V, Gatti A et al. Hypovitaminosis D: a novel risk factor for coronary heart disease in type 2 diabetes? Endocrine 2016; 51(2): 268–273. Dostupné z DOI: <http://doi: 10.1007/s12020–015–0609–7>.
- Raška I, jr, Rašková M, Zikán V et al. High Prevalence of Hypovitaminosis D in Postmenopausal Women with Type 2 Diabetes Mellitus. Prague Med Rep 2016; 117(1): 5–17. Dostupné z DOI: <http://doi: 10.14712/23362936.2016.1>.
- Rahi B, Morais JA, Gaudreau Pet al. Energy and protein intakes and their association with a decline in functional capacity among diabetic older adults from the NuAge cohort. Eur J Nutr 2016; 55(4): 1729–1739. Dostupné z DOI: <http://doi: 10.1007/s00394–015–0991–1>.
- Brunkwall L, Orho-Melander M. The gut microbiome as a target for prevention and treatment of hyperglycaemia in type 2 diabetes: from current human evidence to future possibilities. Diabetologia 2017; 60(6): 943–951. Dostupné z DOI: <http://doi: 10.1007/s00125–017–4278–3>.
- Vestergaard P, Rejnmark, L, Mosekilde L. Relative fracture risk in patients with diabetes mellitus, and the impact of insulin and oral antidiabetic medication on relative fracture risk. Diabetologia 2005; 48(7): 1292–1299. Dostupné z DOI: <http://doi: 10.1007/s00125–005–1786–3>.
- Starup-Linde J, Gregersen S, Frost M et al. Use of glucose-lowering drugs and risk of fracture in patients with type 2 diabetes. Bone 2017; 95 : 136–142. Dostupné z DOI: <http://doi: 10.1016/j.bone.2016.11.026>.
- Lapane KL, Yang S, Brown MJ et al. Sulfonylureas and risk of falls and fractures: a systematic review. Drugs Aging 2013; 30(7): 527–547. Dostupné z DOI: <http://doi: 10.1007/s40266–013–0081–0>.
- Rajpathak SN, Fu C, Brodovicz KG et al. Sulfonylurea use and risk of hip fractures among elderly men and women with type 2 diabetes. Drugs Aging 2015; 32(4): 321–327. Dostupné z DOI: <http://doi: 10.1007/s40266–015–0254–0>.
- Harsløf T, Wamberg L, MøllerL et al. Rosiglitazone decreases bone mass and bone marrow fat. J Clin Endocrinol Metab 2011; 96(5): 1541–1548. Dostupné z DOI: <http://doi: 10.1210/jc.2010–2077>.
- Watts NB, Bilezikian JP, Usiskin K et al. Effects of Canagliflozin on Fracture Risk in Patients With Type 2 Diabetes Mellitus. J Clin Endocrinol Metab 2016; 101(1): 157–166. Dostupné z DOI: <http://doi: 10.1210/jc.2015–3167>.
- Tang HL, Li DD, Zhang JJ et al. Lack of evidence for a harmful effect of sodium-glucose co-transporter 2 (SGLT2) inhibitors on fracture risk among type 2 diabetes patients: a network and cumulative meta-analysis of randomized controlled trials. Diabetes Obes Metab 2016; 18(12): 1199–1206. Dostupné z DOI: <http://doi: 10.1111/dom.12742>.
- Kohler S, Kaspers S, Salsali A et al. Analysis of Fractures in Patients With Type 2 Diabetes Treated With Empagliflozin in Pooled Data From Placebo-Controlled Trials and a Head-to-Head Study Versus Glimepiride. Diabetes Care 2018; 41(8): 1809–1816. Dostupné z DOI: <http://doi: 10.2337/dc17–1525>.
- Toulis KA, Bilezikian JP, Thomas GN et al. Initiation of dapagliflozin and treatment-emergent fractures. Diabetes Obes Metab 2018; 20(4): 1070–1074. Dostupné z DOI: <http://doi: 10.1111/dom.13176>.
- Giangregorio LM, Leslie WD, Lix LM et al. FRAX underestimates fracture risk in patients with diabetes. J Bone Miner Res 2012; 27(2): 301–308. Dostupné z DOI: <http://doi: 10.1002/jbmr.556>.
- Anagnostis P, Paschou SA, Gkekas NN et al. Efficacy of anti-osteoporotic medications in patients with type 1 and 2 diabetes mellitus: a systematic review. Endocrine 2018; 60(3): 373–383. Dostupné z DOI: <http://doi: 10.1007/s12020–018–1548-x>.
- Vestergaard P, Rejnmark L, Mosekilde L. Are antiresorptive drugs effective against fractures in patients with diabetes? Calcif Tissue Int 2011; 88 : 209–214. Dostupné z DOI: <http://doi: 10.1007/s00223–010–9450–4>.
- Schwartz AV, Pavo I, Alam J et al. Teriparatide in patients with osteoporosis and type 2 diabetes. Bone 2016; 91 : 152–158. Dostupné z DOI: <http://doi: 10.1016/j.bone.2016.06.017>.
- Ferrari SL, Abrahamsen B, Napoli N et al. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int 2018; 29(12): 2585–2596. Dostupné z DOI: <http://doi: 10.1007/s00198–018–4650–2>.
Labels
Clinical biochemistry Paediatric gynaecology Paediatric radiology Paediatric rheumatology Endocrinology Gynaecology and obstetrics Surgery Internal medicine Orthopaedics General practitioner for adults Radiodiagnostics Rehabilitation Rheumatology Traumatology Osteology
Article was published inClinical Osteology

2018 Issue 3-
All articles in this issue
- Odešel pan prof. MUDr. Jaroslav Blahoš, DrSc. (30. 6. 1930 – 27. 11. 2018)
- Porovnanie mortality pacientov po zlomenine proximálneho femoru 1995–2002 a 2003–2010
- Prevence a léčba osteoporózy u postmenopauzálních žen s karcinomem prsu léčených inhibitory aromatázy
- Diabetes mellitus 2. typu a kvalita kosti
- Kompresívne vertebrálne fraktúry u detí s Crohnovou chorobou: kazuistiky
- Kostné prejavy porúch štítnej žľazy
- Vyšetrovacie metódy u sarkopénie
- Teriparatid v liečbe ťažkej osteoporózy u starších pacientok: výsledky multicentrickej prospektívnej štúdie
- Clinical Osteology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Teriparatid v liečbe ťažkej osteoporózy u starších pacientok: výsledky multicentrickej prospektívnej štúdie
- Diabetes mellitus 2. typu a kvalita kosti
- Porovnanie mortality pacientov po zlomenine proximálneho femoru 1995–2002 a 2003–2010
- Prevence a léčba osteoporózy u postmenopauzálních žen s karcinomem prsu léčených inhibitory aromatázy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

