-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Získaný von Willebrandův syndrom
Acquired von Willebrand syndrome (AvWS)
Acquired von Willebrand syndrome (AvWS) is a rare bleeding disorder caused by von Willebrand factor (vWF) dysfunction of various types and severities. Clinical manifestations and differences in the intensity of bleeding are then given by the diversity of vWF disorders. AvWS usually occurs in adult patients with a negative personal or family history of bleeding symptoms and is associated with underlying disease. In recent years, vWF dysfunction has been most commonly attributed to cardiovascular, autoimmune, lymphoproliferative or myeloproliferative comorbidities. The true prevalence of AvWS is unknown, since many cases may be clinically or laboratory silent and remain undiagnosed. Thus, a higher incidence can be expected in the above-mentioned specific patient population. We present a case report of a 90year-old patient with the very first episode of bleeding manifestation and newly diagnosed vWF dysfunction. By describing the case, we will try to present the diagnostic and treatment options of AvWS, including their pitfalls, and draw attention to situations in which to think about AvWS.
Keywords:
inhibitor – von Willebrand factor – aortic valve stenosis – bleeding disorder – non‑Hodgkin lymphoma
Autoři: Petr Drenko 1; Petra Přenosilová 1; Alena Lavičková 2
Působiště autorů: I. interní klinika LF UK a FN Plzeň 1; Ústav klinické biochemie a hematologie LF UK a FN Plzeň 2
Vyšlo v časopise: Vnitř Lék 2022; 68(E-4): 16-19
Kategorie: Kazuistiky
Souhrn
Získaný von Willebrandův syndrom (AvWS) je vzácnou krvácivou chorobou, jejíž podstatou je dysfunkce von Willebrandova faktoru (vWF) různého typu a tíže. Klinické projevy a rozdílnost intenzity krvácivých projevů jsou pak dané rozmanitostí postižení vWF. AvWS se vyskytuje obvykle u dospělých pacientů s negativní osobní či rodinou anamnézou krvácivé symptomatologie a je asociován se základními chorobami. V posledních letech je porucha funkce vWF nejčastěji připisována kardiovaskulárním, autoimunitním, lymfoproliferativním či myeloproliferativním komorbiditám. Skutečná prevalence AvWS není známá, protože mnoho případů může být klinicky i laboratorně němých. U výše uvedené specifické populace pacientů lze tak očekávat jeho vyšší výskyt. Prezentujeme kazuistiku 90letého pacienta s první epizodou krvácivého projevu a nově diagnostikovanou dysfunkcí vWF. Popisem případu se budeme snažit přednést diagnostické a léčebné možnosti AvWS včetně jejich úskalí a upozornit na situace, ve kterých na AvWS pomyslet.
Klíčová slova:
inhibítor – aortální stenóza – krvácivá choroba – non‑Hodgkinův lymfom – von Willebrandův fakor
Úvod
Získaný von Willebrandův syndrom je vzácným, ale velmi pravděpodobně také poddiagnostikovaným onemocněním, které se, ve srovnání s hereditární formou (vWD), obvykle vyskytuje u dospělých nemocných s negativní osobní či rodinou anamnézu hemoragických diatéz. Poprvé byl AvWS popsán v roce 1968 u pacienta se systémovým lupus erythematodes (SLE). Jsou to právě lymfoproliferativní, myeloproliferativní, kardiovaskulární, ale i autoimunitní onemocnění, která jsou v posledních letech nejčastěji skloňována v souvislosti se získanou redukcí von Willebrandova fakoru (vWF) (1). Odhadovaná prevalence (na základě přezkoumání databáze Mayo Clinic) je zhruba 0,04 % (1/2500), ta však může být u výše uvedené specifické populace pacientů s asociovanými chorobami znatelně vyšší (2). Svízelná je pak diagnostika AvWS především u pacientů s lehkým deficitem vWf, který nemusí být dostatečný pro vznik krvácivé symptomatologie nebo pro přítomnost odchylek v základním koagulačním screeningu. Jedná se o onemocnění, které se nevyznačuje primární poruchou krevních destiček ani primární koagulopatií, i když sekundárně, za určitých podmínek, může být snížena aktivita f VIII (koagulační faktor VIII). Charakter a intenzita krvácivých projevů jsou odrazem typu a tíže poškození vWF.
Kazuistika
90letý pacient, s velmi dobrou kvalitou života, byl do roku 2017 ambulantně sledován pro CLL (chronická lymfocytární leukémie), která byla toho času ve stadiu remise. V osobní anamnéze dále dominovala známá, středně až těžce hemodynamicky významná (asymptomatická), aortální stenóza. Z anamnézy pacienta nevyplýval údaj o možných změnách v koagulačních parametrech či výskytu krvácivé symptomatologie v minulosti. V roce 2017 došlo k progresi základního onemocnění (CLL) s masivní generalizovanou lymfadenopatií včetně objemných paketů uzlin na krku, v mediastinu, plicních hilech oboustranně (způsobující kompresi dýchacích cest) a retroperitoneu. Nejdříve byla v režii HOO (hematoonkologie) zahájena léčba 4 cykly redukované chemoterapie v režimu COP (cyklofosfamid, vinkristin, prednison) s pouze parciálním efektem. Proto následovala léčba 6 cykly R‑COP a 4 cykly R‑FC lite (rituximab, fludarabin, cyklofosfamid) s adekvátní odpovědí v podobě regrese lymfadenopatie a normalizace parametrů krevního obrazu. Iniciální schéma chemoterapie (tzv. redukovaně COP) bylo zvoleno pro potřebu časného (ambulantního) zahájení léčby, vzhledem k masivní útlakové lymfadenopatii, a s ohledem na pokročilý věk pacienta.
V dubnu roku 2021 byl pacient přijat na naši kliniku s anamnézou 14 dní trvající enterorhagie a projevy anemického syndromu. Riziková farmakologická anamnéza s ohledem na krvácení do trávicího traktu nebyla vystopována.
Na recentním předhospitalizačním CT vyšetření břicha nebyla viditelná progrese lymfadenopatie či přítomnost splenomegalie.
Klinické vyšetření potvrdilo enterorhagii. Pacient byl kardiopulmonálně stabilní, tzv. normotenzní, bez tachykardie, při kvalitním vědomí a bez přítomnosti ortostatických projevů.
Charakter anémie byl normocytární s hodnotou Hb (hemoglobin) 50 g/l. Vyšetření metabolismu železa zároveň poukazovalo na pravděpodobně již déle trvající okultní krvácení. Dle parametrů krevního obrazu, diferenciálního rozpočtu bílých krvinek a průtokové cytometrie (FACS) nebylo vysloveno podezření na přítomnost klonálního onemocnění.
Vzhledem k odchylce v základním koagulačním panelu (prodloužené APTT–R 1,7) šlo usuzovat na patologii ve vnitřním systému. Pacient byl však prost užívání jakékoliv interferující medikace. Hodnota APTT (activated partial tromboplastin time) se plně normalizovala po podání normální plazmy in vitro. Detailní vyšetření vnitřního koagulačního systému odhalilo sníženou aktivitu f VIII (30,5 %). Vstupní screening specifického inhibitoru byl negativní.
Pacient měl stále poměrně významné krevní ztráty s potřebou denního hrazení transfúzních přípravků. S myšlenkou na získaný deficit f VIII jsme zahájili jeho substituci v adekvátní dávce (Advate 2000 IU à 12 hod.). Koloskopie ukázala těžkou divertikulózu tračníku s difúzním krvácením (Obr. 1), které nebylo možné intervenovat. Zároveň křehkost terénu nedovolila provést kompletní vyšetření. CT kolografie neprokázala jiný možný zdroj krvácení včetně případných angiodysplázií v tračníku.
Obr. 1. Těžká divertikulóza sigmatu s difúzním krvácením u pacienta s AvWS 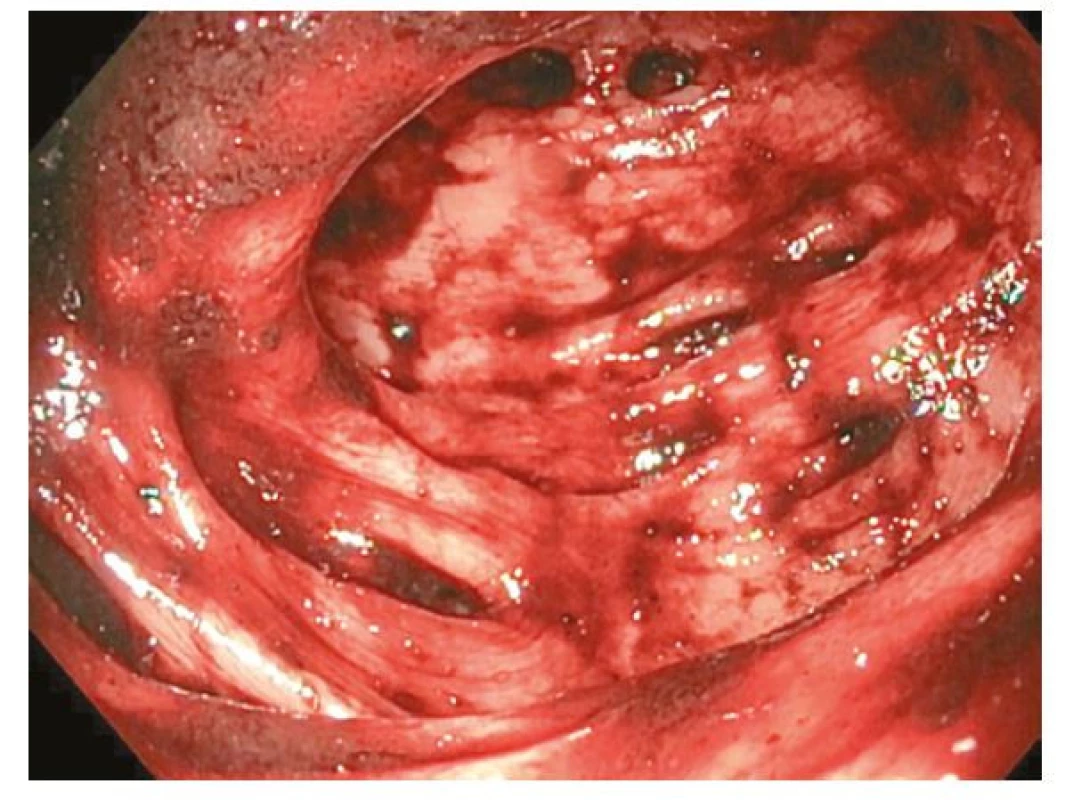
Kontrolní aktivita f VIII, po opakované substituci koncentrátu, perzistovala na vstupní hodnotě (30,8 %). Opakované vyšetření specifického inhibitoru bylo opět negativní. Proto jsme přistoupili ke stanovení aktivity (vWF:GPIb) a celkového množství (vWf:Ag) vWF. Oba tyto parametry byly významně redukované v napovídajícím poměru (Tab. 1). Zahájili jsme tedy substituci kombinovaným preparátem vWf + f VIII (Fánhdí 2000 IU á 12 hod.). Před a po substituci (1,5, 4 a 8 hod.) jsme stanovili kontrolní aktivitu vWF, jeho celkové množství a aktivitu f VIII v čase. Z naměřených výsledků (Tab. 2) jsme měli možnost pozorovat adekvátní reakci aktivity f VIII a celkového množství vWF (vWF:Ag) s opětovnou disproporcionalitou směrem k nižším hodnotám jeho aktivity (vWF: - GPIb). Ve spolupráci s klinickými farmaceuty byl vypočten specifický biologický poločas substituovaného faktoru, tzv. t1/2 = 8 h. Vyšetření ÚKHT (Ústav hematologie a krevní transfuze v Praze) na specifický inhibitor (volné protilátky) vWF bylo negativní. Prokázalo však funkční deficit vWF ve formě strukturální abnormity jeho multimerů. Množství propeptidu vWf (pp vWf) bylo v normě a jeho poměr k celkovému množství (pp vWF:vWF:Ag) byl < 3.
Tab. 1. Disproporcionální redukce celkového množství (Ag) a aktivity (GPIb) vWF ukazující spíše na jeho kvalitativní dysfunkci. 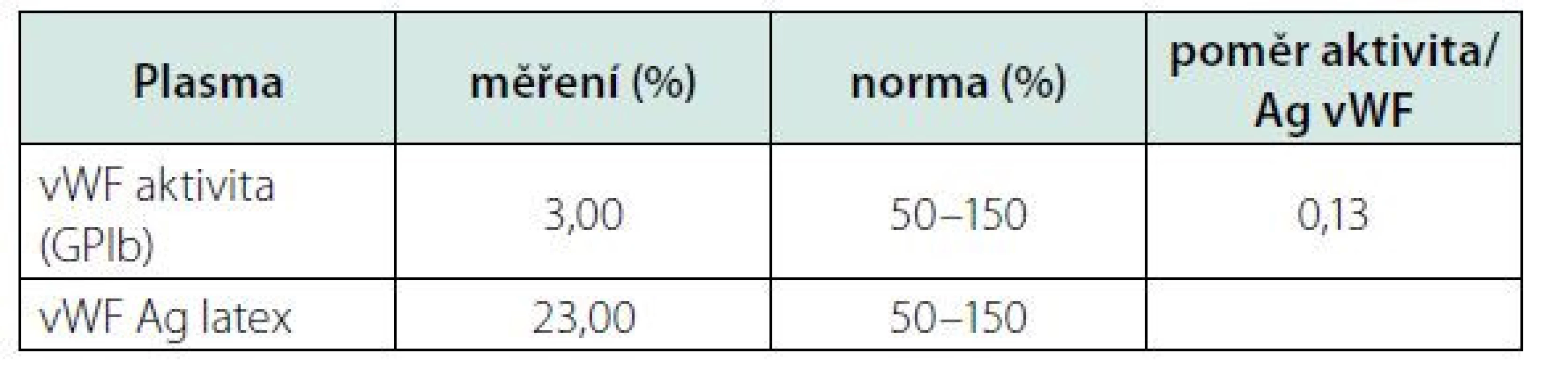
Tab. 2. Hodnocení kinetiky vWF a f VIII před a po substituci faktory (Fanhdi) 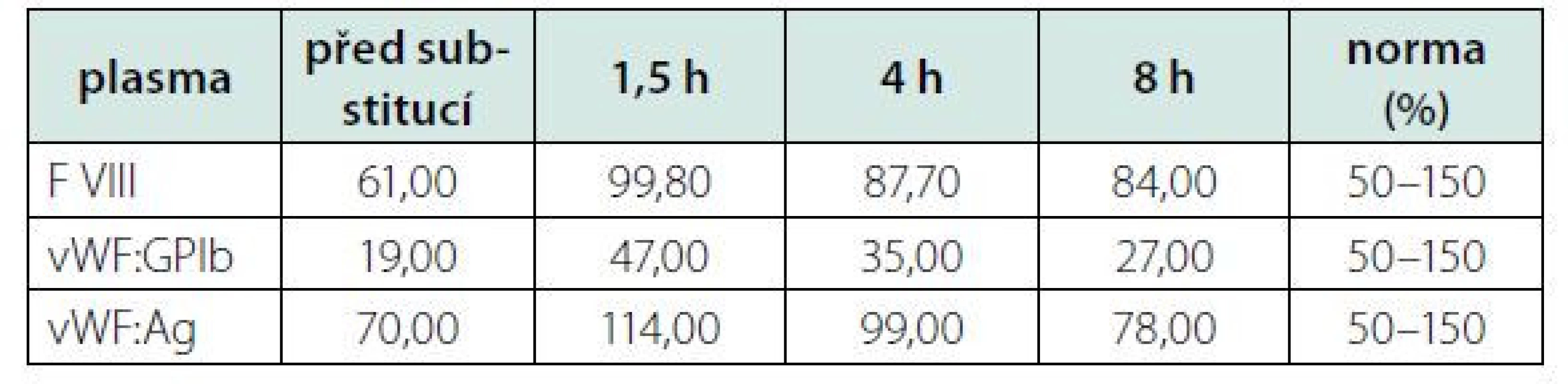
Toho času se klinický stav pacienta stabilizoval, došlo k ústupu enterorhagie spolu s přítomností stabilních parametrů v červeném krevním obraze. Nově však progredovala trombocytopenie.
S myšlenkou na imunitní podtext stonání jsme zahájili parenterální léčbu kortikoidy v dávce 1 mg/kg/den. Efekt kortikoidů na počet trombocytů, po více než týdnu léčby, byl však nulový. Srovnávali jsme také kinetiku vWF na terapii kortikoidy, která se ale téměř nelišila od předchozího hodnocení (Tab. 2 + Tab. 3). Zde je nutné poznamenat, že testování proběhlo pouhý jeden týden od zahájení kortikoterapie. Stejně tak následné podání IVIG (intravenózních imunoglobulinů) nemělo efekt na parametry vWF ani na počet trombocytů.
Tab. 3. Srovnání vývoje kinetiky (viz Tab. 2) vWF a f VIII po týdenní léčbě kortikoidy 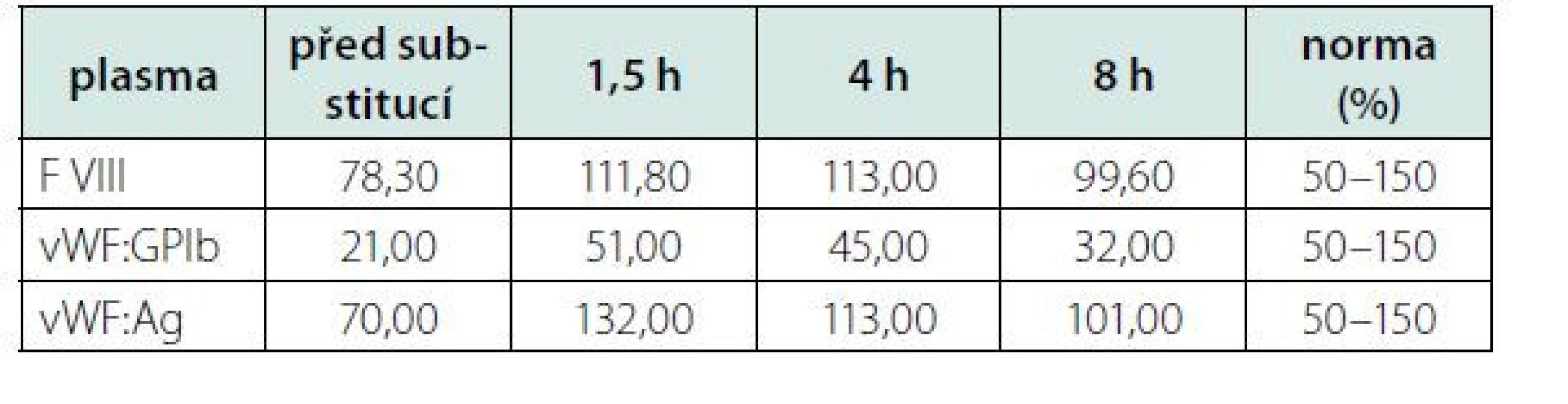
Kontrolní ECHO (echokardiografie) vyšetření potvrdilo stacionární tíži známé aortální vady. Hormony štítné žlázy (TSH, fT4) byly v normě. Na pokračující substituční terapii, bez známek krvácení, byl pacient propuštěn do ambulantní péče.
Ihned v prvních ambulantních kontrolách došlo k postupné progresi v počtu bílých krvinek s lymfocytární predominancí v diferenciálním rozpočtu (maximum: 24,81×10^9/l; 21,11×10^9/l lymfocytů). Dle průtokové cytometrie (FACS) byla prokázána imunofenotypicky neurčená atypická CD20 negativní B‑lymfoproliferace (imunofenotyp není typický pro CLL). Souběžně s tímto nálezem byly detekovány abnormity ve vývoji povrchových znaků myeloidních buněk, které nevylučovaly možnost MDS (myelodysplastický syndrom). Vyšetření kostní dřeně detekovalo nodulárně intersticiální infiltraci malými lymfoidními elementy, které dle imunohistochemického a molekulárně genetického vyšetření odpovídaly non‑Hodgkinské malobuněčné lymfoproliferaci s atypickým CD20 negativním fenotypem (suspekce na MZL; lymfom z marginální zóny). Trilineární dysplázie kostní dřeně zároveň podporovala diagnózu MDS.
Specifickou léčbu proti prokázané lymfoproliferaci a sekundárnímu (postchemoterapeutický) MDS pacient neobdržel vzhledem k pokročilému věku a významnému riziku krvácení při perzistujícím zdroji v dolní části trávicího traktu. Pokračující kortikoterapie s postupným snižováním dávky i nadále neměla efekt na parametry vWF. Nyní je pacientovi ponechána nízká dávka kortikoidu (Prednison; 5 mg/den) jako symptomatická terapie lymfoproliferace. Dalšími pilíři terapie zůstává pravidelná substituce faktory (Fánhdí) dle vývoje klinického stavu pacienta a také substituce transfúzními přípravky v případě nutnosti.
Diskuze
Etiologii získané dysfunkce vWF v zásadě dělíme na imunitní a neimunitní. Imunitně zprostředkované snížení aktivity/množství vWf je založeno na přítomnosti protilátky (inhibitoru), která má schopnost vazby na protein vWF, a snižuje tak jeho celkové množství (urychluje jeho plazmatickou clearance), nebo interferuje s jeho funkcí (méně časté) a způsobuje redukci aktivity faktoru (4, 5, 6). Neprokázaný inhibitor (protilátka) v plazmě však nevylučuje možnost imunitně zprostředkovaného AvWS. Dominantní frakce inhibitoru je v těchto případech ve vazbě na protein vWF, proto se tak minoritní množství volných protilátek v plazmě nemusí prokázat (4, 5). Udává se, že přítomnost inhibitoru prokážeme pouze u 5–10 % pacientů s AvWS. Imunitně zprostředkovanou depleci faktoru můžeme nejčastěji pozorovat u autoimunitních onemocnění (systémový lupus erytematodes), monoklonálních gamapatií (mnohočetný myelom) a lymfoproliferativních neoplázií (chronická lymfocytární leukémie, non‑Hodgkinův lymfom) (7, 8, 9). Pro svou multimerní strukturu je vWf náchylný ke změně toku tekutiny a změně smykového napětí. V oblastech se zvýšeným smykovým napětím mají multimery vWF tendenci měnit svou konformaci, tzv. přecházejí ze své globulární do protáhlé lineární formy, a jsou tak náchylnější k proteolytické degradaci ADAMTS13 při její normální aktivitě (10, 11, 12). Místa s vysokým smykovým napětím, tzv. > 3 Pa, pozorujeme u vrozených srdečních vad, komorových septálních defektů, aortální stenózy, paravalvulárního leaku po náhradě mitrální chlopně nebo u hypertrofické KMP (kardiomyopatie). Při použití ECMO (extrakorporální membránová oxygenace) či LVAD (left ventricular assit device) dochází vlivem kontinuálního průtoku zařízením ke zvýšení smykového napětí a tím ke zvýšenému riziku vzniku AvWS mechanismem vystupňované vazby vWf na trombocytech. U hemodynamicky těžké aortální stenózy dochází k dysfunkci (abnormitám) multimerů vWF (10, 11). Je popisován přímý vztah mezi tíží aortální stenózy, jejím vrcholovým gradientem a závažností dysfunkce mulitmerů vWF. U pacientů po korekci vady dochází téměř ihned po výkonu k normalizaci aktivity vWF. V případě aortální stenózy, insuficience vWF a přítomnosti angiodysplázií v tračníku při vystupňované angiogenezi, mluvíme o Heydého syndromu (13). Mechanismus adsorpce vWF na buněčných či proteinových strukturách vede k jeho urychlené clearance z cirkulace. Tento jev pozorujeme u pacientů s Wilmsovým tumorem, mnohočetným myelomem a u některých non‑Hodgkinských lymfoproliferací (14). U myeloproliferativních onemocnění (esenciální tombocytemie, polycytemia vera, myelofibróza) je popisován inverzní vztah mezi vysokým počtem trombocytů a sníženou aktivitou vWF (15). Přítomnost zvýšené aktivity proteázy (jiné než ADAMTS13), např. plasminu, u stavů jako dekompenzovaná jaterní cirhóza, DIC (diseminovaná intravaskulární koagulace) či u některých případů mnohočetného myelomu, může vést k urychlené degradaci vWF. Snížená syntéza glykoproteinu vWF u hypothyreozy je raritním případem. Stejně tak redukovaná syntéza vWF vlivem kyseliny valproové či jeho vystupňovaná proteolýza při užívání ATB (ciprofloxacin) jsou vzácnými případy.
Naše diagnostika pacienta s AvWS se stala snazší díky patrné odchylce již v základním hemokoagulačním screeningu (prodloužené APTT‑R). Vždy to tak být nemusí. Je známo, že k prodloužení APTT je potřeba redukce aktivity faktoru (v našem případě f VIII) ke 20–30 % normy. K vyšetření parametrů vWF jsme přistoupili v čase, kdy aktivita f VIII zůstala nezměněna po adekvátních substitucích a kdy nebyla opakovaně prokázána přítomnost inhibitoru. Disproporcionální redukce aktivity a celkového množství (vWF:GPIb/vWF:Ag < 0,7), které byly viditelné i při hodnocení rychlosti clearance vWF, svědčí spíše pro jeho funkční problematiku. Rychlost clearance vWF z cirkulace po substituci, která odpovídala jeho biologickému poločasu, poměr propeptidu a celkového množství vWF (vWF:vWF:Ag < 3) (16), který neodpovídal akcelerované clearance faktoru z cirkulace, nulový efekt IVIG a kortikoidů, negativní vyšetření specifického inhibitoru vWF a průkaz funkčních abnormit multimerů jsou parametry, které imunitní etiologii AvWS spíše vylučují. Stejně tak je očividné, že za poklesem trombocytů nestála protilátková činnost, nýbrž pravděpodobně dysfunkce kostní dřeně při MDS či non‑Hodgkinově lymfoproliferaci (NHL).
Výše jsme nastínili diagnostiku AvWS, která vyžaduje důkladnou anamnézu a klinické zhodnocení doplněné o příslušné základní a specifické laboratorní testy. Přístup k AvWS sestává z léčby akutní krvácivé epizody, řešení asociovaných onemocnění a chronické profylaktické léčby. V případě řešení akutního krvácení obvykle podáváme koncentráty faktorů s pravidelnou monitorací jejich aktivity, lze přistoupit k aplikaci desmopresinu (DDAVP) a zároveň substituujeme parametry krevního obrazu transfúzními přípravky dle potřeby. Při podezření nebo průkazu inhibitoru volíme léčbu intravenózními imunoglobuliny (IVIG) či kortikoidy s možností přidání další imunosuprese (např. cyklofosfamid) (3, 17, 20). Je nutno poznamenat, že efekt kortikoidů v monoterapii, v případě přítomnosti inhibitoru vWF, lze pozorovat nejdříve za 3–4 týdny. V případě možnosti ošetření zdroje krvácení, volíme specifickou modalitu.
Náš pacient držel, rozličnými patogenetickými mechanismy, pravděpodobně více než jednu predispozici ke vzniku AvWS. Po možnosti sledování průběhu stonání nemůžeme definitivně říci, zdali za dysfunkcí vWF stojí postupně progredující NHL lymfoproliferace či známá neprogredující aortální vada. Léčebnou limitací AvWS v tomto případě je, že obě různorodá onemocnění a zároveň možné etiologické jednotky AvWS nedosáhnou u pacienta svému kurativnímu řešení. Z výše popsaných indicií, které jsme měli možnost získat, se však můžeme domnívat, že se nejednalo o imunitně podmíněný proces.
Závěr
Prezentovaná kazuistika měla za cíl poukázat na diagnostická a léčebná úskalí AvWS a přednést situace, ve kterých na tuto vzácnou diagnózu pomyslet.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Petr Drenko
I. interní klinika LF UK a FN Plzeň
Alej Svobody 923/80, 323 00 Plzeň 1
Cit. zkr: Vnitř Lék. 2022;68(4):XX-XX
Článek přijat redakcí: X. X. 2022
Článek přijat po recenzích: X. X. 2022
Zdroje
1.Kasatkar P, Ghosh K, Shetty S. Acquired von Willebrand syndrome: a rare disorder of heterogeneous etiology. J Postgrad Med. 2013 Apr‑Jun; 59(2):98-101. doi: 10.4103/0022 - 3859.113816. PMID: 23793308.
2.Kumar S, Pruthi RK, Nichols WL. Acquired von Willebrand’s syndrome: a single institution experience. Am J Hematol. 2003 Apr;72(4):243-7. doi: 10.1002/ajh.10298. PMID: 12666134.
3.Franchini M, Mannucci PM. Acquired von Willebrand syndrome: focused for hematologists. Haematologica. 2020 Aug;105(8):2032-2037. doi: 10.3324/haematol.2020.255117. Epub 2020 Jun 18. PMID: 32554559.
4.Mohri H, Motomura S, Kanamori H, et al. Clinical significance of inhibitors in acquired von Willebrand syndrome. Blood. 1998 May 15;91(10):3623-9. Erratum in: Blood 1999 Jan 1;93(1):413. PMID: 9572997.
5.Handin RI, Martin V, Moloney WC. Antibody ‑ induced von Willebrand’s disease: a newly defined inhibitor syndrome. Blood. 1976 Sep;48(3):393-405. PMID: 1085186.
6.Gan TE, Sawers RJ, Koutts J. Pathogenesis of antibody ‑ induced acquired von Willebrand Syndrome. Am J Hematol. 1980;9(4):363-71. doi: 10.1002/ajh.2830090403. PMID: 6782864.
7.Dicke C, Schneppenheim S, Holstein K et al. Distinct mechanisms account for acquired von Willebrand syndrome in plasma cell dyscrasias. Ann Hematol. 2016 May;95(6):945 - 57. doi: 10.1007/s00277-016-2650-x. Epub 2016 Apr 4. PMID: 27040683.
8.Mohri H, Tanabe J, Ohtsuka M et al. Acquired von Willebrand disease associated with multiple myeloma; characterization of an inhibitor to von Willebrand factor. Blood Coagul Fibrinolysis. 1995 Sep;6(6):561-6. doi: 10.1097/00001721-199509000 - 00010. PMID: 7578899.
9.Alattar ML, Ciccone M, Gaballa MR et al. Bleeding diathesis associated with acquired von Willebrand Syndrome in three patients with chronic lymphocytic leukemia. Leuk Lymphoma. 2015;56(12):3452-4. doi: 10.3109/10428194.2015.1037757. Epub 2015 May 26. PMID: 25926060.
10.Otto CM, Prendergast B. Aortic‑valve stenosis--from patients at risk to severe valve obstruction. N Engl J Med. 2014 Aug 21;371(8):744-56. doi: 10.1056/NEJMra1313875. PMID: 25140960.
11.Yoshida K, Tobe S, Kawata M, Yamaguchi M. Acquired and reversible von Willebrand disease with high shear stress aortic valve stenosis. Ann Thorac Surg. 2006 Feb;81(2):490-4. doi: 10.1016/j.athoracsur.2005. 07. 074. PMID: 16427837.
12.Horiuchi H, Doman T, Kokame K et al. Acquired von Willebrand Syndrome Associated with Cardiovascular Diseases. J Atheroscler Thromb. 2019 Apr 1;26(4):303-314. doi: 10.5551/ jat.RV17031. Epub 2019 Mar 12. PMID: 30867356.
13.Loscalzo J. From clinical observation to mechanism--Heyde’s syndrome. N Engl J Med. 2012 Nov 15;367(20):1954-6. doi: 10.1056/NEJMcibr1205363. PMID: 23150964.
14.Richard C, Cuadrado MA, Prieto M et al. Acquired von Willebrand disease in multiple myeloma secondary to absorption of von Willebrand factor by plasma cells. Am J Hematol. 1990 Oct;35(2):114-7. doi: 10.1002/ajh.2830350210. PMID: 2205095.
15.Mital A, Prejzner W, Bieniaszewska M et al. Prevalence of acquired von Willebrand syndrome during essential thrombocythemia: a retrospective analysis of 170 consecutive patients. Pol Arch Med Wewn. 2015;125(12):914-20. doi: 10.20452/pamw.3211. Epub 2015 Dec 10. PMID: 26658493.
16.Lee A, Sinclair G, Valentine K et al. Acquired von Willebrand syndrome: von Willebrand factor propeptide to von Willebrand factor antigen ratio predicts remission status. Blood. 2014 Jul 31;124(5): e1-3. doi: 10.1182/blood-2014-02-557132. Epub 2014 Jun 20. PMID: 24951428.
17.Charlebois J, Rivard GÉ, St‑Louis J. Management of acquired von Willebrand syndrome. Transfus Apher Sci. 2018 Dec;57(6):721-723. doi: 10.1016/j.transci.2018. 10. 012. Epub 2018 Oct 30. PMID: 30401518.
18.Pushin DM, Salikhova TY, Zlobina KE et al. Platelet activation via dynamic conformational changes of von Willebrand factor under shear. PLoS One. 2020 Jun 11;15(6):e0234501. doi: 10.1371/journal.pone.0234501. PMID: 32525962.
19.Nascimbene A, Neelamegham S, Frazier OH et al. Acquired von Willebrand syndrome associated with left ventricular assist device. Blood. 2016 Jun 23;127(25):3133-41. doi: 10.1182/ blood-2015-10-636480. Epub 2016 May 3. PMID: 27143258.
20.Mohri H. Acquired von Willebrand syndrome: features and management. Am J Hematol. 2006 Aug;81(8):616-23. doi: 10.1002/ajh.20455. PMID: 16823821.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo E-4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Postavení a význam farmakovigilance v České republice a ve světě
- Získaný von Willebrandův syndrom
- Pacient s jaterní cirhózou na interním oddělení – intervence případného abúzu alkoholu
- Multimorbidity working group
- Recidivujúce uroinfekcie u pacientov po transplantácii obličky s polycystickou chorobou obličiek
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Získaný von Willebrandův syndrom
- Postavení a význam farmakovigilance v České republice a ve světě
- Recidivujúce uroinfekcie u pacientov po transplantácii obličky s polycystickou chorobou obličiek
- Pacient s jaterní cirhózou na interním oddělení – intervence případného abúzu alkoholu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



