-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Novinky v léčbě spondyloartritid
Autoři: prof. MUDr. Šenolt Ladislav, Ph.D.
Působiště autorů: Klinika revmatologie, 1. LF UK ; Revmatologický ústav, Praha
Vyšlo v časopise: Svět praktické medicíny, 5, 2023, č. 2, s. 19-24
Kategorie: Medicína v ČR: přehledový článek
Diagnostika a léčba spondyloartritid, zejména dvou nejčastějších nozologických jednotek této skupiny – axiální spondyloartritidy a psoriatické artritidy – zaznamenala v posledních letech významný pokrok. Klinický průběh těchto onemocnění může být značně heterogenní, vedle artritidy může být přítomna entezitida a daktylitida a kromě psoriázy se mohou objevit i jiné extraartikulární manifestace, nejčastěji akutní přední uveitida či idiopatický střevní zánět. Obsahem tohoto přehledového sdělení bude zmínka o schválené biologické léčbě proti tumor nekrotizujícímu faktoru (TNF) a interleukinu (IL)-17 a představení nově zaváděných syntetických léků ovlivňujících Janusovy kinázy nebo biologických léků zasahujících na úrovni signalizace cytokinu IL-23 či potenciálně nadějných duálních a nanoprotilátkových cytokinových inhibitorů a nových kinázových antagonistů.
Spondyloartritidy (SpA) představují skupinu chronických imunitně podmíněných zánětlivých revmatických onemocnění, která se projevují postižením osového skeletu anebo artritidou periferních kloubů, často také entezitidou, tedy zánětem v místě úponů šlach, nebo daktylitidou s bolestivým párkovitým otokem prstů.1 Podle klinického obrazu se rozeznává:
1. axiální SpA, která představuje zhruba dvě třetiny případů z celé skupiny, nejznámější je radiografická axiální SpA neboli ankylozující spondylitida, známá také jako Bechtěrevova nemoc,
2. periferní SpA – nejčastější je psoriatická artritida, případně reaktivní artritidy nebo enteropatické artritidy (Tab. 1).
Tab. 1. Koncept spondyloartritid (SpA) podle převažující manifestace a jednotlivých klinických jednotek 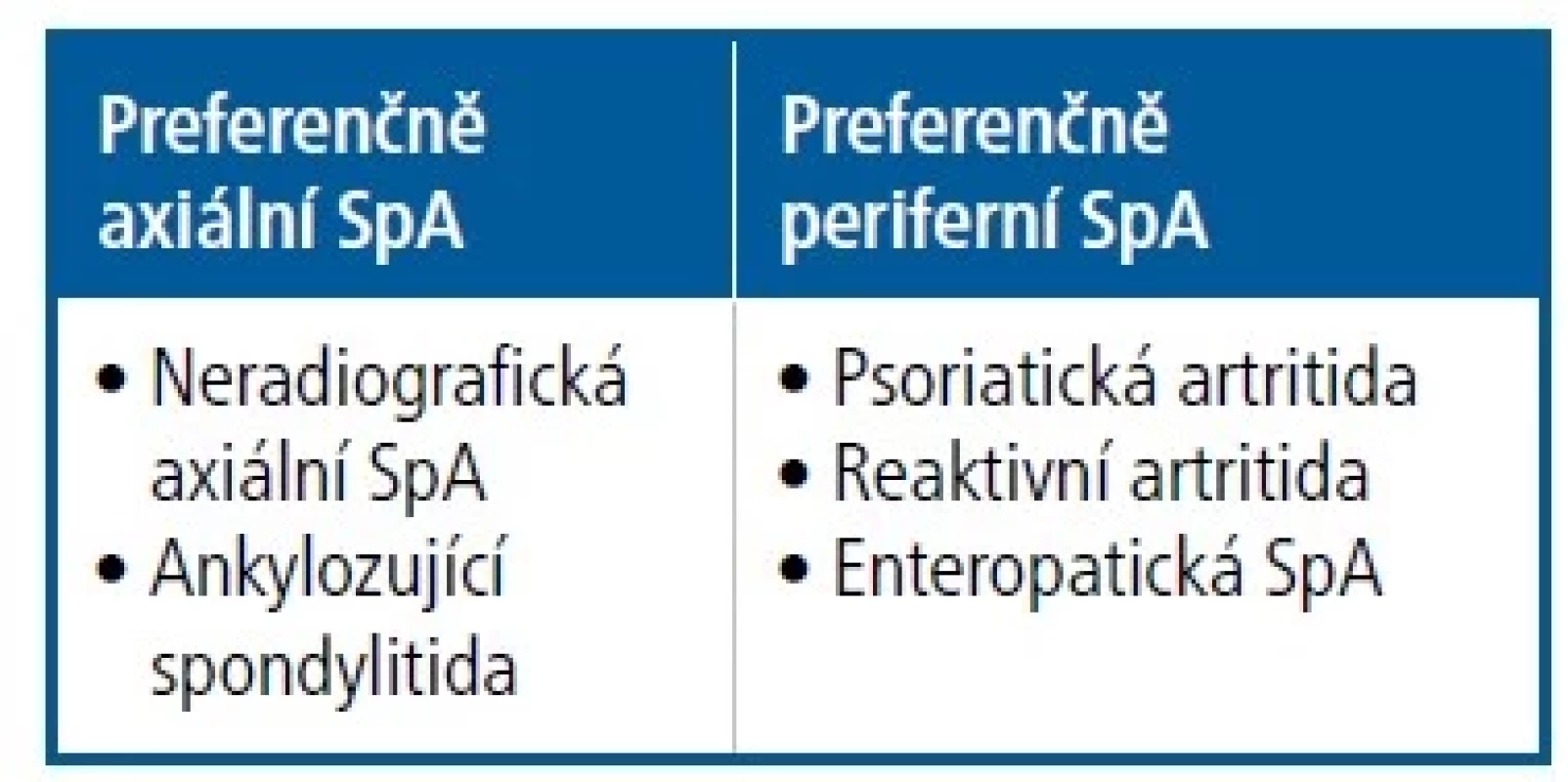
Prevalence celé skupiny SpA se pohybuje kolem 1–2 %.2 Periferní i axiální postižení může být někdy souběžné a při definici pak záleží na převažujícím typu postižení. Až v polovině případů se mohou objevit extraartikulární manifestace – nejčastěji akutní přední uveitida, psoriáza nebo vzácněji idiopatický střevní zánět. SpA bývá také spjata se zvýšeným rizikem komorbidit, u psoriatické artritidy je častější metabolický syndrom, obezita, diabetes, kardiovaskulární onemocnění, deprese, fibromyalgie atp.
Diagnostika onemocnění se zakládá na kombinaci klinických příznaků, laboratorních parametrů a zobrazovacích metod.3 Pro axiální SpA je typická chronická bolest zad, která má většinou zánětlivý charakter, což znamená, že vzniká u mladých jedinců, zpravidla v druhé polovině noci, a bývá spojena s ranní ztuhlostí, zhoršuje se během klidu a většinou se zmírňuje po rozcvičení nebo při užití nesteroidních antirevmatik (NSA). Prostý rentgenový snímek odhalí až pozdní strukturální změny sakroiliakálních (SI) kloubů, zánětlivý proces pomáhá verifikovat magnetická rezonance. Periferní SpA se zakládá na přítomnosti artritidy, daktylitidy nebo entezitidy. Diagnostice napomáhá přítomnost některého z výše uvedených extraartikulárních projevů. Ve většině případů je pozitivní HLA-B27 antigen, přibližně u poloviny pacientů jsou zvýšené reaktanty akutní fáze.
Léčba SpA musí být komplexní, opírá se o doporučené postupy a vyžaduje kombinaci farmakologického a nefarmakologického přístupu.4–6 První volbou jsou NSA, většinou přípravky s delším poločasem, mají jak protizánětlivý, tak analgetický účinek. U axiální nebo mírné formy periferní SpA se obvykle užívají podle potíží, ale při setrvalých symptomech nebo zvýšených reaktantech zánětu se upřednostňuje kontinuální podávání. V případě periferního postižení lze využít lokální instilaci glukokortikoidu, u polyartritidy se nasazují chorobu modifikující antirevmatické léky, nejčastěji metotrexát, sulfasalazin nebo leflunomid. Při selhání účinku této úvodní léčby je možné doporučit biologickou nebo cílenou syntetickou léčbu, o které bude po jednávat tato přehledová práce. Zmíněny budou také nové přípravky, které jsou v časné fázi klinického zkoušení.
Inhibitory TNF
Biologická léčba namířená proti tumor nekrotizujícímu faktoru (TNF) začala být u SpA využívána poté, co byla úspěšně zavedena v léčbě revmatoidní artritidy počátkem tisíciletí a co byla objevena zvýšená exprese TNF v bioptické tkáni z SI kloubů a synoviální výstelky periferních kloubů u pacientů se SpA.7, 8 TNF je pleiotropní cytokin, který je odpovědný za prozánětlivou aktivaci, proliferaci a migraci imunitních buněk, zvýšenou tvorbu destruktivních enzymů a proliferaci synoviálních fibroblastů.
Ačkoliv lékové studie ukazují, že inhibitory TNF navodí dosažení inaktivního onemocnění přibližně u 40 % pacientů s axiální SpA, v reálné klinické praxi to je 26 %.9 K dispozici je pět inhibitorů TNF – infliximab, adalimumab, etanercept, golimumab nebo certolizumab pegol (Tab. 2), přičemž v posledních několika letech jsou schválené biologicky podobné (biosimilární) léky k prvním třem přípravkům. Tyto léky mají srovnatelnou účinnost i bezpečnost jako jejich originální protějšky.10 Všechny inhibitory TNF jsou schváleny pro léčbu radiografické axiální SpA a kromě infliximabu také pro léčbu neradiografické, časnější formy onemocnění. Inhibitory TNF jsou účinné na axiální i periferní projevy onemocnění, včetně entezitidy a daktylitidy, většinou vedou k normalizaci CRP a podstatnému snížení zánětu na páteři a SI kloubech.11 Významně zlepšují projevy lupénky a monoklonální protilátky, tedy všechny inhibitory TNF kromě etanerceptu – solubilního receptoru – jsou účinné na uveitidu a idiopatický střevní zánět. Mezi prediktory dobré léčebné odpovědi patří mladší věk, mužské pohlaví, kratší trvání nemoci a vysoká aktivita onemocnění v podobě vysokého CRP nebo intenzivního zánětu SI kloubů na magnetické rezonanci. Mnoho pacientů na biologické léčbě nemusí užívat NSA nebo jen v omezené míře. U periferní SpA je možné podávání biologické léčby v kombinaci s metotrexátem, v řadě případů je dostatečná účinnost i v monoterapii. Při dosažení remise je možné zkusit redukovat dávku biologického léku, resp. prodlužovat interval podávané subkutánní injekce nebo v případě infliximabu infuze, aniž by došlo ke zhoršení klinického stavu.12 Většina pacientů odpovídá na TNF blokující léčbu dobře, data z evropského registru Euro - SpA ukazují, že v běžné klinické praxi setrvává po roce léčby na prvním inhibitoru TNF 65 % pacientů.9 To znamená, že ve 35 % případů je třeba léčbu změnit, a to zpravidla z důvodu intolerance, primárního nebo sekundárního selhání účinku. Léčbu je možné změnit na jiný přípravek ze stejné skupiny nebo na lék s jiným mechanismem účinku, kterému je při rozšiřujícím se spektru nových léků dávána přednost.
Inhibitory IL-17
Interleukin (IL)-17 je důležitý prozánětlivý mediátor, který je tvořen pomocnými T-lymfocyty, γδ T-lymfocyty a dalšími imunitními buňkami. Zvýšená exprese IL-17 neutrofily a mononukleárními buňkami byla prokázána ve facetových kloubech u pacientů s radiografickou axiální SpA.13 Podobně bylo v synoviální tekutině pacientů s psoriatickou artritidou zjištěno zvýšené množství T-lymfocytů produkujících IL-17, které korelovalo se zánětlivou aktivitou a strukturální progresí onemocnění.14
Pro léčbu axiální SpA a psoriatické artritidy jsou schváleny dvě monoklonální protilátky proti IL-17A – secukinumab a ixekizumab (Tab. 2, Obr. 1). Oba přípravky prokázaly v klinických studiích účinnost jak na axiální, tak na periferní projevy SpA, v porovnání s placebem byly spojeny se snížením bolesti zad, zlepšením pohyblivosti, funkčních schopností, kvality života a pracovní produktivity. 15 Inhibitory IL-17 byly účinné u radiografické i neradiografické axiální SpA. Zlepšení projevů zánětu bylo pozorováno na páteři a SI kloubech, včetně významného zmírnění projevů artritidy, daktylitidy a entezitidy. Podávání inhibitorů IL-17 u pacientů s axiální SpA vede ke zpomalení tvorby syndesmofytů na páteři, které je srovnatelné jako při léčbě TNF blokujícím adalimumabem. Inhibitory IL-17 mají prokázaný účinek jak v první linii, tak po selhání předchozí biologické léčby inhibitory TNF. U pacientů s psoriatickou artritidou vykazovaly oba inhibitory IL-17 v přímém srovnání s TNF blokující léčbou podobnou účinnost na muskuloskeletální projevy nemoci, ale lepší účinnost na psoriázu.16, 17 Úplného vyhojení psoriázy (PASI100) dosahují dvě třetiny pacientů na IL-17 blokující léčbě, přičemž takového stavu nedosahuje zdaleka ani polovina jedinců na TNF blokující léčbě. Na druhé straně, na uveitidu ani idiopatický střevní zánět inhibitory IL-17 účinné nejsou.
Tab. 2. Léčebné možnosti u pacientů se spondyloartritidou, včetně přípravků zkoušených v různých fázích klinického hodnocení. 
IL – interleukin; TNF – tumor nekrotizující faktor;
JAK – Janusova kináza; PDE – fosfodiesteráza;
MK – mitogenem aktivovaná proteinkináza
# v České republice má úhradu pro léčbu psoriázy, ale ne spondyloartritid
* ve fázi klinického výzkumu u spondyloartritidObr. 1. Klíčové postavení cytokinů, nitrobuněčných kináz a možnosti jejich léčebného ovlivnění u spondyloartritid. [Upraveno podle 20]
IL-17A a IL-17F jsou produkovány imunitními buňkami včetně Th17, γδ T-lymfocytů, ILC, iNK T-lymfocytů, buněk MAIT, neutrofilů a žírných buněk ve formě homo- i heterodimerů. Oba interleukiny se váží na receptor IL-17R sestávající se ze 2 podjednotek IL-17RA a IL-17RC, stimulujících adaptorový protein ACT1, který dále stimuluje efektorové proteiny TRAF2, TRAF5 a TRAF6, které zase aktivují cestu NF-κβ. Ixekizumab a secukinumab inhibují IL-17A. Bimekizumab inhibuje navíc i IL-17F.
Podjednotky IL-23 (sestávající se z p19 a p40) jsou produkovány hlavně dendritickými buňkami a makrofágy. Tyto podjednotky se váží na receptor IL-23, což vede k fosforylaci JAK1, JAK3 a TYK2, které aktivují STAT3 a STAT4 k vyvolání produkce RORγT, což podporuje přežití a aktivaci Th17 lymfocytů. Ustekinumab inhibuje podjednotku p40 IL-23, která je sdílena s IL-12. Guselkumab, risankizumab a tildrakizumab inhibují podjednotku p19 IL-23. Filgotinib, tofacitinib a upadacitinib inhibují JAK1 a JAK3. Deucravacitinib inhibuje TYK2. Brepocitinib inhibuje JAK1, JAK3 i TYK2.![Klíčové postavení cytokinů, nitrobuněčných kináz a možnosti jejich léčebného ovlivnění u spondyloartritid. [Upraveno podle 20]<br>
IL-17A a IL-17F jsou produkovány imunitními buňkami včetně Th17, γδ T-lymfocytů, ILC, iNK T-lymfocytů, buněk MAIT, neutrofilů a žírných buněk ve formě homo- i heterodimerů.
Oba interleukiny se váží na receptor IL-17R sestávající se ze 2 podjednotek IL-17RA a IL-17RC, stimulujících adaptorový protein ACT1, který dále stimuluje
efektorové proteiny TRAF2, TRAF5 a TRAF6, které zase aktivují cestu NF-κβ. Ixekizumab a secukinumab inhibují IL-17A. Bimekizumab inhibuje navíc i IL-17F.<br>
Podjednotky IL-23 (sestávající se z p19 a p40) jsou produkovány hlavně dendritickými buňkami a makrofágy. Tyto podjednotky se váží na receptor IL-23, což vede
k fosforylaci JAK1, JAK3 a TYK2, které aktivují STAT3 a STAT4 k vyvolání produkce RORγT, což podporuje přežití a aktivaci Th17 lymfocytů. Ustekinumab inhibuje podjednotku
p40 IL-23, která je sdílena s IL-12. Guselkumab, risankizumab a tildrakizumab inhibují podjednotku p19 IL-23. Filgotinib, tofacitinib a upadacitinib inhibují
JAK1 a JAK3. Deucravacitinib inhibuje TYK2. Brepocitinib inhibuje JAK1, JAK3 i TYK2.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c7647c4ad7f7ce64ddfc6655239ecd48.jpg)
Inhibitory IL-23
IL-23 je heterodimerní cytokin, který patří do rodiny IL-12 a sdílí s ním společnou podjednotku p40. Je tvořen převážně dendritickými buňkami a monocyty, má prozánětlivé účinky a je potřebný pro počáteční fázi vzniku artritidy. 18 IL-23 po vazbě na receptor aktivuje nitrobuněčnou tyrosinkinázovou signalizaci JAK2/TYK2, a polarizuje tak imunitní odpověď k Th17, což vede ke zvýšené tvorbě IL-17.
Ustekinumab, první plně humánní monoklonální protilátka proti společné podjednotce p40 pro cytokiny IL-23 a IL - 12, je schválen pro léčbu psoriázy, psoriatické artritidy, ulcerózní kolitidy a Crohnovy choroby. Postupně byly vyvíjeny nové selektivní inhibitory podjednotky p19 cytokinu IL-23 (Tab. 2, Obr. 1), např. risankizumab a guselkumab, které jsou již schválené pro léčbu psoriázy, psoriatické artritidy a risankizumab i pro léčbu Crohnovy choroby. Tildrakizumab je schválen pro léčbu psoriázy a klinický výzkum u psoriatické artritidy probíhá. Primární cíl časné fáze klinického zkoušení s tildrakizumabem byl u pacientů s psoriatickou artritidou splněn, ale např. účinek na entezitidu a daktylitidu prokázán nebyl. Naopak risankizumab i guselkumab vykázaly v porovnání s konvenční léčbou pozitivní účinky na všechny periferní projevy psoriatické nemoci, tedy na artritidu, entezitidu i daktylitidu.19 Příznivé účinky léčby byly pozorovány u jedinců po selhání základní, ale i biologické léčby. Ačkoliv se výsledky jednotlivých studií mezi sebou nepatrně liší, účinek na psoriázu byl většinou srovnatelný nebo i lepší než při léčbě inhibitory IL-17. Inhibitory IL - 23 mají navíc výhodu komfortnějšího dávkování (po 8–12 týdnech), nižšího výskytu nežádoucích účinků, zejména kandidových infekcí, a vhodnost podávání pacientům s idiopatickým střevním zánětem.
Pro úzký vztah mezi cytokiny IL-17 a IL-23 se původně předpokládalo, a podporovaly to výsledky časné fáze klinického zkoušení s ustekinumabem, že léčba blokující IL-23 bude, podobně jako inhibitory IL-17, účinná v léčbě axiální SpA. To se ovšem v dalších fázích klinického zkoušení nepotvrdilo v případě ustekinumabu i risankizumabu. Inhibice IL-23 je tak účinná na artritidu periferních kloubů, ale ne na zánětlivé postižení páteře. Částečně to lze vysvětlit buď sníženým množstvím myeloidních buněk produkujících IL-23 v oblastech axiálního skeletu proti periferním kloubům, nebo klíčovou rolí IL-23 při vzniku SpA v časné, ale ne rozvinuté fázi onemocnění. IL-17 může být navíc produkován imunitními buňkami nezávisle na cytokinu IL-23.20
Inhibitory JAK
Janusovy kinázy (JAK) byly popsány před 30 lety a podle podobnosti dvou homologických kinázových domén byly pojmenovány podle římského boha dvou tváří Januse. Celkem jsou známy čtyři JAK kinázy – JAK1, JAK2, JAK3 a tyrosinkináza 2 (TYK2), které tvoří homodimery nebo heterodimery a navázáním cytokinů či růstových faktorů aktivují transkripční faktory STAT (signal transducers and activators of transcription) spouštějící v jádře transkripci genů působících na imunitní odpověď. Tato re akce se podílí na patogenezi mnoha imunitně podmíněných onemocnění, včetně spondyloartritid.21
Podrobnější informace o postavení inhibitorů JAK v revmatologii najdete v následujícím článku na stranách 25 až 30 v tomto tematickém čísle.22 Pro léčbu psoriatické artritidy a radiografické axiální SpA jsou v současnosti schváleny dva přípravky ze skupiny inhibitorů JAK – méně selektivní tofacitinib a JAK1 selektivní upadacitinib (Tab. 2, Obr. 1). Oba jsou schváleny pro léčbu pacientů s psoriatickou artritidou po selhání chorobu modifikující léčby, nicméně v ČR má úhradu v době psaní tohoto článku zatím jen upadacitinib, a to po předchozím selhání biologické léčby. V případě axiální SpA jsou doporučovány na stejné úrovni jako TNF nebo inhibitory IL-17, které jsou však preferovány, protože s inhibitory JAK je zatím v léčbě axiální SpA méně zkušeností.4 Výhodou inhibitorů JAK je poměrně rychlý nástup účinku, účinnost v monoterapii (což však u SpA platí i pro biologické léky) a poměrně slušný účinek na periferní projevy onemocnění (artritida, entezitida, daktylitida). Ovlivnění psoriázy je však v porovnání s dostupnými biologickými léky méně účinné. Na axiální projevy onemocnění mají inhibitory JAK dobrý klinický účinek, a to zejména u pacientů se zvýšenými reaktanty zánětu nebo s aktivní sakroiliitidou na magnetické rezonanci. V klinických studiích byla léčba inhibitory JAK provázena podstatným snížením bolesti zad, zlepšením funkčních schopností, poklesem systémového zánětu a zmírněním projevů lokálního zánětu v oblasti SI kloubů.23 Některé inhibitory JAK mají kromě revmatologických indikací, včetně revmatoidní artritidy nebo juvenilní idiopatické artritidy, schválení pro léčbu těžké atopické dermatitidy a alopecia areata nebo ulcerózní kolitidy.
Nové léčebné možnosti spondyloartritid
U psoriatické artritidy probíhají klinická hodnocení s několika perorálně podávanými přípravky zasahujícími na úrovni nitrobuněčných proteinkináz (Tab. 2, Obr. 1).20 Nejpokročilejší jsou studie s deucravacitinibem, selektivním inhibitorem TYK2, který je již schválen pro léčbu psoriázy.24 Protože TYK2 zprostředkovává signalizaci IL - 23 a výsledky časné fáze lékového hodnocení s deucravacitinibem byly příznivé, lze očekávat, že další fáze klinického zkoušení přispěje k úspěšné registraci deucravacitinibu pro léčbu psoriatické artritidy. U pacientů s psoriázou a psoriatickou artritidou jsou nadějné i výsledky s brepocitinibem, duálním inhibitorem JAK1 a TYK2.25 Nově také probíhají klinická hodnocení s inhibitory mitogenem aktivované proteinkinázy 2 (MK2) u psoriatické artritidy a ankylozující spondylitidy.20 MK2 je nitrobuněčný přenašeč signálu aktivovaný MAP - kinázou p38 a podílí se na regulaci exprese řady prozánětlivých cytokinů, např. TNF, IL-6 nebo IL-17.
V rámci biologické léčby jsou nejpokročilejší a zároveň pozitivní výsledky s bimekizumabem, duálním inhibitorem IL-17A a IL-17F, který je již schválen pro léčbu psoriázy a má velmi příznivé účinky na kožní i muskuloskeletální projevy onemocnění, včetně projevů axiální spondyloartritidy.26 V současnosti se také zkouší nanoprotilátky proti IL-17, které mají výhodu malé velikosti, větší stability a významně vyšší afinity vůči IL-17, než má např. secukinumab. Očekává se, že mají menší imunogenicitu a lepší penetraci do míst zánětu.20 U psoriatické artritidy se zkouší izokibep, nanoprotilátka proti IL-17A, a sonelokimab, bispecifická nanoprotilátka proti IL-17A/F. U pacientů s revmatoidní artritidou byly nepříliš úspěšně zkoušeny duální inhibitory TNF a IL-17, jejichž vývoj byl u psoriatické artritidy zastaven, ale v současnosti jsou např. zkoušeny strategie kombinované inhibice TNF a IL-23 (golimumab a guselkumab) u pacientů s psoriatickou artritidou, kteří měli nedostatečný účinek TNF blokující léčby.27
Nežádoucí účinky biologické léčby a inhibitorů JAK
V průběhu biologické léčby se mohou objevit mírné reakce v místě vpichu, infuzní reakce, velmi vzácně až život ohrožující alergické reakce. Častější jsou běžné infekce, většinou respiračního a močového traktu. Vážné a oportunní infekce jsou častější, ale jejich výskyt je velmi nízký. Při léčbě inhibitory IL-17 jsou častější kandidové infekce, při léčbě inhibitory JAK je četnější výskyt herpes zoster.28, 29
Při léčbě inhibitory JAK bývá pozorován pokles lymfocytů a neutrofilních leukocytů, zpravidla bez vztahu k vyššímu riziku infekce. Pozorováno bývá klinicky nevýznamné zvýšení transamináz a kreatinkinázy, sérových hladin LDL-cholesterolu, HDL-cholesterolu nebo triglyceridů. Bezpečnost inhibitorů JAK je obecně srovnatelná s biologickými přípravky, kromě herpes zoster se v porovnání s inhibitory TNF častěji diskutuje zvýšené kardiovaskulární riziko a výskyt tromboembolických komplikací. 30 V současné době tak není doporučováno podávat inhibitory JAK lidem nad 65 let, kuřákům a pacientům s přítomností kardiovaskulárních nebo nádorových rizikových faktorů.
Závěr
Biologická léčba v revmatologii dosáhla významného pokroku. Schválená biologika pro léčbu spondyloartritidy zahrnují látky regulující cytokiny TNF, IL-17 nebo IL-23, které hrají zásadní roli v patogenezi spondyloartritid, včetně komplikujících projevů, jako je uveitida, psoriáza nebo idiopatický střevní zánět. Monoklonální protilátky proti těmto cytokinům jsou účinné při léčbě periferních projevů spondyloartritidy a kromě inhibitoru IL-23 i při léčbě zánětu v rámci axiálního postižení.31 V současné době se rozdílná účinnost inhibitorů IL - 23 a IL-17 vysvětluje rozpojením cytokinové osy IL-23/IL-17, rozdílnou expresí cytokinů mezi periferním a axiálním skeletem, na IL-23 nezávislou produkcí IL-17 v místech axiálního skeletu a pravděpodobně zapojením IL-23 v časných a méně v pokročilých stadiích onemocnění. Mezi novou generaci léčivých přípravků ovlivňujících nitrobuněčnou signalizaci na úrovni proteinkináz patří inhibitory JAK. Jsou schváleny pro léčbu několika imunitně podmíněných revmatických onemocnění, včetně psoriatické artritidy a axiální spondyloartritidy, kde je s nimi zatím méně zkušeností. V pokročilé fázi klinického výzkumu je např. deucravacitinib, selektivní inhibitor TYK2, nebo brepocitinib, duální inhibitor JAK1/ TYK2, zkoušeny jsou také nanoprotilátky nebo duální cytokinové inhibitory ve snaze zesílit účinnost biologické léčby. Spondyloartritidy stále patří mezi nevyléčitelné nemoci, stejně jako mnoho dalších imunitně podmíněných onemocnění, jejichž léčba musí být trvalá, protože její ukončení je ve většině případů doprovázeno relapsem. V některých případech ani stávající moderní léčba nemá potřebný účinek, a proto je nutný další výzkum nových léků a také snaha o objevení možných preventivních opatření.
Poděkování: Tato práce byla podpořena projektem Ministerstva zdravotnictví ČR pro koncepční rozvoj výzkumné organizace 023728.
Zdroje
1. Dougados M, Baeten D. Spondyloarthritis. Lancet 2011;377(9783): 2127–37.
2. Bakland G, Nossent HC. Epidemiology of spondyloarthritis: a review. Curr Rheumatol Rep 2013;15(9):351.
3. Šenolt L, Mann H. Axiální spondyloartritida. Practicus 2015;14(4):19–25.
4. Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023;82(1):19–34.
5. Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020;79(6):700–712.
6. Coates LC, Soriano ER, Corp N, et al.; GRAPPA Treatment Recommendations domain subcommittees. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 2022;18(8):465–479.
7. Braun J, Bollow M, Neure L, et al. Use of immunohistologic and in situ hybridization techniques in the examination of sacroiliac joint biopsy specimens from patients with ankylosing spondylitis. Arthritis Rheum 1995;38(4):499–505.
8. Partsch G, Steiner G, Leeb BF, et al. Highly increased levels of tumor necrosis factor-alpha and other proinflammatory cytokines in psoriatic arthritis synovial fluid. J Rheumatol 1997;24(3):518–23.
9. Ørnbjerg LM, Linde L, Georgiadis S, et al. Predictors of ASDAS-CRP inactive disease in axial spondyloarthritis during treatment with TNF-inhibitors: Data from the EuroSpA collaboration. Semin Arthritis Rheum 2022;56 : 152081. doi: 10.1016/j.semarthrit.2022.152081. Epub 2022 Aug 10.
10. Nabi H, Georgiadis S, Loft AG, et al. Comparative effectiveness of two adalimumab biosimilars in 1318 real-world patients with inflammatory rheumatic disease mandated to switch from originator adalimumab: nationwide observational study emulating a randomised clinical trial. Ann Rheum Dis 2021;80(11):1400–1409.
11. Danve A, Deodhar A. Treatment of axial spondyloarthritis: an update. Nat Rev Rheumatol 2022;18(4):205–216.
12. Michielsens CA, den Broeder N, van den Hoogen FH, et al. Treat-to-target dose reduction and withdrawal strategy of TNF inhibitors in psoriatic arthritis and axial spondyloarthritis: a randomised controlled non-inferiority trial. Ann Rheum Dis 2022;81(10):1392–1399.
13. Appel H, Maier R, Wu P, et al. Analysis of IL-17(+) cells in facet joints of patients with spondyloarthritis suggests that the innate immune pathway might be of greater relevance than the Th17-mediated adaptive immune response. Arthritis Res Ther 2011;13(3):R95.
14. Menon B, Gullick NJ, Walter GJ, et al. Interleukin-17+CD8+ T cells are enriched in the joints of patients with psoriatic arthritis and correlate with disease activity and joint damage progression. Arthritis Rheumatol 2014;66(5):1272–81.
15. Torgutalp M, Poddubnyy D. IL-17 inhibition in axial spondyloarthritis: current and future perspectives. Expert Opin Biol Ther 2019;19(7):631–641.
16. McInnes IB, Behrens F, Mease PJ, et al.; EXCEED Study Group. Secukinumab versus adalimumab for treatment of active psoriatic arthritis (EXCEED): a double-blind, parallel-group, randomised, active-controlled, phase 3b trial. Lancet 2020;395(10235):1496–1505.
17. Mease PJ, Smolen JS, Behrens F, et al.; SPIRIT H2H study group. A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological - naïve patients with active psoriatic arthritis: 24-week results of a randomised, open-label, blinded-assessor trial. Ann Rheum Dis 2020;79(1):123–131.
18. Baeten D, Adamopoulos IE. IL-23 Inhibition in ankylosing spondylitis: Where did it go wrong? Front Immunol 2021;11 : 623874.
19. Yang K, Oak ASW, Elewski BE. Use of IL-23 inhibitors for the treatment of plaque psoriasis and psoriatic arthritis: a comprehensive review. Am J Clin Dermatol 2021;22(2):173–192.
20. Hutton J, Mease P, Jadon D. Horizon scan: State-of-the-art therapeutics for psoriatic arthritis. Best Pract Res Clin Rheumatol 2022 Dec 23 : 101809. doi: 10.1016/j.berh.2022.101809. Epub ahead of print.
21. Šenolt L. Využití JAK inhibitorů v léčbě axiální spondyloartritidy. Vnitr Lek 2023; přijat k publikaci.
22. Filková M. Postavení inhibitorů Janusových kináz v revmatologii. Svět praktické medicíny 2023;2 : 25–30.
23. Keeling S, Maksymowych WP. JAK inhibitors, psoriatic arthritis, and axial spondyloarthritis: a critical review of clinical trials. Expert Rev Clin Immunol 2021;17(7):701–715.
24. Hromadová D, Elewaut D, Inman RD, et al. From science to success? Targeting tyrosine kinase 2 in spondyloarthritis and related chronic inflammatory diseases. Front Genet 2021;12 : 685280.
25. Martin G. Novel therapies in plaque psoriasis: a review of tyrosine kinase 2 inhibitors. Dermatol Ther (Heidelb) 2023;13(2):417–435.
26. Phillips R. Bimekizumab safe and effective for AS and PsA in long-term trials. Nat Rev Rheumatol 2022;18(9):494.
27. ClinicalTrials.gov Identifier: NCT05071664.
28. Sepriano A, Kerschbaumer A, Smolen JS, et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2019 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 2020;79(6):760–770.
29. Kerschbaumer A, Smolen JS, Dougados M, et al. Pharmacological treatment of psoriatic arthritis: a systematic literature research for the 2019 update of the EULAR recommendations for the management of psoriatic arthritis. Ann Rheum Dis 2020;79(6):778–786.
30. Evangelatos G, Fragoulis GE. JAK inhibitors, cardiovascular and thromboembolic events: what we know and what we would like to know. Clin Rheumatol 2023;42(3):959–962.
31. Bittar M, Mease P. Novel therapies in axial spondyloarthritis. Best Pract Res Clin Rheumatol 2022 Dec 22 : 101811. doi: 10.1016/j.berh.2022.101811. Epub ahead of print.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovo
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2023 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář k článku Infekce související se zdravotní péčí: nejlepší postupy pro prevenci
- Komentář k článku Infekce související se zdravotní péčí: nejlepší postupy pro prevenci
- Novinky v léčbě spondyloartritid
- Postavení inhibitorů Janusových kináz v revmatologii
- „Malé molekuly“ v terapii idiopatických střevních zánětů
- Očkování pacientů s idiopatickými střevními záněty
- Posunutí screeningových programů na 45 let věku bude do budoucna velmi efektivní
- Využití inhibice interleukinu-6 v léčbě obrovskobuněčné arteriitidy
- Současné možnosti léčby závažné psoriázy
- Mezenchymální kmenové buňky v léčbě píštělových traktů u PACD
- Léčba monogenních syndromů periodických teplot se zaměřením na využití inhibice IL-1
- Biosimilars a jejich záměna z pohledu farmakologie
- Cesta pacienta k onkologické diagnostice a léčbě
- Léčba esenciální hypertenze – rilmenidin
- Nové registrace na evropském poli
- Intervence kardiovaskulárního rizika vyžaduje změnu strategie
- Diagnostika a léčba obezity napříč specializacemi – tělovýchovné lékařství (2. část)
- Znalostní test: 2 kredity ČLK
- Infekce související se zdravotní péčí: nejlepší postupy pro prevenci
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba esenciální hypertenze – rilmenidin
- Mezenchymální kmenové buňky v léčbě píštělových traktů u PACD
- „Malé molekuly“ v terapii idiopatických střevních zánětů
- Infekce související se zdravotní péčí: nejlepší postupy pro prevenci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



