-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaÚloha neutrofilov a neutrofilných extracelulárnych pascí pri renálnych ochoreniach bakteriálneho pôvodu
The role of neutrophils and neutrophil extracellular traps in renal diseases of bacterial origin
Neutrophils are a central component of the innate immune system. In recent years, neutrophils have gained considerable attention due to their newly discovered biological effector functions and their involvement in various pathological conditions. Neutrophils represent the first line of the immune system defense and act as a physical and chemical barrier against pathogens. Activated neutrophils can release contents – decondensed chromatin along with antimicrobial granular proteins creating neutrophil extracellular traps (NETs). The NET formation is triggered by the contact with various pro-inflammatory stimuli, including microorganisms, cytokines, immune complexes, and others. Currently, we know two basic mechanisms of NET formation. The classical way is one of the forms of programmed cell death dependent on NADPH-oxidase; it is the best described mechanism. The second way of NET formation is characterized by a rapid cellular response to an external stimulus, whereby the trap is released without breaking the cell membrane, so that the neutrophil is not killed. While NETs are very effective at eliminating pathogens, they can also cause serious damage if released in excess or removed inefficiently. This review provides a simple and comprehensible view of the role of neutrophils and the mechanism of NET formation depending on various stimuli, and also summarizes the current knowledge on the role of NETs in the pathophysiology of urinary tract infections and hemolytic uremic syndrome induced by E. coli infection.
Keywords:
inflammation – Urinary tract infections – innate immunity – STEC-HUS – kidney injury
Autoři: Krivošíková Katarína 1; Tóthová Ubomíra 2; Kovalčíková Gaál Alexandra 1,2; Podracká Udmila 1
Působiště autorů: Detská klinika, Lekárska fakulta Univerzity Komenského a Národného ústavu detských chorôb, Bratislava 1; Ústav molekulárnej biomedicíny, Lekárska fakulta Univerzity Komenského, Bratislava 2
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (4): 231-237.
Kategorie: Přehledový článek
doi: https://doi.org/10.55095/CSPediatrie2023/040Souhrn
Neutrofily sú centrálnou zložkou vrodeného imunitného systému. V posledných rokoch si získali značnú pozornosť vďaka novoobjaveným biologickým efektorovým funkciám a ich zapojeniu do rôznych patologických stavov. Neutrofily predstavujú prvú líniu obrany imunitného systému a pôsobia ako fyzická a chemická bariéra proti patogénom. Aktivované neutrofily môžu okrem iného uvoľňovať svoj obsah – dekondenzovaný chromatín spolu s antimikrobiálnymi granulárnymi proteínmi, a vytvárať tak tzv. neutrofilové extracelulárne pasce (neutrophil extracellular traps – NETs). Tvorba NETov sa spúšťa kontaktom s rôznymi prozápalovými stimulmi, vrátane mikroorganizmov, cytokínov, imunitných komplexov a iných. V súčasnosti sú popísané dva základné mechanizmy tvorby NETov. Klasický spôsob je jednou z foriem programovanej bunkovej smrti závislým od NADPH-oxidázy, pričom je najlepšie preskúmaným mechanizmom. Druhý spôsob tvorby NETov charakterizuje rapídna bunková odpoveď na vonkajší stimul, pričom pasca sa uvoľní bez porušenia bunkovej membrány, takže nedochádza k usmrteniu neutrofilu. Zatiaľ čo NETy sú veľmi účinné pri eliminácii patogénov, môžu tiež spôsobiť vážne poškodenie, ak sa uvoľnia v nadmernom množstve alebo ich odstraňovanie nie je efektívne. Cieľom tohto článku je sprostredkovať pohľad na úlohu neutrofilov a spôsob tvorby NETov v závislosti od rôznych stimulov. Tiež sumarizuje súčasné poznatky o úlohe NETov v patofyziológii infekcií močových ciest a hemolyticko-uremického syndrómu indukovaného infekciou E. coli.
Klíčová slova:
zápal – vrodená imunita – STEC-HUS – infekcie močových ciest – poškodenie obličiek
ÚVOD
Neutrofily sú hlavnými efektormi vrodenej imunitnej odpovede a prvé špecifické bunky, ktoré migrujú do miesta zápalu, rozpoznávajú a zneškodňujú široké spektrum mikrobiálnych patogénov.(1) Na sprostredkovanie dôležitých patofyziologických funkcií v organizme využívajú základné mechanizmy zahrňujúce fagocytózu, tvorbu cytokínov, reaktívnych kyslíkových radikálov, degradáciu proteolytickými enzýmami či uvoľňovanie granulovaných antimikrobiálnych peptidov.(1,2) Neutrofily však môžu napádať a eliminovať patogény aj priamo, „vystreľovaním“ neutrofilných extracelulárnych pascí (NETy).(3) Presná regulácia formovania NETov je nevyhnutná pre udržanie homeostatickej rovnováhy v tele. V ostatných rokoch sa výskum upriamuje na neutrofily a ich význam v patogenéze a progresii mnohých ochorení obličiek.(4–6) Imunopatologické mechanizmy nefropatií sú rôznorodé, zahŕňajúce aktiváciu a migráciu imunitných buniek, dysreguláciu zápalových mediátorov, aktiváciu komplementu, ako aj tvorbu autoprotilátok a imunitných komplexov.(6,7) Reparačné mechanizmy po imunitne sprostredkovanom poškodení renálneho tkaniva môžu viesť k fibróze a v konečnom dôsledku k poklesu a strate obličkových funkcií.(8) V nasledujúcom prehľade bližšie predstavíme unikátnu úlohu neutrofilov pri tvorbe a uvoľňovaní extracelulárnych pascí a ich miesto v patogenéze vybraných ochorení obličiek vyvolaných infekčným agens. Vrodená imunita a neutrofily v odpovedi na bakteriálnu infekciu Vrodený imunitný systém sa skladá z mnohých zložiek, ktoré sa spolupodieľajú na antimikrobiálnej obrane. Tieto zložky zahŕňajú fyzikálne bariéry, mukózne sekréty, antimikrobiálne peptidy, v krvi prítomné voľne vylučované antimikrobiálne proteíny, intersticiálnu tekutinu či fagocytujúce leukocyty, vrátane neutrofilov. Vrodená imunitná odpoveď predstavuje prvú líniu obrany proti bakteriálnym infekciám. Dominantnú úlohu pri spustení tejto odpovede má rozpoznávanie infekčného agens mechanizmami vrodenej imunity v kontexte s jedinečnými vlastnosťami mikroorganizmu a hostiteľa.(9)
Neutrofily sú prevládajúcou subpopuláciou cirkulujúcich leukocytov (40–70 %) a pri infekcii sú to prvé bunky imunitného systému v mieste zápalu, kde buď priamo a/alebo prostredníctvom cytokínov a chemokínov modulujú aktivitu ďalších imunitných buniek.(10) Počas infekcie alebo pri poškodení tkaniva sa v prostredí nachádzajú s patogénom asociované molekulárne vzory (PA MP) a/alebo s poškodením asociované molekulárne vzory (DAMP), ktoré slúžia ako ligandy pre receptory rozpoznávania vzorov (PRR) a DAMP receptory neutrofilov. Výsledkom biologickej interakcie je aktivácia rezidentných makrofágov a mastocytov(11) a opätovná tvorba zápalových mediátorov, ako sú chemokíny CXCL1 a CXCL2, ktoré stimulujú na povrchu neutrofilov receptory spojené s G-proteínom (GPCR).(12) DAMP a PA MP môžu aj priamo aktivovať receptory lokalizované na neutrofiloch, čo vedie k ich ďalšej migrácii do miesta zápalu.(13) Neutrofily disponujú účinnými antimikrobiálnymi „zbraňami“, ktoré zahŕňajú antimikrobiálne peptidy (napr. laktoferín, α-defenzíny a katelicidín LL-37, tiež známe ako ľudské neutrofilné peptidy), proteolytické enzýmy, cytokíny a reaktívne formy kyslíka (ROS).(1,14) Pri antimikrobiálnej ochrane využívajú viaceré mechanizmy: fagocytózou zabíjajú invazívne patogény a bránia ich šíreniu; uvoľňujú toxické proteíny z azurofilných (primárnych) granúl, špecifických (sekundárnych) granúl a želatinázových (terciárnych) granúl; alebo vychytávajú patogény pomocou extracelulárnych pascí, ktorých centrálnou zložkou je DNA (extracelulárna DNA – ecDNA) (obr. 1).
Obr. 1. Neutrofily – stimulácia, aktivácia, efektorové funkcie 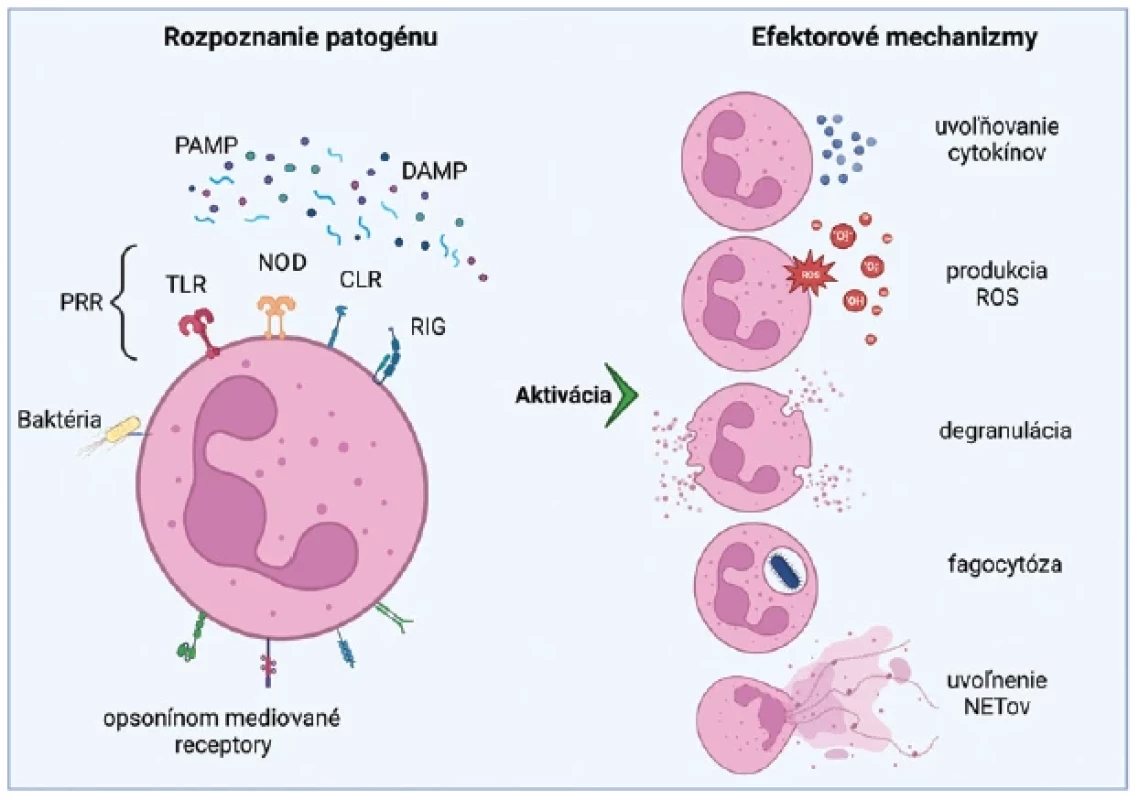
PA MP – s patogénom asociované molekulárne vzory, DAMP – s poškodením asociované molekulárne vzory, PRR – receptory rozpoznávania vzorov, TLR – Toll-like receptory, NOD – receptory pre oligomerizačné domény viažúce nukleotidy, CLR – lektínové receptory typu C, RIG – receptor podobný génu indukovateľnému kyselinou retinovou, ROS – reaktívne formy kyslíka, NET – neutrofilová extracelulárna pasca
Vyrobené pomocou Biorender.com.NEUTROFILNÉ EXTRACELULÁRNE PASCE
NETy sú sieťovité extracelulárne štruktúry pozostávajúce z dekondenzovaného chromatínu, histónov a antimikrobiálnych látok pochádzajúcich z neutrofilových granúl.(3) Molekuly s antimikrobiálnym účinkom sú v týchto štruktúrach výrazne koncentrované, čím napomáhajú eliminácii patogénov a bránia ich šíreniu do okolia. K najvýznamnejším molekulám patrí neutrofilová elastáza, myeloperoxidáza, katelicidín, katepsín G, pentraxín 3, želatináza, proteináza 3 či proteíny viažuce peptidoglykán.(14,15) Po aktivácii neutrofilu dochádza k dekondenzácii chromatínu a tvorbe komplexov s granulárnymi proteínmi, ktoré bunka následne vypudzuje do extracelulárneho priestoru. Hoci boli extracelulárne pasce prvýkrát opísané v neutrofiloch a myslelo sa, že fungujú ako „pasca“ na zabíjanie inváznych mikroorganizmov, najnovšie vedecké práce preukázali, že pasce môžu vytvárať aj iné typy granulocytov.(16) Eozinofilné extracelulárne pasce sa podieľajú na ochrane pred parazitmi a plnia úlohu pri alergickej reakcii.(17) Bazofily môžu tiež externalizovať chromatín a zabíjať baktérie pri deficite fagocytárnej aktivity.(18) Aj mastocyty tvorbou pascí prispievajú k obrane proti niektorým patogénom.(19) Extracelulárne pasce môžu tvoriť aj monocyty alebo makrofágy.(20) Zdá sa, že tento proces funguje ako alternatívny obranný mechanizmus, ktorý sa aktivuje, pokiaľ nie je dostatočná bunková fagocytárna kapacita.(21)
Tvorba NETov sa spúšťa kontaktom s rôznymi prozápalovými stimulmi. Patria sem PA MP molekuly odvodené od bakteriálnych, hubových, vírusových alebo mikrobiálnych patogénov, napr. lipopolysacharid (LPS) alebo N-formylované chemotaktické oligopeptidy. Ďalšiu skupinu tvoria DAMP molekuly zahrňujúce intracelulárne proteíny a proteíny extracelulárnej matrix uvoľnené zo „stresovaných“ alebo umierajúcich buniek.(22) Pri tvorbe NETov sa kontaktom PRR receptorov s patogénnymi mikroorganizmami, imunitnými komplexmi, cytokínmi a/alebo mitogénmi, vrátane forbol - -12-myristát-13-acetátu (PMA), spúšťajú signálne dráhy aktivovaných proteínkináz (MAPK), ktoré indukujú tvorbu ROS. Následne, peptidyl-arginín-deimináza typu 4 (PAD 4) a granulované enzýmy (neutrofilová elastáza a myeloperoxidáza) modifikujú históny a dekondenzujú chromatín.(23) Citrulinizácia enzýmom PAD 4 a enzymatická degradácia histónov destabilizuje štruktúru chromatínu, praská jadrová a bunková membrána a dekondenzovaný chromatín sa dostáva do extracelulárneho priestoru.(24) Tento typ tvorby NETov sa označuje ako „samovražedná NETóza“, ktorú na rozdiel od apoptózy sprevádza respiračné vzplanutie sprostredkované NADPH-oxidázou (NOX).(25)
Iný spôsob tvorby NETov tzv. vitálna NETóza je charakterizovaná okamžitou bunkovou odpoveďou na vonkajší stimul. Pri vitálnej NETóze sa z dekondenzovaného jadra tvoria vezikuly obsahujúce jadrovú DNA (nDNA), ktoré sa transportujú k bunkovej membráne. Vezikuly sa s bunkovou membránou následne spájajú a vypudzujú NETy von z bunky bez porušenia integrity samotného neutrofilu.(26) Je pozoruhodné, že v procese vitálnej NETózy sa z neutrofilov stávajú anukleárne cytoplasty, ktoré sú stále pohyblivé a dokážu vnímať chemotaktické gradienty.(27) K vitálnemu spôsobu generovania NETov, ktorý je závislý od ROS, dochádza aj pri aktivácii neutrofilov faktorom stimulujúcim kolónie granulocytov/ makrofágov (GM-CSF). V tomto prípade sa po následnom kontakte s LPS alebo s komplementovým faktorom 5a uvoľňujú NETy výlučne odvodené z mitochondriálnej DNA (mtDNA) (obr. 2).(28)
Obr. 2. Samovražedná vs. vitálna tvorba NETov 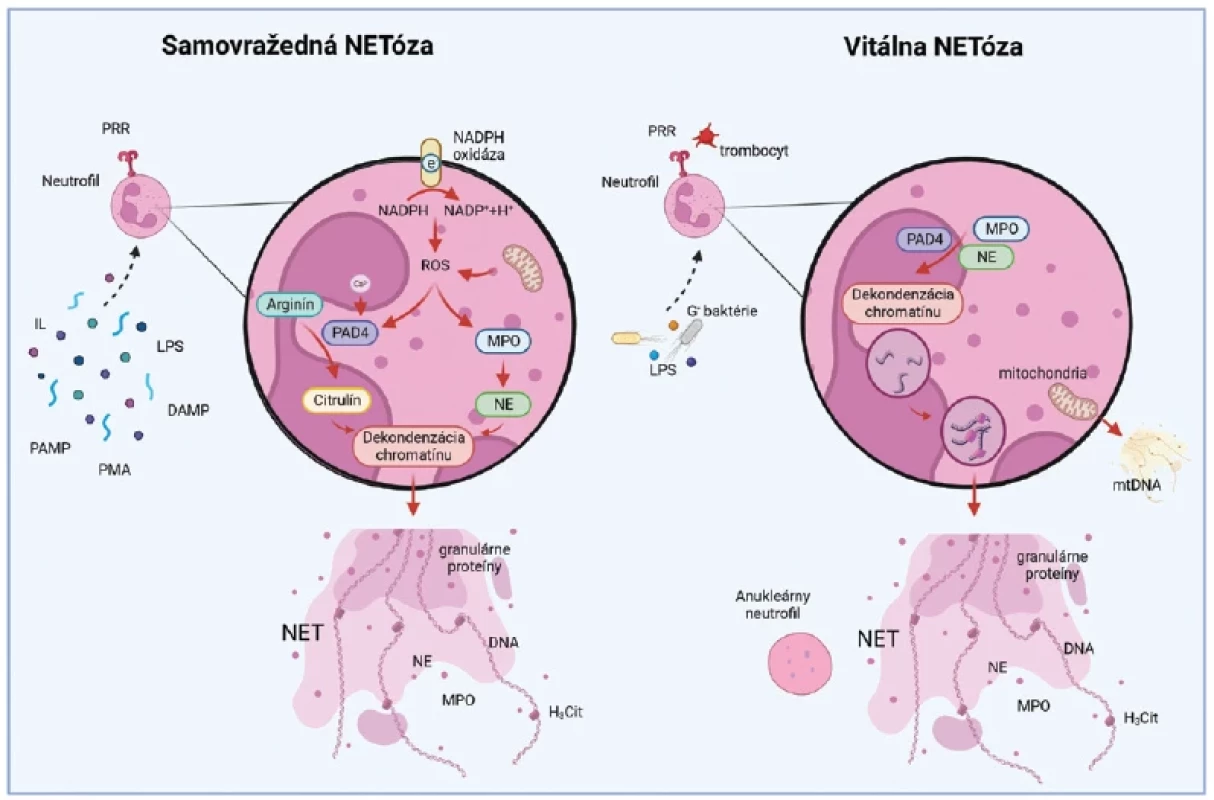
PA MP – s patogénom asociované molekulárne vzory, DAMP – s poškodením asociované molekulárne vzory, PRR – receptory rozpoznávania vzorov, IL – interleukíny, LPS – lipopolysacharid, PMA – forbol-12-myristát-13-acetát, NADPH – nikotínamidadeníndinukleotidfosfát, ROS – reaktívne formy kyslíka, PAD 4 – peptidyl-arginín-deimináza typu 4, MPO – myeloperoxidáza, NE – neutrofilová elastáza, DNA – deoxyribonukleová kyselina, mtDNA – mitochondriálna DNA, H2Cit – citrulinovaný histón, NET – neutrofilová extracelulárna pasca
Vyrobené pomocou Biorender.comVzhľadom na rozdiely medzi mtDNA a nDNA vo veľkosti a štruktúre môžeme predpokladať, že NETy odvodené z ktoréhokoľvek zdroja sa môžu líšiť vo svojom štrukturálnom zložení, a teda aj vo svojej funkcii. V súčasnosti teda nie je úplne jasné, či a ako tieto rôzne typy NETov koexistujú a aké odlišné funkcie vykonávajú. Je potrebné zdôrazniť, že taktiež stále neexistuje jednotný konsenzus o presnom slede udalostí vedúcich k tvorbe NETov a bunkovej smrti,(12) a preto ďalšie štúdium týchto procesov je potrebné. Dôležitú úlohu NETov pri renálnych ochoreniach bakteriálneho pôvodu opísaných v nasledujúcich častiach však podporuje množstvo dôkazov publikovaných rôznymi výskumnými skupinami.
NETY PRI INFEKCIÁCH MOČOVÝCH CIEST
Infekcie močových ciest (IMC) sa prejavujú nešpecifickými klinickými príznakmi, od asymptomatického priebehu až po febrilný stav s urosepsou. Obavy klinikov vyvoláva najmä tvorba renálnych jaziev, ktoré sa vyvinú u približne 18–22 % detí po prvom ataku IMC a až u 50 % detí s febrilnými alebo opakovanými IMC.(29–31) Najčastejším vyvolávateľom je uropatogénna Escherichia coli (UPEC), ktorá sa šíri v močovom trakte ascendentne.(32) Adhéziou P-fimbrií na glykoreceptory uroepitelu sa aktivujú Toll-like receptory (TLR), najmä TLR4, spúšťa sa imunitná odpoveď,(33) uvoľňujú sa transkripčné faktory, vrátane NF-κB a interferónového regulačného faktoru 3 (IRF3), a aktivujú sa neutrofily, ktoré tvoria cytokíny a chemokíny. Tieto patogenetické mechanizmy zodpovedajú za klinické prejavy IMC.(34,35)
Ako sme uviedli vyššie, NETy majú pozitívne účinky pri kontrole a potláčaní bakteriálnych infekcií. Vďaka širokým antimikrobiálnym vlastnostiam dokážu obmedziť rast bakteriálnych kolónií či baktérie eradikovať. Pri febrilných IMC sa v zápalovom tkanive hromadia početné aktivované neutrofily. Na povrchu infikovaných uroepitelových buniek sa exprimuje receptor viažuci chemokín CXCL8/IL8, ktorý má silné chemoatraktívne vlastnosti a uľahčuje migráciu neutrofilov do tkaniva.(35) Z uvedených mechanizmov možno predpokladať, že neutrofily ako rozhodujúce efektorové bunky vrodenej imunitnej odpovede reagujú na prítomnosť baktérií v močových cestách lokálnou tvorbou NETov (obr. 3). Avšak nedostatočná tvorba NETov alebo aberantná NETóza môže viesť k zápalovej a autoimunitnej patológii s poškodením vlastného tkaniva. K takýmto stavom dochádza ako aj pri nadprodukcii NETov, tak aj kvôli porušeniu mechanizmov ich eliminácie (napríklad pri absencii DNázy I).(36) V oboch týchto prípadoch môžu NETy slúžiť ako užitočný biomarker zápalu, poškodenia tkaniva a autoimunity, preto je regulácia týchto mechanizmov kľúčová. Moreira a kol. zistili, že chorí s IMC majú vyššie koncentrácie ecDNA v moči ako zdraví jedinci.(37) Keďže ďalšie komponenty NETov sa v tejto štúdii nevyšetrovali, pôvod močovej ecDNA sa nedá exaktne potvrdiť. Je pravdepodobné, že časť celkovej ecDNA je bakteriálneho pôvodu. Taktiež obličky prefiltrujú menšie množstvo ecDNA z plazmy do moču, ktoré ale predstavuje len malý zdroj z celkového klírensu ecDNA v systémovom obehu.(38) Možno však predpokladať, že infekcia zapríčiní nekrózu buniek v močových cestách, z ktorých sa uvoľňuje DNA do moču. Ďalším zdrojom môže byť aktívne vylúčená DNA z neutrofilov stimulovaných infekciou, čo podporuje korelácia medzi koncentráciou ecDNA a počtom neutrofilov v moči.(37) Zaujímavé je, že až o dekádu neskôr sa v detailne dizajnovanej štúdii dokázala tvorba NETov ako odpoveď na IMC.(39) Vo vzorkách moču sa detegovali fragmenty DNA a proteóm obohatený o históny a obsah azurofilných granúl, ktoré kvalitatívnym zložením korešpondovali s in vitro vytvorenými NETmi. Prostredníctvom imunofluorescenčnej mikroskopie bola potvrdená prítomnosť neutrofilov s dekondenzovaným chromatínom, zvyšky granúl na periférii bunky, myeloperoxidáza a ecDNA. Jadrovým farbením boli identifikované v týchto štruktúrach usmrtené bakteriálne bunky.(40) Aj v našej klinickej štúdií sme zistili signifikantne vyššie koncentrácie ecDNA v moči u detí s IMC oproti zdravým deťom, ktoré pozitívne korelovali so stupňom zápalu a leukocytúriou.(41) Navyše, koncentrácie ecDNA korelovali so stanovenými nadmernými koncentráciami myeloperoxidázy a katelicidínu v moči, ktoré tvoria štrukturálne zložky NETov.(41) Súčasťou štúdie bol aj animálny experiment s využitím PAD 4 deficientných myší, u ktorých sme fluorescenčnou mikroskopiou potvrdili zníženú schopnosť tvorby NETov in vitro. Zároveň tieto myši mali vyššiu nálož baktérií v obličkovom tkanive, čo naznačuje, že tvorba NETov neprebieha len v dôsledku IMC, ale môže byť priamo zapojená do patomechanizmu IMC.(41)
Obr. 3. Tvorba NETov ako odpoveď na infekciu močových ciest 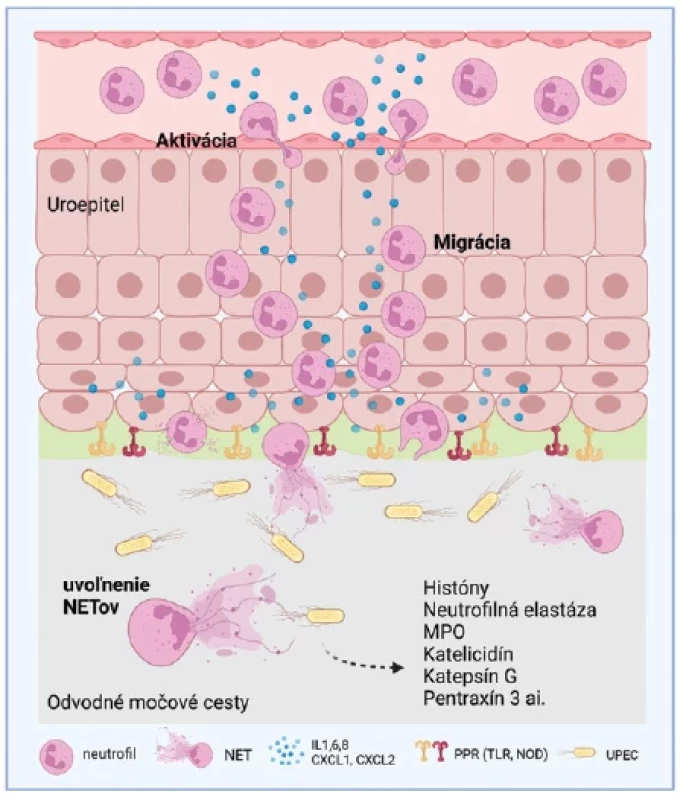
NET – neutrofilová extracelulárna pasca, IL – interleukín, PRR – receptory rozpoznávania vzorov, TLR – Toll like receptory, NOD – receptory pre oligomerizačné domény viažúce nukleotidy, UPEC – uropatogénna Escherichia coli
Vyrobené pomocou Biorender.com.Štúdium tvorby NETov a ich významu pri infekciách močových ciest je v súčasnosti len na začiatku a poskytuje priestor pre ďalší výskum a potenciálne klinické možnosti jeho využitia. Doteraz publikované štúdie boli zamerané na sledovanie produkcie NETov, resp. ich jednotlivých zložiek v moči. Chýbajú ale štúdie, ktoré by sa bližšie zaoberali týmito procesmi v postihnutých tkanivách aj na molekulárnej úrovni a ich dopadom na celý organizmus. Lepšie pochopenie aktivácie a regulácie tvorby NETov, signálnych dráh či toxicity NETov prinesie dokonalejší obraz o chorobných procesoch a obranných mechanizmoch v obličkách a močových cestách. V konečnom dôsledku by toto pochopenie mohlo pomôcť vývoju nových možností terapeutickej intervencie, využitiu jednotlivých komponentov NETov ako neinvazívnych biomarkerov IMC či vytvoreniu stratégií manažmentu týchto infekcií.
NETY PRI HEMOLYTICKO-UREMICKOM SYNDRÓME
Infekcia Shiga toxín (Stx) produkujúcou Escherichiou coli predstavuje najčastejšiu príčinu „typického“ hemolyticko - -uremického syndrómu (STEC-HUS), ktorý patrí do etiopatogeneticky heterogénnej skupiny trombotických mikroangiopatií.( 42) Charakterizovaný je trombocytopéniou, imunitne nepodmienenou hemolytickou anémiou a akútnym poškodením obličiek.(43) Stx, hlavný patogénny faktor STEC, tvorí jedna podjednotka A, ktorá má aktivitu N-glykozidázy na 28S ribozomálnej RNA. Vďaka tomu dochádza k inhibícii syntézy proteínov v eukaryotických bunkách. Toxín tvorí aj 5 podjednotiek B (pentamér), ktoré sa viažu na globotriaozylceramid na povrchu hostiteľských buniek.(44) Stx po uvoľnení z baktérií v čreve vstupuje do krvného obehu a napáda endotel v kapilárach glomerulov. Viaceré štúdie preukázali, že interakcia Stx s neutrofilmi vedie k ich aktivácii s lokálnou zápalovou reakciou a poškodením endotelu.( 44–47) Navyše, Stx priamo stimuluje neutrofily k tvorbe ROS a rôznych aktivačných látok, vedie k degranulácii, ale aj k uvoľňovaniu NETov, čím prispieva k amplifikácii mikrovaskulárneho poškodenia v obličkách.(47,48)
Klinické štúdie zistili, že pacienti so STEC-HUS majú v porovnaní so zdravými jedincami vyššie plazmatické koncentrácie cirkulujúcej ecDNA a nukleozómov. Neutrofily týchto pacientov sú náchylnejšie na spontánne uvoľnenie NETov.(47) Tiež sa zistilo, že aj nedostatočná degradácia NETov a ich pretrvávanie v milieu môže prispievať k ďalšiemu poškodeniu obličiek v dôsledku protrombotických vlastností NETov.(49) NETy stimulujú tvorbu protrombotického tkanivového faktora, ktorý aktivuje koaguláciu a môže slúžiť ako „sieť“ na zachytávanie krvných doštičiek.(50) Okrem toho, NETy aktivujú komplement a prostredníctvom Stx indukujú vychytávanie C3b v glomeruloch a na krvných doštičkách, čo podporuje mikrovaskulárnu trombózu a ďalšie poškodenie obličiek.(51–53) Poškodenie endotelu s tvorbou mikrotrombov (mikroangiopatia) je hlavnou príčinou zlyhania obličiek u pacientov so STEC-HUS.(54) V nedávnej experimentálnej štúdii na myšacom modeli HUS sa znížil stupeň endotelovej dysfunkcie, keď sa narušila tvorba NETov alebo sa vyčerpali krvné doštičky z okolitého tkaniva.(55) To naznačuje, že tvorbu NETov pri STEC-HUS podporujú okrem Stx aj trombocyty, a tak významne prispievajú k endotelovej „toxicite“. Uvedené výsledky po prvýkrát zdokumentovali kľúčovú úlohu trombocytov ako modulátorov poškodenia endotelu prostredníctvom tvorby NETov v reakcii na Stx. Tieto závery prinášajú nový pohľad na potenciálnu liečbu cielenú na zníženie tvorby NETov, a tým zmiernenie poškodenia endotelu pri HUS.
ZÁVER
NETy sú sieťovité štruktúry s vysokou lokálnou koncentráciou veľmi aktívnych antimikrobiálnych molekúl. Silná intermolekulárna väzba zabraňuje jednotlivým zložkám prestupovať do okolitého prostredia, čím sa obmedzuje poškodenie tkaniva. Ak však nie je množstvo a miesto tvorby NETov, ako aj ich včasné odstránenie prísne kontrolované, môže prevaha NETov spôsobiť vážne následky a indukovať mnohé patofyziologické procesy. Spôsoby tvorby NETov sa intenzívne študujú, avšak mnohé otázky týkajúce sa týchto mechanizmov a fyziologickej úlohy pascí zostávajú otvorené. V prvom rade ide o signalizačné mechanizmy iniciácie tvorby NETov. Nie je jednoznačne definované, na základe akých podmienok dochádza k stimulácii jednotlivých procesov tvorby NETov; a tiež procesy vedúce k modifikácii a dekondenzácii chromatínu zostávajú nejasné. Preto je dôležité lepšie porozumieť rôznym signálnym dráham zúčastňujúcim sa na tvorbe NETov a mechanizmu ich účinku pri rôznych patologických stavoch, napr. ochorenia obličiek, a hľadať potenciálne nástroje na intervenciu. Medzi také dnes už napríklad patrí rekombinantná DNáza 1, ktorou možno znižovať viskozitu hlienu pri cystickej fibróze a zlepšovať funkciu pľúc.(56) Inhibítory NE sa zase používajú pri chronickej obštrukčnej chorobe pľúc.(57,58) PAD 4 je nadmerne exprimovaná pri väčšine onkologických ochorení,(59) pričom inhibítory tohto enzýmu by mohli zlepšiť klinický výsledok. Detailné pochopenie molekúl indukujúcich tvorbu NETov a mechanizmov ich degradácie môže úspešne modifikovať pozitívny ako aj patogénny potenciál NETov.
Obrázky publikovány se souhlasem majitele práv, společnosti BioRender Plan.
Poďakovanie
Táto práca bola vypracovaná s finančnou podporou projektom: VEGA č. 1/0212/22 Úloha extracelulárnej DNA a neutrofilových pascí pri infekciách močových ciest a APVV č. APVV-18-0287 Neinvazívne a predsa nevyužívané markery obličkových funkcií: problémy, príčiny a príležitosti
Korešpondenčná adresa:
prof. MUDr. Ľudmila Podracká, CSc.
Detská klinika LFUK a NUDCH
Limbova 1
83340 Bratislava
ludmila.podracka@nudch.euCes-slov Pediat 2023; 78(4): 231–237
Zdroje
1. Burn GL, Foti A, Marsman G, et al. The Neutrophil. Immunity 2021; 54 : 1377–1391.
2. Bardoel BW, Kenny EF, Sollberger G, Zychlinsky A. The balancing act of neutrophils. Cell Host Microbe 2014; 15 : 526–536.
3. Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science 2004; 303 : 1532–1535.
4. S alazar-Gonzalez H, Zepeda-Hernandez A, Melo Z, et al. Neutrophil extracellular traps in the establishment and progression of renal diseases. Medicina 2019; 55 : 431.
5. S epe V, Libetta C, Gregorini M, Rampino T. The innate immune system in human kidney inflammaging. J Nephrol 2022; 35 : 381–395.
6. T ecklenborg J, Clayton D, Siebert S, Coley SM. The role of the immune system in kidney disease. Clin Exp Immunol 2018; 192 : 142–150.
7. M astroianni-Kirsztajn G, Hornig N, Schlumberger W. Autoantibodies in renal diseases - clinical significance and recent developments in serological detection. Front Immunol 2015; 6 : 221.
8. M eng XM, Nikolic-Paterson DJ, Lan HY. Inflammatory processes in renal fibrosis. Nat Rev Nephrol 2014; 10 : 493–503.
9. K ubelkova K, Macela A. Innate immune recognition: an issue more complex than expected. Front Cell Infect Microbiol 2019; 9 : 241.
10. N auseef WM, Borregaard N. Neutrophils at work. Nat Immunol 2014; 15 : 602–611.
11. K obayashi SD, Malachowa N, DeLeo FR. Neutrophils and bacterial immune evasion. J Innate Immun 2018; 10 : 432–441.
12. K olaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol 2013; 13 : 159–175.
13. P ittman K, Kubes P. Damage-associated molecular patterns control neutrophil recruitment. J Innate Immun 2013; 5 : 315–323.
14. D ömer D, Walther T, Möller S, et al. Neutrophil extracellular traps activate proinflammatory functions of human neutrophils. Front Immunol 2021; 12 : 636954.
15. D elgado-Rizo V, Martínez-Guzmán MA, Iñiguez-Gutierrez L, et al. Neutrophil extracellular traps and its implications in inflammation: an overview. Front Immunol 2017; 8 : 81.
16. Vorobjeva NV. Neutrophil extracellular traps: new aspects. Moscow Univ Biol Sci Bull 2020; 75 : 173–188.
17. U eki S, Konno Y, Takeda M, et al. Eosinophil extracellular trap cell death - -derived DNA traps: Their presence in secretions and functional attributes. J Allergy Clin Immunol 2016; 137 : 258–267.
18. Y ousefi S, Morshed M, Amini P, et al. Basophils exhibit antibacterial activity through extracellular trap formation. Allergy 2015; 70 : 1184–1188.
19. von Köckritz-Blickwede M, Goldmann O, Thulin P, et al. Phagocytosis-independent antimicrobial activity of mast cells by means of extracellular trap formation. Blood 2008; 111 : 3070–3080.
20. L i L, Li X, Li G, et al. Mouse macrophages capture and kill Giardia lamblia by means of releasing extracellular trap. Dev Comp Immunol 2018; 88 : 206–212.
21. R awat S, Vrati S, Banerjee A. Neutrophils at the crossroads of acute viral infections and severity. Mol Aspects Med 2021; 81 : 100996.
22. T akeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell 2010; 140 : 805–820.
23. Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol 2018; 18 : 134–147.
24. N eubert E, Meyer D, Rocca F, et al. Chromatin swelling drives neutrophil extracellular trap release. Nat Commun 2018; 9 : 3767.
25. F uchs TA , Abed U, Goosmann C, et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol 2007; 176 : 231–241.
26. P ilsczek FH, Salina D, Poon KK, et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. J Immunol 2010; 185 : 7413–7425.
27. Y ipp BG, Petri B, Salina D, et al. Infection-induced NETosis is a dynamic process involving neutrophil multitasking in vivo. Nat Med 2012; 18 : 1386 – 1393.
28. Y ousefi S, Mihalache C, Kozlowski E, et al. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death Differ 2009; 16 : 1438–1444.
29. Bandari B, Sindgikar SP, Kumar SS, et al. Renal scarring following urinary tract infections in children. Sudan J Paediatr 2019; 19 : 25–30.
30. S haikh N, Ewing AL, Bhatnagar S, Hoberman A. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics 2010; 126 : 1084–1091.
31. M asajtis-Zagajewska A, Nowicki M. New markers of urinary tract infection. Clin Chim Acta 2017; 471 : 286–291.
32. Ronald A. The etiology of urinary tract infection: traditional and emerging pathogens. Am J Med 2002; 113 (Suppl 1A): 14s–19s.
33. R agnarsdóttir B, Fischer H, Godaly G, et al. TLR - and CXCR1-dependent innate immunity: insights into the genetics of urinary tract infections. Eur J Clin Invest 2008; 38 (Suppl 2): 12–20.
34. R agnarsdóttir B, Svanborg C. Susceptibility to acute pyelonephritis or asymptomatic bacteriuria: host-pathogen interaction in urinary tract infections. Pediatr Nephrol 2012; 27 : 2017–2029.
35. Weichhart T, Haidinger M, Hörl WH, Säemann MD. Current concepts of molecular defence mechanisms operative during urinary tract infection. Eur J Clin Invest 2008; 38 Suppl 2 : 29–38.
36. Vorobjeva NV, Chernyak BV. NETosis: Molecular mechanisms, role in physiology and pathology. Biochemistry (Mosc) 2020; 85 : 1178–1190.
37. García Moreira V, Prieto García B, de la Cera Martínez T, Alvarez Menéndez FV. Elevated transrenal DNA (cell-free urine DNA) in patients with urinary tract infection compared to healthy controls. Clin Biochem 2009; 42 : 729–731.
38. C elec P, Vlková B, Lauková L, et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Rev Mol Med 2018; 20: e1.
39. Y u Y, Kwon K, Tsitrin T, et al. Characterization of early-phase neutrophil extracellular traps in urinary tract infections. PLoS Pathog 2017; 13: e1006151.
40. Y u Y, Sikorski P, Bowman-Gholston C, et al. Diagnosing inflammation and infection in the urinary system via proteomics. J Transl Med 2015; 13 : 111.
41. K rivošíková K, Šupčíková N, Gaál Kovalčíková A, et al. Neutrophil extracellular traps in urinary tract infection. Front Pediatr 2023; 11.
42. George JN, Nester CM. Syndromes of thrombotic microangiopathy. N Engl J Med 2014; 371 : 654–666.
43. T alarico V, Aloe M, Monzani A, et al. Hemolytic uremic syndrome in children. Minerva Pediatr 2016; 68 : 441–455.
44. S andvig K. Shiga toxins. Toxicon 2001; 39 : 1629–1635.
45. F ernandez GC, Lopez MF, Gomez SA, et al. Relevance of neutrophils in the murine model of haemolytic uraemic syndrome: mechanisms involved in Shiga toxin type 2-induced neutrophilia. Clin Exp Immunol 2006; 146 : 76–84.
46. L effler J, Prohászka Z, Mikes B, et al. Decreased neutrophil extracellular trap degradation in Shiga toxin-associated haemolytic uraemic syndrome. J Innate Immun 2017; 9 : 12–21.
47. R amos MV, Mejias MP, Sabbione F, et al. Induction of neutrophil extracellular traps in Shiga toxin-associated hemolytic uremic syndrome. J Innate Immun 2016; 8 : 400–411.
48. F eitz WJC, Suntharalingham S, Khan M, et al. Shiga toxin 2a induces NETosis via NOX-dependent pathway. Biomedicines 2021; 9.
49. F uchs TA , Brill A, Duerschmied D, et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A 2010; 107 : 15880–15885.
50. C lark SR, Ma AC, Tavener SA, et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nat Med 2007; 13 : 463–469.
51. Wang G, Ma N, Meng L, et al. Activation of the phosphatidylinositol 3-kinase/ Akt pathway is involved in lipocalin-2-promoted human pulmonary artery smooth muscle cell proliferation. Mol Cell Biochem 2015; 410 : 207–213.
52. L effler J, Martin M, Gullstrand B, et al. Neutrophil extracellular traps that are not degraded in systemic lupus erythematosus activate complement exacerbating the disease. J Immunol 2012; 188 : 3522–3531.
53. L ocatelli M, Buelli S, Pezzotta A, et al. Shiga toxin promotes podocyte injury in experimental hemolytic uremic syndrome via activation of the alternative pathway of complement. J Am Soc Nephrol 2014; 25 : 1786–1798.
54. Westra D, Volokhina EB, van der Molen RG, et al. Serological and genetic complement alterations in infection-induced and complement-mediated hemolytic uremic syndrome. Pediatr Nephrol 2017; 32 : 297–309.
55. L andoni VI, Pittaluga JR, Carestia A, et al. Neutrophil extracellular traps induced by Shiga toxin and lipopolysaccharide-treated platelets exacerbate endothelial cell damage. Front Cell Infect Microbiol 2022; 12 : 897019.
56. T erlizzi V, Castellani C, Taccetti G, Ferrari B. Dornase alfa in cystic fibrosis: indications, comparative studies and effects on lung clearance index. Ital J Pediatr 2022; 48 : 141.
57. K una P, Jenkins M, O’Brien CD, Fahy WA. AZD9668, a neutrophil elastase inhibitor, plus ongoing budesonide/formoterol in patients with COPD. Respir Med 2012; 106 : 531–539.
58. S hute JK, Calzetta L, Cardaci V, et al. Inhaled nebulised unfractionated heparin improves lung function in moderate to very severe COPD: A pilot study. Pulm Pharmacol Ther 2018; 48 : 88–96.
59. Zhu D, Lu Y, Wang Y, Wang Y. PAD 4 and its inhibitors in cancer progression and prognosis. Pharmaceutics 2022; 14.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Jindřich Štyrský: Člověk nesený větrem
- Co jsme psali
- Dopis redakci
- Editorial
- Periodické horečky, autoinflamatorní nemoci
- Spinálna muskulárna atrofia u novorodenca
- Využitie kontrastnej ultrasonografie v diagnostike hepatálnych tumorov u novorodencov
- Trendy v liečbe inguinálnej hernie u detí
- Distribuce tuku podle obvodu pasu a poměru pas/výška u českých sedmiletých dětí – projekt COSI 2016–2019
- Evaluácia programu sociálneho a emocionálneho učenia Zippyho kamaráti
- Úloha neutrofilov a neutrofilných extracelulárnych pascí pri renálnych ochoreniach bakteriálneho pôvodu
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periodické horečky, autoinflamatorní nemoci
- Trendy v liečbe inguinálnej hernie u detí
- Spinálna muskulárna atrofia u novorodenca
- Využitie kontrastnej ultrasonografie v diagnostike hepatálnych tumorov u novorodencov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



