-
Medical journals
- Career
Závěr života nemocných s nehodgkinským lymfomem, analýza souboru zemřelých během šesti let (2012–2017) na jednom pracovišti, integrace paliativní péče
Authors: R. Urbanová 1; R. Machová 1; R. Szotkowská 1; V. Procházka 1; M. Labudíková 1; M. Hošťálková 2; A. Hluší 1; T. Papajík 1; O. Sláma 3
Authors‘ workplace: Hemato-onkologická klinika Fakultní nemocnice Olomouc a Lékařská fakulta, Univerzita Palackého v Olomouci, Olomouc 1; Jsme blízko vám – Institut klinické pastorační péče, z. ú., Olomouc 2; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 3
Published in: Transfuze Hematol. dnes,26, 2020, No. 2, p. 113-123.
Category: Original Papers
Overview
Východiska: Přes úspěchy moderní hemato-onkologie zůstává nehodgkinský lymfom potenciálně život ohrožujícím onemocněním. Stárnoucí populace a prodlužující se přežití nemocných s hematologickou malignitou kladou zvyšující se nároky na zdravotní péči včetně rozhodování o typu léčby a péče. V hemato-onkologii se paliativní péče v literatuře i praxi diskutuje, a to s ohledem na obtíže při stanovení prognózy krevních onemocnění, vzhledem k současným možnostem mnoha linií léčby včetně léčby cílené, postojům samotných hematologů k léčbě, transfuzní závislosti nemocných a malým zkušenostem hospiců s péčí o hematologicky nemocné. Prací, které prokazují přínos paliativní péče u těchto nemocných, je ve srovnání s nemocnými se solidními tumory výrazně méně.
Metody: Analyzovali jsme posledních 6 měsíců, 3 a 1 měsíc života 72 léčených a zemřelých nemocných s nehodgkinským lymfomem na Hemato-onkologické klinice Fakultní nemocnice Olomouc v průběhu 6 let (2012–2017).
Výsledky: Místem úmrtí byla v 90 % nemocnice, přímo na HOK zemřelo 47 % nemocných. 43 % nemocných souboru zemřelo v průběhu kurativní léčby, 57 % zemřelo v průběhu léčby paliativní. 29 % úmrtí bylo v relapsu nemoci, 29 % úmrtí bylo ve stadiu refrakterity na chemoterapii, 27 % úmrtí bylo během léčby první linie. V posledním měsíci života dostávalo chemoterapii 25 (37 %) pacientů, 15 pacientů bylo v léčbě kurativní a 10 v léčbě paliativní. V posledních 7 dnech života bylo chemoterapií léčeno 5 (7 %) pacientů, všichni v léčbě kurativní. Medián počtu hospitalizací v posledních 6 měsících života byl 3 (rozmezí 0–7). Medián počtu dnů hospitalizace v posledních 6 měsících života byl 32 dnů (rozmezí 0–118), 25 dnů (rozmezí 0–90) v posledních 3 měsících života a 11 dnů (rozmezí 0–31) v posledním měsíci života. Medián celkového přežití zemřelých nemocných od stanovení diagnózy onemocnění byl 9,2 měsíce.
Závěr: Přes všechny úspěchy moderní hemato-onkologie zůstává nehodginský lymfom nadále potenciálně život ohrožujícím onemocněním, jeho léčba je spojena s výraznou symptomovou zátěží a intenzivní léčbou na konci života. Část nemocných dostává na konci života chemoterapii, častá je potřeba hospitalizací, část pacientů v přímém důsledku onemocnění nebo jeho komplikací umírá, nejčastěji v nemocnici. Domníváme se, že součástí komplexní péče o nemocné s nehodgkinskými lymfomy by vedle moderní protinádorové terapie měla být také paliativní péče, a to jak terminální péče (end-of-life care), tak časná paliativní péče.
Klíčová slova:
hematoonkologie – nehodgkinský lymfom – integrace paliativní péče – End of life care
Úvod
Incidence i prevalence nehodgkinského lymfomu (NHL) v České republice roste. Podle publikovaných údajů Ústavu zdravotnických informací a statistiky České republiky (ÚZIS) byla v letech 2011–2015 incidence nově diagnostikovaných NHL 14 nemocných na 100 000 obyvatel, s mediánem věku 67 let. NHL je potenciálně život ohrožující onemocnění. Péče o narůstající počty nemocných je náročná po stránce organizační i finanční.
Paliativní péče je podle definice Světové zdravotnické organizace z roku 2002 komplexní, multidisciplinární péče směřující k udržení či zvýšení kvality života nemocných s nevyléčitelnou, život ohrožující chorobou nebo souborem chorob. Nabízí podporu nemocným, ale i jejich blízkým. Zabývá se včasným vyhledáváním a léčbou závažných symptomů – tělesných, psychických, sociálních a spirituálních. Paliativní péče může být poskytována v různých fázích nemoci, nejefektivnější se ukazuje její poskytování v závěru života, jako tzv. péče na konci života (end-of-life-care, EoLC), která se týká zdravotní péče nejen v posledních hodinách a dnech života, ale obecněji v terminální fázi nemoci, která se stala pokročilou, progresivní a nevyléčitelnou. Zabývá se etikou a účinností prováděných lékařských zákroků, práv nemocných na rozhodování a také přidělováním zdrojů v nemocnicích a systémech zdravotní péče. Pokud je paliativní péče poskytována současně s kurativní léčbou (model tzv. časné integrace paliativní péče), pak může znamenat významný přínos pro nemocné, pečovatele a zdravotní systém [1]. Několik kontrolovaných randomizovaných studií provedených u solidních nádorů potvrzuje její efekt na kvalitu života a zvládání symptomů nemoci [2, 3], lepší pochopení prognózy nemoci [4], redukci užívání náročné chemoterapie v posledních týdnech života a obecně užívání méně agresivní péče na konci života [5, 6]. V souvislosti s tím je popsáno i prodloužení přežití onkologicky nemocných [7]. Jsou totiž důkazy o tom, že horší kvalita života a depresivní nálada zkracují přežití nemocných [8–10]. Pacienti pak častěji využili péči hospicovou a byli více spokojeni s péčí na konci života, lépe na tom byly rodiny [4, 7, 11, 12]. Studie vyvrátily mylné představy a obavy, že paliativní péče vede k beznaději a předčasné smrti. Americká společnost klinické onkologie (ASCO) od roku 2012 proto doporučuje u všech nemocných s metastatickým nádorovým onemocněním a nemocných s vysokou symptomovou zátěží souběžnou paliativní péči od stanovení diagnózy [13].
Nemocnice hrají v ošetřování nemocných s nádorovým onemocněním nebo obecně závažným onemocněním důležitou roli. Ze studie Ramireze vyplývá, že v posledním roce života je hospitalizováno až 90 % nemocných a kolem 55 % úmrtí ve Velké Británii je právě v nemocnici [14]. Z podrobnějších analýz Institutu biostatistiky a analýz Lékařské fakulty Univerzity Masarykovy (IBA) pro národní datovou základu paliativní péče, provedených z údajů ÚZIS Polívkou a Švancarou v roce 2017, vyplývá, že v letech 2007–2015 zemřelo v nemocnici 66,9–79,6 % nemocných s hematologickými malignitami (lymfom, mnohočetný myelom, akutní leukemie, myelodysplastický syndrom a myeloproliferativní nemoci), u nemocných s lymfomem to bylo 69,6 %, 6,4 % zemřelo v léčebnách pro dlouhodobě nemocné, 13,5 % doma, na ulici nebo při převozu, v hospicích zemřelo pouze 1,1–5,5 % nemocných s hematologickými malignitami (3,7 % nemocných s lymfomy). Z celkového počtu zemřelých nemocných s lymfomem zemřelo na akutních lůžkách 81,3 %, na lůžkách následné péče 18,2 %.
Výzkum provedený v osmdesátých letech ve Velké Británii přitom zdokumentoval nedostatky v péči o umírající pacienty v nemocnicích. Studie Rogerse z roku 2000, čerpající ze zkušeností pozůstalých, hodnotila zkušenosti s péčí v posledním roce života. Ačkoliv přístup lékařů a ošetřovatelů byl výborný nebo dobrý, dotázaní vyjadřovali nespokojenost s dehumanizací, cítili, že na jejich individuální potřeby a přání nebyl brán zřetel [15]. Ošetřovatelé se vyhýbali setkání se smrtí [16]. Dunneová a Sullivanová v roce 2000 popsaly názory rodin na prostředí nemocnic. Rodiny poukazovaly na nedostatek soukromí, na nedostatečnou komunikaci, stěžovaly si, že nebyly přizvány k péči o své příbuzné [17]. V nemocniční paliativní péči byla i v dalších studiích shledána řada nedostatků, tj. kvůli aspektům lidskosti, schopnosti mírnit úzkost. Sláma uvádí, že paliativní péči na náležité odborné úrovni (lege artis) nelze v České republice v roce 2016 považovat za běžně dostupnou a garantovanou zdravotní a sociální službu. Z toho podle něj vyplývá naléhavá potřeba koncepčního rozvoje obecné a specializované paliativní péče [18].
Earle a kolektiv ve své studii uváděj, že nemocní s nádorovým onemocněním na konci života si přejí mít pohodlí, důstojnost a soukromí [19]. V roce 2004 stejný autor s kolektivem identifikovali ukazatele potenciálně příliš agresivní péče u nádorových onemocnění na konci života. Ta zahrnovala vícečetné návštěvy pohotovosti, vysoký počet dnů strávených v nemocnici, úmrtí v nemocnici a nedostatečné využití hospicových služeb [20]. Temel a kolektiv v randomizované kontrolované studii časné paliativní péče u nemocných s pokročilým metastazujícím nemalobuněčným karcinomem plic zjistili, že příliš agresivní péče na konci života může přežití zkrátit. Jako agresivní péči na konci života autoři definují takovou péči, která zahrnuje chemoterapii v posledních 14 dnech života, nevyužívání péče hospicové a přijetí k hospicové péči v čase kratším než 3 dny [7]. Další studie Wrighta a kolektivu poukazovala na vztah agresivní péče na konci života a snížení kvality života nemocných spolu se zvýšeným výskytem psychických poruch u pozůstalých pečujících [21]. Práce Gonsalvese prokazuje efekt včasné konzultace paliativního týmu na snížení míry agresivní péče u nádorových onemocnění v posledních 30 dnech života [22]. K podobným závěrům dospěli také Barbera a kolektiv, kteří posuzují EoLC v kratším čase než předchozí autoři, v posledních 14 dnech života [23].
Nemocní s hematologickými malignitami výrazně méně využívají specializované paliativní péče včetně péče hospicové [24] a naopak častěji podstupují agresivní péči na konci života [25]. Přitom mají symptomovou zátěž (fyzickou i psychickou) srovnatelnou nebo dokonce vyšší než pacienti s pokročilými solidními tumory [26–28]. Paliativní péči poskytují hematologové sami v rámci obecné paliativní péče, a to zcela nezávisle na specialistech v paliativní péči. Specialisté na paliativní péči by přitom mohli a měli poskytovat péči nemocným s vysokým stupněm zátěže, s velkou prognostickou nejistotou, s relativně špatnou prognózou. Jejich role spočívá v tom, že pomáhají v dobré kontrole symptomů nemoci, pomáhají v komunikaci, slouží jako komunikační most mezi hematologem a nemocným [29, 30]. Roste množství literárních dat o tom, že hematologicky nemocným se nedostává paliativní péče [24, 25, 31, 32]. Hematologové nemají zkušenost ze spolupráce se specialisty na paliativní péči, mohou tak mít nedůvěru nebo mylné představy o paliativní péči [33]. Paliativní péče není buď, anebo, ale doplněk péče hematologa. Hematolog doporučením paliativní péče nechce vzít naději [34]. Pokud jsou sami nemocní dotazováni na preference, říkají, že chtějí být informováni otevřeně, i když je prognóza špatná [35, 36]. Nemocní zpochybňují myšlenku nepodání nepříznivé informace [37]. Nemocní, kteří se dostávají k paliativní péči, jsou schopni nasměrovat svoje naděje z úplného vyléčení k dobré kontrole příznaků, prodloužení života při jeho dobré kvalitě se svými blízkými. Touha zachovat naději je tak slučitelná s paliativní péčí. Studie naznačují, že časná paliativní péče může skutečně existovat, usnadnit pochopení prognózy nemoci a nevede k větší úzkosti nebo depresi [4, 7]. Hematolog pracuje nezávisle na dalších medicínských profesích, což může vést ve vztahu k nemocnému k silnému pocitu vlastnictví a pocitu, že musí uspokojit všechny potřeby svého nemocného, ale současně tak může bránit větší míře zapojení specialistů na paliativní péči [33].
Henson na souboru 681 nemocných s nádorovým onemocněním včetně 54 nemocných s hematologickou malignitou studoval EoLC v posledních 3 měsících života, která je v takto daném období považována za agresivní péči, tj. 2 a více návštěv na pohotovosti, více než 30 dnů hospitalizace a úmrtí v nemocnici. Taková péče byla častěji poskytována právě u hematologických malignit ve srovnání se solidními tumory. Její poskytování se v celém souboru zmenšilo v případě dobře dostupné komunitní paliativní a ošetřovatelské péče a v případě pravidelných návštěv praktického lékaře v domácím prostředí [38].
Chybí ale větší výzkumy, které by definovaly jedinečné potřeby hematologicky nemocných v průběhu léčby stejně jako na konci života [39–41]. Do současnosti neexistuje žádné formální doporučení zapojení paliativní péče do péče o nemocné s hematologickou malignitou.
Cíle práce
- Popsat soubor zemřelých nemocných s NHL na Hemato-onkologické klinice Fakultní nemocnice Olomouc (HOK FNOL) v průběhu 6 let (2012–2017) s ohledem na věk, pohlaví, podtyp onemocnění, stav nemoci, předchozí léčbu, cíl, intenzitu léčby (kurativní nebo paliativní) a výskyt refrakterity na chemoterapii v době úmrtí.
- Zdokumentovat počet nově diagnostikovaných nemocných s NHL, všech hospitalizovaných nemocných s NHL a nemocných léčených chemoterapií pro NHL na HOK FNOL v průběhu 6 let (2012–2017).
- Popsat na sledovaném souboru zemřelých nemocných výskyt faktorů považovaných v EoLC za ukazatele agresivní léčby (počet dnů hospitalizace v nemocnici v posledních 3 a jednom měsíci života, podané chemoterapie v posledním měsíci a 7 dnech života), popsat místo a příčinu úmrtí. Dále analyzovat počty hospitalizací a počty dnů hospitalizace v posledních 6 měsících života, charakterizovat výkonnostní stav nemocného (Karnofského skóre) v posledním měsíci života.
- Diskutovat problémy a překážky v poskytování paliativní péče u hemato-onkologicky nemocných a zamyslet se nad možnostmi řešení.
Soubor a metody
Na HOK FNOL zemřelo s diagnózou NHL od 1. 1. 2012 do 31. 12. 2017, tedy v průběhu 6 let, 72 nemocných, 51 mužů a 21 žen, medián věku v době úmrtí byl 70 let, věkové rozmezí 27–96 let. Celkem 39 nemocných (54 %) bylo ve věku nad 70 let (tab. 1).
Table 1. Charakteristika souboru zemřelých nemocných s NHL na HOK 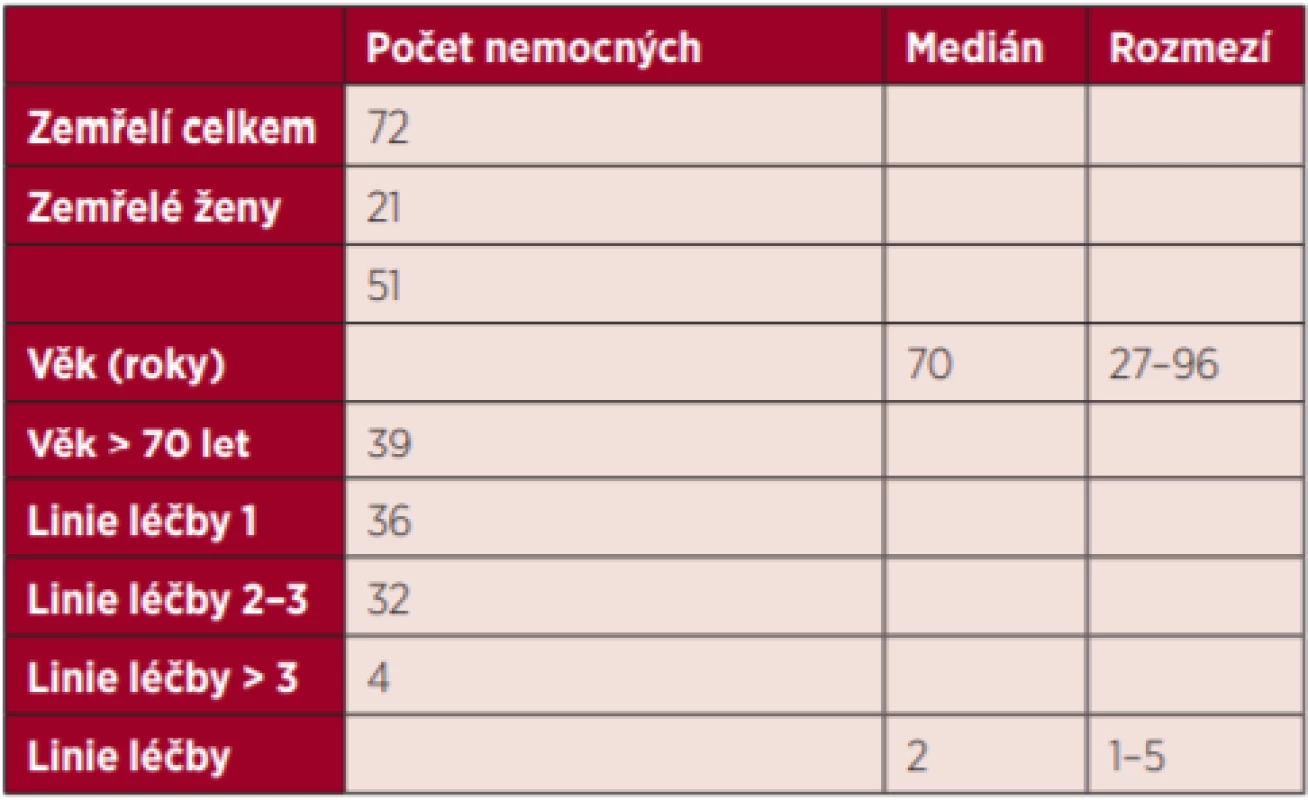
Zastoupení jednotlivých histologických podtypů lymfomů souboru zemřelých nemocných uvádí graf 1. Relativně častěji byly v souboru zemřelých nemocných zastoupeny histologicky agresivní formy NHL, tj. difuzní velkobuněčný lymfom (DLBCL) (26 nemocných, 36 %), lymfom z plášťových buněk (MCL) (7 nemocných, 10 %), lymfom centrálního nervového systému (CNS) (5 nemocných, 7 %), Burkittův lymfom (4 nemocní, 6 %), T nehodgkinský lymfom (7 nemocných, 10 %).
Graph 1. Rozdělení souboru zemřelých nemocných podle typu NHL 
Celkem 36 nemocných absolvovalo 1 linii léčby, 32 nemocných absolvovalo 2–3 linie léčby a 4 nemocní absolvovali více než 3 linie léčby (tab. 1). Pokud budeme blíže analyzovat typ podané léčby, potom 64 nemocných (89 %) bylo léčeno chemoterapií, 12 nemocných bylo léčeno současně chemoterapií i radioterapií, 15 nemocných chemoterapií a následně autologní transplantací krvetvorných buněk, jeden nemocný chemoterapií a alogenní transplantací, chemoterapii a následně biologickou léčbu absolvovali 4 nemocní. Pouze radioterapií byli léčeni 3 nemocní a další 3 nemocní byli léčeni pouze kortikoterapií.
V uvedeném období 6 let bylo na HOK nově diagnostikováno celkem 549 nemocných s NHL (data získaná z registru Kooperativní lymfomové skupiny). U celkem 727 nemocných s NHL ve stadiu nově diagnostikované nemoci a v době relapsu nemoci proběhlo 2 290 hospitalizací (data získaná z nemocničního informačního systému). Celkem 702 nemocných bylo léčeno chemoterapií v léčbě první linie nebo v relapsu, ambulantně byla podána chemoterapie 220 nemocným a 540 nemocným byla podána chemoterapie za hospitalizace, u 68 nemocných byla chemoterapie podávána ambulantně i za hospitalizace. Tato data byla získána ze systému Computer aided Therapy for Oncology (CATO).
Ke statistickému hodnocení byly použity metody popisné statistiky a Kaplanova Meirova analýza. Sledovanou veličinou bylo celkové přežití zemřelých nemocných a celkové přežití nově diagnostikovaných nemocných s NHL z let 2012–2017. Křivka přežívání byla odhadována Kaplanovou Meierovou metodou. K analýzám byla využita data nemocných HOK FNOL z registru nemocných Kooperativní lymfomové skupiny, dále data z nemocničního informačního systému FNOL a data ze systému CATO pro přípravu chemoterapií.
Výsledky
Protinádorová léčba v posledních 6 měsících života: V posledních 6 měsících života dostávalo chemoterapii 61 nemocných (85 %) všech zemřelých nemocných sledovaného souboru.
Protinádorová léčba v posledních 30 dnech života a Karnofského skóre hodnocení celkového stavu: V posledních 30 dnech života bylo chemoterapií léčeno 25 nemocných (37 %). Z nich bylo 15 nemocných v léčbě kurativní, 10 nemocných v péči paliativní. Celkový stav nemocných v posledních 30 dnech života byl hodnocen podle Karnofského skóre. Data bylo možno dohledat u 44 nemocných, z nich 14 (32 %) mělo skóre 50 a méně, 15 (34 %) mělo Karnofského skóre 60–70 % a 15 (34 %) mělo Karnofského skóre 80–100 %.
Protinádorová léčba v posledních 7 dnech života: 5 nemocných dostávalo chemoterapii v posledních 7 dnech života, jednalo se ve všech případech o nemocné v kurativní léčbě. Žádný nemocný v paliativní léčbě nebyl chemoterapií léčen v posledních 7 dnech života.
Pokud jsme analyzovali typ léčby, v průběhu které nemocní zemřeli, potom 30 nemocných (43 %) zemřelo v průběhu kurativní léčby, 20 (29 %) zemřelo v léčbě paliativní, ale primárně byli léčeni s kurativním záměrem, a 19 (28 %) zemřelo v paliativní léčbě, která byla léčbou paliativní od okamžiku stanovení diagnózy. Paliativní terapií rozumíme nízce dávkovanou chemoterapii, kortikoterapii, paliativní radioterapii a léčbu symptomovou (graf 2).
Graph 2. Rozdělení souboru zemřelých nemocných podle typu léčby v době úmrtí 
Počet hospitalizací v posledních 6 měsících života: Medián počtu hospitalizací v posledních 6 měsících života je v souboru nemocných 3 (rozmezí 0–7).
Délka hospitalizace v posledních 6 měsících (resp. ve 3 a 1 měsíci) života: Medián počtu dnů hospitalizace v posledních 6 měsících života je 32 (rozmezí 0–118 dnů), medián počtu dnů hospitalizace v posledních 3 měsících života je 25 (rozmezí 0–90 dnů) a medián počtu dnů hospitalizace v posledním 1 měsíci života je 11 (rozmezí 0–31 dnů) (tab. 2).
Table 2. Charakteristika péče EoLC v posledních 6, 3 a 1 měsíci života nemocných s NHL na HOK 
Stav onemocnění v době úmrtí: 61 nemocných (85 %) mělo aktivní nádorové onemocnění, 6 (8 %) zemřelo v remisi nemoci, u 5 (7 %) nebyl znám stav nemoci v době úmrtí. Ve skupině nemocných s aktivním onemocněním v době úmrtí 19 (27 %) zemřelo v léčbě první linie, 21 (29 %) zemřelo v relapsu a 21 (29 %) bylo refrakterních na chemoterapii (graf 3).
Graph 3. Rozdělení souboru zemřelých nemocných podle stavu nemoci v době úmrtí 
Místo úmrtí: Místem úmrtí byla v 34 případech oddělení HOK (standardní oddělení a jednotka intenzivní péče), dalších 5 nemocných zemřelo po překladu z HOK na Klinice anesteziologie, resuscitace a intenzivní medicíny (KARIM) FNOL, na jiných odděleních FNOL zemřelo 7 nemocných. V ostatních nemocnicích mimo FNOL zemřelo 12 nemocných. U 8 nemocných není místo úmrtí známo. Pouze 3 nemocní zemřeli v péči hospicové a 3 v léčebně pro dlouhodobě nemocné (LDN). Celkem 90 % nemocných léčených s NHL v období let 2012–2017 zemřelo v nemocniční péči, 47 % přímo na odděleních HOK, 4,2 % těchto nemocných zemřelo v péči hospicové a 4,2 % na LDN (graf 4).
Graph 4. Rozdělení souboru zemřelých nemocných podle místa úmrtí 
Příčiny úmrtí: U 24 nemocných byl příčinou úmrtí nehodgkinský lymfom, u 25 byla příčinou infekce v souvislosti s NHL, 10 zemřelo na projevy orgánového selhávání v souvislosti s NHL, 4 zemřeli na sekundární tumor bez přímé příčinné souvislosti s NHL, 1 zemřel v remisi nemoci na cévní mozkovou příhodu a u 8 není příčina úmrtí známa, resp. přesně zjistitelná (graf 5). Padesát devět nemocných (92 %) zemřelo v příčinné souvislosti s NHL (progrese NHL, komplikace infekční nebo orgánové v průběhu léčby NHL), 5 (8 %) zemřelo bez přímé příčinné souvislosti s NHL.
Graph 5. Rozdělení souboru zemřelých nemocných podle příčiny úmrtí 
Celkové přežití zemřelých nemocných: Medián celkového přežití (OS) zemřelých nemocných byl 9,2 měsíce (95 % CI 7,1–14,9) (graf 6).
Graph 6. Kaplanova Meierova křivka celkového přežití souboru zemřelých nemocných s NHL na HOK FNOL v letech 2012–2017 
Pravděpodobnost celkového přežití všech nemocných s NHL nově diagnostikovaných a léčených na HOK FNOL v letech 2012–2017 je v 5 letech 68,0 % (95% CI 0,64–0,72) (graf 7).
Graph 7. Kaplanova Meierova křivka celkového přežití souboru nemocných s nově diagnostikovaným NHL na HOK v letech 2012–2017 
Diskuse
Z naší retrospektivní analýzy zemřelých s diagnózou NHL vyplývá vysoký podíl úmrtí na lůžkách HOK (celkem 47 % zemřelých), 90 % nemocných zemře v některé z nemocnic. 4,2 % nemocných zemřelo na LDN. To odpovídá datům ÚZIS o 69,6 % úmrtí na lymfom v nemocnicích a 6,4 % úmrtí v léčebnách pro dlouhodobě nemocné. Přitom podle údajů ÚZIS na lůžkách akutní péče zemře více než 80 % nemocných s lymfomy. Ať už je podíl nemocniční péče na konci života jakkoliv velký, vždy se jedná o velký objem EoLC péče poskytovaný v nemocnicích.
V hospicové péči zemřeli 4,2 % nemocných souboru, stejné údaje pro nemocné s lymfomem uvádí také ÚZIS (3,7 %). Hospice mají největší zkušenosti s poskytováním specializované paliativní péče v závěru života. Určitou překážkou v širším využití hospicové péče v hemato-onkologii jsou menší zkušenosti hospiců s péčí o hematologicky nemocné [24]. Profesor LeBlanc referuje nedůvěru hematologů ve specialisty v paliativní péči. To vyplývá z četných hloubkových rozhovorů, kde hematologové poukazovali na to, že hematologicky nemocní nedostávali od specialistů na paliativní péči přesné prognostické informace nebo dostávali nevhodná doporučení [33, 42].
Z našich zkušeností vyplývá intenzivní léčba NHL v posledních 6 měsících života, chemoterapií bylo léčeno v tomto období 86 % nemocných. Léčba zahrnovala imunochemoterapii, radioterapii, autologní i alogenní transplantaci, léčbu biologickou. V posledních 30 dnech života bylo chemoterapií léčeno 25 nemocných (37 %), přičemž se u 57 % jednalo o léčbu paliativní. Naše pozorování odpovídá publikovaným zkušenostem Odejide a kolektivu. Nemocní s lymfomy reagují na opakovaně podávanou chemoterapii, léčba je tak možná i ve fázi pokročilého, relabovaného onemocnění. Taková léčba může délku života prodlužovat, bývá ale často nejasné, kdy je nemoc skutečně refrakterní a který relaps nemoci je poslední. Kvůli této vysoké míře nejistoty v prognóze se hematologové spolu s nemocným rozhodují často pro další linii léčby na úkor plánování péče na konci života. Zahájení paliativní péče je tak zpožděno [41]. Ve sledovaném souboru byla chemoterapie v posledních 30 dnech života podána 37 % nemocným, což je relativně vysoké procento, odpovídající datům z práce autorů Hui a kolektiv z MD Anderson Cancer Center, která porovnávala kvalitu péče na konci života nemocných s pokročilou hematologickou malignitou a pokročilým solidním tumorem. V posledních 30 dnech života bylo u hematologicky nemocných trojnásobné podávání chemoterapie (43 % vs. 14 %) a trojnásobné podávání cílené léčby (34 % vs. 11 %). Častější byla u hematologicky nemocných potřeba hospitalizací (81 % vs. 47 %), častější opakované hospitalizace (23 % vs. 10 %), častější úmrtí v klinických studiích a častější úmrtí v intenzivní péči. Naopak méně časté byly paliativní konzultace (22 % vs. 48 %) oproti nemocným se solidními tumory. Ve shodě s uvedenými autory prokazujeme časté hospitalizace.
V posledních 30 dnech (1 měsíci) života nemocných námi sledovaného souboru byl medián délky hospitalizace 11 dní (rozmezí 0–31 dní), v posledních 3 měsících života byl medián délky hospitalizace 25 dní (rozmezí 0–90 dnů). Délku hospitalizací v nemocnici v posledních 3 a jednom měsíci života délku uvádíme jako ukazatel kvality poskytované EoLC, jako ukazatel agresivní léčby na konci života. Část autorů vztahuje tento ukazatel k posledním 14 dnům nebo poslednímu jednomu měsíci života [7, 20, 22, 23]. Henson a kolektiv ve své studii zahrnující hematologicky nemocné uvádí poslední 3 měsíce života jako období, ve kterém posuzuje kvalitu EoLC.
V časovém období naší retrospektivní studie u nemocných s NHL probíhala obecná paliativní péče poskytovaná lékaři hematology, všeobecnými sestrami, psychologem a dalšími zdravotníky v rámci jejich odbornosti s cílem zajistit nemocným dobrou kvalitu života (empatická komunikace o nemoci, léčba symptomů nemoci, zajišťování domácí péče, rozhovory s rodinnými příslušníky.) Specializovaná paliativní péče chápaná jako péče poskytovaná nemocným a jejich rodinám týmem odborníků, kteří absolvovali vzdělání v oboru paliativní péče, v uvedeném období poskytována nebyla.
Autorský kolektiv pod vedením Hui si v roce 2013 položil otázku, proč mají hematologičtí nemocní v posledních 30 dnech života vyšší pravděpodobnost systémové cílené protinádorové léčby. Naznačují, že podstatnou roli hrají také sami hematologové a nemocní [43]. Hematologům a onkologům byl předložen případ nemocného s pokročilým neléčitelným nádorovým onemocněním s minimální pravděpodobností léčebné odpovědi, pravděpodobným přežitím jeden měsíc bez prodloužení přežití léčbou. Hematologové mnohem pravděpodobněji nabídnou nemocnému léčbu ve srovnání s onkology, jejich přesvědčení a postoje tak mohou přispívat k intenzivnější péči na konci života.
Významnou roli v rozhodování o další péči hrají také preference nemocného. Ti upřednostňují léčbu s výhledem prodloužení života. Tato je ale spojena s riziky intenzivní péče, protože léčba krevních onemocnění u oslabených, vyčerpaných a předléčených nemocných s sebou přináší četné komplikace, často s nutností hospitalizace [44, 45]. V našem sledovaném souboru značná část nemocných zemřela na komplikující infekce v průběhu léčby, celkem 25 nemocných a dalších 10 nemocných zemřelo na orgánové selhání. Proto je třeba při plánování další péče a léčby o prospěchu a rizicích podané chemoterapie s nemocnými otevřeně hovořit. Může to být jedna z indikací paliativní intervence.
Medián celkového přežití souboru zemřelých nemocných byl krátký, 9,2 měsíce, s intervalem 7,1–14,9 měsíce. Krátké celkové přežití je dáno spektrem nemocných v pokročilém věku, s rizikovými formami NHL s vysokou pravděpodobností relapsu nemoci nebo nedostatečné odpovědi na léčbu. 29 % nemocných souboru zemřelo v relapsu nemoci, 29 % mělo nemoc refrakterní na podávanou chemoterapii. Ne vždy lze vývoj nemoci předvídat, k úmrtí může dojít již v průběhu léčby první linie, což byl případ 19 nemocných sledovaného souboru.
Časná intervence paliativní péče by měla být indikována u nemocných s rizikovým lymfomem s nejistým průběhem onemocnění. Tato intervence by se měla týkat také jinak rizikových nemocných, starších nebo komorbidních, u nichž je vyšší riziko komplikací. Indikace paliativní intervence nejsou dosud u nemocných s hematologickou malignitou stanoveny oproti indikacím u nemocných se solidními nádory. Příjemce specializované paliativní péče v hematologii se pokusil definovat profesor LeBlanc. Navrhl pro tuto péči nemocné s vysokým stupněm symptomové zátěže, na terapii refrakterní nemocné, nemocné indikované k náročným výkonům, jako je alogenní transplantace, nemocné s psychickou nepohodou nebo ty, kteří nemají správnou představu a náhled stavu své nemoci, nemocné se špatnou prognózou a omezenou délkou života [42].
Paliativní péče by měla zahrnovat komunikaci s nemocným a jeho rodinou v celém průběhu péče, komunikaci o prognóze včetně prognózy nejisté, o předpokládaném vývoji onemocnění. Je třeba dostatek času na plánování závěru života, stanovení plánů péče, které musí zohledňovat přání nemocných. Práce prokázala vysokou míru hospitalizací v posledních 3 měsících života. Tento čas lze chápat také jako příležitost pro komunikaci o cílech léčby a plánech péče s nemocným i rodinou pro případ, že přes léčbu nedochází ke zlepšení stavu. Předpokladem je v komunikaci vzdělaný personál. Nutná je práce v multidisciplinárním týmu a intenzivní spolupráce s ostatními poskytovateli paliativní péče, např. domácími hospici. Ze studií v onkologii vyplývá, že si nemocní přes integraci paliativní péče udrží stálou vazbu na ošetřujícího onkologa a péči vůbec nevnímají jako roztříštěnou [46]. Lze tak předpokládat prospěch zapojení paliativní péče do hematologie, zejména s ohledem na intenzitu léčby a nejasnou prognózu krevních nemocí [26, 27]. Bude třeba vyvinout cílené paliativní intervence také v průběhu kurativní léčby, tzv. časnou paliativní péči [47]. Určitým problémem, který může bránit např. většímu využití hospicové péče, je transfuzní závislost nemocných [27]. V článku, který se týká závěru života hemato-onkologických pacientů v České republice a paliativní péče o ně v roce 2020 dochází Kouba a Rusinová k závěru, že hematologické a paliativní týmy včetně týmů hospicových se mohou v péči o nemocné vhodně doplňovat ve prospěch pacienta [48].
Závěr
Článek potvrzuje i v podmínkách České republiky vysokou míru hospitalizací a intenzivní terapii krátce před úmrtím, tedy proměnné, které nemusí být vždy přiměřené v EoLC. Z našich klinických zkušeností vyplývá potřeba zapojení paliativní péče, a to jak časné, tak EoLC u nemocných s NHL, onemocnění potenciálně život ohrožujícího s prognostickou nejistotou. Od roku 2017 proto probíhá na HOK FNOL vzdělávání ošetřujících v paliativní medicíně, nemocným a ošetřujícím lékařům, hematologům je k dispozici konzultace lékaře se zvláštní specializovanou způsobilostí v oboru paliativní medicína. Paliativní péče vyžaduje spolupráci ošetřujícího lékaře, paliatra, sestry, psychologa, kaplana, sociální sestry, nutričního terapeuta a klinického farmakologa. Úzce spolupracujeme s dalšími poskytovateli paliativní péče, zejména s domácími hospici, a to nejen při předávání nemocných, ale i v předávání zkušeností. To se v praxi ukázalo oboustranně zvláště cenné.
Podíl autorů na přípravě rukopisu
UR – léčba nemocných, příprava rukopisu, závěrečná kontrola rukopisu
MR – léčba nemocných
SR – léčba nemocných a kontrola rukopisu
PV – léčba nemocných, příprava rukopisu
LM – léčba nemocných
HM – kontrola a revize rukopisu
HA – léčba nemocných a kontrola rukopisu
PT – léčba nemocných a kontrola rukopisu
SO – příprava studie, kontrola a revize rukopisu
Poděkování
Příprava rukopisu byla podpořena grantem Nadačního fondu AVAST, Stipendium pro paliativní péči 2018/19.
Čestné prohlášení
Autoři práce prohlašují, že vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 28. 6. 2019.
Přijato po recenzi dne 30. 3. 2020.
Závěr života nemocných s NHL
MUDr. Renata Urbanová, Ph.D.
Hemato-onkologická klinika FNOL a LF UP v Olomouci
I. P. Pavlova 6
779 00 Olomouc
e-mail: renata.urbanova@fnol.cz
Sources
1. Hearn J, Higginson IJ. Do specialist palliative care teams improve outcomes for cancer patients? A systematic literature review. Palliat Med. 1998;12 : 317–332.
2. Bakitas M, Lyons KD, Hegel MT, et al. Effects of a palliative care intervention on clinical outcomes in patients with advanced cancer: the Project ENABLE II randomized controlled trial. JAMA. 2009;302 : 741–749.
3. Jacobsen J, Jackson V, Dahlin C, et al. Components of early outpatient palliative care consultation in patients with metastatic nonsmall cell lung cancer. J Palliat Med. 2011;14 : 459–464.
4. Temel JS, Greer JA, Admane S, et al. Longitudinal perceptions of prognosis and goals of therapy in patients with metastatic non-small-cell lung cancer: results of a randomized study of early palliative care. J Clin Oncol. 2011;29 : 2319–2326.
5. Greer JA, Pirl WF, Jackson VA, et al. Effect of early palliative care on chemotherapy use and end-of-life care in patients with metastatic non-small-cell lung cancer. J Clin Oncol. 2012;30 : 394–400.
6. Morrison RS, Penrod JD, Cassel JB, et al. Cost savings associated with US hospital palliative care consultation programs. Arch Intern Med. 2008;168 : 1783–1790.
7. Temel JS, Greer JA, Muzikansky A, et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med. 2010;363 : 733–742.
8. Pirl WF, Temel JS, Billings A, et al. Depression after diagnosis of advanced non-small cell lung cancer and survival: a pilot study. Psychosomatics. 2008;49 : 218–224.
9. Maione P, Perrone F, Gallo C, et al. Pretreatment quality of life and functional status assessment significantly predict survival of elderly patients with advanced non-small-cell lung cancer receiving chemotherapy: a prognostic analysis of the multicenter Italian lung cancer in the elderly study. J Clin Oncol. 2005;23 : 6865–6872.
10. Movsas B, Moughan J, Sarna L, et al. Quality of life supersedes the classic prognosticators for long-term survival in locally advanced non-small-cell lung cancer: an analysis of RTOG 9801. J Clin Oncol. 2009;27 : 5816–5822.
11. Zimmermann C, Swami N, Krzyzanowska M, et al. Early palliative care for patients with advanced cancer: a cluster-randomised controlled trial. Lancet. 2014;383 : 1721–1730.
12. Dionne-Odom JN, Azuero A, Lyons KD, et al. Benefits of early versus delayed palliative care to informal family caregivers of patients with advanced cancer: outcomes from the ENABLE III randomized controlled trial. J Clin Oncol. 2015;33 : 1446–1452.
13. Smith TJ, Temin S, Alesi ER, et al. American Society of Clinical Oncology provisional clinical opinion: the integration of palliative care into standard oncology care. J Clin Oncol. 2012;30 : 880–887.
14. Ramirez A, Addington-Hall J, Richards M. ABC of palliative care. The carers. Br Med J. 1998;316 : 208–211.
15. Rogers A, Karlsen S, Addington-Hall J. All the services were excellent. It is when the human element comes in that things go wrong’: dis-satisfaction with hospital care in the last year of life. J Adv Nurs. 2000;31 : 768–774.
16. Morris E. A pain of separation. Nurs Times. 1988;84 : 54–56.
17. Dunne K, Sullivan K. Family experiences of palliative care in the acute hospital setting. Int J Palliat Nurs. 2000;6 : 170–178.
18. Slama O, Kabelka L, Loucka M. Palliative care in Czech Republic in 2016. Čas Lék Čes. 2016;155 : 445–450.
19. Earle CC, Park ER, Lai B, et al. Identifying potential indicators of the quality of end-of-life cancer care from administrative data. J Clin Oncol. 2003;21 : 1133–1138.
20. Earle CC, Neville BA, Landrum MB, et al. Trends in the aggressiveness of cancer care near the end of life. J Clin Oncol. 2004;22 : 315–321.
21. Wright AA, Keating NL, Balboni TA, et al. Place of death: correlations with quality of life of patients with cancer and predictors of bereaved caregivers’ mental health. J Clin Oncol. 2010;28 : 4457–4464.
22. Gonsalves WI, Tashi T, Krishnamurthy J, et al. Effect of palliative care services on the aggressiveness of end-of-life care in the Veteran´s Affairs cancer population. J Palliat Med. 2011;14 : 1231–1235.
23. Barbera L, Paszat L, Chartier C. Indicators of poor quality end-of-life cancer care in Ontario. J Palliat Care. 2006;22 : 12–17.
24. Howell DA, Shellens R, Roman E, et al. Haematological malignancy: are patients appropriately referred for specialist palliative and hospice care? A systematic review and meta-analysis of published data. Palliat Med. 2011;25 : 630–641.
25. Hui D, Didwaniya N, Vidal M, et al. Quality of end-of-life care in patients with hematologic malignancies: a retrospective cohort study. Cancer. 2014;120 : 1572–1578.
26. Epstein AS, Goldberg GR, Meier DE. Palliative care and hematologic oncology: the promise of collaboration. Blood Rev. 2012;26 : 233–239.
27. Manitta VJ, Philip JA, Cole-Sinclair MF. Palliative care and the hemato-oncological patient: can we live together? A review of the literature. J Palliat Med. 2010;13 : 1021–1025.
28. Fadul NA, El Osta B, Dalal S, et al. Comparison of symptom burden among patients referred to palliative care with hematologic malignancies versus those with solid tumors. J Palliat Med. 2008;11 : 422–427.
29. Quill TE, Abernethy AP. Generalist plus specialist palliative care-creating a more sustainable model. N Engl J Med. 2013;368 : 1173–1175.
30. Lupu D, American Academy of Health, Palliative Medicine Workforce Task F. Estimate of current hospice and palliative medicine physician workforce shortage. J Pain Symptom Manage. 2010;40 : 899–911.
31. LeBlanc TW, Abernethy AP, Casarett DJ. What is different about patients with hematologic malignancies? A retrospective cohort study of cancer patients referred to a hospice research network. J Pain Symptom Manage. 2015;49 : 505–512.
32. Howell DA, Roman E, Cox H, et al. Destined to die in hospital? Systematic review and meta-analysis of place of death in haematological malignancy. BMC Palliat Care. 2010;9 : 9.
33. LeBlanc TW, O´Donnell JD, Crowley-Matoka M, et al. Perceptions of palliative care among hematologic malignancy specialists: a mixed-methods study. J Oncol Pract. 2015;11:e230–e238.
34. Bernacki RE, Block SD, American College of Physicians High Value Care Task F. Communication about serious illness care goals: a review and synthesis of best practices. JAMA Intern Med. 2014;174 : 1994–2003.
35. El-Jawahri A, Traeger L, Park ER. Associations among prognostic understanding, quality of life, and mood in patients with advanced cancer. Cancer. 2014;120 : 278–285.
36. El-Jawahri A, Traeger L, Kuzmuk K, et al. Prognostic understanding, quality of life and mood in patients undergoing hematopoietic stem cell transplantation. Bone Marrow Transplant. 2015;50 : 1119–1124.
37. Apatira L, Boyd EA, Malvar G, et al. Hope, truth, and preparing for death: perspectives of surrogate decision makers. Ann Intern Med. 2008;149 : 861–868.
38. Henson LA, Gomes B, Koffman J, et al. Factors associated with aggressive end of life cancer care. Support Care Cancer. 2016;24 : 1079–1089.
39. LeBlanc TW. Palliative care and hematologic malignancies: old dog, new tricks? J Oncol Pract. 2014;10:e404–e407.
40. LeBlanc TW. In the sandbox: palliative care and hematologic malignancies. J Community Support Oncol. 2014;12 : 44–45.
41. Odejide OO, Salas Coronado DY, Watts CD, et al. End-of-life care for blood cancers: a series of focus groups with hematologic oncologists. J Oncol Pract. 2014;10:e396–e403.
42. LeBlanc TW, El-Jawahri A. When and why should patients with hematologic malignancies see a palliative care specialist? Hematology Am Soc Hematol Educ Program. 2015;2015 : 471–478.
43. Hui D, Karuturi MS, Tanco KC, et al. Targeted agent use in cancer patients at the end of life. J Pain Symptom Manage. 2013;46 : 1–8.
44. Hui D, Bansal S, Park M, et al. Differences in attitudes and beliefs toward end-of-life care between hematologic and solid tumor oncology specialists. Ann Oncol. 2015;26 : 1440–1446.
45. Wright AA, Zhang B, Keating NL, et al. Associations between palliative chemotherapy and adult cancer patients’ end of life care and place of death: prospective cohort study. Br Med J. 2014;348:g1219.
46. Schenker Y, Crowley-Matoka M, Dohan D, et al. Oncologist factors that influence referrals to subspecialty palliative care clinics. J Oncol Pract. 2014;10:e37–e44.
47. El-Jawahri AR, Traeger LN, Kuzmuk K, et al. Quality of life and mood of patients and family caregivers during hospitalization for hematopoietic stem cell transplantation. Cancer. 2015;121 : 951–959.
48. Kouba M, Rusinová K. Závěr života hematoonkologických pacientů v České republice a paliativní péče o ně v roce 2020. Postgrad Med. 2020;1 : 74–80.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2020 Issue 2-
All articles in this issue
- Editorial
- Trombotické mikroangiopatie
- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity – Mezinárodní diagnostická kritéria z roku 2017
- Léčba histiocytózy z Langerhansových buněk u dospělých osob
- Závěr života nemocných s nehodgkinským lymfomem, analýza souboru zemřelých během šesti let (2012–2017) na jednom pracovišti, integrace paliativní péče
- Skladování erytrocytů při nestandardní teplotě
- Theralite a mnohočetný myelom – známe už odpověď na efektivitu léčby nefrologa s hematologem?
- Překvapivý nález v kostní dřeni: co za ním je?
- Životní jubileum pana profesora Jiřího Mayera
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity – Mezinárodní diagnostická kritéria z roku 2017
- Trombotické mikroangiopatie
- Překvapivý nález v kostní dřeni: co za ním je?
- Léčba histiocytózy z Langerhansových buněk u dospělých osob
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

