-
Medical journals
- Career
Překvapivý nález v kostní dřeni: co za ním je?
Authors: T. Horňák 1,*; N. Holtánová 1,*; L. Křen 2; J. Skřičková 3; A. Hrazdirová 3; J. Mayer 1,4; D. Žáčková 1
Authors‘ workplace: Oba autoři se na vzniku manuskriptu podíleli rovným dílem. *; Interní, hematologická a onkologická klinika, FN Brno a LF MU 1; Ústav patologie, FN Brno 2; Klinika nemocí plicních a TBC, FN Brno a LF MU 3; CEITEC Masarykova Univerzita, Brno 4
Published in: Transfuze Hematol. dnes,26, 2020, No. 2, p. 139-142.
Category: Case Reports
Overview
Tato práce prezentuje komplexní diagnosticko-terapeutický proces u pacientky bez známého imunodeficitu s těžkou generalizovanou infekcí způsobenou Mycobacterium avium complex, projevující se pancytopenií, hepatopatií a renálním selháním. Ojedinělým byl také výskyt pouze mikroskopického nálezu (granulomatózně nekrotizující proces v kostní dřeni a slezině) při absenci makroskopických či radiologických nálezů. Finální diagnóza byla stanovena kultivačním vyšetřením tkáně sleziny. Po nasazení cílené antituberkulotické léčby došlo ke zlepšení stavu pacientky, vymizení všech příznaků a návratu do běžného života.
Klíčová slova:
atypická mykobakteria – infekce – granulomatózní zánět – pancytopenie
Úvod
Mycobacterium avium complex patří mezi atypická mykobakteria, skupinu oportunních patogenů způsobujících infekční komplikace nejčastěji u imunokompromitovaných pacientů. Typické je postižení cílového orgánu, nejčastěji plic, může však lokalizovaně probíhat také v kůži, lymfatických uzlinách, játrech, ledvinách a jiných orgánech [1]. Systémová diseminace může nastat, je však velmi raritní. Popsány jsou také ojedinělé případy výskytu infekcí zapříčiněných těmito agens u pacientů bez imunodeficitu. Incidence výskytu infekcí způsobených atypickými mykobakteriemi v posledních letech narůstá [2].
Kazuistika
Do té doby zdravá žena ve věku 56 let přichází v září 2017 do ambulance praktického lékaře pro bolesti v pravém podžebří, dyspepsie a B symptomy (zvýšená teplota, noční pocení, ztráta hmotnosti 6 kg za 2 měsíce). Pacientka neužívá žádnou chronickou medikaci, neudává abúzus alkoholu, kuřačka (15 cigaret denně od 18 let), pracuje v administrativě ve sběrném středisku odpadu, avšak bez přímého kontaktu s toxickými látkami, cestovatelská i epidemiologická anamnéza negativní. V rodinné anamnéze zachycen výskyt nádorových onemocnění – otec nádor močového měchýře, matka nádor ledviny. Při prvotním laboratorním vyšetření byla nalezena hepatopatie se známkami cholestázy (bilirubin 21 μmol/l, ALT 1,88 μkat/l, AST 2,49 μkat/l, ALP 21,37 μkat/l, GGT 7,82 μkat/l), při fyzikálním vyšetření nebyla přítomna hepatosplenomegalie. Zobrazovacími vyšetřeními (sonografie, počítačová tomografie) nenalezena anomálie v hepatobiliární oblasti, popsán vedlejší nález stenózy truncus coeliacus a arteria mesenterica superior, který řešen později implantací stentu do truncus coeliacus. Základní panel virových i autoimunitních hepatitid negativní, z onkomarkerů pozitivita Ca 125 (332 kU/l) a Ca 15-3 (58 kU/l).
V mezidobí byla pacientka sledována ambulantně, spontánní ústup febrilií i nočního pocení, tendence k úpravě hepatopatie (ALT 0,56 μkat/l, AST 1,02 μkat/l, ALP 6,56 μkat/l, GGT 1,13 μkat/l), naproti tomu ale došlo k elevaci renálních parametrů (urea 9,2 mmol/l, kreatinin 201 μmol/l), vzniku leukopenie (4,06 × 109/l) a trombocytopenie (76 × 109/l), elevaci beta-2-mikroglobulinu (15,4 mg/l) a laktátdehydrogenázy (7 μkat/l), podle zobrazovacích metod nově splenomegalie. Pro podezření na onemocnění krvetvorby pacientka odeslána v únoru 2018 na hematologickou ambulanci Interní, hematologické a onkologické kliniky FN Brno (IHOK). Periferní krev byla vyšetřena mikroskopicky a průtokovou cytometrií bez nálezu signifikantní patologie, provedena sternální punkce, která ale taktéž v mezích normy. Vzhledem k dobrému klinickému stavu byla další poměrně intenzivní vyšetření naplánována ambulantně.
V březnu 2018 přišla pacientka akutně na ambulanci IHOK pro výrazné zhoršení celkového stavu, slabost s omezením hybnosti, anasarku, klidovou dušnost. V laboratoři známky akutního renálního selhání (urea 44 mmol/l, kreatinin 946 μmol/l), koagulopatie (APTTi 1,6, fibrinogen 1,4 g/l), trombocytopenie (25 × 109/l), nicméně výrazné zlepšení jaterních parametrů (ALT 1,02 μkat/l, AST 1,3 μkat/l, ALP 6,9 μkat/l, GGT 0,91 μkat/l). Pacientka byla přijata na jednotku intenzivní péče, zařazena do akutního hemodialyzačního programu. Pokračováno v komplexním došetřování, odebrán rozsáhlý panel autoprotilátek, screening systémových bakteriálních, virových i mykotických infekcí. Autoprotilátky včetně antinukleárních protilátek (ANA), protilátek proti cytoplazmě neutrofilů (ANCA), protilátky proti bazální membráně glomerulů (GBM) opakovaně negativní, biopsie ledviny neproveditelná vzhledem k refrakterní trombocytopenii. Doplněna trepanobiopsie a jako terapeutický pokus zahájen pulz kortikoidů (methylprednisolon 125 mg/den na celkem 9 dnů), ale bez výraznějšího efektu. Stav komplikován rozvojem G-negativní sepse (etiologicky ESBL – rozšířené spektrum beta-laktamáz – E. coli), která byla zaléčena antimikrobiální terapií podle citlivosti s dobrým efektem.
Po zlepšení klinického stavu doplněno vyšetření celotělové pozitronové emisní tomografie v kombinaci s magnetickou rezonancí (PET/MR), na kterém nález pouze drobného aktivního ložiska při ventrálním okraji sleziny, lymfadenopatie retroperitonea, ascites a difuzní prosáknutí měkkých tkání. Provedena punkce ascitu, podle biochemického rozboru transsudát (celková bílkovina v ascitu 13,4 g/l), cytologicky nález četných erytrocytů, záplavy neutrofilů, lymfocytů a klidových i aktivovaných mezotelií, nezachyceny žádné patologické buňky, mikrobiologické a vyšetření pomocí polymerázové řetězcové reakce (PCR) na Mycobacterium tuberculosis z ascitu negativní.
Histologické vyšetření kostní dřeně prokázalo granulomatózně nekrotizující proces nejasné etiopatogeneze, pokračováno tedy v rozsáhlém došetřování vzhledem k široké diferenciální diagnostice granulomatózních zánětů [3]. Klinický stav pacientky se však i přes veškerou podpůrnou péči dále horšil, vzhledem k nejasné etiologii stavu navržen akutní diagnostický výkon. Po extenzivní hematologické přípravě pro hlubokou pancytopenii a hypofibrinogenemii včetně podání intravenózních imunoglobulinů (v celkové dávce 2 g/kg) a kortikoidů (500 mg methylprednisolonu rozdělené do 2 stejných dávek), provedena diagnostická laparotomie. Peroperačně makroskopicky bez známek maligního procesu, bez lymfadenopatie, odpuštěno celkem 7 litrů ascitu, provedena diagnostická splenektomie. Po operačním výkonu stabilizace počtu leukocytů, ale pokles v hodnotách hemoglobinu a trombocytů. Ve slezině byl stejně jako v kostní dřeni potvrzen granulomatózně nekrotizující proces s negativním výsledkem barvení na mikroorganismy. V mezidobí vyloučeny bakteriální infekce, cytomegalovirová infekce, tkáňové helmintózy, leishmanióza, salmonelóza, ehrlichióza, základními vyšetřeními i tuberkulóza (Quantiferon, T-spot), dále sarkoidóza a autoimunitní onemocnění. V dalším průběhu opět rozvoj sepse a masivního fluidothoraxu při těžké hypoalbuminemii s nutností zavedení hrudní drenáže, pacientka zmatená. Pro zhoršování stavu a vyčerpání diagnosticko-terapeutických možností po multioborové rozvaze nasazena empirická antituberkulotická (isoniazid, ethambutol, pyrazinamid) a antimykotická léčba (amfotericin B). Pokračováno v pátrání po primární příčině generalizovaného granulomatózního procesu, provedena gastrofibroskopie, bronchoalveolární laváž, lumbální punkce, vše s negativním výsledkem.
Konečná odpověď přichází dne 17. 4. 2018, kdy ze vzorku tkáně sleziny vykultivována atypická mykobakteria, Mycobacterium avium complex. Masivní nárůst mykobakterií dále umožnil jejich další kultivaci a hodnocení citlivosti k antituberkulotikům, která následně upravena podle citlivosti na kombinaci izoniazid, ethambutol, clarithromycin a rifampicin. Pacientka přeložena na Kliniku nemocí plicních a tuberkulózy FN Brno.
Na zavedené terapii postupné zlepšení klinického stavu, úprava renálních parametrů i krevního obrazu. Pacientka propuštěna dne 7. 7. 2018 do ambulantního sledování, antituberkulotická terapie ukončena dne 6. 8. 2019, po celkem 16 měsících. Kvalita života pacientky je nyní porovnatelná s předchorobím.
Diskuse
Případ pacientky bez známé poruchy či omezení imunitní odpovědi, který je zde prezentován, je neobvyklý z několika pohledů.
Jak již bylo uvedeno výše, nejčastější lokalizací mykobakteriální infekce je plicní tkáň [4]. U naší pacientky byla potvrzena infekce v kostní dřeni a slezině a velmi pravděpodobně byly postiženy i další orgány, zejména játra a ledviny. Vlivem této infekce došlo k selhávání vnitřních orgánů s nutností intenzivní podpůrné terapie včetně provádění intermitentní hemodialýzy. Takový rozsah a závažnost postižení je u pacientů velmi raritní. Vzhledem k tomu, že biopsie ledvin nebyla provedena, lze při ledvinném selhání uvažovat i o podílu bakteriálních superinfekcí (sepse, etiologicky ESBL E. coli) či kontrastní látky použité při CT vyšetření. Nicméně předpokládaný je hlavně podíl granulomatózní intersticiální nefritidy. Nález granulomatózního zánětu se potvrdil v kostní dřeni i slezině, lze ho tedy předpokládat i v ostatních postižených orgánech.
Zajímavostí není pouze rozsah postižení, ale také jeho výskyt u imunokompetentní pacientky. Jak je známo, nejčastěji se atypické mykobakteriózy vyskytují u pacientů s imunodeficitem, typicky u pacientů s HIV/AIDS, chronickými plicními onemocněními, při dlouhodobé neutropenii u hematologických malignit či po vysokodávkové chemoterapii [4, 5]. U naší pacientky jsme nezjistili žádný z výše uvedených predispozičních faktorů. I přesto, že pacientka pracovala ve sběrném středisku odpadu, její náplní práce byla administrativa, tedy nebyla exponována potenciálně rizikovému materiálu. Taktéž nebyla v kontaktu se žádnou osobou s prokázanou TBC.
Za pozornost také stojí výrazná pancytopenie s trombocytopenií refrakterní k podání trombonáplavů. Na tomto nese pravděpodobně podíl zvýšené vychytávaní krevních elementů v postižené slezině při hypersplenismu. Tato trombocytopenie byla také téměř rozhodující překážkou před provedením diagnostické laparotomie v době, kdy jiné diagnostické metody neobjasňovaly potíže pacientky. Po podání intravenózních imunoglobulinů v imunomodulační dávce 2 g/kg a následné substituci trombonáplavy však bylo možné operační výkon provést a díky tomu stanovit finální diagnózu po kultivačním vyšetření splenické tkáně.
V rámci diferenciální diagnostiky granulomatózního procesu prokázaného z vyšetření kostní dřeně byly provedeny taktéž interferon gamma release assay (IGRA) testy (Quantiferon, T spot), které byly negativní, jelikož jsou připraveny pouze pro testování TBC komplex.
Neobvyklá byla též diskrepance mezi rozsahem postižení v břišní dutině a makroskopickým nálezem během laparotomie, který se jevil naprosto fyziologicky. Ani za pomoci zobrazovacích metod nebyla patrná žádná výrazná patologická ložiska či abscesy, a to ani za použití celotělového PET/MR, kde byl popsán pouze nález hraniční lymfadenopatie s ascitem a jedno nespecifické ložisko sleziny velikosti 6 mm. Vzhledem k povaze vyšetření a podle dostupných zdrojů je PET/MR spolehlivým nástrojem k diagnostice a sledování léčebné odpovědi u atypických mykobakterióz [6]. V literatuře jsme nenalezli případ, kdy by diseminované onemocnění bylo detekovatelné pouze na mikroskopické úrovni jako u naší pacientky.
Image 1. Trepanobiopsie kostní dřeně. Barvení Hematoxylin + Eozin (H+E), zvětšení 100×. Vlevo trilineární hematopoéza, uprostřed Langhansovy mnohojaderné buňky, vpravo poprašková nekróza, vpravo dole epitelioidní buňky, vpravo nahoře kostní trámec. 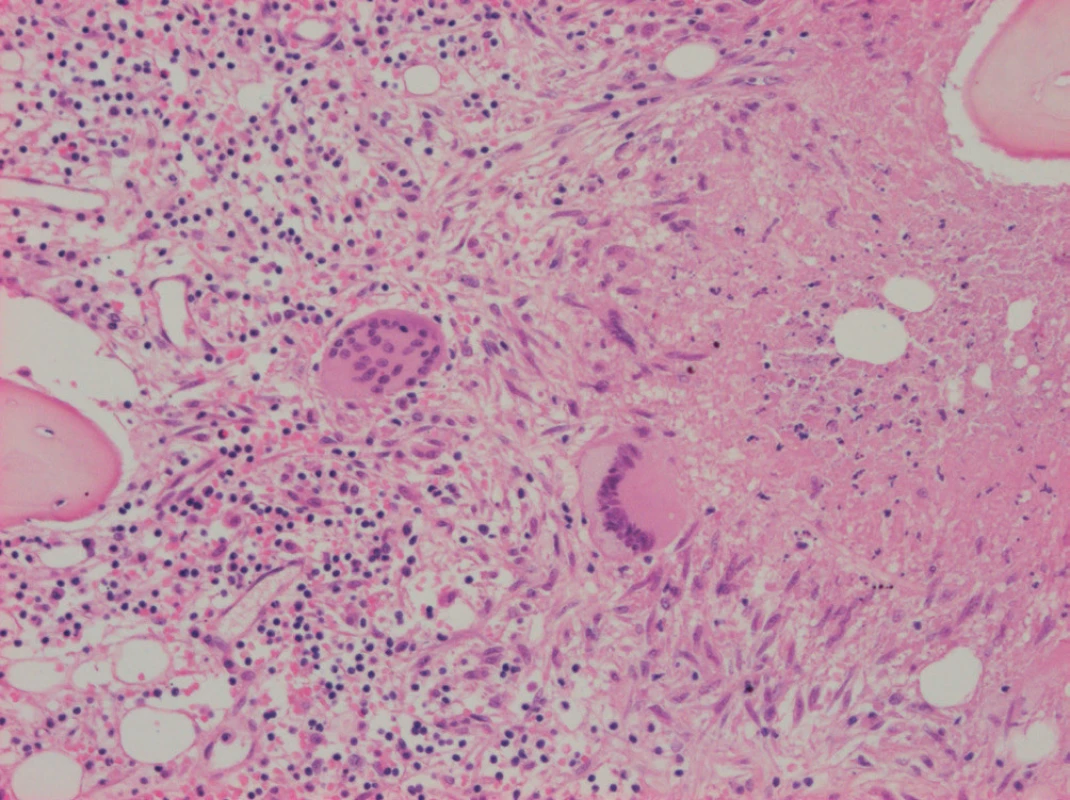
Image 2. Trepanobiopsie kostní dřeně. Barvení na mykobakteria (Fite), zvětšení 200×. Langhansova mnohojaderná buňka a epitelioidní buňky, mykobakteria neidentifikována, periferně nahoře elementy trilineární hermatopoézy 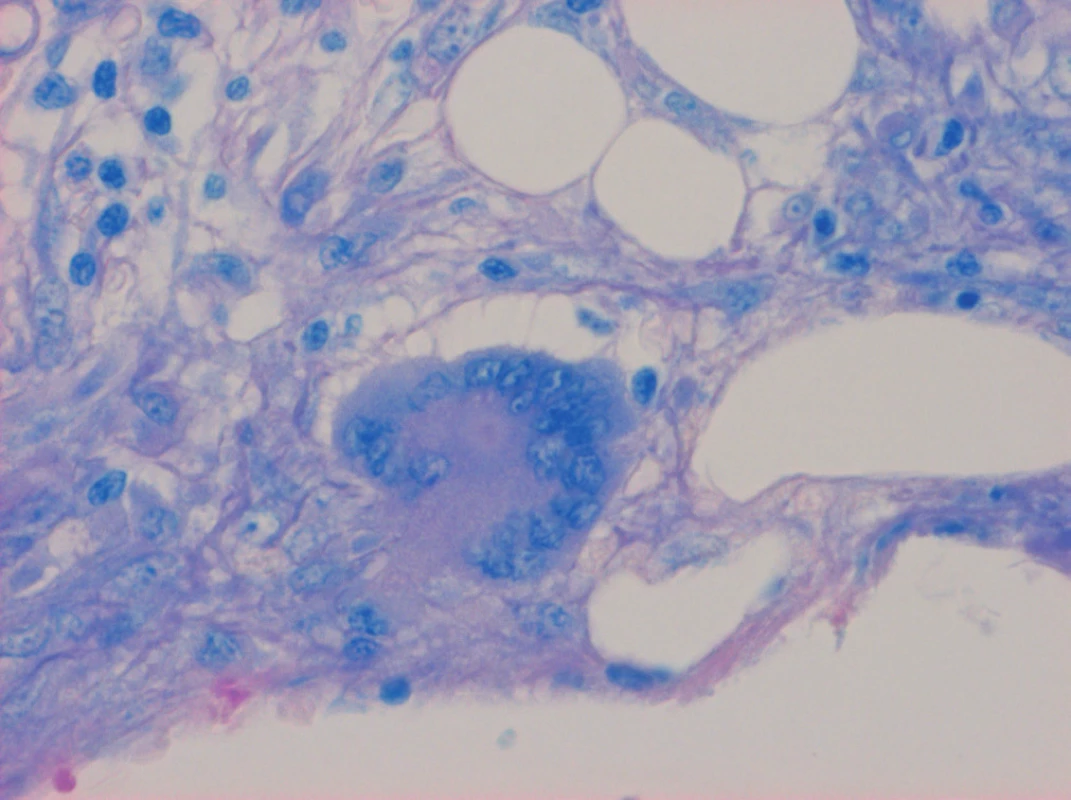
Image 3. Histologický preparát sleziny. Barvení H+E, zvětšení 20×. V červené pulpě centrálně a vlevo granulomy s popraškovou nekrózou, vpravo a nahoře bílá pulpa. 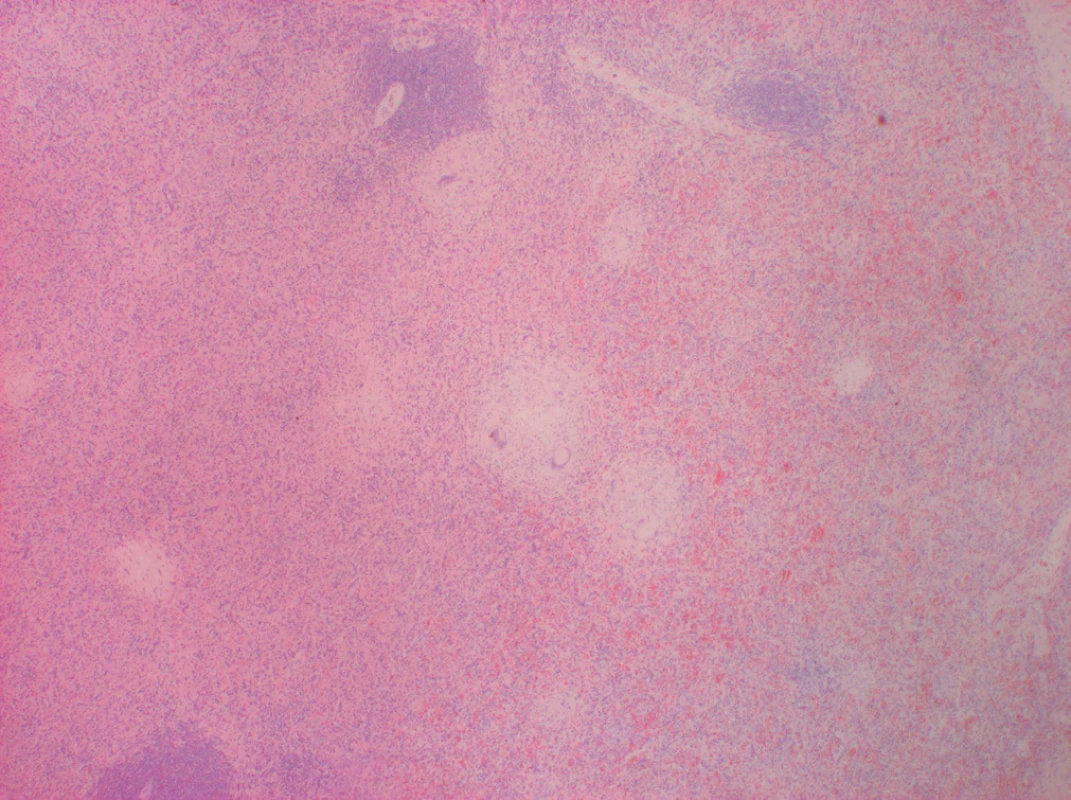
Závěr
Kazuistika představuje podle našich vědomostí atypický průběh diseminované infekce způsobené Mycobacterium avium complex u imunokompetentní pacientky. Vzhledem k tomu, že podle dostupné literatury roste incidence atypických mykobakterióz u pacientů bez známé poruchy imunity, je potřeba lépe pochopit patofyziologii této nemoci, stanovit jasná diagnostická kritéria a doporučenou léčbu. Dalším poselstvím je, aby lékaři u všech infekčních nemocí mysleli po vyloučení častých příčin i na ta méně častá agens a neopomíjeli ani oportunní infekce.
Podíl autorů na přípravě rukopisu
TH, NH – příprava, napsání a následná revize rukopisu
DŽ, JM – revize a korektura rukopisu
LK – zpracování a popis obrazové dokumentace, korektura rukopisu
JS – klinická péče o pacientku, korektura rukopisu
AH – ambulantní péče o pacientku
Prohlášení o konfliktu zájmů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 12. 12. 2019.
Přijato po recenzi dne 28. 2. 2020.
MUDr. Daniela Žáčková, Ph.D.
Interní, hematologická a onkologická klinika
FN Brno a LF MU
Jihlavská 20
625 00 Brno
e-mail: Zackova.Daniela@fnbrno.cz
Sources
1. Jeon D. Infection source and epidemiology of nontuberculous mycobacterial lung disease. Tuberc Respir Dis (Seoul). 2019;2 : 94–101.
2. Lande L, George J, Plush T. Mycobacterium avium complex pulmonary disease: new epidemiology and management concepts. Curr Opin Infect Dis. 2018;2 : 199–207.
3. Wickramasinghe SN, McCullough J. Blood and Bone Marrow PATHOLOGY. Edinburgh, Churchill Livingstone, 2002; 110.
4. Tortoli E. Clinical manifestations of nontuberculous mycobacteria infections. Clin Microbiol Infect. 2009;15 : 906–910.
5. Beswick J, Shin E, Michelis FV, et al. Incidence and risk factors for nontuberculous mycobacterial infection after allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2018;2 : 366–372.
6. Sato M, Hiyama T, Kaito K, et al. Usefulness of F-18 FDG PET/CT in the assessment of disseminated Mycobacterium avium complex infection. Ann Nucl Med. 2009;8 : 757–762.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2020 Issue 2-
All articles in this issue
- Editorial
- Trombotické mikroangiopatie
- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity – Mezinárodní diagnostická kritéria z roku 2017
- Léčba histiocytózy z Langerhansových buněk u dospělých osob
- Závěr života nemocných s nehodgkinským lymfomem, analýza souboru zemřelých během šesti let (2012–2017) na jednom pracovišti, integrace paliativní péče
- Skladování erytrocytů při nestandardní teplotě
- Theralite a mnohočetný myelom – známe už odpověď na efektivitu léčby nefrologa s hematologem?
- Překvapivý nález v kostní dřeni: co za ním je?
- Životní jubileum pana profesora Jiřího Mayera
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity – Mezinárodní diagnostická kritéria z roku 2017
- Trombotické mikroangiopatie
- Překvapivý nález v kostní dřeni: co za ním je?
- Léčba histiocytózy z Langerhansových buněk u dospělých osob
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

