-
Medical journals
- Career
Folikulární lymfom a význam nádorového mikroprostředí
: A. Janíková 1; J. Michalka 1; B. Tichý 1; P. Fabian 2; J. Šupíková 1; J. Mayer 1
: Interní hematoonkologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 1; Masarykův onkologický ústav Brno 2
: Transfuze Hematol. dnes,16, 2010, No. 3, p. 150-157.
: Comprehensive Reports, Original Papers, Case Reports
Folikulární lymfom (FL) je indolentní B-lymfoproliferace charakterizovaná pomalým růstem a rekurentním průběhem. Navzdory histologické uniformitě se klinicky jedná o značně heterogenní onemocnění. Celkový medián přežití se pohybuje kolem 18 let, přesto 10–15 % pacientů umírá v důsledku progrese FL do 2–3 let. Pro FL jsou také příznačné spontánní regrese, což předpokládá imunologickou interakci nádorových buněk s ostatními elementy imunitního systému. Význam nádorového mikroprostředí jako určujícího faktoru chování FL podporují výsledky studií genové exprese a analýzy imunofenotypu ne-nádorových buněk. Předkládaný přehled sumarizuje současné poznatky o jednotlivých „hráčích“ nádorového mikroprostředí FL jako jsou folikulární dendritické buňky (FDC), T-regulační (FOXP3+) a T-cytotoxické lymfocyty (CD8+), s lymfocyty asociované makrofágy (LAM), NK-buňky (CD57+) apod. Vliv nádorového mikroprostředí na chování FL se dnes jeví jako nezpochybnitelný, avšak interpretace výsledků je často nejednotná a rozporuplná. Tyto rozdíly pravděpodobně pramení z různé koncepce jednotlivých studií, ale jsou dány i rozdílnou citlivostí jednotlivých komponent nádorového mikroprostředí k různým typům léčby. Poznání elementů nádorového mikroprostředí, jejich vzájemných vztahů a interakce s nádorovými buňkami by mohlo vést ke stanovení přesnější individuální prognózy pacienta ale také k cílené léčbě „šité na míru“.
Klíčová slova:
folikulární lymfom, t(14;18), nádorové mikroprostředí, FOXP3, folikulární dendritické buňky, s lymfomem asociované makrofágyÚvod
Folikulární lymfom (FL) je jedním z nejčastěji se vyskytujících nehodgkinských lymfomů (NHL). Choroba se typicky manifestuje jako chronicky probíhající nebolestivá lymfadenopatie, vyznačující se návraty ale i spontánními remisemi (1). Medián přežití se nyní pohybuje kolem 18 let (2). Stále však existuje nezanedbatelná část nemocných (cca 10–15 %) s agresivním charakterem choroby, která reaguje nedostatečně na léčbu a vede k úmrtí do 2–3 let od stanovení diagnózy. Příčinou smrti bývají obvykle komplikace vyplývající z toxicity léčby nebo transformace do agresivního lymfomu (3).
Pozorované jevy jako spontánní remise, výborný efekt alogenní transplantace s významným „graft versus lymphoma“ efektem (4) a také prokázané přetrvávání t(14;18)+ buněk v krvi a uzlinách pacientů v dlouhodobých remisích folikulárního lymfomu (5) naznačují, že kromě nádorových buněk se musí uplatňovat v klinické manifestaci FL další faktor. Jedna z prvních prací, která obrátila pozornost směrem k nenádorovým buňkám tzv. mikroprostředí uzliny, je analýza genové exprese na celogenomovém čipu u 96 pacientů s FL. Autoři definovali a validovali dvě nezávislé podskupiny (nazvané „Immune response 1“ a „Immune response 2“), které se lišily expresními profily, klinickým chováním a prognózou (6). Rozdíly v genové expresi se však nepromítaly do B-buněk (CD19+), ale mezi buňky tzv. nádorového mikroprostředí (non CD19+). Dnes existuje celá řada studií podporujících hypotézu, že folikulární lymfom lze nahlížet jako onemocnění funkční interakce nádorových buněk a ostatních nenádorových buněk imunitního systému.
Tento stručný přehled sumarizuje dosavadní poznatky o nádorovém mikroprostředí FL a snaží se je interpretovat v širším rámci této zajímavé diagnózy. Následující text z edukačních a logických důvodů nejprve rozebírá morfologii fyziologické i nádorové uzliny FL včetně charakteristiky vlastních t(14;18) pozitivních buněk. Dále jsou jednotlivé kapitoly věnovány klinicky nejvýznamnějším složkám mikroprostředí v kontextu normální i nádorové tkáně doplněné o výsledky studií a technologické možnosti mapování jednotlivých jejích elementů.
Morfologie lymfatické uzliny
Lymfatická uzlina je sekundární lymfatický orgán (obr. 1), který je osídlen lymfoidními buňkami generovanými v thymu (T-lymfocyty) a kostní dřeni (B-lymfocyty). Histologicky se rozlišuje část periferní – kortikální (zde ještě povrchová vrstva a parakortex blíže centru uzliny) a vnitřní – medulární. Z funkčního hlediska potom lze diferencovat retikulum z kolagenních a elastických vláken tvořící konstrukci uzliny a celulární kompartment (7). Celulární kompartment je tvořen zejména lymfocyty, které jsou v kortikální oblasti shlukovány do tzv. folikulů. Primární folikuly jsou tvořeny malými uniformními lymfocyty bez antigenní stimulace, sekundární folikuly vznikají z primárních po antigenní stimulaci a obsahují světlé blastoidní buňky. Centrální zóna sekundárního folikulu se nazývá zárodečné nebo také germinální centrum (GC) a je obklopena zónou plášťovou („mantle“). Folikuly jsou tvořeny dominantně B-buňkami a GC jsou místem intenzivní humorální imunitní odpovědi. Germinální centra jsou tvořena dvěma populacemi buněk: velkými aktivovanými B-lymfocyty tzv. centroblasty (morfologicky nerozštěpené – „noncleaved“) a menšími centrocyty (rozštěpené – „cleaved“), které vznikají z centroblastů. GC taktéž obsahují Th2 –buňky (CD4+, CD45RO+, CD57+), které mají zásadní význam v T-B interakci. Velká část B-buněk, která není aktivována v rámci humorální odpovědi nebo se nepřemění v paměťové buňky, zaniká apoptózou. Plášťová (mantle) zóna je tvořena malými lymfocyty, které jsou velmi heterogenní po stránce fenotypu i funkce. Parakortex a difuzní zóna kortexu (mezi GC) jsou tvořeny T-lymfocyty a jsou místem celulární imunitní odpovědi (7).
1. Mikroskopický snímek a struktura fyziologické uzliny (barvení hematoxylin-eosin; zvětšení 10x). 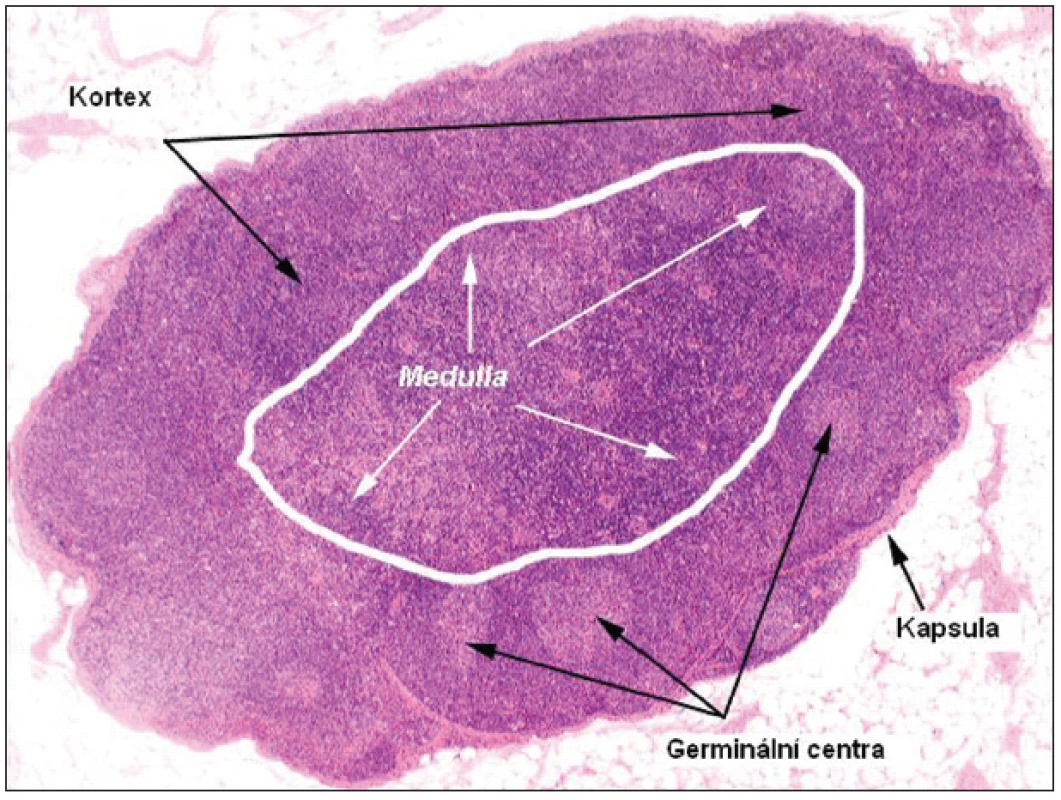
Funkce lymfocytů je závislá na interakci s dendritickými buňkami a makrofágy. Makrofágy jsou obvykle situovány na stěnách sinusů a fagocytují především okolní cizorodé antigeny, modifikují tak kontakt těchto antigenů s jinými elementy imunitního systému a prezentují antigeny fagocytovaného materiálu především T-lymfocytům. Dendritické buňky jsou tzv. profesionální antigen-prezentující buňky a v lymfatické tkáni se vyskytují minimálně ve dvou typech: folikulární dendritické buňky (FDC), které sídlí ve folikulech a interdigitující dendritické buňky lokalizované mimo folikuly (IDC). Každý typ dendritických buněk má odlišnou nejen morfologii, ale i původ a funkci. IDC pocházejí z různých částí těla, jsou především v parakortexu a uplatňují se v rámci T-buněčné odpovědi. FDC pocházejí pravděpodobně z retikulárních buněk uzliny a jsou nezbytné pro existenci a vývoj B-lymfocytů (7).
Morfologie uzliny u folikulárního lymfomu
Folikulární lymfom je definován jako neoplázie z B-buněk folikulárního respektive germinálního centra. Většina FL si obvykle zachovává folikulární charakter s folikuly rostoucími těsně vedle sebe a stírajícími původní strukturu uzliny (obr. 2). Neoplastické folikuly mají obvykle vymizelou plášťovou zónu a centroblasty jsou v různém poměru smíchány s centrocyty, takže folikuly postrádají polarizaci (rozlišitelné zóny centroblastů a centrocytů), která bývá velmi dobře vyjádřena u reaktivní lymfadenitidy (obr. 3). Poměr centrocytů k centroblastům a podíl folikulárního k difuznímu uspořádání určuje tzv. grading FL (grade 1, 2, 3A a 3B). Folikulární dendritické buňky bývají vidět uvnitř nádorových folikulů a jsou CD21+/CD23+. Kromě dendritických buněk jsou v různém počtu zastoupeny i další populace buněk normálně přítomných v germinálních centrech, jako jsou zejména T-lymfocyty (CD3+, CD4+, CD57+, PD1+, CXXCL13+). Proliferace znázorněná barvením Ki 67 bývá u gradu 1 a 2 nízká (obvykle pod 20 %) u gradu 3 vyšší (8).
2. Obraz patologických folikulů folikulárního lymfomu (barvení hematoxylin-eosin; zvětšení 100x). 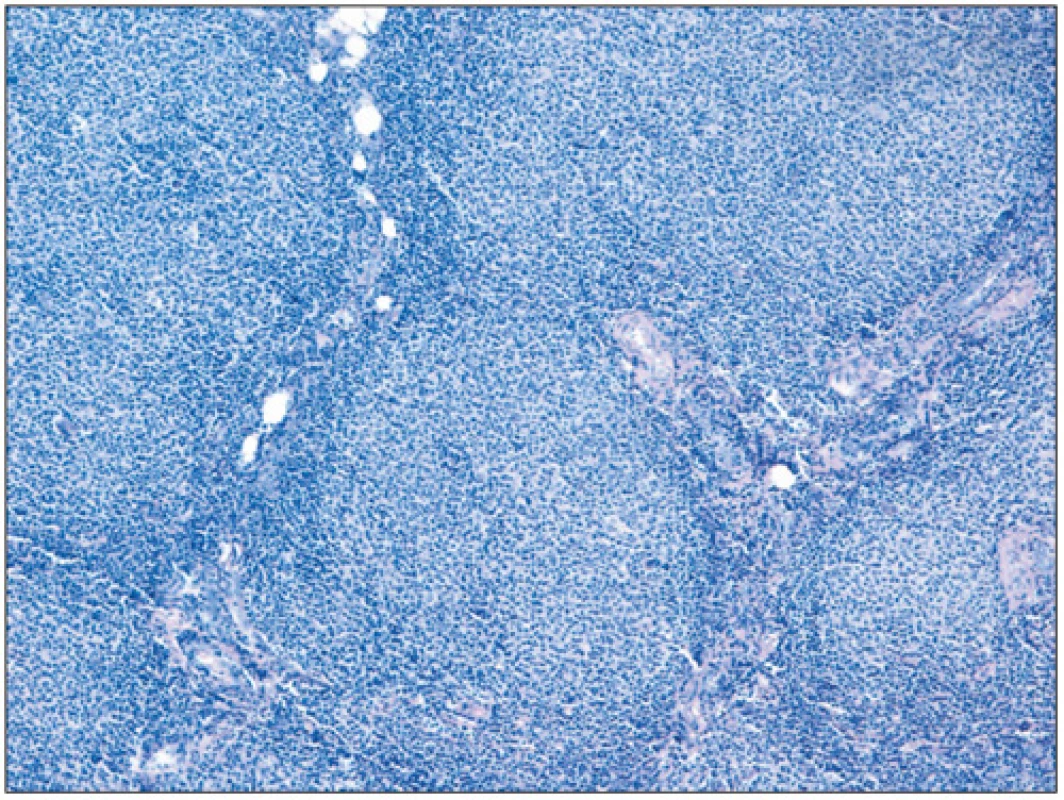
3. Obraz reaktivní lymfadenitidy/hyperplázie s polarizací folikulů (barvení hematoxylin-eosin; zvětšení 100x). 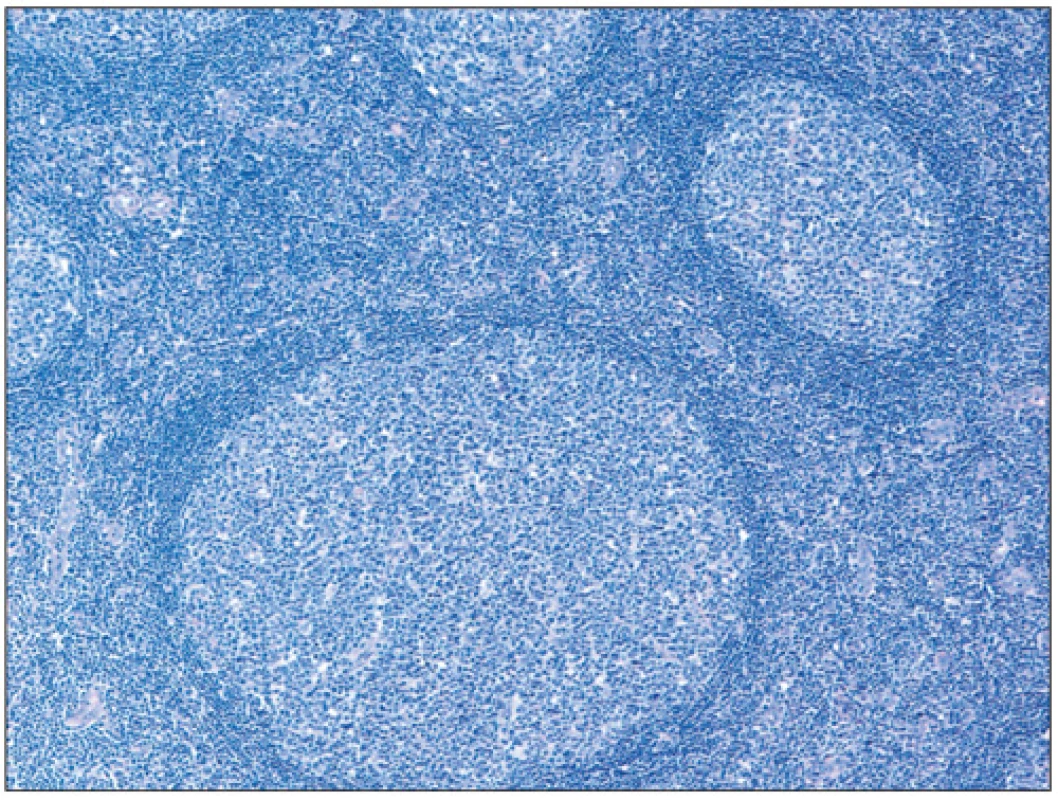
Buňka folikulárního lymfomu a t(14;18)
Folikulární lymfom si udržuje genovou expresi odpovídající B-buňce germinálního centra (6). Nádorové buňky jsou obvykle sIg pozitivní a exprimují antigeny typické pro B-lymfocyty (CD19, CD20, CD22, CD79a), markery germinálního centra Bcl-6, CD10, CD38 a kostimulační molekuly CD95 (FAS), CD86 a CD40 (8). Na rozdíl od normálních GC-buněk, většina folikulárních lymfomů exprimuje bcl-2 jako důsledek translokace t(14;18), která činí tyto buňky rezistentní vůči apoptóze. t(14;18) (q32;q21) je cytogenetickým znakem tradičně spojovaným s folikulárním lymfomem (9, 10, 11). Její výskyt u folikulárního lymfomu se pohybuje mezi 90–95 %, avšak její vztah k tomuto onemocnění není zcela objasněn. Tato translokace je totiž přítomná i u zdravých jedinců (12) a jiných lymfoproliferací (13, 14), sama o sobě navíc nedokáže způsobit vznik FL in vitro (15). K vlastní translokaci t(14;18) dochází v průběhu časné fáze vývoje B-lymfocytu v kostní dřeni a pravděpodobně mechanismem rezistence k apoptóze zvýhodňuje tak v přežívání naivní t(14;18)-pozitivní buňky. Z hlediska vývoje FL je klíčový pobyt t(14;18)-pozitivní buňky v germinálním centru, kde dochází ke vzniku sekundárních genetických změn (16). Kromě t(14;18) lze u folikulárního lymfomu detekovat řadu dalších alterací, jako jsou delece 1p, 6q, 10q a 17p, dále adice chromozomu 1, 6p, 7, 8, 12q, X a 18q (17). U 90 % FL lze zpravidla detekovat alespoň jednu další abnormalitu karyotypu s průměrem 6 chromozomálních alterací (18). Počet přídatných alterací karyotypu stoupá s histologickým gradem a transformací; komplexní karyotyp typicky koreluje s velmi špatnou prognózou (18, 19). Určitá podskupina FL gradu 3B nemá t(14;18) a zvýšenou expresi bcl-2 ale naopak přestavbu 3q27 se zvýšenou expresí bcl-6 (20). Jiná podskupina t(14;18) negativních FL s typicky difuzním růstem nese deleci 1p36 (21).
Je všeobecně akceptovaným faktem, že růst folikulárního lymfomu je u většiny pacientů dán primárně akumulací buněk v důsledku defektu apoptózy než proliferací. Na druhou stranu pokud jsou buňky FL izolovány a kultivovány in vitro, podléhají spontánní apoptóze během 24 hodin. Dlouhodobá kultivace buněk FL je však možná s populací dendritických buněk (22, 23). U FL jsou nádorové B-lymfocyty v těsné interakci s Th buňkami a folikulárními dendritickými buňkami (FDC), zdá se tedy, že buňky FL (podobně jako jejich fyziologické protějšky) vyžadují pro svůj život a růst zásadní podporu ostatních buněčných populací germinálního centra (24).
Metody detekce populací buněk nádorového mikroprostředí
Průtoková cytometrie
Fenotyp nádorových i nenádorových buněk uzliny lze dobře určit průtokovou cytometrií (flowcytometrií) s tříbarevnou fluorescencí. Pro vyšetření je nutné mít suspendovaný nativní vzorek uzliny (25). Výhodou je rychlé, přesné a automatizované hodnocení, nevýhodou je nemožnost lokalizovat populace jednotlivých buněk vzhledem k folikulům a také využít archivního materiálu v parafinu či zamražených vzorků.
TMA (tissue microarray)
V tomto případě jde o variantu klasického imunohistochemického barvení z parafínových bloků. Využívá se však pouze velmi malého válečku vyříznutého z původního bločku. Válečky z různých bločků (obvykle 1,5 mm v průměru) se skládají do nového „bločku“ (araye), z níž jsou nařezány jednotlivé řezy – jakési tkáňové „čipy“. Počet daných buněk se počítá manuálně nebo speciálním automatickým systémem. Výhodou metody je snadná dostupnost materiálu z parafínových bloků, kromě stanovení kvantity je i možná lokalizace buněčných populací (intrafolikulární vs. interfolikulární), nevýhodou je menší přesnost (26).
„Hráči“ nádorového mikroprostředí folikulárního lymfomu a duální charakter folikulární lymfomu
Výsledné klinické chování FL lze chápat jako účinek vzájemného působení genomových a imunologických faktorů. Je jasné, že primárním faktorem vzniku FL je existence nádorového klonu buněk s primární alterací typu t(14;18) umožňující delší přežití a jistou nezávislost na apoptotických případně antiproliferačních signálech. Zda získání sekundárních genetických alterací ovlivňuje také chování a strukturu mikroprostředí, nebo jistý typ mikroprostředí ovlivňuje od počátku vlastnosti nádorových buněk, není dosud zcela jasné.
Buňky, které budí velký zájem mezi kliniky i výzkumníky, jsou folikulární dendritické buňky (FDC), cytotoxické lymfocyty (CD8+), T-regulační lymfocyty (FOXP3), T-helpery (CD4+) a s lymfomem asociované makrofágy (LAM).
Folikulární dendritické buňky (FDC)
FDC jsou nefagocytující buňky, které jsou schopny vázat delší čas antigeny ve formě imunitních komplexů a rozhodují o dalším osudů centrocytů v závislosti na jejich afinitě k danému antigenu. FDC jsou CD21+CD23+ +CD35+CD40+ buňky, které tvoří zhruba 1 % všech buněk GC. Zajišťují především antiapoptotické a růstové signály pro proliferaci centroblastů v místech tmavé zóny GC, kde je fyziologicky nedostatek antigenem aktivovaných T-buněk. FDC komunikují s lymfocyty pomocí adhezivních molekul (ICAM-1 = intercellular adhesion molecule-1, VCAM-1 = vascular cell adhesion molecule-1), které zvyšují intercelulární kontakt, a tím usnadňují antiapoptotické funkce jiných molekul. Další skupinou látek produkovaných FDC jsou molekuly s přímým anti-apoptotickým (BAFF/BLys) a přímým proliferačním efektem (8D6, IL-15 a IL-6) (22, 27). Zdá se, že uvedené vztahy platí jak pro fyziologické B-lymfocyty, tak i pro buňky folikulárního lymfomu (22). FDC naopak pro svoji normální existenci a funkci nutně potřebují signály od ostatních buněk zejména od B-lymfocytů germinálního centra. Tato vzájemná závislost má velmi zásadní implikace v klinické praxi, poněvadž destrukce B-buněk například rituximabem, může způsobit poruchu vývoje a fungování dendritických buněk, jak bylo pozorováno u autoimunitních chorob (28, 29).
Na význam FDC upozornila analýza genové exprese, přičemž zvýšená exprese genů dendritických buněk zde byla sdružena se zkráceným přežitím (6). Ve studii imunofenotypu mikroprostředí FL (n = 66) byla absence FDC nebo výrazně porušená síť dendritických buněk naopak asociována s časnou transformací a horší prognózou (30). Ovšem v jiné studii pacientů s nodálními FL (n=158) léčenými různými typy léčby (včetně vysokodávkované) nebyl význam FDC pozorován (31). V zajímavé analýze vycházející z randomizovaného srovnání režimů CVP (cyklofosfamid, vinkristin, prednison) a fludarabinu u 61 pacientů s FL byl pozorován odlišný prognostický význam FDC v závislosti na typu podané léčby. Sporadický výskyt FDC s lepší odpovědí po fludarabinu vs CVP, naopak dobře vyvinutá síť FDC byla asociována s lepší odpovědí po CVP (32).
T - buňky
T-lymfocyty představují velmi heterogenní skupinu imunitních elementů zahrnující jak regulační, tak i efektorové buňky. Dle analýzy genové exprese byla v rámci „Immune response 1“ s dobrou prognózou zvýšená exprese genů typických pro T-buňky (CD7, CD8, CD3D...), avšak imunofenotypizací nebyla prokázána korelace mezi celkovým počtem T-buněk (CD3+) a prognózou pacientů s FL, což znamená, že za rozdílnou prognózu jsou zodpovědné spíše speciální podskupiny T-buněk (6).
Th-lymfocyty (CD4+)
In vivo představují zejména T-helpery (CD4+) hlavní zdroj CD40L pro vazbu na receptor CD40 B-lymfocytů. Tato ligace je jedním ze silných stimulátorů proliferace a přežití B-buněk. Th-buňky a CD40L chrání před apoptózou jak normální B-lymfocyty tak buňky FL. V souladu s in vitro důkazy o důležité roli CD40L+ nenádorových buněk, je v infiltrovaných uzlinách FL zřejmá hojnost polyklonálních T-buněk, zejména Th lymfocytů (24). Proliferace maligních buněk je stimulovaná IL-4 a jinými cytokiny uvolňovanými taktéž z buněk T-původu (33).
Analýza mikroprostředí FL (n = 59; sledování 6–30 let) využívající tissue microarray (TMA) ukázala, že déle žijící pacienti měli vyšší zastoupení CD4+buněk zejména v perifolikulární lokalizaci (34). Obdobné závěry imunohistochemického hodnocení u FL publikoval i Alvaro a kol. (n=211; medián sledování 6 let) (35). Také v práci kombinující analýzu genové exprese a imunohistochemii byl prokázán vztah mezi počtem infiltrujících CD4+ buněk zejména v interfolikulárním prostoru a aktivovaného stavu T-buněk (CD69+) k transformaci FL na souboru 66 pacientů (30). V jiné studii 61 pacientů s pokročilým FL byla rovněž pozorována dobrá korelace počtu CD4+buněk a příznivé prognózy, která navíc nezávisela na typu podané léčby (CVP vs fludarabin) (32). Na druhou stranu jsou práce, které žádnou korelaci mezi počty CD4+ buněk a přežitím pacientů s FL nenalezly (36, 37, 38).
T-regulační lymfocyty (Treg); FOXP3+
T-regulační lymfocyty (Treg) s imunofenotypem CD4+CD25+ hrají zásadní roli v navození imunotolerance zejména supresí T-efektorových buněk jak na úrovni jejich proliferace, tak i produkce cytokinů. Relativně specifický znak Treg buněk je transkripční faktor FOXP3 (Forkhead Box Protein P3) (39). Masivní přítomnost Treg (FOXP3+) buněk u solidních nádorů, např. u ovariálního karcinomu, je spojená se špatnou prognózou (40). Narozdíl od solidních nádorů se u FL jeví prognostický význam FOXP3 buněk zcela opačný. Předpokládá se, že možný mechanismus působení Treg buněk spočívá v supresi protektivních CD4+lymfocytů (T-helperů) generujících antiapoptotické a proliferační molekuly.
Většina studií u pacientů s folikulárním lymfomem dokládá pozitivní korelaci vysokého počtu FOXP3 buněk ve tkáni infiltrované uzliny s dobrou prognózou (32, 34, 36, 41). Carreras a kol. prokázali, že absolutní počet FOXP3 buněk stanovený imunohistochemicky (n = 97; medián sledován 5,6 roku) pozitivně koreluje s přežitím a dobrou prognózou FL a naopak nízké počty Treg buněk (< 5 %) jsou asociovány s refrakterní chorobou, přičemž výsledky byly nezávislé na FLIPI. Významná byla zejména intrafolikulární infiltrace FOXP3+ buňkami (36). Jiná práce hodnotila řadu buněčných elementů (CD4+, CD7+, CD8+, CD25+, CD68+ a FOXP3+) metodou tissue microarray (n = 59). Vyšší počet CD4+ a FOXP3+ buněk v perifolikulární lokalizaci byl i zde prediktorem delšího celkového přežití (34). Další velká studie (n = 86; medián sledování 7 let) srovnávající absolutní počty FOXP3+ buněk u různých lymfoproliferací prokázala pozitivní korelaci vysokého počtu FOXP3+ buněk u FL s delší dobou do progrese a přežitím vázaným na nemoc (disease-specific survival). V této studii byl podobný efekt FOXP3+ buněk také pozorován u difuzního velkobuněčného lymfomu (GC-typ) a klasického Hodgkinova lymfomu (41). Obdobný prognostický význam FOXP3+ bez ohledu na podaný typ léčby (fludarabin vs CVP) byl u FL potvrzen i další studií (32). Naproti tomu jiné studie prognostický význam FOXP3 neprokázaly (30, 35) nebo prokázaly význam opačný – intrafolikulární infiltráty FOXP3+ buněk asociované s krátkým přežitím (38, 42).
CD8+ buňky
Efektorové nebo také cytotoxické lymfocyty jsou CD8+ a podléhají regulačnímu vlivu jiných buněk. Zdá se, že lze odlišit alespoň dva funkční typy cytotoxických T-lymfocytů: Tc1, které produkují vysoké množství IFNγ a Tc2, které produkují interleukin-4, interleukin-5, interleukin-10 a malé množství IFNγ (43). Tyto podtypy mohou mít v důsledku různých povrchových receptorů a produkovaných cytokinů i různou schopnost pronikat do nádorové tkáně a také různou efektorovou funkci. Určitá podskupina CD8+ lymfocytů může mít i regulační funkce (tzv. CD8+ FOXP3+ buňky) (44).
Ze studie 139 pacientů s FL vyplývá, že vyšší zastoupení CD8+ buněk v bioptických vzorcích (měřeno průtokovou cytometrií) koreluje pozitivně s celkovým přežitím a dobou do progrese. Počet CD8+ nebyl jakkoli závislý na jiných populacích buněk ani na FLIPI. Imunohistochemicky byly CD8+ buňky uloženy uvnitř i vně nádorových folikulů, nejčastěji perifolikulárně (45). Shodné výsledky byly pozorovány i v jiné imunohistochemické analýze FL (n = 211; medián sledování 6 let) (35). Denzní infiltráty zejména v interfolikulární lokalizaci byly rovněž sdruženy s dobrou prognózou v práci analyzující 61 pacientů s FL léčených randomizovaně fludarabinem nebo režimem CVP (32). Naopak v jiné studii nebyl význam CD8+ buněk vůbec prokázán (30).
Makrofágy asociované s lymfomem (LAMs)
Makrofágy se v lidském organismu účastní mnoha různých procesů. V závislosti na prostředí rozeznáváme klasické „zánětlivé“ makrofágy M1, které jsou indukovány IL-12 a TNF-α, a „alternativní“ makrofágy M2, které se účastní tvorby a remodelace tkání a jsou stimulovány IL-4, IL-13 a IL-10. Makrofágy M2 fenotypu hrají pravděpodobně význam u FL (46, 47) a představují takzvané s tumorem/lymfomem-asociované makrofágy (TAM/LAM = tumor/lymphoma associated macrophages). TAM/LAM jsou v jistém smyslu přeprogramovány a indukují supresi v hostitelské imunitní odpovědi uvolněním cytokinů, prostanoidů a dalších mediátorů in situ. Makrofágy také poskytují maligním B-buňkám signály potřebné k jejich růstu a přežití, produkují angiogenní působky, ovlivňují funkci dendritických a Treg buněk (47).
Přítomnost CD68+ makrofágů je dle velké většiny studií sdružena s horší prognózou a kratším přežitím u pacientů s FL (37, 42, 46, 48). 211 pacientů léčených různými typy léčby bylo hodnoceno z hlediska přítomnosti CD68+ buněk a exprese STAT-1 (signal transducer and activator of transcription-1; mediátor interferonem mediované signální dráhy). Zvýšená přítomnost obou uvedených parametrů byla asociována s horší prognózou (medián sledování 6 let) a sice nezávisle na FLIPI (46). Obdobné výsledky publikovali i další autoři (38, 42). Prognostický účinek CD68+ buněk může být, zdá se, anulován léčbou obsahující rituximab (42, 48, 49). Ve studii 96 pacientů s FL léčených R-CHOP (rituximab, cyklofosfamid, vinkristin, adriamycin, prednizon) byl dokonce pozorován pozitivní prognostický efekt zvýšeného počtu CD68+buněk (49). Dle randomizované studie 61 pacientů s FL léčených fludarabinem nebo CVP se jeví, že také různé typy chemoterapie ovlivňují prognostický význam LAM (32). Existují však také práce, které význam CD68+ buněk jako prognostického faktoru u FL nepodporují (30, 34).
Další buňky s potenciálním prognostickým významem
Ojediněle jsou publikované práce zaměřené na význam jiných buněk, jako jsou například T-lymfocyty nesoucí molekulu PD-1 (programmed cell death 1). PD-1 je důležitá v regulaci buněk germinálních center, ale její význam v nádorové imunitě není přesně znám. Svým inhibičním účinkem oslabují T-buněčnou odpověď, a tím mohou umožnit nádorovou expanzi, jde vlastně o jistou alternativu FOXP3+. Infiltrace PD-1 pozitivních buněk (CD3+CD4+CD25-) korelovala pozitivně s dobrou prognózou a negativně s transformací FL (50). Infiltráty mastocyty – s tumorem asociovanými mastocyty (MCs) – byly ve studii 98 pacientů léčených R-CHOP sdruženy s horší prognózou a byly schopny eliminovat pozitivní efekt makrofágů po imunochemoterapii (51). Také infiltráty NK buňkami (CD57+) byly sdruženy s horší prognózou (35).
Vliv různých léčebných modalit na komponenty mikroprostředí u folikulárního lymfomu
Výsledky studií zkoumajících význam mikroprostředí lze jen velmi obtížně shrnout a snadno interpretovat, neboť jsou značně nejednotné (tab. 1). Heterogenita výsledků je zčásti dána různou koncepcí a metodikou, ale z několika studií vyplývá, že zejména typ léčebného režimu může zásadně modifikovat prognostický význam komponent mikroprostředí (42, 51). Z tohoto pohledu je pozoruhodná práce, která navázala na randomizovanou studii zkoumající účinnost fludarabinu vs režim CVP (cyklofosfamid, vinkristin a prednizon) probíhající v 90. letech minulého století (32). V rámci této studie bylo vybráno 61 pacientů s dostupnou biopsií pro imunohistochemickou analýzu metodou tissue microarray (31 léčených fludarabinem a 30 léčených CVP). Exprese CD69 na nádorových buňkách (marker aktivace lymfocytů) byla identifikována jako negativní a intrafolikulární FOXP3+ infiltráty jako příznivý prognostický faktor bez ohledu na typ podané léčby. Zatímco denzní infiltráty FOXP3+buněk a interfolikulární infiltráty CD68+buněk stejně jako kompletní síť dendritických buněk byly sdruženy s lepší prognózou v rameni CVP ale současně s horší prognózou v rameni s fludarabinem (32). Na základě těchto rozdílných výsledků a se znalostí mechanismu účinků fludarabinu lze vyslovit hypotézu, že CVP působí přímo na nádorové buňky, zatímco fludarabin je lymfocytotoxický nejen pro buňky FL, ale ovlivňuje výrazně také mikroprostředí – zejména T-buňky. Tuto studii a její výsledky lze současně považovat za určitý modelový příklad. Z výsledků dalších studií vyplývá, že i další léčebné modality mají pravděpodobně různý vliv na mikroprostředí FL. Rituximab svým působením na B-lymfocyty nepřímo ovlivňuje dendritické buňky a „vakcinačním efektem“ zase vede ke stimulaci T-lymfocytů (28, 29, 52). Vliv na mikroprostředí u FL byl rovněž popsán po nízkých dávkách radioterapie (2 x 2Gy) a týkal se hlavně makrofágů a cytotoxických T-lymfocytů (53). Možnosti působení různých léčebných modalit včetně chemoterapie typu CHOP/CVP, fludarabinu, radioterapie (2 x 2Gy) a rituximabu si můžeme představit na zjednodušeném schématu 1.
1. Přehled studií zkoumajících význam nádorového mikroprostředí folikulárního lymfomu. 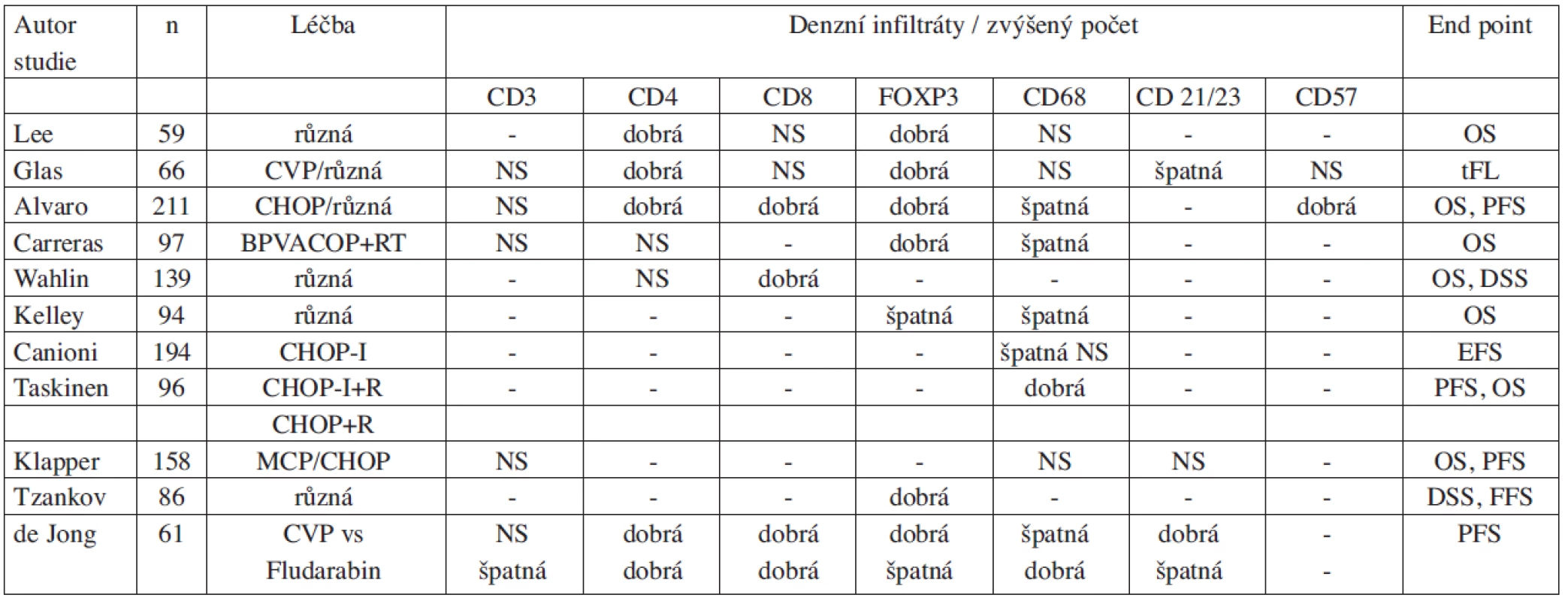
Legenda: Ve snaze zajistit maximální přehlednost není vyznačeno rozlišení mezi intrafolikulárními a interfolikulárními infiltráty. CVP – cyklofosfamid, vinkristin, prednizon; CHOP – cyklofosfamid, adriamycin, vinkristin, prednizon; BPVACOP+RT – bleomycin, cisplatina, etopozid, doxorubicin, vinkristin, prednizon, radioterapie; CHOP-I – cyklofosfamid, adriamycin, vinkristin, prednizon, interferon alfa; MCP – mitoxantron, chlorambucil, prednizon; R – rituximab; NS – nesignifikantní; OS – overal survival (celkové přežití); tFL – transformace folikulárního lymfomu; PFS – progression free survival (doba do progrese); DSS – disease specific survival (přežití vázané na nemoc); EFS – event free survival (doba do události); FFS – failure free survival (přežití do selhání léčby) Schéma 1. A-D. Model Interakce B-buněk FL s mikroprostředím a vliv různých typů léčby. Červenými čarami je vyjádřeno působení dané modality na jednotlivé komponenty nádoru. A. režim CVP (cyklofosfamid, vinkristin, prednizon); B. Fludarabin; C. Rituximab; D. Radioterapie (2x2Gy) 
Závěr
Na folikulární lymfom lze na základě výše uvedených výsledků nahlížet jako na funkční interakci nádorového klonu buněk s primární chromozomální odchylkou t(14;18) (eventuálně jinou adekvátní) a okolním imunitním systémem. Tuto skutečnost podporuje řada klinických pozorování a také analýzy nádorového mikroprostředí uzliny folikulárního lymfomu. Pozoruhodné je zjištění, že různé léčebné modality mohou působit odlišně na komponenty nádorového prostředí a tím patrně i modifikovat výslednou prognózu u konkrétního nemocného. Dosavadní výsledky vyvolávají celou řadu otázek týkajících se jednak dalších možných elementů mikroprostředí, podtypů již definovaných populací buněk a také dalšího výzkumu účinku jednotlivých léčebných modalit na nádorové mikroprostředí.
Doručeno do redakce: 8. 2. 2010
Přijato po recenzi: 29. 3. 2010
MUDr. Andrea Janíková, Ph.D.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: ajanikova@fnbrno.cz
Sources
1. Gattiker HH, Wiltshaw E, Galton DA. Spontaneous regression in non-Hodgkin’s lymphoma. Cancer 1980; 45 : 2627-32.
2. Tan D, Horning SJ. Hematol Oncol Clin North Am 2008; 22 : 863-82.
3. Montoto S, Davies AJ, Matthews J, et al. Risk and clinical implications of transformation of follicular lymphoma to diffuse large B-cell lymphoma. J Clin Oncol 2007; 25 : 2426-33.
4. Mandingers CM, Verdonck LF, Meijerink JP, et al. Graft-versus-lymphoma effect of donor lymphocyte infusion in indolent lymphomas relapsed after allogeneic stem cell transplantation. Bone Marrow Transplant 2003; 32 : 1159-63.
5. Janikova A, Mayer J, Kren L, et al. The persistence of t(14;18)-bearing cells in lymph nodes of patients with follicular lymphoma in complete remission: the evidence for ‚a lymphoma stem cell‘. Leuk Lymphoma 2009; 50 : 1102-9.
6. Dave SS, Wright G, Tan B, et al. Prediction of survival in follicular lymphoma based on molecular features of tumor-infiltrating immune cells. N Engl J Med 2004; 351 : 2159-69.
7. Paraskevas F. Lymphocytes and lymphatic organs. In: Wintrobeęs Clinical Hematology – 12th ed./ Greer JP eds., Lippincott Williams and Wilkins, Philadelphia 2009.
8. Swerdlow SH, Campo E, Hartus NL, et al. Follicular lymphoma. In: WHO classification of tumours of haematopoietic and lymphoid tissues. International Agency for Research on Cancer: Lyon, 2008.
9. Bakhshi A, Wright JJ, Graninger W, et al. Mechanism of the t(14;18) chromosomal translocation: structural analysis of both derivative 14 and 18 reciprocal partners. Proc Natl Acad Sci USA 1987; 84 : 2396-400.
10. Cleary ML, Sklar J. Nucleoside sequence of a t(14;18) chromosomal breakpoint in follicular lymphoma and demonstration of breakpoint-cluster region near a transcriptionally active locus on chromosome 18. Proc Natl Acad Sci USA 1985; 82 : 7439-43.
11. Tsujimoto Y, Croce CM. Analysis of the structure, transcripts, and protein products of bcl-2, the gene involved in human follicular lymphoma. Proc Natl Acad Sci USA 1986; 83 : 5214-18.
12. Limpens J, Stad R, Vos C, et al. Lymphoma-associated translocation t(14;18) in blood B-cells of normal individuals. Blood 1995; 85 : 2528-36.
13. Meijerink JPP. t(14;18), a journey to eternity. Leukemia 1998; 11 : 2175-87.
14. Papajík T, Jedličková K, Kriegová E, et al. Polymerase chain reaction detection of cells carrying t(14;18) in bone marrow of patients with follicular and diffuse large B-cell lymphoma: the importance of analysis at diagnosis and significance of long term follow-up. Neoplasma 2001; 6 : 501-5.
15. McDonnell TJ, Deane N, Platt FM, et al. Bcl-2-immunoglobulin transgenic mice demonstrate extended B cell survival and follicular lymphoproliferation. Cell 1989; 57 : 79-88.
16. Roulland S, Navarro JM, Grenot P, et al. Follicular lymphoma-like B cells in healthy individuals: a novel intermediate step in early lymphomagenesis. J Exp Med 2006; 203 : 2425-31.
17. Martinez-Climent JA, Alizadeh AA, Segraves R, et al. Transformation of follicular lymphoma to diffuse large cell lymphoma is associated with a heterogeneous set of DNA copy number and gene expression alterations. Blood 2003; 101 : 3109-17.
18. Horsman DE, Connors JM, Pantzar T, et al. Analysis of secondary chromosomal alterations in 165 cases of follicular lymphoma with t(14;18). Gen Chrom Cancer 2001; 30 : 375-82.
19. Yunis JJ, Frizzera G, Oken MM, et al. Multiple recurrent genomic defects in follicular lymphoma: a possible model for cancer. N Engl J Med 1987; 316 : 79-84.
20. Jardin F, Gaulard P, Buchonnet G, et al. Follicular lymphoma without t(14;18) and with bcl-6 rearrangement: a lymphoma subtype with distinct pathological, molecular and clinical characteristics. Leukemia 2002; 16 : 2309-17.
21. Katzenberger T, Kalla J, Leich E, et al. A distinctive subtype of t(14;18)-negative nodal follicular lymphoma non-Hodgkin lymphoma characterized by a predominantly diffuse growth pattern and deletions in the chromosomal region 1p36. Blood 2009; 113 : 1053-61.
22. Goval JJ, Thielen C, Bourguignon C, et al. The prevention of spontaneous apoptosis of follicular lymphoma B cells by a follicular dendritic cell line: involvement of caspase-3, caspase-8 and c-FLIP. Haematologica 2008; 93 : 1169-77.
23. Kagami Y, Jung J, Choi YS, et al. Establishment of a follicular lymphoma cell line (FLK-1) dependent on follicular dendritic cell-like cell line HK. Leukemia 2001; 15 : 148-56.
24. Carbone A, Gloghini A, Gruss HJ, et al. CD40 ligand is constitutively expressed in a subset of T cell lymphomas and on the microenvironmental reactive T cells of follicular lymphomas and Hodgkinęs disease. Am J Pathol 1995; 147 : 912-22.
25. Ray S, Craig FE, Swerdlow SH. Abnormal patterns of antigenic expression in follicular lymphoma: a flow cytometric study. Am J Clin Pathol 2005; 124 : 576-83.
26. Hedvat CV, Hegde A, Chaganti RSK, et al. Application of tissue microarray technology to the study of Non-Hodgkinęs and Hodgkinęs lymphoma. Hum Pathol 2002; 33 : 968-74.
27. Park CS, Choi YS. How do follicular dendritic cells interact intimately with B cells in the germinal centre? Immunology 2005; 114 : 2-10.
28. Edwards JC, Szcepanski L, Szechinski J, et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350 : 2572-81.
29. Shaw T, Juan J, Totoritis MC. B cell therapy for rheumatoid arthritis: the rituximab (anti-CD20) experience. Ann Rheum Dis 2003; 62(Suppl 2): 55-9.
30. Glas AM, Knoops L, Delahaye L, et al. Gene-expression and Immunohistochemical Study of specific T-cell subsets and accessory cell types in the transformation and prognosis of follicular lymphoma. J Clin Oncol 2007; 25 : 390-8.
31. Klapper W, Hoster E, Rölver L, et al. Tumor sclerosis but not cell proliferation or malignancy grade is a prognostic marker in advanced-stage follicular lymphoma: the German Low Grade Lymphoma Study Group. J Clin Oncol 2007; 25 : 3330-6.
32. De Jong D, Koster A, Hagenbeek A, et al. Impact of the tumor microenvironment on prognosis in follicular lymphoma is dependent on specific treatment protocols. Haematologica 2009; 94 : 70-7.
33. Schmitter D, Koss M, Niederer E, et al. T-cell derived cytokines co-stimulate proliferation of CD40-activated germinal centre as well as follicular lymphoma cells. Hematol Oncol 1997; 15 : 197-207.
34. Lee AM, Clear AJ, Calaminici M, et al. Number of CD4+ cells and location of Fork head Box Protein P3-positive cells in diagnostic follicular lymphoma tissue microarrays correlates with outcome. J Clin Oncol 2006; 24 : 5052-9.
35. Alvaro T, Lejeune M, Salvado MT, et al. Immunohistochemical patterns of reactive microenvironment are associated with clinicobiologic behavior in follicular lymphoma patients. J Clin Oncol 2006; 24 : 5350-7.
36. Carreras J, Lopez-Guillermo A, Fox BC, et al. High numbers of tumor-infiltrating FOXP3-positive regulatory T cells are associated with improved overall survival in follicular lymphoma. Blood 2006; 108 : 2957-64.
37. Farinha P, Masoudi H, Skinnider BF, et al. Analysis of multiple biomarkers shows that lymphoma-associated macrophage (LAM) content is an independent predictor of survival in follicular lymphoma (FL). Blood 2005; 106 : 2169-74.
38. Lee AM, Clear AJ, Morris KJ, et al. The impact of tumor microenvironment in diagnostic follicular lymphoma samples using tissue microarrays. Ann Oncol 2008; 19 (Suppl 4): 126 (abstr No 131).
39. Roncador G, Brown PJ, Maestre L, et al. Analysis of FOXP3 protein expression in human CD4_CD25_regulatory T cells at the single-cell level. Eur J Immunol 2005; 35 : 1681-91.
40. Curiel TJ, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med 2004; 10 : 942-9.
41. Tzankov A, Meier C, Hirschmann P, et al. Correlation of high numbers of intratumoral FOXP3+ regulatory T cells with improved survival in germinal center-like diffuse large B-cell lymphoma, follicular lymphoma and classical Hodgkinęs lymphoma. Haematologica 2008; 93 : 193-200.
42. Kelley T, Beck R, Absi A, et al. Biologic predictors in follicular lymphoma: importance of markers of immune response. Leuk Lymphoma 2007; 48 : 2403-11.
43. Delfs MW, Furukawa Y, Mitchel RN, et al. CD8+ T cell subsets TC1 and TC2 cause different histopathologic forms of murine cardiac allograft rejection. Transplantation 2001; 71 : 606-10.
44. Zou W. Regulatory T cells, tumor immunity and immunotherapy. Nat Rev Immunol 2006; 6 : 295-307.
45. Wahlin BE, Sander B, Christensson B, et al. CD8+ T-cell content in diagnostic lymph nodes measured by flow cytometry is a predictor of survival in follicular lymphoma. Clin Cancer Res 2007; 13 : 388-97.
46. Alvaro T, Lejeune M, Camacho FI, et al. The presence of STAT1-positive tumor-associated macrophages and their relation to outcome in patients with follicular lymphoma. Haematologica 2006; 91 : 1605-12.
47. Mantovani A, Sozzani S, Locati M, Allavena P, Sica A. Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol 2002; 23 : 549-55.
48. Canioni D, Salles G, Mounier N, et al. High numbers of tumor-associated macrophages have an adverse prognostic value that can be circumvented by rituximab in patients with follicular lymphoma enrolled onto the GELA-GOELAMS FL-2000 trial. J Clin Oncol 2008; 26 : 440-6.
49. Taskinen M, Karjalainen-Lindsberg Ml, Nyman H, et al. A high tumor-associated macrophage content predicts favorable outcome in follicular lymphoma patients treated with rituximab and cyclophosphamide-doxorubicin-vincristin-prednisone. Clin Cancer Res 2007; 13 : 5784-9.
50. Carreras J, Guillermo AL, Roncador G, et al. High numbers of tumor-infiltrating programmed cell death 1-positive regulatory lymphocytes are associated with improved overall survival in follicular lymphoma. J Clin Oncol 2009; 27 : 1470-6.
51. Taskinen M, Karjalainen-Lindsberg ML, Leppä S. Prognostic influence of tumor-infiltrating mast cells in patients with follicular lymphoma treated with rituximab and CHOP. Blood 2008; 111 : 4664-7.
52. Hilchey SP, Hyrien O, Mosmann TR, et al. Rituximab immunotherapy results in the induction of a lymphoma idiotype-specific T-cell response in patients with follicular lymphoma: support for a „vaccinal effect“ of rituximab. Blood 2009; 113 : 3809-12.
53. Knoops L, Haas R, de Kemp S, et al. In vivo p53 response and immune reaction underlie highly effective low-dose radiotherapy in follicular lymphoma.Blood 2007; 110 : 1116-22.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 3-
All articles in this issue
- Global assessment of haemostatic function - part II. Our experience with thrombin generation test using in thrombophilia patients
- The efficacy of the CTD regimen (cyclophosphamide, thalidomide, dexamethasone) in therapy of relapsed and refractory multiple myeloma
- Diverse asparagine synthetase expression in lymphoid blasts is not relevant to the sensitivity to L-Asparaginase
- Cytomegalovirus – specific cellular imunity: profile of immune function assesment provides clinically relevant answer
- Follicullar lymphoma and the significance of its tumour microenvironment
- Hairy cell leukemia – diagnostics, treatment and monoclonal antibodies
- Immunophenotypic characterization of acute leukemias of ambiguous lineage- new diagnostic entity of the revised WHO classification 2008
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hairy cell leukemia – diagnostics, treatment and monoclonal antibodies
- Follicullar lymphoma and the significance of its tumour microenvironment
- Cytomegalovirus – specific cellular imunity: profile of immune function assesment provides clinically relevant answer
- Immunophenotypic characterization of acute leukemias of ambiguous lineage- new diagnostic entity of the revised WHO classification 2008
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


