-
Medical journals
- Career
Imunoterapie rituximabem v kombinaci s dexametazonem následovaná podáním 90Y - ibritumomab tiuxetanu u předléčených nemocných s relabovaným folikulárním lymfomem
Authors: T. Papajík 1; T. Szotkowski 1; V. Procházka 1; Z. Kubová 1; V. Heinzová 2; M. Brejcha 3; J. Drymlová 4; E. Buriánková 4; P. Koranda 4; M. Mysliveček 4; L. Kučerová 5; K. Indrák 1
Authors‘ workplace: Hemato-onkologická klinika FNO a LF UP v Olomouci, 2Hematologické a transfúzní oddělení nemocnice Opava 1; Onkologické centrum J. G. Mendela Nový Jičín, 4Klinika nukleární medicíny FNO a LF UP v Olomouci 3; Oddělení patologie FNO a LF UP v Olomouci 5
Published in: Transfuze Hematol. dnes,13, 2007, No. 4, p. 209-215.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Zavedení léčby monoklonálními protilátkami (MoAb) přineslo naději na zlepšení prognózy nemocných s folikulárním lymfomem (FL). Rituximab (anti-CD20 chimérická monoklonální protilátka, MabThera®) byl první vysoce efektivní a netoxickou cílenou léčbou pomocí MoAb u FL. Další zvýšení účinku MoAb bylo dosaženo jejich spojením s radioizotopem. 90Y-ibritumomab tiuxetan (Zevalin®) je prvním představitelem nového léčebného směru - radioimunoterapie (RIT), který byl registrován pro standardní klinické použití u relabujících a refrakterních nemocných s FL. Řada klinických studií prokázala jeho účinnost a bezpečnost i u nemocných v pokročilém stadiu choroby. Podle nejnovějších dat se jeví jako optimální použít RIT jako konsolidační léčbu poté, co vhodnou předchozí terapií redukujeme nádorovou masu. V našem sdělení popisujeme případy 3 nemocných s relabovaným FL, kteří byli léčeni monoterapií – 4 dávkami rituximabu (375 mg/m²) a dexametazonu (20 mg/m²) v týdenním intervalu. Důvodem indikace monoterapie rituximabem byl vyšší věk nemocných, jejich předléčenost, přidružené choroby nebo obavy pacienta z následků chemoterapie. Všichni nemocní dosáhli po rituximabu léčebnou odpověď, kterou ale nebylo možno hodnotit jako kompletní remisi – u všech byla prokázána zbytková choroba. Proto byl jako konsolidační léčba indikován 90Y-ibritumomab tiuxetan (Zevalin®) v dávce 14,8 MBq/kg u dvou pacientů a 11,1 MBq/kg u jednoho nemocného s nižším výchozím počtem trombocytů (125x109/l). Nadiru hematologických parametrů bylo dosaženo za 4–6 týdnů od podání RIT. Neutropenie stupně 3 byla zaznamenána u jednoho, trombocytopenie stupně 4, respektive stupně 3 u dvou pacientů. U dvou pacientů byly léčba 90Y-ibritumomab tiuxetanem provázena infekčními komplikacemi (akutní bronchitida a enteritida). V odstupu 2–3 měsíců od RIT bylo u všech nemocných provedeno kombinované vyšetření pozitronovou emisní tomografií a počítačovou tomografií (PET/CT), které neprokázalo akumulaci 18F-fluoro-deoxy-glukózy (18F-FDG) v žádné z dříve postižených lymfatických uzlin. Na CT snímcích byly u 2 nemocných zjištěny uzliny o maximální velikosti 2x1 cm. Léčebná odpověď u nich byla hodnocena jako nepotvrzená kompletní remise (CRu) choroby. U třetí nemocné byl stav hodnocen jako kompletní remise (CR). 11, 9 a 7 měsíců po podání RIT jsou všichni nemocní v remisi choroby a bez výskytu pozdních komplikací léčby.
Klíčová slova:
folikulární lymfom, 90Y-ibritumomab tiuxetan, rituximab, pozitronová emisní tomografie, remiseÚvod
Folikulární lymfom (FL) představuje druhý nejčastější podtyp nehodgkinského lymfomu (NHL). Obecně platí, že z velké části jde o pomalu postupující lymfoproliferativní onemocnění, často označované jako “nízce maligní”, u něhož kombinovaná chemoterapie sice vede k ústupu choroby, ale jen výjimečně k vyléčení pacienta. U drtivé většiny nemocných se choroba po různě dlouhém bezpříznakovém intervalu znovu objeví a vyžaduje další léčbu (1). Zavedení monoklonálních protilátek do léčby relabovaných FL výrazně zlepšilo možnosti volby účinné a přitom šetrné terapie pro tuto skupinu – často starších a předléčených pacientů s dalšími chorobami. Rituximab (anti-CD20 chimerická monoklonální protilátka) prokázal svou účinnost v monoterapii relabovaného FL, když u 60 % nemocných byla konstatována objektivní léčebná odpověď, jejíž medián trvání přesahoval 1 rok (2). Ve snaze dále zlepšit léčebné výsledky a prodloužit jejich trvání, byla na jedné straně imunoterapie úspěšně kombinována s chemoterapií (3), na straně druhé se objevily snahy spojit (konjugovat) monoklonální protilátky s dalšími účinnými látkami. Monoklonální protilátka by v tomto případě jednak sama, resp. ve spolupráci s imunitním systémem organismu narušila metabolické děje nádorové buňky, ale zároveň by přímo k nádoru dopravila další lék, jež by nádor relativně cíleně a účinně ničil. Vhodnými látkami se pro toto použití ukázaly být některé z radioizotopů, a to díky svým fyzikálním vlastnostem a také vzhledem k tomu, že lymfomy jsou výrazně radiosenzitivní nádory (4). Atraktivním radioizotopem se stalo ytrium 90 (90Y), které je čistý beta-zářič, produkujícím energii 2,3 mV na vzdálenost 5 mm (v měkké tkáni) s poločasem rozpadu 64 hodin (5). Tento radionuklid byl po řadě experimentů kovalentně navázán pomocí chelatační techniky a molekuly tiuxetanu na ibritumomab, myší IgG1 anti-CD20 protilátku. Tímto bioinženýrským krokem se významně usnadnilo cílené podávání radionuklidu do nádorové tkáně a takto připravený lék (90Y-ibritumomab tiuxetan) se stal úspěšným představitelem nové léčebné modality – radioimunoterapie (RIT) (6). Fáze I/II klinické studie s 90Y-ibritumomab tiuxetanem prokázala bezpečnost a efektivitu podání léku, když u nemocných s relabovanými a refrakterními lymfomy bylo dosaženo 67 % léčebných odpovědí (26 % kompletních remisí [CR] a 41 % parciálních remisí [PR]). U skupiny nemocných s nízce maligními lymfomy byla úspěšnost léčby ještě vyšší (82 % léčebných odpovědí, 26 % CR a 56 % PR) (7). Neméně důležitý byl také průkaz bezpečnosti rutinního podání 90Y-ibritumomab tiuxetanu bez nutnosti hospitalizace nemocného a popis reverzibilní hematologické toxicity, jež má přece jen mírně odlišnou kinetiku – na rozdíl od běžného útlumu krvetvorby po kombinované chemoterapii. Ve fázi III randomizované klinické studie byla pak u nemocných s relabovaným či refrakterním nízce maligním lymfomem nebo s transformovaným lymfomem srovnávána účinnost léčby 90Y-ibritumomab tiuxetanem s podáním rituximabu. Počet léčebných odpovědí a CR byl významně vyšší v rameni s RIT (počet odpovědí 83 % vs 56 %, p = 0,002; CR 30 % vs 16 %, p = 0,004). Trend k delšímu trvání léčebné odezvy byl zaznamenán u nemocných s folikulárním lymfomem (18,5 měsíců vs 12,1 měsíců, p = 0,371) (8). I když se doba celkového přežití nemocných v obou léčebných větvích statisticky nelišila, dlouhodobý příznivý efekt po RIT 90Y-ibritumomab tiuxetanem byl popsán zejména u nemocných v CR (9). Novější práce poukazují také na to, že další zlepšení výsledků přináší časnější zařazení 90Y-ibritumomab tiuxetanu do léčby relabovaných nemocných s FL. Tento léčebný postup nevylučuje zařazení další cytostatické nebo transplantační léčby (10, 11), ale na druhé straně lze RIT bezpečně podat i relabovaným nemocným po vysoce dávkované terapii s autologní transplantací krvetvorných buněk (12).
V naší práci demonstrujeme úspěšné sekvenční podání 4 dávek rituximabu v kombinaci s dexametazonem s následnou konsolidační terapií 90Y-ibritumomab tiuxetanem u třech nemocných s předléčeným relabovaným folikulárním lymfomem.
Soubor nemocných a metody
Diagnóza relapsu FL byla u všech tří nemocných potvrzena histologicky z extirpované uzliny. V imunohistochemické diagnostice povrchových znaků nádorové populace byl použit panel monoklonálních protilátek (anti-CD20, CD 79a, CD5, CD3, bcl-2 a Ki-67). Všechny vzorky tkáně byly hodnoceny dvěma nezávislými hemato-patology.
U všech nemocných byla při relapsu vyšetřena kostní dřeň získaná jednak aspirací a jednak pomocí trepanobiopsie. Aspirát kostní dřeně byl vedle morfologie vyšetřen pomocí monoklonálních protilátek průtokovou cytometrií a byla provedena i standardní vyšetření krve a séra nemocného zvykle používaná při stážování a před zahájením terapie maligních lymfomů. Všichni nemocní byli při relapsu vyšetřeni pomocí celotělové integrované pozitronové emisní tomografie s použitím 18F-fluoro-deoxy-glukózy a počítačovou tomografií (18F-FDG PET/CT) s podáním perorální a intravenózní kontrastní látky. U každého nemocného bylo vypočítáno skóre Mezinárodního prognostického indexu (IPI) a Mezinárodního indexu pro FL (FLIPI), jak bylo již dříve popsáno v literatuře (13, 14).
Popis 1. nemocného
Žena ve věku 65 let, FL patologického stupně II diagnostikován v červnu 1998. Klinické stadium v době diagnózy IIIA, IPI 1, FLIPI 1. Chemoterapie CHOP 6 cyklů byla komplikována iritací pankreatu, hmotnostním úbytkem 18 kg, výsevem herpes zoster, akutními exacerbacemi chronické bronchitidy. Léčbou 1. linie byla dosažena CR choroby s dobou trvání léčebné odpovědi 6 měsíců. Pro relaps s útlakem cévních struktur pravé dolní končetiny byla podána kombinovaná terapie fludarabinem, mitoxantronem a dexametazonem, celkem 4 cykly. Chemoterapie byla komplikována dyspepsií horního typu, bakteriálními infekty horních cest dýchacích, výraznou úzkostí a depresemi. Proto byla dále indikována radioterapie do celkové dávky 40 Gy na původní uzlinovou masu v pravém třísle. Touto léčbou bylo dosaženo CRu. Druhá léčebná odpověď trvala 64 měsíců. Na podzim 2005 došlo k 2. relapsu choroby, který byl histologicky ověřen v lednu 2006 z uzliny na krku. Byla potvrzena CD20 pozitivita buněk FL, nebyla prokázána histologická transformace FL. V době druhého relapsu bylo klinické stadium hodnoceno na základě vyšetření PET-CT jako IIIA; IPI2, FLIPI3. Kostní dřeň nebyla FL postižena. Přidružené choroby – hypertenze st. II dle WHO, chronická ischemická choroba srdeční, chronická bronchitida, hyperlipidemie, chronická pankreatitida, chronická pyelo-nefritida, diabetes mellitus II. typu na dietě. Další chemoterapii v té době již 73letá polymorbidní nemocná odmítla. Byla proto indikována k imunoterapii rituximabem v kombinaci s dexametazonem.
Popis 2. nemocné
Žena ve věku 48 let, diagnóza FL v listopadu 2002, patologický stupeň IIIa, velká nádorová masa v retroperitoneu (mnohočetné pakety uzlin, největší z nich 4x8 cm), postižení plic, jater, sleziny a kostní dřeně, klinické stadium IVB, IPI3, FLIPI 4. Nemocná podstoupila 6 cyklů intenzivní sekvenční chemoterapie (PACEBO a režim s použitím cytosin-arabinosidu a metotrexátu) s následnou stimulací a sběrem periferních kmenových krvetvorných buněk. Vysoce dávkovanou terapií BEAM s následnou autologní transplantací v 1. PR v květnu 2003 bylo dosaženo CRu. Následně byly podány 4 cykly imunoterapie rituximabem s dosažením CR, dále indikována udržovací terapie interferonem-alfa. Relaps choroby byl diagnostikován po 30 měsících (leden 2006) a ověřen histologicky. Byla potvrzena CD20 pozitivita nádorové tkáně, nebyl prokázán přechod v agresivnější lymfom a nebyla zjištěna infiltrace kostní dřeně. Klinické stadium v době relapsu bylo na základě vyšetření PET-CT hodnoceno jako IIIA, IPI 1, FLIPI 2. Pro lokální komplikace v oblasti extirpované uzliny v pravém třísle a pomalou progresi růstu lymfomové tkáně byla nemocná indikována k terapii 2. linie rituximabem v kombinaci s dexametazonem.
Popis 3. nemocného
Muž ve věku 59 let, FL patologického stupně I diagnostikován v dubnu 2000. Klinické stadium IVA, IPI 1, FLIPI 1. Vzhledem k aktivitě choroby bylo podáno 6 cyklů kombinované chemoterapie mitoxantron, chlorambucil a prednizon. Léčbou bylo dosaženo CR, která trvala 27 měsíců. 1. relaps choroby byl léčen v rámci klinické studie rituximabem a interferonem-gama. Touto léčbou bylo opět dosaženo CR onemocnění, která trvala 26 měsíců. 2. relaps choroby byl diagnostikován v červenci 2006. Histologicky bylo verifikováno, že se jedná o FL, patologický stupeň II. V krevním obraze dominovala trombocytopenie (118x109/l), která byla pravděpodobně imunitní etiologie (vyšetření protilátek proti trombocytům bylo pozitivní). Klinické stadium jsme hodnotili jako IVA, IPI 1, FLIPI 2 (provedeno PET-CT). V kostní dřeni byla imunocytologicky prokázána počínající infiltrace dřeně klonem CD20+ lymfocytů. Velké uzlinové masy v obou tříslech hrozily uzávěrem cévních struktur. Nemocný navíc trpěl chronickou obstrukční bronchitidou s opakovanými exacerbacemi (silný kuřák), chronickou maxilární sinusitidou, chronickou žilní insuficiencí na dolních končetinách s komplikovanými varikozitami a hypertenzní chorobou. Jako léčba 3. linie byl u v té době 67letého nemocného s výraznou komorbiditou indikován rituximab v kombinaci s dexametazonem.
Aplikace rituximabu
Rituximab (MabThera®, Roche) byl podáván formou pomalé intravenózní infuze, vlastní množství účinné látky bylo ředěno ve fyziologického roztoku chloridu sodného. Jednotlivá dávka rituximabu byla 375 mg/m2, interval mezi jednotlivými dávkami byl jeden týden, celkem byly podávány 4 dávky u každého nemocného. Nemocní byli před každou infuzí premedikováni 1000 mg paracetamolu perorálně (p.o.) a 10 mg cetirizinu p.o. Před každou dávkou rituximabu byl aplikován dexametazon 20 mg/m2 intravenózní formou. Rychlost první infuze rituximabu byla během první hodiny 50 mg účinné látky/h, při dobré snášenlivosti byla postupně zvyšována o 50 mg/h každých 30 minut až na 400 mg/h. Pokud první aplikace rituximabu nebyla provázena závažnějšími komplikacemi (stupeň III a IV dle WHO škály), činila celková doba následující infuze 90 minut (20 % dávky léku v prvních 30 minutách, zbylých 80 % léku během dalších 60 minut).
Aplikace90Y-ibritumomab tiuxetanu
V den 1 byla podána nitrožilní infuze rituximabu v dávce 250 mg/m2 a o týden později (den 8) byla aplikována stejná dávka rituximabu následovaná krátkým (10 minut trvajícím) intravenózním podáním 90Y-ibritumomab tiuxetanu (Zevalin®, Bayer Schering Pharma) v dávce 14,8 MBq/kg (u 2 pacientů s počtem trombocytů nad 150x109/l) nebo 11,1 MBq/kg (u pacienta s počtem trombocytů 125x109/l). Horní hranice maximální dávky90Y-ibritumomab tiuxetanu pro pacienta činila 1200 MBq (32 mCi). RIT byla podána na ambulanci Kliniky nukleární medicíny FN Olomouc.
Hodnocení léčebné odpovědi
Léčebná odpověď byla hodnocena podle kritérií publikovaných Chesonem a kolegy v roce 1999 (15). Byla použita kritéria CR, nepotvrzené CR (CRu), PR, stabilní choroby (SD), progresivní choroby (PD) a relapsu choroby.
Léčebná odpověď byla hodnocena po aplikaci 4 dávek rituximabu a nejdříve za 60 dní od podání 90Y-ibritumomab tiuxetanu. U všech nemocných bylo provedeno integrované PET/CT vyšetření s podáním 18F-FDG, perorální a intravenózní kontrastní látky standardně používané pro CT vyšetření. Hodnocení výsledných snímků bylo nezávisle na sobě provedeno radiologem (CT snímky) a lékařem nukleární medicíny (PET skeny). Vyšetření kostní dřeně (aspirace, průtoková cytometrie a trepanobiopsie) bylo provedeno jen v případě, že nemocný měl před zahájením léčby kostní dřeň infiltrovanou buňkami FL.
Výsledky
Terapie rituximabem v kombinaci s dexametazonem byla velmi dobře tolerována a nebyly zaznamenány žádné nežádoucí příhody či orgánová toxicita stupně III a IV dle škály WHO. U první nemocné bylo po ukončení léčby rituximabem provedeno integrované PET/CT vyšetření a byla konstatována PR s průkazem konsumpce 18F-FDG, resp. hypermetabolismu glukózy v nádorových buňkách zvětšených lymfatických uzlin retroperitonea. U zbylých dvou nemocných byla hodnocena léčebná odezva po aplikaci rituximabu fyzikálním a ultrazvukovým vyšetřením, jelikož patologické uzliny byly těmito metodami dobře měřitelné. U obou nemocných byla rovněž po léčbě rituximabem stanovena částečná léčebná odpověď. U všech 3 nemocných byla po zvážení poměru přínosu a rizika indikována RIT. Aplikace 90Y-ibritumomab tiuxetanu proběhla bez jakýchkoliv časných komplikací a nemocní byli ve stabilizovaném stavu a po řádném poučení propuštěni z ambulance Kliniky nukleární medicíny FN Olomouc v den podání léku. Další sledování nemocných probíhalo na ambulanci Hemato-onkologické kliniky FN Olomouc, u dvou nemocných ve spolupráci s regionálními hematologickými pracovišti v Opavě a Novém Jičíně.
U všech nemocných došlo k poklesu v základních řadách krevních buněk. Jejich nadir jsme zaznamenali mezi 4.–6. týdnem od podání RIT. Nejnižší hodnoty uvádíme v tabulce 1. Nebyly zaznamenány žádné epizody klinicky významného či život ohrožujícího krvácení. Do 60. dne od podání RIT jsme zaznamenali u 2 pacientů 2 infekční příhody. U jednoho nemocného došlo k akutní exacerbaci chronické bronchitidy, která byla zvládnuta kombinovanou antibiotickou terapií. U jedné nemocné byla dokumentována febrilní neutropenie následovaná mukositidou zejména v oblasti střeva. Stav byl na chirurgickém pracovišti mylně diagnostikován jako akutní apendicitida a byla provedena laparotomie s normálním nálezem na apendixu. Rána po laparotomii se hojila poměrně komplikovaně, a nemocná proto musela být opakovaně léčena intravenózní antibiotickou terapií.
Table 1. Nejnižší hodnoty parametrů krevního obrazu u nemocných po terapii 90Y-ibritumomab tiuxetanem. 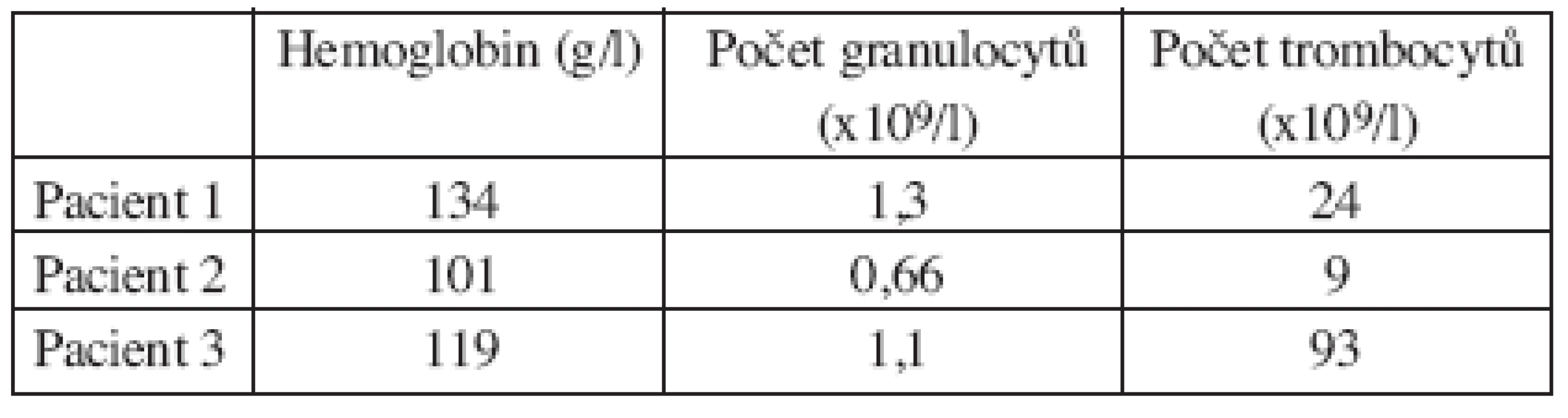
Integrované 18F-FDG PET/CT vyšetření neprokázalo u žádného z nemocných patologickou akumulaci fluoro-deoxy-glukózy v oblastech dříve zvětšených a 18F-FDG PET pozitivních uzlin. U 1 nemocného s probíhající akutní bakteriální bronchitidou bylo prokázáno drobné ložisko akumulace 18FDG v horním plicním poli vpravo o velikosti 1x1 cm, které bylo po detailní analýze současně provedených CT snímků hodnoceno jako ložisko zánětlivé (obr. 1). Na kontrolním vyšetření provedeném v časovém odstupu po infekční epizodě léčené kombinací antibiotik již toto ložisko nalezeno nebylo. U 2 nemocných byly na CT skenech vyšetření pozorovány dříve postižené uzliny, které byly i po léčbě větší než 1 cm (u obou nemocných maximálně do rozměru 2x1 cm). Léčebnou odpověď jsme proto u nich hodnotili jako CRu s PET-negativním obrazem. U 1 nemocné vymizely patologické uzliny zcela a mohlo tak být konstatováno dosažení CR choroby s dokumentovanou PET-negativitou (obr. 2, 3, 4). 11, resp. 9 a 7 měsíců po RIT jsou všichni 3 pacienti v dobrém stavu a z klinického hlediska v trvající remisi onemocnění.
Image 1. Srovnání snímků pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) (a) a integrované pozitronové emisní tomografie s počítačovou tomografií (b) po skončení léčby 90Y-ibritumomab tiuxetanem u třetího pacienta s folikulárním lymfomem a nálezem ložiska v plicním parenchymu. 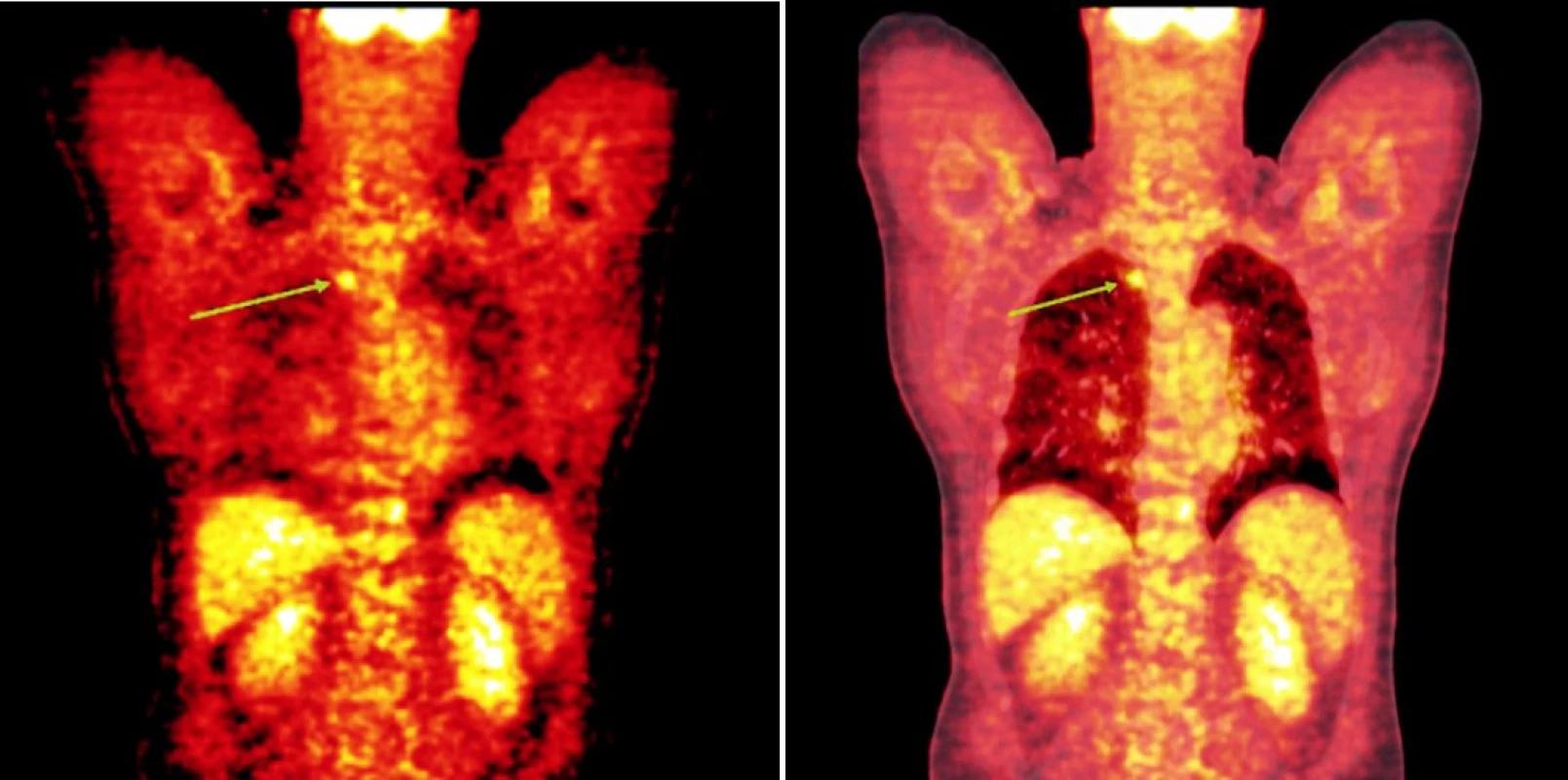
Image 2. Srovnání snímků integrované pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) a počítačové tomografie při relapsu (a) a po skončení léčby 90Y-ibritumomab tiuxetanem (b) u prvního pacienta s folikulárním lymfomem. 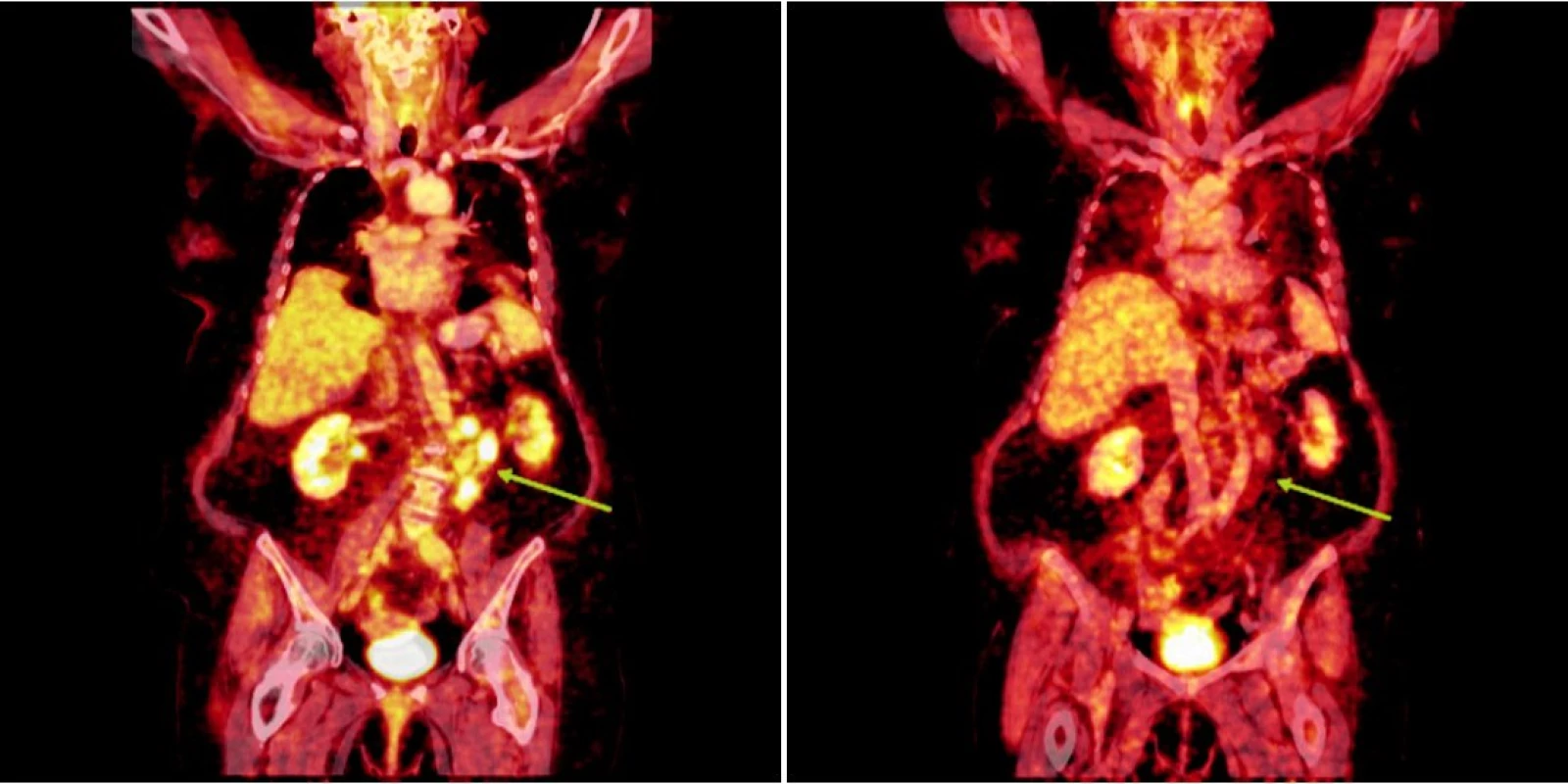
Image 3. Srovnání snímků integrované pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) a počítačové tomografie při relapsu (a) a po skončení léčby 90Y-ibritumomab tiuxetanem (b) u druhého pacienta s folikulárním lymfomem. 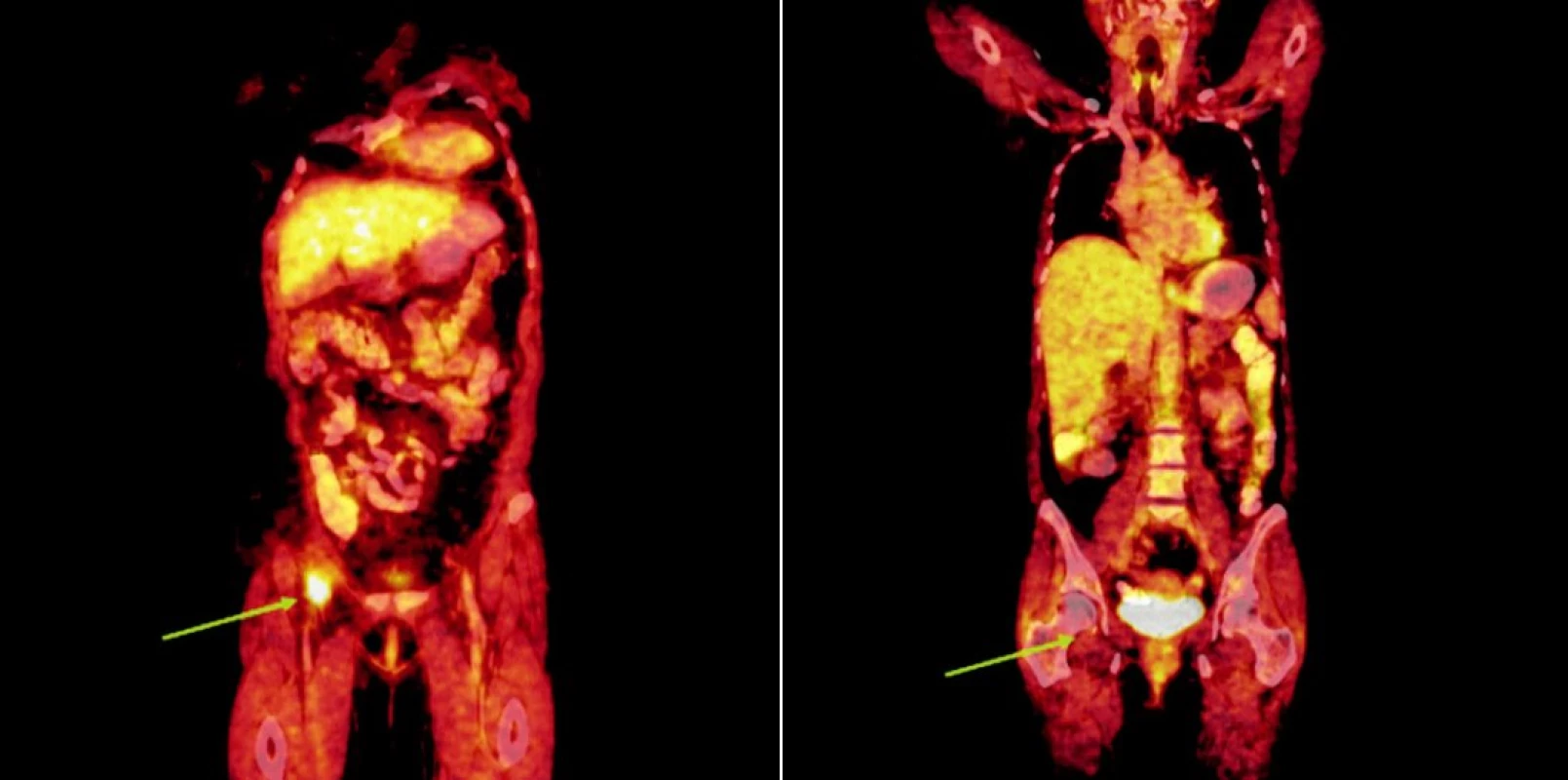
Image 4. Srovnání snímků integrované pozitronové emisní tomografie (s použitím 18F-fluoro-deoxy-glukózy) a počítačové tomografie při relapsu (a) a po skončení léčby 90Y-ibritumomab tiuxetanem (b) u třetího pacienta s folikulárním lymfomem. 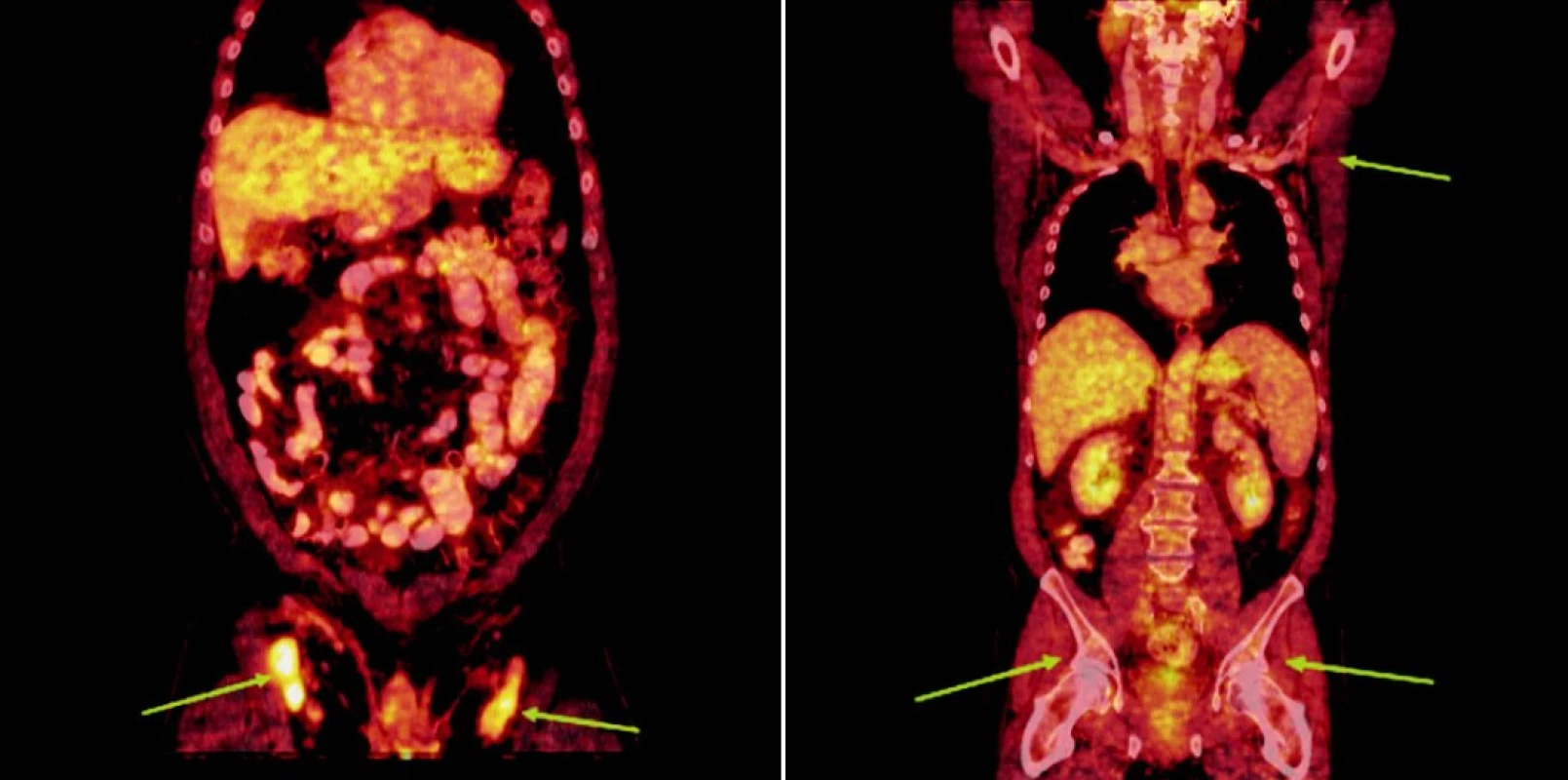
Diskuse
Ačkoliv většina nemocných s FL na prvotní protinádorovou chemoterapii nebo imunochemoterapii dobře reaguje, téměř u každého z nich onemocnění po kratším či delším bezpříznakovém období znovu propuká (relabuje). Léčba relapsů bývá často problematická, zejména u nemocných ve vyšším věku a s dalšími přidruženými chorobami. Pokud je dosaženo remise onemocnění, pak délka jejího trvání bývá vždy kratší než u předchozí léčby a dříve či později se vyvine rezistence k jakékoliv terapii. Folikulární lymfom se pak často histologicky transformuje v agresivní lymfoproliferaci s velmi špatnou prognózou. Monoklonální protilátky podstatně rozšířily léčebné možnosti u nemocných s FL. Konjugace anti-CD20 protilátky s radionuklidem 90Y zvýšila účinnost samotné imunoterapie a vedla ke zvýšení počtu léčebných odpovědí a trvání remise u senzitivních pacientů s FL. Výhody podání 90Y-ibritumomab tiuxetanu spočívají v kombinaci cílené léčby s vlastnostmi radioizotopu, jež byly zmíněny v úvodu práce. Beta záření, jež izotop produkuje, je účinné na vzdálenost asi 100–200 průměrů nádorové buňky FL a dovoluje tak ničit buňky uvnitř lymfomových mas, k nimž se protilátka s radio-izotopem přímo nedostane. Tento účinek byl nazván efektem křížové palby (cross-fire effect) a umožňuje také destrukci buněk, resp. nádorových klonů, jež na svém povrchu nenesou cílový antigen – v tomto případě CD20. Díky fyzikálním vlastnostem izotopu a jeho krátkému poločasu rozpadu, je možné podat 90Y-ibritumomab tiuxetan dobře vyškoleným personálem oddělení nukleární medicíny ambulantně a propustit nemocného do domácí péče téměř bezprostředně po aplikaci léku. Vzhledem k tomu, že beta záření je téměř kompletně pohlceno tkáněmi nemocného, nedochází k riziku ozáření pro osoby, které se s ním po podání 90Y-ibritumomab tiuxetanu dostanou do bezprostředního styku (ošetřující personál či rodinní příslušníci). Také tělní tekutiny a exkrementy obsahují v prvních hodinách a dnech po podání jen zanedbatelné stopy radioaktivní látky.
Řada dat z poslední doby dokumentovala zlepšení léčebných výsledků 90Y-ibritumomab tiuxetanu při podání nemocným v prvním relapsu onemocnění nebo jako konsolidaci zbytkové choroby po předchozí léčbě, a to dokonce v první terapeutické linii. Národní konsensus německých hemato-onkologů doporučuje podat lék po předchozí redukci nádorové masy vhodnou terapií (11, 16–18). Dále bylo prokázáno, že 90Y-ibritumomab tiuxetan lze bezpečně podat u nemocných s relapsem FL po autologní transplantaci krvetvorných buněk a také to, že následná kombinovaná chemoterapie nemocných s relapsem FL po podání RIT není zatížena nadměrným počtem závažných nežádoucích příhod či toxicity pro pacienty (10, 12).
V předložené práci hodnotíme podání 90Y-ibritumomab tiuxetanu u nemocných s relabujícím FL, které jsme z důvodů věku, předléčenosti, přidružených chorob či jejich obav z následků další chemoterapie léčili 4 standardními dávkami rituximabu v kombinaci s dexametazonem v týdenních odstupech. Kombinace rituximabu s glukokortikoidem byla zvolena mimo výše uvedené důvody i pro jejich prokázaný vzájemný synergní antiproliferativní a proapoptotický efekt na buňky různých typů lymfomu (19). Léčba byla dobře tolerována, nicméně vedla jen k redukci nádorové tkáně a přítomnost zbytkové choroby signalizovala vysokou pravděpodobnost brzké progrese lymfomu. Na základě vlastních zkušeností a s přihlédnutím k nejnovějším zprávám z mezinárodních literárních zdrojů (16–18) jsme indikovali tyto nemocné k podání 90Y-ibritumomab tiuxetanu. RIT byla všemi nemocnými excelentně tolerována a nebyly zaznamenány žádné časné komplikace. Pečlivě byla sledována dynamika následného útlumu krvetvorby, jež se obecně projevuje s delší latencí, než bývá pozorováno např. po kombinované chemoterapii. V souladu s literárními údaji bylo dosaženo nadiru hematologických parametrů u všech pacientů za 4–6 týdnů od podání RIT, u jednoho nemocného byla dokumentována granulocytopenie stupně 4 dle WHO škály a u 2 nemocných si zánětlivá komplikace vyžádala antibiotickou terapii (mukositida/enteritida, bronchitida). U všech nemocných se objevila trombocytopenie, nebyly však zaznamenány žádné krvácivé komplikace. V odstupu nejméně 60 dní po aplikaci Zevalinu prokázalo integrované PET/CT vyšetření výbornou léčebnou odpověď po RIT. Všichni nemocní byli hodnoceni jako 18F-FDG PET negativní. Vzhledem k tomu, že CT vyšetření nalezlo u 2 nemocných uzliny větší než 1 cm (u obou maximálně do velikosti 2x1 cm), hodnotili jsme léčebnou odpověď u těchto nemocných jako CRu. Zajímavým nálezem na PET-CT vyšetření byla podezřelá minimální léze v plicním parenchymu u 1 nemocného. Ta byla detailní analýzou CT snímků označena jako zánětlivá (pacient prodělal v době před vyšetřením akutní bronchitidu) a na kontrolním vyšetření po léčbě zánětu již nebyla patrná. Tato epizoda dokumentuje přínos integrovaného PET/CT vyšetření a jeho schopnost odhalit 18F-FDG PET pozitivní, ale nenádorové léze (infekční fokusy, záněty, aj.). Všichni nemocní zůstávají v ambulantním sledování a klinicky jsou stále v remisi choroby, mají dobrou kvalitu života bez jakýchkoliv pozdních následků léčby.
Závěr
Radioimunoterapie 90Y-ibritumomab tiuxetanem dnes představuje standardní, bezpečnou a účinnou možnost léčby nemocných s relabovanými folikulárními lymfomy. Lék je v současné době v České republice registrován pro léčbu dospělých nemocných s CD20 pozitivním folikulárním lymfomem, který zrelaboval po předchozí léčbě obsahující rituximab nebo byl k této léčbě refrakterní. Před podáním 90Y-ibritumomab tiuxetanu je nutné vyšetřit parametry krevního obrazu a provést vyšetření kostní dřeně. Počet neutrofilních granulocytů před léčbou nesmí poklesnout pod 1,5x109/l, počet krevních destiček pod 100x109/l a počet patologických lymfocytů v kostní dřeni nesmí překročit 25 %. Nemocní by neměli v minulosti absolvovat zevní ozáření, které by zahrnovalo více jak 25 % plochy aktivní kostní dřeně, opatrnosti je rovněž zapotřebí u pacientů, kterým byla dříve provedena transplantace kmenových buněk, i když data o bezpečnosti léčby 90Y-ibritumomab tiuxetanem po autologní transplantaci kmenových buněk již byla publikována (12). Zařazení RIT do terapeutického schématu v časném období choroby (1. či 2. relaps) nebo její použití v rámci konsolidace předchozí léčby může přinést další zlepšení výsledků a významné prodloužení trvání remise u nemocných s FL. Výsledky nejnovějších klinických studií ukazují, že RIT se zřejmě brzy stane také standardní součástí některých přípravných režimů k autologní transplantaci nebo součástí léčebných schémat u dalších typů CD20 pozitivních lymfomů.
Podpořeno grantem IGA MZ ČR No. NR/9502-3 a VZ MŠM 619 895 9205
MUDr. Tomáš Papajík, CSc.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.papajik@fnol.cz
Sources
1. Hiddeman W, Buske C, Dreyling M, et al. Treatment Strategies in Follicular Lymphomas: Current Status and Future Perspectives. J Clin Oncol 2005; 23 : 6394-6399.
2. McLaughlin P, Grillo-Lopez AJ, Link BK, et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: Half of patients respond to a 4-dose treatment program. J Clin Oncol 1998; 16 : 2825–2833.
3. Czuczman MS, Grillo-López AJ, White CA, et al. Treatment of patients with low-grade B-cell lymphoma with the combination of chimeric anti-CD20 monoclonal antibody and CHOP chemotherapy. J Clin Oncol 1999; 17 : 268–276.
4. Cheson BD. Radioimmunotherapy of non-Hodgkin’s lymphoma. Blood 2003; 101 : 391–398.
5. DeNardo GL, O’Donnell RT, Shen S, et al. Radiation dosimetry for 90Y-2IT-BAD-Lym-1 extrapolated from pharmacokinetics using 111In-2IT-BAD-Lym-1 in patients with non-Hodgkin’s lymphoma. J Nucl Med 2000; 41 : 952–958.
6. Gordon LI, Witzig TE, Wiseman GA, et al. Yttrium 90 ibritumomab tiuxetan radioimmunotherapy for relapsed or refractory low-grade non-Hodgkin’s lymhoma. Sem Oncol 2002; 29 (Suppl 2): 87–92.
7. Witzig TE, White CA, Wiseman GA, Gordon LI, Emmanouilides C, Raubitschek A, et al. Phase I/II trial of IDEC-Y2B8 radioimmunotherapy for treatment of relapsed or refractory CD20+ B-cell non-Hodgkin’s lymphoma. J Clin Oncol 1999; 17 : 3793–3803.
8. Witzig TE, Gordon LI, Cabanillas F, Czuczman MS, Emmanouilides C, Joyce R, et al. Randomized controlled trial of yttrium-90-labeled ibritumomab tiuxetan radioimmunotherapy versus rituximab immunotherapy for patients with relapsed or refractory low-grade, follicular, or transformed B-cell non-Hodgkin’s lym-phoma. J Clin Oncol 2002; 20 : 2453–2463.
9. Gordon LI, Molina A, Witzig T, Emmanouilides C, Raubtischek A, Darif M, et al. Durable responses after ibritumomab tiuxetan radioimmunotherapy for CD20+ B-cell lymphoma: long-term follow-up of a phase 1/2 study. Blood 2004; 103 : 4429–4431.
10. Ansell SM, Ristow KM, Hanermann TM, et al. Subsequent chemotherapy regimens are well tolerated after radioimmunotherapy with yttrium-90 ibrituomomab tiuxetan fo non-Hodgkin’s lymphoma. J Clin Oncol 2002; 20 : 3885–3890.
11. Emmanoulides C, Witzig TE, Gordon LI, et al. Treatment with yttrium 90 ibritumomab tiuxetan at early relapse is safe and effective in patients with previously treated B-cell non-Hodgkin’s lymphoma. Leuk Lymphoma 2006; 47 : 629–636.
12. Jacobs SA , Vidnovic N, Joyce J, et al. Full-dose 90Y ibritumomab tiuxetan therapy is safe in patients with prior myeloablative chemotherapy. Clin Cancer Res 2005; 11 : 7146–7150.
13. Shipp MA, Harrington DP, Anderson JR, et al. A predictive model for aggressive non-Hodgkin’s lymphoma. N Engl J Med 1993; 329 : 987–994.
14. Solal-Céligny P, Roy P, Colombat P, et al. Follicular lymphoma prognostic index. Blood 2004; 104 : 1258–1265.
15. Cheson BD, Horning SJ, Coiffier B, et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomnas. J Clin Oncol 1999; 17 : 1244–1253.
16. Shipley DL, Spigel DR, Carell DL, et al. Phase II trial of rituximab and short duration chemotherapy followed by 90Y ibritumomab tiuxetan as first-line treatment for patients with follicular lymphoma: a Minnie Pearl Cancer Research Network phase II trial. J Clin Oncol ASCO Annual Meeting Proceedings 2004; 22 (Suppl 14): 6519.
17. Jurczak WJ, Szostek MS, Giza AG, et al. Consolidation of chemotherapy response in mantle cell lymphoma (MCL) patients with 90Y-ibritumomab tiuxetan (90Y-Zevalin®) radioimmunotherapy (RIT). Haematologica 2006 : 91 (Suppl. 1): 188.
18. Dreyling M, Trümper L, von Schilling C, et al. Results of national consensus workshop: therapeutic algorithm in patients with follicular lymphoma – role of radioimmunotherapy. Ann Hematol 2007; 86 : 81–87.
19. Rose AL, Smith B, Maloney DG. Glucocorticoids and rituximab in vitro: synergistic direct antiproliferative and apoptotic effects. Blood 2002; 100 : 1765 – 1773.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 4-
All articles in this issue
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Imunoterapie rituximabem v kombinaci s dexametazonem následovaná podáním 90Y - ibritumomab tiuxetanu u předléčených nemocných s relabovaným folikulárním lymfomem
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

