-
Medical journals
- Career
Vyšetrovacie metódy krvných doštičiek – stručný prehľad
Authors: I. Varga
Authors‘ workplace: Kardiologická klinika, Národný ústav srdcových a cievnych chorôb, a. s., Bratislava
Published in: Transfuze Hematol. dnes,13, 2007, No. 4, p. 184-191.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Krvné doštičky sú dôležitou súčasťou cirkulácie a hemostázy. Pomocou adhézie, zmeny tvaru, agregácie, degranulácie a prokoagulačných aktivít zabezpečujú integritu cievneho riečiska. Ich hypofunkcia sa prejaví krvácavým stavom, hyperfunkcia naopak náchylnosťou k prevažne arteriálnej trombóze. Súčasné vyšetrovacie metódy funkcie krvných doštičiek predstavujú širokú škálu dobre prepracovaných postupov. Ani jeden z nich však sólo nepodáva úplnú informáciu o stave krvných doštičiek u konkrétneho pacienta. Je preto žiaduce, aby bol na použitie diagnostických testov funkcií krvných doštičiek vypracovaný štandardný univerzálny vyšetrovací algoritmus. Túto potrebu v súčasnosti zvýrazňuje aj problém tzv. rezistencie voči antiagregačnej liečbe.
Kľúčové slová:
krvné doštičky, vyšetrovacie metódy, krvácavé stavy, arteriálna trombóza, rezistencia na antiagregačnú liečbuÚvod
Vyšetrovacie metódy krvných doštičiek vychádzajú z poznania ich fyziológie a patofyziológie. Predstavujú širokú škálu dobre prepracovaných metód, z ktorých však zatiaľ ani jedna – vzhľadom na určité limitácie – nedosiahla univerzálne rozšírenie. Potreba vypracovania všeobecne platného algoritmu analýzy funkcie krvných doštičiek sa tak stáva čoraz aktuálnejšou, aj vzhľadom na pomerne časté zlyhávanie antiagregačnej prevencie či liečby.
Referencia
Fyziológia krvných doštičiek
Krvné doštičky (KD) cirkulujú za normálnych okolností v krvi ako malé bezjadrové disky a ich hlavnou funkciou je aktívna účasť v procese hemostázy. Pri poškodení cievnej steny, odhalení protrombogénnych hmôt aterosklerotického plátu, uvoľnení aktivačných látok (tzv. agonistov) z krvných elementov, vyplavení humorálnych aktivátorov do systémovej cirkulácie alebo po ich podaní z externého prostredia dochádza k zmenám tvaru i funkčnej odozve krvných doštičiek. Uvoľnené látky, schopné aktivovať KD, sa viažu na svoje špecifické proteínové receptory: glykoproteíny (GP-y), receptory pre trombín, prostanoidy, adenozíndifosfát, ale tiež selektíny a intercelulárne adhezívne molekuly.
Po väzbe ligandu na tieto receptory je signál odovzdávaný ďalej cez proteíny viažuce guanozíntrifosfát (GTP) – tzv. G-proteíny a malé GTP-ázy. Tieto proteíny sú vlastne druhí poslovia transformujúci signál na enzymatickú kaskádu, ktorej aktivita vedie k ďalším zmenám. Výnimkou z tohto celého procesu je otvorenie iónového kanálu priamo po väzbe ligandu na receptor (napr. adenozíndifosfát naviazaním sa na receptor P2X1 umožní vstup ionizovaného vápnika priamo do cytoplazmy KD). Ďalšie zmeny zahŕňajú predovšetkým zvýšenie intracelulárnej hladiny vápnika – (Ca2+)i, jednak spomenutým vstupom cez iónové kanály, ale tiež prostredníctvom enzýmov v plazmatickej membráne KD (Na+/Ca2+-výmenník, Ca2+-adenozíntrifosfatázy) alebo jeho vyplavením zo zásob v endoplazmatického retikule. Vápnik aktivuje fosfolipázu C, Ca2+-dependentný enzým katalyzujúci hlavne premenu fosfatidylinozitol-4,5-bisfosfátu na inozitol-1,4,5-trifosfát a diacylglycerol. Ide o tzv. fosfatidylinozitolový obrat. Inozitol-1,4,5-trifosfát zvyšuje spätne hladinu (Ca2+)i jeho vyplavením z intracelulárnych zásob a diacylglycerol aktivuje proteínkinázu C.Tá je skupinou viacerých enzýmov, ktoré kontrolujú agregáciu, degranuláciu (uvoľnenie obsahu intracelulárnych granúl – viď nižšie), mobilizáciu Ca2+, tvar KD a diferenciáciu megakaryocytov. Iným výkonným enzýmom v aktivácii KD je fosfolipáza A2, ktorá hydrolyzuje estery glycerofosfolipidov, pričom sa uvoľňujú voľné mastné kyseliny (kyselina arachidónová a iné) a lyzofosfolipidy. Uvoľnená kyselina arachidónová je substrátom pre tvorbu endoperoxidov – prostaglandínu G2a H2prostredníctvom cyklooxygenázy 1 (COX-1). COX-1 je hlavný enzým metabolizujúci kyselinu arachidónovú v krvných doštičkách. Prostaglandín H2 je ďalej tromboxánsyntetázou premieňaný na tromboxán A2, silný aktivátor KD. Jeho väzba s príslušným receptorom v membráne KD spôsobuje zmenu tvaru doštičiek, ich agregáciu a sekréciu granulárneho obsahu. Aktivácie doštičiek sa zúčastňujú tiež fosfolipáza D a systém tyrozínkináz. Inhibične naopak pôsobia cyklické nukleotidy – cyklický adenozínmonofosfát a guanozínmonofosfát. Znižujú činnosť aktivačných enzýmov a vedú k poklesu (Ca2+)i (1).
Agregáciu krvných doštičiek spravidla predchádza ich adhézia. Prvým krokom v adhézii (priľnutí) KD k endotelu cievy je v skutočnosti väzba plazmatického von Willebrandovho faktora (vWf) na obnažený kolagén v cievnej stene. Potom nasleduje väzba KD na vWf cez glykoproteín GPIb/V/IX. To je impulzom pre uchytenie ďalších cirkulujúcich KD. Tie putujú v smere krvného prúdu a vznik či zánik ich väzieb s vWf je podkladom tzv. rolovania doštičiek. Na tomto procese sa spolupodieľa aj väzba glykoproteínového ligandu viažúceho P-selektín (PSGL-1) na povrchu KD s P-selektínom (adhezívna molekula) na povrchu endotelových buniek. Za pomoci ďalších receptorov napr. pre kolagén, fibronektín, fibrinogén (GPIIbIIIa) a napokon pre laminín dochádza k pevnému ukotveniu KD (2, 3).
Pevnú adhéziu dopĺňa zmena tvaru KD – rozprestretie prostredníctvom GPIIbIIIa. Rozprestretie do plochy umožňuje doštičkám pokryť maximum poškodenej oblasti. Po počiatočnom zaguľatení, dochádza k vytvoreniu nitkovitých výbežkov (filopódií) a celá doštička sa sploští. Z disku tak vzniká dendritický útvar, ktorý sa neskôr pomocou tenučkých výbežkov – lamelipódií zmení na úplne plošné teleso pripomínajúce pizzové cesto. Povrch doštičky sa takto zväčší približne 4-násobne (4).
Proces agregácie (zhlukovania sa) krvných doštičiek môžeme rozdeliť na dve fázy – primárnu (reverzibilnú – väzba KD cez vWf a GPIb/IX/V) a sekundárnu (ireverzibilnú – väzba KD cez fibrinogén a GPIIbIIIa) spojenú s degranuláciou KD. Ireverzibilná agregácia je vyvolaná pôsobením aktivačnej látky (agonistu) pri pôsobení v dlhšej časovej perióde alebo pri vyššej koncentrácii. Základom agregácie KD je ich vzájomné spojenie fibrinogénovými mostíkmi prostredníctvom GPIIbIIIa. Uvoľ-nené substancie z α - a δ-granúl (napr. β-tromboglobulín, doštičkový faktor 4, P-selektín z α-granúl alebo adenozíndifosfát – ADP - z δ-granúl) stupňujú signalizáciu z receptorov, zosilňujú prebiehajúcu aktiváciu, priťahujú ďalšie KD, vedú ku kompletnej degranulácii a agregácii KD ako aj k rozvoju ich prokoagulačných vlastností. K posledne menovanej vlastnosti prispievajú predovšetkým membránové fosfolipidy, ktoré sú súčasťou koagulačnej kaskády a tiež vychytávanie tkanivového faktora syntetizovaného monocytmi. Silnú stimuláciu KD sprevádza aj uvoľnenie mikročastíc (sú to často fragmenty doštičkovej membrány), ktoré majú prokoagulačný charakter. Napokon agregáciu zosilňuje aj samotnými doštičkami novosyntetizovaný tromboxán A2(TXA2) (viď vyššie) (3, 5).
Krvné doštičky – vyšetrovacie metódy
Vyšetrovacie metódy, ktorými hodnotíme počet a funkciu krvných doštičiek, sa neustále zdokonaľujú vzhľadom na pribúdajúce poznatky o význame KD v rôznych patofyziologických procesoch. V zásade poznáme dva druhy vyšetrovacích metód: a) koagulačné, b) prietokovo-cytometrické (6). Z hľadiska samotného vyšetrovacieho postupu rozlišujeme tiež: 1. globálne testy doštičkových funkcií, 2. testy adhézie a agregácie KD, 3. postupy hodnotiace hladinu produktov a súčastí krvných doštičiek uvoľňovaných pri ich aktivácii do cirkulácie, 4. posudzovanie funkcie KD prietokovou cytometriou, 5. meranie prokoagulačnej aktivity KD a napokon 6. analýzu polymorfizmov doštičkových receptorov (7).
Globálne testy doštičkových funkcií
Najstaršou z týchto metód je in vivo hodnotenie času krvácania, ktoré zaviedol do praxe Duke v roku 1912. Jeho najbežnejšou modifikáciou je tzv. Ivyho metóda, pri ktorej meriame čas, za ktorý prestane krvácanie spôsobené presne charakterizovaným rezom (10 mm dĺžka, 1 mm hĺbka) na volárnej strane predlaktia (norma 4–8 minút). Rezu predchádza nafúkanie manžety tlakomeru na 40 mmHg na ramene vyšetrovaného. Istú medzilaboratórnu reprodukovateľnosť umožňujú komerčne vyrábané pomôcky (Simplate), ktoré zaistia jednotnú veľkosť zárezu. Test je citlivý na ochorenia s poruchou cievnej steny, trombocytopéniu (počet KD pod 100 x 109/l), stavy so zníženou hladinou von Willebrandovho faktora a fibrinogénu (6, 7). Jeho výhodou je in vivo fyziologické stanovenie času potrebného na vytvorenie krvnej zrazeniny. Hlavnými nevýhodami testu sú nedostatočná senzitivita a špecificita, interpersonálna variabilita v závislosti od vyšetrujúceho, možnosť vzniku nepríjemných jaziev (8). Patologické hodnoty testu sú typické pre rôzne typy trombocytopatií, ako aj pre deficit či defekty koagulačných faktorov.
Novšou z globálnych metód hodnotenia funkcií KD je využitie PFA-100® in vitro analyzátora (obr. 1). Umožňuje kvantitatívne hodnotenie primárnej, t. j. KD sprostredkovanej hemostázy. Vyšetrujeme funkciu KD v plnej krvi s pridaním antikoagulačnej prísady (napr. citrát). Princípom je stanovenie tzv. closure time, čiže času potrebného na uzavretie kapiláry doštičkovým trombom. KD sú vháňané pod tlakom (simulácia zvýšeného šmykového napätia – shear stress – pri prúdení krvi cez zúžený priesvit tepien pri aterosklerotickom procese) cez testovaciu komôrku (cartridge). Komôrky sú potiahnuté prozrážavou membránou obsahujúcou buď adenozíndifosfát (ADP) a kolagén (tzv. CADP membrána) alebo kolagén a epinefrín (tzv. CEPI membrána) (7, 9). Výhodou testu je jeho jednoduchosť, rýchlosť, potreba malého objemu krvi, simulácia tzv. shear stress a analýza z plnej krvi. Pri patologických hodnotách oboch testov je vysoko pravdepodobná porucha funkcie KD u daného pacienta. Normálny výsledok CADP testu, ale abnormálny CEPI test, je typický po užití kyseliny acetylsalicylovej (ASA). Nevýhodou metodiky je naopak závislosť výsledku na hladine vWf, hematokrite, počte KD a štandardizácii inštrumentária. Test využívame pri hodnotení účinnosti ASA, antagonistov GPIIb/IIIa receptora a tiež v skríningu trombocytopatií či koagulopatií (8, 10).
Image 1. Dostupné metódy analýzy funkcií krvných doštičiek. (prevzaté z prezentácie: Calatzis A. Multiplate analysis. A new aproach to platelet function analysis in whole blood. Z materiálov poskytnutých firmou GNOSIS s. r. o.) a) Accumetrics® b) Agregometria podľa Borna c) Chrono-log® - impedančný agregometer d) PFA-100® e) Plateletworks® f) Prietoková cytometria 
Inou metódou uvedenou v literatúre je hodnotenie adhézie a agregácie KD či koagulačných reakcií pomocou tzv. Xylum clot signature® analyzátora. Prístroj zaznamenáva čas potrebný na obnovenie tlaku v prietokovej komôrke, ktorý poklesol v dôsledku jej arterficálneho poškodenia. K obnoveniu tlaku dôjde po vytvorení agregátu a následnom obnovení integrity steny poškodenej komôrky (tzv. platelet haemostasis time). Inokedy je hodnotený čas po ktorom klesne tlak až na nulové hodnoty v dôsledku obturácie prietokovej komôrky vytvoreným trombom – tzv. clotting time. Treťou možnosťou je zmeranie času potrebného na pokles prietokového tlaku v komôrke na 50 % pri využití proagregačného charakteru kolagénovej membrány (7). Napriek tomu, že merania majú slušnú senzitivitu pri hodnotení krvácavých komplikácii a vyšetrujeme v plnej krvi, prístroj sa nedostal do širšieho používania. Nedostatočne totiž rozlišuje medzi podielom doštičiek a koagulácie na krvácavom stave, má nízku špecificitu. Vyšetrenie v plnej krvi bez antikoagulačnej prísady vyžaduje spracovanie vzorky do 3 minút. Prístroj je tiež príliš veľký – pacient sa musí osobne dostaviť priamo na miesto vyšetrenia, preto je nevhodný na vyšetrovanie hospitalizovaných pacientov. Taktiež vyžaduje zahriatie a kalibráciu pred použitím (11).
Testy adhézie a agregácie krvných doštičiek
Pojem adhézia označuje schopnosť KD priľnúť k poškodenému povrchu. Najznámejším testom adhéznej schopnosti KD je metóda využívajúca pretlačenie nezrážavej krvi cez umelohmotnú trubicu obsahujúcu sklenené guličky. Rozdiel v počte KD pred a po prechode trubicou je hodnotiacim parametrom adhézie doštičiek. Porušená adhézna schopnosť KD je napr. pri von Willebrandovej chorobe či niektorých trombocytopatiách (6).
Historickým zlatým štandardom posúdenia funkcie KD, ktorý uviedol do praxe Gustav Boru, je však hodnotenie ich agregácie – schopnosti vytvárať zhluky. Existujú 2 spôsoby agregometrie: a) turbidimetrický – hodnotenie agregácie KD pomocou zmeny v intenzite prechodu svetla (transmitancii) cez plazmu bohatú na KD a b) impedančný, pri ktorom stanovujeme zmeny v odpore elektrického prúdu medzi dvoma elektródami pri vzniku doštičkových agregátov v plnej krvi. Plazmu bohatú na KD získavame centrifugáciou plnej krvi, pričom je možné hodnotiť v nej spontánnu i indukovanú agregáciu. Ako induktory agregácie KD môžeme použiť pomerne široké spektrum substancií, najpoužívanejšími však sú ADP, kolagén, adrenalín, kyselina arachidónová, ristocetín, peptid aktivujúci trombínový receptor (TRAP) či monoklonálne protilátky (napr. anti-CD9, anti-GPIIIa). Agregometriou spravidla zaznamenáme tzv. prvú vlnu agregácie KD, ktorá je dôsledkom aktivácie KD pridaným agonistom. V závislosti od druhu a koncentrácie agonistu, ako aj od funkčnosti KD môžeme pozorovať následne druhú vlnu agregácie, ktorá je dôsledkom degranulačnej reakcie KD (6, 7) (obr. 2). Napr. nízke koncentrácie ADP vyvolajú bifázickú agregačnú reakciu (t. j. prvú i druhú vlnu agregácie), veľmi nízke koncentrácie indukujú len prvú agregačnú vlnu nasledovanú disagregáciou a naopak veľmi vysoké koncentrácie navodia jednu masívnu agregačnú odpoveď (12). Zvýšená agregačná reakcia sa typicky vyskytuje u pacientov s kardiovaskulárnymi ochoreniami, diabetes mellitus, hyperlipidémiou, či napr. u fajčiarov. Znížená odpoveď sa vyskytuje pri trombocytopatiách (Bernardov-Soulierov syndróm, Glanzmannova trombasténia), pri urémii, myeloproliferatívnych ochoreniach alebo systémovom lupus erythematosus (13). Výhodou agregometrie je pomerne presné vyhodnotenie agregačnej aktivity KD, avšak za cenu časovej a finančnej náročnosti. Pri získavaní plazmy bohatej na doštičky sú funkcie KD čiastočne alterované už v priebehu samotnej prípravy. Vyšetrenie agregácie KD v plnej krvi predstavuje preto fyziologickejší variant hodnotenia tejto vlastnosti KD (8). Sledovanými parametrami sú rýchlosť nástupu agregačnej krivky, dosiahnutá maximálna agregácia a plocha pod agregačnou krivkou (obr. 3).
Image 2. Bifázická krivka agregácie krvných doštičiek. 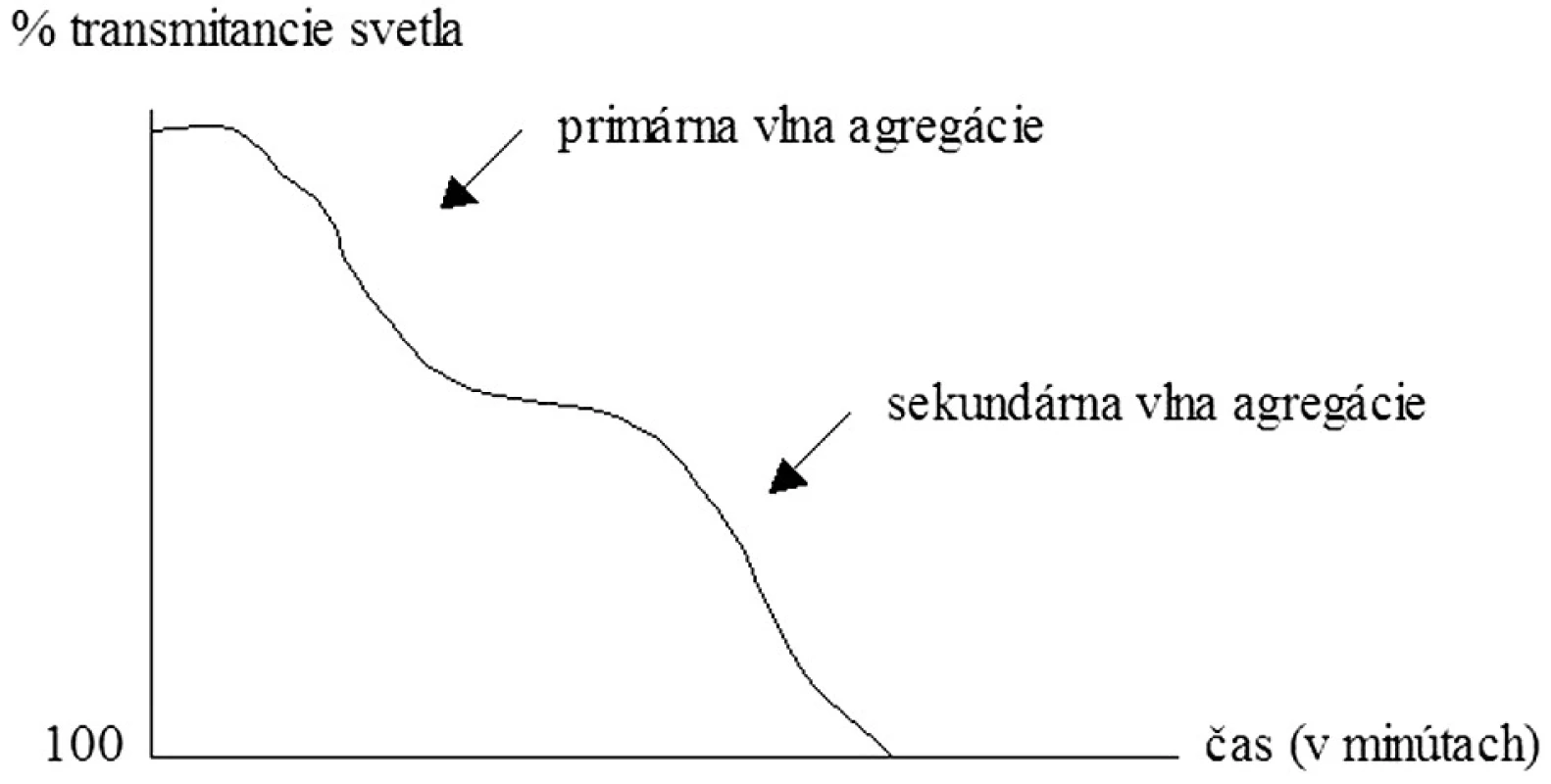
Image 3. Sledované parametre při impedančnej agregometrii. 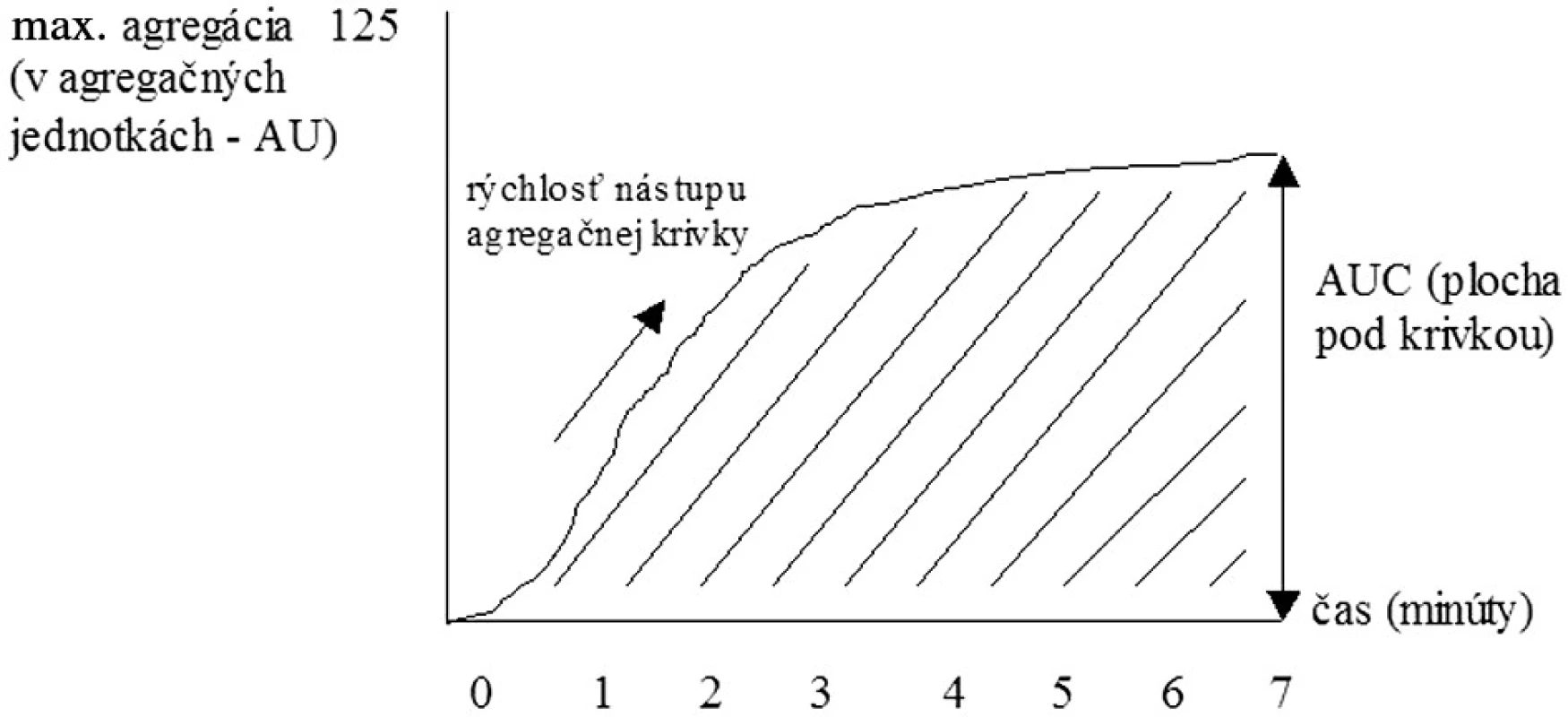
Novšiu metódu hodnotenia antidoštičkovej terapie pomocou turbidimetrického princípu ponúka systém Ultegra®. Nezrážavá krv je nasávaná do kanálika, ktorý obsahuje fibrinogénom potiahnuté mikročastice spolu s induktormi agregácie KD. Hodnotiacim parametrom je vzostup prieniku svetla vzorkou. Po vytvorení agregátov sa totiž plocha, ktorú zaberajú KD zmenší, dôjde k „vyčíreniu“ vzorky a prechod svetelných lúčov sa zvýši. Výsledky sú prepočítané na tzv. PAU (platelet aggregation units) – jednotky agregácie doštiček (9). Výsledky dobre korelujú s konvenčnou agregometriou (14). Výhodou je rýchlosť a jednoduchosť merania, stanovenie v plnej krvi a potreba malého objemu vzorky. Nevýhodou je vysoká cena vyšetrenia a nejednotnosť inštrumentária (8). Systém však ponúka možnosti hodnotenia účinnosť ASA, tienopyridínových preparátov i GPIIb/IIIa antagonistov, čo vedie aj k jeho postupnému zaraďovaniu do klinickej praxe (9, 10).
Produkt Plateletworks®je inou metodikou, ktorá po-núka rýchle orientačné zhodnotenie funkcie KD. Porovnáva sa pri nej počet KD vo vzorke plnej krvi pred a po aplikácii induktoru agregácie v špeciálnej skúmavke. Agregované KD nie sú v ďalšom meraní započítané do celkového počtu doštičiek vo vzorke a rozdiel (pokles) v počte KD je hodnotiacim parametrom funkcie KD (12). Výhodou je opäť analýza z plnej krvi a potreba minimálnej manipulácie so vzorkou, nevýhodou nedostatočne zdokumentovaná validita výsledkov (8).
Hodnotenie aktivácie KD šmykovým napätím umožňuje napr. CTA analyzátor® (z angl. cone and plate analyzer). Ide o typ rotačného viskozimetra, ktorý hodnotí adhézne schopnosti doštičiek v plnej krvi s antikoagulačnou prísadou (citrát). Po úprave polystyrénových zásobníkov (premytie a ofarbenie napr. May-Grünwaldovou metódou) je do nich krv nadávkovaná a následne rotovaná pri vysokých otáčkach s použitím teflónového kužeľa. Hodnotí sa percento plochy pokrytej adherovanými doštičkami (15). Výhodou je jednoduchosť a rýchlosť vyšetrenia, malý objem krvi potrebný na analýzu, ako aj vysoké šmykové napätie a možnosť hodnotenia v plnej krvi. Nevýhodou zatiaľ malé rozšírenie a nemožnosť medzilaboratórnej korelácie výsledkov (8).
Vyšetrenie krvných doštičiek prietokovou cytometriou
Metóda je založená na inkubácii plnej krvi s mono-klonálnymi alebo polyklonálnymi protilátkami proti rôznym doštičkovým glykoproteínom (napr. P-selektínu, GPIIbIIIa, CD40) alebo ich ligandom (fibrinogén, CD40L ap.). Protilátky sú detekované pomocou fluorescenčných markerov, ktoré spôsobujú charakteristickú absorbciu a neskôr emisiu prechádzajúceho svetelného lúča. Tieto zmeny sníma svetelný senzor, ktorý vie pomocou nich zhodnotiť veľkosť a molekulové charakteristiky vyšetrovaných buniek. Pomocou prietokovej cytometrie môžeme hodnotiť aktivované cirkulujúce KD, agregáty KD, agregáty leukocytov s KD či doštičkové prokoagulačné mikročastice (9). Prietoková cytometria je metódou vhodnou aj na posudzovanie účinnosti protidoštičkovej liečby (napr. pri liečbe antagonistami GPIIbIIIa stanovíme pomocou špecifickej protilátky percento neobsadených molekúl GPIIbIIIa, čo nám ozrejmí účinnosť alebo zlyhanie želanej inhibície). Taktiež môžeme prietokovou cytometriou diagnostikovať defekty doštičkových receptorov pri rôznych trombocytopatiách (napr. Glanzmannovej trombasténii alebo Bernardovom-Solierovom syndróme) alebo poruchy vo funkcii skladovacích granúl KD (napr. Heřmanského-Pudlákov syndróm, syndróm šedých doštičiek či tzv. storage pool disease, čo je názov pre porušenú funkciu δ-granúl) (6). Výhodou prietokovej cytometrie je možnosť analýzy širokého spektra doštičkových funkcií a morfologických zmien s nimi spojených, realizácia meraní v malom množstve plnej krvi a tiež schopnosť hodnotenia aktivácie KD ako in vivo, tak aj in vitro (7). Hlavnými nevýhodami sú nutnosť prípravy vzorky pred samotnou analýzou, vysoké náklady na zariadenie a nevyhnutnosť kvalifikovaného personálu (8).
Vyšetrenie aktivity krvných doštičiek molekulovými markermi
Ako molekulové markery aktivity KD využívame jednak látky uvoľňované doštičkami v procese degranulácie, jednak molekuly nimi syntetizované v priebehu ich aktivácie. Nevyhnutnými podmienkami odberu krvi na stanovenie je minimalizácia traumatizujúceho vplyvu vpichu a rýchly transport vzorky v ľade do laboratória (16).
Typickými degranulačnými molekulami sú β-tromboglobulín a doštičkový faktor 4, ale aj rozpustný P-selektín, ktoré sú uvoľňované do plazmy z α-granúl. Ich hladinu stanovujeme pomocou enzymoimunoanalýzy a rádioimunoanalýzy. Ide o pomerne spoľahlivé metódy určenia aktivity KD, avšak aj tieto majú svoje nedostatky. Separácia plazmy môže viesť totiž k arteficiálnej aktivácii KD a tým skresleniu – nadhodnoteniu získaných výsledkov. Plazmatický polčas doštičkového faktora 4 je veľmi krátky (cca 5 minút, následne je vychytávaný endotelovými bunkami), hladiny β-tromboglobulínu zasa stúpajú pri obličkovej nedostatočnosti. Rozpustný P-selektín je do plazmy uvoľňovaný aj z Weibel-Paladeho teliesok endotelových buniek, pričom v publikovaných prácach boli rozdiely v udávaných normálnych hladinách ako aj ich veľká interindividuálna variabilita. Meranie hladiny glykoproteínu V (GPV), špecifického proteínu KD a megakaryocytov, je inou možnosťou hodnotenia aktivity KD (16). Nevýhodami pri jeho stanovení je opäť možnosť arteficiálneho ovplyvnenia KD pri získavaní plazmy, ako aj fakt, že toto meranie je vzhľadom na funkciu GPV odrazom len trombínom indukovanej aktivácie KD. Problém s arteficálnou modifikáciou činnosti KD sa týka aj stanovenia plazmatickej hladiny rozpustného CD40L. CD40L je uvoľňovaný z cytoplazmy a membrány doštičiek, pričom práve KD predstavujú majoritný zdroj tejto molekuly v plazme (8).
Stanovenie hladiny tromboxánu A2, jeho metabolitu – tromboxánu B2 alebo ich ďalších metabolitov, či už v plazme alebo v moči, sú pomerne často a široko využívanými metodikami hodnotenia aktivácie KD. Miestom syntézy tromboxánu sú však aj napr. monocyty, takže vyšetrovacia metóda je nedostatočne špecifická. Navyše močová exkrécia tromboxánu B2 je priamo ovplyvnená funkciou obličiek (7, 8).
Hodnotenie prokoagulačnej aktivity krvných doštičiek
Metódy hodnotenia vplyvu KD na koagulačnú kaskádu sa opierali najmä o analýzu vzniku a aktivity protrombinázového komplexu, tzn. komplexu faktorov Xa a Va naviazaných na fosfolipidový povrch KD. Vzhľadom na technickú náročnosť a zatiaľ neoverenú validitu v klinickej praxi t. č. neprenikli do širšieho používania ako diagnostické metódy (7).
Genetické metódy
Analýza polymorfizmov jednotlivých nukleotidov či oligonukleotidov pomocou amplifikácie sledovaného úseku DNA polymerázovou reťazovou reakciou a následným štiepením kópií reštrikčnými enzýmami je metódou, ktorá prebieha dnes azda najrýchlejším vývojom. Informuje totiž bezkonkurenčne o interindividuálnej variabilite vo funkcii KD a s tým súvisiacim rizikom predovšetkým arteriálnej trombózy ako aj odpovede na antitrombotickú liečbu. Finančná a metodická náročnosť sú však zatiaľ limitáciou rozšírenia postupov v každodennej praxi (7).
Klinické stavy s poruchou krvných doštičiek (trombocytov)
Diagnostickými metódami sa snažíme ozrejmiť či a do akej miery sú práve KD a ich funkcie zodpovedné za riešený klinický stav. Ochorenia v dôsledku poruchy počtu alebo funkcie KD sa prejavia buď vo forme krvácavého stavu (hypofunkcia) alebo zvýšenej tendencie predovšetkým k arteriálnej trombóze (hyperfunkcia).
Krvácavé stavy pri poruche KD sa najčastejšie manifestujú na koži (petéchie, sufúzie) alebo na slizniciach (epistaxa, hematúria, ap.). Etiológiu a stručné rozdelenie krvácavých stavov na podklade nedostatku KD – kvantitatívnych porúch (trombocytopénií) alebo zlyhania funkcie KD – kvalitatívnych porúch (trombocytopatií) prináša tabuľka 1.
Table 1. Krvácavé stavy pri nedostatku/zlyhaní funkcie krvných doštičiek.* 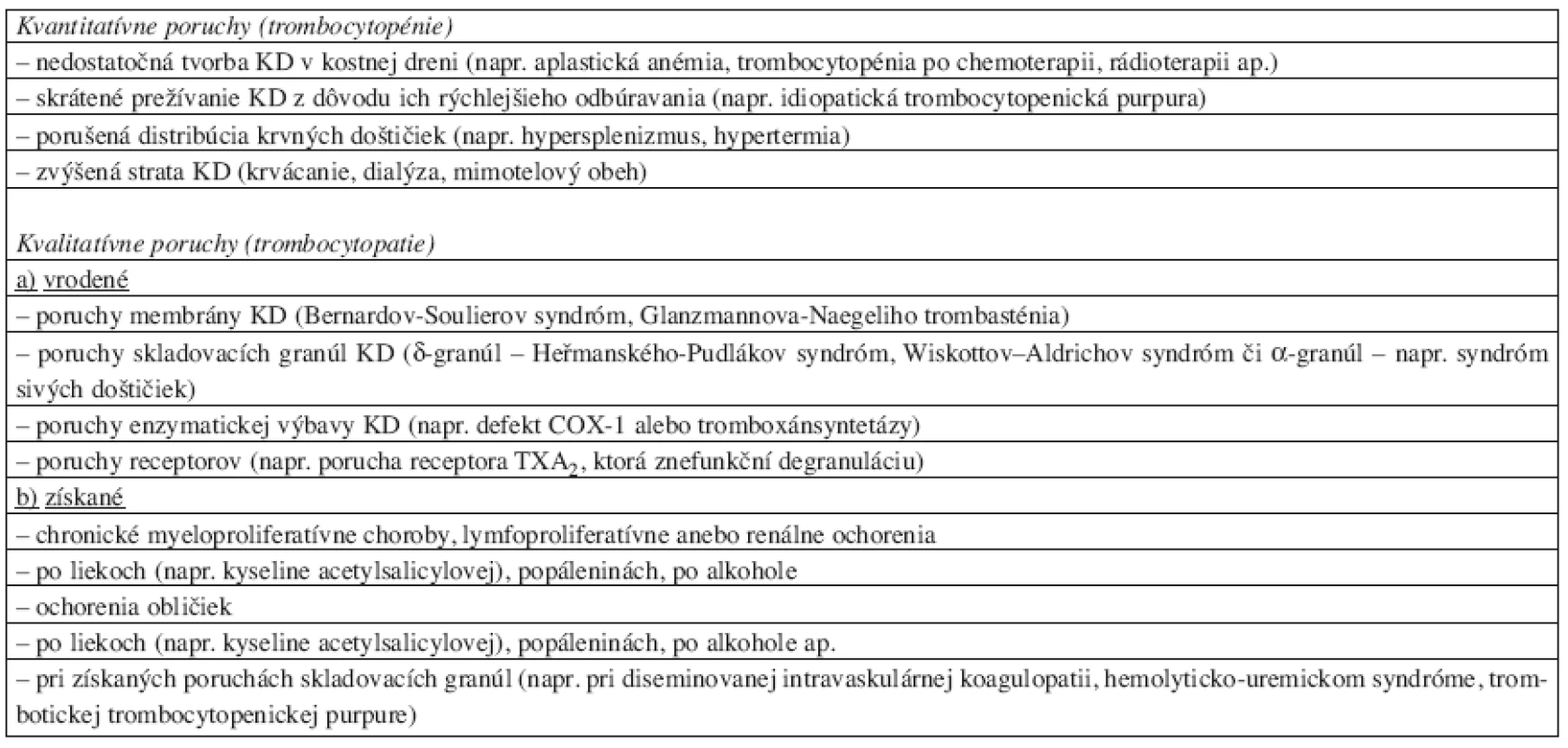
* pre bližšie informácie pozri citáciu č. 17 Zvýšená aktivácia KD vyúsťujúca do progresie aterosklerotického procesu a neustále stúpajúceho výskytu vaskulárnych komplikácii (napr. akútnych infarktov myokardu či cievnych mozgových príhod) je oveľa častejším klinickým problémom. Stavy hyperfunkcie KD môžu byť primárne navodené zmenou v ich štruktúre alebo sú súčasťou komplexnejších protrombotických stavov – v stručnom prehľade ich prináša tabuľka 2.
Table 2. Stavy so zvýšenou aktiváciou krvných doštičiek a tendenciou k arteriálnej trombóze.** 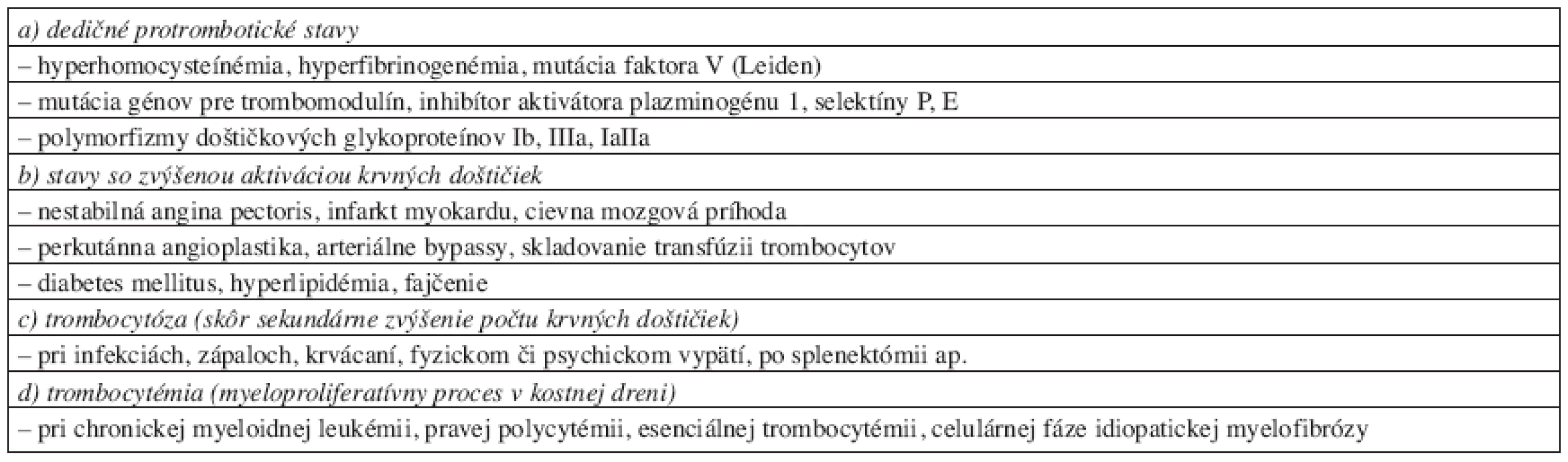
**pre bližšie informácie pozri citácie č. 5 a 17 Rezistencia na antiagregačnú liečbu – aktuálny klinický problém
Popri komplikovanej, často substitučnej liečbe krvácavých stavov spôsobených poruchou KD, ktorých problematika je užšou problematikou predovšetkým hematológov, sa do popredia dostáva otázka nedostatočne efektívnej liečby vaskulárnych komplikácii. Kardiovaskulárne a cerebrovaskulárne príhody naďalej totiž figurujú na popredných priečkach v príčine mortality, morbidity, invalidity a v socio-ekonomických dopadoch na obyvateľstvo našich zemepisných šírok. Pritom máme minimálne tri účinné spôsoby prevencie a liečby arteriálnej trombózy. Je to kyselina acetylsalicylová (aspirín, ASA), tienopyridínové deriváty (tiklopidín a klopidogrel) a antagonisty GPIIbIIIa (schéma 1).
Mechanizmy pôsobenia dostupných protidoštičkových liekov (pre lepšie pochopenie viď vyššie – fyziológia krvných doštičiek). 
V poslednej dobe sa intenzívne skúma podstata zlyhávania prevencie podávania aspirínu či klopidogrelu (vystriedal starší a z hľadiska nežiaducich účinkov škodlivejší tiklopidín), ktorú označujeme aj pojmom rezistencia – v anglosaskej literatúre „aspirin resistance“ resp. „clopidogrel resistance“. Rozlišujeme rezistenciu: a) klinickú, ktorá spôsobuje nedostatočnú ochranu pacienta pred vznikom trombotických komplikácii alebo b) biochemickú. Tou označujeme neschopnosť napr. ASA v terapeutickej dávke navodiť predĺženie protrombínového času, redukovať syntézu TXA2alebo spôsobiť očakávaný inhibičný efekt v jednom alebo viacerých in vitro testoch funkcií krvných doštičiek. Možné príčiny prináša v prehľade tabuľka 3. Rezistencia je nedosiahnutie očakávaného účinku pri adekvátne dlhej liečbe medikamentom v dostatočnej dávke, ktorú môžeme objektivizovať špecifickou, validnou a spoľahlivou laboratórnou metódou zameranou na sledovanie antidoštičkového efektu sledovanej látky, pričom táto metóda musí mať signifikantnú, nezávislú a konzistentnú koreláciu so zvýšeným výskytom aterotrombotických cievnych príhod (18, 19). To je práve zatiaľ problém, ako vyplýva aj z vyššie uvedeného prehľadu vyšetrovacích metód. Dnes je možné z hľadiska monitorovania účinnosti antigregancií využiť agregometrické merania, systémy Ultegra® či PFA-100®, či prietokovú cytometriu.
Table 3. Možné príčiny rezistencie voči antiagregačnej liečbe (upravené podľa cit. č. 18). 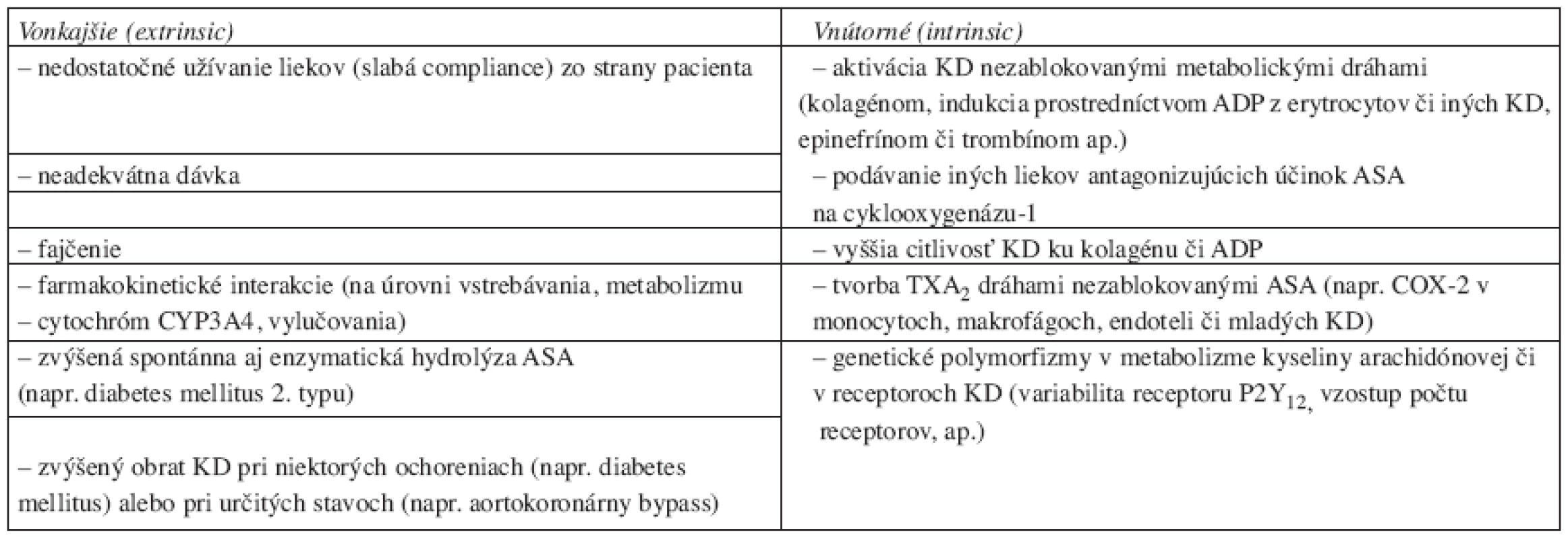
Súčasnými možnosťami prekonania rezistencie je používanie adekvátnych terapeutických dávok (napr. pre ASA 75–150 mg/deň, pre klopidogrel 75 mg/deň), prísna compliance zo strany pacienta, odstránenie vonkajších (ovplyvniteľných) možných príčin a tiež použitie iných antiagregačných látok (20). Jednou z ciest môže byť aj snaha o potvrdenie a využitie aditívnych antidoštičkových vlastností u liekov už používaných v iných indikáciách.
Záver
Z horeuvedeného prehľadu vyplýva potreba jednotného univerzálneho konsenzu pri využití už dostupných vyšetrovacích metód krvných doštičiek, ako aj nutnosť ich neustáleho zdokonaľovania. Je na nás – lekároch, výskumných pracovníkoch, farmaceutoch, ale aj na pacientoch, aby sme spoločným úsilím neustále rozširovali prah poznania nielen cestou klinických štúdií („evidence based medicine“), ale predovšetkým každodennou ústretovou komunikáciou. Týmto spôsobom môžeme rýchlejšie dospieť k definícii spoľahlivej vyšetrovacej metódy krvných doštičiek a stanoveniu účinnej antiagregačnej liečby.
Zoznam skratiek
ADP – adenozíndifosfát
ASA – kyselina acetylsalicylová
AU – jednotky agregácie krvných doštičiek
CADP – kolagén a adenozíndifosfát
CD – identifikačný povrchový antigén bunky
CEPI – kolagén a epinefrín
COX-1 – cyklooxygenáza 1
GP – glykoproteín
GTP – guanozíntrifosfát
KD – krvné doštičky
PAU – jednotky agregácie krvných doštičiek
PSGL-1 - glykoproteínový ligand pre P-selektín
TRAP – peptid aktivujúci trombínový receptor
TXA2 – tromboxán A2
vWf – von Willebrandov faktor
Poďakovanie
„Touto cestou by som rád poďakoval prof. MUDr. J. Fabiánovi, DrSc. a doc. MUDr. E. Goncalvesovej, CSc. za ich osobný príklad, ktorým ovplyvnili moje ďalšie profesionálne smerovanie.“
MUDr. Ivan Varga
Kardiologická klinika
Národný ústav srdcových a cievnych chorôb, a. s.
Pod Krásnou hôrkou 1
833 48 Bratislava 37
e-mail: ivan_varga@stonline.sk
Sources
1. Kamath S, Blann AD, Lip GY. Platelet activation: assessment and quantification. Eur Heart 2001; 22 : 1561-1571.
2. Hrachovinová I, Malý M. Patofyziologie arteriální trombózy. In: Vojáček J, Malý M, et al. Arteriální a žilní trombóza v klinické praxi. 1. vyd. Praha, Grada Publishing 2004; 69–78.
3. Packham MA, Rand ML, Kinlough-Ratbone RL. Aggregation. In: Gresele P, Page C, Fuster V, Vermylen J. Platelets in thrombotic and non-thrombotic disorders. First edition. Cambridge, Cambridge University Press, 2002; 338–356.
4. Gear AR, Polanowska-Grabowska RK. The platelet shape change. In: Gresele P, Page C, Fuster V, Vermylen J. Platelets in thrombotic and non-thrombotic disorders. First edition. Cambridge, Cambridge University Press, 2002; 319–327.
5. Kvasnička J. Trombofilie a trombotické stavy v klinické praxi. 1. vyd. Praha, Grada Publishing, 2003; 299 strán.
6. Salaj P. Laboratorní hodnotení funkce krevných destiček. In: Vojáček J, Malý M, et al. Arteriální a žilní trombóza v klinické praxi. 1. vyd. Praha, Grada Publishing, 2004; 191–196.
7. Thiagarajan P, Wu KK. In vitro assays for evaluating platelet function. In: Gresele P, Page C, Fuster V, Vermylen J. Platelets in thrombotic and non-thrombotic disorders. First edition. Cambridge, Cambridge University Press, 2002; 459–470.
8. Michelson AD. Platelet function testing in cardiovascular diseases. Circulation 2004; 110 : 489–493.
9. Vojáček J, Malý M. Funkce krevných destiček. In: Vojáček J, Malý M, et al. Arteriální a žilní trombóza v klinické praxi. 1. vyd. Praha, Grada Publishing, 2004; 51–68.
10. http://www.labtestonline.org/understanding/analytes/platelet_fun
ction/glance.html. 31.3.2007.
11. Fricke W, Kouides P, Kessler C, et al. A multicenter clinical evaluation of the Clot Signature Analyser. J Thromb Haemost 2004; 2 : 763–768.
12. Johns CS. Platelet function testing. Clinical Hemostasis Review 2004; 18 : 1–9.
13. Meško D, Pullmann R, Nosáľová G, et al. Vademékum klinickej biochémie. 1. vyd. Martin, Osveta, 1998; 1647 strán.
14. Smith JW, Steinhubl SR, Lincoff AM, et al. Rapid platelet function assay. An automated and quantitative cartridge-based method. Circulation 1999; 99 : 620–625.
15. Osende J, Fuster V, Lev EI, et. al. Testing platelet activation with a shear-dependent platelet function test versus aggregation-based tests. Circulation 2001; 103 : 1488–1491.
16. Galajda P, Mokáň M. Poruchy hemostázy pri diabetes mellitus. 1. vyd. Martin, PROKONZULT, 2001; 255 strán.
17. Kubisz P, et al. Hematológia a transfuziológia. 1. vyd. Bratislava, Praha, Grada Publishing, 2006; 323 strán.
18. Hankey JH, Eikelboom JW. Aspirin resistance. BMJ 2004; 328 : 477–479.
19. Wiviott SD, Antmann EM. Clopidogrel resistance. New chapter in fast-moving story. Circulation 2004; 109 : 3064–3067.
20. Patrono C, Coller B, FitzGerald GA, et al. Platelet-Active drugs: The relationships among dose, effectiveness, and side effects. The seventh ACCP conference on antithrombotic and thrombolytic therapy. Chest 2004; 126 : 234S–264S.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 4-
All articles in this issue
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Imunoterapie rituximabem v kombinaci s dexametazonem následovaná podáním 90Y - ibritumomab tiuxetanu u předléčených nemocných s relabovaným folikulárním lymfomem
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

