-
Medical journals
- Career
LDL-aferéza v léčbě familiárních hyperlipoproteinemií
Authors: Vladimír Bláha 1; Milan Bláha 2; Miriam Lánská 2; Eduard Havel 1; Pavel Vyroubal 1; Zdeněk Zadák 1; Pavel Žák 2; Luboš Sobotka 1
Authors‘ workplace: III. interní gerontometabolická klinika LF UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc. 1; IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D. 2
Published in: Vnitř Lék 2014; 60(11): 970-976
Category: Reviews
Overview
LDL-aferéza je extrakorporální eliminační metodika, která usiluje o pokud možno specifické odstranění LDL-cholesterolu z cirkulující krve. V současnosti je používáno 6 účinných metod k selektivnímu odstranění LDL-cholesterolu. Mezi hlavní indikace k léčbě LDL-aferézou patří diagnózy homozygotní familiární hypercholesterolemie, heterozygotní familiární hypercholesterolemie refrakterní nebo při intoleranci k standardní léčbě, a dále pacienti se zvýšením lipoproteinu(a) refrakterní nebo intolerantní k farmakoterapii. Dosud však není jednoty o tom, jaká hladina LDL-cholesterolu je rozhodující pro zahájení LDL-aferézy, názory se liší i v jednotlivých státech. I když neexistují klasické velké randomizované studie, existuje dostatečný počet dobře řízených studií k tomu, aby v celém světě bylo uznáváno, že je efekt LDL-aferézy na kardiovaskulární prognózu u závažné hypercholesterolemie významný.
Klíčová slova:
ateroskleróza – hypercholesterolemie – hypolipidemická léčba – kardiovaskulární onemocnění – LDL-aferézaÚvod
Léčba familiární hypercholesterolemie (FH) je obecně oproti nedávné minulosti podstatně účinnější, ale přesto zbývají pacienti, u nichž nelze docílit přijatelně nízkých hodnot LDL-cholesterolu – jde o pacienty rezistentní k léčbě, netolerující dostatečně vysoké dávky léků či pacienty alergické na léky, anebo jde o kontraindikaci léků (např. v těhotenství). Toto malé a zmenšující se procento pacientů se recentně odhaduje asi na 1 % [16]. Vzhledem k poměrně frekventní incidenci FH to však není číslo zanedbatelné. V České republice by mohlo jít o asi 10 homozygotů a asi 200 heterozygotů. Tento počet však není v současné praxi možno léčit ani v zemích s nejvíce rozšířenou sítí center, používajících v léčbě metodu LDL-aferéz, jako je Německo (léčí asi 1 500 pacientů, ale je to jen 30–50 % těch, u nichž by byla léčba indikovaná) [16]; v ČR jsou současné možnosti asi 3krát menší.
Vymezení pojmů
LDL-aferéza je extrakorporální eliminační (EE) metodika, která usiluje o pokud možno specifické odstranění LDL-cholesterolu z cirkulující krve. Je obecně řazená mezi léčebné (hem)aferézy (což jsou metody odnětí nežádoucích krevních elementů nebo patogeneticky účinných substancí vyskytujících se v plazmě – jde např. o léčebnou plazmaferézu, leukocytaferézu, trombocytaferézu, erytrocytaferézu a další). Je prováděna specializovanými hemaferetickými pracovišti, řazenými v ČR mezi hematologická nebo transfuziologická pracoviště, jinde ve světě většinou mezi nefrologické subspecializace.
Historická poznámka
První extrakorporální eliminací LDL-cholesterolu byly klasické léčebné plazmaferézy (tj. prosté odstranění či výměna plazmy). Úspěšné použití plazmaferézy v léčbě FH bylo poprvé popsáno Thompsonem et al v roce 1975 [36]. Již v roce 1980 byla tato léčba zahájena v Československu [17]. Plazmaferéza je zcela nespecifická, protože znamená prosté odnětí plazmy a její náhradu náhradními roztoky. S žádaným odstraněním LDL-cholesterolu tedy odstraníme řadu užitečných substancí. Podle některých názorů se obvykle musí k odstranění 1–2 g patologické bílkoviny odstranit až 150 g jiných bílkovin [30]. Budoucnost proto patřila specifičtějším metodám, jako je klasická LDL-aferéza imunoadsorpční metodou, zavedená Stoffelem a Borbergem roku 1981 [34] a používaná dosud, v Československu poprvé použitá roku 1996 [6]. Pozornost v celém světě byla věnována samozřejmě především nejtěžší formě FH – homozygotním nemocným. Podle PubMed bylo za posledních 10 let do roku 2013 publikováno 47 článků a léčeno 243 pacientů s homozygotní FH [37]. Pokud jde o heterozygotní formy rezistentní FH, v PubMed bylo problematice heterozygotů FH věnováno za léta 2003–2013 celkem 20 prací o léčbě 213 pacientů [37].
Terminologická poznámka
Pojem LDL-aferéza doporučil prof. Arens (Rockefeler Univeristy) roku 1983 prof. Borbergovi pro Stoffelovu a Borbergovu metodu odstraňování LDL-cholesterolu imunoadsorpcí na principu reakce antigen-protilátka [7]. Tuto metodu klinicky rozpracoval Borberg a jeho kolektiv [8] a zprvu byl originální název „LDL-aferéza“ používán pouze pro tuto metodu. V současné době je však tento název všeobecně používán pro všechny metody selektivní extrakorporální eliminace LDL-cholesterolu a toto pravidlo respektujeme v této publikaci. Někteří autoři dávají přednost názvu „lipidaferéza“ nebo „lipoproteinaferéza“. Další poznámku zaslouží pojem „selektivní“. Někteří autoři namítají, že selektivní metoda na molekulární úrovni v současnosti neexistuje. Přesto se pojem „selektivní“ metoda eliminace LDL-cholesterolu běžně používá [37,40], protože vystihuje snahu o odstranění jen LDL-cholesterolu a co možno nejmenšího množství dalších substancí, a tím také o vymezení pojmu od prosté výměny plazmy.
Principy současných metod LDL-aferézy
V současnosti je používáno 6 účinných metod k selektivnímu odstranění LDL-cholesterolu (tab. 1). Principy lze jednoduše sumarizovat: LDL-cholesterol lze z krve oddělit buď imunoadsorpcí, iontovou vazbou, filtrací, anebo precipitací. Dvě metody odstraňují LDL-cholesterol přímo z plné krve (DALI a dextransulfátová přímá adsorpce), další čtyři primárně získávají plazmu buď centrifugací, nebo filtrací a s ní dále pracují.
Table 1. Přehled současných možností LDL-aferézy. Upraveno podle [40]. ![Přehled současných možností LDL-aferézy. Upraveno podle [40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/aea65973d0bf3cb065cc01dd6f86e629.jpg)
Metoda imunoadsorpce a dvojité filtrace plazmy je v tabulce podle Winterse et al z roku 2012 modifikována podle vlastních zkušeností; redukce je vyšší nežli podle Winterse et al především proto, že zpracováváme větší množství plazmy. Na našem pracovišti se extrakorporálními eliminačními metodikami dlouhodobě zabýváme. Pokud jde o eliminaci LDL-cholesterolu, vybrali jsme po seznámení se se všemi výše uvedenými metodami k dlouhodobé terapii 2 metodiky, které jsou vysoce účinné, bezpečné a relativně ekonomicky v našich podmínkách výhodné: vlastní modifikaci klasické Stofellovy a Borbergovy LDL-aferézy [7,8] – imunoadsorpci, a jako druhou metodu filtraci plazmy (plazmafiltraci) – jde o modifikaci dvojité filtrace plazmy, při níž se k oddělení plazmy nepoužívá filtr, ale centrifugační separátor.
Klasická imunoadsorpční LDL-aferéza
Klasickou imunoadsorpční LDL-aferézu zobrazuje schéma 1: krev je odebírána z periferní žíly, z krve je oddělena plazma centrifugačním separátorem (může být použit i membránový separátor). Plazma je dále čerpána do dvojice (páru) adsorberů uložených v řídicím adsorpčně-desorpčním automatu. Adsorbery obsahují sepharózu, na kterou je kovalentně navázána ovčí protilátka proti lidskému apoproteinu B, takže imunologickou reakcí antigen-protilátka je v adsorberu zachycena bílkovina obsahující apoprotein B. První adsorber je po průtoku určitého množství plazmy zaplněn a pak automat přepne na druhý adsorber. Zaplněný adsorber je promýván fyziologickým roztokem, potom glycinem o nízkém pH (1,8–2,4), čímž se apoprotein B uvolní z vazby a odtéká do odpadu. Potom je tento adsorber promyt pufrem PBS (tím se upraví pH), následně ještě fyziologickým roztokem a je připraven k dalšímu použití. Systém páru adsorberů tak pracuje střídavě a opakovaně, až je docíleno žádaného snížení množství LDL-cholesterolu (teoreticky neomezený počet cyklů). V praxi je promýváno průměrně 1,5 objemu plazmy, což při přítoku z periferní žíly trvá asi 3–5 hodin. Antikoagulace je zajištěna úvodním bolusem heparinu (4 000 j) a pak kontinuálním přidáváním ACD-A (acidum citricum + dextróza) v poměru 1 : 22. Adsorpční kolony mohou být pro daného pacienta používány opakovaně, garantuje se 50 použití (což je ekonomicky výhodné). Mezi jednotlivými procedurami jsou adsorbery zaplněny roztokem NaN3 a uloženy v chladničce. Nevýhodou je styk plazmy s ovčí protilátkou.
Schéma 1. Schéma imunoadsorpční LDL-aferézy 
Plazmafiltrace (dvojitá filtrace plazmy – double plasma filtration)
Plazma, získaná stejným postupem jako u imunoadsorpce, je proháněna „druhým stupněm“ – filtrem. Rozhodující je velikost pórů filtru, používají se filtry o velikosti průduchů 30–40 nanometrů. Sami používáme filtry Evaflux 4A (Kuraray, Osaka, Japonsko). Jde o simultánní odstranění LDL-cholesterolu, ale i spektra některých dalších vysokomolekulárních bílkovin (např. α2-makroglobulin, fibrinogen, Lp(a), von Willebrandův faktor, IgM, fibronektin a multimerický vitronektin), proto touto metodou léčíme pacienty se současně zvýšeným fibrinogenem. Odstraňováním výše definovaného spektra reologicky účinných proteinů se mění reologické vlastnosti krve. Jde tedy také o formu lékařské reoterapie [5]. Proto pro tuto metodiku používáme termín reohemaferéza nebo reoferéza, zavedený německými autory [8,20].
Průtok plazmy je opět kontinuální, množství zpracované plazmy je 1,5 tělesného objemu plazmy (vypočteno separátorem). Antikoagulace se provádí kombinací heparinu (bolus i.v. v úvodu) a ACD-A. Schematicky princip znázorňuje schéma 2.
Schéma 2. Plazmafiltrace (dvojitá filtrace plazmy – double plasma filtration) 
Indikace k LDL-aferéze u FH
Ve světě bylo dosud publikováno několik prací o indikacích k LDL-aferéze [12,18,37,39,40]. Podle Thompsona [37] jsou 3 hlavní indikace k léčbě LDL-aferézou:
- homozygotní familiární hypercholesterolemie (HFH)
- heterozygotní familiární hypercholesterolemie refrakterní nebo při intoleranci k standardní léčbě
- pacienti se zvýšením lipoproteinu(a) refrakterní nebo intolerantní k vysokým dávkám kyseliny nikotinové
Dosud však není jednoty o tom, jaká hladina LDL-cholesterolu je při FH rozhodující pro zahájení LDL-aferézy, názory se liší i v jednotlivých státech (tab. 2).
Table 2. Kritéria pro LDL-aferézu. Upraveno podle [28]. ![Kritéria pro LDL-aferézu. Upraveno podle [28].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8cf779eb5bdd73ee06e55b64c1297f5e.jpg)
Striktní jsou kritéria v Německu [12]. Cílové hodnoty LDL-cholesterolu jsou podle posledního konsensu European Atherosclerosis Society u pacientů s FH < 2,5 mmol/l a u pacientů s FH a projevy ICHS nebo diabetem < 1,8 mmol/l [18]. Není ani úplná jednota v tom, kdy se má začít s LDL-aferézou u dětí, zejména homozygotů. Jisté je, že je třeba začít časně. Thompson et al (2010) doporučují zahájit léčbu v 7 letech věku [35], Graesdal et al (2012) ve věku 3–5 let [13], Dann et al (2013) při dosažení hmotnosti 14 kg [10], což odpovídá v České republice věku asi 3 roky. European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia z roku 2014 doporučuje začít v 5 letech, nejpozději v 8 [9].
Vliv LDL-aferézy na kardiovaskulární riziko u FH
„Tvrdá“ data podle klasických pravidel (evidence based medicine), tj. randomizovaných velkých mezinárodních, prospektivních, zaslepených a placebem kontrolovaných studií, která by detailně zhodnotila vliv LDL-aferézy na kardiovaskulární riziko u homozygotů familiární hypercholesterolemie, nemáme. Existuje ovšem dostatečný počet dobře řízených studií k tomu, aby v celém světě bylo uznáváno, že efekt LDL-aferézy na prognózu FH je prokázán do této míry:
- úspěch LDL-aferézy u homozygotů se pokládá za nesporný [9,14,18,37,38], podle znalců dokonce v tomto směru není třeba dalších studií [37]
- pokládá se rovněž za prokázané, že u heterozygotní FH s postižením koronárních tepen je LDL-aferéza jednoznačně prospěšná [9,14,18,22,27,38]
- u heterozygotů při progredující ateromatóze bez postižení koronárních tepen je nejspíše také vhodná, ale je nutno ještě některé detaily dořešit [12,28,37]
Z hlediska medicíny založené na důkazech (evidence based medicine) je do budoucna obtíž v tom, že obvyklá klasická prospektivní randomizovaná studie je z etických důvodů již nevhodná [37]. I když tomu ale tak je, platí stále, že nejdůležitější ukazatel efektu léčby je délka přežití [7]. V období, než byla léčba LDL-aferézou dostupná, se pacienti s HoFH zřídka dožili 3. decénia [38]. Podle klinického pozorování se však v současnosti dožívají pacienti s HoFH, léčení všemi dostupnými prostředky, řádově 4.-5. decénia [9]. Proto je oprávněné tvrzení, že LDL-aferéza významně (i když to není změřeno exaktně) prodlužuje přežití. LDL-aferéza také prokazatelně snižuje riziko ICHS u heterozygotní FH [3].
Výhody a omezení LDL-aferézy
Rozsáhlá data, která máme k dispozici z registrů pro aferézy, a zkušenosti z velkých center potvrzují klinický benefit pravidelné a dlouhodobé léčby LDL-aferézou zejména u HoFH (tab. 3). Poměr nákladů a efektivity léčby je rovněž jednoznačně pozitivní [9].
Table 3. Vliv léčby LDL-aferézou na aterosklerotické kardiovaskulární onemocnění u dětí a mladých homozygotů familiární hypercholesterolemie: data z kazuistik, studií a registrů 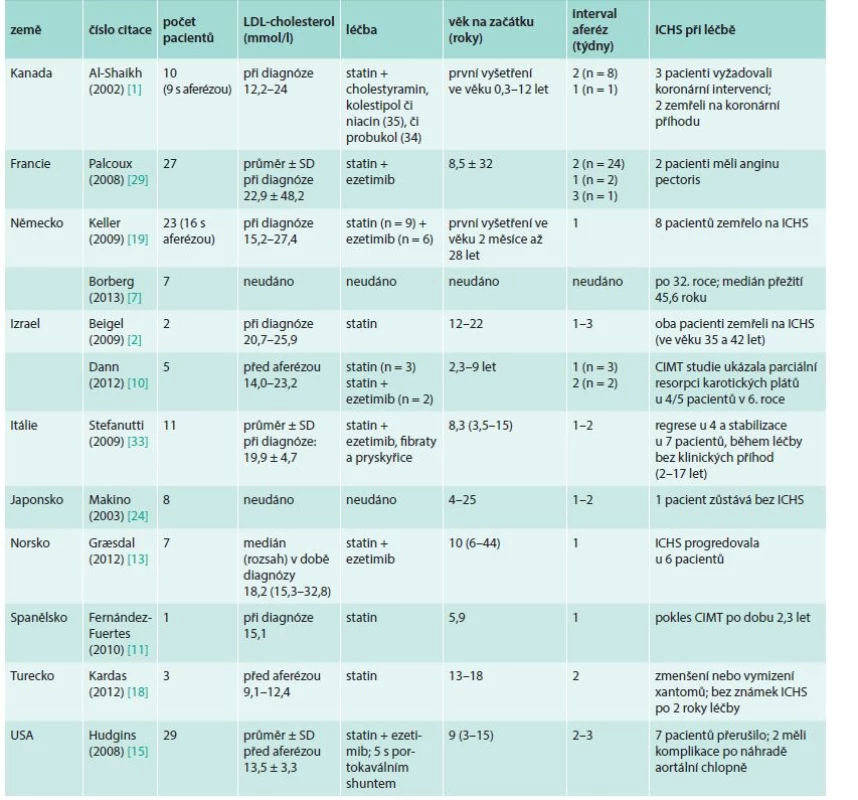
CIMT – carotid intima-media thickness (tloušťka) ICHS – ischemická choroba srdeční Jednoznačná výhoda platná pro současné metody (a to pro všech 6 metod LDL-aferézy) je, že sníží v krátké době LDL-cholesterol hluboce pod normu (naše cílová hodnota je 0,5–1 mmol/l na konci procedury). Obecně se udává jako úspěšné průměrné snížení LDL-cholesterolu o 70–80 % [26], naše výsledky z poslední doby ukázaly 80–90 % [21]. Tohotu efektu nelze docílit žádným jiným dosud známým (např. medikamentózním) způsobem. Po LDL-aferéze proto vznikne velmi důležitá asi jednotýdenní perioda hypocholesterolemie, během níž se redistribuuje LDL-cholesterol z tkání. Dojde ovšem k opětnému poměrně rychlému vzestupu hladiny LDL-cholesterolu a původní hladiny je dosaženo asi za 2 týdny (u homozygotů pomaleji, u heterozygotů rychleji – podle poměrně složité „rebound“ dynamiky a procesu odbourávání – [26,35], graf. Proto je nutno výkony v přesně definovaných intervalech opakovat.
Graph 1. Dynamika hladiny LDL-cholesterolu po LDLaferéze. Upraveno dle [35]. ![Dynamika hladiny LDL-cholesterolu po LDLaferéze. Upraveno dle [35].](https://pl-master.mdcdn.cz/media/image/8ade793e50ca91577b2fb21e68300c85.jpg?version=1537795144)
Minimální hladina Cmin a maximální hladina Cmax jsou změřeny a průměrná hodnota (Cmean průměr za časový interval – interval or time-average mean) se pak spočítá z rovnice podle Kroona [Cmean = Cmin + K(max – Cmin )], kde K je 0,71 pro heterozygoty a 0,65 pro homozygoty. LDL-aferéza je také jako jediná možná v těhotenství, kdy jsou statiny i ezetimib kontraindikovány a díky léčbě LDL-aferézou může těhotenství někdy hladce proběhnout i u homozygotních pacientek [4].
Omezením při LDL-aferéze jsou především cévní problémy. Dobrý přítok krve do přístrojů někdy nezajistí periferní žíly, zejména u dětí. Provádějí se A-V shunty, což přináší obvyklé možnosti komplikací, jako jsou infekční nebo trombotické problémy. Pokud jde o dospělé, zpravidla vystačíme s periferními žilami. Další problém je časová ztráta pro nemocné, a to nejméně půl dne, často celý den – samotná procedura trvá 3–5 hodin, čas zabere doprava do centra a po výkonu se cítí někteří nemocní unavení. Bolestivý je jen vpich do žil, ale při výkonu je nepohodlím nutnost ležet v klidu, obvykle s jehlami zavedenými do žil obou horních končetin. Další komplikace LDL-aferézy jsou řídké, jde o slabost, nevolnost, krátkodobá hypotenze, obtíže z hypokalcemie (může ji působit předávkování antikoagulans – ACD-A) aj; komplikace jsme zaznamenali u 3,1 % pacientů [21]. Obdobný výsledek udává celosvětový registr WAA (World Apheresis Registry), do nějž údaje o všech výkonech pravidelně hlásíme.
Výhled do budoucna
I když je v poslední době k disposici nebo ve vývoji několik účinných nových hypolipidemik, nepokládá se za pravděpodobné, že by bylo možno dosáhnout cílových hodnot LDL-cholesterolu zejména u homozygotů bez LDL-aferézy [25,32]. Naopak se však předpokládá pozitivum, že by se vytvořily kombinace nejúčinnějších a nejekonomičtějších postupů – kombinace léků a LDL-aferézy, aby bylo možno u více pacientů dosáhnout nejoptimálnějších cílových hodnot tak, že by se progrese FH nejen pozastavila, ale zcela odstranila. Bude také možno více přihlížet k vedlejším účinkům, přáním pacientů (upravit časový harmonogram podle možností pacientů bez následků na omezenou účinnost) a regulovat intenzitu LDL-aferéz (snížit frekvenci nebo mohutnost pro pacienta nepříjemných procedur).
Situace v České republice
EE cholesterolu používáme na našem pracovišti od roku 1994, zprvu plazmaferézu, od roku 1996 LDL-aferézu. Homozygotní pacienti jsou soustřeďováni do našeho centra z České republiky. Dlouhodobě sledujeme 14 pacientů s FH (8 mužů, 6 žen) ve věku 28–70 let (věkový průměr 52,5 roků; medián 57 let; rozmezí 28–70 let). Jedná se o 5 homozygotů FH, u nichž je věkový průměr nižší – 35 let (rozmezí 28–59 let) a 9 heterozygotů FH s věkovým průměrem 59 let (rozmezí 48–70 let). Medián sledování pacientů je 8,5 roku (rozmezí 1–17 let). 10 pacientů je léčeno imunoadsorpcí (5 homozygotů a 5 heterozygotů) a 4 pacienti reohemaferézou (2 muži, 2 ženy, všichni heterozygoti). Od roku 1996 bylo na našem pracovišti provedeno celkem 1 922 výkonů, z toho 1 590 LDL-imunoadsorpcí a 332 reohemaferéz. Průměrná hodnota cholesterolu a LDL-cholesterolu byla před výkonem 5,34 a 3,12 mmol/l u imunoadsorpcí, u reohemaferéz 5,07 a 2,86; po výkonu 1,73 a 0,72 (pokles o 72 a 85 %), resp. 1,96 a 0,97 mmol/l (pokles o 61 a 66 %). Ve sledovaném období nedošlo ke vzniku nové koronární příhody ani k úmrtí žádného pacienta léčeného LDL-aferézou.
Závěr
LDL-aferéza účinně a relativně selektivně odstraní 70–80 % LDL-cholesterolu u homozygotních nebo těžkých heterozygotních pacientů. I když rychle dochází k tzv. rebound fenoménu, může zajistit průměrný pokles (time-average reduction) LDL-cholesterolu asi o 40 %. Oproti plazmaferéze nemá klinicky negativní dopad na HDL-cholesterol, albumin nebo imunoglobuliny. I když neexistují klasické velké randomizované studie, pokládá se její pozitivní efekt na kardiovaskulární prognózu u FH za prokázaný.
Práce byla podpořena projekty IGA MZ ČR NT/12287–5 a PRVOUK P37/12.
prof. MUDr. Vladimír Bláha, CSc.
blaha@lfhk.cuni.cz
III. interní gerontometabolická klinika LF UK a FN, Hradec Králové
www.fnhk.cuni.cz
Doručeno do redakce 29. 9. 2014
Přijato po recenzi 15. 10. 2014
Sources
1. Al-Shaikh AM, Abdullah MH, Barclay A et al. Impact of the characteristics of patients and their clinical management on outcomes in children with homozygous familial hypercholesterolemia. Cardiol Young 2002; 12(2): 105–112.
2. Beigel R, Beigel Y. Homozygous familial hypercholesterolemia: long term clinical course and plasma exchange therapy for two individual patients and review of the literature. J Clin Apher 2009; 24(6): 219–224.
3. Benlian P. Genes of lipoprotein metabolism. In: Genetics of dyslipidemia. Kluwer Academic Publishers: London 2001. ISBN 0–7923–7362–6. 41–181.
4. Bláha M, Lánská M, Bláha V. Pregnancy in homozygous familial hypercholesterolemia – importance of LDL-apheresis. Atherosclerosis Suppl. Přijato do tisku 2014.
5. Bláha M, Rencová E, Malý R et al. Léčba hemorheoferézou (současný stav a vlastní zkušenosti). Aktuality z nefrologie 2008; 14(3): 118–124.
6. Bláha M, Zadák Z, Havel E et al. Léčba těžké hyperlipoproteinémie LDL-aferézou. Transfuze dnes 1997; 19 : 9–10.
7. Borberg H. The lower the better: target values after LDL-Apheresis and semi-selective LDL-elimination therapies. Transfus Apher Sci 2013; 48(2): 203–206.
8. Borberg H. 26 years of LDL-apheresis: a review of experience. Transfus Apher Sci 2009; 41(1): 49–59.
9. Cuchel M, Bruckert E, Ginsberg HN et al. European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J 2014; 35(32): 2146–2157.
10. Dann EJ, Shamir R, Mashiach T et al. Early-onset plasmapheresis and LDL-apheresis provide better disease control for pediatric homozygous familial hypercholesterolemia than HMG-CoA reductase inhibitors and ameliorate atherosclerosis. Transfus Apher Sci 2013; 49(2): 268–277.
11. Fernández-Fuertes LF, Tapia Martín M, Nieves Plá I et al. Low-density lipoprotein apheresis using double filtration plasmapheresis: 27-month use in a child with homozygous familial hypercholesterolemia. Ther Apher Dial 2010; 14(5): 484–485.
12. Fischer S, Schatz U, Julius U. Current standards in diagnosis and therapy of hyperlipoproteinemia. Atheroscler Suppl 2013; 14(1): 15–18.
13. Græsdal A, Bogsrud MP, Holven KB et al. Apheresis in homozygous familial hypercholesterolemia: the results of a follow-up of all Norwegian patients with homozygous familial hypercholesterolemia. J Clin Lipidol 2012; 6(4): 331–339.
14. Harada-Shiba M, Arai H, Oikawa S et al. Guidelines for the management of familial hypercholesterolemia. J Atheroscler Thromb 2012; 19(12): 1043–1060.
15. Hudgins LC, Kleinman B, Scheuer A et al. Long-term safety and efficacy of low-density lipoprotein apheresis in childhood for homozygous familial hypercholesterolemia. Am J Cardiol 2008; 102(9): 1199–1204.
16. Julius U, Taseva K, Fischer S et al. Current situation of lipoprotein apheresis in Saxony. Atheroscler Suppl 2013; 14(1): 51–55.
17. Kalinová M, Zadák Z, Bláha M. Léčba hyperlipoproteinémií kontinuálními plazmaferézami. Lék Zprávy (Hradec Králové) 1981; 26 : 135–142.
18. Kardaş F, Cetin A, Solmaz M et al. Successful treatment of homozygous familial hypercholesterolemia using cascade filtration plasmapheresis. Turk J Haematol 2012; 29(4): 334–341.
19. Keller C. LDL-apheresis in homozygous LDL-receptor-defective familial hypercholesterolemia: the Munich experience. Atheroscler Suppl 2009; 10(5): 21–26.
20. Klingel R, Fassbender C, Fassbender T et al. Rheopheresis: rheologic, functional, and structural aspects. Ther Apher 2000; 4(5): 348–357.
21. Lánská M, Bláha M, Žák P. Extrakorporální eliminace cholesterolu u familiární hypercholesterolémie – srovnání dvou metodik. Transfuze a hematologie dnes. Přijato do tisku 2014.
22. Leebman J, Roeseler E, Julius U et al. Lipoprotein apheresis in patients with maximally tolerated lipid-lowering therapy, lipoprotein(a)-hyperlipoproteinemia, and progressive cardiovascular disease: prospective observational multicenter study. Circulation 2013; 128(24): 2567–2576.
23. Mabuchi H, Koizumi J, Shimizu M et al. Long-term efficacy of low-density lipoprotein apheresis on coronary heart disease in familial hypercholesterolemia. Hokuriku-FH-LDL-Apheresis Study Group. Am J Cardiol 1998; 82(12): 1489–1495.
24. Makino H, Harada-Shiba M. Long-term effect of low-density lipoprotein apheresis in patients with homozygous familial hypercholesterolemia. Ther Apher Dial 2003; 7(4): 397–401.
25. Marais AD, Blom DJ. Recent advances in the treatment of homozygous familial hypercholesterolaemia. Curr Opin Lipidol 2013; 24(4): 288–294.
26. McGowan MP. Emerging low-density lipoprotein (LDL) therapies: Management of severely elevated LDL cholesterol – the role of LDL-apheresis. J Clin Lipidol 2013; 7(3 Suppl): S21-S26.
27. Nordestgaard BG, Chapman MJ, Humphries SE et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J 2013; 34(45): 3478–3490.
28. Page MM, Bell DA, Hooper AJ et al. Lipoprotein apheresis and new therapies for severe familial hypercholesterolemia in adults and children. Best Pract Res Clin Endocrinol Metab 2014; 28(3): 387–403.
29. Palcoux JB, Atassi-Dumont M, Lefevre P et al. Low-density lipoprotein apheresis in children with familial hypercholesterolemia: follow-up to 21 years. Ther Apher Dial 2008; 12(3): 195–201.
30. Pták J. Changes of plasma proteins after immunoadsorption using Ig-Adsopak columns in patients with myasthenia gravis. Transfus Apher Sci 2004; 30(2): 125–129.
31. Schwarz J, Winters JL, Padmanabhan A et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Committee of the American Society for Apheresis: the sixth special issue. J Clin Apher 2013; 28(3): 145–284.
32. Stefanutti C. Treatment of severe genetic dyslipidemia: where are we going? Ther Apher Dial 2013; 17(2): 122–123.
33. Stefanutti C, Vivenzio A, Di Giacomo S et al. Aorta and coronary angiographic follow-up of children with severe hypercholesterolemia treated with low-density lipoprotein apheresis. Transfusion 2009; 49(7): 1461–1470.
34. Stoffel W, Borberg H, Greve V. Application of specific extracorporeal removal of low density lipoprotein in familial hypercholesterolaemia. Lancet 1981; 2(8254): 1005–1007.
35. Thompson GR, Barbir M, Davies D et al. Efficacy criteria and cholesterol targets for LDL apheresis. Atherosclerosis 2010; 208(2): 317–321.
36. Thompson GR, Miller JP, Breslow JL. Improved survival of patients with homozygous familial hypercholesterolaemia treated by plasma exchange. Br Med J (Clin Res Ed) 1985; 291(6510): 1671–1673.
37. Thompson GR. The evidence-base for the efficacy of lipoprotein apheresis in combating cardiovascular disease. Atheroscler Suppl 2013; 14(1): 67–70.
38. Watts GF, Gidding S, Wierzbicki AS et al. Integrated guidance on the care of familial hypercholesterolemia from International FH Foundation. J Clin Lipidol 2014; 8(2): 148–172.
39. Winters JL. American society for apheresis guidelines on the use of apheresis in clinical practice: Practical, concise, evidence-based recommendations for the apheresis practitioner. J Clin Apher 2014; 29(4): 191–193.
40. Winters JL. Low-density lipoprotein apheresis: principles and indications. Semin Dial 2012; 25(2): 145–151.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 11-
All articles in this issue
- Nový SGLT2 inhibitor empagliflozin: moderní a bezpečná léčba diabetu
- Prevence kardiovaskulárních onemocnění v běžné klinické praxi: lze dosáhnout zlepšení?
- Markery reziduálního kardiovaskulárního rizika
- Nové pohledy na hormonální substituční terapii
- Novinky v oblasti hypolipidemické léčby
- Nefarmakologická léčba – výsledky z Poděbrad
-
Familiární hypercholesterolemie včera a dnes.
Vlastní zkušenosti a nálezy u našeho souboru nemocných s familiární hypercholesterolemií - LDL-aferéza v léčbě familiárních hyperlipoproteinemií
- Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
- Co mají společného žilní a tepenná onemocnění?
- Kardiovaskulární rizikový profil u 40letých mužů a 50letých žen v České republice: výsledky průřezové studie
-
Adherence pacientů s diabetem 2. typu k aplikaci inzulinových analog: vynechávání, časový posun a snižování dávek
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) v České republice
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nové pohledy na hormonální substituční terapii
- LDL-aferéza v léčbě familiárních hyperlipoproteinemií
- Nový SGLT2 inhibitor empagliflozin: moderní a bezpečná léčba diabetu
- Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

