-
Medical journals
- Career
Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let
Authors: Jitka Čepková; Filip Gabalec; Ioannis Svilias; Jiří Horáček
Authors‘ workplace: IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D.
Published in: Vnitř Lék 2014; 60(10): 832-836
Category: Original Contributions
Overview
Úvod:
Agranulocytóza je závažná komplikace léčby tyreostatiky (ATD) u zvýšené funkce štítné žlázy. Cílem naší práce bylo zjistit výskyt agranulocytózy u pacientů s Gravesovou nemocí (GD) přijatých k léčbě radioaktivním jodem 131I (RAI) na tyreoidální jednotku naší kliniky.Pacienti a metody:
Retrospektivně jsme analyzovali 603 pacientů s GD (500 žen a 103 mužů; průměrný věk 51,5 ± 12,7 let), kterým byl v letech 1999–2012 aplikován RAI. Z nich 327 (54 %) předtím užívalo karbimazol (CBZ), 215 (36 %) methimazol (MMI) a 61 (10 %) propylthiouracil (PTU).Výsledky:
Agranulocytóza po ATD byla důvodem k léčbě RAI u 7 z 603 nemocných. Šlo vždy o ženy, s věkovým průměrem 48,7 let (rozpětí 23–78). U 4 pacientek agranulocytóza vznikla po MMI a 3 pacientky užívaly CBZ. Po přepočtu CBZ na odpovídající dávku MMI byla průměrná dávka ATD 22,4 mg MMI/den (rozpětí 9–40). Agranulocytózu po PTU jsme v našem souboru nezachytili. Interval od zahájení terapie ATD do vzniku agranulocytózy byl 20–41 dní. U 5 nemocných došlo k rozvoji teploty, ve 2 případech byla komplikace diagnostikována z rutinní kontroly krevního obrazu. Průměrná doba trvání agranulocytózy byla 5,9 dní (rozpětí 4–8).Závěr:
Výskyt agranulocytózy v našem souboru nemocných byl 1,2 %, zatímco literární data uvádějí výskyt 0,2–0,5 %. U všech nemocných došlo k rozvoji agranulocytózy časně, z toho asi 30 % bylo v době diagnózy asymptomatických. Práce má za cíl upozornit na poměrně vzácnou, ale potenciálně závažnou komplikaci léčby ATD.Klíčová slova:
agranulocytóza – Gravesova nemoc – karbimazol – methimazol – propylthiouracilÚvod
Gravesova nemoc (GD) je nejčastější příčinou hypertyreózy s prevalencí asi 0,5–1 % [1]. Po potvrzení diagnózy GD máme k dispozici 3 efektivní a relativně bezpečné možnosti léčby: navození farmakologické remise tyreostatiky (ATD), aplikaci radioaktivního jodu 131I (RAI) nebo chirurgické řešení [2]. Mezi jednotlivými zeměmi existují rozdílné přístupy v použití jednotlivých léčebných metod [3]. V USA je na prvním místě zvažována aplikace RAI, v Evropě (a stejně tak i v ČR) se na prvním místě zahajuje terapie ATD [3,4]. K radikální léčbě (aplikace RAI nebo chirurgické řešení) se přistupuje až při recidivě onemocnění nebo při nemožnosti vysadit ATD [5].
ATD se v léčbě GD používají již více než 60 let [6]. Hlavní efekt léčby je snížení tvorby tyreoidálních hormonů a udržení eutyreózy, dokud nedojde k remisi. Mezi ATD patří karbimazol (CBZ), který v současné době není na českém trhu dostupný, a methimazol (MMI) nebo chemicky odlišný propylthiouracil (PTU). Tato tyreostatika inhibují oxidaci jodu a jeho vazbu na tyrozolové zbytky. PTU navíc zčásti inhibuje periferní přeměnu tyroxinu (T4) na trijodtyronin (T3) [7]. CBZ je prekurzorem MMI; po vstřebání se rychle konvertuje na MMI (10 mg CBZ je metabolizováno přibližně na 6 mg MMI) [2].
Vstupní dávka ATD je vyšší než udržovací dávka (asi 30–60 mg MMI nebo 300–600 mg PTU) [8], přesto je vzhledem k dlouhému eliminačnímu poločasu T4 (asi 7 dní) nástup účinku ATD pomalý; plný efekt lze očekávat asi za 4–8 týdnů. Po této době by mělo dojít ke klinickému zlepšení s odpovídajícím laboratorním nálezem; normalizace nebo pokles volného tyroxinu (fT4), tyrotropin (TSH) může zůstat suprimován déle. Po dosažení eutyreózy je doporučováno pokračovat v udržovací terapii ATD v nízké dávce (asi 10 mg MMI nebo 100 mg PTU) po dobu 12–18 měsíců [9], pak ATD zpravidla zkoušíme vysadit. K navození dlouhodobé remise po monoterapii ATD však dochází pouze v 40–50 % [10,11]. Prodloužení podávání ATD po dobu delší než 18 měsíců po první atace choroby již nezvyšuje pravděpodobnost udržení dlouhodobé remise [12].
Vyšší riziko relapsu tyreotoxikózy mají muži, kuřáci, pacienti s objemnou strumou (> 80 ml) [13–15]. Přetrvávající vyšší hodnota protilátek proti TSH receptoru (TRAK) a vyšší vaskularizace žlázy dle dopplerovského vyšetření má rovněž souvislost s vyšší pravděpodobností reaktivace GD [15–18]. Po vysazení ATD by tito pacienti měli být kontrolováni častěji. Doporučeny jsou 1–3měsíční intervaly po dobu 6–12 měsíců [2]. Za remisi považujeme, pokud pacienti mají normální TSH, fT4 a fT3 rok po vysazení ATD [2]. Recidivy choroby se však mohou vyskytovat i déle než 1 rok po vysazení ATD.
Vedlejší účinky se mohou vyskytnout asi u 5 % pacientů užívajících ATD [19]. Mezi ty mírné řadíme vyrážku, bolesti kloubů, GIT obtíže, snížení chuti a čichu. Pravděpodobnost výskytu obtíží je adekvátní výši dávky ATD zejména u MMI, u PTU tato závislost není až tolik nápadná [6]. Menší kožní reakce se dají zvládnout současným podáním antihistaminik bez přerušení ATD. Při přetrvávání obtíží je možná výměna za jiné tyreostatikum. Při vážné alergické reakci předepsání alternativního tyreostatika není doporučováno [2].
Mezi závažné komplikace léčby ATD patří agranulocytóza. Predikce a prevence je velmi obtížná. Prevalence je naštěstí nízká, okolo 0,2–0,5 % nemocných s GD užívajících ATD [2,20–22]. Nejčastěji se obtíže (vysoké teploty, bolesti v krku, soor) objevují náhle v prvních 3 měsících po zahájení léčby tyreostatiky [23]. Obvykle bývají po MMI nebo CBZ a riziko vzniku obtíží se zvyšuje se stoupající dávkou ATD [24]. Ojediněle se obtíže mohou vyskytnout i později nebo se vyvíjet plynule [23]. PTU agranulocytózu způsobuje méně často [25,26]. Pacienti musí být upozorněni, aby při výskytu horečky, bolesti v krku nebo sooru v dutině ústní neprodleně navštívili lékaře. Při poklesu absolutního počtu neutrofilů (ANC) pod 1 000/µl je nutné ukončit podávání ATD a zahájit empirickou intravenózní ATB terapii [27]. Po zvládnutí akutních obtíží je na místě po domluvě s pacientem radikální řešení. Dlouhodobé podávání ATD je v tomto případě kontraindikováno pro existenci zkřížené reaktivity mezi MMI a PTU stran rozvoje agranulocytózy [28].
Z dalších vážných komplikací je možný hepatotoxický účinek PTU, v ojedinělých případech může dojít až k akutnímu jaternímu selhání. Hepatotoxický efekt přetrvává i po vysazení PTU a může mít fatální následky [29]. Dle doporučení ATA by PTU neměl být předepisován v první linii léčby, ale jeho použití by mělo být indikováno ve zvláštních případech, jako je první trimestr gravidity, tyreotoxická krize a u pacientů netolerujících MMI (s výjimkou agranulocytózy) [29]. Hepatotoxický efekt MMI je typicky cholestatický. Zřídka může dojít k hepatocelulárnímu postižení, které je obvykle mírné a spontánně odezní [30,31]. ANCA pozitivní vaskulitida je další vzácnou komplikací, u které je nutné přerušit podávání ATD [32].
Pacienti a metody
Retrospektivně jsme analyzovali 603 pacientů s GD, kterým byl v letech 1999–2012 aplikován RAI na tyreoidální jednotce IV. interní hematologické kliniky LF UK a FN Hradec Králové, provozované ve spolupráci s oddělením nukleární medicíny FN Hradec Králové. V souboru bylo 500 žen a 103 mužů. Průměrný věk v době aplikace RAI byl 51,5 ± 12,7 let. Dle doporučených postupů v České republice se obvykle jednalo o pacienty s delší než roční anamnézou nemoci, v prvním nebo dalším relapsu onemocnění. Výjimečně byl RAI podán již po zaléčení první ataky choroby. V tomto případě šlo především o mladé pacientky plánující do budoucna těhotenství, o pacienty s nežádoucími účinky ATD a o starší pacienty s vysokým rizikem převážně kardiálních a skeletálních komplikací při nedostatečně kompenzované tyreotoxikóze. Před aplikací RAI 327 (54 %) pacientů užívalo CBZ, 215 (36 %) MMI a 61 (10 %) PTU. Agranulocytóza byla definovaná jako počet granulocytů pod 500/µl. Kontroly krevního obrazu po zahájení terapie ATD nebyly rutinně prováděny.
Výsledky
Z celkového počtu 603 nemocných byla agranulocytóza zachycena u 7 případů (1,2 %), u kterých bylo nutno ATD léčbu ukončit a aplikovat RAI jako radikální řešení. Ve všech případech šlo o ženy s prvním záchytem GD s věkovým rozmezím 23–78 let, průměrný věk byl 48,7 ± 19,4 let (tab). Čtyři pacientky užívaly MMI a 3 pacientky užívaly CBZ. Po přepočtu CBZ na odpovídající dávku MMI byla průměrná dávka ATD 22,4 mg MMI/den (rozpětí 9–40). Interval od zahájení terapie ATD do rozvoje agranulocytózy (potvrzeno dle hodnot krevního obrazu) byl 20–41 dní. U 5 nemocných došlo ke vzniku obtíží (vysoké teploty), ve 2 případech byla agranulocytóza diagnostikována u asymptomatické pacientky z hodnot krevního obrazu při standardní endokrinologické kontrole. Průměrná doba trvání agranulocytózy byla 5,9 dní (rozpětí 4–8). V 5 případech došlo ke spontánní regeneraci krvetvorby po vysazení ATD. V tomto případě agranulocytóza průměrně trvala 5,6 dní (rozpětí 4–8). Ve 2 případech byl podáván růstový faktor (filgrastim, G-CSF) ke stimulaci tvorby granulocytů s trváním agranulocytózy průměrně 6,5 dní (rozpětí 6–7). Po regeneraci krvetvorby byl všem pacientkám přechodně podáván PTU a jako definitivní léčba GD byl aplikován RAI s úspěšnou odezvou. Rok po aplikaci RAI všech 7 nemocných užívalo hormonální substituci levotyroxinem a mělo normální hodnoty krevního obrazu. V naší kohortě 603 pacientů jsme nezaznamenali žádný výskyt závažných hepatotoxických účinků tyreostatik a žádný případ tyreostatiky navozené vaskulitidy.
Table 1. Pacienti s agranulocytózou po podání methimazolu (MMI) a karbimazolu (CBZ) 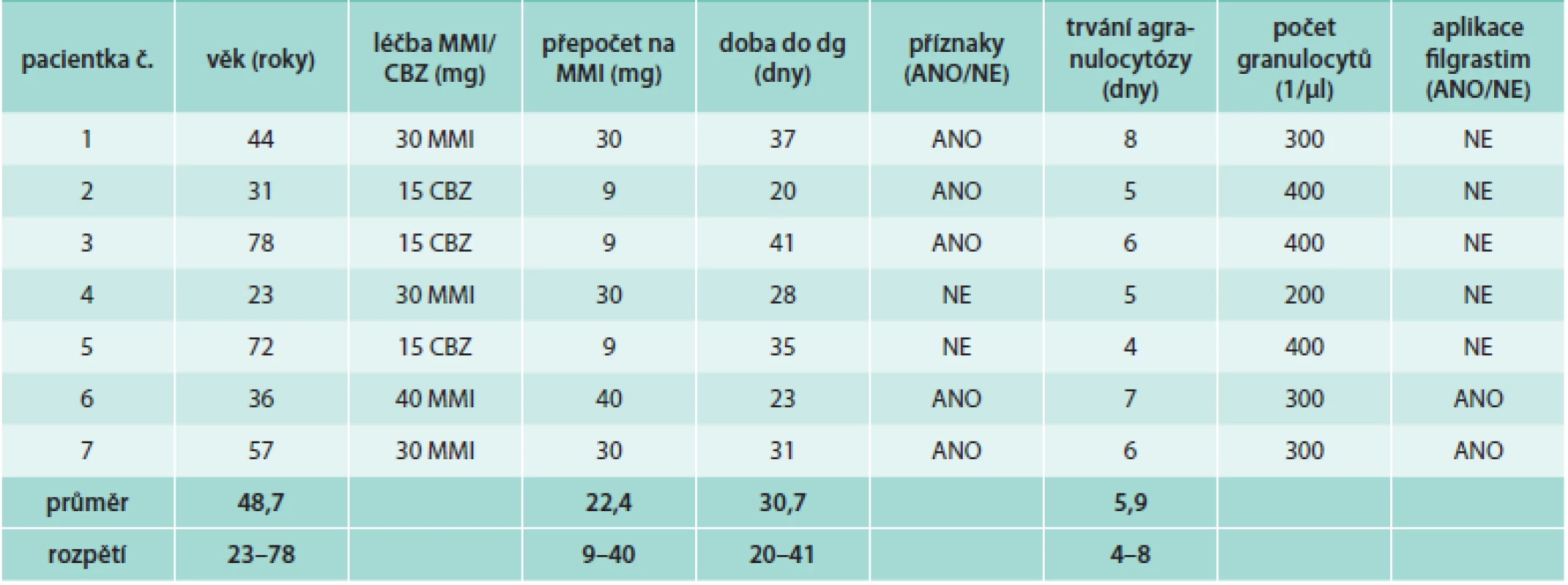
Diskuse
V této retrospektivní studii jsme analyzovali 7 případů agranulocytózy způsobené ATD z celkového počtu 603 pacientů s GD, kteří byli léčení aplikací RAI v průběhu 14 let. Výskyt této závažné až život ohrožující komplikace v našem souboru nemocných tak byl 1,2 % oproti očekávaným 0,2–0,5 % [2,20,21]. Dle nedávné práce japonských autorů, kteří zkoumali 754 případů ATD indukované agranulocytózy u GD v průběhu 30 let, je výskyt této vážné komplikace dokonce ještě nižší 0,1–0,15 % [23]. Zvýšený výskyt agranulocytózy v naší kohortě pacientů je pravděpodobně způsoben tím, že se jednalo o nemocné vyžadující radikální léčbu GD. Šlo nejčastěji o pacienty s relapsem choroby, ale také (vzácně) s nežádoucími účinky ATD. V našem souboru však nebyl zaznamenán žádný výskyt závažných hepatotoxických účinků ATD, pravděpodobně proto, že naši pacienti byli léčeni převážně MMI a CBZ, jejichž případný hepatotoxický účinek bývá mírný [30,31]. Pouze 10 % našich pacientů užívalo PTU, který může způsobit těžké jaterní poškození až akutní jaterní selhání [29].
Při bližší analýze jednotlivých případů agranulocytózy šlo ve všech případech o ženy s nově diagnostikovanou GD. Oproti původnímu očekávání věkový medián ve skupině s výskytem agranulocytózy (44 let) byl nižší než v celém souboru (51 let). V dříve publikovaných pracích je výskyt agranulocytózy spojován s vyšším věkem [23,33].
Ke vzniku agranulocytózy v našem souboru nemocných došlo ve všech případech během prvních 2 měsíců terapie ATD, medián byl 31 dní od zahájení léčby. Tyto výsledky jsou v dobré shodě s dříve publikovanými pracemi [33–35]. Dle rozsáhlé studie japonských autorů (Nakamura et al) [23] se více než 70 % případů agranulocytózy objevilo během prvních 60 dní terapie ATD a téměř 85 % během prvních 90 dní podávání tyreostatik. Pouze u 55 pacientů (7 %) z celkových 754 se rozvinula agranulocytóza později než 4 měsíce od zahájení terapie ATD. Ke vzniku agranulocytózy rovněž může dojít po znovuzahájení léčby ATD při relapsu onemocnění.
K rozvoji obtíží (vysoké teploty, bolesti v krku, soor) obvykle dochází náhle. U 5 našich pacientek s diagnózou agranulocytózy došlo náhle ke vzniku vysokých teplot bez předchozích příznaků. Naopak u 2 nemocných byla diagnóza učiněna náhodně z rutinního odběru krevního obrazu v rámci standardní endokrinologické kontroly. Pravidelné monitorování krevních testů není mnohými autory doporučováno pro malou výpovědní hodnotu v predikci agranulocytózy [2,20,21]. Naopak v Japonsku je doporučováno pravidelné monitorování krevního obrazu v intervalu 2 týdnů během prvních 2 měsíců terapie ATD [23]. Tajiri et al [33] publikovali, že pouze 12 z 55 nemocných s ATD indukovanou agranulocytózou mělo klinicky manifestní příznaky v době diagnózy. Více než 70 % případů bylo diagnostikováno náhodně z rutinního odběru krevních testů. Naopak Nakamura et al [23] varují před přílišným spoléháním na rutinní monitorování krevního obrazu. Více než polovina nemocných v jejich souboru (n = 754) měla normální krevní testy 2 týdny před klinickou manifestací agranulocytózy.
V našem souboru nebyl zaznamenán žádný případ vzniku agranulocytózy po užívání PTU. CBZ byl podáván ve 3 případech a MMI ve 4 případech. Po přepočtu dávky CBZ na adekvátní dávku MMI byla průměrná dávka MMI 22,4 ± 12,1 mg/den v době diagnózy agranulocytózy. Podobnou průměrnou dávku (25,2 ± 12,8 mg/den) vypočítali i Nakamura et al v jejich souboru pacientů [23]. Vyšší dávka ATD je spojena se zvýšeným rizikem. Dle jiné rozsáhlé studie byl výskyt agranulocytózy 0,8 % z 2 087 pacientů léčených počáteční dávkou MMI 30 mg/den, ale jen 0,2 % z 2 739 pacientů léčených počáteční dávkou MMI 15 mg/den [24].
Při diagnóze agranulocytózy je na zvážení přechodné podávání G-CSF ke stimulaci tvorby granulocytů k celkovému zkrácení regenerace krvetvorby, a tím i doby hospitalizace, ačkoliv prospektivní randomizovaná studie tento fakt nepotvrdila [36]. Jiní autoři naopak prokázali zkrácení doby regenerace podáním G-CSF [37]. Při rozdělení našeho souboru na 2 skupiny podle aplikace G-CSF nebyl zřetelný rozdíl v délce regenerace krvetvorby. Soubor však byl příliš malý a sledování nikoli prospektivní, takže toto zjištění má jen orientační výpovědní hodnotu.
Závěr
Práce má za cíl upozornit na poměrně vzácnou, ale potenciálně závažnou komplikaci léčby ATD. Prevalence agranulocytózy v naší kohortě 603 pacientů byla 1,2 % proti v literatuře uváděným 0,2–0,5 %. Tento zvýšený výskyt byl pravděpodobně způsoben povahou našeho souboru, jednalo se o pacienty vyžadující radikální léčbu GD.
Retrospektivní design naší studie neumožňuje posoudit, zda rutinní monitorování krevního obrazu při léčbě ATD má v časném odhalení vzniku agranulocytózy klinický význam. Pozorovali jsme však, že skoro ve 30 % případů v našem souboru byla agranulocytóza zachycena právě při rutinním vyšetření, tedy ještě bez příznaků. Vzhledem k běžné dostupnosti a nízké ceně se nám rutinní vyšetřování krevního obrazu při standardních kontrolách jeví spíše vhodné, přinejmenším během prvních 3 měsíců terapie ATD, kdy je vznik této komplikace nejpravděpodobnější. V každém případě musí být pacienti poučeni, aby při výskytu obtíží (vysoké teploty, bolesti v krku, soor) přestali užívat ATD a neprodleně navštívili lékaře.
Aplikace G-CSF v našem (pro spolehlivé hodnocení příliš malém) souboru léčených nevedla ke zkrácení doby regenerace krvetvorby.
Podpořeno projektem IGA MZ ČR NT 13535–3/2012.
MUDr. Jitka Čepková
jitka.cepkova@fnhk.cz
IV. interní hematologická klinika LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 11. 6. 2014
Přijato po recenzi 14. 7. 2014
Sources
1. Zamrazil V. Nemoci štítné žlázy v klinické praxi. Postgrad Med J 2013; 15(7): 720–729.
2. Bahn Chair RS, Burch HB, Cooper DS et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011; 21(6): 593–646.
3. Burch HB, Burman KD, Cooper DS. A 2011 survey of clinical practice patterns in the management of Graves' disease. J Clin Endocrinol Metab 2012; 97(12): 4549–4558.
4. Wartofsky L, Glinoer D, Solomon B et al. Differences and similarities in the diagnosis and treatment of Graves' disease in Europe, Japan, and the United States. Thyroid 1991; 1(2): 129–135.
5. Vaidya B, Williams GR, Abraham P et al. Radioiodine treatment for benign thyroid disorders: results of a nationwide survey of UK endocrinologists. Clin Endocrinol (Oxf) 2008; 68(5): 814–820.
6. Cooper DS. Antithyroid drugs. N Engl J Med 2005; 352(9): 905–917.
7. Dokupilova A, Payer J. Thyrostatic treatment and its adverse effects. Vnitř Lék 2013; 59(11): 989–995.
8. Brunová J Diagnostika a terapie poruch funkce štítné žlázy. Med pro praxi 2008; 5(9): 315–321.
9. Rajput R, Goel V. Indefinite antithyroid drug therapy in toxic Graves' disease: What are the cons. Indian J Endocrinol Metab 2013; 17(Suppl 1): S88-S92.
10. Allannic H, Fauchet R, Orgiazzi J et al. Antithyroid drugs and Graves' disease: a prospective randomized evaluation of the efficacy of treatment duration. J Clin Endocrinol Metab 1990; 70(3): 675–679.
11. Maugendre D, Gatel A, Campion L et al. Antithyroid drugs and Graves' disease – prospective randomized assessment of long-term treatment. Clin Endocrinol (Oxf) 1999; 50(1): 127–132.
12. Weetman AP. Graves' hyperthyroidism: how long should antithyroid drug therapy be continued to achieve remission? Nat Clin Pract Endocrinol Metab 2006; 2(1): 2–3.
13. Allahabadia A, Daykin J, Holder RL et al. Age and gender predict the outcome of treatment for Graves' hyperthyroidism. J Clin Endocrinol Metab 2000; 85(3): 1038–1042.
14. Nedrebo BG, Holm PI, Uhlving S et al. Predictors of outcome and comparison of different drug regimens for the prevention of relapse in patients with Graves' disease. Eur J Endocrinol 2002; 147(5): 583–589.
15. Orunesu E, Bagnasco M, Salmaso C et al. Use of an artificial neural network to predict Graves' disease outcome within 2 years of drug withdrawal. Eur J Clin Invest 2004; 34(3): 210–217.
16. Glinoer D, de Nayer P, Bex M et al. Effects of l-thyroxine administration, TSH-receptor antibodies and smoking on the risk of recurrence in Graves' hyperthyroidism treated with antithyroid drugs: a double-blind prospective randomized study. Eur J Endocrinol 2001; 144(5): 475–483.
17. Orgiazzi J, Madec AM. Reduction of the risk of relapse after withdrawal of medical therapy for Graves' disease. Thyroid 2002; 12(10): 849–853.
18. Takasu N, Yamashiro K, Komiya I et al. Remission of Graves' hyperthyroidism predicted by smooth decreases of thyroid-stimulating antibody and thyrotropin-binding inhibitor immunoglobulin during antithyroid drug treatment. Thyroid 2000; 10(10): 891–896.
19. Abraham P, Avenell A, Park CM et al. A systematic review of drug therapy for Graves' hyperthyroidism. Eur J Endocrinol 2005; 153(4): 489–498.
20. Brent GA. Clinical practice. Graves' disease. N Engl J Med 2008; 358(24): 2594–2605.
21. Franklyn JA, Boelaert K. Thyrotoxicosis. Lancet 2012; 379(9821): 1155–1166.
22. Watanabe N, Narimatsu H, Noh JY et al. Antithyroid drug-induced hematopoietic damage: a retrospective cohort study of agranulocytosis and pancytopenia involving 50,385 patients with Graves' disease. J Clin Endocrinol Metab 2012; 97(1): E49-E53.
23. Nakamura H, Miyauchi A, Miyawaki N et al. Analysis of 754 cases of antithyroid drug-induced agranulocytosis over 30 years in Japan. J Clin Endocrinol Metab 2013; 98(12): 4776–4783.
24. Takata K, Kubota S, Fukata S et al. Methimazole-induced agranulocytosis in patients with Graves' disease is more frequent with an initial dose of 30 mg daily than with 15 mg daily. Thyroid 2009; 19(6): 559–563.
25. Andersohn F, Konzen C, Garbe E. Systematic review: agranulocytosis induced by nonchemotherapy drugs. Ann Intern Med 2007; 146(9): 657–665.
26. Meyer-Gessner M, Benker G, Lederbogen S et al. Antithyroid drug-induced agranulocytosis: clinical experience with ten patients treated at one institution and review of the literature. J Endocrinol Invest 1994; 17(1): 29–36.
27. Abraham P, Acharya S. Current and emerging treatment options for Graves' hyperthyroidism. Ther Clin Risk Manag 2010; 6 : 29–40.
28. Ahmed K, Rao S, Simha V. Antineutrophil cytoplasmic antibody-positive vasculitis in a patient with graves disease: cross-reaction between propylthiouracil and methimazole. Endocr Pract 2010; 16(3): 449–451.
29. Bahn RS, Burch HS, Cooper DS et al. The Role of Propylthiouracil in the Management of Graves' Disease in Adults: report of a meeting jointly sponsored by the American Thyroid Association and the Food and Drug Administration. Thyroid 2009; 19(7): 673–674.
30. Vilchez FJ, Torres I, Garcia-Valero A et al. Concomitant agranulocytosis and hepatotoxicity after treatment with carbimazole. Ann Pharmacother 2006; 40(11): 2059–2063.
31. Woeber KA. Methimazole-induced hepatotoxicity. Endocr Pract 2002; 8(3): 222–224.
32. Kaňová N. Tyreostatika stále aktuální. DMEV 2007; 10(1): 37–42.
33. Tajiri J, Noguchi S, Murakami T et al. Antithyroid drug-induced agranulocytosis. The usefulness of routine white blood cell count monitoring. Arch Intern Med 1990; 150(3): 621–624.
34. Dai WX, Zhang JD, Zhan SW et al. Retrospective analysis of 18 cases of antithyroid drug (ATD)-induced agranulocytosis. Endocr J 2002; 49(1): 29–33.
35. Pearce SH. Spontaneous reporting of adverse reactions to carbimazole and propylthiouracil in the UK. Clin Endocrinol (Oxf) 2004; 61(5): 589–594.
36. Fukata S, Kuma K, Sugawara M. Granulocyte colony-stimulating factor (G-CSF) does not improve recovery from antithyroid drug-induced agranulocytosis: a prospective study. Thyroid 1999; 9(1): 29–31.
37. Andres E, Kurtz JE, Perrin AE et al. Haematopoietic growth factor in antithyroid-drug-induced agranulocytosis. QJM 2001; 94(8): 423–428.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 10-
All articles in this issue
- Infekční endokarditidy v okrese Tábor v letech 2009–2013
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let
- Uživatelské výstupy z národního registru katetrových implantací aortální chlopně (Czech TAVI Registry): možnosti analytických výstupů založených na databázovém systému TrialDB2
- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Plicní hypertenze – patofyziologické mechanizmy
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Asociace aterotrombózy a trombofilie – genetické aspekty
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Dna a kardiovaskulární riziko
- Jak se mění možnosti léčby obézních diabetiků 2. typu
- Léčba bortezomibem u pacientů s onemocněním z depozice lehkých řetězců imunoglobulinu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Dna a kardiovaskulární riziko
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

