-
Medical journals
- Career
Vzťah polymorfizmov génov CDKAL1 a KCNQ1 k veku diagnózy diabetu 2. typu v populácii Slovenska
Authors: M. Dobríková 1; M. Javorský 1; V. Habálová 2; L. Klimčáková 2; M. Kozárová 1; J. Židzik 2; J. Halušková 2; J. Šalagovič 2; I. Tkáč 1
Authors‘ workplace: IV. interná klinika Lekárskej fakulty UPJŠ a Centra excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA) Lekárskej fakulty UPJŠ Košice, Slovenská republika, prednosta prof. MUDr. Ivan Tkáč, PhD. 1; Ústav lekárskej biológie Lekárskej fakulty UPJŠ a Centra excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA) Lekárskej fakulty UPJŠ v Košice, Slovenská republika, prednosta prof. RNDr. Ján Šalagovič, PhD. 2
Published in: Vnitř Lék 2011; 57(2): 155-158
Category: Original Contributions
Overview
Úvod/cieľ:
Asociácia génov CDKAL1 a KCNQ1 s diabetes mellitus 2. typu (DM2T) bola potvrdená viacerými celogénomovými asociačnými štúdiami v kaukazskej aj ázijskej populácii. U oboch génov sa predpokladá vplyv na riziko rozvoja DM2T prostredníctvom poruchy inzulínovej sekrécie. Vychádzali sme z predpokladu, že prítomnosť rizikovej alely môže predisponovať k skoršiemu nástupu DM2T. Cieľom našej štúdie bolo zistiť frekvenciu rizikových alel polymorfizmov rs7756992 génu CDKAL1 a rs163184 génu KCNQ1 a analyzovať ich vzťah k veku stanovenia diagnózy DM2T v populácii Slovenska.Metódy:
V súbore 538 pacientov s DM2T boli určené genotypy polymorfizmu rs7756992 A/G génu CDKAL1 a polymorfizmu rs163184 G/T génu KCNQ1 metódou asymetrickej PCR s následnou analýzou krivky topenia. Antropometrické a laboratórne parametre boli vyšetrené štandardnými metódami. Vzhľadom na analýzu 2 génov bola definovaná požadovaná hladina štatistickej významnosti na hladine p < 0,025.Výsledky:
Rizikoví homozygoti (GG) polymorfizmu KCNQ1 mali v recesívnom modeli o 2 roky vyšší priemerný vek diagnózy DM2T ako nosiči alely T (GT + TT), ale hodnota štatistickej významnosti nedosiahla preddefinovanú úroveň. Pri polymorfizme génu CDKAL1 nebol pozorovaný signifikantný rozdiel vo veku diagnózy DM2T medzi jednotlivými genotypmi.Záver:
V tejto štúdii sme nezistili vzťah medzi sledovanými polymorfizmami génov CDKAL1 a KCNQ1 a skorším vekom nástupu DM2T v populácii Slovenska.Kľúčové slová:
diabetes mellitus 2. typu – génové polymorfizmy – CDKAL1 – KCNQ1 – vek diagnózy diabetuÚvod
Diabetes mellitus 2. typu (DM2T) je komplexné ochorenie. Na jeho etiopatogenéze sa podieľajú viaceré gény s malým účinkom, medzigénové interakcie, ako aj environmentálne vplyvy. V minulosti sa na zisťovanie genetických faktorov komplexných ochorení používali prístupy identifikácie kandidátskych génov a väzobnej analýzy. Posledné roky sa do popredia dostali celogenómové asociačné štúdie (genome-wide association studies), ktoré umožnili identifikovať veľké množstvo významných asociácií medzi určitými chromozómovými lokusmi a komplexnými ochoreniami. Prostredníctvom nich boli potvrdené asociácie DM2T s predtým identifikovanými kandidátskymi génmi – TCF7L2, PPARG, KCNJ11 a bolo objavených viac ako 20 nových génov, ktorých polymorfizmy sú spojené so zvýšeným rizikom rozvoja DM2T, medzi nimi aj gény CDKAL1 a KCNQ1.
CDKAL1 kóduje inhibítor cyklín dependentnej kinázy 5 (CDK5). Aktívny komplex p35/CDK5 znižuje inzulínovú expresiu. Inhibícia aktivity tohto komplexu bráni deštrukcii β-buniek počas glukotoxických stavov [1]. Niektorí vedci predpokladajú, že patomechanizmus vedúci k rozvoju DM2T je v prítomnosti rizikových polymorfizmov tohto génu sprostredkovaný prostredníctvom porušenej regulácie bunkového cyklu [2]. Viaceré štúdie dokázali vplyv jeho polymorfizmov na zníženie inzulínovej sekrécie [3–6]. Niektoré publikácie poukazujú u určitých variácií tohto génu na porušenú konverziu proinzulínu na inzulín [7,8].
Gén KCNQ1 kóduje podjednotku napätím regulovaného (voltage-dependent) draslíkového kanála nachádzajúceho sa v pankreatických a myokardiálnych bunkách. Práce Unokiho et al poukazujú na najväčšiu expresiu KCNQ1 v srdci, pankrease, vo vnútornom uchu a v menšom množstve aj v placente, pľúcach, pečeni a obličkách [9]. Tento draslíkový kanál sa nachádza aj v bunkových kultúrach INS-1 produkujúcich inzulín, keďže inhibícia tohto kanála sulfónamidovým analógom spôsobuje zvýšenie inzulínovej sekrécie v prítomnosti tolbutamidu [10]. U laboratórnych zvierat so zníženou funkciou tohto génu sa nepozorovala hyperglykémia ani glukózová intolerancia. Preto sa predpokladá, že za rozvoj DM2T je zodpovedná zvýšená expresia tohto génu v pankreatických β-bunkách.
Polymorfizmy KCNQ1 boli asociované s DM2T vo východoázijskej aj kaukazskej populácii, pričom vyšší vplyv na riziko DM2T bol dokumentovaný v ázijskej populácii [9,11,12]. V jednej štúdii bola pozorovaná asociácia niektorých polymorfizmov KCNQ1 so znížením inkretínovej sekrécie [13].
Pri géne TCF7L2, ktorý je tesne asociovaný s DM2T, bolo zistené, že nosiči rizikových alel majú skorší vek nástupu diabetu [14–16]. Vo vzťahu ku génom CDKAL1 a KCNQ1 nám štúdie analyzujúce vzťah genotypu ku veku diagnózy diabetu nie sú známe. Cieľom našej štúdie bolo zistiť frekvenciu rizikových polymorfizmov a analyzovať vzťah polymorfizmu rs7756992 génu CDKAL1 a polymorfizmu rs163184 génu KCNQ1 na vek nástupu DM2T v populácii Slovenska.
Metódy
Pacienti
Do štúdie bolo zaradených 538 pacientov s DM2T dispenzarizovaných v 3 ambulanciách východného Slovenska (Košice, Prešov). Diagnóza bola založená na diagnostických kritériách Americkej diabetologickej spoločnosti [17]. Do štúdie neboli zaradení diabetici s dokázanou autoimunitnou etiológiou alebo špecifickými typmi diabetu.
Anamnestické údaje boli získané zo zdravotnej dokumentácie a antropometrické vyšetrenie (výška, váha, obvod pása, bokov, systolický a diastolický krvný tlak) bolo doplnené v rámci bežnej diabetologickej kontroly. Ďalej bol odobratý materiál na zistenie laboratórnych údajov (glykémia nalačno, glykovaný hemoglobín, lipidový profil) a materiál na stanovenie DNA. Klinická charakteristika subjektov štúdie je uvedená v tab. 1. Účastníci vyjadrili informovaný súhlas s účasťou v štúdii a štúdia bola schválená etickou komisiou Fakultnej nemocnice L. Pasteura v Košiciach.
Table 1. Klinická charakteristika pacientov s DM2T. 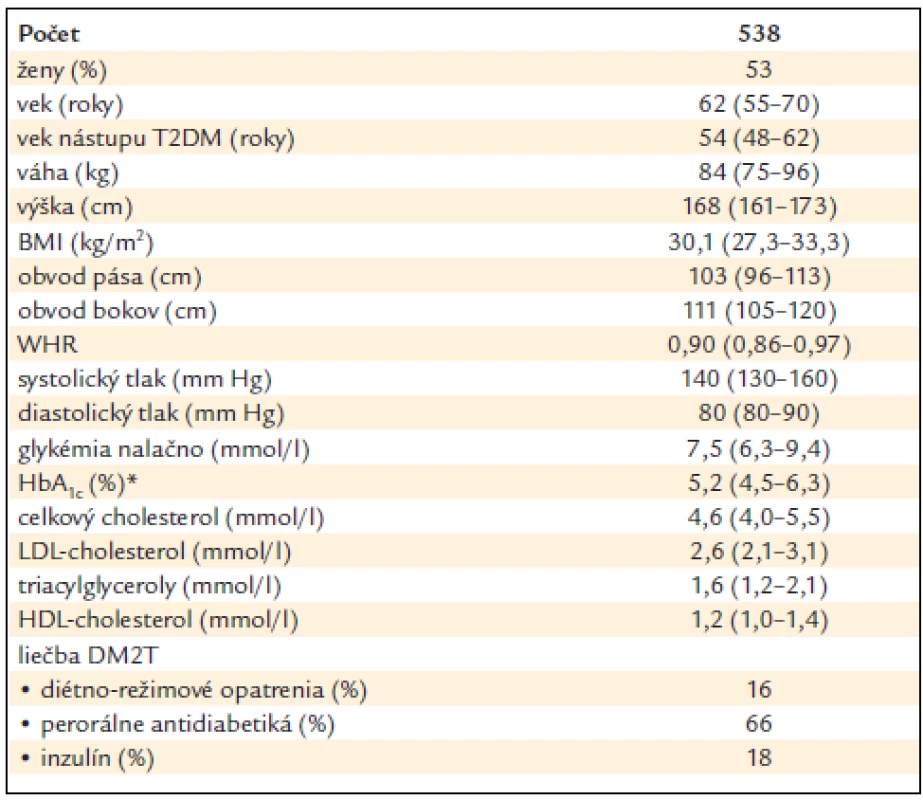
Údaje sú uvedené ako medián (25.–75. percentil) alebo v %. *HbA1c – podľa štandardu IFCC: horná hranica normy 4,2 % (zodpovedá 6,0 % podľa štandardu DCCT). Genotypizácia
Genomická DNA bola izolovaná z periférnych leukocytov použitím súpravy Wizard Genomic DNA Purification Kit (Promega, Madison, WI, USA).
Genotypizácia pri polymorfizme rs7756992 CDKAL1 bola realizovaná pomocou PCR-RFLP za použitia primerov: forward-primer: 5´-CACTTCAGCCTCCCTAGTATCTA-3´; reverse-primer: 5´-TTTAACACACAAGAATCCATAATCC-3´. Produkt PCR sa štiepil reštrikčnými endonukleázami Bgl II (New England BioLabs). Produkty štiepenia boli separované na 2% agarózovom géli, G alela bola detekovaná ako fragment dĺžky 599 bp, A alela v podobe fragmentov 463 bp a 136 bp.
Genotypizácia polymorfizmu rs163184 génu KCNQ1 bola realizovaná na prístroji LightCycler 1.5 (Roche Applied Science, Nemecko) asymetrickou polymerázovou reťazovou reakciou s neznačenou sondou v prítomnosti farbiva LC Green Plus, s následnou analýzou krivky topenia. Boli použité primery: forward-5´-CTTTGCTCTGTAACGGACTGGACCA-3´; reverse-5´-TCTGTGGAAAGGGGTTGCCATGC-3´. V reakcii bola aj neznačená sonda blokovaná na 3´ konci fosfátom prekrývajúca polymorfné miesto: 5´-TATGGAGTTTGGAGTAAAGAGAGA[Phos]3´. Heterozygoti boli rozpoznávaní na základe odlišného tvaru krivky topenia a rôzne typy homozygotov na základe odlišnej teploty topenia (Tm), pričom genotyp GG mal nižšiu teplotu topenia ako genotyp TT.
Štatistická analýza
Pri analýze štatistickej sily štúdie sme vychádzali z očakávaného rozdielu 3 rokov vo veku diagnózy diabetu medzi nosičmi rizikových alel sledovaných génov. Na dosiahnutie štatistickej sily nad 80 % pri tomto rozdiele bolo potrebné zaradenie 500 pacientov do štúdie. Vzhľadom na fakt, že sme vykonali analýzu 2 génov, sme po Bonferroniho korekcii definovali požadovanú štatistickú významnosť na hladine p < 0,025. Hardyho-Weinbergovu rovnováhu sme testovali pomocou χ2-testu. Porovnanie priemerného veku nástupu diabetu pri jednotlivých polymorfizmoch bolo vykonané za použitia analýzy rozptylu (ANOVA) alebo nepárového t-testu. Na výpočty boli použité programy SPSS v.15 (SPSS, Chicago, IL, USA) a SNPstats [18].
Výsledky
Frekvencie jednotlivých genotypov sledovaných polymorfizmov génov CDKAL1 a KCNQ1 boli v Hardy-Weinbergovej rovnováhe. Frekvencia rizikovej alely G polymorfizmu rs7756992 CDKAL1 bola 31 %, kým pri polymorfizme rs163184 KCNQ1 bola frekvencia rizikovej alely G 51 % (tab. 2).
Table 2. Frekvencie genotypov a rizikových alel pri polymorfi zmoch génov CDKAL1 a KCNQ1 u pacientov s DM2T. 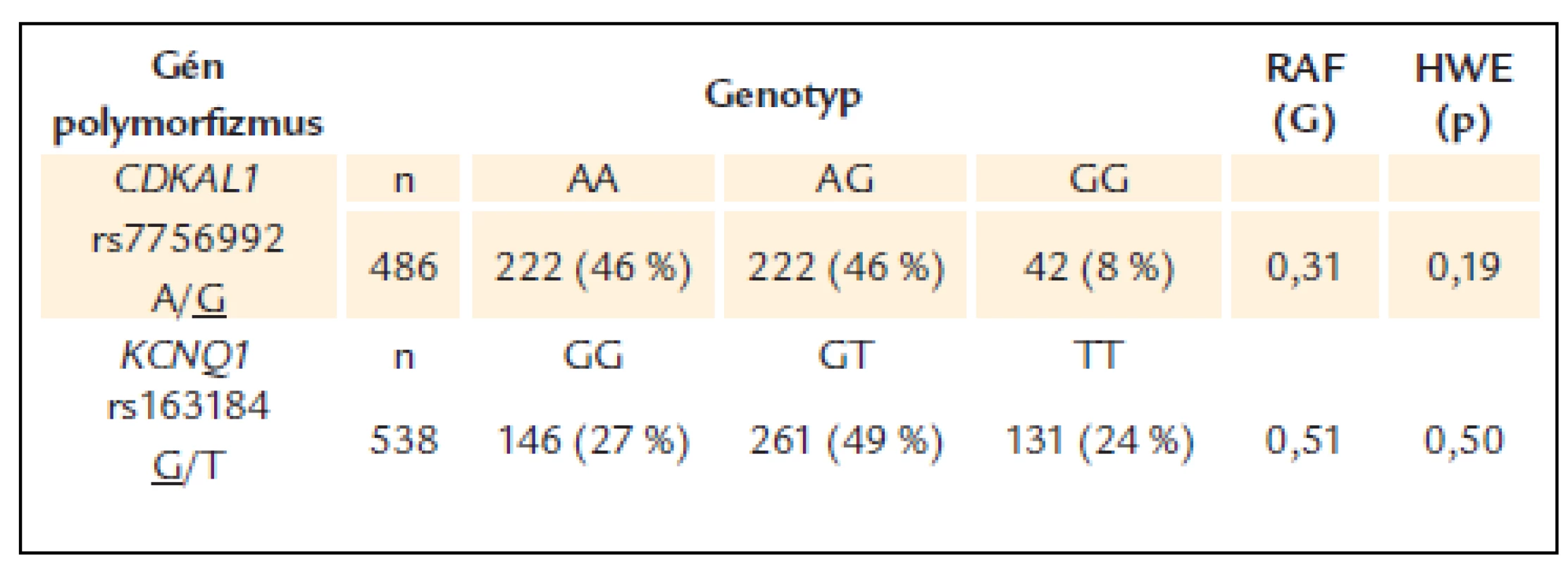
Podčiarknutá alela je riziková v asociácii s DM2T, RAF – frekvencia rizikovej alely, HWE – Hardy-Weinbergova rovnováha Pri oboch polymorfizmoch nebol zistený vplyv rizikovej alely na včasnejší vek diagnózy DM2T v žiadnom z testovených genetických modelov – aditívnom, dominantnom ani recesívnom.
Pri polymorfizme rs163184 génu KCNQ1 bol v recesívnom modeli u rizikových homozygotov (GG) pozorovaný v rozpore s predpokladom o 2 roky vyšší priemerný vek nástupu DM2T ako u nosičov alely T (GT + TT), ale tento rozdiel nedosiahol preddefinovanú hladinu štatistickej významnosti. Podobne aj pri polymorfizme génu CDKAL1 nedosahovali rozdiely v priemernom veku nástupu DM2T medzi jednotlivými genotypovými skupinami štatistickú významnosť v žiadnom z testovaných genetických modelov (tab. 3).
Table 3. Vek diagnózy DM2T v jednotlivých genotypových skupinách sledovaných polymorfi zmov. 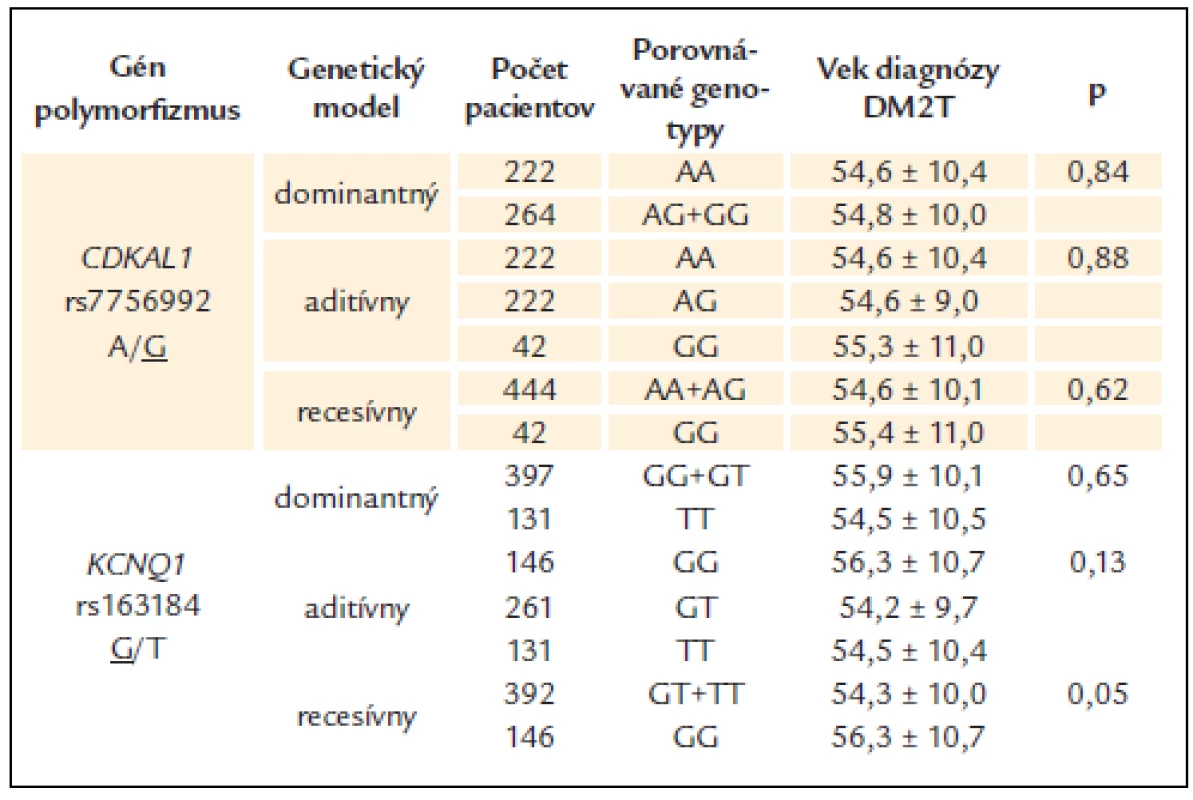
Podčiarknutá alela je riziková. Údaje sú uvedené ako priemer ± štandardná odchýlka. Diskusia
V tejto štúdii sme nezistili signifikantnú asociáciu rizikových alel polymorfizmov génov KCNQ1 a CDKAL1 s včasnejším vekom diagnózy DM2T v populácii Slovenska.
Polymorfizmus rs163184 génu KCNQ1 bol podľa dostupnej literatúry sledovaný len v japonskej populácii, v ktorej bola frekvencia rizikovej alely 58 %, čo bolo spojené so zvýšením rizika rozvoja DM2T o 33 % [11]. Frekvencia rizikovej alely v našej vzorke pacientov s DM2T (51 %) bola o trochu nižšia ako frekvencia v japonskej populácii.
Riziková alela polymorfizmu rs756992 génu CDKAL1 bola asociovaná so zvýšeným rizikom rozvoja DM2T v kaukazskej populácii o 20 % [6], kým v ázijskej populácii o 25–38 % [3,4]. V kaukazskej populácii bola táto alela zastúpená v 25 % a v ázijskej populácii dosahovala jej frekvencia 42–50 % [3,4,6]. Zastúpenie rizikovej alely polymorfizmu rs756992 v našej populácii (31 %) je podobné frekvencii rizikovej alely referovanej v kaukazskej populácii.
Z doteraz identifikovaných génov bol v predchádzajúcich štúdiách pozorovaný signifikantný efekt génu TCF7L2 na nižší vek nástupu DM2T [14–16]. Vo francúzskej populácii mali rizikoví homozygoti TT v priemere o 2,4 roka skorší nástup DM2T v porovnaní s nerizikovými homozygotmi CC [14]. Podobne v štúdii GoDARTs, vykonanej na škótskej populácii, bol zistený signifikantný rozdiel medzi homozygotmi TT a CC génu TCF7L2 vo veku diagnózy DM2T, ktorý predstavoval v priemere 1,4 roka [16].
Vysvetlenie chýbania efektu sledovaných polymorfizmov na včasnejší vek nástupu DM2T môže súvisieť so slabšou asociáciou týchto génov s DM2T ako pri géne TCF7L2, ktorý má zo všetkých doteraz identifikovaných kandidátskych génov najtesnejšiu asociáciu s DM2T, keď riziko per alellam pri polymorfizme rs7901346 bolo v celogenómových asociačných štúdiách zvýšené skoro o 40 % [19].
Obmedzením tejto štúdie môže byť jej nedostatočná štatistická sila vyplývajúca z faktu, že pozorované rozdiely v priemerných hodnotách veku diagnózy DM2T boli nižšie ako očakávané rozdiely. Keďže gény CDKAL1 a KCNQ1 majú výraznejší vplyv na rozvoj DM2T v ázijskej populácii ako v kaukazskej (vyššia frekvencia rizikovej alely, vyššie riziko per allelam), na dôkaz asociácií v našej populácii môžu byť potrebné vyššie počty sledovaných subjektov. Ďalšiu limitáciu by mohla predstavovať skutočnosť, že vek diagnózy DM2T sa nemusel vždy zhodovať s vekom nástupu ochorenia. Vplyv tejto chyby však bol pravdepodobne rovnaký vo všetkých genotypových skupinách.
Záver
V súhrne možno konštatovať, že v prezentovanej štúdii nebol pozorovaný vzťah medzi polymorfizmami génov CDKAL1 a KCNQ1 a skorším vekom nástupu DM2T v populácii Slovenska.
Táto publikácia bola vytvorená za podpory grantu VEGA 1/0380/10 (50 %) a realizáciou projektu „Centrum excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA)“ na základe Operačného programu výskum a vývoj financovaného z Európskeho fondu regionálneho rozvoja (50 %).
prof. MUDr. Ivan Tkáč, PhD.
www.fnlp.sk
e-mail: ivantkac@lf.upjs.skDoručeno do redakce: 15. 4. 2010
Přijato po recenzi: 23. 11. 2010
Sources
1. Ubeda M, Rukstalis JM, Habener JF. Inhibition of cyclin-dependent kinase 5 activity protects pancreatic beta cells from glucotoxicity. J Biol Chem 2006; 281 : 28858–28864.
2. Ridderstråle M, Groop L. Genetic dissection of type 2 diabetes. Mol Cell Endocrinol 2009; 297 : 10–17.
3. Tabara Y, Osawa H, Kawamoto R et al. Replication study of candidate genes associated with type 2 diabetes based on genome-wide screening. Diabetes 2009; 58 : 493–498.
4. Wu Y, Li H, Loos RJ et al. Common variants in CDKAL1, CDKN2A/B, IGF2BP2, SLC30A8, and HHEX/IDE genes are associated with type 2 diabetes and impaired fasting glucose in a Chinese Han population. Diabetes 2008; 57 : 2834–2842.
5. Horikoshi M, Hara K, Ito C et al. Variations in the HHEX gene are associated with increased risk of type 2 diabetes in the Japanese population. Diabetologia 2007; 50 : 2461–2466.
6. Steinthorsdottir V, Thorleifsson G, Reynisdottir I et al. A variant in CDKAL1 influences insulin response and risk of type 2 diabetes. Nat Genet 2007; 39 : 770–775.
7. Kirchhoff K, Machicao F, Haupt A et al. Polymorphisms in TCF7L2, CDKAL1 and SLC30A8 genes are associated with impaired proinsulin conversion. Diabetologia 2008; 51 : 597–601.
8. Stančáková A, Kuulasmaa T, Paananen J et al. Association of 18 confirmed susceptibility loci for type 2 diabetes with indices of insulin release, proinsulin conversion, and insulin sensitivity in 5327 non-diabetic Finnish men. Diabetes 2009; 58 : 2129–2136.
9. Unoki H, Takahashi A, Kawaguchi T et al. SNPs in KCNQ1 are associated with susceptibility to type 2 diabetes in East Asian and European populations. Nat Genet 2008; 40 : 1098–1102.
10. Ullrich S, Su J, Ranta F et al. Effects of I( Ks) channels inhibitors in insulin-secreting INS-1 cells. Pflugers Arch 2005; 451 : 428–436.
11. Yasuda K, Miyake K, Horikawa Y et al. Variants in KCNQ1 are associated with susceptibility to type 2 diabetes mellitus. Nat Genet 2008; 40 : 1092–1097.
12. Lee Y, Kang ES, Kim SH et al. Association between polymorphisms in SLC30A8, HHEX, CDKN2A/B, IGF2BP2, FTO, WFS1, CDKAL1, KCNQ1 and type 2 diabetes in the Korean population. J Hum Genet 2008; 53 : 991–998.
13. Müssig K, Staiger H, Machicao F et al. Association of type 2 diabetes candidate polymorphisms in KCNQ1 with incretin and insulin secretion. Diabetes 2009; 58 : 1715–1720.
14. Cauchi S, Meyre D, Dina C et al. Transcription factor TCF7L2 genetics study in the French population: expression in human beta-cells and adipose tissue and strong association with type 2 diabetes. Diabetes 2006; 55 : 2903–2908.
15. Lehman DM, Hunt KJ, Leach RJ et al. Haplotypes of transcription factor 7-like 2 (TCF7L2) gene and its upstream region are associated with type 2 diabetes and age of onset in Mexican Americans. Diabetes 2007; 56 : 389–393.
16. Kimber CH, Doney AS, Pearson ER et al. TCF7L2 in the Go-DARTS study: evidence for a gene dose effect on both diabetes susceptibility and control of glucose levels. Diabetologia 2007; 50 : 1186–1191.
17. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20 : 1183–1197.
18. Solé X, Guinó E, Valls J et al. SNPStats: a web tool for the analysis of association studies. Bioinformatics 2006; 22 : 1928–1929.
19. Tong Y, Lin Y, Zhang Y et al. Association between TCF7L2 gene polymorphisms and susceptibility to type 2 diabetes mellitus: a large Human Genome Epidemiology (HuGE) review and meta-analysis. BMC Med Genet 2009; 10 : 15.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 2-
All articles in this issue
- Endokarditidy 2007: Výsledky multicentrické studie o výskytu a vlastnostech infekční endokarditidy
- Chronická tromboembolická plicní hypertenze – editorial
- Výskyt infekční endokarditidy a některé problémy její diagnostiky – editorial
- Genetická determinace věku diagnózy diabetes mellitus 2. typu? Revidovaná koncepce „střádavého genotypu“ – editorial
- Pankreatický karcinom – vztah k diabetes mellitus a kouření – editorial
- Význam a možnosti screeningu v diagnostice celiakie – editorial
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – editorial
- Chronická tromboembolická pľúcna hypertenzia v spádovej nemocnici
- Vzťah polymorfizmov génov CDKAL1 a KCNQ1 k veku diagnózy diabetu 2. typu v populácii Slovenska
- Pankreatický karcinom – vztah k diabetes mellitus a kouření
- Alkoholová kardiomyopatia – diagnóza stále aktuálna
- Hodnotenie kvality života a funkčného stavu u pacientov s reumatoidnou artritídou
- Bikuspidální aortální chlopeň – etiopatogeneze a přirozený vývoj
- Význam a možnosti skríningu v diagnostike celiakie
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP
- Selhání ledvin u pacientky s chronickou B-lymfocytární leukemií (B-CLL) vzniklé na podkladě tvorby odlitkových válců v tubulech ledvin z monoklonálních volných lehkých řetězců (cast nephropathy). Přínos stanovení volných lehkých řetězců imunoglobulinů pro
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bikuspidální aortální chlopeň – etiopatogeneze a přirozený vývoj
- Alkoholová kardiomyopatia – diagnóza stále aktuálna
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP
- Hodnotenie kvality života a funkčného stavu u pacientov s reumatoidnou artritídou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

