-
Medical journals
- Career
Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
Authors: R. Široká; R. Cibulka; D. Rajdl; J. Racek
Authors‘ workplace: Ústav klinické biochemie a hematologie Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Jaroslav Racek, DrSc.
Published in: Vnitř Lék 2006; 52(3): 249-255
Category: Review
Overview
K nejvýznamnějším poznatkům minulých deseti let patří pochopení úlohy oxidu dusnatého (NO), signální molekuly uvolňované z buněk endotelu, na cévní systém: snižuje tonus cévní stěny, brání adhezi buněk k cévní stěně, působí proti aktivaci trombocytů a brání rozvoji aterosklerózy. Snížená biologická dostupnost NO je považována za jeden z patogenetických faktorů při vzniku kardiovaskulárních onemocnění. Asymetrický dimetylarginin (ADMA) je endogenní inhibitor syntázy oxidu dusnatého, enzymu katalyzujícího vznik NO z argininu. Tento článek předkládá stručný pohled na současný stav problematiky vztahu mezi ADMA a kardiovaskulárním onemocněním. Zvýšená hladina ADMA je spojena se sníženou produkcí NO způsobující vazokonstrikci. V několika prospektivních studiích byl ADMA prokázán jako marker kardiovaskulárního rizika. V prvých kapitolách je popsán dosavadní výzkum biosyntézy, degradace a vylučování ADMA ve vztahu k endotelové dysfunkci, koronárnímu onemocnění srdce, kardiovaskulárnímu riziku u hemodialyzovaných, k diabetes mellitus, hypertenzi, poruchám lipidového metabolizmu a prognóze nemocných v intenzivní péči. Další kapitoly stručně popisují metody detekce ADMA a frekvenci jejich využití. V závěru je diskutován klinický význam stanovení ADMA jako markeru endotelové dysfunkce. Budoucnost výzkumu úlohy ADMA zřejmě směřuje k prospektivním studiím různých skupin pacientů, jakož i běžné populace s výhledem na možnost farmakologického ovlivnění vysokých hladin ADMA.
Klíčová slova:
endotelová dysfunkce - oxid dusnatý - asymetrický dimetylarginin - prognóza - kardiovaskulární onemocněníÚvod
Přítomností tradičních rizikových faktorů, jako je hypercholesterolemie, hypertenze, kouření a diabetes mellitus, se dá vysvětlit asi 80 % případů koronárních onemocnění. Přestože u zbývající části pacientů s koronárním onemocněním tyto rizikové faktory chybí, dochází k progresi choroby. V průběhu několika posledních let byly objeveny a popsány nové rizikové faktory aterosklerózy a vysvětleno jejich působení na molekulární úrovni. Jedním z míst, kde dochází k funkčním změnám, vedoucím později k rozvoji k aterosklerotického procesu, jsou buňky endotelu. Poškození endotelu je jedním z několika intenzivně zkoumaných parametrů předpovídajících riziko rozvoje aterosklerózy. Většina nových studií udává, že důležité prognostické informace o kardiovaskulárních komplikacích lze zjistit sledováním některých parametrů v periferním krevním oběhu. Jedním z nich je i oxid dusnatý, resp. jeho radikál (·NO), který vzniká dvoustupňovou reakcí z L-argininu působením syntázy oxidu dusnatého (NO-synthasy, NOS), ale i bez jejího vlivu, a to působením superoxidu. Tyto reakce umožňují vznik NO i ve tkáních neobsahujících NOS. NO způsobuje vazodilataci a je klíčovým inhibitorem adheze a agregace trombocytů. Navíc tato molekula snižuje produkci superoxidového radikálu v cévách a působí jako inhibitor oxidace lipoproteinů o nízké hustotě (LDL). Inhibicí produkce tkáňového faktoru v monocytech brzdí NO iniciaci koagulační kaskády. Hojivé pochody a remodelace cévní stěny jsou rovněž kontrolovány NO. Vzhledem k významnému vlivu NO na cévní stěnu je jeho mezinárodní název „endogenous anti-atherosclerotic molecule“ více než výstižný.
ADMA - endogenní inhibitor NOS
Oxid dusnatý resp. jeho radikál (·NO) způsobuje vazodilataci a je klíčovým inhibitorem adheze a agregace trombocytů [1]. Syntéza NO je selektivně inhibována kompetitivní blokádou aktivního centra NOS dvěma deriváty L-argininu: NG-monometyl-L-argininem (L-NMMA) a NG,NG-dimetyl-L-argininem (asymetrický dimetylarginin - ADMA). Koncentrace ADMA v krvi je desetkrát vyšší než koncentrace druhého derivátu (L-NMMA) a tím je určena i jeho role hlavního inhibitoru NOS [2,3]. Valace et al byli první, kdo popsali ADMA jako hlavní endogenní inhibitor NOS v plazmě, ačkoli ještě neznali způsob interference metylargininů se signální transdukční cestou. Na rozdíl od ADMA, symetrický dimetylarginin (SDMA) nezpůsobuje inhibici NOS.
Data z experimentálních studií potvrzují patologickou koncentraci ADMA v rozmezí 3-15 µmol/l, kdy prokazatelně dochází k inhibici produkce NO endotelem [4-7]. Faraci et al [6] určili hodnotu 1,8 ± 0,1 µmol/l jako IC50 pro inhibici syntázy NO molekulou ADMA v homogenátu krysích mozečků (IC50 je taková koncentrace inhibitoru, která působí pokles aktivity příslušného enzymu, v našem případě NOS, na polovinu). U experimentů in vitro (aortální buňky endotelu hovězího dobytka) bylo nedávno prokázáno, že vysoká koncentrace ADMA (IC50 = 3,9 µmol/l) inhibuje aktivitu jak endotelové tak neuronální NOS [24].
NOS je dimer složený ze dvou domén, oxidující a redukující. Za ideálních katalytických podmínek (je přítomen substrát L-arginin a kofaktory: tetrahydrobiopterin, kalmodulin, NADPH, flavinmononukleotid - FMN a flavinadenindinukleotid - FAD v optimální koncentraci) probíhá transfer elektronu z molekuly kyslíku přes kaskádu kofaktorů až k L-argininu. Produkty této reakce jsou NO a L-citrulin. Pokud dojde k porušení optimálních podmínek (deficit L-argininu, převaha LDL cholesterolu, přítomnost ADMA), cyklus přenosu elektronu je přerušen a dochází ke vzniku superoxidového radikálu (O2·-) jako důsledek přijetí elektronu molekulou kyslíku [8-10].
Biosyntéza, metabolizmus a vylučování ADMA
Biochemické cesty přeměny asymetrického dimetylargininu a jeho odbourávání jsou znázorněny na obr. 1. Působením enzymu proteinmetyltransferázy (PRMT) I a II dochází k metylaci zbytků argininu v molekulách proteinů. Při jejich degradaci vznikají dva stereoizomery, ADMA a SDMA. Lidské endotelové buňky jsou schopny syntetizovat ADMA i SDMA [11-15]. ADMA zde za určitých podmínek, např. za přítomnosti oxidovaných LDL, figuruje jako autokrinní regulátor aktivity entotelové NOS. Ito et al [16] prokázali, že po inkubaci oxidovaných LDL a TNF-α (tumor necrosis factor) s buňkami endotelu dochází na rozdíl od kontrolní skupiny ke zvýšení hodnot ADMA. Hladina dimetylargininů v cytoplazmě (nikoliv v extracelulárním prostoru) byla též zvýšena. Bogle et al [17] demonstrovali kompetitivní inhibici ADMA na vazebném místu pro L-arginin. Stejné výsledky popsali Azuma et al [14] u balónové angioplastiky. Prokázali, že regenerovaný endotel produkuje více ADMA než kontrolní buňky.
Image 1. Biosyntéza a metabolizmus ADMA. 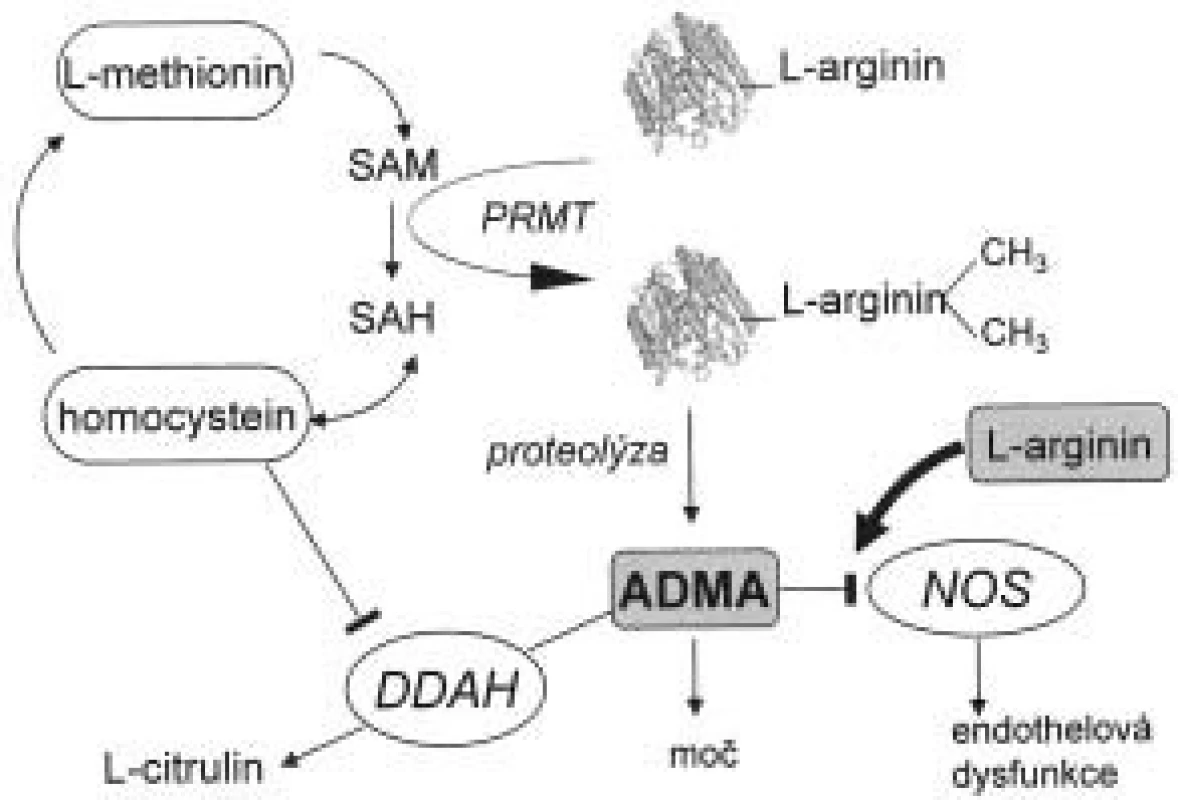
Zkratky vysvětleny v textu. Jak ADMA, tak SDMA jsou eliminovány renální exkrecí. Je známo, že pacienti v terminální fázi renálního onemocnění (end stage renal disease - ESRD) mají hodnoty ADMA v plazmě až 5krát vyšší než zdravé kontroly. Velké skupiny pacientů s renálním selháním byla sledována jak v Evropě, tak v USA. Výsledky těchto prací shrnul Kielstein et al [18], a ačkoli se absolutní hodnoty koncentrací ADMA liší v závislosti na použité metodě měření, je z této práce patrné zvýšení ADMA i SDMA řádově 2krát až 10krát vůči zdravým kontrolám. U hemodialyzovaných pacientů lze nalézt vysokou hladinu jak ADMA tak SDMA na rozdíl od pacientů léčených peritoneální dialýzou, kde je zvýšen pouze SDMA a nikoli ADMA [19,20]. Lze tedy konstatovat, že eliminace SDMA probíhá pouze ledvinami, na rozdíl od ADMA, kde bylo nutné hledat další metabolickou dráhu pro jeho odbourání. Gross et al nalezli vztah koncentrace ADMA k vazodilataci závislé na endotelu, kdy při peritoneální dialýze hodnoty ADMA byly zvýšeny, nedocházelo k vazodilataci endotelu na rozdíl od hemodialyzovaných po hemodialýze s nízkou hodnotou ADMA, kde vazodilatace byla prokázána [21].
Metabolizmus ADMA, ale nikoli SDMA, probíhá hydrolytickou degradací na citrulin a dimetylamin pomocí enzymu dimetylarginin-diaminohydrolázy (DDAH) [22].
Inhibice DDAH způsobuje vazokonstrikci, která je reverzibilní za přítomnosti L-argininu [15]. Jsou známy dvě izoformy DDAH: DDAH-1 a DDAH-2. První z nich lze nalézt v tkáni syntetizující neuronální NOS a druhou v tkáních zodpovědných za syntézu endotelové NOS [23]. Aktivita tohoto enzymu je závislá na komplexu regulačních mechanizmů, které ještě nejsou zcela detailně popsány. Bylo prokázáno, že oxidační stres indukovaný oxidovanými LDL nebo TNF-α snižuje aktivitu DDAH, ale nikoli expresi jejího proteinu v buňkách endotelu in vitro [16]. Aktivita DDAH je blokována zvýšenou koncentrací homocysteinu (Hcy) v buňce jednak pomocí redox přenašečů a zároveň přímou interferencí Hcy se samotnou DDAH. Oba mechanizmy vedou ke zvýšení koncentrace ADMA [24]. Dále je DDAH inaktivována S-nitrosylací [25], což vede k předpokladu zpětné regulace hladiny ADMA při zvýšené hladině NO. Exprese genu DDAH je indukována tzv. all-trans retinovou kyselinou [26]. Závěrem lze tedy konstatovat, že ADMA je produkován zcela běžně v důsledku přeměny proteinů a k jejímu hromadění dochází zejména v závislosti na aktivitě DDAH.
ADMA u jednotlivých klinických stavů
Endotelová dysfunkce je někdy považována za časné stadium aterosklerózy. Dochází ke snížené syntéze oxidu dusnatého (NO) v cévní stěně (hlavní vazodilatační látka) a naopak ke zvýšené produkci látek s vazokonstričními účinky (endotelin-1, tromboxan A2, prostaglandin H2 aj.). Přehled onemocnění souvisejících se zvýšenou hladinou ADMA udává tab. 1.
Table 1. Onemocnění zvyšující koncentraci ADMA v plazmě/séru (vzhledem ke zdravým kontrolám). 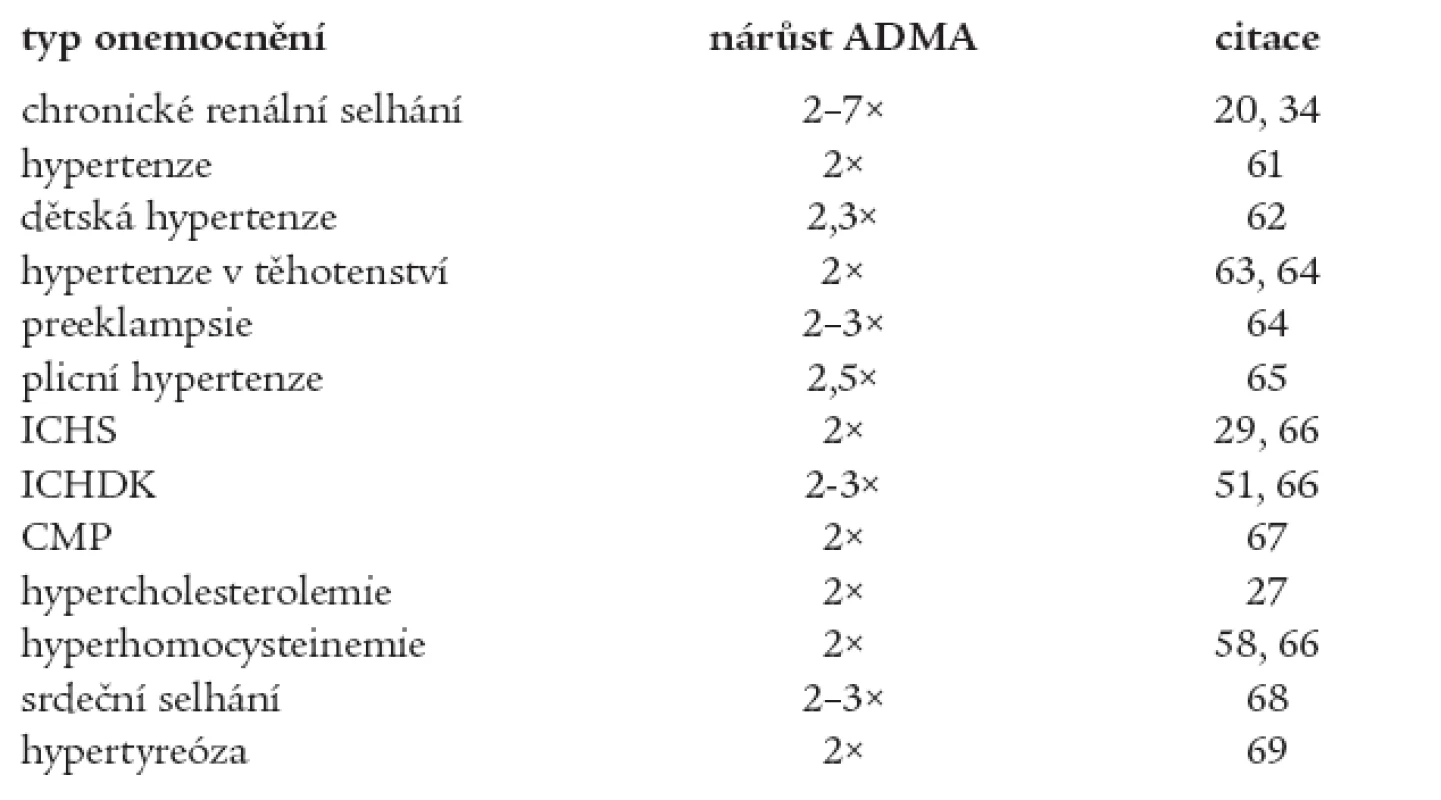
ADMA a kardiovaskulární onemocnění
Zvýšená hodnota ADMA v lidské plazmě u nemocných s hypercholesterolemií s aterosklerózou byla prokázána již v roce 1998. Koncentrace ADMA (u zdravých jedinců 1,0 µmol/l) dosáhla hodnoty 2,2 µmol/l u mladých, klinicky asymptomatických jedinců s hypercholesterolemií [27]. U starších pacientů s onemocněním periferních arterií a generalizovanou aterosklerózou byly změřeny hladiny ADMA od 2,5 do 3,5 µmol/l; jejich výše odpovídala stadiu poškození cévního systému [28]. Multicentrická studie CARDIAC, provedená v Německu a zahrnující 400 pacientů s koronárním onemocněním srdce (CAD) a více než 400 zdravých jedinců, potvrdila signifikantně zvýšené hodnoty ADMA u pacientů s CAD na rozdíl od věkem a pohlavím srovnatelných zdravých jedinců [29].
Pacienti s chronickou srdeční nedostatečností mají vyšší koncentraci ADMA než zdraví jedinci [34]. Echokardiografické parametry ukazující funkci levé srdeční komory u 198 pacientů s ESRD jevily významný vztah k hladině ADMA: pozitivní byla korelace mezi koncentrací ADMA a tloušťkou stěny levé komory myokardu, významný inverzní vztah byl nalezen mezi ADMA a hodnotou ejekční frakce [35]. Další z poznatků souvisejících se zvýšenou hladinou ADMA je inverzní vztah mezi ADMA a maximální spotřebou kyslíku během fyzické zátěže [34].
ADMA u hemodialyzovaných pacientů
Pacienti s chronickou renální insuficiencí byli první skupinou s vysokou hladinou ADMA, získané výsledky byly publikovány a potvrzeny mnoha dalšími studiemi [30,31,32]. Zvýšení hladiny ADMA u hemodialyzovaných pacientů je částečně způsobeno zhoršenou eliminací ADMA během dialýzy [20]. Takto chronicky zvýšená hladina ADMA může částečně souviset s vysokým výskytem kardiovaskulární morbidity a mortality u pacientů s chronickou renální insuficiencí [30]. Vzhledem k výše uvedeným výsledkům byla provedena prognostická studie s 224 hemodialyzovanými pacienty: pacienti s hodnotou ADMA v nejvyšším kvartilu vykazovali nejvyšší celkovou úmrtnost a nejvíce kardiovaskulárních příhod během dalších tří let, kdy byli sledováni (graf 1). Např. celková úmrtnost pacientů během 33 měsíců sledování byla o 72 % vyšší u pacientů s hodnotou ADMA nad mediánem (2,52 µmol/l) ve srovnání s těmi, jejichž koncentrace ADMA byla nižší než medián [33]. Přestože je díky omezené glomerulární filtraci vysoká hladina ADMA u hemodialyzovaných obvyklá, lze tyto nemocné podle koncentrace ADMA rozdělit na skupiny s vysokým a nízkým rizikem.
Graph 1. Graf přežití u hemodialyzovaných pacientů (pravděpodobnost úmrtí z kardiovaskulárních příčin) vzhledem k výchozím hodnotám koncentrace ADMA. 
Zkratky vysvětleny v textu. ADMA a diabetes mellitus
ADMA může též hrát důležitou roli jako ukazatel rizika kardiovaskulárních komplikací u diabetických pacientů. V sérii studií různých autorů je popsána zvýšená hladina ADMA u diabetiků 2. typu [36-38]. Molekulární mechanizmus zvýšení ADMA v plazmě u diabetiků lze objasnit například oxidačním stresem, který porušuje aktivací PRMT rovnováhu mezi tvorbou ADMA a jeho odbouráváním účinkem DDAH [41] nebo mechanizmem závislým na angiotenzimu II [40].
ADMA a metabolizmus lipidů
Existuje zřejmě vztah mezi přítomností tradičních rizikových faktorů aterosklerózy (dyslipidemie) a endotelovou dysfunkcí. Jedním z mechanizmů, spojujících poruchy lipidového metabolizmu s endotelem, je aminokyselina ADMA. Ta působí jako inhibitor základního enzymu, potřebného pro tvorbu oxidu dusnatého - NOS. Bylo například zjištěno, že u zdravých osob s hypercholesterolemií dochází asi k dvojnásobnému zvýšení koncentrace ADMA ve srovnání s osobami s normální hladinou cholesterolu. Jednalo se o mladé jedince bez klinické manifestace aterosklerózy. Zvýšení koncentrace ADMA bylo navíc doprovázeno zhoršenou schopností vazodilatace a sníženou hladinou metabolitů NO v moči [27]. Podobné změny byly pozorovány i v některých pokusech na zvířecích modelech [41]. Dále bylo prokázáno, že rovněž hypertriacylglycerolemie, další významný rizikový faktor aterogeneze, je asociována se zvýšenou koncentrací ADMA [31]. Patofyziologie zvýšené koncentrace ADMA u poruch lipidového metabolizmu je však zatím neznámá [42] a lze pouze předpokládat vliv léčby fibráty na zvýšení hladiny Hcy, a tím nepřímo i na ADMA.
Intenzivní péče
V holandské studii s 52 pacienty léčenými na jednotkách intenzivní péče byl ADMA při použití mnohorozměrné analýzy jedním ze silných prediktorů přežití [43]. Pacienti s hodnotou ADMA v nejvyšším kvartilu byli 17krát více ohroženi rizikem selhání životních funkcí. Také bylo prokázáno, že hladina ADMA v plazmě je kontrolována z velké části funkcí ledvin a jater [43,44]. Některé studie hovoří v této souvislosti o zvýšení ADMA u pacientů se selháním jaterních funkcí [45].
Metody detekce ADMA
První metoda měření ADMA byla založena na vysokorozlišovací kapalinové chromatografii (HPLC). Tato metoda umožňuje kvantitativně rozdělit dva velmi podobné stereoizomery, ADMA a SDMA (symetrický dimetylarginin). Metoda je založena na separaci vzorku pomocí chromatografie na reverzní fázi na koloně C18 izokratickým způsobem. Po preanalytické fázi (deproteinace a následná derivatizace všech homologů L-argininu) následuje nástřik na kolonu a fluorescenční detekce [46,47].
V současné době je tato metoda nahrazována jinou, časově i finančně méně náročnou enzymatickou imunoanalýzou (enzyme-linked immunosorbent assay - ELISA). Tato nová metoda využívá vysoké specifity polyklonálních protilátek (kompetitivní princip, odlišení dvou stereoizomerů ADMA a SDMA se děje acylací) a byla srovnána s metodami kapalinové (LC-MS, Liquid Chromatography-Mass Spectrometry) a plynové chromatografie (GC-MS, Gas Chromatography-Mass Spectrometry). Výsledkem byla dobrá korelace těchto dvou metod, daná korelačním koeficientem r = 0,424 [48].
Klinický význam stanovení ADMA
Výsledky výše zmíněných studií naznačují, že by zvýšená koncentrace ADMA mohla sloužit jako marker endotelové dysfunkce a časných stadií aterogeneze. Její monitorování by tedy mohlo být prospěšné zejména v primární prevenci těchto poruch. Skutečnost, že významné zvýšení rizika bylo zjištěno pouze u pacientů s hodnotou ADMA v nejvyšším kvartilu, ukazuje, že existuje nějaká „kritická koncentrace“ ADMA v plazmě, která je důležitá při uplatnění jeho patologického vlivu.
S rostoucími poznatky o metabolizmu ADMA lze dále diskutovat možná terapeutická řešení, z nichž nejjednodušší se jeví suplementace L-argininem. Schopnost exogenního L-argininu zlepšovat funkci a strukturu cév byla prověřena několika experimentálními a klinickými studiemi. Tyto studie prokázaly, že L-arginin zlepšuje funkci endotelu a zároveň redukuje klinické symptomy prodělaných kardiovaskulárních onemocnění [49-53]. Mechanizmus působení je jasný - přirozený substrát L-arginin vytěsňuje s aktivního centra NOS kompetitivní inhibitor tohoto enzymu, ADMA. Některé prameny rovněž uvádějí snížení hladiny ADMA v důsledku podávání ACE inhibitorů nebo blokátorů angiotenzinových receptorů [54] a pod vlivem substituce folátem [55]. Další možností snížení koncentrace ADMA představuje podání statinů [56,57], i když naopak Jing et al ve své studii popírají vliv simvastatinu na aktivitu DDAH či snížení koncentrace ADMA [58]. Další možností je ovlivnění oxidačního stresu podáváním antioxidantů - superoxid totiž zvyšuje aktivitu metylačních enzymů a tedy následně i produkci ADMA [59]. Zdá se, že pomůže i snížení hmotnosti - u morbidně obézních pacientek (BMI = 49) byla plazmatická koncentrace ADMA vyšší než u kontrol (BMI < 25) a při poklesu hmotnosti na BMI 34 koncentrace ADMA signifikantně klesla [60].
Závěr
Objev a popsání metabolizmu ADMA a dalších metabolitů z cyklu homocysteinu představuje další pokrok v prevenci a léčbě onemocnění souvisejících s oxidačním stresem. Na základě dnešních poznatků se zdá, že ADMA je významným prediktorem rozvoje aterosklerózy a onemocnění endotelu (endotelové dysfunkce). Je známo, že dosud sledované rizikové faktory nevysvětlují zcela vznik všech akutních koronárních příhod. Sledování ADMA by mohlo tuto situaci alespoň u některých pacientů zlepšit. Je nutné pokračovat v dalších multicentrických studiích s cílem detailněji popsat vliv ADMA na regeneraci endotelu a ev. i určení tzv. kritické hladiny u rizikových skupin pacientů.
Tato práce vznikla za podpory grantu GA UK 78/2005/C/LFP.
Mgr. Romana Široká
www.fnplzen.cz
e-mail: sirokar@fnplzen.cz
Doručeno do redakce: 24. 11. 2005
Přijato po recenzi: 2. 1. 2006
Sources
1. Racek J, Holeček V. Enzymy a volné radikály. Chem Listy 1999; 93 : 774-780.
2. Kielstein JT, Frölich JC, Haller H et al. ADMA: an atherosclerotic disease mediating agent in patient with renal disease? Nephrol Dial Transplant 2001; 16 : 1742-1745.
3. Miyazaki H, Matsuoka H, Cooke JP et al. Endogenous nitric oxide synthase inhibitor. A novel marker of atherosclerosis. Circulation 1999; 99 : 1141-1146.
4. Vallance A, Leone A, Calver J et al. Accumulation of an endogenous inhibitor of NO synthesis in chronic renal failure. Lancet 1992; 339 : 572-575.
5. Kurose R, Wolf MB, Grisham DN et al. Effects of an endogenous inhibitor of nitric oxide synthesis on postcapillary venules. Am J Physiol 1995; 268: H2224-H2231.
6. Faraci FM,. Brian JE, Heistad DD. Response of cerebral blood vessels to an endogenous inhibitor of nitric oxide synthase. Am J Physiol 1995; 269: H1522-H1527.
7. Segarra G, Medina P, Ballester RM et al. Effects of some guanidino compounds on human cerebral arteries. Stroke 1999; 30 : 2206-2211.
8. Klatt P, Schmidt K, Uray G et al. Multiple catalytic functions of brain nitric oxide synthase. J Biol Chem 1994; 268 : 14781-14787.
9. Vasquez-Vivar J, Kalyanaraman B, Martasek P et al. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc Natl Acad Sci USA 1998; 95 : 9220-9225.
10. Pritchard KA, Groszek L, Smalley DM et al. Native low-density lipoprotein increases endothelial nitric oxide synthase generation of superoxide anion. Circ Res 1995; 77 : 510-518.
11. Fickling SA, Leone AM, Nussey SS et al. Synthesis of NG,NG-dimethylarginine by human endothelial cells. Endothelium 1993; 1 : 137-140.
12. MacAllister RJ, Fickling SA, Whitley GSJ et al. Metabolism of methylarginines by human vasculature: implications for the regulation of nitric oxide synthesis. Br J Pharmacol 1994; 112 : 43-48.
13. Böger RH, Sydow K, Borlak J et al. Cholesterol upregulates synthesis of asymmetric dimethylarginine (ADMA) in human endothelial cells. Involvement of S-adenosylmethionine-dependent methyltransferases. Circ Res 2000; 87 : 99-105.
14. Azuma H, Sato J, Hamasaki H et al. Accumulation of endogenous inhibitors for nitric oxide synthesis and decreased content of L-arginine in regenerated endothelial cells. Br J Pharmacol 1995; 115 : 1001-1004.
15. MacAllister RJ, Parry H, Kimoto M et al. Regulation of nitric oxide synthesis by dimethylarginine dimethylaminohydrolase. Br J Pharmacol 1996; 119 : 1533-1540.
16. Ito S, Teak PS, Adimoolam S et al. Novel mechanism for endothelial dysfunction. Dysregulation of dimethylarginine dimethylaminohydrolase. Circulation 1999; 99 : 3092-3095.
17. Bogle RG, MacAllister RJ, Whitley GSJ et al. Induction of NG-monomethyl-arginine uptake: a mechanism for differential inhibition of NO synthases? Am J Physiol 1995; 269: C750-C756.
18. Kielstein JT, Bode-Böger SM, Frölich JC et al. Relationship of asymmetric dimethylarginine to dialysis treatment and atherosclerotic disease. Kidney Int 2001; 78, Suppl: S9-S13.
19. MacAllister RJ, Rambausek MH, Vallance P et al. Concentration of dimethyl-arginine in the plasma of patients with end-stage renal failure. Nephrol Dial Transplant 1996; 11 : 2449-2452.
20. Kielstein JT, Böger RH, Bode-Böger SM et al. Asymmetric dimethylarginine plasma concentrations differ in patients with end-stage renal disease: relationship to treatment method and atherosclerotic disease. J Am Soc Nephrol 1999; 10 : 594-600.
21. Gross JM, Donald AE, Vallance P et al. Dialysis improves endothelial function in humans. Nephrol Dial Transplant 2001; 16 : 823-1829.
22. Ogawa T, Kimoto M, Sasanka K. Occurrence of a new enzyme catalysing the direct conversion of NG,NG-dimethyl - arginine to-citrulline in rats. Biochem Biophys Res Commun 1987; 148 : 671-677.
23. Leiper JM, Santa Maria J, Chubb A et al. Identification of two human dimethylarginine dimethylaminohydrolases with distinct tissue distributions and homology with microbial arginine deiminases. Biochem J 1999; 343 : 209-214.
24. Stühlinger MC, Tsao PS, Her JH et al. Homocysteine impairs the nitric oxide synthase pathway. Role of asymmetric dimethylarginine. Circulation 2001; 104 : 2569-2575.
25. Leiper J, Murray-Rust J, Macdonald N et al. S-Nitrosylation of dimethylarginine dimethylaminohydrolase regulates enzyme activity: further interactions between nitric oxide synthase and dimethylarginine dimethylaminohydrolase. Proc Natl Acad Sci 2002; 99 : 13527-13532.
26. Achan V, Tran CT, Strigoni F et al. All-trans-retinoic acid increases nitric oxide synthesis by endothelial cells: a role for the induction of dimethylarginine dimethylaminohydrolase. Circ Res 2002; 90 : 764-769.
27. Böger RH, Bode-Böger SM, Szuba A et al. Asymmetric dimethylarginine: a novel risk factor for endothelial dysfunction. Its role in hypercholesterolemia. Circulation 1998; 98 : 1842-1847.
28. Böger RH, Bode-Böger SM, Thiele W et al. Biochemical evidence for impaired nitric oxide synthesis in patients with peripheral arterial occlusive disease. Circulation 1997; 95 : 2068-2074.
29. Böger RH, Lenzen H, Hanefeld C et al. Asymmetric dimethylarginine: an endogenous inhibitor of NO synthase is a predictor of the risk for coronary heart disease - Result of multicenter CARDIAC study. Circulation 2003; 108: IV-256 52.
30. Böger RH, Zoccali C. ADMA: A novel risk factor that explains excess cardiovascular event rate in patient with end-stage renal disease. Atherosclerosis Suppl 2003; 4 : 23-28.
31. Široká R, Trefil L, Rajdl D et al. Asymmetric dimethylarginine, homocysteine and renal function - is there a relation? Clin Chem Lab Med 2005, 43; 1147-1150.
32. Široká R, Trefil L, Rajdl D et al. Asymetrický dimethylarginin, homocystein a funkce ledvin. KBM 2005; in press.
33. Zoccali C, Bode-Böger SM, Mallamaci F et al. Asymmetric dimethylarginine (ADMA): an endogenous inhibitor of nitric oxide synthase predicts mortality in end-stage renal disease (ESRD). Lancet 2001; 358 : 2113-2117.
34. Hornig B, Arakawa N, Böger RH et al. Plasma levels of ADMA are increased and inversely related to endothelium-mediated vasodilatation in patients with chronic heart failure: a new predictor of endothelial dysfunction? Circulation 1998; 98(Suppl): I-318.
35. Zoccali C, Mallamaci F, Maas R et al. Left ventricular hypertrophy, cardiac remodelling and asymmetric dimethylarginine (ADMA) in hemodialysis patients. Kidney Int 2002; 62 : 339-345.
36. Abbasi F, Asagmi T, Cooke JP et al. Plasma concentrations of asymmetric dimethylarginine are increased in patients with type 2 diabetes mellitus. Am J Cardiol 2001; 88 : 1201-1203.
37. Fard A, Tuck CH, Donis JA et al. Acute elevations of plasma asymmetric dimethylarginine and impaired endothelial function in response to a high-fat meal in patients with type 2 diabetes. Arterioscler Thromb Vasc Biol 2000; 20 : 2039-2044.
38. Stühlinger M, Abbasi F, Chu et JW et al. Relationship between insulin resistance and an endogenous nitric oxide synthase inhibitor. J Am Med Assoc 2002; 287 : 420-426.
39. Lin KY, Ito A, Asagami T et al. Impaired nitric oxide synthase pathway in diabetes mellitus. Role of asymmetric dimethylarginine and dimethylarginine dimethylaminohydrolase. Circulation 2002; 106 : 987-992.
40. Ito A, Egashira K, Narishige T et al. Angiotensin-converting enzyme activity is involvedin the mechanism of increased endogenous nitric oxide synthase inhibitor in patients with type 2 diabetes mellitus. Circ J 2002; 66 : 811-815.
41. Rainer H, Böger RH. Asymmetric Dimethylarginine, an Endogenous Inhibitor of Nitric Oxide Synthase, Explains the ”L-Arginine Paradox” and Acts as a Novel Cardiovascular Risk Factor 1,2. Nitric Oxide 2004; 11 : 1-8.
42. Lundman P, Eriksson, MJ, Stühlinger M et al. Mild-to-moderate hypertriglyceridemia in young men is associated with endothelial dysfunction and increased plasma concentrations of asymmetric dimethylarginine. J Am Coll Cardiol 2001; 38 : 111-116.
43. Nijveldt RJ, Teerlink T, Van Der Hoven B et al. Asymmetrical dimethylarginine (ADMA) in critically ill patients: high plasma ADMA concentration is an independent risk factor of ICU mortality. Clin Nutr 2003; 22 : 23-30.
44. Nijveldt RJ, Teerlink T, Siroen MP et al. The liver is an important organ in the
metabolism of asymmetrical dimethylarginine (ADMA). Clin Nutr 2003; 22 : 17-22.
45. Tsikas D, Rode I, Becker T et al. Elevated plasma and urine levels of ADMA and 15(S)-8-iso-PGF2alpha in end-stage liver disease. Hepatology 2003; 38 : 1063-1064.
46. Teerlink T, Nijveldt RJ, de Jong S et al. Determination of arginine, asymmetric dimethylarginine, and symmetric dimethylarginine in human plasma and other biological samples by high-performance liquid chromatography. Anal Biochem 2002; 303 : 131-137.
47. Široká R, Racek J, Filipovský J. Asymetrický dimethylarginin (ADMA). Klin Biochem Metab 2005; 13 : 131-134.
48. Schulze F, Wesemann R, Schwedhelm E et al. Determination of asymmetric dimethylarginine (ADMA) by a novel ELISA assay. Clin Chem Lab Med 2004; 42 : 1377-1383.
49. Böger RH, Bode-Boger SM, Thiele W et al. Restoring vascular nitric oxide formation by L-arginine improves the symptoms of intermittent claudication in patients with peripheral arterial occlusive disease. J Am Coll Cardiol 1998; 32 : 1336-1344.
50. Rector TS, Bank AJ, Kuklen KA et al. Randomized, double-blind, placebo-controlled study of supplemental oral L-arginine in patients with heart failure. Circulation 1996; 93 : 2135-2141.
51. Ceremuzynksi L, Chamiec T, Herbacynska-Cedro K. Effect of supplemental oral L-arginine on exercise capacity in patients with stable angina pectoris. Am J Cardiol 1997; 80 : 331-333.
52. Maxwell AJ, Anderson BE, Cooke JP. Nutritional therapy for peripheral arterial disease: a double-blind, placebo-controlled, randomized trial of Heart Bar. Vasc Med 2000; 5 : 11-19.
53. Tousoulis D, Davies GJ, Tentolouris C et al. Effects of L-arginine on flow mediated dilatation induced by atrial pacing in diseased epicardial coronary arteries. Heart 2003; 89 : 531-534.
54. Delles C, Schneider MP, John S et al. Angiotensin converting enzyme inhibition and angiotensin II AT1-receptor blockade reduce the levels of asymmetrical N(G), N(G)-dimethylarginine in human essential hypertension. Am J Hypertens 2002;15 : 590-593.
55. Holven KB, Haugstad TS, Holm T et al. Folic acid treatment reduces elevated plasma levels of asymmetric dimethylarginine in hyperhomocysteinaemic subjects. Br J Nutr 2003; 89 : 359-363.
56. Valkonen VP, Laakso J, Paiva H et al. Asymmetrical dimethylarginine (ADMA) and risk of acute coronary events. Does statin treatment influence plasma ADMA levels?
Atheroscler Suppl 2003; 4 : 19-22.
57. Lu TM, Ding YA, Leu HB et al. Effect of rosuvastatin on plasma levels of asymmetric dimethylarginine in patients with hypercholesterolemia. Am J Cardiol 2004; 94 : 157-161.
58. Jiang JL, Jiang DJ, Tang YH et al. Effect of simvastatin on endothelium-dependent vaso-relaxation and endogenous nitric oxide synthase inhibitor. Acta Pharmacol Sin 2004; 25 : 893-901.
59. Sydow K, Munzel T. ADMA and oxidative stress. Atheroscler Suppl 2003; 4 : 41-51.
60. Krzyzanowska K, Mittermayer F, Kopp HP et al. Weight loss reduces circulating asymmetrical dimethylarginine concentrations in morbidly obese women. J Clin Endocrinol Metab 2004; 89 : 6277-6281.
61. Surdacki A, Nowicki M, Sandmann J et al. Effects of acute euglycemic hyperinsulinemia on urinary nitrite/nitrate excretion and plasma endothelin-1 levels in men with essential hypertension and normotensive controls. Metabolism 1999; 48 : 887-891.
62. Goonasekera CD, Shah V, Rees DD et al. Vascular endothelial cell activation associated with increased plasma asymmetric dimethyl arginine in children and young adults with hypertension: a basis for atheroma? Blood Press 2000; 9 : 16-21.
63. Holden DP, Fickling SA, Whitley GS et al. Plasma concentrations of asymmetric dimethylarginine, a natural inhibitor of nitric oxide synthase, in normal pregnancy and preeclampsia. Am J Obstet Gynecol 1998; 178 : 551-556.
64. Savvidou MD, Hingorani AD, Tsikas D et al. Endothelial dysfunction and raised plasma concentrations of asymmetric dimethylarginine in pregnant women who subsequently develop pre-eclampsia. Lancet 2003; 361 : 1511-1517.
65. Gorenflo M, Zheng C, Werle E et al. Plasma levels of asymmetrical dimethyl-L-arginine in patients with congenital heart disease and pulmonary hypertension. J Cardiovasc Pharmacol 2001; 37 : 489-492.
66. Sydow K, Hornig B, Arakawa N et al. Endothelial dysfunction in patients with peripheral arterial disease and chronic hyperhomocysteinemia: potential role of ADMA.Vasc Med 2004; 9 : 93-101.
67. Yoo JH, Lee SC. Elevated levels of plasma homocyst(e)ine and asymmetric dimethylarginine in elderly patients with stroke. Atherosclerosis 2001; 158 : 425-430.
68. Usui M, Matsuoka H, Miyazaki H et al. Increased endogenous nitric oxide synthase inhibitor in patients with congestive heart failure. Life Sci 1998; 62 : 2425-2430.
69. Hermenegildo C, Medina P, Peiro M et al. Plasma concentration of asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase, is elevated in hyperthyroid patients. J Clin Endocrinol Metab 2002; 87 : 5636-5640.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 3-
All articles in this issue
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Hypertenze v těhotenství
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

