-
Medical journals
- Career
Spondylodiscitida – známá a neznámá
Authors: P. Polák 1; E. Pernicová 1; P. Husa 1; Š. Bohatá 2; A. Štouračová 2
Authors‘ workplace: Klinika infekčních chorob FN a LF MU Brno Přednosta: prof. MUDr. Petr Husa, CSc. 1; Radiologická klinika FN a LF MU Brno Přednosta: prof. MUDr. Vlastimil Válek, CSc., MBA 2
Published in: Prakt. Lék. 2010; 90(9): 519-524
Category: Various Specialization
Overview
Infekční postižení meziobratlové ploténky a obratle (spondylodiscitida) je onemocnění s rizikem relativně vysoké mortality a závažných dlouhodobých komplikací. Predisponovanými osobami jsou především imobilní a imunokompromitovaní jedinci s metabolickými komplikacemi. Etiologicky rozlišujeme spondylodiscitidu
– bakteriální,
– mykotickou, a
– parazitární.
Zvláštní nozologickou jednotku představují spondylodiscitidy tuberkulózní.
Diagnostika je často obtížná – většinou je třeba kombinovat více vyšetřovacích metod. Největší senzitivitu a specificitu v diagnostice spondylodiscitid vykazuje magnetická rezonance (MRI). Terapie spondylodiscitid musí zohledňovat specifika farmakokinetiky antibiotik do kostní tkáně a musí být vždy dlouhodobá. V současnosti neexistuje sjednocený celosvětový diagnosticko-terapeutický algoritmus. V článku jsou přehledně vypsány současné znalosti o etiologii, patofyziologii, diagnostice a léčbě spondylodiscitid.
Cílem práce je zvýšit všeobecné povědomí ošetřujících lékařů o této chorobě.Klíčová slova:
spondylodiscitis, infekce, farmakoterapie.Úvod
Celosvětově dochází k nárůstu globální incidence infekčních onemocnění páteře. Podílí se na tom prodlužování střední doby života, rozvoj cestovního ruchu, vyšší počet poranění páteře a častější výskyt imunokompromitujících faktorů (např. onemocnění HIV/AIDS) (1). Celkově se incidence spondylodiscitid odhaduje na 1 : 100 000 až 1 : 250 000 obyvatel a rok (2, 4, 18). Spondylodiscitidy představují asi 2–7 % všech osteomyelitid. Častěji bývají postiženi muži než ženy (poměr 3 : 1). Onemocnění vykazuje dva věkové vrcholy:
- dětský věk, a
- pátou až šestou dekádu života.
Mortalita spondylodiscitid se pohybuje mezi 2 a 17 % (18). Asi 0,4–2,4 % operačních výkonů v oblasti páteře je zkomplikováno rozvojem spondylodiscitidy. Pooperační záněty obratlových těl a obratlových plotének představují v současnosti asi 20–30 % všech spondylodiscitid (4). Světová zdravotnická organizace (WHO) odhaduje celosvětovou incidenci tuberkulózních spondylodiscitid asi na 800 000 (1) – nárůst prevalence tohoto onemocnění těsně koreluje s výskytem infekce virem lidské imunodeficience (HIV).
Etiologie
Spondylodiscitidy lze rozdělit podle několika kritérií:
- exogenní x endogenní,
- pyogenní x granulomatózní,
- komunitní x nozokomiální,
Dle původce na
- bakteriální,
- mykotické, a
- parazitární
Dle průběhu na
- akutní (méně než 3 týdny),
- subakutní (3 týdny až 3 měsíce), a
- chronické
V naprosté většině případů se jedná o nákazu jedním patogenem (4). Smíšené infekce se často vyskytují u imunokompromitovaných pacientů a u imobilních pacientů s dekubity. Nejčastější etiologická agens jsou vypsána v tabulce 1.
Table 1. Nejčastější bakteriální původci spondylodiscitid 
Celkově narůstá počet stafylokokových a pseudomonádových spondylodiscitid a výskyt k antibiotikům multirezistentních kmenů (1). Při stafylokokové etiologii lze nezřídka nalézt porušený kožní kryt, a tedy bránu vstupu infekce do organismu.
Methicilin-rezistentní stafylokoky (MRSA) způsobují méně než 1 % komunitních spondylodiscitid, ale naopak až 30 až 40 % spondylodiscitid nozokomiálních (9).
Streptokoková spondylodiscitida mívá zpravidla odontogenní nebo kardiální origo.
Pseudomonádové spondylodiscitidy bývají pozorovány u narkomanů, mohou však navazovat i na prodělaný uroinfekt.
Koinfekce Escherichia coli a Enterococcus faecalis se typicky podílí na rozvoji spondylodiscitidy v návaznosti na uroinfekci nebo při spontánní bakteriální peritonitidě při jaterní cirhóze.
K nákaze brucelami může dojít při dojení dobytka bez rukavic, při pití nepasterizovaného mléka, požití nepasterizovaných ovčích či kozích sýrů a po pobytu v endemických oblastech (Sicílie, Turecko, tropy) (11).
Po pokousání zvířaty může dojít k rozvoji spondylodiscitidy způsobené kmeny Pasteurella multocida, Haemophilus aphrophilus nebo Eikenella corrodens. Z ostatních patogenů stojí za zmínku Mycobacterium tuberculosis, Corynebacterium spp., Proteus spp., Bacillus megaterium a Fusobacterium necrophorum (1). Candida albicans a Aspergillus spp. způsobují přibližně 1 % všech spondylodiscitid.
K těmto infekcím jsou náchylnější diabetici, imunokompromitovaní, intravenózní narkomani, pacienti hospitalizovaní na jednotkách intenzivní péče a pacienti s dlouhodobě zavedeným balónkovým katétrem (4).
Mykotické spondylodiscitidy vznikají rovněž jako komplikace zánětů plic. Spondylodiscitidu mohou vyvolat i importované dimorfní houby (např. Coccidioides immitis) z oblasti Las Vegas nebo Death Valley. Zřídka bývá pozorována parazitární spondylodiscitida způsobená např. echinokoky (10).
Při odběru anamnézy od pacienta by tedy neměl chybět dotaz na
- případný fokus infekce (dentální, plicní, urogenitální),
- na předchozí invazivní vyšetření a zákroky (včetně obstřiků páteře),
- na pobyt v zahraničí,
- kontakt se zvířaty, a
- na požívání nepasterizovaných mléčných výrobků.
Anamnéza by měla pokrýt období několika předchozích měsíců.
Patofyziologie
Pojem discitis označuje zánět pouze meziobratlové ploténky. Samotná discitida dosud nebyla patology jednoznačně prokázána. Spondylodiscitis popisuje primárně zánět meziobratlové ploténky a posléze přilehlé části obratlového těla. Podrobné učebnicové rozdělení pyogenních infekcí v oblasti páteře zobrazuje tabulka 2 (10).
Table 2. Dělení pyogenních infekcí páteře 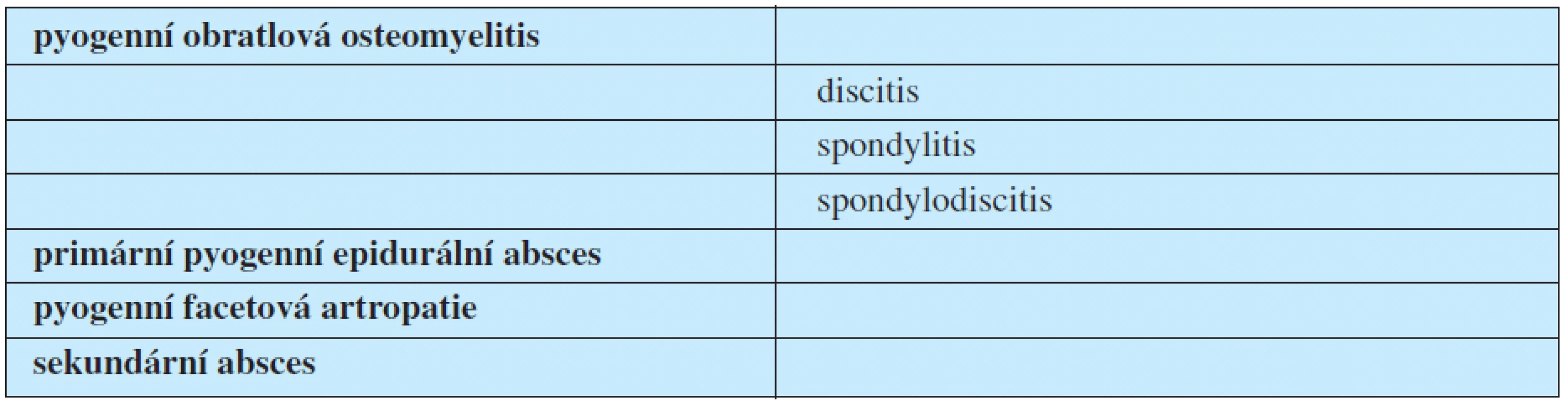
Infekční patogen může do oblasti páteře proniknout v zásadě třemi způsoby:
- a) hematogenně (nejčastěji),
- b) přímou inokulací,
- c) z okolí.
V dětském věku pronikají krevní cévy až do nucleus pulposus, u dospělých pouze do anulus fibrosus meziobratlové ploténky. Při bakteriémii poté dochází k depozitům baktérií v endarteriálních arkádách v metafýze obratle a k rozvoji ischémie, která potencuje další šíření patogenů do okolní tkáně. Byl rovněž prokázán retrográdní žilní tok z pánevních plexů do paravertebrálních pletení, a to především při zvýšeném intraabdominálním tlaku (ascites, gravidita, ale i pouhá defekace). V krční oblasti může jako přívodná síť sloužit retrofaryngeální venózní plexus (10). Při hematogenním rozsevu se infekce zpravidla rozvíjí ve ventrálních segmentech páteře; primární fokus již nemusí být průkazný.
K šíření infekce může docházet i lymfogenně nebo per continuitatem. Rozvoj zánětu je komplexní – uplatňuje se venózní trombóza, zánětem indukovaná vaskulitida a toxický vliv cytokinů (4).
Tuberkulózní spondylodiscitida je vždy endogenní (u HIV-negativních pacientů dochází k manifestaci tuberkulózy na skeletu jen ve 3–5 %, u HIV-pozitivních až v 60 %, z toho polovina postihuje páteř (16).
Rizikové faktory
Prakticky všichni autoři se shodují na následujících rizikových faktorech potencujících rozvoj spondylodiscitidy:
- vysoký věk,
- malnutrice,
- imunodeficit,
- diabetes mellitus,
- chronická renální insuficience,
- hepatální insuficience,
- intravenózní narkomanie,
- přítomnost cizích těles v organismu,
- HIV-pozitivita,
- sepse,
- trauma,
- autoimunitní onemocnění,
- endokarditida,
- kortikoterapie.
Klinické projevy spondylodiscitidy
Délka trvání příznaků bývá v průměru 14–90 dnů (12, 14). Pooperační spondylodiscitidy se zpravidla manifestují do 4 týdnů. Mezi nejčastější a typické klinické projevy spondylodiscitidy patří
- bolesti v zádech nereagující na analgetika, a
- rigidita páteře.
Může být přítomna anorexie a váhový úbytek.
Výskyt horečky je nekonstantní (pouze asi v 60–70 %). Neurologický deficit je přítomen u 10–50 % pacientů (4). Může zahrnovat
- hypestézie,
- hyporeflexie,
- pozitivní Lassègueův příznak,
- dysfagii, a
- svalové spasmy.
Vzácně dochází ke vzniku deformující kyfózy, paréz či sfinkterových potíží. Rozvoj paraplegie či radikulopatie obvykle značí progresi lokálního zánětu (1).
Asi 60 % všech spondylodiscitid bývá v oblasti bederní páteře, 30 % v oblasti páteře hrudní a 10 % v oblasti krční (4). Nejvíce postiženými segmenty bývá etáž C5/6, Th5/6 a L4/5 (7). Neurologický deficit bývá nejčastěji při postižení krční páteře (až v 60 %), méně pak při postižení páteře bederní (5–20 %). K rozvoji epidurálního abscesu dochází u 4–38 % neoperovaných spondylodiscitid (nejčastěji v krční oblasti). Pro tuberkulózní spondylodiscitidu je typický protrahovaný a afebrilní průběh onemocnění a častý rozvoj kyfotických deformit páteře (gibbus). Typická bývá netraumatická paraplegie.
Na kandidovou spondylodiscitidu je nutno pomýšlet u každého pacienta s anamnézou kandidémie (i před několika měsíci!) a s nově vzniklými neurologickými příznaky (4).
Všeobecně lze říci, že pacient vyhledává úlevovou polohu v retroflexi páteře (šetří postižené ventrální segmenty) a udává bolestivost odpovídajících segmentů při poklepu a také během inklinace a zpětné extenze.
Diferenciální diagnostika
V diferenciální diagnostice je nutno odlišit:
- degenerativní a traumatická onemocnění páteře (osteoporóza, erozivní osteochondróza, herniace meziobratlových plotének, M. Scheuermann a M. Bechtěrev),
- metastatické nádorové postižení páteře,
- autoimunitní onemocnění.
Neměla by být opomenuta ani tzv. primární aseptická či primární chronická osteomyelitida/spondylodiscitida či spondylartropatie. Zde se jedná o primárně paravertebrální enteziopatickou destruující komplikaci postižených segmentů páteře.
Primárně chronická osteomyelitida bývá součástí chronické rekurentní multifokální osteomyelitidy (CRMO), která se často vyskytuje v rámci tzv. SAPHO-syndromu (Synovitis, Akné, Pustulosis, Hyperostosis).
Skleróza kosti je zde zapříčiněna plazmatickými buňkami, rozvíjí se aseptická ostitida. Až ve 30 % bývá výrazné postižení obratlů. Onemocnění se vyskytuje ve všech věkových skupinách.
Laboratorní vyšetření
Diagnóza spondylodiscitidy bývá stanovena pouze ve 3/4 případů (8). Výtěžnost výsledků vyšetření negativně ovlivňuje předchozí antibiotická léčba (často empirická!) a nedostatečné množství odebraného materiálu na mikrobiologická kultivační vyšetření. Leukocytóza v krevním obraze bývá přítomna pouze asi v 1/3 případů. Naopak elevace C-reaktivního proteinu (CRP) bývá zhruba ve 2/3 případů. Více než 90 % pacientů se spondylodiscitidou má současně elevaci CRP a zvýšenou rychlost sedimentace erytrocytů. Normální rychlost sedimentace erytrocytů má velkou negativní prediktivní hodnotu, tj. s velkou pravděpodobností spondylodiscitidu vylučuje (3, 10). Současná leukocytóza a zvýšená rychlost sedimentace erytrocytů mohou signalizovat závažnější postižení (10).
Z těchto tří parametrů (leukocytóza, elevace CRP a zvýšená rychlost sedimentace erytrocytů) je nejcitlivější právě rychlost sedimentace erytrocytů (1), jejíž vyšetření by tedy nemělo být podceňováno.
Obtížnější je interpretace CRP a rychlosti sedimentace po operačním výkonu, neboť tehdy dochází fyziologicky k jejich vzestupu. CRP zpravidla rychle klesá k normě během několika dnů – není-li tento pokles zaznamenán, svědčí to s pravděpodobností 64–100 % pro pooperační infekci. Rychlost sedimentace erytrocytů se za normálních okolností upravuje během tří pooperačních týdnů.
Při podezření na spondylodiscitidu je nezbytné provést mikrobiologická kultivační vyšetření, a to pokud možno ještě před zahájením antibiotické léčby. Hemokultury bývají pozitivní pouze asi ve 47 % komunitních spondylodiscitid (14), v pooperačním průběhu nebo po předchozí antibiotické léčbě již jen asi ve 14 % (4). Hemokultury jsou často pozitivní i při absenci klinických známek bakteriální infekce (16). Pozitivita hemokultur bývá nezřídka mylně interpretována jako závažnější postižení, většinou je to pouze ukazatel opožděné diagnózy (8).
Při záchytu koaguláza-negativních stafylokoků v hemokulturách je nezbytné provést okamžitou biopsii meziobratlové ploténky a obratle (PDVB – percutaneous discal and vertebral biopsy) k odlišení eventuální kontaminace materiálu. Jsou-li hemokultury negativní 48 hodin a trvá-li podezření na spondylodiscitidu, je indikováno provedení cílené punkce pod CT (počítačová tomografie) a za čtyři hodiny po punkci opětovný odběr hemokultur. Je-li již zahájena empirická antibiotická léčba, doporučuje se za přísné klinické kontroly stavu pacienta léčbu přerušit a odebrat biologický materiál na kultivaci.
PDVB zachytí agens asi v 63 % komunitních spondylodiscitid, pokud pacient dosud neužíval antibiotika. PDVB představuje diagnostickou metodu volby při podezření na pooperační spondylodiscitidu (4). Odebraný materiál se barví dle Grama, měl by být kultivačně vyšetřen na acidorezistentní tyčky a houby, k rychlé diagnostice lze použít i metodu polymerázové řetězové reakce (PCR). Zjistilo se, že žádný pacient se spondylodiscitidou a negativní PDVB neměl pozitivní hemokultury (18).
V případě negativity hemokultur i PDVB je doporučeno provést druhou biopsii – je-li i tato negativní, je nutno stav komplexně přehodnotit. Peroperační biopsie je v záchytu agens o 25 % úspěšnější než PDVB (16).
Hladina prokalcitoninu v séru nemá žádnou vypovídající hodnotu o závažnosti spondylodiscitidy (17).
Při podezření na tuberkulózu nesmí být opomenuta cílená kultivace sputa a moče. Brucelózu může prokázat mikroskopické vyšetření kostní dřeně. Sérologická vyšetření se uplatňují především při negativních hemokulturách a při suspekci na brucelózu, bartonelózu, Q-horečku nebo tkáňové mykózy.
Zobrazovací metody
Senzitivita konvenčních rentgenových snímků pro stanovení diagnózy spondylodiscitidy se udává mezi 57–82 %. Bývá setřelá struktura obratlových těl, zúžení meziobratlových prostorů a snížení výšky těla postiženého obratle. U většiny pacientů se změny na skeletu projeví nejdříve po 2–3 týdnech trvání onemocnění. Lze zachytit i expanzi mediastina, stín v retrofaryngeálním prostoru či v psoatu.
Skleróza kosti se rozvíjí po 10–12 týdnech onemocnění. Změna struktury pediklů, laminy či trnového výběžku a postižení více obratlů při zachovalé struktuře meziobratlových disků zvyšuje podezření na tuberkulózu. Počítačová tomografie (CT) může prokázat hypodenzity, eroze či otok měkkých tkání – po 2 týdnech trvání onemocnění dosahuje její senzitivita 50 % (4). Při provedení CT-pozitronové emisní tomografie (CT-PET) s leukocyty značenými indiem dosahuje senzitivita 100 %. Scintigrafie skeletu s galliem či techneciem (gallium 67, Tc 99-mMDP) vykazuje již v časném stádiu onemocnění senzitivitu 87–98 % a specificitu 91–100 %.
Ze všech zobrazovacích metod je nejcitlivější magnetická rezonance (MRI), která prokazuje v T1 sekvencích redukci intenzity signálu těla i ploténky a její zvýšení v T2 sekvencích. Senzitivita MRI již v časných stádiích spondylodiscitidy dosahuje 93–96 % se srovnatelnou specificitou a dosahuje téměř 100 % při použití gadoliniové kontrastní látky. Je-li vstupní MRI vyšetření neprůkazné, doporučuje se vyšetření zopakovat s odstupem několika dnů (1, 4). MRI je rovněž nejcitlivější metodou k průkazu abscesu v oblasti páteře (senzitivita MRI 85 % versus CT 69 % a konvenční rentgenový snímek 25 %) (18) a lépe rozliší mezi purulentním zánětem, tuberkulózou a tumorem. Doporučuje se vždy provést MRI celé páteře k vyloučení víceetážového postižení.
Po implantaci cizího tělesa do oblasti páteře může k rozlišení mezi sterilním zánětem a bakteriální infekcí pomoci technecium-ciprofloxacinová scintigrafie nebo pozitronová emisní tomografie s glukózou (FDG-PET), tato metoda však jednoznačně nerozliší zánětlivé změny od nádorových. Vícefázová scintigrafie nerozliší spondylodiscitidu od aktivované osteochondrózy. Negativní scintigrafie s největší pravděpodobností vylučuje zánětlivý kostní proces (16).
Terapie
Na druh léčby a délku jejího podávání neexistuje jednotný názor. Je to dáno poměrně širokým spektrem infekčních agens vyvolávajících spondylodiscitidy, jejich epidemiologickými a mikrobiologickými charakteristikami a v neposlední řadě záleží i na stavu pacienta a na zkušenostech daného pracoviště. Pouze ve Francii je vypracován diagnosticko-terapeutický plán, který však bývá právě pro nutnost občasné simplifikace problematiky kritizován. Všeobecně se doporučuje podávat vždy alespoň dvě baktericidní a širokospektrá antibiotika s dobrým průnikem do kosti.
Při empirické terapii je vždy třeba pokrýt zlatého stafylokoka, Escherichia coli a předpokládané agens. Farmakokinetika průniku antibiotik do meziobratlové ploténky není ještě přesně známa. Nucleus pulposus vykazuje negativní náboj, proto je lepší průnik antibiotik s nábojem pozitivním (např. gentamicin) než negativním. Přesto průměrná koncentrace antibiotika v kosti dosahuje maximálně 40 % sérové koncentrace (17). Nejčastěji se užívají fluorochinolony, klindamycin, rifampicin, metronidazol a kyselina fusidinová. Betalaktamy a glykopeptidy jsou indikovány méně pro svůj horší průnik do kostní tkáně. Aminoglykosidy se z téhož důvodu uplatní výjimečně. Teicoplanin vykazuje lepší prostup do kosti a menší nefrotoxicitu než vancomycin. Linezolid má dobrý účinek na gram-pozitivní mikroby i dobrý průnik do kosti, limitací léčby je kromě ceny riziko myelotoxicity a neuropatie po více než třech týdnech léčby. Do kostní tkáně též skvěle proniká fosfomycin. Nejčastěji užívané kombinace jsou následující:
- levofloxacin/ciprofloxacin a rifampicin.
- ciprofloxacin a klindamycin.
- teicoplanin a rifampicin,
- vancomycin a rifampicin (1, 4, 12).
V empirické léčbě by dnes již neměl klindamycin figurovat – až 20 % kmenů zlatého stafylokoka vykazuje rezistenci (11). Rifampicin je kontraindikován při podezření na tuberkulózu – hrozí rozvoj rezistence. Je třeba zohlednit změněnou farmakokinetiku antibiotik (např. fluorochinolonů) při současném užívání preparátů železa, antacid a mléčných výrobků. Dále je při terapii aminoglykosidy nutné důsledné monitorování sérových hladin (alespoň 1x týdně) a úprava dávek antibiotik při změněné funkci ledvin a jater.
V jedné multicentrické studii (14) se zjistilo, že 95 % pacientů bylo léčeno kombinací antibiotik (nejčastěji betalaktamy, fluorochinolony a aminoglykosidy), zatímco jen zlomek pacientů dostával kombinaci fluorochinolon a rifampicin, ačkoli se jedná o kombinaci první volby při stafylokokové spondylodiscitidě.
Všeobecně nepanuje konsenzus stran délky antibiotické léčby a délky parenterální aplikace antibiotik – kvůli celkové nehomogenitě souboru pacientů se spondylodiscitidou chybí prospektivní randomizované kontrolované studie.
V současnosti není žádný jednoznačný parametr uzdravení. Doporučuje se podávat antibiotika 6–9 týdnů parenterálně a poté ještě alespoň 6 týdnů perorálně (1, 7, 12), všeobecně minimálně do vymizení teplot, do normalizace laboratorních parametrů zánětu (CRP, rychlost sedimentace erytrocytů) a do stabilizace nálezu na zobrazovacích vyšetřeních (konvenční rentgenové snímky – viz níže). Pokud jsou antibiotika podávána méně než 4 týdny, je vysoká pravděpodobnost relapsu onemocnění (7). Pozitivita hemokultur zpravidla vede k nesprávně indikované prodloužené parenterální aplikaci antibiotik. Jak je již výše zmíněno, pozitivní hemokultury neodrážejí závažnost stavu a zásadním kritériem sanace ložiska je zde stále normalizace parametrů zánětu (8).
Antibiotické kombinace první volby jsou vypsány v tabulce 3.
Table 3. Antibiotika první volby (4, 9) 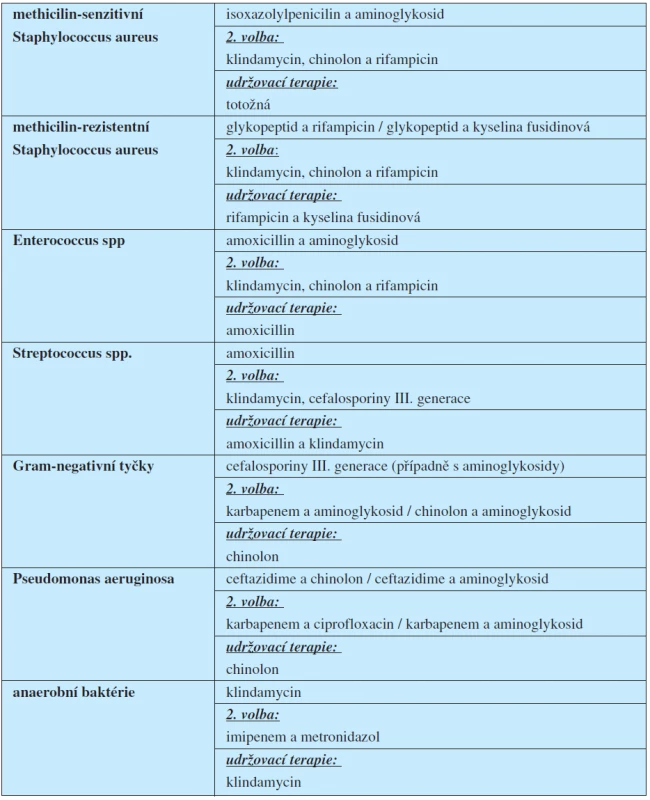
Při brucelové etiologii je lékem volby doxycyklin podávaný několik měsíců.
Tuberkulózní spondylodiscitida vyžaduje specifickou kombinovanou terapii po dobu alespoň 12 měsíců (isoniazid, pyrazinamid a rifampicin).
Kandidová spondylodiscitida se léčí amfotericinem B po 6–10 týdnů parenterálně (dávka 0,5–0,6 mg/kg hmotnosti), poté perorálně flukonazolem do normalizace rychlosti sedimentace erytrocytů.
Lékem volby na aspergilovou spondylodiscitidu je vorikonazol, rovněž do normalizace rychlosti sedimentace erytrocytů. Pro dobrou léčebnou odpověď svědčí pokles CRP každý týden o 50 % předcházející hodnoty (4). Při včasné diagnóze a správné léčbě je až 85 % pacientů vyléčeno konzervativně (1). Pravděpodobnost úspěchu na vyléčení konzervativní metodou je minimální v případě klinických a radiologických známek zánětu trvajících déle než 4–6 týdnů od zahájení léčby. U některých pacientů je nutná operační léčba – dekomprese, drenáž abscesu, stabilizace či intersomatická fúze.
Chirurgické řešení je indikováno při nově vzniklém neurologickém deficitu či při rychlé progresi stavu, při silných bolestech a při známkách nestability páteře dle zobrazovacích vyšetření. Slibně se rozvíjí torakoskopická páteřní chirurgie. S operací by se nemělo váhat při mykotické etiologii spondylodiscitidy, jelikož konzervativní léčba nezřídka selhává (16). Relativní indikaci chirurgického zákroku představuje neovlivnitelná bolest a noncompliance při konzervativní léčbě. Cílem operace je
- průkaz agens,
- sanace ložiska, a
- stabilizace postiženého segmentu páteře.
Pooperačně je možná časná mobilizace, hrozí však bakteriální kolonizace implantovaného materiálu. Druh chirurgického výkonu (ventrální, dorzální, dorzoventrální či ventrodorzální fúze) se liší na každém pracovišti. Pooperační mortalita dosahuje 2–9 %. Chronické následky udává až 30 % operovaných pacientů (7).
Nedílnou součástí terapie je i správná imobilizace v korzetu: délka znehybnění je individuální, doporučuje se alespoň 6–10 týdnů (9). Korzet není nutno používat při lokalizaci zánětu v etáži Th4-Th9. K mobilizaci pacienta je možno přistoupit při radiologických známkách novotvorby kosti. Prodloužená imobilizace je spojena s rizikem rozvoje pseudoartróz, chronické bolesti a osteoporózy.
Zkoumá se vliv hyperbarické oxygenoterapie na průběh léčby s předpokladem, že volné kyslíkové radikály zvýší účinnost antibiotické léčby. K operační fúzi obratlů se zkouší antibiotiky sycené pelety síranu vápenatého – tato metoda však přispívá spíše k rozvoji antibiotické rezistence (2, 17).
Selhání terapie
K selhání konzervativní léčby dochází ve 25–50 % případů (1). Trvají nadále klinické příznaky, nedochází k poklesu CRP a přetrvává nález na zobrazovacích vyšetřeních. K relapsu onemocnění nejčastěji dojde do šesti měsíců po ukončení terapie (4). Kvantitativní výskyt relapsů v závislosti na délce antibiotické léčby ukazuje tabulka 4.
Table 4. Kvantitativní výskyt relapsů v závislosti na délce antibiotické léčby 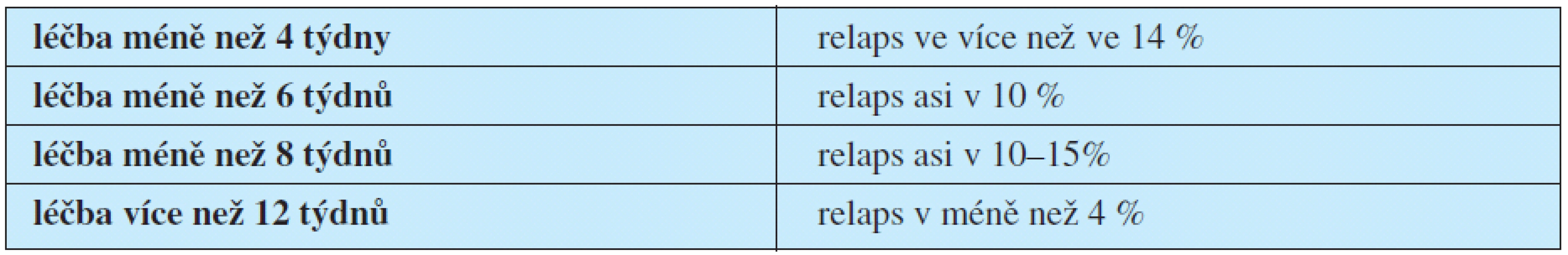
Dispenzarizace a prognóza pacientů
Kontrolní konvenční rentgenový snímek postiženého segmentu se doporučuje provést po jednom a po třech měsících léčby a dále ještě po třech měsících od ukončení terapie. Vzhledem k probíhající přestavbě kostní tkáně během léčby může být i po jejím skončení nález na magnetické rezonanci zdánlivě zhoršen – při pochybnostech se doporučuje spíše provést kontrolní CT (4).
Velké procento pacientů udává chronickou bolest, hypestézie či chronický motorický deficit (16). K ojedinělým recidivám může dojít i po dalších několika letech.
Vlastní pozorování
Padesáti šesti letá pacientka s hypertenzní chorobou a autoimunitní thyreoiditidou v anamnéze byla původně hospitalizována počátkem září 2009 ve spádové nemocnici pro dyspeptické potíže. Infúzní terapie byla aplikována flexilou zavedenou v oblasti pravé kubitální jamky. Po propuštění do domácí péče se rozvinula lokální flebitida. O několik dnů později se pacientka dostavila k ošetření do jiného zdravotnického zařízení pro bolestivou zarudlou induraci před pravým kývačem. Diagnostikovaný absces byl chirurgicky ošetřen lege artis, kultivačně byl ze získaného hnisu i z hemokultur zjištěn Staphylococcus aureus meticilin-rezistentní (MRSA). Tato nozokomiální stafylokoková infekce (HA-MRSA, hospital-acquired-MRSA) byla přeléčena parenterální aplikací cefotaximu po celkovou dobu 14-ti dnů. Již během této terapie začala pacientka pozorovat klidové i námahové bolesti v dolní části zad a výrazné pocení. Horečky a zimnice již nepozorovala. Přechodně dokonce pocítila slabost obou dolních končetin, proto se dostavila 5. listopadu 2009 na neurologickou ambulanci, odkud byla pro bolesti zad a vysokou rychlost sedimentace erytrocytů (90/100 mm) odeslána na Kliniku infekčních chorob (KICH) Fakultní nemocnice (FN) Brno k vyloučení spondylodiscitidy.
Při přijetí byla pacientka afebrilní (36,7 °C), normostenická, kardiorespiračně stabilizovaná, neurologicky bez motorického či senzitivního deficitu. Klinickému vyšetření dominovala poklepová bolestivost v oblasti lumbální páteře. Parametry zánětu nebyly při přijetí výrazně elevovány (C-reaktivní protein 23 mg/l), leukocytů 8,00 x 109/l s normálním diferenciálním rozpočtem). Byla přítomna mírná retence dusíkatých katabolitů v séru (kreatinin 133 μmol/l, urea 11,3 mmol/l).
V hemokulturách odebraných v den přijetí byl zachycen meticilin-rezistentní Staphylococcus aureus (MRSA) s citlivostí na tigecyklin, linezolid, chloramfenikol (minimální inhibiční koncentrace MIC v mg/l: 2,0), vancomycin (MIC: 1,0), tetracyklin (MIC: 0,125), co-trimoxazol (MIC: 2,0) a gentamicin (MIC: 0,25).
Akutní vyšetření hrudní a bederní páteře na magnetické rezonanci (MRI) v T1 sekvencích zobrazilo hyposignální části obratlových těl L4 a L5, které byly v T2 sekvencích hypersignální. V T2 váženém obraze byl sledovatelný patologicky zvýšený signál meziobratlové ploténky L4/L5 a současně zvýšený signál přilehlé subchondrální kostní dřeně obratlových těl, svědčící o edému. Kontury krycích plotének byly erodované a neostré. Tělo L4 bylo v lehkém ventrálním skluzu vůči L5 (obr. 1 a 2).
Obr. 1 a 2. Obraz akutní spondylodiscitidy v etáži L4/L5 v T2 váženém obraze magnetické rezonance 
Celotělová scintigrafie skeletu s techneciem MDP prokázala patologickou kumulaci radionuklidu ve čtvrtém a pátém bederním obratli (L4/5) s maximem vpravo. Těmito vyšetřeními byla jednoznačně diagnostikována nozokomiální stafylokoková spondylodiscitida v etáži L4/L5. Ortopedičtí konziliáři zvolili konzervativní postup s přechodnou imobilizací, fixačním bederním pásem a dlouhodobou antibiotickou terapií. Původně zvolená empirická antibiotická terapie (rifampicin a co-trimoxazol) byla změněna dle MIC na parenterálně aplikovaný vancomycin v dávce 2 g denně po dobu celkem 14-ti dnů, následně byl nasazen co-trimoxazol intravenózně v dávce 3 x 960 mg denně na celkem 7 dnů. Co-trimoxazol v dávce 960 mg 2x denně byl vybrán i jako lék pro udržovací perorální terapii, která trvala dalších plných 6 měsíců.
Hospitalizace proběhla bez dalších komplikací, během léčby nedošlo k další progresi renální insuficience (renální parametry se naopak upravily k normě), pacientka úspěšně rehabilitovala a byla propuštěna do domácího ošetřování. Při kontrolním vyšetření bederní páteře magnetickou rezonancí dne 29. 1. 2010 byla zjištěna zřetelná regrese patologického signálu v etáži L4/5, a to jak v oblasti ploténky a dřeně obratlů, tak i patologické kolekce paravertebrálně vlevo. Při klinické kontrole 12. 2. 2010 pacientka udávala trvající bolesti v oblasti bederní páteře s výrazně nižší intenzitou. Hladina C-reaktivního proteinu byla pod 1 mg/l, tj. v referenčním rozmezí, rychlost sedimentace erytrocytů dosahovala 28/50 mm.
Při dalším MRI-vyšetření dne 14. 5. 2010 byl popsán reziduální lem edému v oblasti krycích ploch a stacionární obraz zachycených degenerativních změn. Na prostém rentgenovém snímku bederní páteře v bočné projekci dne 14. 5. 2010 se zobrazilo snížení meziobratlového prostoru L4/L5, ventrální skluz L4 druhého stupně dle Meyerdinga, subchondrální sklerotizace při krycích plochách – nález odpovídá stavu po prodělané spondylodiscitidě (obr. 3).
Image 1. Prostý rentgenový snímek bederní páteře po prodělané spondylodiscitidě 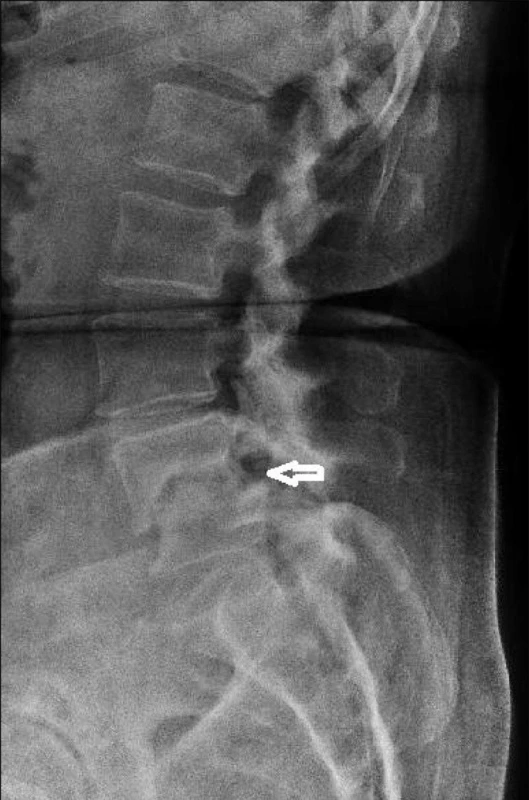
Co-trimoxazol byl vysazen koncem května 2010. Celková doba antibiotické léčby byla 31 týdnů, z toho 7 týdnů probíhala léčba parenterálně. Pacientce bylo doporučeno provedení kontrolního rentgenového snímku a vyšetření rychlosti sedimentace erytrocytů v odstupu tří měsíců.
Závěr
Spondylodiscitida zůstává i ve třetím tisíciletí závažným onemocněním s vysokou mortalitou. Pro správnou a rychlou diagnostiku tohoto onemocnění je nezbytné, aby klinik zvážil všechny rizikové faktory a zahájil včasnou cílenou diagnostiku. Antibiotická léčba musí zohledňovat specifika farmakokinetiky konkrétního léčivého přípravku v kostní tkáni a musí být dlouhodobá. Vždy je třeba pátrat po etiologickém agens a pomýšlet i na vzácnější patogeny.
MUDr. Pavel Polák
Klinika infekčních chorob FN a LF MU Brno
Jihlavská 20
625 00 Brno
E-mail: pavel.polak@fnbrno.cz
Sources
1. Acosta, F.L. Jr., Galvez, L.F., Aryan, H.E. Recent advances: infections of the spine. Curr. Inf. Dis. Reports 2006, 8, p. 390-393.
2. Bettini, N., Girardo, C.M., Dema, C.E. Evaluation of conservative treatment of non specific spondylodiscitis. Eur. Spine J. 2009,18, p. 143-150.
3. Butler, J.S., Shelly, M.J., Timlin, M. et al. Nontuberculous pyogenic spinal infection in adults. Spine 2006, 31(23), p. 2695-2700.
4. Cottle, L., Riordan, T. Infectious spondylodiscitis. J. Inf. 2008, 56, p. 401-412.
5. Darley, E.S.R., MacGowan, A.P. Antibiotic treatment of gram-positive bone and joint infections. J. Antimicrob. Chemother. 2004, 53, p. 928-935.
6. del Pozo, J.S.G., Soto, M.V., Solera, J. Vertebral osteomyelitis: long-term disability assessment and prognostic factors. J. Inf. 2007, 54, p. 129-134.
7. Ewald, C., Gartemann, J., Kuhn, S.A. et al. Operative Therapie der bakteriellen Spondylodiszitis – eine retrospektive Untersuchung. Orthopäde, 2009, 38, s. 248-255.
8. Gaudias, J. Considerations on antimicrobial therapy for pyogenic discitis. Joint Bone Spine 2001, 68, p. 463-465.
9. Grados, F., Lescure, F.X., Senneville, E. Suggestions for managing pyogenic (non-tuberculous) discitis in adults. Joint Bone Spine 2007, 74, p. 133-139.
10. Hadjipavlou, A.G., Mader, J.T., Necessary, J.T. et al. Hematogenous pyogenic spinal infections and their surgical management. Spine 2000, 25(13), p. 1668-1679.
11. Hof, H., Schilling, F. Diskussion zu dem Beitrag: Aktuelle Diagnostik und Therapie der Spondylodiszitis. Dtsch. Aerzteblatt 2008, 105(39), s. 674.
12. Kapsalaki, E., Gatselis, N., Stefos, A. et al. Spontaneous spondylodiscitis: presentation, risk factors, diagnosis, management, and outcomes. Int. J. Inf. Dis. 2009, 13, p. 564-569.
13. Khan, I.A., Vaccaro, A.R., Zlotolow, D.A. Management of vertebral diskitis and osteomyelitis. Orthopedics 1999, 22(8), p. 758-765.
14. Legrand, E., Flipo, R.-M., Guggenbuhl, P. et al. Management of nontuberculous infectious discitis. Treatments used in 110 patients admitted to 12 teaching hospitals in France. Joint Bone Spine 2001, 68, p. 504-509.
15. Müller, E.J., Russe, O.J., Muhr, G. Osteomyelitis der Wirbelsäule. Orthopäde, 2004, 33, s. 305-315.
16. Sobottke, R., Seifert, H., Fätkenheuer, G., et al. Aktuelle Diagnostik un Therapie der Spondylodiszitis. Dtsch. Aerzteblatt, 2008, 105(10), s. 181-187.
17. Société de pathologie infectieuse de langue francaise. Recommandations pour la pratique clinique: spondylodiscites infectieuses primitives, et secondaires à un geste intradiscal, sans mise en place de materiel. Med et mal infectieuses, 2007, 37, p. 573-583.
18. Wirtz, D.Ch., Genius, I., Wildberger, J.E. et al. Diagnostic and therapeutic management of lumbar and thoracic spondylodiscitis – an evaluation of 59 cases. Arch. Orthop. Traum. Surg. 2000, 120, p. 245-251.
19. Zeller, V., Desplaces, N. Antibiothérapie des infections osteoarticulaires à pyogènes chez l´adulte: principes et modalités. Rev du Rhumatisme, 2006; 3, p. 183-190.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2010 Issue 9-
All articles in this issue
- Evoluce a evoluční teorie pro lékaře IX. Evoluční psychologie
- Přínos nových doporučení pro hodnocení 12-ti svodového elektrokardiogramu u sportovců pro praktické lékaře
- Spondylodiscitida – známá a neznámá
- Názory české veřejnosti na užívání antibiotik i dalších léků
- Péče o ženu středního a vyššího věku z pohledu porodní asistentky
- Hodnocení stavu výživy hospitalizovaných seniorů
- Příprava diabetika k operaci
- Změna počtu trombolyzovaných pacientů v ČR po prodloužení terapeutického okna ze 3 na 4,5 hodiny
- Oniománie, aneb nakupování jako problém
-
Duplicitní malignita s paraneoplastickou polymyositidou
Kazuistika a přehled problematiky
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spondylodiscitida – známá a neznámá
- Příprava diabetika k operaci
- Hodnocení stavu výživy hospitalizovaných seniorů
- Oniománie, aneb nakupování jako problém
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

