-
Medical journals
- Career
Karcinom pankreatu
: T. Hucl
: Klinika hepatogastroenterologie IKEM, Praha
: Gastroent Hepatol 2012; 66(5): 350-356
: Gastrointestinal Oncology: Review Article
Karcinom pankreatu je onemocnění se stoupající incidencí a nepříznivou prognózou. Navzdory pokrokům v poznání jeho biologie a léčbě přežívá 5 let méně než 5 % pacientů. Nejčastěji se jedná o onemocnění sporadické bez známé dominantní příčiny. Mezi hlavní rizikové faktory jeho vzniku patří kouření, obezita s nadměrným příjmem tuků, vysoký věk, mužské pohlaví, etnický původ, chronická pankreatitida či diabetes mellitus. Méně často je karcinom pankreatu onemocněním s rodinným výskytem, ať už jako součást některých genetických syndromů či bez doposud známé konkrétní genetické predispozice. Podobně jako u jiných epitelových nádorů vzniká karcinom pankreatu postupnou progresí z neinvazivních prekurzorů, z nichž některé lze identifikovat zobrazovacími metodami. Histologická progrese těchto prekurzorů sleduje progresi genetickou, která je podstatou patogeneze onemocnění. Poškození DNA či jiné negenetické změny vedou k alteraci buněčných signálních drah, v jejichž důsledku dochází ke změnám biologického chování buněk a nádorové iniciaci, progresi a metastazování. Hlavními příčinami nepříznivé prognózy je časná generalizace onemocnění a jeho chemo - a radiorezistence. Pacienti s lokalizovanou chorobou jsou indikováni k chirurgickému výkonu následovanému adjuvantní chemoterapií. Lokálně pokročilé či generalizované nádory jsou vhodné k paliativní chemoterapii či chemoradioterapii. Neoadjuvantní léčba si nově získává své postavení v terapeutickém algoritmu. Bližší pochopení molekulárních mechanizmů patogeneze a možnost jejich ovlivnění cílenou protinádorovou léčbou však představují největší potenciál v léčbě karcinomu pankreatu.
Klíčová slova:
karcinom pankreatu – etiologie – signální dráha – terapieEpidemiologie
Duktální adenokarcinom pankreatu je nejčastějším představitelem nádorů pankreatu. Ostatní nádory jako například acinární karcinom, pankreatoblastom či neuroendokrinní nádory tvoří menšinu nádorů a mají odlišnou etiopatogenezi, manifestaci, diagnostiku a léčbu. Karcinom pankreatu je devastující onemocnění s dlouhodobě omezenými možnostmi léčby a špatnou prognózou. Výskyt tohoto onemocnění v posledních desetiletích jednoznačně narůstá a dosahuje průměrné incidence v západním světě kolem 8/100 000 obyvatel za rok. V ČR je incidence dokonce až dvojnásobně vyšší a pohybuje se mezi 15 a 19/100 000. V průměru se jedná o čtvrtou nejčastější příčinu úmrtí na nádorová onemocnění. Odhaduje se, že na karcinom pankreatu umírá ve světě 250 000 pacientů za rok. Incidence onemocnění je téměř totožná s prevalencí, neboť pětileté přežití pacientů je menší než 5 %. Hlavní příčinou nepříznivé prognózy je fakt, že onemocnění je v době diagnózy generalizované až u 85 % pacientů [1].
Nejčastěji se jedná o onemocnění sporadické bez známé dominantní příčiny. Mezi rizikové faktory jeho vzniku patří kouření, obezita s nadměrným příjmem tuků, vysoký věk, mužské pohlaví, etnický původ, chronická pankreatitida, diabetes mellitus či expozice některým karcinogenům v zaměstnání [1].
Kouření představuje nejvýznamnější preventabilní rizikový faktor. Zvyšuje riziko vzniku karcinomu asi dvakrát a je zodpovědné za asi jednu čtvrtinu nádorů. Kouření je asociované s nízkým věkem v době diagnózy. Riziko také koreluje s dobou trvání a intenzitou kouření. Ze studií posledních let je patrné, že pasivní kouření, nejvíce v dětství a mezi matkou a dítětem, taktéž zvyšuje riziko. Přerušení kouření má pozitivní efekt, který se však dostaví až po několika letech. Navíc u kuřáků, jejichž rodinná anamnéza je pozitivní ve smyslu karcinomu pankreatu, riziko stoupá nebo se onemocnění projeví o 1–2 dekády dříve. Na rozdíl od kouření nebyla jednoznačná role abúzu alkoholu prokázána. Výrazný příjem může riziko vzniku karcinomu mírně zvyšovat, je však obtížné odlišit působení současně se vyskytujícího kouření či chronické pankreatitidy [1–2].
Riziko vzniku karcinomu pankreatu stoupá s věkem. Absolutní většina pacientů s karcinomem pankreatu je starších 60 let. 80 % pacientů je starších 60 let a jen 10 % mladších 50 let. Karcinom pankreatu je o něco častější u mužů a v afroamerické populaci. Dlouhotrvající zánět slinivky představuje riziko vzniku karcinomu, avšak pouze velmi malé procento pacientů s karcinomem pankreatu má chronickou pankreatitidu. Kumulativní riziko vzniku karcinomu se odhaduje pouze na 4 % [3].
Diabetes mellitus se vyskytuje v asi 5–10 % obecné populace, avšak až u 50 % pacientů s karcinomem pankreatu. Dlouhodobý průběh diabetu mellitu zdvojnásobuje riziko vzniku karcinomu, na druhé straně však může být sekundární diabetes časným symptomem nádorového onemocnění. Zdá se, že inzulin v léčbě diabetu může působit kancerogenně, naopak metformin by mohl riziko vzniku nádoru snižovat. Příčiny vzniku diabetu u pacientů s karcinomem jsou nejasné. Nabízející se možnost screeningu pacientů s nově zjištěným diabetem na přítomnost karcinomu pankreatu je neúčelná, neboť karcinom je přítomný pouze u asi 1 % těchto pacientů [4].
Expozice chlorovaným uhlovodíkům, polyaromatickým uhlovodíkům či některým kovům v pracovním prostředí může výskyt karcinomu pankreatu mírně zvyšovat. Obezita a nadměrný příjem živočišných tuků jsou mírnými rizikovými faktory. Efekt diety bohaté na ovoce a zeleninu nebyl v posledních studiích potvrzen. Mezi faktory s doposud nejednoznačně prokázanou souvislostí patří infekce Helicobacter pylori a krevní skupiny non-0 [1–3].
Méně často je karcinom pankreatu onemocněním s rodinným výskytem, ať už jako součást některých genetických syndromů či bez doposud známé konkrétní genetické predispozice. Pozitivní rodinnou anamnézu nacházíme u asi 10 % pacientů. V rodinách s familiárním karcinomem pankreatu (dva a více příbuzných prvního stupně) je riziko karcinomu u dalšího člena asi devětkrát zvýšené, v případě postižení ještě dalšího příbuzného riziko stoupá až na 32násobek. U sporadického karcinomu se riziko zvyšuje asi 2–5× v případě, že jeden z příbuzných prvního stupně onemocněl karcinomem. Genetické syndromy způsobené vrozenými mutacemi v BRCA2, PALB2, CDKN2A, STK11 a genech způsobujících Lynchův syndrom (HMSH2, HMLH1 a HPMS2) mají výrazně zvýšené riziko vzniku karcinomu pankreatu. BRCA2 mutace jsou nejčastější známou příčinou familiárního karcinomu pankreatu nacházejí se u 5–20 % rodin s familiárním výskytem. Geneticky podmíněná je také hereditární pankreatitida způsobená mutacemi v genu pro kationický trypsinogen PRSS1, u které je kumulativní riziko vzniku karcinomu pankreatu až 44 % do 70 let věku [1–3]. Přítomnost známé genetické predispozice umožňuje genetické vyšetření rodinných příslušníků, a identifikuje tak pacienty, kteří jsou nejlepšími kandidáty screeningu karcinomu pankreatu.
Patogeneze
Genetické změny
Karcinom pankreatu stejně jako jiná nádorová onemocnění vzniká v důsledku poškození DNA. Toto poškození může být vrozené (vrozené mutace) získané v důsledku působení rizikových faktorů/karcinogenů či vzniklé náhodně při dělení buněk a replikaci DNA. Mezi nejčastější genetické abnormality u invazivního karcinomu pankreatu patří mutační aktivace KRAS onkogenu a inaktivace tumor-supresorových genů CDKN2A, TP53, SMAD4 a BRCA2, rozsáhlé chromozomální ztráty, genové amplifikace a zkrácení telomer [5–8]. Mezi méně často mutované geny patří například BRAF, MYB, AKT2 a STK11 [2,9,10]. Jones et al provedli kompletní genomovou analýzu u 24 karcinomů pankreatu. V průměru nalezli 63 genetických alterací na jeden tumor, mutace v jedné z 12 hlavních signálních drah byly přítomny u 63–100 % nádorů [11].
Negenetické změny
Vedle genetických mechanizmů mohou funkci genů ovlivnit také epigenetické změny jako například metylace DNA či modifikace histonů. Příkladem může být metylací promotoru navozené potlačení funkce tumor--supresorového genu CDKN2A u těch nádorů, které v tomto genu nenesou mutaci. Jiným příkladem negenetických změn je abnormální exprese. Může se jednat o abnormální expresi některých proteinů, jako např. mezotelinu [12] či některých molekul mikroRNA. U karcinomu pankreatu se jedná například o zvýšenou expresi miR-21, miR-34, miR-155 či miR-200. Předpokládá se, že tato abnormální exprese může přispět k nádorové progresi. Přítomnost zvýšeného množství proteinů či mikro-RNA ve tkáni či plazmě představuje potenciál jejich užití jako diagnostického markeru [13–14].
Nádorové mikroprostředí
Pro karcinom pankreatu je charakteristická výrazná přítomnost vazivového stromatu. Interakce mezi stromálními fibroblasty (stelárními buňkami) a neoplastickými buňkami přispívá k nádorové iniciaci, progresi a metastazování. Tato interakce se odehrává na molekulární úrovni. Nádorové stroma může také způsobovat fyzickou bariéru zabraňující chemoterapeutikům dosáhnout k nádorovým buňkám. Potlačení jeho růstu tak může představovat jeden z mechanizmů jak zvýšit dostupnost a efektivitu protinádorových léků [15]. Předpoklad účasti imunitního systému v progresi karcinomu pankreatu vychází například z pozorování pozitivního terapeutického účinku inhibice T regulačních lymfocytů (buňky potlačující protinádorovou imunitní odpověď), jiným příkladem potlačení nádorového růstu je použití vakcín obsahujících ozářené nádorové buňky či jejich antigeny [16]. Teorie kmenových buněk předpokládá, že jediným obnovitelným zdrojem nádorových buněk jsou kmenové buňky (nádor iniciující buňky) obsažené v nádoru. U karcinomu pankreatu by měly být charakterizované přítomností CD24, CD44 a CD133. Vedle schopnosti inicializace nádoru a neomezeného dělení jsou nositeli rezistence k léčbě. Jejich existence a role u karcinomu však zůstává nejasná [17].
Signální dráhy
Výše uvedené mechanizmy vedou různým způsobem k alteraci buněčných signálních drah, v jejichž důsledku pak dochází ke změně biologického chování buněk. Signální dráha představuje kaskádu reakcí jednotlivých proteinů, která se spouští v reakci na impulz a vede většinou k zajištění základních životních funkcí buňky. Protoonkogeny a tumor supresorové geny jsou součástí signálních drah. Mezi nejdůležitější signální dráhy alterované u karcinomu pankreatu patří ty, které regulují apoptózu, opravu DNA, progresi buněčného cyklu, adhezi, invazi či konkrétně signální dráhy KRAS, CDKN2A, P-53, TGF-ß, Wnt/Notch, NF-kappa B, AKT1-PI3K-MTOR, Fanconiho anémie či Hedgehog. Některé z těchto signálních drah jsou předmětem cílené protinádorové léčby [14].
Aktivace jedné signální dráhy může zajišťovat interakci mezi nádorovými buňkami a nenádorovým stromatem. Hedgehog ligandy pocházející z nádorových buněk stimulují stromální fibroblasty exprimující receptory Hedgehog signální dráhy (SMO). Fibroblasty s aktivovanou Hedgehog signální dráhou pak tvoří vazivo a parakrinně stimulují nádorové buňky k růstu [18].
Prekurzory karcinomu pankreatu
Molekulární evoluce karcinomu pankreatu je postupná a poslední studie potvrzují, že trvá mnoho let [19]. V důsledku postupně přibývajících alterací genetického materiálu a abnormální aktivace signálních drah dochází k patologicko-anatomickým změnám buněk. Preneoplastické prekurzory, ze kterých vzniká většina nádorů, se nazývají pankreatické intraepiteliální neoplazie (PanIN) a představují postupnou progresi normálního duktálního epitelu v invazivní karcinom. PanIN jsou mikroskopické léze do 5mm velikosti detekovatelné pouze histologicky [20]. Mezi další preneoplastické prekurzory patří intraduktální papilární mucinózní neoplazie (IPMN) a mucinózní cystické nádory (MCN). Tyto léze jsou již přístupné detekci zobrazovacími metodami, a jejich nalezení tak umožňuje pravidelné sledování či preventivní chirurgické odstranění [21].
PanIN bývají nejčastěji lokalizovány v hlavě pankreatu, vznikají především v menších pankreatických vývodech do 5 mm a jsou klasifikovány do tří stupňů. Nejnižším a relativně častou je PanIN-1, její výskyt se popisuje až u poloviny starých osob a přibližně 1 z 500 dospěje do stadia invaze. PanIN-1A je charakterizována náhradou kuboidních buněk pankreatických vývodů vysokými protáhlými buňkami s malými jádry lokalizovanými při bázi. V případě, že tyto buňky vytvoří papilární strukturu, hodnotí se jako PanIN-1B. PanIN-2 jsou méně časté, nalézané asi u 10 % starých osob, mají však vyšší maligní potenciál a typické jsou pro ně abnormality jader jako např. ztráta polarity, zvětšení či kondenzace chromatinu. U PanIN-3 lézí nacházíme kribriformí shluky epiteliálních buněk oddělující se do lumen společně s nekrózami a těžšími jadernými atypiemi. PanIN-3 léze se většinou vyskytují společně s jednoznačným invazivním karcinomem [20–21].
Progrese morfologická odpovídá s narůstajícími abnormalitami progresi genetické (obr. 1). Chromozomální nestabilita je považována za časné poškození v průběhu tumorogeneze. Je přítomná téměř u všech PanIN-1, jedná se o zkrácení telomer, které je výsledkem dysfunkce enzymu telomerázy. Mutace KRAS protoonkogenu se vyskytuje u poloviny PanIN-1 lézí. Tato frekvence se zvyšuje u PanIN-2, kdy se navíc přidávají CDKN2A (p16) abnormality. Inaktivace proteinu p53 je považována za pozdější a objevuje se u vyšších stadií PanIN. Ztráta MADH4 genu je charakteristická pro PanIN-3 léze. Tato uspořádaná progrese intraduktální neoplazie vede k takové konstelaci genetického poškození, které je nakonec odpovědné za invazivní a metastatický charakter tumoru [20–21].
1. Model histologické a genetické progrese duktálního adenokarcinomu pankreatu. Fig. 1. Model of the histological and genetic progression of the ductal adenocarcinoma of the pancreas. 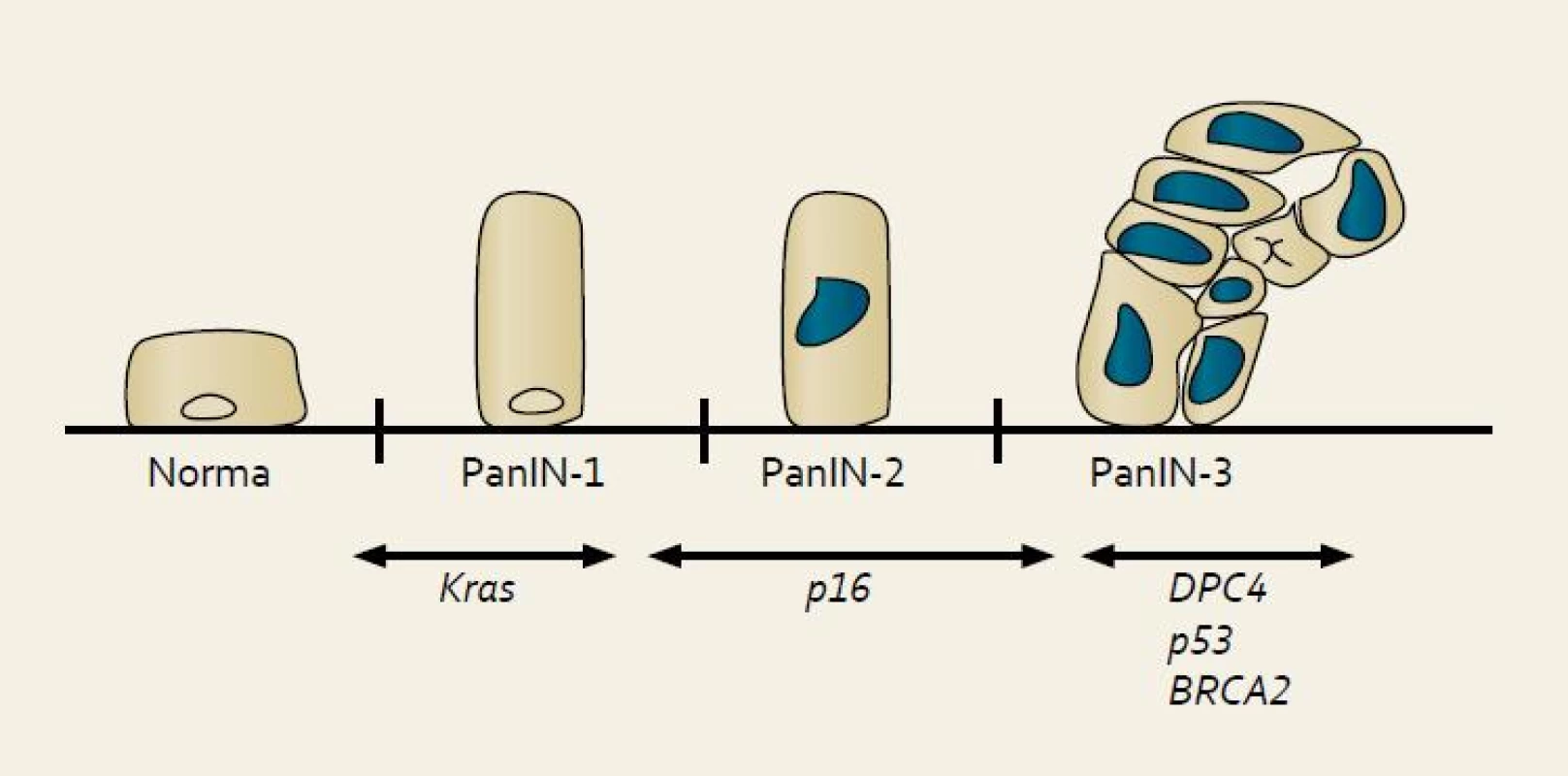
Jinou abnormalitou pankreatických vývodů s maligním potenciálem jsou IPMN (Intraductal Papillary Mucinous Neoplasms). IPMN vycházející z hlavního pankreatického vývodu (Main Duct Type) mají větší maligní potenciál ve srovnání s IPMN z větví pankreatického vývodu (Branch Duct Type). Morfologicky je lze rozdělit mezi žaludeční, intestinální, pankreatobiliární a onkocytické. Přirozený vývoj IPMN, jejich maligní potenciál, naše schopnost tento potenciál predikovat, indikace k chirurgickému řešení či sledování včetně jeho časové strategie jsou doposud kontroverzní. Hlavní indikace k chirurgickému řešení zahrnují přítomnost symptomů, velikost nad 3 cm, původ z hlavního vývodu a přítomnost solidní nodulární složky. Rozhodnutí o léčbě IPMN může však být komplikované dalšími faktory jako např. klinickým stavem pacienta, jeho věkem a komorbiditami [21–23].
Mucinózní cystické nádory (MCN) tvoří 40–50 % všech cystických lézí pankreatu a nekomunikují s pankreatickými vývody. Jsou nejčastěji lokalizované v těle a ocasu, obsahují stroma ovariálního typu a vyskytují se především u žen. Většina z nich obsahuje adenomové struktury a až u jedné třetiny je přítomen duktální adenokarcinom. V jejich diagnostice hraje významnou roli odběr obsahu cystického ložiska ke stanovení CEA [21].
Prevence a screening
Základním preventivním opatřením je eliminace ovlivnitelných rizikových faktorů. To je možné uskutečnit jen u některých z nich jako např. u kouření, obezity, chronického zánětu slinivky etylické etiologie, expozici kancerogenům či do určité míry diabetu. Role diety bohaté na ovoce a zeleninu zůstává nepotvrzená [1–3].
V ideálním případě je cílem screeningu zachytit chorobu v časné neinvazivní fázi, kdy je ještě léčitelná. To u karcinomu pankreatu představuje jedno ze tří prekurzorových stadií. Zachycení choroby ve stadiu již invazivního karcinomu, byť v malé velikosti, představuje většinou pouze malou výhodu ve smyslu dlouhodobé prognózy. Vhodnými pacienty ke screeningu jsou ti, u kterých je riziko karcinomu pankreatu zvýšené, tedy pacienti s hereditární pankreatitidou, Peutz-Jeghersovým, FAMMM nebo BRCA syndromem, příbuzní starší 55 let v rodině s HNPCC či rodiny s familiárním výskytem karcinomu pankreatu [23].
Otázkou zůstává, kdy a jakým způsobem tyto pacienty vyšetřovat. Obecně by měl být screening zahájen dříve než ve věku, ve kterém se průměrně nejčastěji choroba rozvíjí. Incidence karcinomu pankreatu u postižených hereditární pankreatitidou vzrůstá exponenciálně s věkem a je zanedbatelná před 40. rokem. U familiárního karcinomu pankreatu riziko spojené s věkem závisí na věku v čase diagnózy jednotlivých postižených v rámci dané rodiny. U následujících generací je totiž tendence k časnějšímu rozvoji onemocnění. Průměrný věk rozvoje onemocnění je v 6. dekádě, screening by měl začít ve 40 letech anebo o 10 let dříve, než byl věk nejmladšího postiženého v rodině. Postižení Peutz-Jeghers syndromem rozvíjejí karcinom pankreatu ve 3. a 4. dekádě, proto by měli být pravidelně vyšetřováni od 30 let. Prozatím není jasné, jak často rizikové pacienty vyšetřovat, nejčastěji se tak děje v rozmezí 1–3 let [2,10,23,24].
Jednoduchá ideální screeningová metoda pro adenokarcinom pankreatu neexistuje, nejlepší by byla kombinace biomarkeru v plazmě nebo pankreatické šťávě se zobrazovací metodou. Vyšetřování tumor markeru CA19-9 se neukázalo jako efektivní. Nově se snahy upírají k hodnotám postprandiální a lačné glykemie. Ze zobrazovacích metod má pro ložiska v pankreatu vysokou senzitivitu endoskopická sonografie, která nezatěžuje pacienta radiačním zářením, je však invazivní. Magnetická rezonance (MR) je alternativní metoda. Významným problémem screeningových vyšetření je jejich senzitivita, ale také specificita. Falešně pozitivní nález u pacienta, který musí podstoupit duodenopankreatektomii, je problém. Vzhledem k tomu, že naše poznání o screeningu karcinomu pankreatu je stále ve formě klinických studií, které dávají různorodé výsledky, neexistuje jednoznačné doporučení, jak konkrétně u těchto pacientů postupovat [10,23,24].
Klinická manifestace a diagnostika
Karcinom pankreatu se manifestuje ve většině případů v již pokročilém stadiu, kdy nádor infiltruje okolní struktury či metastazuje. Mezi typické symptomy patří dyspepsie, nechutenství, váhový úbytek, bolest či obstrukční ikterus.
Základním vyšetřením v diagnostice karcinomu pankreatu je kvalitně provedené CT břicha. Kvalita zobrazení se s vývojem technologií neustále zlepšuje. Vedle diagnostiky má CT vyšetření asi 80% přesnost v predikci resekability, tedy v určení stadia onemocnění (tab. 1) [14].
1. Staging karcinomu pankreatu. Tab. 1. Pancreatic cancer staging. 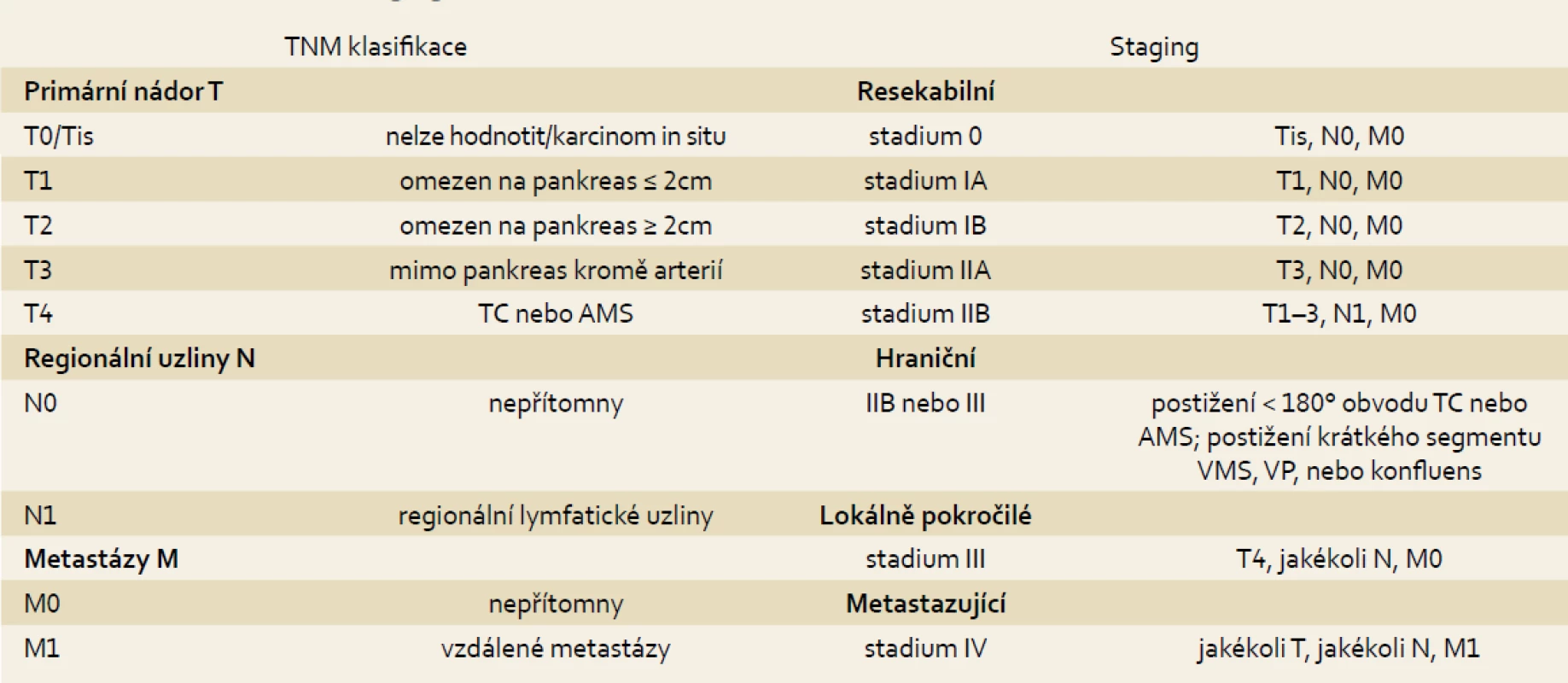
TC – truncus coeliacus; AMS – arteria mesenterica superior; VMS – vena mesenterica superior; VP – vena portae Další vyšetřovací modalitou je endoskopická endosonografie (EUS). Nevýhodou vyšetření je jeho invazivita a výrazná závislost na kvalitě vyšetřujícího. V některých studiích je senzitivita EUS vyšší než CT, především v případě tumorů menších než 2 cm. Výhodou EUS je také vysoká negativní prediktivní hodnota v případě, že vyšetření provádí zkušený endoskopista. Největší výhodou EUS je však možnost odběru materiálu k histopatologickému vyšetření, který je indikován v případě diagnostických nejasností či ke stanovení definitivní diagnózy v případě onkologické léčby. CT a EUS spolu v diagnostice nesoupeří, ale doplňují se [14].
K histopatologické diagnostice lze kromě EUS použít CT navigovanou perkutánní aspiraci či kartáčový odběr materiálu při ERCP ze zúženého vývodu. Výtěžnost druhé uvedené metody je v případě karcinomu pankreatu (extraluminální příčiny stenózy) velmi nízká. V případě vysokého podezření na nádorovné onemocnění, které je resekabilní, není žádný odběr materiálu indikovaný [14].
Doplňujícím vyšetřením v rámci stagingu je RTG či CT hrudníku. PET CT není rutinně k diagnostice karcinomu pankreatu indikováno, může být vhodné v případě sporných nálezů potenciálních metastáz. Rutinní součástí vyšetření je stanovení hodnoty nádorového markeru CA 19-9 v séru, jehož hodnoty korelují s resekabilitou a přežitím [14].
Chirurgická léčba
Rozhodnutí o léčbě by mělo být výsledkem multioborového přístupu zahrnujícího gastroenterologa, radiologa, chirurga a onkologa. Vzhledem k náročnosti a rizikům léčby je součástí rozhodnutí také věk, klinický stav a přání nemocného. Ani pokročilý věk však nemusí být překážkou radikálního chirurgického řešení [25].
Chirurgická léčba představuje jedinou léčebnou modalitu dávající naději na dlouhodobé přežití. Pětileté přežití u pacientů po resekci karcinomu pankreatu je 20–25 %. Pozitivní resekční okraje (R1 a R2 resekce), nízká diferenciace, velikost tumoru a pozitivní nález v uzlinách patří mezi negativní prognostické faktory. Duodenopankreatektomie by měla být rezervována pro centra, která provádějí dostatečný počet výkonů za rok. Za resekabilní nádor považujeme onemocnění bez vzdálených metastáz a arteriální invaze. Resekci portální či horní mezenterické žíly lze považovat za opodstatněnou v případě, že umožní R0 resekci. Nádory lokalizované v distální části pankreatu lze odstranit laparoskopicky [14].
Preoperativní drenáž žlučových cest je kontroverzním tématem. Jednoznačnou indikací je akutní cholangitida, jaterní dysfunkce z obstrukce či symptomy z obstrukce jako svědění. Studie srovnávající pacienty s bilirubinem v séru do 250 µmol/l, kteří buď podstoupili časné chirurgické řešení, nebo předoperační biliární drenáž, ukázala vyšší výskyt komplikací v druhé skupině. Část komplikací endoskopické drenáže lze omezit pomocí zavedení metalických stentů s lepší dlouhodobou průchodností. Tato varianta se nabízí nově také u kandidátů neoadjuvantní terapie [26].
Adjuvantní terapie
Pacienti po resekci většinou vyvinou systémovou (70 %) či lokální (20 %) recidivu. Adjuvantní chemoterapie u pacientů s odstraněným karcinomem pankreatu více než zdvojnásobuje procento přežití. Přežití po resekci bez chemoterapie kolem 10 % se zvyšuje na 25 % s užitím chemoterapie (ESPAC 01, CONKO 001, RTOG-9704). Užití radioterapie je kontroverzní, neboť k průkazu jejího příznivého účinku chybí randomizované kontrolované studie. Naopak studie ESPAC-1 prokázala dokonce horší výsledky u pacientů léčených radioterapií, otázkou nicméně zůstává design studie a způsob a kvalita radioterapie. Radioterapie je tak užívána především v USA. Chemoterapii zahajujeme v průměru za 1–2 měsíce po operaci a spočívá v podání šesti cyklů gemcitabinu či 5-fluorouracilu. Gemcitabin a 5-fluorouracil jsou stejně efektivní, 5-fluorouracil má však více vedlejších účinků (ESPAC-3) [27].
Neoadjuvantní terapie
Z dostupných, avšak nerandomizovaných studií se zdá, že neoadjuvantní terapie nepředstavuje výhodu u neselektovaných pacientů podstupujících resekci pankreatu. Většina studií však nezahrnula dostatečné množství pacientů. Má však potenciál downstagingu u pacientů s primárně hraničně resekabilním nádorem. Současně také dokáže selektovat ty pacienty, kteří rychle progredují, a zabrání tak nežádoucí resekci. Účinnost současné neoadjuvantní terapie není vysoká a spočívá většinou v podání kombinací chemoterapeutik (např. gemcitabin a platina). Je nicméně příslibem do budoucna a předmětem zájmu řady studií, jako např. ESPAC-5 (význam neoadjuvantní chemo - či chemoradioterapie u pacientů indikovaných k resekci) [14,27].
Léčba pokročilého nádoru
Inoperabilní nádory pankreatu jsou buď lokálně pokročilé, či metastazující. Přežití pacientů s lokálně pokročilým nádorem je výrazně lepší než pacientů s metastazujícím (9–15 měsíců vs 3–6 měsíců).
V léčbě lokálně pokročilých nádorů pankreatu lze užít chemoterapii či chemoradioterapii. Chemoradioterapie se vzhledem k lokální pokročilosti nabízí jako vhodné řešení. Metaanalýza studií však prokázala, že chemoradioterapie je lepší než podpůrná léčba, lepší než samotná radioterapie, avšak horší pro svou toxicitu než samotná chemoterapie. Mnoho z provedených studií však nebylo metodologicky optimálních a může se v budoucnu ukázat, že chemoradioterapie má u těchto pacientů svou úlohu, zvláště v případě, kdy ji předchází chemoterapie. Až prospektivní randomizované studie dají definitivní odpověď na tuto otázku.
U pacientů s generalizovaným nádorem je dlouhodobě standardem monoterapie gemcitabinem. Tato léčba prokazatelně mírně zlepšuje přežití. Vedle toho také pozitivně ovlivňuje symptomy nemoci a zlepšuje kvalitu života. Vzhledem k chemorezistenci na gemcitabin a nedostatečnému efektu byla v této indikaci zkoušena řada kombinací léků. V nedávné době se ukázalo, že kombinace FOLFIRINOX (5-fluorouracil, irinotekan, oxaliplatina) je lepší ve srovnání s monoterapií gemcitabinem ve smyslu přežití pacientů. Výskyt nežádoucích účinků byl však vyšší. Užití FOLFIRINOXU je vhodné u pacientů v dobrém klinickém stavu, normálním sérovým bilirubinem a absencí srdeční ischemie [28].
Symptomatická a podpůrná terapie
Symptomatická a podpůrná terapie jsou hlavní a jediné modality léčby pro velkou část pacientů s karcinomem pankreatu. Vzhledem k nedostatečnému efektu kurativní léčby je symptomatická léčba pro většinu pacientů zásadní, neboť umožní bez komplikací a symptomů prožít poslední měsíce života. Důležitými aspekty je zajištění biliární drenáže pomocí biliárních stentů. Užití metalických stentů s delší dobou průchodnosti je výhodou. Jiným cílem je zajištění průchodnosti zažívacího traktu při stenóze duodena. V léčbě této obstrukce se s dobrým efektem užívají metalické duodenální stenty. Nutriční stav pacienta lze podpořit užitím nutničních přípravků, hormonálních preparátů a pankreatické substituce. Klíčovým aspektem je léčba bolesti, při které se uplatňují jednak analgetika, jednak neurolýza truncus coeliacus provedená pod CT či EUS kontrolou.
Racionální/cílená léčba
Racionální terapie znamená využití znalostí konkrétní molekulárně biologické alterace určitého typu nádorového onemocnění k rozvoji nových specifických terapeutických postupů. Vysoký výskyt aktivačních mutací KRAS2 u karcinomu pankreatu dával naději při užití farnesyl transferázových inhibitorů či jiných inibitorů funkce Ras proteinů. Tyto snahy však byly neúspěšné. Alternativně lze využít absolutního biochemického rozdílu mezi nádorovými a nenádorovými buňkami. V tomto případě není důsledkem mutace v nádorových buňkách získání nové funkce, ale její absolutní ztráta v důsledku nepřítomnosti proteinu. Rakovinové buňky obsahující inaktivované geny pak nemohou v důsledku nádorové terapie vyvinout rezistenci. Např. buňky postrádající BRCA2 protein, a tudíž neschopné opravit poškozenou DNA, jsou zvýšeně citlivé k mitomycinu C či jiným preparátům způsobujícím meziřetězcové můstky nebo jiným látkám způsobujícím poškození DNA [29].
Doposud největší pokus o použití cílené léčby u karcinomu pankreatu spočíval v kombinaci gemcitabinu a erlotinibu. Molekulárně biologická podstata je v případě užití inhibitorů EGFR signální dráhy u karcinomu pankreatu sporná, stejně tak byl sporný výsledek. Kombinace přinesla zlepšení přežití o méně než dva týdny [30].
Nezbytnou podmínkou dotýkající se samotného principu cílené léčby je její individualizace. Zdá se, že nestačí charakterizovat nádorové onemocnění na molekulárně biologické úrovni jako celek, ale je nezbytné charakterizovat nádor konkrétního pacienta. Takovouto charakteristiku je možné udělat mutační analýzou, funkčními testy nebo také pomocí vystavení nádorových buněk daného pacienta v ex-vivo modelu spektru chemoterapeutik. Výsledkem je pak chemogram, profil citlivosti a rezistence nádorových buněk pacienta k jednotlivým chemoterapeutikům, analogie antibiotikogramu v případě testování citlovosti infekčního agens k antibiotikům. Tento plán představuje budoucnost onkologické léčby.
Závěr
Navzdory výše uvedenému poznání zůstává karcinom pankreatu onemocněním s mimořádně špatnou prognózou. Prohloubení naší znalosti etiopatogeneze tohoto onemocnění dává největší šanci tuto prognózu ovlivnit. Eliminace rizikových faktorů, včasné rozpoznání prekancerózních lézí a jejich pravidelné sledování či eventuální chirurgické odstranění a především vyvinutí nových terapeutických postupů na základě znalosti genetických a negenetických alterací signálních drah, které řídí proces vzniku a progrese nádoru, dávají naději prognózu tohoto onemocnění ovlivnit.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 9. 2012
Přijato: 4. 10. 2012
MUDr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie, IKEM
Vídeňská 9, Praha 4, 140 21
tomas.hucl@ikem.cz
Sources
1. Lowenfels AB, Maisonneuve P. Epidemiology and risk factors for pancreatic cancer. Best Pract Res Clin Gastroenterol 2006; 20(2): 197–209.
2. Saglova A, Spicak J, Hucl T. Karcinom pankreatu: Molekulární biologie a časná diagnostika. Prak Lék 2010; 90 : 489–493.
3. Raimondi S, Maisonneuve P, Lowenfels AB. Epidemiology of pancreatic cancer: an overview. Nat Rev Gastroenterol Hepatol 2009; 6(12): 699–708.
4. Chari ST, Leibson CL, Rabe KG et al. Pancreatic cancer-associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer. Gastroenterology 2008; 134(1): 95–101.
5. Almoguera C, Shibata D, Forrester K et al. Most human carcinomas of the exocrine pancreas contain mutant c-Kras genes. Cell 1988; 53(4): 549–554.
6. Caldas C, Hahn SA, da Costa LT et al. Frequent somatic mutations and homozygous deletions of the p16 (MTS1) gene in pancreatic adenocarcinoma. Nat Genet 1994; 8(1): 27–32.
7. Schutte M, Hruban RH, Geradts J et al. Abrogation of the Rb/p16 tumor-supressive pathway in virtually all pancreatic carcinomas. Cancer Res 1997; 57(15): 3126–3130.
8. Hanh SA, Schutte M, Hoque AT et al. DPC4, a candidate tumor suppressor gene at human chromosome 18q21.1. Science 1996; 271(5247): 350–353.
9. Goggins M, Shekher M, Turnacioglu K et al. Genetic alterations of the TGF beta receptor genes in pancreatic and biliary adenocarcinomas. Cancer Res 1998; 58(23): 5329–5332.
10. Hucl T. Molekulární patogeneze karcinomu pankreatu. Čes a Slov Ganstroent a Hepatol 2009; 63(2): 58–64.
11. Jones S, Zhang X, Parsons DW et al. Core signaling pathways in human pancreatic cancers revealed by global genomic analyses. Science 2008; 321(5897): 1801–1806.
12. Hucl T, Brody JR, Gallmeir E et al. High cancer-specific expression of mesothelin (MSLN) is attributable to an upstream enhancer containing a transcription enhancer factor dependent MCAT motif. Cancer Res 2007; 67(19): 9055–9065.
13. Zavoral M, Minarikova P, Zavada F et al. Molecular biology of pancreatic cancer. World J Gastroenterol 2011; 17(24): 2897–2908.
14. Vincent A, Herman J, Schulick R et al. Pancreatic cancer. Lancet 2011; 378(9791): 607–620.
15. Olive KP, Jacobetz MA, Davidson CJ et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science 2009; 324(5933): 1457–1461.
16. Thomas AM, Santarsiero LM, Lutz ER et al. Mesothelin-specific CD8(+) T cell responses provide evidence of in vivo cross-priming by antigen-presenting cells in vaccinated pancreatic cancer patients. J Exp Med 2004; 200(3): 297–306.
17. Kern SE, Shibata D. The fuzzy math of solid tumor stem cells. Cancer Res 2007; 67(19): 8985–8988.
18. Hidalgo M, Maitra A. The hedgehog pathway and pancreatic cancer. N Engl J Med 2009; 361(21): 2094–2096.
19. Yachida S, Jones S, Bozic I et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature 2010; 467(7319): 1114–1117.
20. Hruban RH, Adsaz NV, Albores-Saavedra J et al. Pancreatic intraepithelial neoplasia: A new nomenclature and classification system for pancreatic duct lesions. Am J Surg Pathol 2001; 25(5): 579–586.
21. Hruban RH, Maitra A, Kern SE et al. Precursors to pancreatic cancer. Gastroenterol Clin North Am 2007; 36(4): 831–849.
22. Tanaka M, Fernandez-del Castillo C, Adsay V et al. International consensus guidelines 201 for the management of IPMN and MCN of the pancreas. Pancreatology 2012; 12(3): 183–197.
23. Canto MI, Goggins M, Hruban RH et al. Screening for early pancreatic neoplasia in high-risk individuals: a prospective controlled study. Clin Gastroenterol Hepatol 2006; 4(6): 766–781.
24. Canto MI et al. Strategies for Screening for Pancreatic Adenocarcinoma in High-Risk Patients. Semin Oncol 2007; 34(4): 295–302.
25. Oliverius M, Kala Z, Varga M et al. Radical surgery for pancreatic malignancy in the elderly. Pancreatology 2010; 10(4): 499–502.
26. Van der GaaG NA, Rauws EA, van Eijck CH et al. Preoperative biliary drainage for cancer of the head of the pancreas. N Engl J Med 2010; 362(2): 129–137.
27. Laethem JL, Verslype C, Iovanna JL et al. New strategies and designs in pancreatic cancer research: consensus guidelines report from a European expert panel. Ann Oncol 2012; 23(3): 570–576.
28. Conroy T, Desseigne F, Ychou M et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364(19): 1817–1825.
29. Hucl T, Rago C, Gallmeier E et al. A syngeneic variance library for functional annotation of human variation: application to BRCA2. Cancer Res 2008; 68(13): 5023–5030.
30. Moore MJ, Goldstein D, Hamm J et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada clinical trials group. J Clin Oncol 2007; 25(15): 1960–1966.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2012 Issue 5-
All articles in this issue
- Gastrointestinal oncology – near future reality?
- Epidemiology of malignant tumours of the gastrointestinal tract in the Czech Republic – state of the art and prediction
- Reflection on the financial aspects of caring for patients with colorectal carcinoma
- National Colorectal Cancer Screening Program in the Czech Republic – past, presence and future
- Pancreatic cancer
- Endoscopic ablative therapy of the proctosigmoideal neoplastic lesions – a pilot study
- Oesophageal cancer and risk factors by histological type
- Diagnosis and therapy of celiac disease: today and tomorrow
- Non-alcoholic steatohepatitis (NASH) – every physician's concern
- Endoscopy in patients with anticoagulant and antiplatelet therapy
- Guidelines for the administration of aminosalicylatesin patients with inflammatory bowel diseases
- How to improve colorectal cancer screening?
- XXI. Spring Meeting in Loket – advances in the treatment of patients with carcinoma of the pancreas
- Prague Hepatology Meeting 2012
- Prof. MUDr. Aleš Hep, CSc., turned 60
- Budenofalk 2 mg rectal foam represents a major new option in the treatment of patients with ulcerous colitis
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Budenofalk 2 mg rectal foam represents a major new option in the treatment of patients with ulcerous colitis
- Epidemiology of malignant tumours of the gastrointestinal tract in the Czech Republic – state of the art and prediction
- Pancreatic cancer
- Prof. MUDr. Aleš Hep, CSc., turned 60
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

