-
Medical journals
- Career
Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene*
Authors: M. Krůtová; J. Matějková; M. Zajac; P. Hubáček; O. Nyč
Authors‘ workplace: Ústav lékařské mikrobiologie, Univerzita Karlova, 2. lékařská fakulta a Fakultní nemocnice v Motole
Published in: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 2, s. 99-102
Category: Review articles, original papers, case report
*Výsledky této práce byly částečně prezentovány na Kongresu klinické mikrobiologie a infekčního lékařství 2013 v Olomouci.
Overview
Cíl práce:
Porovnání senzitivity a specificity dvou komerčních testů na stanovení Clostridium difficile GDH (glutamát dehydrogenázy) a toxinů A/B.Materiál a metodiky:
Bylo testováno 86 stolic pacientů hospitalizovaných ve FN Motol. GDH a toxiny A/B byly paralelně vyšetřovány dvěma testy: C. difficile Quik Chek Complete®, Techlab,USA) a Liaison® C. difficile GDH a Toxins AαB (DiaSorin USA). Současně byly ze stolic izolovány nukleové kyseliny pomocí UltraClean® Fecal DNA (MoBio Laboratories, USA). Pro metodu PCR byla použita komerční souprava C. difficile Elite MGB® kit (Nanogen, Itálie). Anaerobní kultivace na selektivním médiu pro C. difficile (Oxoid) proběhla u všech vzorků vykazující pozitivitu alespoň jednoho testu. Čisté izoláty byly molekulárně analyzovány ribotypizací.Výsledky:
GDH a toxin A/B negativních oběma metodami bylo 36 vzorků (42 %). GDH a toxin pozitivních oběma metodami bylo 20 vzorků (23 %). GDH pozitivních a toxin negativních oběma metodami, ale PCR pozitivních bylo 9 vzorků (10 %). GDH pozitivních a toxin negativních oběma metodami a PCR negativních bylo 11 vzorků (13 %). GDH pozitivní, toxin pozitivní pouze testem Liaison® bylo 6 vzorků (7 %). GDH pozitivní pouze Liaison® byly 4 vzorky (5 %). K selhání kultivace došlo u 11 vzorků (13), z toho u 7 vzorků byl pozitivní test PCR. PCR reakce byla inhibována v 5 případech (6 %). Zachycené ribotypy toxigenní: AI-3, 001, 002, 012,014, 017, 020, 049, 054, 078, 176, 203, 413 a netoxigenní: AI-34, AI-61, 010, 485, 495, 596.Závěr:
Stanovení toxinu A/B testem Liaison® vykazuje u námi vyšetřeného souboru o 7 % vyšší senzitivitu. Dvoukrokové uspořádání testů také přináší ekonomickou úsporu, která může být využita např. k zavedení PCR metod do diagnostického algoritmu laboratoře.Klíčová slova:
Clostridium difficile – ribotypizace – glutamát dehydrogenáza – toxiny A/B – Quik Chek Complete – LiaisonÚVOD
Clostridium difficile je významným nozokomiálním patogenem současnosti [1, 2]. V České republice dochází k výraznému nárůstu incidence CDI (Clostridium difficile Infection), zejména v souvislosti s ribotypem 176 [3]. Včasná diagnostika CDI je klíčová k zavedení protiepidemických opatření k zábraně šíření infekce a adekvátní terapie pro pacienta [4]. Podle posledních britských doporučení pro diagnostiku a hlášení C. difficile, která vycházejí z testování 12 441 průjmových stolic, je diagnostiku CDI doporučeno provádět ve dvoustupňovém testovacím schématu, které se skládá z průkazu GDH imunoenzymaticky nebo NAAT (Nucleic Acid Amplification Test) či PCR (Polymerase Chain Reaction) a v druhém kroku použití senzitivního imunoenzymatického testu na průkaz toxinu nebo cytotoxický test [5]. Zavedení PCR metod do diagnostiky CDI je evropským trendem, ať jako metody screeningové nebo konfirmační. Tyto metody se vyznačují vysokou senzitivitou a specificitou a významně zkracují čas získání výsledku [6–13]. V naší práci jsme porovnávali senzitivitu a specificitu dvou komerčních metod (imunoenzymatická a imunoluminiscenční metoda) na stanovení antigenu GDH a toxinů A/B. U všech vzorků byl zároveň proveden průkaz DNA toxigenních C. difficile pomocí real-time PCR. Vzorky, které vykazovaly pozitivitu, alespoň jednoho testu, byly kultivovány v anaerobním boxu. Izoláty C. difficile byly dále analyzovány PCR ribotypizací založené na kapilární elektroforéze.
MATERIÁL A METODY
Materiál
Do testování bylo zařazeno 86 tekutých/neformovaných stolic od pacientů s podezřením na klostridiovou infekci hospitalizovaných ve Fakultní nemocnici Motol za období květen až červen 2013.
Metody
Detekce antigenu GDH a toxinu A/B
C. difficile Quik Chek Complete® (Techlab, USA) je rychlý membránový imunoenzymatický test detekující GDH a toxiny A/B v jednom kroku [14–17].
Princip testu: Specifické protilátky (anti GDH, anti toxin A/B, anti peroxidáza) jsou imobilizovány ve třech liniích na membráně. Vzorek je přidán do ředícího roztoku obsahujícího konjugát (monoklonální protilátka specifická pro GDH a polyklonální protilátka specifická pro toxiny A/B, obě značené křenovou peroxidázou). Během 15minutové inkubace dochází k navázání antigenů ve vzorku na konjugát a migraci komplexů antigen-protilátka přes filtrační papír na membránu s imobilizovanými specifickými protilátkami. Po promytí je přidán substrát. Pokud došlo k navázání imunokomplexů antigen-konjugát na protilátku, dojde k zabarvení testovací linie.
Liaison® C. difficile GDH test (DiaSorin, USA)
Je to automatizovaná chemiluminiscenční imunoanalýza sendvičového typu určená k detekci antigenu GDH na přístroji Liaison®.
Princip testu: Vzorek je podle konzistence naředěn dilučním roztokem. Poté je přidán do extrakční zkumavky, vortexován a centrifugován. Během centrifugace dojde k oddělení pevných částí stolice od tekutiny, která je následně analyzována. Takto upravený vzorek je inkubován s paramagnetickými částicemi potaženými monoklonální protilátkou proti GDH a protilátku proti GDH konjugovanou s isoluminolem. Po inkubaci je nenavázaný materiál vymyt v promývacím kroku. Přidáním startovacího roztoku je započata chemiluminiscenční reakce. Světelný signál je v relativních světelných jednotkách (RLU) měřen fotonásobičem. Intenzita signálu je přímo úměrná ke koncentraci antigenu v kalibrátorech, kontrolách a vzorku.
Liaison® C. difficile Toxins AαB test (DiaSorin, USA)
K provedení testu byl použit předpřipravený vzorek (ředění, extrakce) z testování přítomnosti GDH. Na paramagnetických částicích je navázána monoklonální protilátka proti toxinu A a polyklonální protilátka proti toxinu B. Konjugát obsahuje polyklonální protilátky proti toxinu A a B. V tomto testu je první inkubace s konjugátem a poté inkubace s paramagnetickými částicemi. Jinak se princip testu neliší. Oba testy byly provedeny v souladu s manuálem výrobce.
Detekce DNA toxigenních C. difficile pomocí PCR v reálném čase
DNA ze vzorků stolic byla izolována a purifikována pomocí soupravy UltraClean® Fecal DNA (MoBio Laboratories, USA) podle manuálu výrobce. Interní kontrola amplifikace (součást amplifikační soupravy) byla přidána během izolace (po lyzačním kroku). PCR amplifikace byla provedena soupravou C. difficile Elite MGB® kit (Nanogen, Itálie) v souladu s manuálem výrobce. Tato metoda je založená na triplexové amplifikační reakci v reálném čase a obsahuje specifické MGB proby pro detekci genů pro produkci toxinu A, B a interní kontroly.
Anaerobní kultivace
Vzorky stolic byly kultivovány podle standardního operačního postupu pro anaerobní kultivaci C. difficile FN v Motole. Před kultivací byl vzorek vystaven tzv. „alkoholovému šoku“, kdy je vzorek stolice smíchán v poměru 1 : 1 se 70% alkoholem, vortexován a inkubován 30–60 minut při laboratorní teplotě. Dvě kapky suspenze jsou inokulovány na selektivní agar pro C. difficile (Brazier, Oxoid) a anaerobně kultivovány při 35–37 °C, 48–72 hodin. Suspektní kolonie byly konfirmovány pomocí MALDI-ToF hmotnostní spektrometrie (matrix-assisted laser desorption/ionization time-of-flight mass spectrometry) [18].
PCR ribotypizace
PCR ribotypizace následovala po extrakci DNA z kolonie čistého izolátu pomocí chelexových kuliček [19]. PCR probíhala podle standardního operačního protokolu ECDIS-net (European Clostridium difficile infection surveillance network), který je dostupný po přihlášení na http://www.ecdisnet.eu/.
Toxigenita kmene
Toxigenita kmene C. difficile byla určena pomocí multiplexové PCR reakce se specifickými primery pro geny tcdA (toxin A), tcdB (toxin B), cdtA a cdtB, (binární toxin) [20]. Vizualizace amplifikovaných PCR produktů byla provedena elektroforeticky na agarózovém gelu s barvením GelRed.
VÝSLEDKY
Souhrnné výsledky jsou schematicky znázorněny na obrázku 1. Celkem bylo testováno 86 vzorků tekutých/neformovaných stolic od pacientů s podezřením na CDI hospitalizovaných ve FN Motol. GDH a toxin A/B negativních oběma metodami a PCR negativních bylo 36 vzorků (42 %). GDH a toxin pozitivních oběma metodami a PCR pozitivních bylo 20 vzorků (23 %). GDH pozitivních a toxin negativních oběma metodami, ale PCR pozitivních bylo 9 vzorků (10 %). GDH pozitivních a toxin negativních oběma metodami, ale PCR negativních bylo 11 vzorků (13 %). GDH pozitivní, toxin pozitivní a PCR pozitivních pouze Liaison® bylo 6 vzorků (7 %). GDH pozitivní pouze Liaison® byly 4 vzorky (5 %), z toho u 2 vzorků byla PCR pozitivita. K selhání kultivace došlo u 11 vzorků (13 %), z toho u 9 vzorků byl pozitivní test PCR. PCR reakce byla inhibována v 5 případech (6 %). Po opakované izolaci DNA ze stolice nedošlo k opakované inhibici PCR reakce. Zachycené ribotypy toxigenní: AI-3, 001, 002, 012,014, 017, 020, 049, 054, 078, 176, 203, 413 a netoxigenní: AI-34, AI-61, 010, 485, 495, 596.
Image 1. Výsledky porovnávací studie testů Quik Chek Complete<sup>®</sup>, Liaison<sup>®</sup> s konfirmací Real-Time PCR <em>C. difficile</em> Elite MGB<sup>®</sup> a kultivace s následnou ribotypizací kmene Vysvětlivky: PCR – polymerázová řetězová reakce, GDH – glutamát dehydrogenáza Fig 1. Results of the comparative study of the C. difficile Quik Chek Complete<sup>®</sup> test and Liaison<sup>®</sup> <em>C. difficile</em> GDH and Toxins AαB test with confirmation by Real-Time PCR <em>C. difficile</em> Elite MGB<sup>®</sup>test and culture followed by PCR ribotyping Note: PCR – polymerase chain reaction, GDH – glutamate dehydrogenase 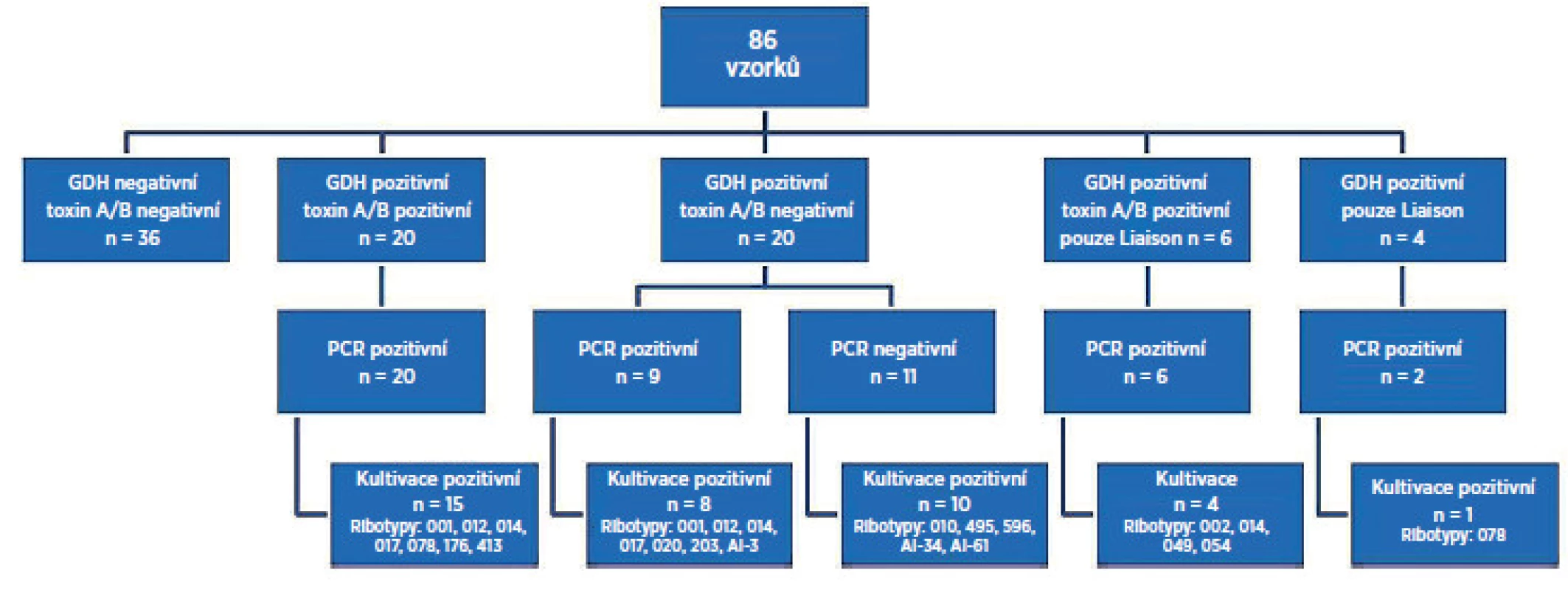
DISKUSE
Výsledky naší srovnávací studie ukazují, že průkaz C. difficile toxinu A/B na přístroji Liaison® vykazuje vyšší senzitivitu o 7 % ve srovnání s druhou testovanou metodou a test Liaison® C. difficile GDH o 5 % oproti testu C. difficile Quik Chek Complete®. Tento fakt si vysvětlujeme v rozdílném principu testu. Quik Chek Complete® test je metodou imunoenzymatickou, kdy detekce probíhá na imobilizovaných protilátkách na membráně, zatímco testy Liaison® C. difficile GDH a toxin A/B jsou metodami chemiluminiscenčními a protilátka je navázaná na paramagnetické kuličce, tudíž poskytuje větší povrch pro navázání případného antigenu. Výsledkem chemiluminiscenční reakce je světelný signál měřený fotonásobičem, citlivým detektorem schopným zachytit i slabé světelné signály. Intenzita signálu je přímo úměrná koncentraci analytu ve vzorku. U testu Quik Chek Complete® je hodnocení testu prováděno vizuálně. Výhodu dvoukrokového testu firmy DiaSorin vidíme především v možné ekonomické úspoře u GDH negativních vzorků, vycházíme z vysoké negativní prediktivní hodnoty GDH. GDH negativní vzorky je možno interpretovat jako definitivně negativní na přítomnost C. difficile a není třeba testovat na přítomnost toxinů A/B.
V našem souboru vzorků se jednalo o 36 vzorků (42 %). Pozitivita GDH při negativitě toxinů A, B může znamenat přítomnost netoxigenního kmene C. difficile, ale nevylučuje ani přítomnost toxigenního kmene, kdy je třeba vycházet ze skutečnosti, že žádný z doposud užívaných imunochemických testů pro přímý průkaz toxinů A a B, nedosahuje zcela spolehlivou senzitivitu. Navíc se může vyskytnout zkřížená reaktivita testu GDH s jinými klostridii. Je proto vhodné a v klinické praxi často potřebné další doplňující vyšetření – v našem případě PCR cílené na průkaz genů kódujících produkci toxinů. K selhání kultivace u 11 vzorků došlo zřejmě z důvodů přechodně vzniklé nedostatečné anaerobiózy. Spektrum zachycených ribotypů z kultivovaných kmenů C. difficile odpovídá spektru ribotypů vyskytujících se v ČR. Vycházíme z výsledků PCR ribotypizace cca 200 kmenů v roce 2012. Implementaci molekulárních metod do diagnostiky CDI považujeme za přínosnou, zvláště jako metodu konfirmační u GDH pozitivních vzorků. Náklady na diagnostický set C. difficile Elite MGB® dodávaný firmou Elisabeth Pharmacon jsou poloviční než u komerčních uzavřených systémů, nicméně je nutná předchozí izolace nukleových kyselin a s tím související vybavení a zaškolený personál laboratoře. Součástí každé testované série musí být přítomna pozitivní a negativní kontrola testu, proto je ekonomicky výhodnější testovat více vzorků najednou. Interní kontrola testu je součástí soupravy a přidává se během extrakce nukleových kyselin ze vzorku. Během našeho testování jsme zaznamenali inhibici PCR reakce v 5 případech. Bez přítomnosti interní kontroly v testu by byl vydán falešně negativní výsledek.
ZÁVĚR
Hledání optimální metody či spolehlivého algoritmu kombinujícího několik přístupů v laboratorní diagnostice CDI je stále předmětem odborných diskusí. Kromě toho se objevují stále nové komerční testy se snahou dosáhnout vysoké spolehlivosti. Diagnostické testy Liaison® C. difficile GDH, toxin A/B, (Diasorin, USA) v našem sledování potvrdily vysokou senzitivitu. Implementace přímého průkazu DNA toxigenních C. difficile amplifikací nukleových kyselin nesporně přispívá k urychlení a zkvalitnění diagnostiky CDI jako doplňující nebo konfirmační metoda u GDH pozitivních, toxin negativních vzorků. Vyšší cena PCR vyšetření, může být do jisté míry kompenzována úsporou za neprovedená stanovení toxinů u GDH negativních vzorků. Rychlá a spolehlivá detekce C. difficile má kromě vlastního benefitu pro pacienta (omezení progrese infekce a rozvoje závažných komplikací, snížení počtu následných rekurencí) i významný epidemiologický aspekt spočívající v možnosti včasné prevence šíření C. difficile na další vnímavé jedince.
Podpora: Diagnostické soupravy byly dodány firmami DiaSorin, Elisabeth Pharmacon. Kultivace a PCR ribotypizace byly podpořeny granty: MZ ČR – RVO, FN v Motole 00064203 a MZ ČR IGA NT/14209–3.
Do redakce došlo dne 27. 11. 2013.
Adresa pro korespondenci:
Mgr. Marcela Krůtová
Ústav lékařské mikrobiologie
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: marcela.krutova@seznam.cz
Sources
1. Bauer MP, Notermans DW, van Benthem BH, Brazier JS et. al. ECDIS Study Group. Clostridium difficile infection in Europe: a hospital-based survey. Lancet, 2011; Jan 1, 377(9759):63–73.
2. He M, Miyajima F, Roberts P, Ellison L et al. Emergence and global spread of epidemic healthcare-associated Clostridium difficile. Nat Genet, 2013;45 : 109–113.
3. Nyč O, Pituch H, Matějková J, Obuch-Woszczatynski P, Kuijper EJ. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet, 2011; Apr 23;377(9775):1407.
4. Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol, 2009;7 : 526–536.
5. Department of Health. Updated guidance on the diagnosis and reporting of Clostridium difficile, 6 March 2012. Dostupný na: http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAndGuidance/DH_132927 (last accessed 4 May 2012)
6. Belanger SD, Boissinot M, Clairoux N, Picard FJ, Bergeron MG. Rapid detection of Clostridium difficile in feces by real-time PCR. J Clin Microbiol, 2003;41 : 730–734.
7. Peterson LR, Manson RU, Paule SM, Hacek DM, Robicsek A, Thomson RB, Jr, Kaul KL. Detection of toxigenic Clostridium difficile in stool samples by real-time polymerase chain reaction for the diagnosis of C. difficile-associated diarrhea. Clin Infect Dis, 2007;45 : 1152–1160.
8. Barbut F, Braun M, Burghoffer B, Lalande V, Eckert C. Rapid detection of toxigenic strains of Clostridium difficile in diarrheal stools by real-time PCR. J Clin Microbiol, 2009;47 : 1276–1277.
9. Stamper PD, Babiker W, Alcabasa R, Aird D et. al. Evaluation of a new commercial TaqMan PCR assay for direct detection of the Clostridium difficile toxin B gene in clinical stool specimens. J Clin Microbiol, 2009;47 : 3846–3850.
10. Terhes G, Urban E, Soki J, Nacsa E, Nagy E. Comparison of a rapid molecular method, the BD GeneOhm Cdiff assay, to the most frequently used laboratory tests for detection of toxin-producing Clostridium difficile in diarrheal feces. J Clin Microbiol, 2009;47 : 3478–3481.
11. Goldenberg SD, Dieringer T, French GL. Detection of toxigenic Clostridium difficile in diarrheal stools by rapid real-time polymerase chain reaction. Diagn Microbiol Infect Dis, 2010;67 : 304–307.
12. de Jong E, de Jong AS, Bartels CJ, van der Rijt-van den Biggelaar C et. al. Clinical and laboratory evaluation of a real-time PCR for Clostridium difficile toxin A and B genes. Eur J Clin Microbiol Infect Dis, 2012;31 : 2219–2225.
13. Le Guern R, Herwegh S, Grandbastien B, Courcol R, Wallet F. Evaluation of a new molecular test, the BD Max Cdiff, for detection of toxigenic Clostridium difficile in fecal samples. J Clin Microbiol, 2012;50 : 3089–3090.
14. Quinn CD, Sefers SE, Babiker W, He Y et. al. C. Diff Quik Chek complete enzyme immunoassay provides a reliable first-line method for detection of Clostridium difficile in stool specimens. J Clin Microbiol, 2010;48(2):603–605.
15. Sharp SE, Ruden LO, Pohl JC, Hatcher PA et. al. Evaluation of the C.Diff Quik Chek Complete Assay, a new glutamate dehydrogenase and A/B toxin combination lateral flow assay for use in rapid, simple diagnosis of clostridium difficile disease. J Clin Microbiol, 2010;48(6):2082–20826.
16. Kawada M, Annaka M, Kato H, Shibasaki S et. al. Evaluation of a simultaneous detection kit for the glutamate dehydrogenase antigen and toxin A/B in feces for diagnosis of Clostridium difficile infection. J Infect Chemother, 2011;17(6):807–811.
17. Orellana-Miguel MA, Alcolea-Medina A, Barrado-Blanco L, Rodriguez-Otero J, Chaves-Sánchez F. Algorithm proposal based on the C. Diff Quik Chek Complete ICT device for detecting Clostridium difficile infection. Enferm Infecc Microbiol Clin, 2013;31(2):97-9.
18. Coltella L, Mancinelli L, Onori M, Lucignano B et. al. Advancement in the routine identification of anaerobic bacteria by MALDI-TOF mass spectrometry. Eur J Clin Microbiol Infect Dis, 2013;32(9):1183–1192.
19. Valiente E, Dawson LF, Cairns MD, Stabler RA, Wren BW. Emergence of new PCR ribotypes from the hypervirulent Clostridium difficile 027 lineage. Journal of Medical Microbiology, 2012;61 : 49–56.
20. Persson S, Torpdahl M, Olsen KEP. New multiplex PCR method for the detection of Clostridium difficile toxin A (tcdA) and toxin B (tcdB) and the binary toxin (cdtA/cdtB) genes applied to a Danish strain collection. Clinical Microbiology and Infection, 2008;14 : 1057–1064.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2014 Issue 2-
All articles in this issue
- Fylogenetická a molekulární analýza virů chřipky A/H1N1pdm izolovaných v epidemické sezoně 2012/2013 od pacientů hospitalizovaných s příznaky ILI
- Růst prevalence syfilis u žen ve východočeském regionu – 30 let sledování
- Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene*
- Bodové prevalenčné sledovanie nozokomiálnych nákaz na Slovensku – súčasť projektu Európskej únie
- Nozokomiální přenos listeriózy
- Diverzita humánních izolátů salmonel v Jihomoravském kraji v letech 2009–2012
- Výskyt Candida dubliniensis v klinickém materiálu a možnosti její identifikace
- Přirozené protilátky proti α(1,3) galaktosylovému epitopu v séru nemocných s maligními nádory
- CDT toxíny
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Očekávané pokrytí kmenů novou proteinovou meningokokovou vakcínou v České republice
- Post-mortem analýza průlomové infekce Candida albicans při léčbě echinokandiny u pacienta po transplantaci kmenových buněk krvetvorby
- Virové gastroenteritidy v regionu východních Čech
- Studie o výskytu protilátek viru hepatitidy E ve dvou oblastech České republiky
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výskyt Candida dubliniensis v klinickém materiálu a možnosti její identifikace
- Bodové prevalenčné sledovanie nozokomiálnych nákaz na Slovensku – súčasť projektu Európskej únie
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene*
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

