-
Medical journals
- Career
50 rokov od objavu hemoglobínu HbA1c
Authors: Jozef Čársky
Authors‘ workplace: Ústav lekárskej chémie, biochémie a klinickej biochémie, LF UK, Bratislava
Published in: Diab Obez 2019; 19(38): 84-89
Overview
V roku 1968 iránsky imunológ Samuel Rahbar publikoval náhodné zistenie minoritnej zložky ľudského hemoglobínu (HbA1c) u diabetikov. Jeho nález otvoril široký priestor pre výskum s hlavnými výsledkami: glykohemoglobín HbA1c sa stal v klinickej praxi objektívnym ukazovateľom metabolickej kompenzácie pri diabetes mellitus a štúdium zložitého procesu glykácie biomolekúl vyústilo do poznávania molekulového mechanizmu patogenézy chronických diabetických komplikácií a hľadania možností jeho ovplyvnenia.
Klíčová slova:
glykácia – hemoglobín HbA1c – patogenéza chronických diabetických komplikácií
Úvod
Uplynulo 50 rokov, keď Samuel Rahbar (obr. 1), imunológ univerzitnej nemocnice v Teheráne, uverejnil v medzinárodnom odbornom periodiku Clinica Chimica Acta prácu pod názvom „Abnormálny hemoglobín v červených krvinkách diabetikov“ [1]. V relatívne stručnej publikácii prezentoval náhodný laboratórny nález zistený pri rutinnej elektroforéznej analýze krvných vzoriek na prítomnosť patologických hemoglobínov v iránskej populácii. V súbore 1 200 vyšetrených pacientov sa mu ukázala v dvoch vzorkách výraznejšia, rýchlejšie sa pohybujúca „anomálna“ hemoglobínová zložka. V následnom pátraní zistil, že v obidvoch prípadoch išlo o pacientov s diabetes mellitus. Nevšedný nález si nechal pre istotu overiť v laboratóriu na Univerzite v Cambridge. V ďalšom, už cielenom výskume, ktorý realizoval v Department of Medicine na Albert Einstein College v USA (v spolupráci s prof. Helen M. Ranneyovou, odborníčkou v problematike patologických hemoglobínov), sa dokázal jednoznačný vzťah zisteného „anomálneho“ hemoglobínu k diabetu, ktorý sa potvrdil aj v experimentálnych podmienkach [2]. Existencia tejto zložky bola však konštatovaná už skôr ako minoritná, zapadajúca do „chromatografickej heterogenity“ normálneho adultného ľudského hemoglobínu HbA. Podľa vzdialenosti od štartu bola označená na chromatograme ako „c“, v súbore „1“ týchto minorít – HbA1c [3].
Image 1. Samuel Rahbar, M.D., Ph.D. 
Výskum štruktúrnej modifikácie HbA1c
Výskumom štruktúrnej modifikácie HbA1c sa zistilo, že vzniká chemickou (neenzýmovou) väzbou glukózy na molekulu hemoglobínu HbA. Kvantifikácia jeho tvorby závisí od koncentrácie a doby pôsobenia glukózy, preto je zrejmé, že sa nachádza v nízkom zastúpení aj v krvi nediabetikov. Reakcia prebieha ako dvojstupňový proces [4,5]. V prvom, rýchlejšom a vratnom stupni sa tvorí Schiffova zásada, ktorá prechádza Amadoriho molekulovým prešmykom na stabilnú aldimínovú (fruktozamínovú) formu (obr. 2):
Image 2. Amadoriho produkt (fruktozamín) 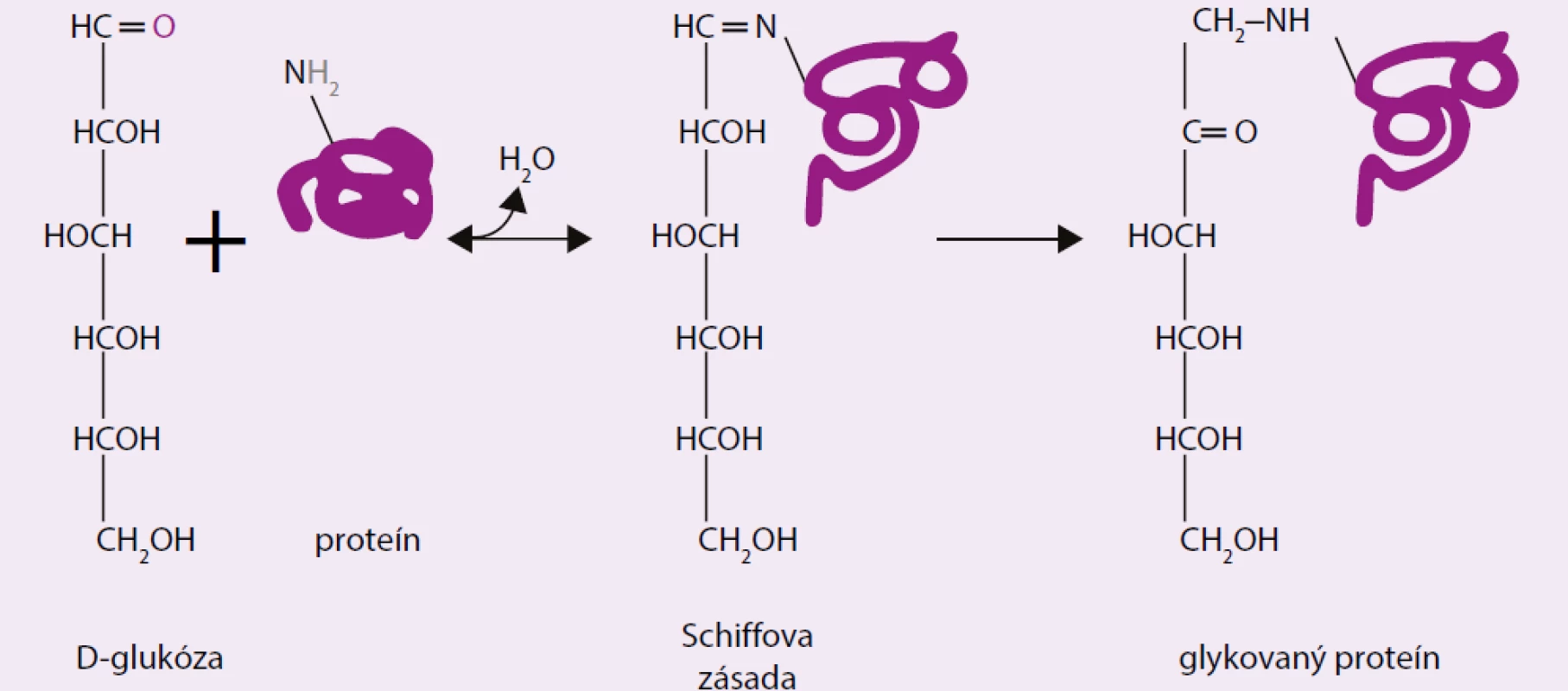
Väzbovým miestom glukózy v tetramérnej molekule hemoglobínu sú N-terminálne aminoskupiny polypeptidových β-reťazcov [6]. Ide o funkčne významné miesta, v ktorých dochádza k iónovej interakcii s alosterickým efektorom 2,3-bisfosfoglycerátom (BPG), pri ktorej nastáva vratná konformačná zmena molekuly hemoglobínu z napnutého T-stavu (z angl. tight), na relaxovaný R-stav so slabšou afinitou ku kyslíku (posun oxygenačnej izotermy doprava). Výsledkom je uvoľnenie väčšieho množstva kyslíka do tkanív. Trvalé obsadenie väzbového miesta pre BPG glukózou znamená nepriaznivé zníženie transportnej schopnosti hemoglobínu [7,8].
Klinický význam HbA1c
Objav HbA1c otvoril priestor pre mimoriadne široký výskum zameraný spočiatku na jeho využitie v klinickej praxi ako objektívny ukazovateľ dlhodobej metabolickej kompenzácie a efektívnosti liečby u diabetikov. Hodnotu HbA1c pri vyšetrení neovplyvňuje aplikácia inzulínu, príjem potravy, ani fyzická a psychická záťaž [9–11]. Neskôr sa ako krátkodobý ukazovateľ uplatnilo v klinickej praxi aj stanovenie glukózou modifikovaných plazmových proteínov s ich kratším polčasom obratu – fruktozamínový test [12].
Výskum pokročilej glykácie
Pribúdaním nových poznatkov sa výskum glykácie postupne sústredil na neenzýmovú (chemickú) väzbu glukózy aj na iné proteíny ako hemoglobín – všeobecne na jej vzťah k molekulovému mechanizmu patogenézy chronických diabetických komplikácií. Ukázalo sa, že sacharidová štruktúrna modifikácia postihuje patologicky nielen hemoglobín, ale aj ďalšie biomolekuly – proteíny, lipoproteíny, DNA a iné. Naviac, okrem glukózy sa týka aj ďalších redukujúcich monosacharidov (fruktóza, manóza a iné) a ich derivátov. Glykácia prebieha ako zložitý proces následných a paralelných chemických reakcií spojených s tvorbou reaktívnych voľných radikálov (oxidačný stres) a sekundárnych nesacharidových karbonylových štruktúr (karbonylový stres) vyúsťujúci do tvorby koncových produktov pokročilej glykácie (Advanced Glycation End products – AGEs) [13–20]. Ich patologické pôsobenie môže byť priame – trvalá modifikácia molekulových štruktúr a následná zmena funkčných vlastností extracelulárneho matrixu, alebo pôsobením špecifického receptora, ktorý zabezpečuje interakciu AGEs s bunkami organizmu. Identifikovalo sa viacero takýchto receptorov – AGE-R1, AGE-R2, AGE-R3, ale najviac je preskúmaný multifunkčný receptor RAGE, patriaci do veľkorodiny imunoglobulínov. Zistilo sa, že jeho aktiváciou sa realizuje účinok AGEs v patogenéze chronických diabetických komplikácií, vrátane oxidačného stresu a zápalových procesov (obr. 3) [21–23].
Image 3. Účinok AGEs v patogenéze chronických diabetických komplikácií 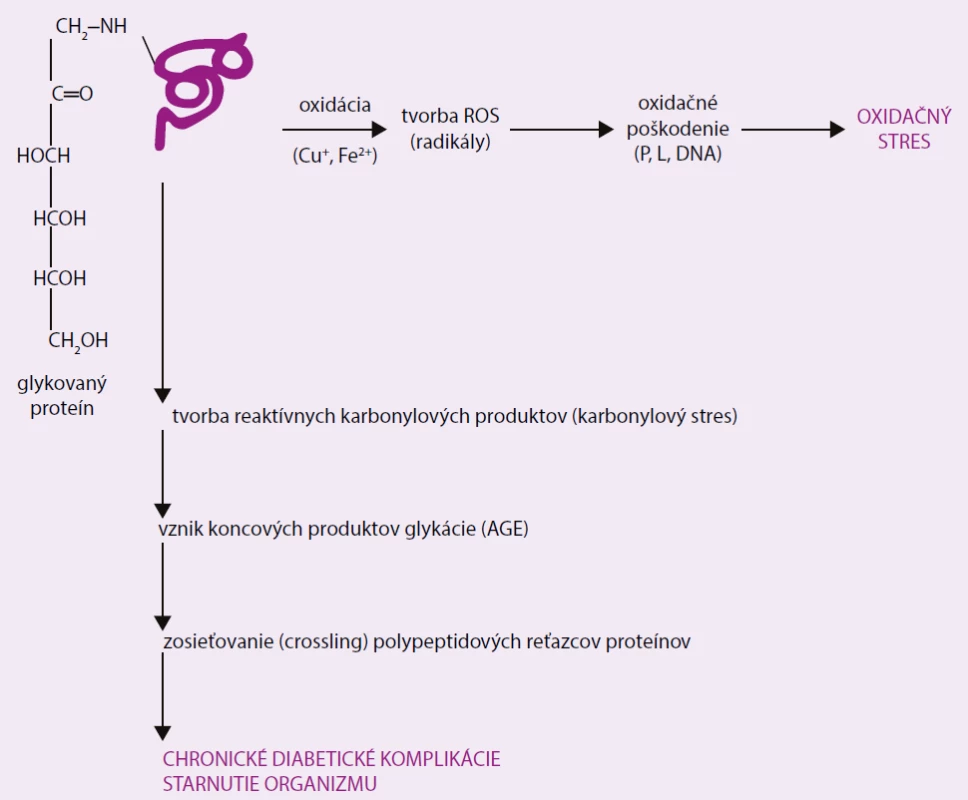
Na základe vyššie konštatovaných poznatkov výskumu sa ukazuje, že zložitý chemizmus glykácie je súčasťou molekulového mechanizmu patogenézy chronických diabetických komplikácií, a predpokladá sa jeho aktuálnosť aj v procese starnutia organizmu. Vychádzajúc z chemickej podstaty glykácie možno v jej procesoch predpokladať reálnosť biologickej aplikácie Maillardovej reakcie sacharidov s aminokyselinami a proteínmi, zistenej ešte v r. 1912 a označovanej aj ako „reakcia hnednutia“, ktorá je dlhodobo predmetom výskumu v odbore potravinárskej chémie [24–27].
Aktuálnosť HbA1c a výskum glykácie na Slovensku
Na Slovensku iniciovala záujem o HbA1c prof. MUDr. D. Michalková, DrSc. (1. detská klinika Detskej fakultnej nemocnice v Bratislave), obr. 4. Skoro po zverejnení prvých informácií v medzinárodných periodikách o predpokladanom klinickom význame HbA1c [28–30], boli prezentované v spolupráci s Ústavom lekárskej chémie LF UK prvé vlastné výsledky klinickej aplikácie nového markera (už v r. 1980–1983) – na odborných seminároch a pracovných dňoch Slovenskej diabetologickej spoločnosti a Slovenskej lekárskej spoločnosti, a na Diabetologických dňoch v Luhačoviciach. Neskôr to boli aj Diabetologicko-biochemické dni v Bardejovských Kúpeľoch a Vedecké konferencie v Topoľčiankach venované pamiatke prof. MUDr. Rudolfa Korca, DrSc., veľkého propagátora HbA1c. Prvé práce v domácich vedeckých periodikách vyšli v r. 1982 [31,32]. Výskum bol spočiatku zameraný na hodnotenie klinického významu HbA1c s uplatnením, resp. modifikáciou laboratórneho fotometrického stanovenia založeného na meraní viazanej glukózy na hemoglobín [4], neskôr chromatografickej analýzy. Záujem o HbA1c postupne prechádzal aj na iné klinické pracoviská – 1. a 2. internú kliniku a 1. neurologickú kliniku FN v Bratislave.
Image 4. Prof. MUDr. D. Michalková, DrSc. (1. detská klinika Detskej fakultnej nemocnice v Bratislave) 
Paralelne s uvedenými bratislavskými pracoviskami sa prejavoval klinický i výskumný záujem o HbA1c aj na Lekárskej fakulte Univerzity P. J. Šafárika v Košiciach, ktorý bol koordinovaný na Ústave patologickej fyziológie pod vedením prof. MUDr. O. Rácza, CSc. Tento ústav sa zúčastňoval na organizovaní pravidelných (I.–IV.) „Diabetologicko-biochemických dní“ Slovenskej diabetologickej spoločnosti, ktoré sa konali v 2-ročných odstupoch v Bardejovských Kúpeľoch (v r. 1987–1993), na ktorých mala problematika glykohemoglobínu a glykácie plazmových proteínov (fruktozamínový test) významné zastúpenie. V r. 1983 zorganizoval tento ústav monotematické pracovné dni na tému Glykozylovaný hemoglobín a r. 2004 seminár Glykovaný hemoglobín – HbA1c, pod záštitou viacerých odborných spoločností. Pod autorstvom košického kolektívu vyšlo v r. 1989 monografické spracovanie problematiky HbA1c a glykácie proteínov [33].
Štúdium možnosti ovplyvnenia procesu glykácie
Záujem o glykovaný hemoglobín HbA1c postupne prechádzal do základného výskumu glykácie – molekulového mechanizmu vývoja chronických diabetických komplikácií, s hľadaním možností jeho ovplyvnenia syntetickými alebo prírodnými látkami s antiglykačnými, antioxidačnými a chelátotvornými vlastnosťami (vychytávanie kovových iónov katalyzujúcich tvorbu voľných radikálov). Z tohto hľadiska bol medzinárodne mimoriadne intenzívne sledovaný aminoguanidín [34], u ktorého sa však zistili aj toxické vlastnosti [35]. K početným skúmaným inhibítorom glykácie prispel aj sám objaviteľ hemoglobínu HbA1c S. Rahbar [36]. Na bratislavskom ústave LF UK sa venoval v tomto zameraní značný výskumný priestor – experimentálne testovanie kondenzačného derivátu aminoguanidínu – rezorcylidénaminoguanidín (RAG), ktorý vykazoval rovnaký antiglykačný potenciál ako voľný aminoguanidín, ale bez toxických účinkov, naviac s prejavom aj antioxidačných, chelátotvorných a iných pozitívnych vlastností [37,38]. Analogickým derivátom je pyridoxylidénaminoguanidín – kondenzát aminoguanidínu s pyridoxálom (zložkou vitamínu B6), testovaný japonskými autormi [39].
Vyššie naznačený výskum, spojený s riešením početných výskumných úloh v širokej domácej a zahraničnej spolupráci, vyústil na Ústave lekárskej chémie, biochémie a klinickej biochémie LF UK v Bratislave do vedeckej školy v danej problematike, ako základne pre školenie diplomandov a postgraduálnych doktorandov z viacerých fakúlt UK (aj zo zahraničia) a univerzitných kliník LF.
Z celkového počtu približne 100 prác venovaných HbA1c a problematike glykácie, publikovaných v domácich a zahraničných odborných periodikách, k 10 najcitovanejším prácam (v r. 2018) podľa SCI patria [42–51].
Záver
Rahbarov objav sa považuje z hľadiska zdokonalenia diagnostiky a manažmentu diabetu za revolučný. Ako laboratórny test bol prvýkrát použitý v r. 1977. Komerčne vyrábaný (imunoanalytický test, RIA) bol dostupný v r. 1991.
Americká diabetologická asociácia (ADA) ocenila v r. 2012 Samuela Rahbara (krátko pred jeho smrťou) udelením, po ňom pomenovanej národnej ceny za vedecký prínos Samuel Rahbar Outstanding Discovery Award – objaviteľa hemoglobínu HbA1c – markera monitorovania glykemického statusu, markera prevencie vzniku chronických diabetických komplikácií markera kvality manažmentu liečby miliónov diabetikov na celom svete.
Hemoglobín HbA1c otvoril cestu k intenzívnemu výskumu neenzýmovej chémie v biologických systémoch, ktorý pokračuje doteraz [40,41].
Doručené do redakcie 7. 10. 2019
prof. RNDr. Jozef Čársky, CSc.,
emeritný profesor
Sources
- Rahbar S. An abnormal hemoglobin in red cells of diabetics. Clin Chim Acta 1968; 22(2): 296–298. Dostupné z DOI: <http://dx.doi.org/10.1016/0009–8981(68)90372–0>.
- Rahbar S, Blumenfeld O, Ranney HM. Studies of an unusual hemoglobin in patients with diabetes mellitus. Biochem Biophys Res Commun 1969; 36(5): 838–843. Dostupné z DOI: <http://dx.doi.org/10.1016/0006–291x(69)90685–8>.
- Allen DW, Schroeder WA, Balog J. Observation on the chromatographic heterogenity of normal adult and fetal human hemoglobin. J Am Chem Soc 1958; 80(7): 1628–1634. Dostupné z DOI: <https://doi.org/10.1021/ja01540a030>.
- Flückiger R, Winterhalter KH. In vitro synthesis of hemoglobin HbA1c. FEBS Lett 1976; 71 : 356–360. Dostupné z DOI: <http://dx.doi.org/10.1016/0014–5793(76)80969–6>.
- Bunn HF, Haney DN, Kamin S et al. The biosynthesis of human hemoglobin A1c. J Clin Inves. 1976; 57(6): 1652–1659. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI108436>.
- Bunn HF, Haney DN, Gabbay KH et al. Further identification of the nature and linkage of the carbohydrate in hemoglobin A1c. Biochem Biophys Res Commun 1975; 67(1): 103–109. Dostupné z DOI: <http://dx.doi.org/10.1016/0006–291x(75)90289–2>.
- Ditzel J, Standl E. The problem of tissue oxygenation in diabetes mellitus. Acta Med Scand 1975; 578(Suppl): 49–83.
- Coletta M, Amiconi G, Bellelli A et al. Alteration of T-state Binding Properties of naturally glycated Hemoglobin HbA1c. J Biol Chem 1988; 203 : 233–239.
- Koenig RJ, Peterson CM, Jones RL et al. Correlation of glucose regulation and hemoglobin AIc in diabetes mellitus. N Engl J Med 1976; 295(8): 417–420. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM197608192950804>.
- [UK Prospective Diabetes Studium]. Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352(9131): 837–853. Erratum in Lancet 1999; 354(9178): 602.
- Thornalley P. The clinical significance of glycation. Clin Lab 1999; 45 : 263–273.
- Johnson RN, Metcalf PA, Baker JR. Fructosamine: a new approach to the estimation of serum glycosyl-protein. An index of diabetic control. Clin Chim Acta 1983; 127(1): 87–95. Dostupné z DOI: <http://dx.doi.org/10.1016/0009–8981(83)90078–5>.
- Baynes JW. Role of oxidative stress in development of complication in diabetes. Diabetes 1991; 40(4): 205–212. Dostupné z DOI: <http://dx.doi.org/10.2337/diab.40.4.405>.
- Hunt JV, Wolff SP. Oxidative glycation and free radical production: A causal mechanism of diabetic complications. Free Radic Res Commun 1991; 12–13(Pt 1): 115–123.
- Wolff SP. Free radicals and glycation theory. In: Ikan R (ed). The Maillard reaction/consequence for the chemical and life sciences. J. Wiley: New York 2006 : 74–88. ISBN 9780471963004.
- Brownlee M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes 2005; 54(6): 1615–1625. Dostupné z DOI: <http://dx.doi.org/10.2337/diabetes.54.6.1615>.
- Rácz O, Šipulová A. Patogenéza chronických diabetických komplikácií. In: Kreze A, Langer P, Klimeš I et al (eds). Všeobecná a klinická endokrinológia. Academic Electronic Press: Bratislava 2004 : 654–660.
- Čársky J. Mitochondrial Diabetology. In: Gvozdjáková A (ed.). Mitochondrial Medicine – Mitochondrial Metabolism, Diseases, Diagnosis and Therapy. Springer Science 2008 : 129–147. ISBN 978–1–4020–6713–6.
- Jakus V, Cársky J, Hrnciarová M. Význam koncových produktov pokročilej glykácie – AGE produktov. Bratisl lek Listy 1998; 99(7): 368–375.
- Čársky J. Voľné radikály a diabetes mellitus. In: Z. Ďuračková Ľ, Bergendi J, Čársky (eds). Voľné radikály a antioxidanty v medicíne. Slovak Academic Press: Bratislava 1999 : 177 - 202. ISBN 80–88908–46–9.
- Schmidt AM, Hori O, Cao R et al. RAGE: A novel cellular receptor for advanced glycation end products. Diabetes 1996; 45(Suppl 3): S77-S80. Dostupné z DOI: <http://dx.doi.org/10.2337/diab.45.3.s77>.
- Yan SD, Stern D, Schmidt AM. What´s the RAGE ? The receptor for advanced glycation end products (AGE) and the dark side of glucose. Eur J Clin Invest 1997; 27(3): 179–181. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1365–2362.1996.00072.x>.
- Čársky J. Glykácia proteínov a diabetes mellitus. In: Ferenčík, M. (ed.): Zápal – fundamentálny princíp vzniku chorôb. Balneotherma: Bratislava 2009 : 192–199. ISBN 978–80–970156–1–9.
- Maillard IC. Action des acides aminés sur les sucres: formation des mélanoidines par voie méthodique. C R Hebd Séances Acad Sci 1912; 154 : 66–68.
- Monnier VM, Cerami A. Nonenzymatic glycosylation and browning of proteins in vivo. In: Maillard reaction in foods and nutrition. ACS Symposium Series; American Chemical Society: Washington, DC: 1983; 215 : 431–449. Dostupné z DOI: <http://doi 10.1021/bk-1983–0215.ch023>.
- Monnier VM, Cerami A. Detection of nonenzymatic browning products in human lens. Biochem Biophys Acta 1983; 760(1): 97–103. Dostupné z DOI: <http://dx.doi.org/10.1016/0304–4165(83)90129–0>.
- Tessier FJ. The Maillard reaction in the human body. The main discoveries and factors that affect glycation. Pathol Biol (Paris) 2010; 58(3): 214–219. Dostupné z DOI: <http://dx.doi.org/10.1016/j.patbio.2009.09.014>.
- Trivelli LA, Ranney HM, Lai HT. Hemoglobin components in patients with diabetes mellitus. N Engl J Med 1971; 284(7): 353–357. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM197102182840703>.
- Gabbay KH, Hasty K, Breslow JL et al. Glycosylated hemoglobin and long-term blood glucose control in diabetes mellitus. J Clin Endocrinol Metab 1977; 44(5): 859–864. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem-44–5–859>.
- Goldstein DE, Parker KM, England JD Jr et al. Clinical Application of Glycosylated Hemoglobin Measurements Diabetes 1982; 31(Supplement 3): 70–78. Dostupné z DOI: <https://doi.org/10.2337/diab.31.3.S70>.
- Michalková D, Čársky J, Birčák J et al. Glykozylovaný hemoglobín HbA1c ako indikátor metabolickej kompenzácie u detí s diabetes mellitus. Čes-slov Pediat 1981; 36(5): 243–247.
- Vozár J, Cársky J, Mikulecký M et al. Klinický význam určenia hladiny glykozyloného hemoglobínu u chorých s diabetes mellitus. Bratisl lek Listy 1982; 77(1): 12–23.
- Rácz O, Vícha T, Pačin J. Glykohemoglobín, glykácia bielkovín a diabetes mellitus. Osveta: Martin 1989.
- Edelstein D, Brownlee M. Mechanistic studies of advanced glycosylation end-product inhibition by aminoguanidine. Diabetes 1992; 41(1): 26–29. Dostupné z DOI: <http://dx.doi.org/10.2337/diab.41.1.26>.
- Sugiyama T, Miyamoto K, Katagiri S. Fetal toxicity of aminoguanidine in mice and rats. J Toxicol Sci 1986; 11(3): 189–195. Dostupné z DOI: <http://dx.doi.org/10.2131/jts.11.189>.
- Hrnciarová M, Cársky J, Jakus V et al Inhibícia peroxidácie lipidov v erytrocytoch diabetických potkanov aminoguanidínom, rezorcylidénaminoguanidínom a ich kyslíkatými a sírnymi analógmi. Bratisl lek Listy 1998); 99(7): 364–367.
- Waczulíková I, Ziegelhöffer A, Országhová Z et al. Fluidizing effect of resorcylidene aminoguanidine on sarcolemmal membranes in streptosotocin-diabetic rats: blunted adaptation of diabetic myocardium to Ca² overload. J Physiol Pharmacol 2002; 53(4 Pt): 727–739.
- Jakus V, Hrnciarová M, Cársky J et al. Inhibition of nonenzymatic protein glycation and lipid peroxidation by drugs with antioxidative activity. Life Sci 1999; 65(18–19): 1991–1993. Dostupné z DOI: <http://dx.doi.org/10.1016/s0024–3205(99)00462–2>.
- Taguchi T, Sugiura M, Hamada Y et al. Inhibition of protein glycation by Schiff base between aminoguanidine and pyridoxal. Eur J Pharmacol 1999; 378(3): 283–289. Dostupné z DOI: <http://dx.doi.org/10.1016/s0014–2999(99)00471–9>.
- Gebel E. The start of something good. The Discovery of HbA1c and the American Diabetes Assotiation Samuel Rahbar outstanding discovery Award. Diabetes Care 2012; 35(12): 2429–2431. Dostupné z DOI: <http://dx.doi.org/10.2337/dc12–1763>.
- Azizi MH, Bahadori M, Azizi F. Breakthrough Discovery of HbA1c by Professor Samuel Rahbar in 1968. Arch Iran Med 2013; 16(12): 743–745. Dostupné z DOI: <http://dx.doi.org/0131612/AIM.0013>.
- Ziegelhöffer A, Ravingerová T, Styk J et al. Mechanism that may by involved tolerance of the diabetic heart. Mol Cell Biochem 1997; 176(1–2): 191–198.
- Jakus V, Hrnciarová M, Cársky J et al. Inhibition of nonenzymatic protein glycation and lipid peroxidation by drugs with antioxidant activity. Life Sci 1999; 65(18–19): 1991–1993. Dostupné z DOI: <http://dx.doi.org/10.1016/s0024–3205(99)00462–2>.
- Muchová J, Liptáková A, Országhová Z et al. Antioxidant systems in polymorphonuclear leucocytes of Type 2 diabetes mellitus. Diabet Med 1999; 16(1): 74–78. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1464–5491.1999.00015.x>. (74 cit.)
- Jakuš V. The role of the radicals, oxidative stress and antioxidant systems in diabetic vascular disease. Bratisl lek Listy 2000; 101(10): 541–551.
- Waczulíkova I, Sikurová L, Cársky J et al. Decreased fluidity of isolated erythrocyte membranes in type 1 and 2 diabetes. Effect of resorcylideneaminoguanidine. Gen Physiol Biophys 2000; 19(4): 381–392.
- Jakus V, Rietbrock N. Advanced glycation end-products and the progress of diabetic vascular complications. Physiol Res 2004; 53(2): 131–142.
- Ulicná O, Vancová O, Bozek P et al. Rooibos tea (Aspalathus linearis) partially prevents oxidative stress in streptozocin-induced diabetic rats. Physiol Res 2006; 55(2): 157–164.
- Viktorínová A, Toserová E, Krizko M et al. Altered metabolism of copper, zinc and magnesium is associated with increased levels of glycated hemoglobin in patients with diabetes mellitus. Metabolism 2009; 58(10): 1477–1482. Dostupné z DOI: <http://dx.doi.org/10.1016/j.metabol.2009.04.035>.
- Kostolanská J, Jakus V, Barák L. HbA1c and serum levels of advanced glycation and oxidation protein products in poorly and well contrplled children with type 1 diabetes mellitus. J Pediatr Endocrinol Metab 2009; 22(5): 433–442.
- Duracková Z. Some current insights into oxidative stress. Physiol Res 2010; 59(4): 459–469.
Labels
Diabetology Obesitology
Article was published inDiabetes and obesity

2019 Issue 38-
All articles in this issue
- Editorial
- Detský črevný mikrobióm a riziko vzniku diabetes mellitus 1. typu
- 50 rokov od objavu hemoglobínu HbA1c
- Ľubomíra Fábryová, Pavol Holéczy a kolektív. Diabezita. Diabetes a obezita: nerozlučné dvojičky
- Vliv léčby inzulinem Fiasp na glykemie, HbA1c a tělesnou hmotnost u osob s diabetem 1. a 2. typu: studie z reálné praxe
- Je odhalené už všetko o inhibítoroch SGLT2?
- Adipocytokíny ako možné etiopatogenetické mechanizmy vedúce k vyššiemu výskytu autoimunitnej tyroiditídy u pacientov s diabetes mellitus 2. typu
- Manažment artériovej hypertenzie u osôb s diabetes mellitus 2. typu
- Fixná kombinácia bazálneho inzulínu glargín 100 U/ml s agonistom GLP1-receptorov lixisenatidom: klinické štúdie a ich implikácia do klinickej praxe
- Renálne a kardiovaskulárne výsledky štúdie CREDENCE: implikácie pre klinickú prax
- Intenzívna glykemická kompenzácia a prevencia chronických diabetických komplikácií
- Prvé skúsenosti s biosimilárnym inzulínom glargín 100 IU/ml – inzulínom Semglee®: kazuistika
- Včasná liečba novodiagnostikovaného diabetika 2. typu inzulínom: kazuistika
- Kombinácia bazálneho inzulínu a metformínu: kazuistika
- 55. výročný kongres European Association for the Study of Diabetes
- IV. česko-slovenská multidisciplinárna diabetologická konferencia: Ako sa odporúčania prenášajú do klinickej praxe
- 79. konferencia American Diabetes Association
- Viliam Mojto. Diabetes mellitus – komplikácie a liečba
- Diabetes and obesity
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv léčby inzulinem Fiasp na glykemie, HbA1c a tělesnou hmotnost u osob s diabetem 1. a 2. typu: studie z reálné praxe
- Je odhalené už všetko o inhibítoroch SGLT2?
- Včasná liečba novodiagnostikovaného diabetika 2. typu inzulínom: kazuistika
- Detský črevný mikrobióm a riziko vzniku diabetes mellitus 1. typu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

