-
Medical journals
- Career
Detský črevný mikrobióm a riziko vzniku diabetes mellitus 1. typu
Authors: Uboš Ambro 1; Anna Kamlárová 1; René Link 1; Ivana Lukáčová 1; Alojz Bo 1; Oliver Rácz 2
Authors‘ workplace: Ústav experimentálnej medicíny LF UPJŠ v Košiciach 1; Ústav patologickej fyziológie LF UPJŠ v Košiciach 2
Published in: Diab Obez 2019; 19(38): 75-83
Category: Reviews
Overview
Diabetes mellitus 1. typu (DM1T) je autoimunitné ochorenie, ktorého vznik je podmienený exogénnymi a endogénnymi faktormi. Rozvoj DM1T vo veľkej miere súvisí s génmi hlavného histokompatibilného systému (Major Histocompatibility Complex – MHC), ktoré sú zodpovedné za rozpoznávanie vlastných a cudzích antigénov. Incidencia DM1T každoročne stúpa a predpokladá sa, že za tento trend sú zodpovedné environmentálne faktory ovplyvňujúce stav imunitného systému. Doterajšie poznatky o faktoroch, ktoré znamenajú zvýšené riziko manifestácie DM1T, však stále nestačia na uspokojivé vysvetlenie patogenézy tejto choroby. Okrem toho je známe, že väčšina ľudí s rizikovými haplotypmi nakoniec nikdy neochorie na DM1T. Najnovšie štúdie naznačujú, že pri rozvoji DM1T môže mať dôležitú úlohu aj črevný mikrobióm človeka. Bolo preukázané, že u prediabetických detí dochádza k zníženiu diverzity črevného mikrobiómu. Zároveň sa predpokladá, že dietetická modulácia črevného mikrobiómu v rannom detstve môže mať vplyv na neskorší rozvoj tohto ochorenia.
Klíčová slova:
autoimunitné ochorenie – črevný mikrobióm – diabetes mellitus 1. typu – výživa
Úvod
Diabetes mellitus 1. typu patrí do skupiny autoimunitných ochorení (AO). V súčasnosti sa tieto ochorenia považujú celosvetovo za hlavnú príčinu morbidity a mortality a patria k 10 najčastejším príčinám úmrtí ľudí v rozvinutých krajinách. Aj napriek neustálemu pokroku vo výskume stále nie je jasná etiológia mnohých AO [1]. Súčasný manažment pacientov s AO je založený na symptomatickej liečbe, čo má ale svoje obmedzenia. AO sa síce rozvíjajú pomaly, ale práve z toho dôvodu sú ťažko diagnostikovateľné pred plným nástupom klinických príznakov. V tom čase už častokrát býva poškodenie natoľko vážne, že zastavenie progresu ochorenia už nie je možné. Pozornosť odborníkov a nevyhnutnosť hľadania nových riešení pre prevenciu a liečbu AO zvýrazňuje skutočnosť, že incidencia AO z doteraz neobjasnených príčin každoročne stúpa, a to najmä v rozvinutých krajinách s vysokým životným a hygienickým štandardom [1].
Pri DM1T je pozorovaný najvyšší nárast incidencie ochorenia spomedzi všetkých AO. Napríklad vo Fínsku sa incidencia DM1T u detí mladších ako 15 rokov zvýšila z 12 na 65 nových prípadov na 100 000 ľudí za rok za posledných 5 desaťročí [2]! Zvyšujúci sa počet pacientov s DM1T preto nemožno vysvetliť iba genetickou predispozíciou (variantami HLA génov). Údaje skôr naznačujú, že tento nárast je výsledkom interakcií medzi moderným západným spôsobom života, prostredím a predispozičnými génmi [3].
V súčasnosti je predmetom intenzívneho výskumu možná úloha črevného mikrobiómu v patogenéze DM1T. Ľudský črevný mikrobióm totiž dozrieva počas prvých 3 rokoch života, potom jeho zloženie pripomína mikrobióm dospelého človeka [4,5]. Správny vývin črevného mikrobiómu úzko súvisí s vývinom imunitného systému [6], a preto sa uvažuje, či dynamický vývoj imunitného systému, dozrievanie črevného mikrobiómu a výskyt prvých autoprotilátok súvisiacich s DM1T sú tri vzájomne prepojené javy. Narušenie vývinu črevného mikrobiómu v ranom veku by však mohlo byť jedným z faktorov, ktorý navodí spustenie patogenézy tohto ochorenia.
Diabetes mellitus 1. typu
Genetické faktory chorenia
Diabetes mellitus 1. typu je definovaný ako dedičné polygénne ochorenie. Pri monozygotných dvojčatách je pravdepodobnosť rozvoja ochorenia u oboch jedincov 30–70 % [7], riziko u súrodencov je 6–7 % a pre deti, ktoré majú rodiča s diabetom 1–9 % [8]. Celoživotné riziko sa mení prevažne podľa krajín a zemepisných oblastí a podľa aktuálnych štatistík sa ochorenie vyskytuje u jedného z 250 ľudí [9]. Výskyt DM1T je o niečo častejší u mužov a chlapcov ako u žien a dievčat [10], hoci vo všeobecnosti sú k výskytu AO viac náchylné ženy ako muži.
Odhaduje sa, že dva haplotypy HLA triedy 2 zapojené do prezentácie antigénu HLA DRB1*0301-DQA1*0501-DQ*B10201 (DR3) a HLA DRB1*0401-DQA1*0301-DQB1*0301 (DR4-DQ8), ktoré prevládajú u ľudí bielej rasy, sú zodpovedné približne za 50 % dedičnej zložky ochorenia [11]. Je známe, že niektoré haplotypy (DRB1*1501-DQA1*0102-DQB1–0602 (DR15-DQ6)) naopak znižujú riziko diabetu 1. typu [11]. Mechanizmy, ktorými tieto haplotypy HLA interagujú a prispievajú k riziku rozvoja ochorenia, nie sú však úplne objasnené, čo je koniec koncov odrazom veľkej komplexnosti systému získanej imunity človeka.
Celogenómové štúdie ľudí doteraz identifikovali viac ako 60 ďalších lokusov nachádzajúcich sa mimo HLA-systému, ktoré sú spojené s rizikom rozvoja diabetu 1. typu. Tieto gény majú súvis s funkciou imunitného systému a ich produkty participujú na niektorých dráhach zapojených v rozvoji ochorenia (expresia génu inzulínu v týmuse, regulácia aktivácie T-lymfocytov a odpoveď na vírusové infekcie) [11].
Pre výskum genetickej podstaty ochorenia boli v minulosti selektovaní ľudia s vysokým rizikom rozvoja DM1T na základe rizikového variantu HLA, familiárneho rizika alebo kombinácie oboch pozorovaní [12]. Ukazuje sa, že lokusy mimo HLA systému, ktoré boli doteraz identifikované, však nemôžu byť použité samostatne pre predpovedanie rizika rozvoja DM1T alebo pre rozlíšenie jednotlivých typov diabetu. Predpokladá sa, že kombinované sledovanie lokusov (HLA a ostatných) by mohlo poskytnúť lepšiu predpoveď rizika rozvoja DM1T a rozlíšenia diabetu 1. typu od diabetu 2. typu [13,14]. Okrem toho sa predpokladá, že náklady na celogenómové sekvenovanie človeka sa budú naďalej znižovať, čím sa globálne zlepší genotypizácia pacientov a spresní sa diagnostika DM1T [15,16].
Epidemiológia chorenia
Incidencia a prevalencia DM1T sa celosvetovo zvyšuje ročne približne o 2–3 % [17,18]. Výskyt DM1T má veľkú geografickú variáciu a líši sa v závislosti od krajiny a dokonca aj regiónu v rámci krajín [19]. Diabetes 1. typu je najbežnejší vo Fínsku (viac ako 60 prípadov na 100 000 ľudí ročne) a na Sardínii (približne 40 prípadov na 100 000 ľudí ročne) [20]. Naopak, toto ochorenie je podstatne zriedkavejšie v Číne, Indii a Venezuele (približne 0,1 prípadov na 100 000 ľudí ročne). Globálny výskyt DM1T predstavuje epidemiologický hlavolam, keďže medzi susednými oblasťami Európy a Severnej Ameriky sú zaznamenané veľké rozdiely vo výskyte chorôb. Napríklad výskyt DM1T v Estónsku predstavuje menej ako jednu tretinu incidencie vo Fínsku, hoci obe krajiny sú od seba vzdialené menej ako 120 km [21].
Výskyt diabetu 1. typu na celom svete už niekoľko desaťročí narastá [22]. Ak sa miera incidencie bude naďalej zvyšovať podľa súčasného trendu, globálny výskyt by sa mohol v nasledujúcom desaťročí dokonca zdvojnásobiť [20]. Najväčší nárast incidencie bol pozorovaný u detí do 15 rokov, z toho najviac v podskupine detí vo veku do 5 rokov [23]. Pozorovaný nárast incidencie diabetu 1. typu sa nedá uspokojivo vysvetliť výlučne genetickými faktormi, ktoré sú v populácii relatívne stabilné. S diabetom 1. typu je však spojených veľa environmentálnych faktorov vrátane výživy dojčiat a dospelých, nedostatku vitamínu D, ranej expozície vírusom spojenej so zápalom pankreatických ostrovčekov a zníženej diverzite črevného mikrobiómu [24]. Viaceré teórie sú v súčasnosti predmetom intenzívneho výskumu.
Patofyziológia chorenia
Diabetes 1. typu je orgánovo špecifické autoimunitné ochorenie charakterizované nedostatočnou produkciou inzulínu spôsobenou poškodením inzulín produkujúcich B-buniek pankreasu. Patogenéza DM1T je výsledkom komplexnej interakcie medzi pankreatickými B-bunkami a vrodeným a adaptívnym imunitným systémom [25]. V procese patogenézy je však viacero nejasností a otázka, či existuje spúšťač pre imunitnú odpoveď proti B-bunkám, alebo či je imunitná odpoveď náhodná udalosť, je stále predmetom odbornej diskusie.
Je známe, že jedným z hlavných markerov DM1T je znížená funkcia pankreatických B-buniek v porovnaní so zdravými kontrolami [26]. Po diagnostikovaní ochorenia a zmiernení hyperglykémie môžu B-bunky na krátky čas obnoviť sekréciu inzulínu a to až tak, že nie je potrebná suplementácia exogénnym inzulínom. Následne však zvyčajne dochádza k opätovnému poklesu jeho sekrécie. Štúdie naznačujú možnosť, že u 30–80 % pacientov DM1T je zachovaná mikrosekrécia inzulínu (a tým aj C-peptidu) a to aj po desaťročiach od diagnostikovania ochorenia [27,28]. Zaujímavým zistením je, že zachovanie aspoň minimálnej sekrécie vlastného inzulínu môže mať benefičné účinky vo forme spomalenia rozvoja niektorých asociovaných príznakov, ako je retinopatia, nefropatia a hypoglykémia [29]. Mechanizmy, ktoré sú základom pretrvávania zvyškových B-buniek u časti pacientov s dlhodobým diabetom 1. typu avšak zostávajú nejasné. Identifikácia ciest, ktoré umožnili týmto bunkám uniknúť autoimunitnému útoku by preto mohla priniesť nové terapeutické prístupy (schéma) [30].
Schéma. Aktuálny model rozvoja diabetu 1. typu. Upravené podľa [31,32] ![Schéma. Aktuálny model rozvoja diabetu 1. typu. Upravené podľa [31,32]](https://pl-master.mdcdn.cz/media/image_pdf/e76db3b5732c4edbd87477f6ae59ebc4.png?version=1582577741)
So spustením patogenézy diabetu 1. typu sa spája aj prekonanie vírusových infekcií, pričom jednou z najčastejšie asociovaných infekcií je enterovírusová infekcia. V pankreatických ostrovčekoch ľudí s novodiagnostikovaným DM1T boli identifikovaný hlavný kapsidový proteín VP1 a jeho RNA, hyperexpresia hlavného histokompatibilného komplexu triedy 1 a ďalšie ukazovatele vírusovej infekcie [33]. Jednou z teórií spustenia patogenézy ochorenia je, že niektorí ľudia s predispozíciou pre diabetes 1. typu majú atypickú chronickú vírusovú infekciu B-buniek pankreasu, čo vedie k chronickému zápalu a rozvoju autoimunitných odpovedí. Vírusová hypotéza je predmetom verifikácie a za týmto účelom sa vyvíja a testuje antivírusová terapia a vývoj vakcín zameraných na enterovírusy [30].
Teória molekulárnych mimikry hovorí o tom, že niektoré črevné baktérie môžu na svojom povrchu obsahovať epitopy, ktoré sú svojou štruktúrou podobné vlastným antigénom pankreatických buniek hostiteľa. Tieto bakteriálne antigény následne vybudia autoreaktívnu subpopuláciu lymfocytov. Príkladom je Mgt proteín baktérie Leptotrichia goodfellowii (črevná fusobaktéria) a pankreatický IGRP proteín. Zdieľajú epitop VYLKTNVFL, ktorý môže aktivovať diabetogénne NY8.3 T-bunky [34]. Predpokladá sa, že takáto autoimunitná reakcia spustená bakteriálnymi epitopmi môže zohrávať úlohu pri rozvoji DM1T, ale aj ďalších autoimunitných chorobách [35].
Detský črevný mikrobióm človeka a DM1T
Zloženie a dynamika črevného mikrobiómu dieťaťa
Gastrointestinálny trakt človeka predstavuje veľké rozhranie, v ktorom hostiteľské tkanivá interagujú s vonkajším prostredím [36] Sliznica čreva umožňuje efektívne vstrebávanie potrebných živín a neustále prichádza do kontaktu s množstvom mikrobiálnych antigénov [37]. Odhaduje sa, že ľudské črevo obsahuje približne 1013 až 1014 komenzálnych mikroorganizmov – baktérií, vírusov a húb [38]. V súčasnosti je najdetailnejšie charakterizovaná bakteriálna zložka mikrobiómu a bolo dokázané, že pre hostiteľa zabezpečuje viaceré prospešné funkcie vrátane trávenia potravy, produkcie vitamínov a ochrany proti rastu patogénnych mikroorganizmov [39]. Okrem toho zohráva dôležitú úlohu pri dozrievaní získanej imunity človeka.
V črevnom mikrobióme dominujú 4 bakteriálne kmene – Firmicutes, Bacteroides, Proteobacteria a Actinobacteria [40], pričom do kmeňov Firmicutes a Bacteroidetes patrí približne 90 % druhov črevných baktérií. Firmicutes (Gram-pozitívne baktérie) osídľujú črevnú mucínovú vrstvu a u zdravých dospelých ľudí predstavujú najviac 80 % z celkového počtu baktérií. Bacteroidetes (Gram-negatívne baktérie) sa nachádzajú skôr v lumene čreva a predstavujú menšiu časť (15–30 % baktérií) črevného mikrobiómu [41,42]. Pomer medzi počtami baktérií kmeňov Firmicutes a Bacteroidetes sa zvyčajne používa ako indikátor dozrievania črevného mikrobiómu počas života človeka. Okrem toho je pomer Firmicutes a Bacteroidetes biomarkerom narušenia zloženia črevného mikrobiómu – tzv. dysbiózy. Takýto stav črevného mikrobiómu bol preukázaný pri viacerých AO vrátane u osôb s DM1T [43].
Kolonizácia čreva začína v skorej fáze života človeka. Do veku 3 rokov sa črevný mikrobióm dynamicky rozvíja. Tento proces je ovplyvnený materským mikrobiómom, ale aj oportunistickou kolonizáciou baktériami prítomnými u ostatných blízkych jedincov a v konkrétnom prostredí. Okrem toho úlohu zohráva aj vnútorné prostredie daného jedinca, ktoré je determinované jeho genetickou výbavou. Zloženie črevného mikrobiómu človeka v skorom detstve je preto veľmi variabilné a z množstva mikróbov, ktoré sa dostanú do čreva, ho iba podskupina úspešne kolonizuje [4].
Viaceré štúdie preukázali, že spôsob pôrodu (vaginálny alebo cisársky rez) môže mať dlhodobé účinky na rozvoj črevného mikrobiómu. Ukázalo sa, že črevná kolonizácia u dojčiat narodených cisárskym rezom je oneskorená [44]. Taktiež bola pozorovaná nižšia mikrobiálna diverzita, ktorá môže pretrvávať najmenej 2 roky [45]. Črevný mikrobióm detí narodených vaginálne je podobný vaginálnemu mikrobiómu matky [46,47] s typickými zástupcami rodov Lactobacillus, Prevotella a Sneathia. Naproti tomu črevný mikrobióm detí narodených cisárskym rezom obsahuje typicky kožné a vzdušné baktérie rodov Staphylococcus, Corynebacterium a Propionibacterium [48] a vyššie počty patogénnych baktérií, ako sú Klebsiella, Citrobacter a Escherichia coli [49,50].
Ďalší vývoj zloženia črevného mikrobiómu je ovplyvnený hlavne spôsobom výživy novorodencov. Dojčenie materským mliekom podporuje prirodzenú kolonizáciu bifidobaktériami, predovšetkým druhmi Bifidobacterium breve a Bifidobacterium bifidum [51], kým umelá dojčenská výživa stimuluje rast proteobaktérií a baktérií kmeňa Bacteroidetes. Pri následnom prechode na tuhú stravu sa tento rozdiel eliminuje. Črevný mikrobióm dieťaťa získa črty dospelého človeka okolo 3. roku života a naďalej je ovplyvňovaný viacerými faktormi – stravou, stresom, zdravotným stavom, užívaním liekov a antibiotík, hygienickými návykmi a geografickou polohou [52,53].
Črevný mikrobióm a jeho zmeny pri DM1T
Zaujímavosťou je pravdepodobná existencia korelácie medzi štádiom DM1T a zložením črevného mikrobiómu detí. Znížená diverzita baktérií v črevnom mikrobióme bola pozorovaná u detí, ktorým bolo možné detegovať autoprotilátky proti pankreatickým B-bunkám a vyskytli sa u nich klinické príznaky ochorenia. Pri kontrolných probandoch bez sérovej konverzie tento jav nebol pozorovaný [54,55]. Podobný fenomén bol popísaný v črevnom mikrobióme novorodencov s predispozíciou pre DM1T v čase medzi sérovou konverziou a diagnostikovaním ochorenia [56]. Tieto zmeny boli sprevádzané zvýšenými počtami niektorých patogénnych baktérií (Ruminococcus gnavus a Streptococcus infantarius) a naopak zníženými počtami baktérií s protizápalovými účinkami (Lachnospiraceae a Veillonellaceae) [56]. Okrem uvedeného sú v súčasnosti dostupné dáta viacerých klinických štúdií črevného mikrobiómu pacientov s DM1T a ich prehľad je uvedený v tab.
Table 1. Dostupné dáta klinických štúdií črevného mikrobiómu pacientov s DM1T 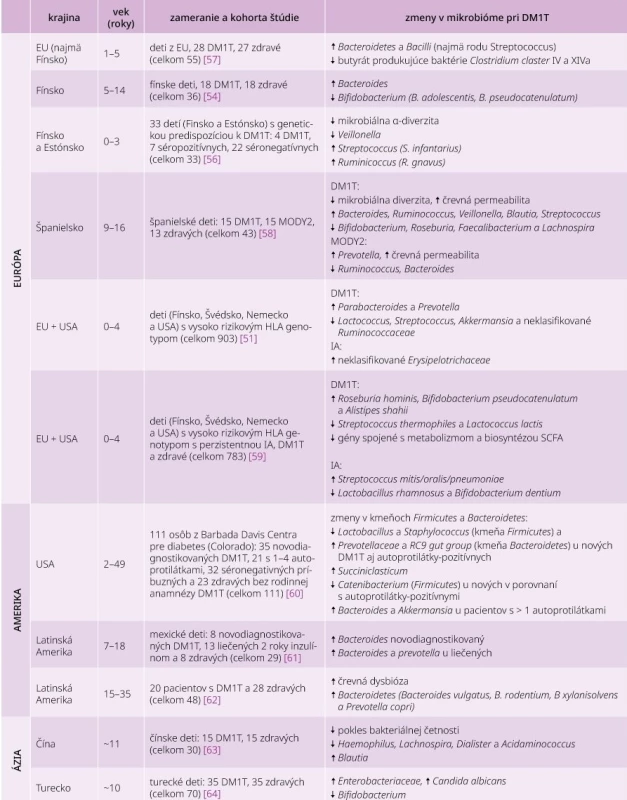
Faktory ovplyvňujúce črevný mikrobióm a riziko vzniku DM1T
Na základe viacerých výskumov sa zistilo, že narušený črevný mikrobióm v dôsledku užívania antibiotík v ranom štádiu života človeka môže mať implikácie s rozvojom DM1T. Je známe, že perorálne podávanie antibiotík, ako sú ciprofloxacín, klindamycín, metronidazol a klaritromycín, ovplyvňuje diverzitu črevných baktérií, a to po dobu niekoľkých týždňov až rokov [65–67]. Antibiotická liečba taktiež môže stimulovať množenie niektorých patogénnych organizmov, ako je Salmonella typhimurium a Clostridioides difficile poskytovaním priaznivých podmienok pre ich rozšírenie [68,69]. Používanie antibiotík však môže zvýšiť aj riziko rozvoja DM1T. V Britskej štúdii s približne miliónom participantov sa dospelo k záveru, že liečba s viac ako 5 cyklami penicilínov alebo cefalosporínov mohla zvýšiť riziko DM1T [70]. Tento trend sa však nevyskytol pri liečbe antivírusovými látkami alebo antimykotikami v [70], čo naznačuje, že zvýšené riziko DM1T bolo dôsledkom narušenia komunity črevných baktérií. Dánska štúdia zahŕňajúca približne 800 000 jedincov narodených v rokoch 1997 až 2010 odhalila, že používanie širokospektrálnych antibiotík počas prvých 2 rokoch života bolo spojené so zvýšeným rizikom DM1T v neskorších rokoch života [71].
Okrem antibiotickej liečby môže signifikantne ovplyvniť riziko vzniku DM1T aj spôsob pôrodu dieťaťa. Štúdia zahŕňajúca 1 650 detí s familiárnym rizikom DM1T odhalila 2-násobné zvýšenie progresie DM1T u detí narodených cisárskym rezom v porovnaní s deťmi narodenými vaginálnym pôrodom [72]. Podobne aj taiwanská štúdia detí narodených v rokoch 2000–2005 (n = 1 760 336) a dánska štúdia detí narodených v rokoch 1982–2010 (n = 1 760 336) odhalili vyššie riziko vzniku DM1T pri deťoch narodených sekciou [73,74]. Mimoriadne vysoká početnosť sekcie vo vyspelých krajinách môže preto súvisieť so zvýšenou mierou autoimunitného DM1T [75]. Pravdepodobné vysvetlenie môže spočívať v narušení prirodzeného vývoja črevného mikrobiómu a absentujúcej stimulácii raného imunitného systému chýbajúcimi baktériami.
Diéta novorodenca je ďalším faktorom, ktorý môže súvisieť s rozvojom DM1T. Materské mlieko zohráva dôležitú úlohu pri vytváraní črevnej bariéry novorodenca poskytovaním živín, vitamínov, imunoglobulínov a ďalších makromolekúl [76]. Ukázalo sa, že dojčenie materským mliekom je dôležitý faktor formujúci štruktúru črevného mikrobiómu počas prvého roka života [51]. Stimuluje rast druhov Bifidobacterium (B. breve a B. bifidum), podporuje rýchlejšiu maturáciu črevného mikrobiómu, čo je indikované vyšším zastúpením baktérií kmeňa Firmicutes [51,77]. Tento účinok je pravdepodobne sprostredkovaný mliečnymi oligosacharidmi, ktoré sú fermentované črevnými baktériami na mastné kyseliny s krátkym reťazcom. Molekulárny účinok týchto metabolitov spočíva v udržiavaní integrity črevnej bariéry a inhibícii rastu patogénnych mikroorganizmov [78]. Predpokladá sa, že materské mlieko má ochranný účinok pred autoimunitným DM1T u vysokorizikových jedincov [79], čo môže byť sprostredkované práve stimuláciou rastu prospešných črevných baktérií v ranom veku dieťaťa.
V neposlednom rade je v súvislosti s incidenciou DM1T často diskutovaná aj životná úroveň a hygiena ľudských subpopulácií. Predpokladá sa, že znížené vystavenie mikrobiálnym antigénom v ranom veku človeka môže negatívne ovplyvniť správny vývin získanej imunity a následne viesť k rozvoju autoimunitných ochorení u jedincov s predispozíciou [80,81]. Krajiny s nižším hygienickým štandardom majú typicky vyššiu incidenciu infekčných ochorení, ale naopak nižšiu incidenciu autoimunintých ochorení. Je však diskutabilné, či je to skutočne dôsledkom vysokej životnej úrovne, čistoty a mestského spôsobu života, alebo možnosťou lepšej diagnostiky ochorenia v rozvinutých krajinách.
Záver
Diabetes mellitus 1. typu je orgánovo špecifické autoimunitné ochorenie spôsobené deštrukciou pankreatických B-buniek, pričom spoločným menovateľom s inými autoimunitnými ochoreniami je genetická predispozícia. Pre DM1T bolo doteraz identifikovaných viac ako 50 génov, ktorých mutantné varianty môžu prispievať k rozvoju ochorenia. Zároveň je známe, že existuje viacero environmentálnych faktorov, ktoré môžu podporovať spustenie patogenézy autoimunitných ochorení vrátane DM1T. Zdá sa, že črevný mikrobióm človeka môže byť jedným z množstva modulačných faktorov. Viacero doteraz uskutočnených klinických štúdií poukazuje na túto skutočnosť, avšak stále sa nepodarilo uspokojivo vysvetliť presnú úlohu črevného mikrobiómu v procese patogenézy DM1T. Je preto nutné pokračovať v tomto výskume a zamýšľať sa aj nad novými prístupmi ovplyvnenia črevného mikrobiómu u ľudí s predispozíciou pre DM1T vrátane špecifickej dietetickej modulácie.
Doručené do redakcie 7. 10. 2019
Prijaté po recenzii 8. 11. 2019
Mgr. Ľuboš Ambro, PhD.
Sources
- Campbell AW. Autoimmunity and the Gut. Autoimmune Dis. 2014;2014 : 152428. Dostupné z DOI: <http://dx.doi.org/10.1155/2014/152428>.
- Harjutsalo V, Sund R, Knip M et al. Incidence of Type 1 Diabetes in Finland. JAMA 2013; 310(4):427–428. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2013.8399>.
- Siljander H, Honkanen J, Knip M. Microbiome and type 1 diabetes. EBioMedicine 2019; 46 : 512–521. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ebiom.2019.06.031>.
- Yatsunenko T, Rey FE, Manary MJ et al. Human gut microbiome viewed across age and geography. Nature 2012; 486(7402): 222–227. Dostupné z DOI: <http://dx.doi.org/10.1038/nature11053>.
- Yassour M, Vatanen T, Siljander H et al. Natural history of the infant gut microbiome and impact of antibiotic treatment on bacterial strain diversity and stability. Sci Transl Med 2016; 8(343):343ra81. Dostupné z DOI: <http://dx.doi.org/10.1126/scitranslmed.aad0917>.
- Belkaid Y, Hand TW. Role of the Microbiota in Immunity and Inflammation. Cell 2014; 157(1): 121–141. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cell.2014.03.011>.
- Redondo MJ, Jeffrey J, Fain PR et al. Concordance for Islet Autoimmunity among Monozygotic Twins. N Engl J Med 2008; 359(26): 2849–2850. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc0805398>.
- Pociot F, Lernmark Å. Genetic risk factors for type 1 diabetes. Lancet 2016; 387(10035): 2331–2339. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(16)30582–7>.
- Redondo MJ, Fain PR, Eisenbarth GS. Genetics of type 1A diabetes. Recent Prog Horm Res 2001; 56 : 69–89.
- Diaz-Valencia PA, Bougnères P, Valleron AJ. Global epidemiology of type 1 diabetes in young adults and adults: a systematic review. BMC Public Health 2015; 15 : 255. Dostupné z DOI: <http://dx.doi.org/10.1186/s12889–015–1591-y>.
- Noble JA. Immunogenetics of type 1 diabetes: A comprehensive review. J Autoimmun 2015; 64 : 101–112. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaut.2015.07.014>.
- [TEDDY Study Group]. The Environmental Determinants of Diabetes in the Young (TEDDY) study: study design. Pediatr Diabetes 2007; 8(5): 286–298. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–5448.2007.00269.x>.
- Oram RA, Patel K, Hill A et al. A Type 1 Diabetes Genetic Risk Score Can Aid Discrimination Between Type 1 and Type 2 Diabetes in Young Adults. Diabetes Care 2016; 39(3): 337–344. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–1111>.
- Winkler C, Krumsiek J, Buettner F et al. Feature ranking of type 1 diabetes susceptibility genes improves prediction of type 1 diabetes. Diabetologia 2014; 57(12): 2521–2529. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–014–3362–1>.
- Ziegler AG, Danne T, Dunger DB et al. Primary prevention of beta-cell autoimmunity and type 1 diabetes – The Global Platform for the Prevention of Autoimmune Diabetes (GPPAD) perspectives. Mol Metab 2016; 5(4): 255–262. Dostupné z DOI: <http://dx.doi.org/10.1016/j.molmet.2016.02.003>.
- Bonifacio E, Beyerlein A, Hippich M et al. Genetic scores to stratify risk of developing multiple islet autoantibodies and type 1 diabetes: A prospective study in children. PLoS Med 2018; 15(4): e1002548. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pmed.1002548>.
- Maahs DM, West NA, Lawrence JM et al. Epidemiology of Type 1 Diabetes. Endocrinol Metab Clin North Am 2010; 39(3): 481–497. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ecl.2010.05.011>.
- Mayer-Davis EJ, Lawrence JM, Dabelea D et al. Incidence Trends of Type 1 and Type 2 Diabetes among Youths, 2002–2012. N Engl J Med 2017; 376(15): 1419–1429. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1610187>.
- Rogers MAM, Kim C, Banerjee T et al. Fluctuations in the incidence of type 1 diabetes in the United States from 2001 to 2015: a longitudinal study. BMC Med 2017; 15(1): 199. Dostupné z DOI: <http://dx.doi.org/10.1186/s12916–017–0958–6>.
- Patterson CC, Dahlquist GG, Gyürüs E et al. Incidence trends for childhood type 1 diabetes in Europe during 1989–2003 and predicted new cases 2005–20: a multicentre prospective registration study. Lancet 2009; 373(9680): 2027–2033. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)60568–7>.
- Podar T, Solntsev A, Karvonen M et al. Increasing incidence of childhood-onset Type I diabetes in 3 Baltic countries and Finland 1983–1998. Diabetologia 2001; 44(Suppl 3): B17–20. Dostupné z DOI: <http://dx.doi.org/10.1007/pl00002947>.
- Dabelea D. The accelerating epidemic of childhood diabetes. Lancet 2009; 373(9680): 1999–2000. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)60874–6>.
- Chobot A, Polanska J, Brandt A et al. Updated 24-year trend of Type 1 diabetes incidence in children in Poland reveals a sinusoidal pattern and sustained increase. Diabet Med 2017; 34(9): 1252–1258. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.13345>.
- Rewers M, Ludvigsson J. Environmental risk factors for type 1 diabetes. Lancet 2016; 387(10035): 2340–2348. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(16)30507–4>.
- Hull CM, Peakman M, Tree TIM. Regulatory T cell dysfunction in type 1 diabetes: what’s broken and how can we fix it? Diabetologia 2017; 60(10): 1839–1850. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–017–4377–1>.
- Greenbaum CJ, Anderson AM, Dolan LM et al. Preservation of -Cell Function in Autoantibody-Positive Youth With Diabetes. Diabetes Care 2009; 32(10): 1839–1844. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08–2326>.
- Keenan HA, Sun JK, Levine J et al. Residual Insulin Production and Pancreatic -Cell Turnover After 50 Years of Diabetes: Joslin Medalist Study. Diabetes 2010; 59(11): 2846–2853. Dostupné z DOI: <http://dx.doi.org/10.2337/db10–0676>.
- Lam CJ, Jacobson DR, Rankin MM et al. β Cells Persist in T1D Pancreata Without Evidence of Ongoing β-Cell Turnover or Neogenesis. J Clin Endocrinol Metab 2017; 102(8): 2647–2659. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2016–3806>.
- Zenz S, Mader JK, Regittnig W et al. Impact of C-Peptide Status on the Response of Glucagon and Endogenous Glucose Production to Induced Hypoglycemia in T1DM. J Clin Endocrinol Metab 2018; 103(4): 1408–1417. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2017–01836>.
- DiMeglio LA, Evans-Molina C, Oram RA. Type 1 diabetes. Lancet 2018; 391(10138): 2449–2462. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(18)31320–5>.
- Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 2014; 383(9911): 69–82. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(13)60591–7>.
- Eisenbarth GS. Type I diabetes mellitus. A chronic autoimmune disease. N Engl J Med 1986; 314( 21): 1360–1368. Dostupné z DOI: <http://10.1056/NEJM198605223142106>.
- Krogvold L, Edwin B, Buanes T et al. Detection of a Low-Grade Enteroviral Infection in the Islets of Langerhans of Living Patients Newly Diagnosed With Type 1 Diabetes. Diabetes 2015; 64(5): 1682–1687. Dostupné z DOI: <http://dx.doi.org/10.2337/db14–1370>.
- Ohkusa T, Okayasu I, Ogihara T et al. Induction of experimental ulcerative colitis by Fusobacterium varium isolated from colonic mucosa of patients with ulcerative colitis. Gut 2003; 52(1): 79–83. Dostupné z DOI: <http://dx.doi.org/10.1136/gut.52.1.79>.
- Zheng P, Li Z, Zhou Z. Gut microbiome in type 1 diabetes: A comprehensive review. Diabetes Metab Res Rev 2018; 34(7): e3043. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.3043>.
- Helander HF, Fändriks L. Surface area of the digestive tract – revisited. Scand J Gastroenterol 2014; 49(6): 681–9. Dostupné z DOI: <http://dx.doi.org/10.3109/00365521.2014.898326>.
- Bengmark S. Ecological control of the gastrointestinal tract. The role of probiotic flora. Gut 1998; 42(1):2–7. Dostupné z DOI: <http://dx.doi.org/10.1136/gut.42.1.2>.
- Qin J, Li R, Raes J, Arumugam M et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature 2010; 464(7285): 59–65. Dostupné z DOI: <http://dx.doi.org/10.1038/nature08821>.
- Sommer F, Bäckhed F. The gut microbiota — masters of host development and physiology. Nat Rev Microbiol 2013; 11(4): 227–238. Dostupné z DOI: <http://dx.doi.org/10.1038/nrmicro2974>.
- Bibbò S, Dore MP, Pes GM et al. Is there a role for gut microbiota in type 1 diabetes pathogenesis? Ann Med 2017; 49(1): 11–22. Dostupné z DOI: <http://dx.doi.org/10.1080/07853890.2016.1222449>.
- Goodrich JK, Waters JL, Poole AC et al. Human Genetics Shape the Gut Microbiome. Cell 2014; 159(4): 789–799. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cell.2014.09.053>.
- Van den Abbeele P, Belzer C, Goossens M et al. Butyrate-producing Clostridium cluster XIVa species specifically colonize mucins in an in vitro gut model. ISME J 2013; 7(5): 949–961. Dostupné z DOI: <http://dx.doi.org/10.1038/ismej.2012.158>.
- de Oliveira GLV1, Leite AZ, Higuchi BS et al. Intestinal dysbiosis and probiotic applications in autoimmune diseases. Immunology 2017; 152(1): 1–12. Dostupné z DOI: <http://dx.doi.org/10.1111/imm.12765>.
- Grölund, M.-M. et al. Fecal Microflora in Healthy Infants Born by Different Methods of Delivery: Permanent Changes in Intestinal Flora After Cesarean Delivery. J Pediatr Gastroenterol Nutr 1999; 28(1): 19–25. Dostupné z DOI: <http://dx.doi.org/10.1097/00005176–199901000–00007>.
- Jakobsson HE, Abrahamsson TR, Jenmalm MC et al. Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by Caesarean section. Gut 2014; 63(4): 559–66. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2012–303249>.
- Dominguez-Bello MG, Costello EK, Contreras M et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A. 2010; 107(26): 11971–11975. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.1002601107>.
- Knip M, Siljander H. The role of the intestinal microbiota in type 1 diabetes mellitus. Nat Rev Endocrinol 2016; 12(3): 154–167. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2015.218>.
- Dominguez-Bello MG, Blaser MJ, Ley RE et al. Development of the Human Gastrointestinal Microbiota and Insights From High-Throughput Sequencing. Gastroenterology 2011; 140(6): 1713–1719. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2011.02.011>.
- Dogra S, Sakwinska O, Soh SE et al. Dynamics of Infant Gut Microbiota Are Influenced by Delivery Mode and Gestational Duration and Are Associated with Subsequent Adiposity. MBio 2015; 6(1). pii: e02419–14. Dostupné z DOI: http://dx.doi.org/<10.1128/mBio.02419–14>.
- Penders J, Thijs C, Vink C et al. Factors Influencing the Composition of the Intestinal Microbiota in Early Infancy. Pediatrics 2006; 118(2): 511–521. Dostupné z DOI: http://dx.doi.org/<10.1542/peds.2005–2824>.
- Stewart CJ, Ajami NJ, O‘Brien JL et al. Temporal development of the gut microbiome in early childhood from the TEDDY study. Nature 2018; 562(7728): 583–588. Dostupné z DOI: <http://dx.doi.org/10.1038/s41586–018–0617-x>.
- Scott FW, Pound LD, Patrick C et al. Where genes meet environment—integrating the role of gut luminal contents, immunity and pancreas in type 1 diabetes. Transl Res 2017; 179 : 183–198. Dostupné z DOI: <http://dx.doi.org/10.1016/j.trsl.2016.09.001>.
- Montoya-Williams D, Lemas DJ, Spiryda L et al. The Neonatal Microbiome and Its Partial Role in Mediating the Association between Birth by Cesarean Section and Adverse Pediatric Outcomes. Neonatology 2018; 114(2): 103–111. Dostupné z DOI: <http://dx.doi.org/10.1159/000487102>.
- de Goffau MC, Luopajarvi K, Knip M et al. Fecal Microbiota Composition Differs Between Children With β-Cell Autoimmunity and Those Without. Diabetes 2013; 62(4): 1238–1244. Dostupné z DOI: <http://dx.doi.org/https://doi.org/10.2337/db12–0526>.
- Brown CT, Davis-Richardson AG, Giongo A et al. Gut Microbiome Metagenomics Analysis Suggests a Functional Model for the Development of Autoimmunity for Type 1 Diabetes. PLoS One 2011; 6(10): e25792. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0025792>.
- Kostic AD, Gevers D, Siljander H et al. The Dynamics of the Human Infant Gut Microbiome in Development and in Progression toward Type 1 Diabetes. Cell Host Microbe 2015; 17(2): 260–273. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chom.2015.01.001>.
- de Goffau MC, Fuentes S, van den Bogert B et al. Aberrant gut microbiota composition at the onset of type 1 diabetes in young children. Diabetologia 2014; 57(8): 1569–1577. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–014–3274–0>.
- Leiva-Gea I, Sánchez-Alcoholado L, Martín-Tejedor B et al. Gut Microbiota Differs in Composition and Functionality Between Children With Type 1 Diabetes and MODY2 and Healthy Control Subjects: A Case-Control Study. Diabetes Care 2018; 41(11): 2385–2395. Dostupné z DOI: <http://dx.doi.org/10.2337/dc18–0253>.
- Chamaillard M, Cesaro A, Lober PE et al. Decoding Norovirus Infection in Crohnʼs Disease. Inflamm Bowel Dis 2014; 20(4): 767–770. Dostupné z DOI: <http://dx.doi.org/10.1097/01.MIB.0000440613.83703.4a>.
- Alkanani AK, Hara N, Gottlieb PA et al. Alterations in Intestinal Microbiota Correlate With Susceptibility to Type 1 Diabetes. Diabetes 2015; 64(10): 3510–3520. Dostupné z DOI: <http://dx.doi.org/10.2337/db14–1847>.
- Mejía-León ME, Petrosino JF, Ajami NJ et al. Fecal microbiota imbalance in Mexican children with type 1 diabetes. Sci Rep 2014; 4 : 3814. Dostupné z DOI: <http://dx.doi.org/10.1038/srep03814>.
- Higuchi BS, Rodrigues N, Gonzaga MI et al. Intestinal Dysbiosis in Autoimmune Diabetes Is Correlated With Poor Glycemic Control and Increased Interleukin-6: A Pilot Study. Front Immunol 2018; 9 : 1689. Dostupné z DOI: <http://dx.doi.org/10.3389/fimmu.2018.01689>.
- Qi CJ, Zhang Q, Yu M et al. Imbalance of Fecal Microbiota at Newly Diagnosed Type 1 Diabetes in Chinese Children. Chin Med J (Engl) 2016; 129(11): 1298–1304. Dostupné z DOI: <http://dx.doi.org/10.4103/0366–6999.182841>.
- Soyucen E, Gulcan A, Aktuglu-Zeybek AC et al. Differences in the gut microbiota of healthy children and those with type 1 diabetes. Pediatr Int 2014; 56(3): 336–343. Dostupné z DOI: <http://dx.doi.org/10.1111/ped.12243>.
- Dethlefsen L, Huse S, Sogin ML et al. The Pervasive Effects of an Antibiotic on the Human Gut Microbiota, as Revealed by Deep 16S rRNA Sequencing. PLoS Biol 2008; 6(11): e280. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pbio.0060280>.
- Jernberg C, Löfmark S, Edlund C et al. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota. ISME J 2007; 1(1): 56–66. Dostupné z DOI: <http://dx.doi.org/10.1038/ismej.2007.3>. Erratum in ISME J 2013; 7(2): 456.
- Jakobsson HE, Jernberg C, Andersson AF et al. Short-Term Antibiotic Treatment Has Differing Long-Term Impacts on the Human Throat and Gut Microbiome. PLoS One 2010; 5(3): e9836. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0009836>.
- Blaser MJ. Antibiotic use and its consequences for the normal microbiome. Science 2016; 352(6285): 544–545. Dostupné z DOI: <http://dx.doi.org/10.1126/science.aad9358>.
- Keeney KM, Yurist-Doutsch S, Arrieta MC et al. Effects of Antibiotics on Human Microbiota and Subsequent Disease. Annu Rev Microbiol 2014; 68 : 217–235. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev-micro-091313–103456>.
- Boursi B, Mamtani R, Haynes K et al. The effect of past antibiotic exposure on diabetes risk. Eur J Endocrinol 2015; 172(6): 639–648. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-14–1163>.
- Clausen TD, Bergholt T, Bouaziz O et al. Broad-Spectrum Antibiotic Treatment and Subsequent Childhood Type 1 Diabetes: A Nationwide Danish Cohort Study. PLoS One 2016; 11(8): e0161654. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0161654>.
- Bonifacio E, Warncke K, Winkler C et al. Cesarean Section and Interferon-Induced Helicase Gene Polymorphisms Combine to Increase Childhood Type 1 Diabetes Risk. Diabetes 2011; 60(12): 3300–3306. Dostupné z DOI: <http://dx.doi.org/10.2337/db11–0729>.
- Lee HY, Lu CL, Chen HF et al. Perinatal and childhood risk factors for early-onset type 1 diabetes: a population-based case-control study in Taiwan. Eur J Public Health 2015; 25(6): 1024–1029. Dostupné z DOI: <http://dx.doi.org/10.1093/eurpub/ckv059>.
- Clausen TD, Bergholt T, Eriksson F et al. Prelabor Cesarean Section and Risk of Childhood Type 1 Diabetes. Epidemiology 2016; 27(4): 547–555. Dostupné z DOI: <http://dx.doi.org/10.1097/EDE.0000000000000488>.
- Betrán AP, Ye J, Moller AB et al. The Increasing Trend in Caesarean Section Rates: Global, Regional and National Estimates: 1990–2014. PLoS One 2016; 11(2): e0148343. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0148343>.
- Mosca F, Giannì ML. Human milk: composition and health benefits. La Pediatr. Pediatr Med Chir 2017; 3(2): 155. <http://dx.doi.org/10.4081/pmc.2017.155>.
- Bezirtzoglou E, Tsiotsias A, Welling GW. Microbiota profile in feces of breast - and formula-fed newborns by using fluorescence in situ hybridization (FISH). Anaerobe 2011; 17(6): 478–482. Dostupné z DOI: <http://dx.doi.org/10.1016/j.anaerobe.2011.03.009>.
- Aakko J, Kumar H, Rautava S et al. Human milk oligosaccharide categories define the microbiota composition in human colostrum. Benef Microbes 2017; 8(4): 563–567. Dostupné z DOI: <http://dx.doi.org/10.3920/BM2016.0185>.
- Gabrielli O, Zampini L, Galeazzi T et al. Preterm Milk Oligosaccharides During the First Month of Lactation. Pediatrics 2011; 128(6): e1520–1531. Dostupné z DOI: <http://dx.doi.org/10.1542/peds.2011–1206>.
- Bach JF, Chatenoud L. The Hygiene Hypothesis: An Explanation for the Increased Frequency of Insulin-Dependent Diabetes. Cold Spring Harb Perspect Med 2012; 2(2): a007799. Dostupné z DOI: <http://dx.doi.org/10.1101/cshperspect.a007799>.
- Itoh A, Ridgway WM. Targeting innate immunity to downmodulate adaptive immunity and reverse type 1 diabetes. Immunotargets Ther 2017; 6 : 31–38. Dostupné z DOI: <http://dx.doi.org/10.2147/ITT.S117264>.
Labels
Diabetology Obesitology
Article was published inDiabetes and obesity

2019 Issue 38-
All articles in this issue
- Editorial
- Gut microbiome in children and risk of developing type 1 diabetes mellitus
- 50 rokov od objavu hemoglobínu HbA1c
- Ľubomíra Fábryová, Pavol Holéczy a kolektív. Diabezita. Diabetes a obezita: nerozlučné dvojičky
- Vliv léčby inzulinem Fiasp na glykemie, HbA1c a tělesnou hmotnost u osob s diabetem 1. a 2. typu: studie z reálné praxe
- Has everything really been discovered about SGLT2 inhibitors?
- Adipocytokines as possible etiopathogenetic mechanisms leading to a higher incidence of autoimmune thyroiditis in patients with type 2 diabetes mellitus
- Management of arterial hypertension in persons with type 2 diabetes mellitus
- Fixed-ratio combination of basal insulin glargine 100 U/ml with GLP1-receptor agonist lixisenatide: clinical trials and their implications in clinical practice
- The renal and cardiovascular results of the CREDENCE study: implications for the clinical practice
- Intensive glycemic compensation and prevention of chronic diabetic complications
- Initial experience with biosimillar insulin glargine 100 IU/ml – Semglee® insulin: a case report
- Early insulin treatment of a newly diagnosed type 2 diabetic patient: a case report
- Combination of basal insulin and metformin: a case report
- 55. výročný kongres European Association for the Study of Diabetes
- IV. česko-slovenská multidisciplinárna diabetologická konferencia: Ako sa odporúčania prenášajú do klinickej praxe
- 79. konferencia American Diabetes Association
- Viliam Mojto. Diabetes mellitus – komplikácie a liečba
- Diabetes and obesity
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv léčby inzulinem Fiasp na glykemie, HbA1c a tělesnou hmotnost u osob s diabetem 1. a 2. typu: studie z reálné praxe
- Has everything really been discovered about SGLT2 inhibitors?
- Early insulin treatment of a newly diagnosed type 2 diabetic patient: a case report
- Gut microbiome in children and risk of developing type 1 diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

