-
Medical journals
- Career
Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
Authors: Jan Hrudka 1; Jana Drozenová 1; Anasuya Guha 2; Martin Chovanec 2
Authors‘ workplace: Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 1; Otorinolaryngologická klinika 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 2
Published in: Čes.-slov. Patol., 56, 2020, No. 3, p. 172-176
Category: Original Articles
Overview
Adenoidně cystický karcinom (ACC) je jednou z nejčastějších malignit slinných žláz. Vzácně dochází v ACC k high-grade transformaci neboli dediferenciaci, která je spojená se špatnou prognózou oproti poměrně dlouhému přežití nemocných s konvenčním ACC. Konvenční ACC je charakterizován typickou histomorfologií s glandulární úpravou a ostře ohraničenými luminy, nádorové buňky mají sporou cytoplazmu a angulovaná hyperchromní jádra. High-grade transformovaný ACC pak tyto znaky ztrácí. V této práci popisujeme případ 46leté ženy, která přišla k operačnímu řešení lokálně pokročilého nádoru příušní slinné žlázy s krční lymfadenopatií. Jedna ze suspektních uzlin byla zaslána k peroperačnímu vyšetření ve zmraženém řezu, kdy byly mikroskopicky zastiženy velké nekohezivní buňky s vezikulárními jádry a prominentními jadérky při zachovalé architektonice uzliny. Tento nález vedl k suspekci na lymfom a ukončení operace v rozsahu superficiální parotidektomie a selektivní krční disekce skupin II-IV. Následné histopatologické vyšetření fixované uzliny prokázalo karcinomovou povahu atypických buněk s pozitivitou p63. V resekátu slinné žlázy pak byl identifikován ACC s high-grade komponentou, která vykazovala obdobný vzhled buněk jako popsaná uzlinová metastáza. 17 z 20 uzlin z krční disekce obsahovalo metastázy high-grade ACC. V samotném tumoru parotis byla pozoruhodná silná exprese CD117 v high-grade komponentě, přičemž konvenční ACC byl zcela negativní. High-grade ACC je v příušní žláze podle dostupných informací velmi vzácný, dosud bylo popsáno jen 10 případů.
Klíčová slova:
adenoidně cystický karcinom – high grade – transformace – metastáza – příušní žláza
Adenoidně cystický karcinom (ACC) je jednou z nejčastějších malignit slinných žláz (1). Vzácně pak ACC podléhá high-grade transformaci (2-4), která je spojena s nepříznivou prognózou (5) oproti relativně dlouhému přežití nemocných s konvenčním ACC, které je ovšem zatížené častými recidivami. Desetileté přežití u pacientů s konvenčním ACC se pohybuje mezi 50-70 % (6-8). High-grade transformaci ACC popsali roku 1999 jako první Cheuk et al. (2) jako dediferencovaný ACC, od té doby bylo publikováno nejméně 40 případů, nejčastěji postihujících sinonasální a patrové malé žlázky a žlázy submandibulární, přičemž bylo popsáno pouze 10 případů high-grade ACC v parotis (9).
Konvenční ACC se vyznačuje charakteristickou morfologií, která odpovídá epitelovému nádoru sestávajícímu z tubulárních nebo kribriformních žlázek s ostře ohraničenými luminy, která obsahují homogenní PAS-pozitivní matrix. Žlázky jsou vystlány dvojvrstevným nádorovým epitelem s pravými luminy. Nádorové buňky mají málo objemnou cytoplazmu a hyperchromní jádra. Perineurální šíření a hematogenní metastazování jsou časté. Uzlinové metastázy ACC jsou spíše vzácné, podle literatury se vyskytují uzlinové metastázy u 14,5 % ACC příušních, 22,5 % podčelistních a 24,7 % podjazykových žláz. Metastatické postižení regionálních mízních uzlin se vyskytuje častěji u nemocných s pokročilými tumory ve stadiu T3 a T4. Metastázy jsou obvykle ve skupinách II a III (10).
ACC s high-grade transformací postrádá popsané morfologické znaky, často nabývá vzhledu málo diferencovaného nebo nediferencovaného karcinomu. Diagnóza high-grade ACC nemá být stanovena, pokud chybí současně nález konvenčního ACC (1). Správná diagnóza a identifikace eventuální high-grade komponenty přináší podstatnou informaci o prognóze. ACC s high-grade transformací má vyšší výskyt uzlinových metastáz odpovídající 57 % v porovnání s 5-25 % u konvenčního ACC (9).
V této práci popisujeme případ 46leté nemocné s high-grade ACC, u níž byla diagnóza potvrzena imunohistochemicky, dále popisujeme relevantní diferenciálně diagnostickou rozvahu s rešerší příslušné literatury.
POPIS PŘÍPADU
46letá žena nízkého socioekonomického statutu, kuřačka s anamnézou etylické léze jater byla opakovaně klinicky vyšetřována pro nádor levé příušní žlázy s opakovaným doporučením operace. Nemocná odmítla tenkojehlovou biopsii, CT vyšetření i plánovanou parotidektomii. První kontakt proběhl kvůli poúrazové epistaxi nesouvisející s nádorem. Jednalo se o nebolestivý multinodulární tumor velikosti cca 6x5x4cm v dolním pólu parotis. Při prvním kontaktu nebyly patrné známky obrny lícního nervu ani hmatná lymfadenopatie. Pacientka při první návštěvě udávala, že o tumoru ví asi sedm let. O tři roky později pacientka přichází znovu z důvodu zvětšování tumoru. Klinické a zobrazovací vyšetření potvrdily hypotenzní ostře ohraničený multinodulární útvar v povrchovém listu levé příušní žlázy rozměrů 8x7x6cm s ipsilaterální intraparotickou, horní a střední jugulární lymfadenopatií ve skupinách IIa a III (obr. 1). Pacientka tentokrát souhlasila s operací. Z důvodu nejasné předoperační diagnózy byla jedna z uzlin zaslána k pooperačnímu vyšetření ve zmraženém řezu.
Image 1. A: CT vyšetření s nálezem hypotenzního ostře ohraničeného multinodulárního útvaru v povrchovém listu levé příušní žlázy se stejnostrannou lymfadenopatií. B: fotografie nemocné se zjevným multinodulárním tumorem příušní žlázy. 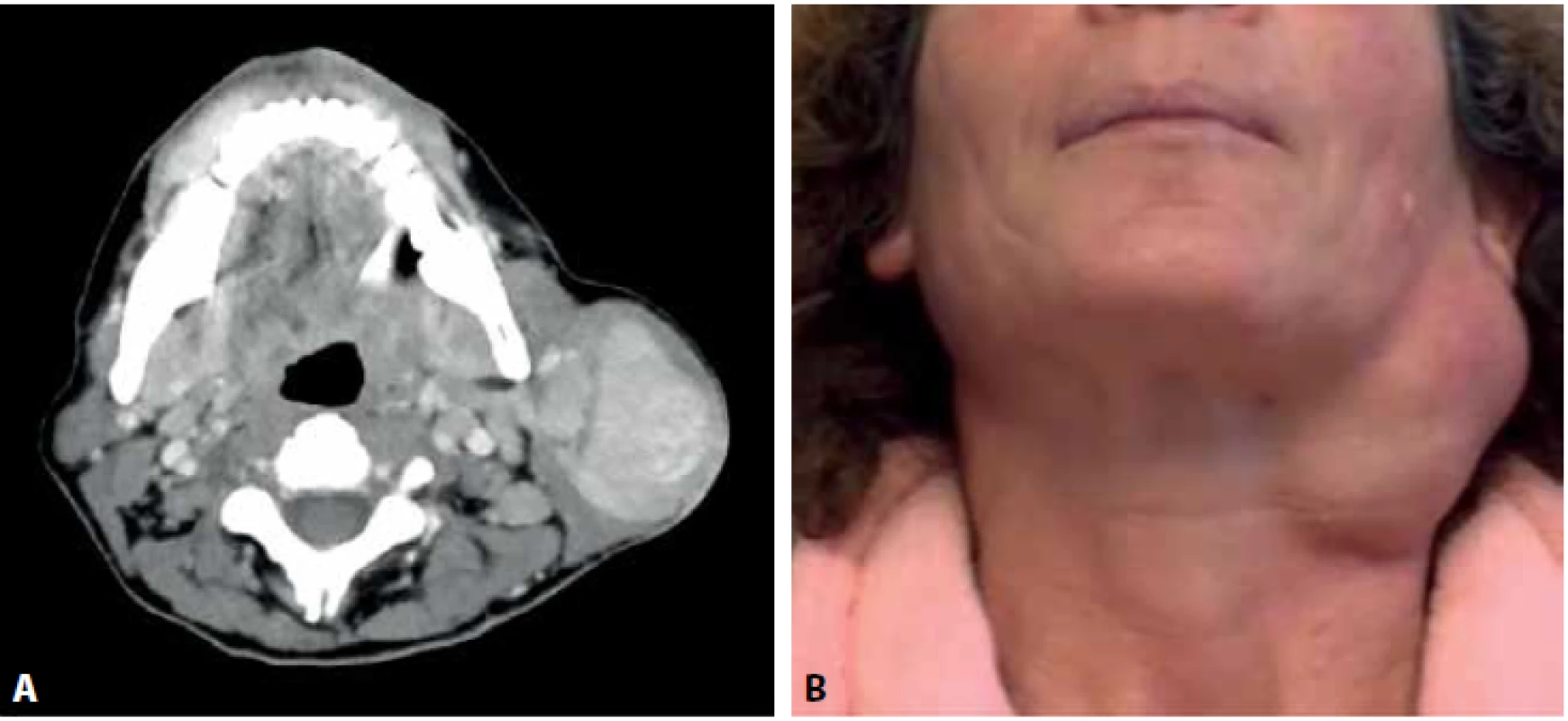
Mikroskopicky jsme ve zmražených řezech pozorovali mízní uzlinu s dobře zachovaným kortexem, přičemž parakortex a dřeň byly infiltrovány populací nekohezivních buněk s velkými světlými vezikulárními jádry a prominentními jadérky, některé buňky pak měly vzhled připomínající buňky Hodgkinovy či buňky Reed-Sternbergové, s vysokou mitotickou aktivitou (obr. 2AB). Pouze místy byly v postižené uzlině patrné skupinky kohezivních nádorových buněk v hnízdech či pruzích s mírnou desmoplasií stromatu (obr. 2C). Operatérovi byl sdělen nález suspektní z lymfomu. Na základě tohoto nálezu operatér neprovedl úplnou krční disekci a totální paroditektomii: operace byla dokončena v rozsahu superficiální parotidektomie a selektivní krční disekce skupin II-IV.
Image 2. Fotografie scanu zmrzlého řezu z mízní uzliny; A: zachovalý kortex, parakortex s infiltrací atypickými buňkami, HE, 18x, B: velké atypické nádorové buňky s vezikulárními jádry, nápadnými jadérky a mitotickou aktivitou, HE, 145x, C: kohezivní shluky atypických buněk s desmoplasií stromatu, HE, 86x, D: následná immunohistochemie p63s pozitivitou v atypických buňkách, 146x. 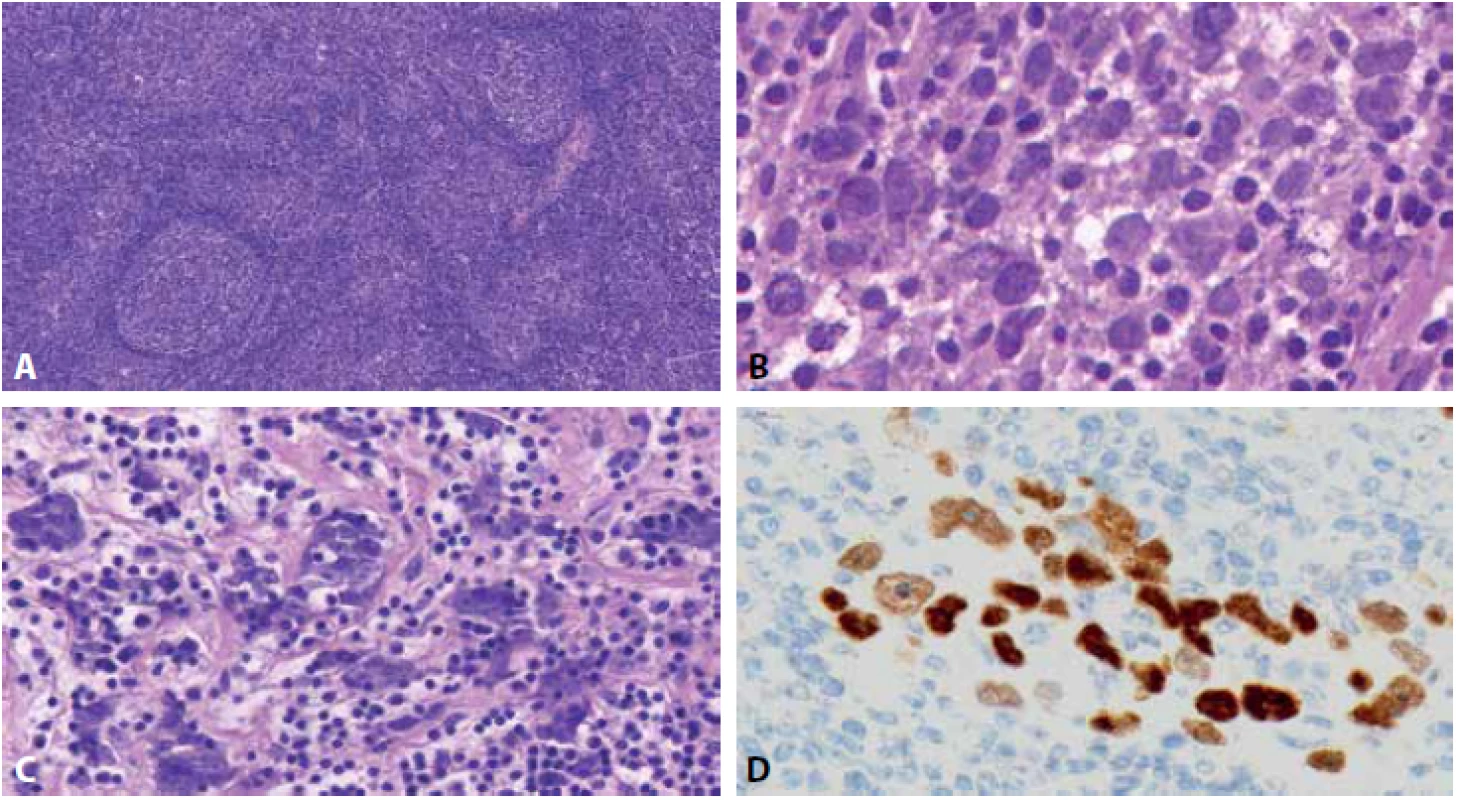
Posléze byla uzlina fixována ve formolu a zpracována v parafinových řezech. Popsané atypické buňky vykazovaly imunohistochemickou pozitivitu p63(ZETA Corp. 4A4 1 : 50)(obr. 2D) a vysokou míru proliferace (Ki67) přes 90 %. Všechny vyšetřované lymfocytární markery - PAX5(Roche, SP34, ready to use), CD20(DAKO, L26, 1 : 100), CD3(Novocastra, NCL-L-CD3-565, 1 : 50), CD5(Inovative Diagnostic, SP19, 1 : 50), CD30(DAKO, Ber-H2, 1 : 75) a CD15(Roche, MMA, ready to use) – byly v atypických buňkách negativní.
Ve fixovaném resekátu parotis byl makroskopicky nalezen šedavý tuhý tumor velikosti 42x30x22mm s lemem nenádorové tkáně slinné žlázy v rozsahu 22x22x16mm. V okolí tumoru byly uzliny suspektní z metastatické infiltrace velikosti do 22mm, v materiálu z lymfadenektomie bylo několik suspektních uzlin velikosti až 28mm.
Mikroskopicky jsme nalezli ve tkáni slinné žlázy ACC vykazující částečně konvenční morfologii z bifázickou epitelo-myoepiteliální diferenciací. Část nádoru vykazovala obraz high-grade transformace solidní a částečně kribriformní stavby, s výraznými cytonukleárními atypiemi, s vezikulárními jádry, prominentními jadérky a mitózami (obr. 3A). Nádor byl relativně dobře ohraničený, v jednom místě byla patrná perineurální a žilní invaze. Imunohistochemicky byla konvenční i high-grade komponenta silně pozitivní v průkazu p40(Roche, BC28, ready to use)(obr. 3B) a p63(ZETA Corp. 4A4 1 : 50). CD117 (BIO SB, EP10, 1 : 400) byl silně pozitivní v high-grade nádoru a kompletně negativní v konvenčním ACC (obr. 3C). Protein p53 vykazoval heterogenní wild-type expresi v obou komponentách. Hladkosvalový aktin (SMA, DAKO, 1A4, 1 : 400) byl pozitivní v myoepiteliálních buňkách v zevní vrstvě nádorových žlázek v konvenční části ACC, zatímco v high-grade komponentě byla patrná pozitivita SMA v nahodile distribuovaných buňkách nebo byl negativní. S100-protein (DAKO, polyclonal, 1 : 6000) byl silně pozitivní v high-grade nádoru, v konvenční části byla exprese patrná pouze v myoepiteliích (obr. 3D).
Image 3. Fotografie scanu parafinového řezu z resekátu tumoru s patrným rozhraním obou komponent ACC parotis; A: konvenční ACC vlevo, highgrade ACC vpravo, HE, 63x; B: silná imunohistochemická pozitivita p40 v obou komponentách, 46x, C: pozitivní imunohistochemie CD117 v highgrade komponentě (vpravo) a negativita v konvenčním ACC, s drobným ložiskem high-grade transformace (vlevo), 20x, D: difúzní imunoreaktivita S100 v high-grade ACC (vpravo) a pouze myoepiteliální pozitivita v konvenční části (vlevo), 54x. 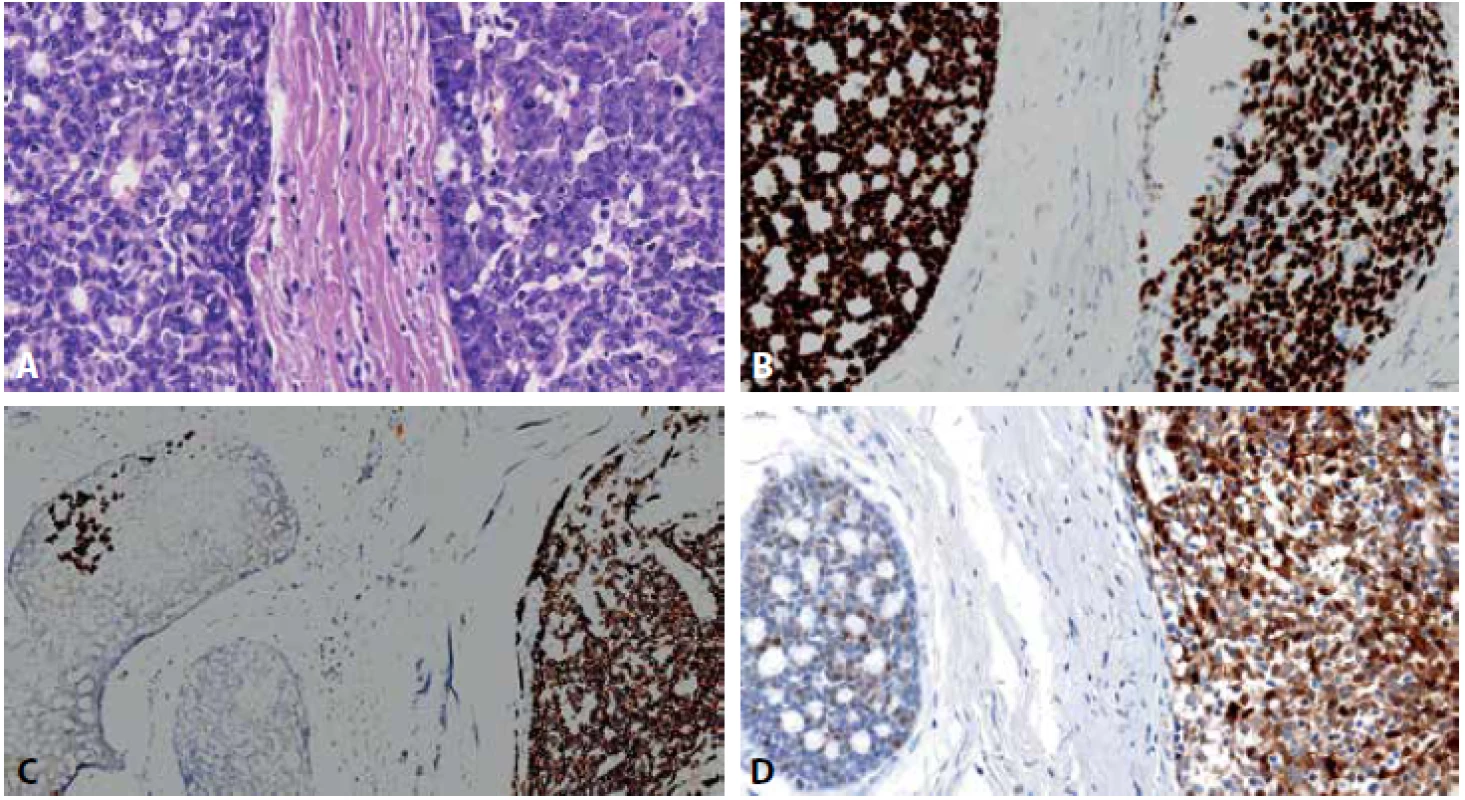
Chirurgické okraje resekátu byly nádoru prosté. Z 20 mízních uzlin byly v 17 přítomné metastázy ACC, velikost metastáz nepřesahovala 30mm, šíření nádoru přes pouzdro uzlin do perinodální tukové tkáně nalezeno nebylo. Nález tedy odpovídal stadiu pT3 pN2b (17/20) Pn1 V1 R0. Pooperační průběh byl klidný, na indikačním semináři byla pacientce doporučena adjuvantní chemoradioterapie, kterou však pacienta odmítla stejně jako další dispenzarizaci a její další osud nám není známý.
DISKUZE
High-grade transformace ACC, zvaná též dediferenciace, je poměrně vzácná a je spojená se špatnou prognózou. Histologicky pozorujeme u high-grade ACC zvýšenou mitotickou aktivitu a ztrátu charakteristické bifázické duktální-myoepiteliální struktury. Nejčastěji má ACC charakter málo diferencovaného kribriformního adenokarcinomu nebo solidního nediferencovaného karcinomu s velkými pleomorfními jádry, chromatin je obvykle vezikulární s výraznými jadérky. Podpůrná kritéria zahrnují případné komedo-nekrózy a desmoplastické stroma. Někdy lze pozorovat mikropapilární či skvamózní diferenciaci (4). High-grade ACC by měl obsahovat alespoň rezidua konvenčního ACC. Obě komponenty mohou být oddělené, někdy lze nalézt přechodnou zónu, která může pomoci odlišit high-grade ACC od hybridních tumorů, kdy jeden z nich je ACC (9). V našem případě lze pozorovat přechodnou zónu v imunohistochemii CD117 (obr. 3C).
Molekulárně genetické mechanismy podmiňující high-grade transformaci zahrnují několik genomických alterací, např. mutaci genu p53 nebo amplifikaci C-MYC (9,12). Jedna z teorií vysvětluje dediferenciaci ACC amplifikací genu HER-2/neu (5), která představuje nepříznivý prognostický znak u řady salivárních malignit (11). High-grade ACC je charakterizován ztrátou exprese myoepiteliálních markerů, i když u některých high-grade ACC je popisována pozitivita S100 (2), podobně jako v našem případě. Existují reference o vzácném dediferencovaném ACC s fenotypem myoepiteliálního karcinomu (13) s vřetenobuněčnou stavbou (14).
Hlavní diferenciálně diagnostické alternativy oproti konvenčnímu ACC slinných žláz zahrnují pleomorfní adenom, polymorfní (low-grade) adenokarcinom, epiteliální-myoepiteliální karcinom a adenokarcinom z bazálních buněk (1,15).
Odlišení ACC od pleomorfního adenomu a polymorfního adenokarcinomu je založeno na klasické histologii, kromě odlišné celkové stavby mají tyto léze jinou morfologii jader. Jádra v ACC jsou spíše angulovaná a hyperchromní, přičemž pleomorfní adenom a polymorfní adenokarcinom mají jádra oválná, spíše světlá a nesuspektní (16). I polymorfní adenokarcinom i ACC vykazují kribriformní architektoniku, infiltrativní způsob růstu a časné perineurální šíření, zatímco pleomorfní adenom je zpravidla dobře ohraničený. Jak polymorfní adenokarcinom, tak i ACC se často vyskytují v malých slinných žlázkách tvrdého patra. Při odlišení obou lézí může pomoci imunohistochemie CD117, přičemž ACC bývá silně pozitivní a polymorfní adenokarcinom má být pouze slabě pozitivní nebo negativní (17). Nicméně, v našem případě vykazovala jasnou pozitivitu CD117 pouze high-grade komponenta, která může být podle některých pramenů i zcela CD117-negativní (9). Spolehlivými markery při odlišení těchto tumorů jsou p40 a p63: ACC je p63+/p40+, zatímco polymorfní adenokarcinom je p63+/p40-. Odlišení ACC od pleomorfního adenomu se pak zakládá hlavně na morfologii, neboť oba nádory jsou p63+/p40+ (18).
Epiteliální-myoepiteliální karcinom a bazocelulární adenokarcinom se pak liší od ACC zejména morfologicky - epiteliální-myoepiteliální karcinom je častěji opouzdřený a mikroskopicky sestává z vývodů charakteristické bifázické stavby s vnitřní vrstvou luminálních buněk a zevní vrstvou myoepitelií. Bazocelulární adenokarcinom je pak tvořen hnízdy z velkých světlých a malých tmavých buněk s periferním palisádováním, příležitostně lze najít tubulární formace. Společným rysem s ACC je pak přítomnost matrix bazálních membrán v nádorovém stromatu, naopak perineurální šíření nacházíme u bazocelulárního adenokarcinomu zřídka. ACC má oproti epiteliálnímu-myoepiteliálnímu karcinomu i oproti bazocelulárnímu adenokarcinomu horší prognózu s tendencí k recidivám (15).
V malých slinných žlázkách v ústní dutině je další diferenciálně diagnostickou možností bazaloidní spinocelulární karcinom (SCC), který se od ACC liší přítomností komedo-nekróz a abruptního rohovění v bazaloidní komponentě, odlišení však může být problematické v malých biopsiích. Bazaloidní SCC i ACC sestávají z menších nádorových buněk s protáhlými hyperchromními jádry a se sporou cytoplazmou, obě léze jsou p40 a p63 pozitivní. Spolu s morfologií může být vodítkem ke správné diagnóze zejména distribuce pozitivity p63: zatímco bazaloidní SCC exprimuje p63 difúzně, ACC vykazuje kompartmentalizaci exprese, přičemž p63 barví buď periferní vrstvu v dvouvrstevných nádorových tubulech nebo se barví mnohočetná glandulární/kribriformní hnízda nádorových buněk, která jsou promíchána s nádorovými p63-negativními buňkami (19).
Vzácným nádorem příušní slinné žlázy, který může připomínat ACC, je intraduktální karcinom (dříve low-grade kribriformní cystadenokarcinom), mikroskopicky sestávající z dobře ohraničených nádorových ostrůvků, z nichž některé mohou být cysticky dilatované; architektonika samotných ostrůvku je kribriformní, solidní nebo mikropapilární, bez komedo-nekróz. Hlavním rozdílem oproti ACC jsou pak jádra nádorových buněk, která v případě intraduktálního karcinomu nevykazují žádné signifikantní atypie (21,22), zatímco u ACC jsou hyperchromní a angulovaná.
Ve většině případů vystačíme v diferenciální diagnostice nádorů slinných žláz s mikroskopií a imunohistochemií; ve sporných případech lze užít také metody molekulárně-genetické, např. při malém množství bioptického materiálu. Ve většině ACC se nachází translokace (6;9)(q22-23;p23-34) s fúzí genů MYB-NFIB (22). V našem případě molekulární vyšetření kvůli zjevné diagnóze ACC z resekátu tumoru indikováno nebylo.
V případě high-grade transformace ACC, pokud nezastihujeme zároveň konvenční ACC, je diferenciálně diagnostická paleta výrazně širší – lze uvažovat o high-grade salivárním duktálním karcinomu nebo o metastáze jiného origa. Při velmi variabilní a necharakteristické morfologii je klíčové vůbec rozpoznat, že se jedná o epitelový nádor. Ještě složitější je situace, tak jako v našem případě, při identifikaci uzlinové metastázy high-grade ACC, kdy může tato imponovat nejen jako high-grade karcinom, ale může připomínat různé typy lymfomu – anaplastický velkobuněčný T-lymfom (ALCL), difúzní velkobuněčný B-lymfom nebo dokonce jako klasický Hodgkinův lymfom. Klíčem ke správné diagnóze je, jak je v patologii obvyklé, adekvátní a správné zablokování materiálu, dobře indikovaná imunohistochemie a klinicko-patologická korelace. Náš případ demonstruje svízelnost peroperační diagnostiky uzlinových procesů ve zmraženém řezu.
Pokud se týká terapie high-grade ACC, kvůli častému výskytu uzlinových metastáz, který je 5-10krát častější u high-grade ACC než u konvenčního, Hellquist et al. doporučují krční disekci u těchto nemocných. Je-li diagnóza high-grade ACC zjevná až po resekci tumoru, je na místě pooperační radioterapie nebo elektivní krční disekce v druhé době (9). V našem případě však pacientka odmítla další léčbu i sledování.
Řečeno souhrnně, v této práci popisujeme vzácný případ high-grade ACC příušní slinné žlázy, který byl podle našich znalostí v parotis popsán pouze v 10 případech, přičemž uzlinové postižení je ještě o trochu vzácnější.
PODĚKOVÁNÍ
Tato práce byla podpořena z grantu výzkumného projektu PROGRES Q28 onkologie.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Jan Hrudka, Ph.D.
Ústav patologie 3. lékařské fakulty Univerzity Karlovy
a Fakultní nemocnice Královské Vinohrady
Ruská 87, 100 00, Praha 10
e-mail: jan.hrudka@lf3.cuni.cz
tel: +420 724 579 183
Sources
Stenman G, Licitra L, Said-Al-Naief N, van Zante A, Yarbrough WG. Adenoid cystic carcinoma. In: El-Naggar AK, Chan JKC, Grandis JR, Takata T, Slootweg PJ, eds. WHO Classification of Head and Neck Tumours (4th ed). IARC: Lyon; 2017 : 164-165.
Cheuk W, Chan JK, Ngan RK. Dedifferentiation in adenoid cystic carcinoma of salivary gland: an uncommon complication associated with an accelerated clinical course. Am J Surg Pathol 1999; 23(4): 465-472.
Nagao T. Dedifferentiation and high-grade transformation in salivary gland carcinomas. Head Neck Pathol 2013; Suppl 1: S37-47.
Seethala RR, Hunt JL, Baloch ZW, Livolsi VA, Leon Barnes E. Adenoid cystic carcinoma with high-grade transformation: a report of 11 cases and review of the literature. Am J Surg Pathol 2007; 31(11): 1683-1694.
Nagao T, Gaffey TA, Serizawa H, et al. Dedifferentiated adenoid cystic carcinoma: a clinicopathologic study of 6 cases. Mod Pathol 2003; 16(12): 1265-1272.
Coca-Pelaz A, Rodrigo JP, Bradley PJ, et al. Adenoid cystic carcinoma of the head and neck-An update. Oral Oncol 2015; 51(7): 652-661.
Marcinow A, Ozer E, Teknos T, et al. Clinicopathologic predictors of recurrence and overall survival in adenoid cystic carcinoma of the head and neck: a single institutional experience at a tertiary care center. Head Neck 2014; 36(12): 1705-1711.
Retting EM, Tan M, Ling S, Yonescu R, Bishop JA, Fakhry C, Ha PK. MYB rearrangement and clinicopathologic characteristics in head and neck adenoid cystic carcinoma. Laryngoscope 2015; 125(9): E292-299.
Hellquist H, Skálová A, Barnes L, et al. Cervical lymph node metastasis in high-grade transformation of head and neck adenoid cystic carcinoma: a collective international review. Adv Ther 2016; 33(3): 357-368.
International Head And Neck Scientific Group. Cervical lymph node metastasis in adenoid cystic carcinoma of the major salivary glands. J Laryngol Otol 2017; 131(2): 96-105.
Ettl T, Stiegler C, Zeitler K, et al. EGFR, HER2, survivin, and loss of pSTAT3 characterize high-grade malignancy in salivary gland cancer with impact on prognosis. Hum Pathol 2012; 43(6): 921-931.
Chau Y, Hongyo T, Aozasa K, Chan JK. Dedifferentiation of adenoid cystic carcinoma: a report of a case implicating p53 gene mutation. Hum Pathol 2001; 32(12): 1403-1407.
Tando S, Nagao T, Kayano K, Fushiki S, Itoh K. High-grade transformation/dedifferentiation of an adenoid cystic carcinoma of the minor salivary gland to myoepithelial carcinoma. Pathol Int 2018; 68(2): 133-138.
Miyazaki M, Aoki M, Koga K, et al. Adenoid cystic carcinoma with high-grade transformation forming spindle cell komponent of the submandibular gland. Auris Nasus Larynx 2019; 46(6): 934-939.
Di Palma S, Simpson RHW, Skálová A, Leivo I. Groβe und kleine Speicheldrüsen. In: Cardesa A, Mentzel T, Rudolph P, Slootweg PJ, eds. Pathologie, Kopf-Hals-Region, Weichgewebstumoren, Haut (3. Auflage). Springer-Verlag Berlin Heidelberg; 2009 : 178-183.
McHugh JB. Upper aerodigestive tract. In: Goldblum JR, Lamps LW, McKenney JK, Myers JL, eds. Rosai and Ackerman´s surgical patology (11th ed). Elsevier, Philadelphia; 2018: p. 158-159.
Penner CR, Folpe AL, Budnick SD. C-kit expression distinguishes salivary gland adenoid cystic carcinoma from polymorphous low-grade adenocarcinoma. Mod Pathol 2002; 15(17): 687-691.
Rooper L, Sharma R, Bishop JA. Polymorphous low grade adenocarcinoma has a consistent p63+/p40 - immunophenotype that helps distinguish it from adenoid cystic carcinoma and cellular pleomorphic adenoma. Head Neck Pathol 2015; 9(1): 79-84.
Emanuel P, Wang B, Wu M, Burstein DE. p63 Immunohistochemistry in the distinction of adenoid cystic carcinoma from basaloid squamous cell carcinoma. Mod Pathol 2005; 18(5): 645-650.
Laco J, Podhola M, Doležalová H. Low-grade cribriform cystadenocarcinoma of the parotid gland: a neoplasm with favorable prognosis, distinct from salivary duct carcinoma. Int J Surg Pathol 2010; 18(5): 369-373.
Wang L, Liu Y, Lin X, Zhang D, Li Q, Quiu X, Wang EH. Low-grade cribriform cystadenocarcinoma of salivary glands: report of two cases and review of the literature. Diagn Pathol 2013; 8 : 28.
Skálová A, Stenman G, Simpson RHW, et al. The Role of Molecular Testing in the Differential Diagnosis of Salivary Gland Carcinomas. Am J Surg Pathol 2018; 42(2): e11-e27.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2020 Issue 3-
All articles in this issue
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Praktické využití imunohistochemie a genetiky v diagnostice nádorů varlat
- Využití imunohistochemie v patologii prostaty
- Gossypibóm – imitujúci recidívu nádoru mandibuly: kazuistika
- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Karcinom z Merkelových buněk se skvamózní diferenciací – kazuistika
- Praktická imunohistochémia v genitourinárnej patológii
- Profesor Ivo Šteiner osmdesátiletý
- Monitor aneb nemělo by vám uniknout, že...
- Monitor aneb nemělo by vám uniknout, že...
- Diagnostic Histopathology of Tumors
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie v patologii prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

