-
Medical journals
- Career
Incidence, diagnostika a léčba karcinomu prostaty u HIV pozitivních pacientů
Authors: Jan Hrbáček 1; Jiří Heráček 1,2; Václav Eis 3; Eva Hamšíková 4; Ruth Tachezy 4; Michael Urban 1,2
Authors‘ workplace: Urologická klinika 3. LF UK a FNKV Praha 1; Androgeos, Praha 2; Ústav patologie 3. LF UK a FNKV, Praha 3; Ústav hematologie a krevní transfuze Praha 4
Published in: Ces Urol 2010; 14(1): 16-23
Category: Review article
Overview
Cílem přehledového článku je shrnout dosavadní publikace, které se zabývají výskytem, diagnostikou a léčbou karcinomu prostaty v HIV pozitivní populaci. Relevantní publikace jsme vybrali na základě rešerše v databázi Medline.
Zavedení vysoce aktivní antiretrovirové terapie do léčby infekce virem lidské imunodeficience prodloužilo celkové přežívání pacientů s tímto onemocněním. V důsledku toho však mimo jiné častěji trpí tito pacienti zhoubnými nádory. Incidence některých malignit je v HIV pozitivní populaci vyšší než u osob HIV negativních. Dosavadní studie zabývající se výskytem nádorových onemocnění dokumentují relativně nižší incidenci karcinomu prostaty u pacientů s HIV. Touto problematikou se však dosud zabývalo relativně málo autorů. Současné poznatky nasvědčují, že v otázce screeningu, diagnostiky, terapie a sledování pacientů s karcinomem prostaty není třeba používané algoritmy u HIV pozitivní populace zásadně modifikovat.Klíčová slova:
AIDS, HAART, HIV, karcinom prostaty, muži.ÚVOD
Zavedení vysoce aktivní antiretrovirové terapie (HAART – Highly Active Antiretroviral Therapy) do léčby infekce HIV/AIDS (Human Immunodeficiency Virus/Acquired Immune Deficiency Syndrome) v letech 1995–1996 vedlo k významnému snížení morbidity i mortality na toto dosud fatální onemocnění. Z obávané smrtící nemoci se v průběhu posledních let stala jen další chronická choroba současnosti. Prodloužené přežívání pacientů s HIV/AIDS však vytváří podmínky pro rozvoj jiných nemocí včetně zhoubných nádorů.
Tři z nich – Kaposiho sarkom, non-hodgkinský lymfom (NHL) a invazivní karcinom cervixu – jsou projevem plně rozvinutého AIDS. Anglicky se označují jako AIDS – defining cancers (ADC), nádory spojené s AIDS, neboť jejich vznik je jedním z kritérií přechodu HIV infekce v rozvinutý AIDS (1). U pacientů s HIV se častěji než v běžné populaci vyskytují i některé jiné zhoubné nádory. Označují se jako non-AIDS defining cancers (NADC), nádory neasociované s AIDS.
Karcinom prostaty (KP) je nejčastěji diagnostikovaným zhoubným nádorem u mužů. V roce 2006 představoval přibližně 20 % všech nově diagnostikovaných malignit u mužů (vyjma kožních nádorů). Jeho incidence v posledních dvaceti letech dramaticky roste, mezi jednotlivými státy jsou však rozdíly (2). Výskyt KP roste exponenciálně s věkem a také proto byla donedávna koincidence HIV a KP ryze akademickou otázkou. Se zavedením HAART ovšem vzrůstá počet pacientů, u nichž diagnostikujeme obě nemoci.
HIV A KARCINOM PROSTATY
Pravděpodobnost onemocnění zhoubným nádorem je u HIV pozitivních pacientů v průběhu jejich života 30–40%. Mnoho maligních nádorů se u HIV pozitivních osob vyskytuje častěji než v běžné populaci. Jde zejména o nádory anorekta, Hodgkinův lymfom, hepatocelulární karcinom, nádory orofaryngu, plic, melanom a leukémii (3–5).
Důvodů může být několik. Prvním je snížená schopnost imunitní odpovědi organismu s poruchou buněčné imunity a dysregulací cytokinů (6), dalším pak konkomitantní infekce viry s onkogenním potenciálem nebo onkogenní aktivita vlastního HIV (7). Grulich et al. (8) analyzovali sedm studií pacientů s HIV/ AIDS a pět studií imunosuprimovaných pacientů po transplantaci. Odhalili signifikantně vyšší výskyt 20 typů zhoubných nádorů v obou skupinách. Většinou se jednalo o neoplazie prokazatelně infekční etiologie (tumory způsobené HPV, Hodgkinův lymfom, hepatocelulární karcinom) a nejběžnější epiteliální nádory zvýšenou incidenci nevykazovaly. Autoři uzavírají, že rakovinné bujení infekční etiologie se v budoucnu stane důležitou komplikací HIV infekce (8). Třetí příčinu zvýšeného výskytu maligního bujení tvoří životní styl pacientů včetně konzumace alkoholu, kouření a promiskuity (1, 3).
Po zavedení HAART do klinické praxe se zvýšil počet HIV pozitivních osob, které zemřely dříve, než se dostaly do stadia rozvinutého AIDS, a současně vzrostl průměrný věk v době úmrtí (z 37,4 na 41,8 let mezi obdobím 1994 až 1995 a 1998–2001) (9). Poklesl také globální výskyt maligních nádorů u pacientů s HIV/ AIDS: relativní riziko v letech 1996–2002 činilo RR = 0,9 (95% interval spolehlivosti CI 0,7–1,0) oproti období 1991–1995. V éře HAART došlo k významnému poklesu dvou hlavních ADC (Kaposiho sarkomu a NHL) a současně vzrostl výskyt NADC, jež nyní tvoří většinu nádorů u osob s HIV (1). Některé studie připisují užívání HAART protinádorový účinek, tento efekt však není jednoznačný (7). Záleží zřejmě na etiologii konkrétního nádoru, léčbě HIV a snad i na dalších faktorech (5, 10).
Table 1. Přehled studií HIV pozitivních pacientů s neoplazií prostaty Table 1. Studies focusing on HIV positive individuals with prostate cancer 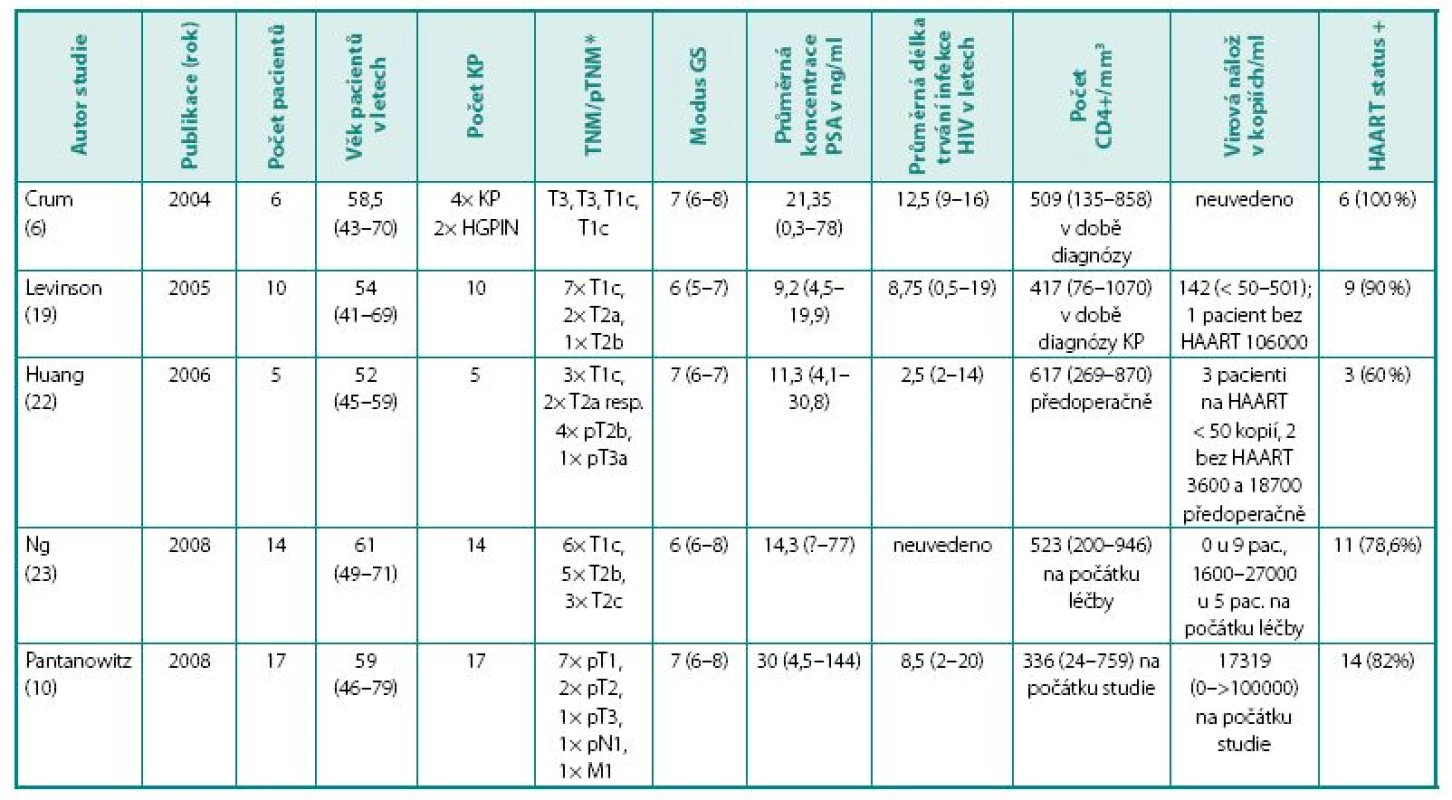
n – počet diagnostikovaných osob, KP – karcinom prostaty, HGPIN – high-grade prostatická intraepiteliální neoplazie, TNM – stadium nemoci, GS – Gleasonovo skóre, PSA – prostatický specifický antigen, HAART status + – počet pacientů užívajících vysoce aktivní antiretrovirovou terapii *Kompletní staging včetně postižení lymfatických uzlin a vzdálených metastáz nebyl u všech pacientů všech studií dostupný n – number of subjects, KP – prostate cancer, HGPIN high-grade prostatic intraepithelial neoplasia, TNM – disease classification, GS – Gleason score, PSA – prostatic specific antigen, HAART status + – number of patients on highly active antiretroviral therapy, * staging details including lymph node involvement and distant metastasis were not available for all patients of all studies. První publikace na dané téma se objevily na přelomu 80. a 90. let minulého století. Zpočátku se jednalo pochopitelně o kuriózní kazuistiky. Staiman a Lowe (11) referovali o HIV pozitivním pacientovi, jemuž po brachyterapii pro KP diagnostikovali enterokokový prostatický absces. Schwartz a Prince (12) popsali případ 43letého pacienta s HIV infekcí, diseminovanou intravaskulární koagulopatií (DIC), krvácením do gastrointestinálního traktu, bolestí beder a progredující slabostí. Punkce kostní dřeně odhalila metastázy KP. V roce 2003 publikovali Furco et al. (13) případ čtyřicetiletého muže s HIV infekcí ve stadiu B1 na antiretrovirové terapii s generalizovaným KP. Další, italská kazuistika (14) popisovala 53letého pacienta s léčenou infekcí HIV hospitalizovaného pro nespecifické celkové příznaky. Vyšetření odhalilo metastatický rozsev KP do skeletu; pacient zemřel po 7 týdnech na DIC. Quatan et al. (15) popsali v roce 2005 dva muže s KP a s HIV na antiretrovirové terapii: pacient A (64 let, prostatický specifický antigen (PSA) 9,5, Gleasonovo skóre (GS) 3+2, lokalizovaný KP), pacient B (58 let, PSA 5638, GS neuvedeno, s generalizací nemoci do skeletu). V době publikace uběhly od diagnózy 4, resp. 3 roky a oba muži byli stále naživu.
Další publikace lze rozdělit do dvou skupin: První se týká výhradně pacientů s HIV a KP, publikované soubory čítají do 20 pacientů a blíží se spíše souborům kazuistik (tabulka 1 uvádí přehled studií u HIV pozitivních pacientů s neoplazií prostaty); druhou skupinu představují rozsáhlé populační studie zejména americké provenience zabývající se souvislostí infekce HIV a incidence nádorových onemocnění obecně. Hodnotný přehledový článek na toto téma publikoval v roce 2008 Silberstein (16).
Burgi et al. (7) zahrnuli v roce 2005 do retrospektivní studie 4144 HIV pozitivních pacientů. Zaznamenali výskyt 133 NADC, z nichž nejčastější byly basaliomy a spinaliomy kůže. KP představoval 4,5 % malignit, což je hodnota vyšší než u běžné americké populace. Výskyt NADC pozitivně koreloval s věkem nad 40 let, s délkou trvání HIV infekce, počtem CD4+ lymfocytů při diagnóze malignity a výskytem oportunní infekce v anamnéze (7).
Recentní rozsáhlá retrospektivní kohortová studie provedená ve Spojených státech amerických se zabývala výskytem neoplazií u pacientů s infekcí HIV, u nichž se dosud AIDS nerozvinul. V souboru 57 350 osob studie zaznamenala v průběhu pěti let následujících po zanesení diagnózy HIV do registru celkem 871 případů nádorového bujení; 46 % z nich patřilo mezi AIDS-defining cancers, 54 % tvořily NADC. Autoři vypočetli standardizovaný incidenční index (SIR – poměr incidence nádoru v HIV pozitivní populaci a incidence v běžné populaci). V případě KP byl SIR = 0,3, což znamená nižší výskyt mezi HIV pozitivními osobami než u HIV negativních osob (1). Souměřitelný výsledek pro KP (SIR = 0,6) uvádí i další rozsáhlá populační studie zahrnující 54 780 osob s infekcí HIV (3).
Biggar et al. (4) zkoumali, zda incidence maligních nádorů ve skupině HIV pozitivních pacientů starších 60 let převyšuje výskyt v běžné populaci. Propojením onkologických registrů s databázemi osob s HIV v šesti státech USA vyhodnotili celkem 8828 pacientů, z nichž 83,3 % tvořili muži. KP v 118 případech byl mezi NADC nejčastějším nádorem s relativním rizikem výskytu 0,8 (4).
Podobnou metodu použili Hessol et al. (5), když spojili kalifornské databáze pacientů s HIV a s nádorovým onemocněním. Pravděpodobnost výskytu malignity byla u HIV pozitivních pacientů vyšší než ve zdravé populaci a také vyšší v éře HAART než před ní. Současně však u mužů užívajících HAART bylo nižší riziko vzniku neoplazie než u pacientů, kteří antiretrovirotika neužívali. Riziko KP u HIV pozitivní populace bylo zvýšené, SIR = 1,7 (5).
Crum et al. (6) prováděli v letech 2002 až 2003 v rámci dispenzarizace HIV pozitivních pacientů rutinní kontroly PSA a vyšetření per rectum (DRE). Při suspektní hodnotě PSA (vztažené k věku) nebo abnormálním nálezu při DRE pacienta urologicky vyšetřili. Screeningu se zúčastnilo 269 mužů. Žádný z nich však neměl palpační nález na prostatě suspektní z malignity. S odběrem PSA souhlasilo 216 (80,3 %) pacientů, zvýšenou hodnotu zjistili u sedmi z nich. U jednoho pacienta lékaři prokázali biopticky high-grade prostatickou intraepiteliální neoplazii (HGPIN), u třech mužů diagnostikovali dalším vyšetřením prostatitidu, u zbylých pacientů zůstala etiologie elevace PSA nejasná a při opakovaném odběru byl výsledek v referenčních mezích. Autoři zmiňují pět případů HIV pozitivních pacientů s diagnostikovaným KP a HGPIN v průběhu dvou let před zahájením jmenované studie. Výskyt karcinomu pozitivně koreloval s věkem a délkou trvání infekce (ve shodě s Burgim et al. (7)). Souvislost naopak neprokázali mezi karcinomem a počtem CD4+ buněk (na rozdíl od Burgiho studie), užíváním HAART, sérovou koncentrací testosteronu či PSA nebo virovou náloží HIV (6).
Proč má být incidence KP u pacientů s HIV nižší, jestliže řada jiných nádorů se vyskytuje častěji? Někteří autoři se domnívají, že je to nižšími hladinami androgenů, které HIV infekci provázejí; hypogonadismus je u HIV pozitivních pacientů o 20 % častější než ve stejné věkové populaci zdravých mužů. Jeho etiologie je pravděpodobně kombinovaná a podílejí se na ní vlastní infekce HIV, malnutrice, oportunní infekce a také užívání HAART (16). Jiní uvádějí, že jde o zkreslení dané méně agresivním screeningem v HIV pozitivní populaci (4). Pacienti s HIV jsou zpravidla sledováni podrobněji než většina běžné populace, není ovšem jasné, do jaké míry u nich lékaři provádějí pravidelné kontroly PSA a DRE.
Autoři, kteří uvádějí vyšší incidenci KP v HIV pozitivní populaci, ji etiologicky vysvětlují mj. chronickou prostatitidou, která se u pacientů vyskytuje často a bývá hlavní příčinou elevace PSA. Recentní výzkumy dávají chronický zánět prostaty do souvislosti se vznikem proliferativní zánětlivé atrofie, prostatické intraepiteliální neoplazie a také KP (6, 17, 18).
Table 2. Přehled studií zabývajících se incidencí nádorových onemocnění v HIV pozitivní populaci Table 2. Studies of cancer incidence among HIV positive patients 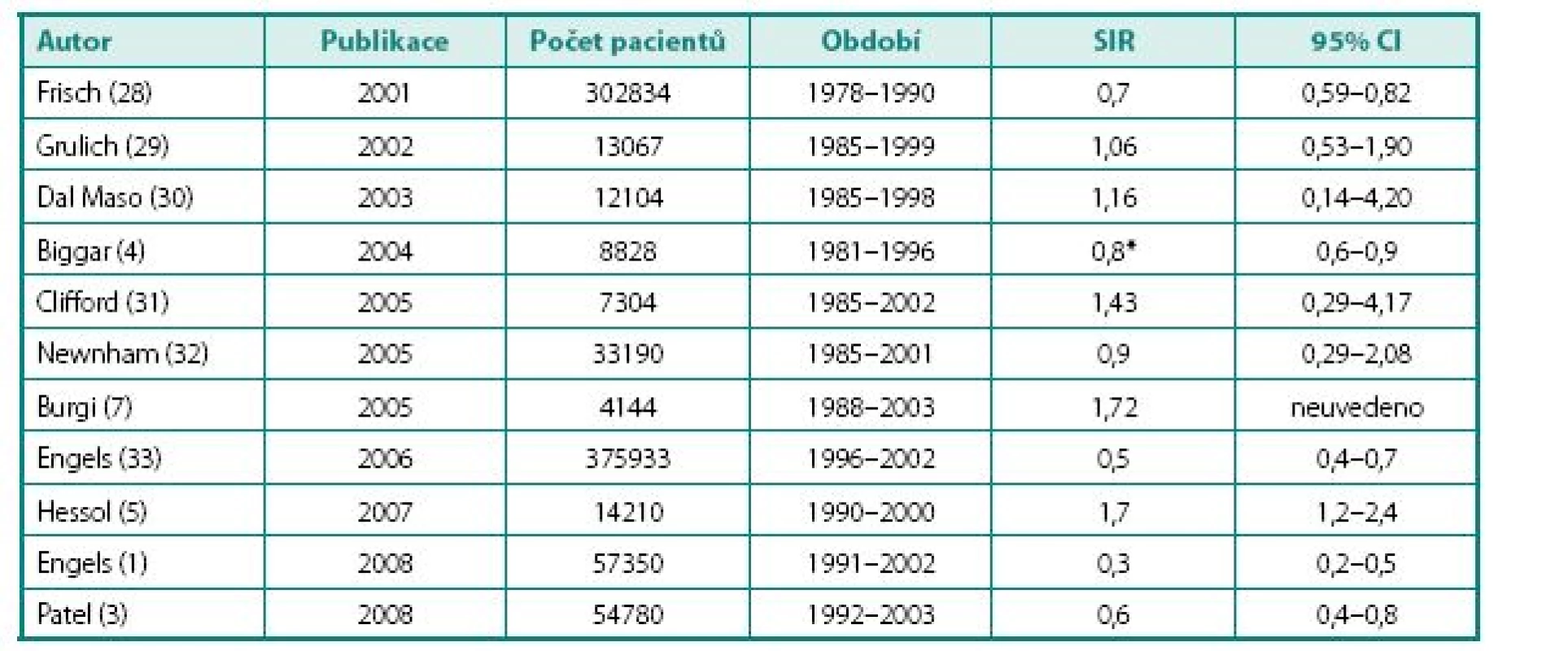
SIR – standardizovaný incidenční index pro karcinom prostaty, CI – interval spolehlivosti * Jedná se o relativní riziko (RR), nikoli SIR; upraveno podle Pantanovitze et al. (10). SIR – Standardized Incidence Ratio for prostate cancer, CI – confidence interval, * relative risk (RR) instead of SIR; adapted from: Pantanowitz et al. (10) S případným vyšším výskytem KP u HIV pozitivních pacientů anebo jeho incidencí v mladším věku souvisí otázka screeningu a diagnostického postupu. Crum et al. (6) uvádějí 20,5× vyšší incidenci KP u HIV pozitivních pacientů ve věku mezi 60–70 lety ve srovnání se séronegativní populací. V mladších věkových skupinách rozdíl nepozorovali a uzavírají, že modifikace standardních screeningových schémat není nutná (6). Ke stejnému závěru došli i jiní autoři (19, 20). Paradoxně naprosto opačný výsledek uvádějí Pantanowitz et al. (10): Incidence KP není u HIV pozitivních pacientů vyšší než v běžné populaci, avšak KP se u nich vyskytuje v mladším věku (10). Pro ilustraci: Crumova studie je založena na čtyřech pacientech s KP a dvou s HGPIN, Pantanowitzův soubor čítá 17 pacientů s KP.
V případě KP dospěly provedené výzkumy k rozdílným výsledkům, které dokumentuje tabulka 2 se shrnutím SIR z několika studií. Rozsáhlejší z nich však shodně uvádějí nižší hodnoty SIR než v běžné populaci. Pohled na intervaly spolehlivosti ostatních navíc svědčí o jejich nevelké výpovědní hodnotě.
Podle dosavadních poznatků není biopsie prostaty pod ultrazvukovou kontrolou zatížena zvýšenou morbiditou ani u imunokompromitovaných pacientů s HIV (16). Při odběru biopsie u pacientů s potvrzenou infekcí HIV je třeba klást zvýšený důraz na správnou dezinfekci nástrojů a minimalizaci rizika přenosu viru (21).
Před zavedením HAART byla u HIV pozitivních pacientů jedinou používanou kurativní léčbou zevní radioterapie; dnešní pohled je zcela jiný a publikované studie naznačují, že mezi séropozitivními a zdravými pacienty není třeba v léčbě KP činit rozdíly.
Chirurgické výkony obecně představují pro organismus značnou zátěž, a proto je nutné, aby se k elektivním operacím pacient dostával v nejlepším možném zdravotním stavu. Jako proměnné, jež ovlivňující výsledek zákroku u HIV pozitivních pacientů, se uvádějí počet lymfocytů CD4+, klinická kategorie infekce HIV, druh operačního výkonu a hladina sérového albuminu. Zatímco reálný přínos informací o počtu CD4+ a klinické kategorii HIV vyžaduje další zkoumání, hypalbuminémie (pod 35 g/l) je spojena s vyšší morbiditou a je přesnějším prediktorem mortality než počet CD4+. Podle dosavadních poznatků operační výkony v břišní dutině u HIV pozitivních pacientů přinášejí vyšší počet komplikací než menší otevřené operace a endoskopické výkony. Rozsáhlejší data pro urologii nejsou k dispozici. Analogicky lze odvodit, že na běžné urologické výkony (TUR, TURP, menší otevřené operační zákroky) by séropozitivita HIV neměla mít vliv, zatímco u náročnějších procedur (nefrektomie, radikální prostatektomie, cystektomie) lze dopad porušené imunity těžko předvídat. Příprava HIV pozitivního pacienta před radikální prostatektomií by měla zahrnovat anamnézu prodělaných oportunních infekcí, všechna běžná předoperační vyšetření a dále stanovení počtu CD4+ lymfocytů, virové nálože a hladiny albuminu. Optimalizace imunitního stavu je imperativem (22). Z hlediska operatéra se nabízí možnost využít robotickou radikální prostatektomii, která zcela minimalizuje riziko přenosu infekce (19).
Huang et al. (22) léčili pět pacientů s klinicky lokalizovaným KP a kompenzovanou infekcí HIV (kategorie A1 nebo A2) radikální prostatektomií. Všechny operace proběhly úspěšně s negativními chirurgickými okraji resekátu, u jednoho pacienta zjistili nádorem postižené pánevní lymfatické uzliny. U dvou mužů se vyskytla infekce v ráně, jeden z pacientů musel být léčen za hospitalizace intravenózní aplikací antibiotik. Při poslední kontrole (sledování v rozmezí 11–32 měsíců) byly hladiny PSA u všech mužů pod 0,1 ng/ml. HIV infekce u žádného pacienta neprogredovala do AIDS (22).
Ng et al. (23) publikovali soubor 14 HIV pozitivních mužů s KP léčeným zevní radioterapií (dva pacienti), brachyterapií (4) nebo kombinací obou metod (8). Hladina PSA u 13 poklesla pod 1,1 ng/ml, u zbývajícího pacienta se zdvojnásobila a scintigrafie skeletu odhalila ložisko suspektní z metastatického procesu. Infekce HIV měřeno počtem CD4+ lymfocytů byla stabilizovaná s výjimkou dvou pacientů. U jednoho autoři zaznamenali zhoršení celkového stavu provázené vzestupem virové nálože (ze 13 na 60 tisíc kopií/μl) a poklesem CD4+ lymfocytů (ze 700 na 200), u dalšího muže virová nálož vzrostla po ozáření z 3000 na 4342 kopií/μl). Vedlejší účinky léčby u žádného pacienta nepřesáhly 2. stupeň obecných kritérií toxicity (CTCAE). Nejčastějšími mikčními symptomy byly nykturie (1–3×), dysurie a slabý proud. Gastrointestinální potíže zahrnovaly intermitentní krvácení a odchod hlenu. Pět pacientů (36 %) trpělo průjmem, avšak nebylo možné odlišit, zda jde o následek radioterapie nebo vedlejší účinek antiretrovirové léčby. Osm pacientů (57 %) si stěžovalo na poruchu erekce, dva muži ztratili schopnost ejakulace a tři z devíti, kteří praktikovali receptivní anální styk, v něm nepokračovali. Dotazníkem kvality života při nádorové léčbě (FACT-G) autoři zjistili průměrný výsledek 80,1. Jak efekt léčby, tak míra nežádoucích účinků včetně ovlivnění kvality života jsou srovnatelné s údaji pro HIV negativní pacienty s KP léčené radioterapií. Autoři uzavírají, že ozařování nemá vliv na imunitní systém, a zvolíme-li tuto léčebnou modalitu, není důvod léčbu KP ve skupině HIV pozitivních oproti běžné populaci modifikovat (23). Nízkou míru akutní toxicity zevního ozáření a klesající PSA po dobu dalšího sledování uvádějí i O’Connor et al. (24).
Levinson et al. (19) popisují soubor deseti pacientů s HIV vyšetřených na urologické ambulanci během dvou let s nálezem elevace PSA a KP. Pacienti byli léčeni různými způsoby dle doporučení lékaře a vlastní volby: jeden laparoskopickou radikální prostatektomií, jeden kryoablační léčbou, jeden medikamentózní androgenní blokádou, dva brachyterapií (jeden z nich s neoadjuvantní hormonální léčbou), tři zevní radioterapií a dva zvolili sledování. Léčbu provázely standardní vedlejší účinky a pacienti ji vesměs dobře snášeli. V průběhu sledování (1,4–3,0 let) byly hladiny PSA nižší než na počátku léčby, u dvou pouze sledovaných pacientů zůstávaly stabilní (19).
V retrospektivní studii čtyř zdravotnických zařízení z let 1996–2006 shromáždili Pantanowitz et al. (10) 17 pacientů s HIV a konkomitantním KP. Pouze šest z nich (35 %) mělo suspektní palpační nález při DRE. Deset mužů (59 %) si stěžovalo na symptomy dolních močových cest. Radikální prostatektomii zvolili tři pacienti, sedm podstoupilo androgenní blokádu a radikální radioterapii, dva pouze hormonální léčbu a tři pouze brachyterapii. Jeden pacient nebyl na vlastní přání léčen. Terapie byla ve všech případech úspěšná (podle nedetekovatelného PSA). Pět dosavadních úmrtí nesouviselo s KP (10).
Pro léčbu KP v budoucnosti (a snad i HIV negativních pacientů) jsou zajímavá nedávná zjištění, která se týkají některých antiretrovirotik. Inhibitory proteázy ritonavir, saquinavir a indinavir inhibují klonální proliferaci nádorových buněk KP DU145 a PC-3 in vitro. Kombinace docetaxelu s ritonavirem pak zpomaluje růst DU145 více než tato léčiva podávaná v monoterapii. Buňky DU145 konstitutivně exprimují cytochrom jaterních mikrosomů CYP 3A4. Docetaxel expresi 2,5× zvýší, zatímco ritonavir tento efekt kompletně blokuje. Při pokusech in vivo kombinace docetaxelu s ritonavirem snižovala hmotnost a velikost tumoru signifikantně více než docetaxel v monoterapii. Kombinovaná léčba ovlivní i histologický vzhled nádoru, ve kterém zcela chybějí maligní buňky, jež jsou nahrazeny fibrotickou a nekrotickou tkání. Inhibiční účinek ritonaviru na indukci CYP 3A4 se projevuje též in vivo. Ritonavir navíc inhibuje aktivitu membránového proteinu P-gp, který funguje jako efluxní pumpa pro řadu látek včetně docetaxelu, a tak se podílí na lékové rezistenci. Tímto mechanismem zřejmě ritonavir dále potencuje účinek docetaxelu (25).
Podobné účinky vykazuje in vitro i nelfinavir, který inhibuje růst nádorových buněk KP LNCaP, DU145 a PC-3 a způsobuje jejich apoptózu. Kromě toho snižuje expresi androgenních receptorů v jádru nádorových buněk LNCaP i hladinu jejich cílové molekuly, PSA. Podání nelfinaviru in vivo vede k inhibici proliferace buněk LNCaP (26).
ZÁVĚR
Souběžný výskyt infekce HIV a KP bude jistě v budoucnosti stále častějším jevem. Řada rozsáhlých populačních studií HIV pozitivních pacientů odhalila nižší výskyt KP než ve srovnatelné HIV negativní populaci. Vysvětlení tohoto jevu vyžaduje další výzkum. V diagnostice, léčbě a urologickém sledování KP u HIV pozitivních pacientů není nutné měnit standardní schémata platná pro séronegativní populaci. Ačkoli se podle našich informací v České republice případ koincidence HIV a KP dosud nevyskytl (27), vzhledem k uváděným trendům musíme na tuto možnost pamatovat. To se týká především urologů a infekcionistů.
Práce byla podpořena grantem IGA MZ NS9984.
Došlo: 11. 8. 2009.
Přijato: 18. 9. 2009.
Kontaktní adresa
MUDr. Jan Hrbáček
Urologická klinika 3. LF UK a FNKV
Šrobárova 50,
100 34 Praha 10
e-mail: honzahrbacek@seznam.cz
Sources
1. Engels EA, Biggar RJ, Hall HI, et al. Cancer risk in people infected with human immunodeficiency virus in the United States. Int J Cancer 2008; 123 : 187.
2. Marberger M. Prostate Cancer 2008: Challenges in Diagnosis and Management. Eur Urol Suppl 2009; 8 : 89–96.
3. Patel P, Hanson DL, Sullivan PS, et al. Incidence of types of cancer among HIV infected persons compared with the general population in the United States, 1992-2003. Ann Int Med 2008; 10 : 728–736.
4. Biggar RJ, Kirby KA, Atkinson J, McNeel TS, Engels E. Cancer risk in elderly persons with HIV/AIDS. J Acquir Immune Defic Syndr 2004; 36 : 861–868.
5. Hessol NA, Pipkin S, Schwarcz S, et al. The impact of highly active antiretroviral therapy on non-AIDS-defining cancers among adults with AIDS. Am J Epidemiol 2007; 165 : 1143–1153.
6. Crum NF, Spencer CR, Amling CL. Prostate carcinoma among men with human immunodeficiency virus infection. Cancer 2004; 101 : 294–299.
7. Burgi A, Brodine S, Wegner S, et al. Incidence and risk factors for the occurrence of non-AIDS-defining cancers among human immunodeficiency virus infected individuals. Cancer 2005; 104 : 1505–1511.
8. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 2007; 370 : 59–67.
9. Mocroft A, Brettle R, Kirk O, et al. Changes in the cause of death among HIV positive subjects across Europe: results from the Euro-SIDA Study. AIDS 2002; 16 : 1663–1671.
10. Pantanowitz L, Bohac G, Cooley TP, Aboulafia D, Dezube BJ. Human immunodeficiency virus-associated prostate cancer: clinicopathological findings and outcome in a multi-institutional study. BJU Int 2008; 101 : 1519–1523.
11. Staiman V, Lowe FC. Prostatic disease in HIV-infected patients. Infect Urol 1996; 9 : 42–47.
12. Schwartz JD, Prince D. Prostate cancer in HIV infection. AIDS 1996; 10 : 797 – 798.
13. Furco A, Bani-Sadr F, Guymar S, Molina JM. Metastatic cancer of the prostate in a young 40 year-old HIV-infected male patient. Presse Med 2003; 32 : 930–931.
14. Manfredi R, Fulgaro C, Sabbatani S, Dentale N, Legnani G. Disseminated, lethal prostate cancer during human immunodeficiency virus infection presenting with non-specific features. Open questions for urologists, oncologists, and infectious disease specialists. Cancer Detect Prev 2006; 30 : 20–23.
15. Quatan N, Nair S, Harrowes F, Hay P. Should HIV patients be considered a high risk group for the development of prostate cancer? Ann R Coll Surg Engl 2005; 87 : 437–438.
16. Silberstein J, Downs T, Lakin C, Kane1 CJ. HIV and prostate cancer: a systematic review of the literature. Prostate Cancer and Prostatic Diseases 2008; 12 : 6–12.
17. De Marzo AM, Platz EA, Siobhan S, et al. Inflammation in prostate carcinogenesis. Nature 2007; 7 : 256–269.
18. Dennis LK, Lynch CF, Torner, JC. Epidemiologic association between prostatitis and prostate cancer. Urology 2002; 60 : 70–83.
19. Levinson A, Nagler EA, Lowe FC. Approach to management of clinically localized prostate cancer in patients with human immunodeficiency virus. Urology 2005; 65 : 91–94.
20. Vianna LE, Lo Y, Klein RS. Serum prostate-specific antigen levels in older men with or at risk of HIV infection. HIVMed 2006; 7 : 471–476.
21. Masood J, Voulgaris S, Awogu O, et al. Condom perforation during transrectal ultrasound guided (TRUS) prostate biopsies: a potential infection risk. Int Urol Nephrol 2007; 39 : 1121–1124.
22. Huang WC, Kwon EO, Scardino PT, Eastham JA. Radical prostatectomy in patients infected with human immunodeficiency virus. BJU Int 2006; 98 : 303–307.
23. Ng T, Stein NF, Kaminetsky J, et al. Preliminary results of radiation therapy for prostate cancer in human immunodeficiency virus-positive patients. Urology 2008; 72 : 1135–1138.
24. O’Connor JK, Nedzi LA, Zakris EL. Prostate adenocarcinoma and human immunodeficiency virus: report of three cases and review of the literature. Clin Genitourin Cancer 2006; 5 : 85–88.
25. Ikezoe T, Hisatake Y, Takeuchi T, et al. HIV-1 protease inhibitor, ritonavir: a potent inhibitor of CYP3A4, enhanced the anticancer effects of docetaxel in androgen - independent prostate cancer cells in vitro and in vivo. Cancer Res 2004; 64 : 7426–7431.
26. Yang Y, Ikezoe T, Takeuchi T, et al. HIV-1 protease inhibitor induces growth arrest and apoptosis of human prostate cancer LNCaP cells in vitro and in vivo in conjunction with blockade of androgen receptor STAT3 and AKT signaling. Cancer Sci 2005; 96 : 425–433.
27. Osobní sdělení, Marie Staňková, AIDS centrum FN Na Bulovce 5. 5. 2009.
28. Frisch M, Biggar RJ, Engels EA, Goedert JJ, AIDS-Cancer Match Registry Study Group. Association of cancer with AIDS related immunosuppression in adults. JAMA 2001; 285 : 1736-1745.
29. Grulich AE, Li Y, McDonald A, Correll PK, Law MG, Kaldor JM. Rates of non - AIDS-defining cancers in people with HIV infection before and after AIDS diagnosis. AIDS 2002; 16 : 1155–1161.
30. Dal Maso L, Franceschi S, Polesel J, et al. Risk of cancer in persons with AIDS in Italy, 1985–1998. Br J Cancer 2003; 89 : 94–100.
31. Clifford GM, Polesel J, Rickenbach M, et al. Cancer risk in the Swiss HIV Cohort Study: associations with immunodeficiency, smoking, and highly active antiretroviral therapy. J Natl Cancer Inst 2005; 97 : 425–432.
32. Newnham A, Harris J, Evans HS, Evans BG, Møller H. The risk of cancer in HIVinfected people in southeast England: a cohort study. Br J Cancer 2005; 92 : 194–200.
33. Engels EA, Pfeiffer RM, Goedert JJ, et al. Trends in cancer risk among people with AIDS in the United States 1980–2002. AIDS 2006; 20 : 1645–1654.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2010 Issue 1-
All articles in this issue
- Incidence, diagnostika a léčba karcinomu prostaty u HIV pozitivních pacientů
- Evoluce operační techniky laparoskopické resekce nádorů ledvin
- Laparoskopická nefropexe – technika pomocí tří nevstřebatelných stehů
- Exprese DD3PCA3 (Differential Display Code 3) mRNA ve tkáni prostaty u pacientů s karcinomem prostaty a benigní hyperplazií prostaty
- Agresivní karcinom prostaty u pacientů s nízkým PSA
- Anatomické aspekty chirurgické konverze pohlaví u pacientek s male-to-female transsexualismem – výsledky hodnocené tři měsíce po výkonu
- Pheochromocytoma and paraganglioma syndromes: going on 2010
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Agresivní karcinom prostaty u pacientů s nízkým PSA
- Anatomické aspekty chirurgické konverze pohlaví u pacientek s male-to-female transsexualismem – výsledky hodnocené tři měsíce po výkonu
- Laparoskopická nefropexe – technika pomocí tří nevstřebatelných stehů
- Incidence, diagnostika a léčba karcinomu prostaty u HIV pozitivních pacientů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

