-
Medical journals
- Career
Hematologické manifestace u pacientů se systémovým lupus erythematodes
Authors: M. Schubertová; P. Horák; M. Skácelová; J. Zadražil
Authors‘ workplace: Fakultní nemocnice, Olomouc ; III. interní klinika – nefrologická, revmatologická a endokrinologická
Published in: Čes. Revmatol., 24, 2016, No. 1, p. 6-14.
Category: Original article
Overview
Cíl:
Systémový lupus erythematodes (SLE) je chronické autoimunitní zánětlivé onemocnění charakteristické hyperaktivitou B buněk a nadprodukcí orgánově nespecifických autoprotilátek. Mezi nejčastější orgánové manifestace patří postižení kůže, ledvin, kloubů, kardiovaskulárního systému, centrálního nervového systému či hematologické manifestace. Cílem této studie bylo posouzení výskytu hematologických projevů a jejich četnost u pacientů se SLE.Soubor a metodika:
Retrospektivní monocentrická studie analyzovala výskyt hematologických projevů u 160 pacientů splňujících ACR diagnostická kritéria SLE. Jejich výskyt a zastoupení byl porovnán v úvodu onemocnění s obdobím navození remise onemocnění. Získaná data byla statisticky zpracována.Výsledky:
Hematologické manifestace byly přítomny u 67 % pacientů se SLE. Nejčastější z nich, anémie, se vyskytla na počátku onemocnění u 45 % pacientů s hladinou hemoglobinu (Hb) 101 ± 13g/l a průměrným počtem erytrocytů 3,50 ± 0,53 x 1012/l. Po stabilizaci onemocnění poklesl její výskyt na 20 % s průměrnou hodnotou Hb 123 ± 18g/l a počtem erytrocytů 3,9 ± 0,53 x 1012/l. Hemolytická anémie se podílela na anémii u 21 % pacientů. Leukopenie byla přítomna u 24 % pacientů, průměrný počet leukocytů u těchto pacientů byl 2,71 ± 0,71 x 109/l. Trombocytopenií bylo postiženo 24 % a antifosfolipidový syndrom byl zjištěn u 16 % pacientů.Závěr:
Hematologické abnormality patří mezi nejčastější projevy SLE. Jsou jedním z ACR, SLICC diagnostických kritérií SLE. Nejčastěji byla přítomna anémie, postihující téměř polovinu pacientů.Klíčová slova:
Systémový lupus erythematodes, krvetvorba, anémie, antifosfolipidový syndromÚvod
Systémový lupus erythematodes je autoimunitní onemocnění charakteristické hyperaktivitou B buněk a nadprodukcí orgánově nespecifických autoprotilátek. Postihuje jeden či více orgánových systémů. Vyskytuje se s incidencí 1–25 na 100 000 obyvatel, prevalence se liší v závislosti na rase a geografické poloze (1). Nejčastěji postihuje ženy v reproduktivním věku. Typická je pozitivita antinukleárních protilátek, přítomná až v 95 % případů (2). Vyšetření krevního obrazu je jednou z prvních laboratorních informací o zdravotním stavu pacienta. Nezanedbatelná část změn v krevním obraze může být projevem nehematologického patologického procesu. Krevní obraz je nutno hodnotit komplexně, včetně velikosti erytrocytů, jejich morfologie, počtu leukocytů, trombocytů a diferenciálního krevního obrazu. Jak klasifikační kritéria choroby stanovená ACR v roce 1971 (American College of Rheumatology, revidována 1982, 1997), tak nově kritéria SLICC (Systemic Lupus International Collaborating Clinic z roku 2012) (3, 4) hodnotí přítomnost abnormalit krevního obrazu. Hematologické manifestace mohou dle některých studií postihovat v době stanovení diagnózy až 82 % pacientů se SLE a mohou být také první a jedinou manifestací tohoto onemocnění (5–6). Nejčastěji se jedná o anémii, leukopenii, trombocytopenii a nebo přítomnost antifosfolipidových protilátek, popřípadě manifestní antifosfolipidový syndrom. Cílem této retrospektivní studie bylo posouzení výskytu hematologických projevů a jejich četnost ve skupině nemocných se SLE.
Soubor a metodika
Do retrospektivní studie bylo zařazeno celkem 160 pacientů splňujících ACR diagnostická kritéria pro SLE. Soubor byl tvořen pacienty diagnostikovanými a léčenými, následně pak ambulantně sledovanými na III. interní klinice Fakultní nemocnice Olomouc v období let 2005–2014. Ženy představovaly celkem 84 % (n = 135) pacientů a muži 16 % (n = 25). Celkový poměr mužů a žen byl 1 : 5,5. Průměrný věk při stanovení diagnózy činil 32 ± 12 let. Hodnocená data byla shromážděna v období stanovení diagnózy SLE (v době vysoké aktivity onemocnění) a byla porovnávána s výsledky po dosažení parciální či kompletní remise onemocnění. Pacienti s hematologickým onemocněním navozeným jiným prokázaným onemocněním byli ze studie vyloučeni. Mezi analyzovaná data bylo zahrnuto vyšetření krevního obrazu, včetně diferenciálního rozpočtu leukocytů, imunologické vyšetření, stanovení antifosfolipidových a antierytrocytárních protilátek pomocí Coombsova testu. Byla vyhodnocena přítomnost lupusové nefritidy, která byla v naprosté většině případů biopticky verifikovaná. Po kompletizaci výsledků byla data porovnána a statisticky zpracována.
Table 1. Hematologická kritéria pro diagnostiku SLE (a, b). 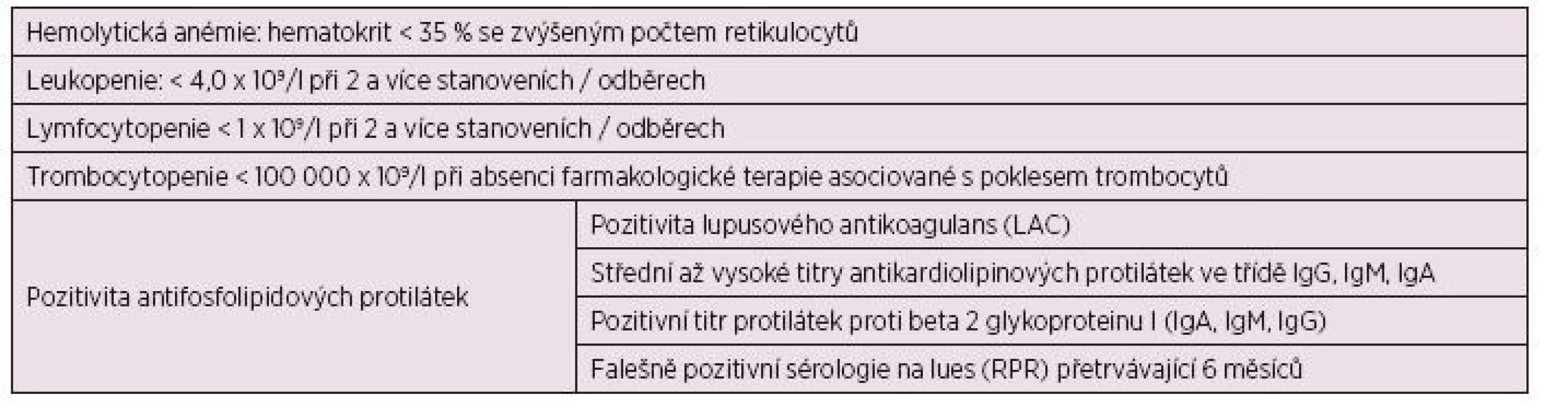
Petri M., SLICC Clasification Criteriafor Systemic Lupus Erythematosus, Arthritis Rheum, 2012. Tan E.M., Cohen A.S., Fries J.F., et al. Revised criteria for classification of systemic lupus erythematosus. Arthritis Rheum. 1982; 25, 1271. Anémie byla charakterizována poklesem hemoglobinu pod 130 g/l u mužů a pod 120 g/l u žen. Diagnóza autoimunní hemolytické anémie byla stanovena na základě přítomnosti hemolytické anémie (anémie, elevace laktátdehydrogenázy – LDH, nízké hodnoty haptoglobinu a elevace nepřímého bilirubinu, spolu s přítomností sférocytů v periferní krvi). Aktivní hemolýza společně s pozitivitou přímého či nepřímého Coombsova testu je vysoce specifická pro autoimunní etiologii (7–10).
Za leukopenii byl považován pokles počtu bílých krvinek pod 4 x 109/l, lymfocytopenie poté jako pokles pod 1,0 x 109/l, neutropenie jako pokles neutrofilních leukocytů pod 2 x 109/l. Trombocytopenie byla hodnocena jako lehká (100–149 x 109/l), střední (50–99 x 109/l) a těžká (0–49 x 109/l). APS byl charakterizován přítomností arteriální nebo venózní trombózy, specifickou komplikací při těhotenství a perzistující (opakovaná pozitivita v rozmezí minimálně 12 týdnů) pozitivitou lupusového antikoagulans (LAC), antikardiolipinových protilátek (ACA) či protilátek proti beta-2 glykoproteinu 1 (B2GI).
Shromážděná data byla statisticky vyhodnocena pomocí popisné statistické analýzy, korelační analýzy s použitím Pearsonova korelačního koeficientu. K hodnocení demografických údajů byly použity parametry jako průměr, směrodatná odchylka, medián, mezikvartilové rozpětí a další. Byl užit Software – MS Excel 2013.
Table 2. Charakteristika pacientů. 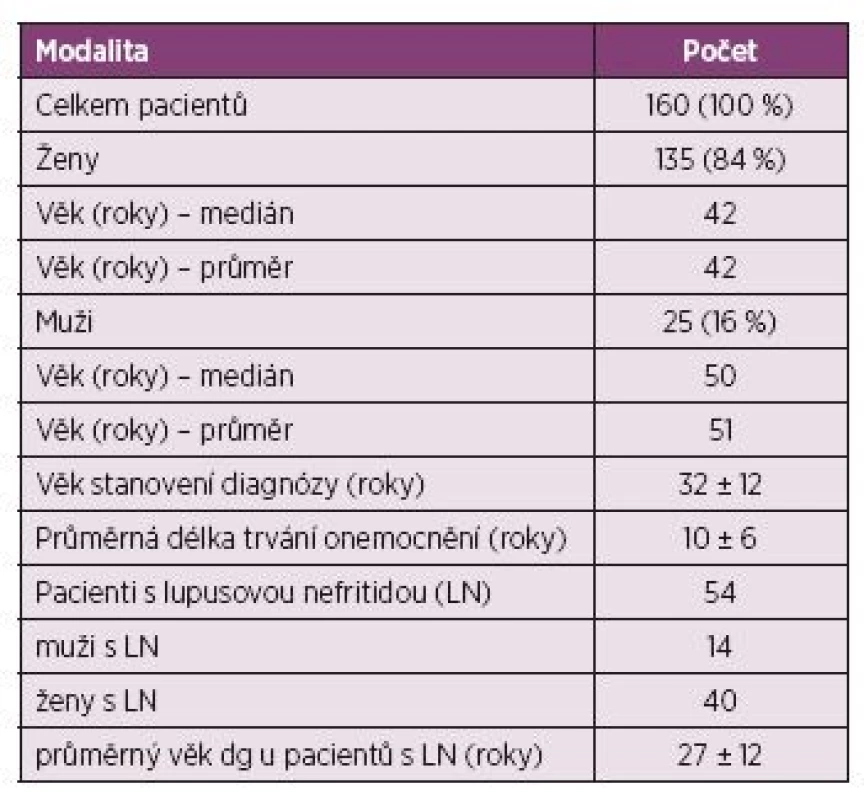
Výsledky
Všech 160 zařazených pacientů splnilo ACR i SLICC klasifikační kritéria pro systémový lupus erythematodes. Abnormality krevního obrazu byly kdykoliv v průběhu choroby zjištěny u 67 % pacientů (n = 106, 18 mužů, 88 žen). Anémie byla nejčastější hematologickou manifestací. Postihovala v době diagnózy 45 % pacientů (n = 71) s hladinou hemoglobinu 101 ± 13 g/l a počtem erytrocytů 3,5 ± 0,53 x 1012/l. Při kontrole po dosažení léčebné odpovědi byla anémie přítomna pouze u 20 % pacientů (n = 32) s průměrnou hladinou hemoglobinu v krvi 123 ± 18 g/l a počtem erytrocytů 3,9 ± 0,53 x 1012/l. U 25 % (n = 40) pacientů došlo k normalizaci krevního obrazu, naopak u 3 % (n = 4) došlo k nové manifestaci anémie. Hemolytická anémie byla stanovena jako příčina poklesu hemoglobinu ve 21 % anémií (n = 15), vyskytla se tak u 9 % zařazených nemocných.
Leukopenie byla nalezena v době diagnózy u 24 % (n = 38) pacientů s hladinou leukocytů 2,71 ± 0,71 x 109/l. Z toho čistá lymfocytopenie byla přítomna u 7 pacientů, čistá neutropenie ve 13 případech a kombinace obou v 18 případech (11 %).
V našem souboru byla těžká trombocytopenie (0–49 x 109/l) přítomna u 3 % pacientů (n = 5), středně těžká (50–99 x 109/l) u 6 % pacientů (n = 10), lehká (100–149 x 109/l) v 15 % (n = 23). Trombocytóza (> 450 x 109/l) se vyskytla u 4 pacientů (3 %) v době diagnózy SLE. Závažné krvácení postihlo 4 pacienty s trombocytopenií. Jednalo se o alveolární krvácení s nutností UPV, rozsáhlé kožní hematomy vyžadující opakované podání trombocytárních náplavů a krvácení do gastrointestinálního traktu. Pancytopenie, definovaná jako pokles počtu všech typů krevních buněk v periferní krvi pod dolní hranici normálních hodnot, byla přítomna u 10 (6 %) pacientů, dlouhodobě přetrvávala pancytopenie u 4 pacientů (3 %).
Diagnostická kritéria antifosfolipidového syndromu byla splněna v 16 % případů v průběhu sledování. Antifosfolipidové protilátky byly v průběhu onemocnění prokázány u 39 % (n = 63). Nejčastěji byla zjištěna pozitivita lupus antikoagulans (LAC), a to v 60 %, anti-kardiolipinových protilátek (ACLA) 5 %, protilátek proti beta2-glykoproteinu 1 (B2G1) v 1 %, kombinace LAC + ACLA ve 25 %, kombinace všech tří v 8 %.
Hodnocení parametrů hemogramu u nemocných s LN. V rámci této pilotní studie byl rovněž hodnocen vztah hematologických projevů choroby a renálního postižení. Lupusová nefritida byla diagnostikována u 54 pacientů (34 %), z toho v 53 případů byla biopticky verifikována. Ve zbývajícím případě byla diagnóza klinicky vysoce pravděpodobná, ale biopticky ověřená nebyla pro současný výskyt trombocytopenie s vysokým rizikem krvácení. Průměrná hodnota sérového kreatininu u těchto pacientů byla v době diagnózy 96,4 µmol/l. Anémie byla přítomna téměř u poloviny pacientů s prokázanou lupusovou nefritidou (n = 27) s hodnotou hemoglobinu 100 ± 16 g/l. Závažnost anémie (hladina Hb, počet erytrocytů i hematokrit) korelovala inverzně s hladinou sérového kreatininu (r = -0,29, p ≤ 0,00001) (obr. 1). V 59 % (n = 19) byla anémie normocytární normochromní. Ve 2 případech byl dále zjištěn deficit folátu a vitamínu B 12. V ostatních případech byly tyto stanovované parametry v normě.
Diskuse
Hematologické manifestace jsou velmi časté u pacientů se SLE a jsou součástí diagnostických kritérií tohoto onemocnění. Jsou markerem závažnosti onemocnění, odrážejí efekt zánětlivého stimulu na funkci kostní dřeně a délku přežití periferních krevních buněk. V literatuře je jejich výskyt udáván až u 85 % pacientů se SLE (6, 11–15) a shodně byly uváděny jako jeden z nejčastějších projevů tohoto onemocnění. V našem souboru 160 pacientů s nově diagnostikovaným onemocněním byly přítomny u 67 % pacientů. Nejčastější hematologickou manifestací byla anémie. Také celosvětově je řazena jako nejčastější hematologická manifestace s výskytem u 38–70 % pacientů (6, 11–13). V našem souboru byl její výskyt při počátku choroby 45 %. Shodně tak tvořila nejčastější abnormalitu krevního obrazu.
Table 3. Patofyziologie anémie u SLE. 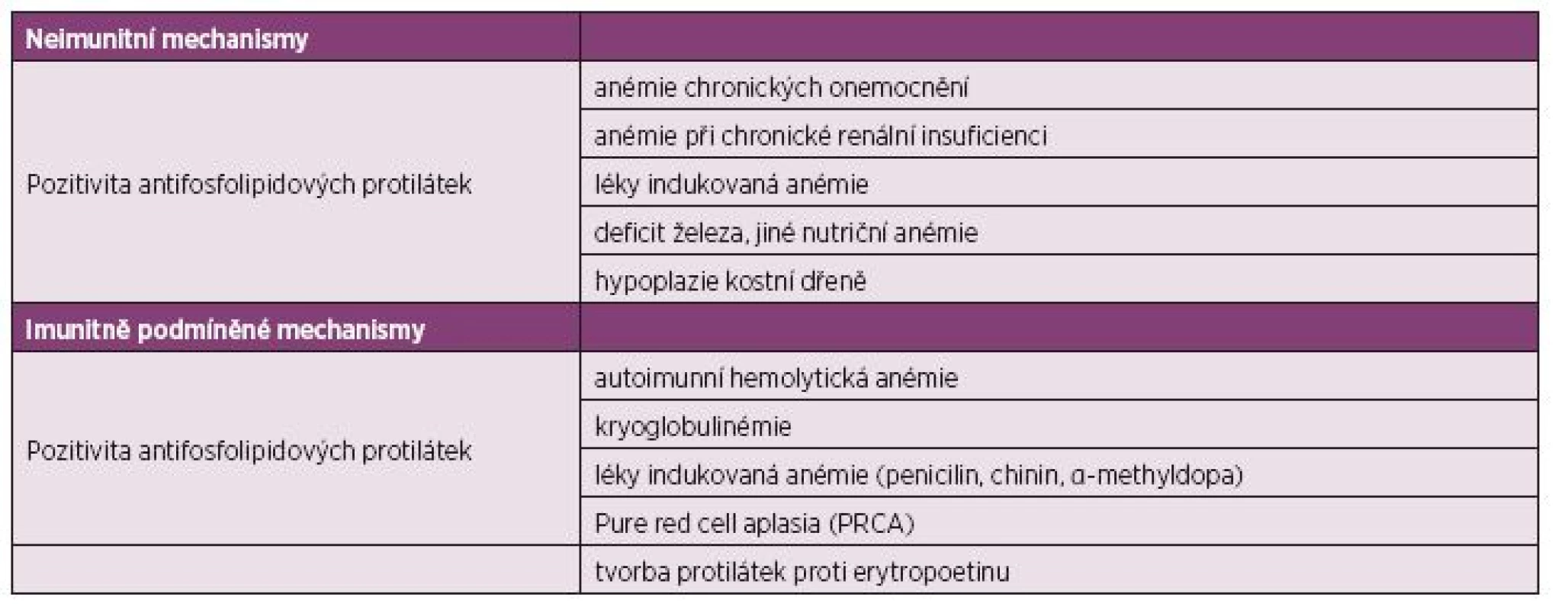
Graph 1. Inverzní signifikantní korelace mezi hodnotou sérového kreatininu a koncentrací hemoglobinu. 
Table 4. Zastoupení jednotlivých hematologických manifestací vzhledem k celkovému počtu pacientů – souhrn hodnot. 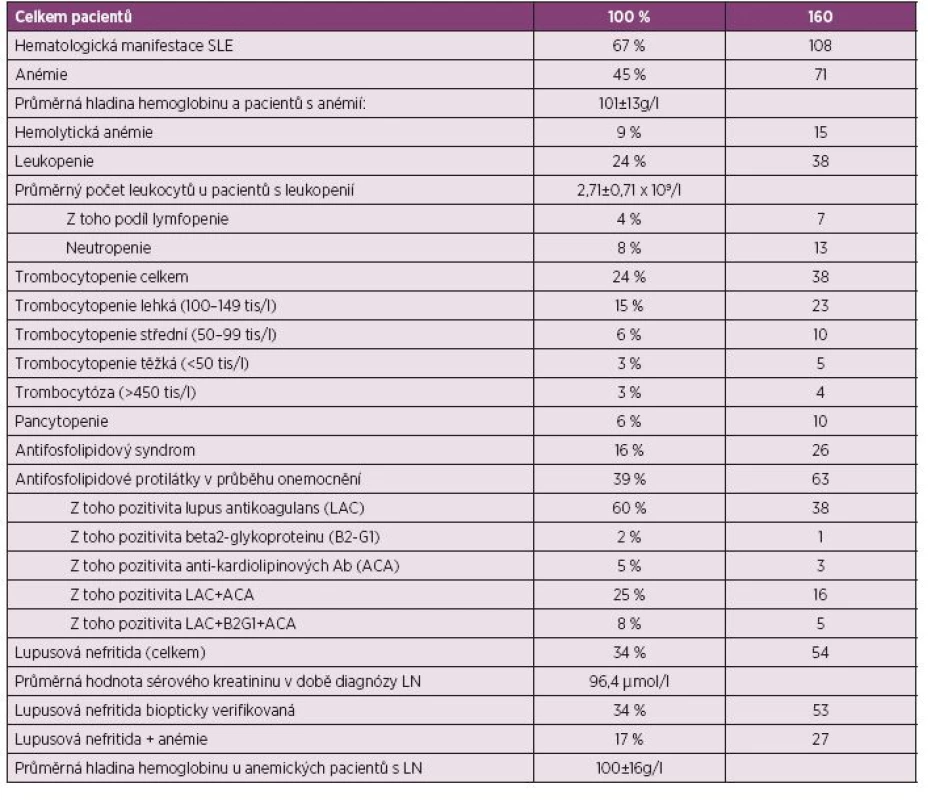
Etiologie anémie bývá velmi často multifaktoriální. Vzniká v důsledku chronického zánětu jako anémie normocytární, normochromní s relativně nízkým počtem retikulocytů. Další příčinou může být také renální insuficience, hemolýza, krevní ztráty, vliv medikamentózní terapie, hypersplenismu, aplastická anémie a další. Nejčastěji je přítomna anémie chronických onemocnění (v 60–80 %), anémie z nedostatku železa (35 %), autoimunní hemolytická anémie (10–14 %) a také anémie asociovaná s chronickou renální insuficiencí (17–19). V našem souboru byl výskyt anémie chronických onemocnění srovnatelný, podíl hemolýzy na anémii činil 21 %. Hemolýza se tak vyskytla u 10 % z celkového počtu nemocných. Diagnóza autoimunní hemolytické anémie bývá stanovena na základě přítomnosti hemolytické anémie (anémie, zvláště rychle nastupující s bledostí, kdy pokles hematokritu a hemoglobinu neodpovídal snížené produkci erytrocytů), elevace laktátdehydrogenázy (LDH), nízké hodnoty haptoglobinu a elevace nepřímého bilirubinu, spolu s přítomností sférocytů v periferní krvi. Aktivní hemolýza společně s pozitivitou přímého či nepřímého Coombsova testu je vysoce specifická pro autoimunní etiologii (7–10). Zvýšené LDH a pokles haptoglobinu je z 90 % specifické pro průkaz hemolýzy.
Leukopenie je u pacientů se SLE velmi častá a obvykle odráží aktivitu onemocnění. Pokles leukocytů pod 4 x 109/l může postihnout 15–20 % pacientů, zvláště v případě vysoké aktivity onemocnění (12, 17). Na jejím vzniku se může podílet neutropenie, lymfocytopenie i snížený počet cirkulujících eozinofilních a bazofilních leukocytů. Příčinou neutropenie či dysfunkce neutrofilních leukocytů může být medikamentózní terapie, imunitní mechanismy, dysfunkce kostní dřeně či hypersplenismus (17, 19, 20). Lymfocytopenie byla pozorována u 20–70 % pacientů, zvláště ve fázi aktivního onemocnění. Známá je přítomnost cytotoxických antilymfocytárních protilátek i zvýšená tendence T-lymfocytů k apoptóze (21). V našem souboru byl výskyt leukopenie srovnatelný. Téměř u poloviny pacientů byl zjištěn pokles jak v lymfocytární, tak neutrofilní populaci (22).
Trombocytopenie postihuje 25–50 % pacientů se SLE, přičemž závažná trombocytopenie s poklesem pod 50 x 109/l postihuje méně než 10 % pacientů (5, 18). Zvýšená destrukce trombocytů a přítomnost antitrombocytárních protilátek jsou nejčastějším patologickým mechanismem. Imunní trombocytopenie (ITP) může předcházet manifestaci SLE až o 10 let u 3–15 % pacientů (18). Tíže trombocytopenie může být různá. Těžká trombocytopenie (počet trombocytů < 50 x 109/l) je obvykle asociovaná s aktivním onemocněním a odpovídá na terapii steroidy. Častěji se vyskytující chronická trombocytopenie bývá méně závažná, avšak méně odpovídající na steroidní terapii. Trombocytopenie a její tíže je dále udávána jako signifikantní rizikový faktor mortality u pacientů se SLE. Souvisí se zvýšeným výskytem renálního postižení a nežádoucích účinků terapie. Její závažnost je silně asociovaná s výskytem závažných krvácivých komplikací, koreluje s vysokou aktivitou onemocnění, morbiditou a kumulativním orgánovým poškozením. V našem souboru byl výskyt trombocytopenie srovnatelný. K závažnému krvácení došlo pouze v ojedinělých případech a bylo posuzováno jako závažná komplikace aktivního onemocnění. Hladina kreatininu inverzně korelovala s počty trombocytů (r = -0,24, p ≤ 0,00001). Zhodnocení podílu trombocytopenie na morbiditě a mortalitě nemocných nebylo předmětem této studie a bude zhodnoceno v průběhu dalšího sledování.
Pancytopenie může být znakem aktivity choroby, jakož i důsledkem selhání kostní dřeně, či koincidujícího onemocnění jako akutní leukémie, myelodysplastického syndromu či závažné infekce (20, 23). V našem souboru se vyskytla u 10 pacientů, přičemž ve všech případech jako důsledek vysoké aktivity SLE, v 1 případě se spolupodílem krvácení do GIT, hemolýzy a anémie chronických onemocnění na anemizaci.
Abnormality krevního obrazu, zvláště anémie, mohou mít podíl na přítomnosti nespecifických příznaků, které se u lupusu vyskytují velmi často. Únava a nevolnost mohou postihovat až 90 % pacientů se SLE a patří mezi nejvíce hendikepující příznaky. Na jejich vzniku se může podílet aktivita onemocnění, poruchy nálady, nekvalitní spánek, nízká fyzická aktivita, medikace, fibromyalgie (24), nebo může být jedním z projevů anemického syndromu. U těchto pacientů byl také pozorován zvýšený výskyt úzkostných stavů a deprese (25, 26).
Antifosfolipidový syndrom (APS) se vyskytuje asi u 20 % pacientů se SLE (27). Katastrofický antifosfolipidový syndrom je vzácné a závažné onemocnění s prevalencí méně než 1 % pacientů s APS. Charakteristický je vznikem mnohočetných vaskulárních okluzí, vysokým titrem aPL protilátek a vysokou mortalitou (až 50 %) navzdory antikoagulační a imunosupresivní terapii (28, 29). V našem souboru byla pozitivita aPL zjištěna u 35 % pacientů, koincidující APS se vyskytl v 16 % případů, katastrofický antifosfolipidový syndrom nebyl v souvislosti se SLE v této retrospektivní analýze zaznamenán.
Anémie při chronickém onemocnění ledvin je poměrně častým nálezem. Jedná se obvykle o anémii normocytární, normochromní způsobenou sníženou produkcí erytropoetinu ledvinami a zkráceným přežíváním erytrocytů. Může být asociovaná s přítomností akantocytů a schistocytů (30). Její prevalence exponenciálně stoupá s klesající glomerulární filtrací. K rozvoji anémie dochází při poklesu glomerulární filtrace pod 1ml/s (31, 32), výrazněji jsou postiženi pacienti s diabetickou nefropatií (33). U pacientů s chronickou renální insuficiencí (CKD) není pozorován adekvátní vzestup produkce erytropoetinu při tkáňové hypoxii (34, 35). V souboru pacientů s lupusovou nefritidou a CKD byla anémie zjištěna v 50 % případů. Hodnota hemoglobinu korelovala s hladinou sérového kreatininu a stupněm renální insuficience.
Se SLE byla zvažována asociace se zvýšeným výskytem malignit. V několika studiích byl uváděn vyšší výskyt lymfoproliferativních onemocnění, zvláště non-Hodgkinského lymfomu, Hodgkinova lymfomu a leukémie. Ostatní malignity postihovaly larynx, plíce, játra, malignity štítné žlázy a vulvy. Naopak nižší byl výskyt melanomu (36, 37). V našem souboru nebyly malignity zjištěny.
Vzácnější hematologické manifestace jako hemolyticko-uremický syndrom, idiopatická trombotická, trombocytopenická purpura, cryopyrin-associated periodic syndroms (CAPS), protilátky proti koagulačním faktorům nebyly v souboru našich pacientů stanovovány a diagnostikovány. Tyto komplikace jsou poměrně vzácné s incidencí 3/1 milion pacientů (38, 39) a bývají prediktorem morbidity a mortality, stejně jako zvýšené četnosti relapsů u pacientů se SLE.
Shrnutí a limitace studie
Cílem této studie bylo posoudit četnost a jednotlivé zastoupení hematologických projevů systémového lupusu v populaci pacientů sledovaných v revmatologické ambulanci III. interní kliniky Fakultní nemocnice Olomouc a jejich vývoj v závislosti na terapeutické kontrole onemocnění. Autoři jsou si vědomi výrazných limitací prezentovaných dat. Jedná se o retrospektivní analýzu, která neumožňovala pro heterogenní populaci i zdroje výsledků korelaci jak s aktivitou choroby, hodnocenou validizovaným skórovacím systémem, tak s hladinami autoprotilátek. Ze stejných důvodů nebylo možné vyhodnotit případný vliv dalších faktorů (léčba, komorbidity, atd.) na hematologické nálezy. Jednalo se o pilotní projekt, na který navazuje prospektivní sledování tohoto souboru nemocných jak z hlediska vývoje hematologických manifestací, tak dalšího orgánového postižení v rámci SLE.
Vytvořeno za podpory grantu: NT/137 07, 15-28659A
Adresa pro korespondenci:
MUDr. Markéta Schubertová
III. interní klinika – nefrologická, revmatologická a endokrinologická
Fakultní nemocnice Olomouc
I. P. Pavlova 6
779 00 Olomouc
Marketa.Schubertova@fnol.cz
Tel.: 732 201 293
Sources
1. Danchenko N, Satia JA, Anthony MS. Epidemiology of systemic lupus erythematosus: a comparison of worldwide disease burden. Lupus May 2006; 15 : 308–318.
2. Wallace DJ, Hahn BH. Dubois´ lupus erythematosus. Section IV: autoantibodies, Lea and Febinger. Philadelphia 1993; 181–276.
3. Hochberg MC. 1997 Update of the 1982 American College of Rheumatology Revised Criteria for Classification of Systemic Lupus Erythematosus. Arthritis Rheum 1997; 40; 1725.
4. Petri M, Orbai AM, Alarcon GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64 : 2677–2686.
5. Sasidharan PK, Bindiya M, Sajeeth Kumar KG. Systemic lupus erythematosus–A Hematological Problem. J Blood Disorder Transf 2013; 4 : 168.
6. Al Afraj AS, Khalil N. Clinical and imunological manifestatins in 624 SLE patients in Saudi Arabia. Lupus 2009; 18(5): 465–73.
7. Marchand A, Galen RS, Van Lente F. The predictive value of serum haptoglobin in hemolytic disease. JAMA 1980; 243 : 1909–1911.
8. Galen RS. Application of the predictive value model in the analysis of test effectiveness. Clin Lab Med 1982; 2 : 685–699.
9. Voulgarelis M, Kokori SL, Loannidis JP, et al. Anemia in systemic lupus erythematosus: aetiological profileand the role of erythopoetin. Ann Rheum Dis 2000 59(3): 217–222.
10. Valent P, Lechner K. Diagnosis and treatment of autoimunne haemolytic anemia in adults: a clinical review. Wien Klin Wochenschr 2008 120(5-6):136–151.
11. Hux M, Fan ZR, Zhou SY et al. Hematological abnormality and clinical characteristics in systemic lupus erythematosus. Zhongguo shi Yan 2004;12(2): 170–173.
12. Rouf A, Uddin R, Hoque E. Pattern of Hematological Manifestations in Patients with Systemic Lupus Erythematosus Attending in a Tertiary Care Hospital. Chattagram Maa-O-Shishu Hospital. Medical College Journal 2014; 13(1): 49–53.
13. Aleem A, Al Arfaj AS, Khalil N, et al. Haematological abnormalities in systemic lupus erythematosus. Acta Reumatol Port 2014; 39(3): 236–241.
14. Simantov R, Laurence J, Nachman RL. The cellular hematology of systemic lupus erythematosus. Systemic lupus erythematosus, Fourth edition, 2004; Elsevier
15. Pisetski, DS, Gilkeson G, St Clair EW. Systemic lupus erythematosus, Diagnosis and treatment. Med Clin North Am 1997; 81 : 113–128.
16. Sasidharan PK, Bindya M, Kumar KGS. Hematological manifestation of SLE at initial presentation: Is it underestimated? ISRN Hematol 2012; 961872–7.
17. Voulgarelis M, Kokoria SI, Ioannidisb JP, et al. Anaemia in systemic lupus erythematosus: aetiological profile and the role of erythropoetin. Ann Rheum Dis 2000; 59 : 217–222.
18. Giannouli S, Voulgarelis M, Ziakas PD, et al. Anaemia in systemic lupus erythematosus: from pathophysiology to clinical assessment. Annals of the Rheumatic Diseases 2006; 65(2): 144–148.
19. Nossent JC, Swaak AJ. Prevalence and Significance of Haematological Abnormalities in Patients with Systemic Lupus Erythematosus. Q J Med 1991; 80 : 605–612.
20. Newman K, Owlia MB, El-Hemaidi I, et al. Management of immune cytopenias in patients with systemic lupus erythematosus–old and new. Autoimmun Rev 2013; 12 : 784–791.
21. Chun Li, Rong Mu, Xiao-yan Lu. Antilymphocyte Antibodies in Systemic Lupus Erythematosus: Association with Disease Activity and Lymphopenia. J Immunology Research 2014; 2014; 309–326.
22. Budman DR, Steinberg AD. Hematologic aspect of systemic lupus erythematosus. Current concepts. Ann Int Med 1977; 86; 220–229.
23. Hepburn AL, Narat S, et al. The management of periperal blood cytopenias in systemic lupus erythematosus. Oxford Rheumatol J 2010; 49 : 2243–2254.
24. Trench CM, McCurdie I, White PD, et al. The prevalence and association s of fatigue in systemic lupus erythetosus. Int J Clin Rheumatol 2012; 7(2): 217–227.
25. Jump RL, Robinson ME, Armstrong AE et al. Fatigue in systemic lupus: contributions of disease activity, pain, depression, and perceived socialsupport. J Rheumatol 2005; 32 : 1699–1705.
26. Burgos PI, Alarcon GS, McGwin G, et al. Disease activity and damage are not associated with increased levels of fatigue in systemic lupus erythematosus patients from multiethnic cohort. Arthritis Rheum 2009; 61 : 1179–1186.
27. Bazzan M, Vaccarino A, Marletto F. Systemic lupus erythematosus and thrombosis. Thrombosis J 2015; 13 : 16–26.
28. Cervera R, Piette JC, Font J, et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum 2002; 46 : 1019–1027.
29. Stratta P, Canavese C, Ferrero S. Catastrophic antiphospholipid syndromes in systemic lupus erythematosus. Ren Fail 1999; 21(1): 49–61.
30. Zadrazil J, Horak P. Pathophysiology of anemia in chronic kidney diseases: A review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(2): 197–202.
31. Astor BC, Muntner P, Levin A, et al. Association of kidney function with anemia: the Third National Health and Nutrition Examination Survey (1988-1994). Arch Intern Med 2002; 162 : 1401–1408.
32. Hsu CY, McCulloch CE, Curhan GC. Epidemiology of anemia associated with chronic renal insufficiency among adults in the United States: results from the Third National Health and Nutrition Examination Survey. J Am Soc Nephrol 2002; 13 : 504–510.
33. El-Achkar TM, Ohmit SE, McCullough PA, et al. Higher prevalence of anemia with diabetes mellitus in moderate kidney insufficiency: The Kidney Early Evaluation Program. Kidney Int 2005; 67 : 1483–1488.
34. Walle AJ, Wong GY, Clemons GK, et al. Erytropoetin–hematocrit feedback circuit in the anemia of end stage renal disease. Kidney Int 1987; 31 : 1205–1259.
35. Nangaku M, Eckardt KU. Pathogenesis of renal anemia. Semin nephrol 2006; 26 : 261–268.
36. Cao L, Tong H, Xu G, et al. Systemic Lupus Erythematous and Malignancy Risk: A Meta-Analysis. Scheurer M, ed. PLoS ONE 2015; 10(4).
37. Leandro MJ, Isenberg DA. Rheumatic diseases and malignancy–is there an association? Scand J Rheumatol 2001;30(4): 185–188.
38. Pistiner M, Wallace DJ, Nessim S, et al. Lupus erythematosus in 1980s: a survey of 570 patients. Semin Arthritis Rheum 1991; 21(1): 55–64.
39. Lansigan F, Isufi I, Tagoe CE. Microangiopatic haemolytic anémie resembling trombocytopenic purpura in SLE: the role of ADAMTS 13. Rheumatology (Oxford) 2011 50(5): 824–829.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2016 Issue 1
Most read in this issue- Hematologické manifestace u pacientů se systémovým lupus erythematodes
- První zkušenosti s biosimilárním infliximabem CT-P13 u nemocných se zánětlivými revmatickými onemocněními v České republice v národním registru ATTRA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

